2, 4-二氯苯氧乙酸是高效、内吸、具高度选择性的除草剂和植物生长调节剂,被广泛用于禾科类作用的除草剂、生长调节剂和水果保鲜剂[1]。近期浙江、江苏等地监管部门在水果、豆芽中仍检测出超标的2,4-二氯苯氧乙酸。相关毒理实验研究表明,2,4-二氯苯氧乙酸作为作物的除草剂和蔬果保鲜剂,其过高的残留会对人的神经系统、内分泌系统和免疫系统造成影响,具有潜在致癌性和致突变性[2-3]。在国家标准GB 2763—2019《食品中农药残留最大限量》中规定谷物、蔬菜和水果中2,4-二氯苯氧乙酸的最高残留限量分别为2.0、0.5、1.0 mg/kg。
目前,国内对苯氧乙酸类激素的检测方法主要有气相色谱法[4]、气相色谱-串联质谱法[5-6]、高效液相色谱法(high performance liquid chromatography, HPLC)[7]、高效液相色谱-串联质谱法(high performance liquid chromatography-mass spectrometry, HPLC-MS)[8-11]、分子印迹传感器法[12]、拉曼光谱检测法[13]和免疫检测法[14-16]。色谱类仪器检测方法准确率高、灵敏度好等优点,同时也存在设备昂贵、需专业人员、前处理要求高等不足。传感器和拉曼光谱分析方法多停留在研究层次,实际应用率偏低。而基于抗原抗体特异性识别为基础的免疫快速筛选方法,已经成为食品安全检测方法的主流检测方法[17-20],与仪器方法互补使用。微孔侧流免疫层析法(microwell lateral flow immunochromatography, mwLFIA)是一种类似于胶体金层析卡,但又存在差别的检测方法[21]。其主要原理是:将待测物与标记免疫金抗体在微孔中充分结合,通过层析作用,固相载体的包被抗原会捕获金标抗体而聚集显色,待测物越多,结合的抗体约多,固相载体上的包被抗原结合的少,显色不明显,表明阳性,反之则为阴性。微孔的使用,使得金标抗体与样品在微孔中首先接触,充分反应,有效地解决了传统的胶体金中抗原抗体反应不充分或竞争力弱而带来的假阴性和灵敏度偏低的问题。目前微孔测流免疫层析法已经用于食品中抗生素类药物、他达那非类药物残留的检测[21-22],但检测苯氧乙酸类激素的mwLFIA还未见报道。
本研究利用采用活泼酯法制备了人工抗原,通过动物免疫获得了针对2,4-二氯苯氧乙酸的特异性抗体。通过试验条件优化,建立了灵敏度好,前处理简单,检测时间较短的mwLFIA,该方法能够用于水果、蔬菜和谷物类苯氧乙酸类激素残留的检测,为农产品监管提供技术支持。
1 材料与方法
1.1 试剂
4-氯苯氧乙酸、2,4-二氯苯氧乙酸标准品、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS),上海阿拉丁试剂有限公司;牛血清蛋白(BSA)和卵清蛋白(OVA)、OVA和羊抗鼠IgG 抗体,美国Sigma 公司;硝酸纤维素膜,美国Ahlstrom 公司;吸水纸H-8和底板J-B6,基因有限公司;金标复溶液、缓冲液,广州万联生物科技有限公司;其他试剂,广州化学试剂公司。
1.2 仪器与设备
UV-3010紫外可见分光光度计,日本Hitachi 公司;HGS 510划膜喷金机和HGS 201切条机,杭州峰航科技有限公司;胶体金免疫层析读数仪,南京微测生物科技有限公司;LC-15C液相色谱仪,岛津(上海)商贸有限公司;5417R高速离心机,德国Eppendorf 公司;氮吹仪,康宁科技有限公司。
1.3 实验方法
1.3.1 抗体制备
采用活泼酯法将2,4-二氯苯氧乙酸与载体蛋白BSA 偶联作为免疫原,载体蛋白OVA偶联得到包被原(图1),采用紫外扫描法进行鉴定,-20 ℃冻存。将鉴定成功的免疫原,免疫雌性新西兰大白兔,制备多克隆抗体。通过辛酸硫酸铵沉淀法纯化抗体,并于-20 ℃冻存。
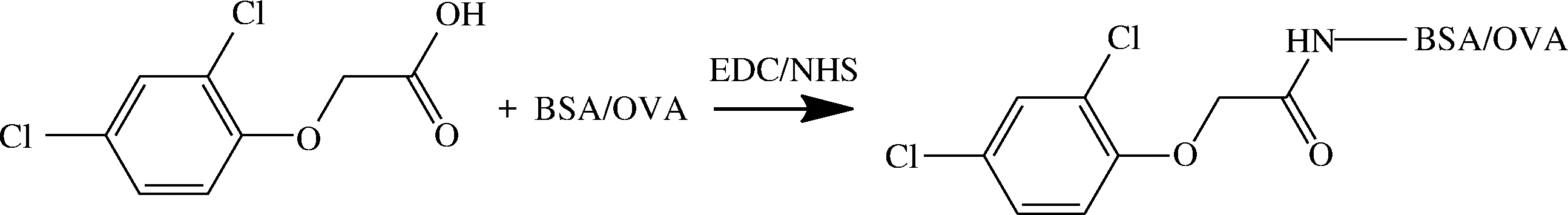
图1 免疫原与包被原的制备
Fig.1 Preparation of immunogen and coating antigen
1.3.2 制备纳米金
采用氯金酸-柠檬酸三钠还原法制备胶体金。取99 mL蒸馏水置于500 mL烧瓶中,加入1 mL 1%的氯金酸溶液,加热至沸腾并持续1 min后,迅速加入1.5 mL 1%柠檬酸三钠溶液,观察溶液颜色,当溶液变为红色并逐步稳定后,再继续加热3 min后冷却、备用。制备好的胶体金紫外扫描鉴定,确定最大吸收峰波长,观察吸收峰的峰形和峰宽。
1.3.3 纳米金抗体标记条件优化
纳米金与抗体结合是基于静电吸附作用,这种吸附稳定性与标记溶液pH密切相关。若纳米金溶液的pH不合适,反应后的金溶液不稳定易聚集沉淀,只有在合适pH,标记抗体效率最高,结合物较稳定。实验利用0.1 mol/L K2CO3溶液调节纳米金溶液的pH 值分别为7.5、8.0、8.5、9.0和9.5,各加入适量抗体进行振荡10 min标记,再加入20 μL 10% BSA溶液振荡15 min封闭,10 000 r/ min 离心15 min后弃上清液,加入等体积复溶液,裸眼观察复溶情况,测定各复溶液在525 nm 处的吸光值,将易复溶、吸光值最高的复溶液的pH 值作为最佳标记pH 值。
1.3.4 标记抗体浓度优化
在标记过程中,抗体用量少,则难以复溶,如果用量过多,会造成资源浪费。在已确定pH 值的纳米金溶液中加入适量抗体(1.0 mg/mL),终质量浓度分别为2.0、4.0、6.0、8.0、10.0 μg/mL,振荡孵育10 min 后,加入 10% BSA溶液 封闭10 min,离心后弃上清液,观察复溶情况和525 nm 吸光值,选择维持纳米金溶液为红色的最低抗体浓度为最佳抗体标记浓度。
1.3.5 金标抗体用量和包被原浓度的优化
标记抗体与包被原浓度的平衡对方法的建立至关重要。若金标抗体的含量过多,会导致假阴性,反之会造成假阳,都会降低方法的灵敏度。因此本研究通过棋盘法找出两者之间最优组合。分别将包被抗原稀释1、2、3、4倍,金标抗体稀释2、3、4、5倍,同时检测0.2 mg/kg的2,4-二氯苯氧乙酸标准品,根据层析卡的检测线(T线)和质控线(C线)变化找出最优组合。
1.3.6 质控线二抗浓度优化
将羊抗鼠IgG分别稀释成1.0、1.5、2.0、2.5 mg/mL,利用划膜机,划膜于C线,用胶体金免疫层析读数仪读数并辅助肉眼观测颜色,并与已优化好的T线颜色对比,选择出最适羊抗鼠浓度。
1.3.7 试纸条的组装和金标微孔的制备
免疫层析卡包括样品垫、硝酸纤维素膜(NC膜)、吸水纸和PVC 底板,检测线和质控线分别为包被抗原和羊抗鼠IgG 抗体。金标抗体用量按照上述优化后的条件加入96 孔板的微孔,振荡均匀37 ℃烘干过夜,密封干燥保存。
1.3.8 测定步骤及结果判定
吸取100 μL缓冲液于金标微孔内,室温孵育8 min后,将试纸条垂直插入微孔,反应6 min。裸眼观察判断:T 线和C 线显色相近或T线大于C线时时,结果均判定为阴性;T线不显色或颜色稍浅于C线时,结果判定阳性或弱阳性;C线无色,试纸条判定为失效(图2)。
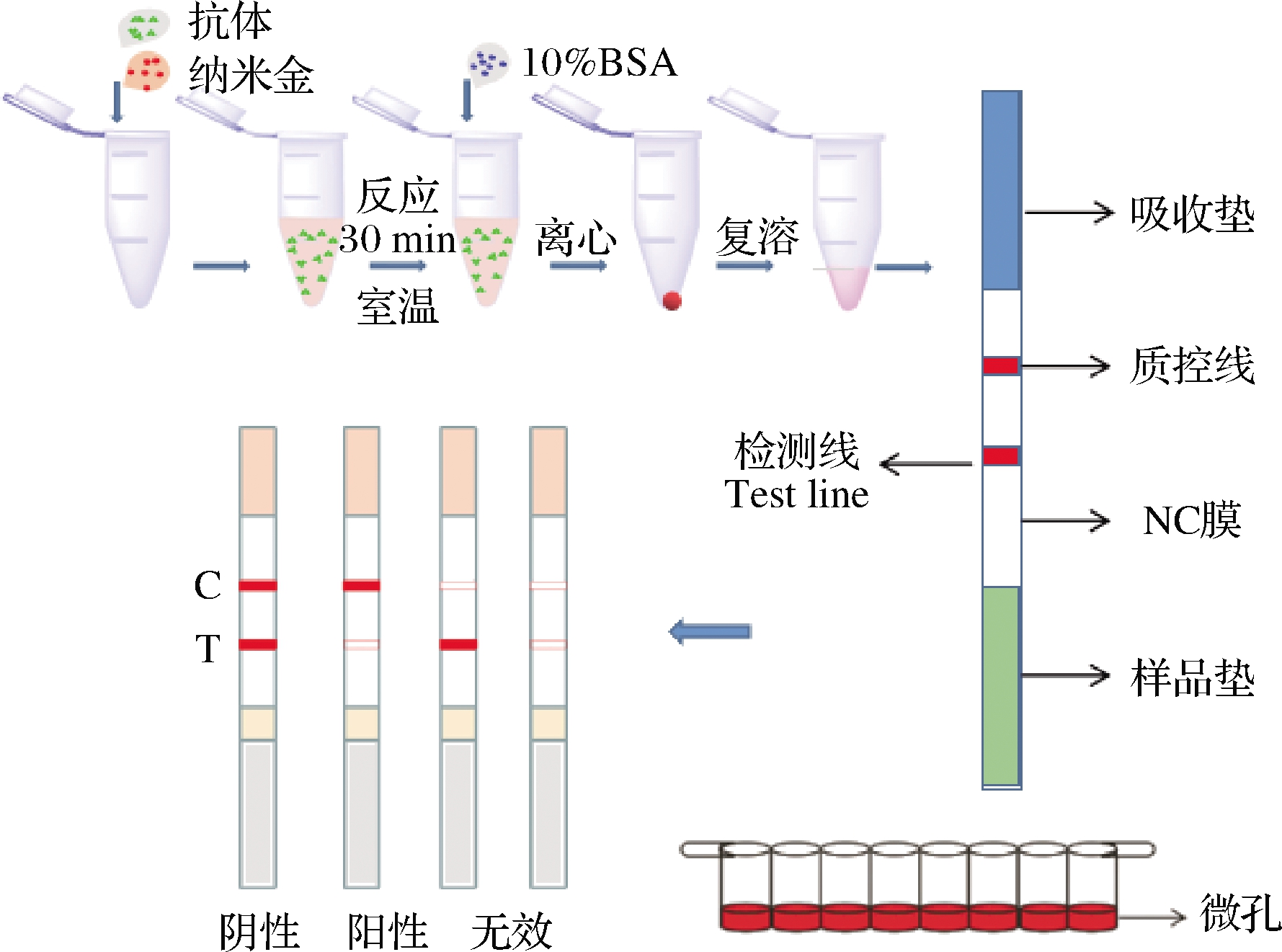
图2 微孔侧流免疫层析试纸条的结构与实验原理示意图
Fig.2 Structure and principle of the microwell lateral flow immunochromatography strip
1.3.9 样品前处理
将待测的芒果、豆芽等蔬菜水果切成碎片,置于打碎机中打碎,分析天平称取10 g 样品置于50 mL离心管中, 加入20 mL的乙腈, 漩涡振荡涡旋3~5 min充分混合,涡旋仪将固液混合物充分混匀, 室温10 000 r/min 离心5 min;取1 mL上清液至10 mL洁净干燥玻璃管中,水浴氮气流下吹干;加入1 mL复溶工作液,涡旋振荡1 min,待测。
2 结果与分析
2.1 人工抗原的鉴定
利用紫外光谱,分别扫描人工抗原、载体蛋白和2,4-二氯苯氧乙酸,如图3所示。从扫描结果分析,与载体蛋白和2,4-二氯苯氧乙酸相比,人工抗原的特征吸收峰位移或峰型发生一定变化,表明2,4-二氯苯氧乙酸共价偶联至载体蛋白表面。通过竞争抑制实验,表明抗血清对药物和包被抗原有特异性识别反应,证明人工抗原合成成功,从而获得了特异性抗体。
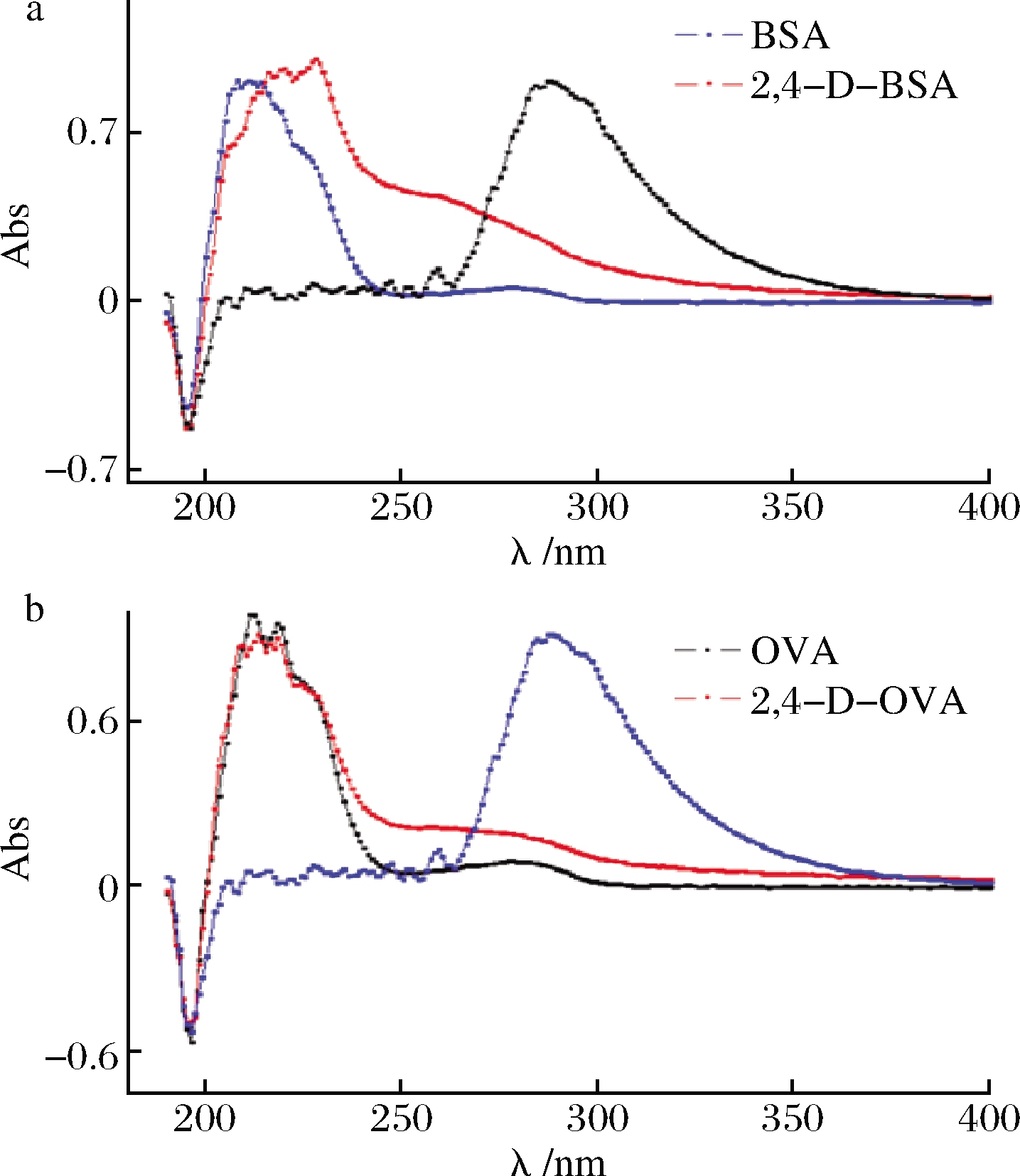
a-免疫原;b-包被原
图3 人工抗原的紫外光谱扫描图
Fig.3 Ultraviolet absorption spectra of artificial antigens
2.2 纳米金的制备
制备的胶体金溶液澄清无沉淀,颜色呈酒红色;通过紫外扫描发现,胶体金溶液在521 nm附近存在特征吸收峰,峰形越窄颗粒越均匀(图4)。
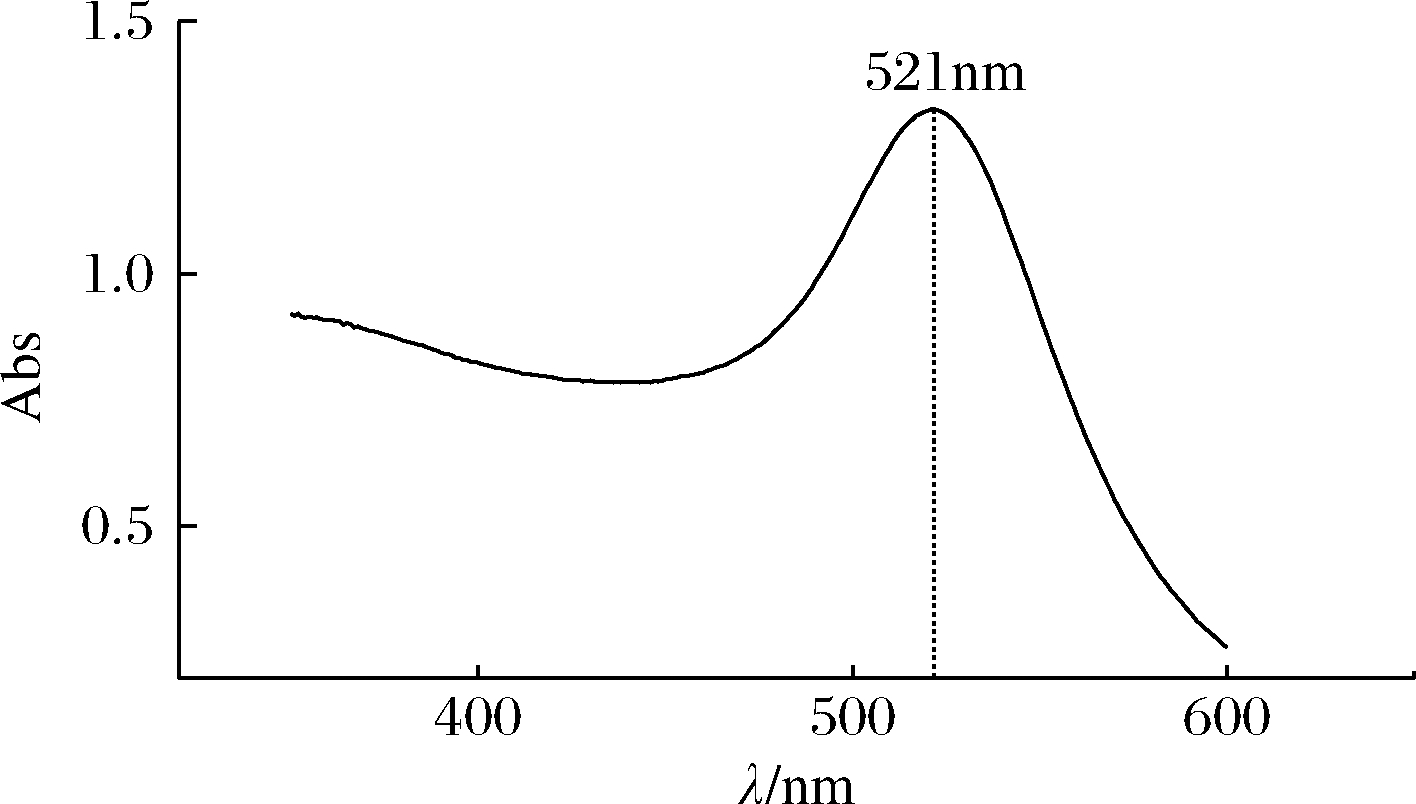
图4 胶体金溶液紫外扫描图
Fig.4 Absorption spectrum image of synthesized gold nanoparticles
2.3 标记溶液pH的选择
利用0.1 mol/L K2CO3溶液调节纳米金溶液的pH 值分别为7.0、7.5、8.0、8.5和9.0,通过观察及紫外扫描溶液在521 nm处的吸光值选择最适的pH值,如图5-a所示。随着标记溶液pH值增大,其吸光值先增大后减小。当溶液的pH值为8.5时,胶体金的颜色最为鲜艳、明亮,吸光值也达到最大。
2.4 标记抗体浓度的选择
将原始质量浓度为5.0 mg/mL的抗体在1 mL的胶体金溶液中分别加入不同体积(2、4、6、8、10 μL)来优化标记过程中抗体用量,如图5-b所示。当标记用抗体逐渐增加时,标记抗体后纳米金溶液由蓝紫色逐渐变为酒红色,且离心后沉淀易复溶,溶液的吸光值则先增大后减小。在加入6 μL时,胶体金上清颜色和沉淀复溶效果最好,因此8 μL/mL为标记抗体的最佳用量,即40 μg/mL。
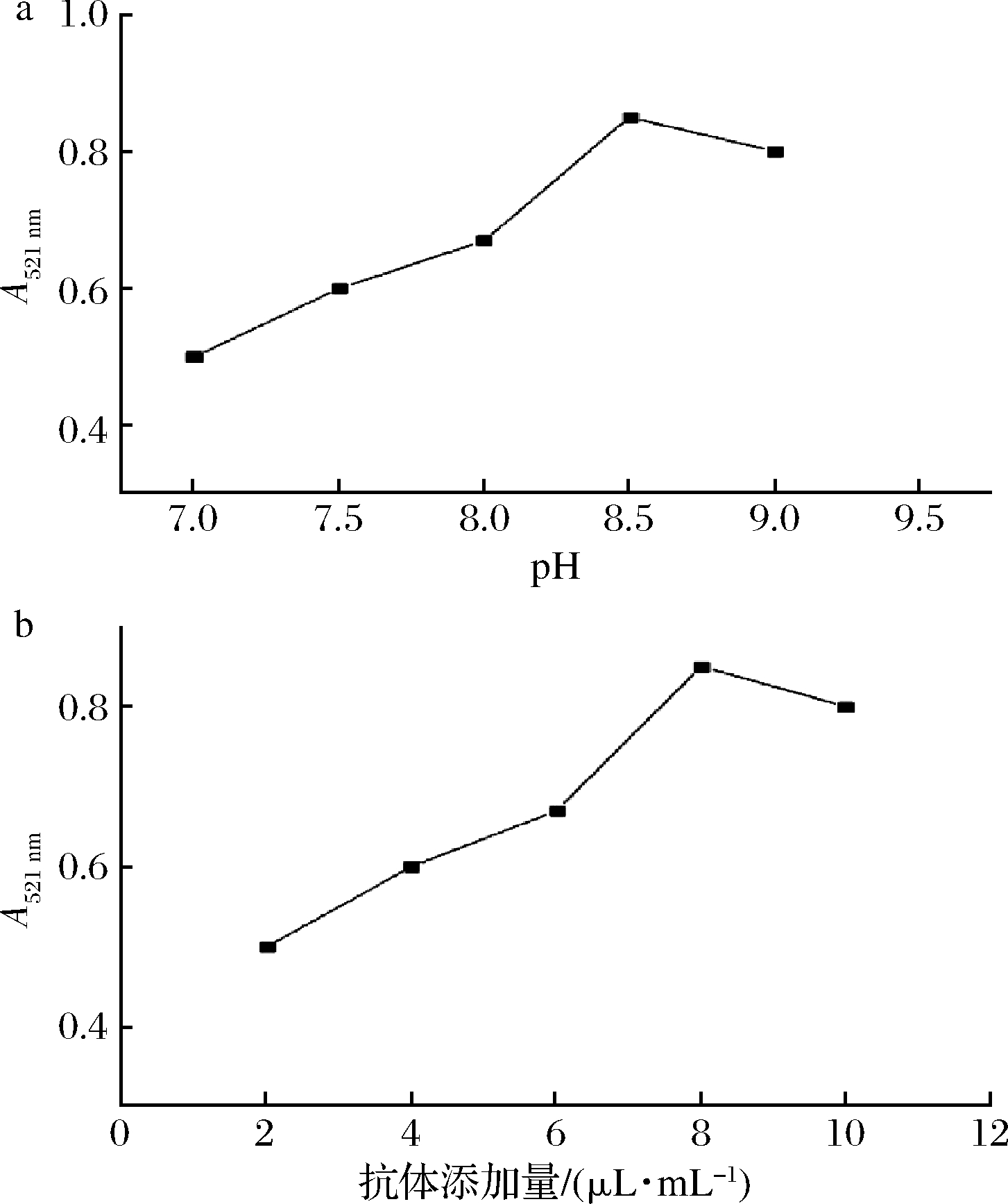
a-pH 值;b-抗体浓度
图5 AuNPs 溶液pH 值及抗体浓度优化
Fig.5 Optimization of pH value of AuNPs solutionand concentration of antibody
2.5 金标抗体用量和包被原浓度的选择
根据实验1.3.4的棋盘方法优化得到的结果如表1所示,不论是检测阴性和200 ng/mL 2,4-二氯苯氧乙酸,随着稀释倍数的增加,层析卡T线颜色逐渐变浅。当金标抗体稀释3倍、包被抗原稀释2倍时,此时试纸条的阴性和阳性T线对比最明显,不会存在金标抗体过剩或不足的现象,因此选择金标抗体稀释3倍、包被抗原稀释2倍(1 mg/mL)。
表1 金标抗体与包被原浓度的棋盘优化
Table 1 Chessboard optimization of concentration of gold labeled antibody and coating antigen
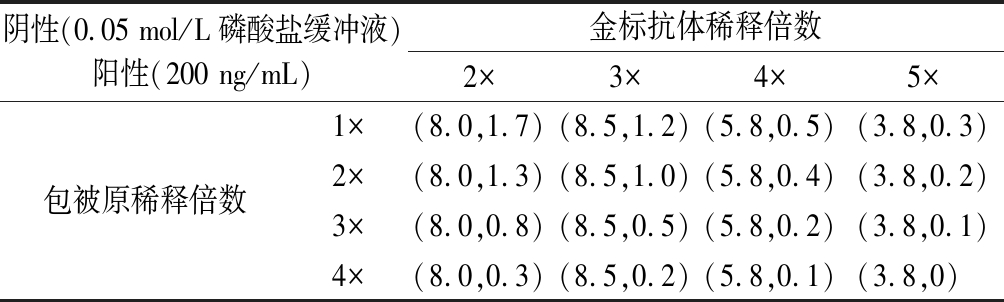
阴性(0.05 mol/L磷酸盐缓冲液)阳性(200 ng/mL)金标抗体稀释倍数2×3×4×5×1×(8.0,1.7)(8.5,1.2)(5.8,0.5)(3.8,0.3)包被原稀释倍数2×(8.0,1.3)(8.5,1.0)(5.8,0.4)(3.8,0.2)3×(8.0,0.8)(8.5,0.5)(5.8,0.2)(3.8,0.1)4×(8.0,0.3)(8.5,0.2)(5.8,0.1)(3.8,0)
2.6 C线二抗质量浓度选择
将羊抗鼠IgG分别稀释成1.0、1.5、2.0、2.5 mg/mL,划膜机划出C线,搭配已经选择好的金标抗体的量和包被抗原的质量浓度,检测阴性样品(0.05 mol/L磷酸盐缓冲液),对比T线和C线的比值(T/C)在约≤1的时候较为合适,结果如图6所示,二抗质量浓度在2.0 mg/mL时最佳。
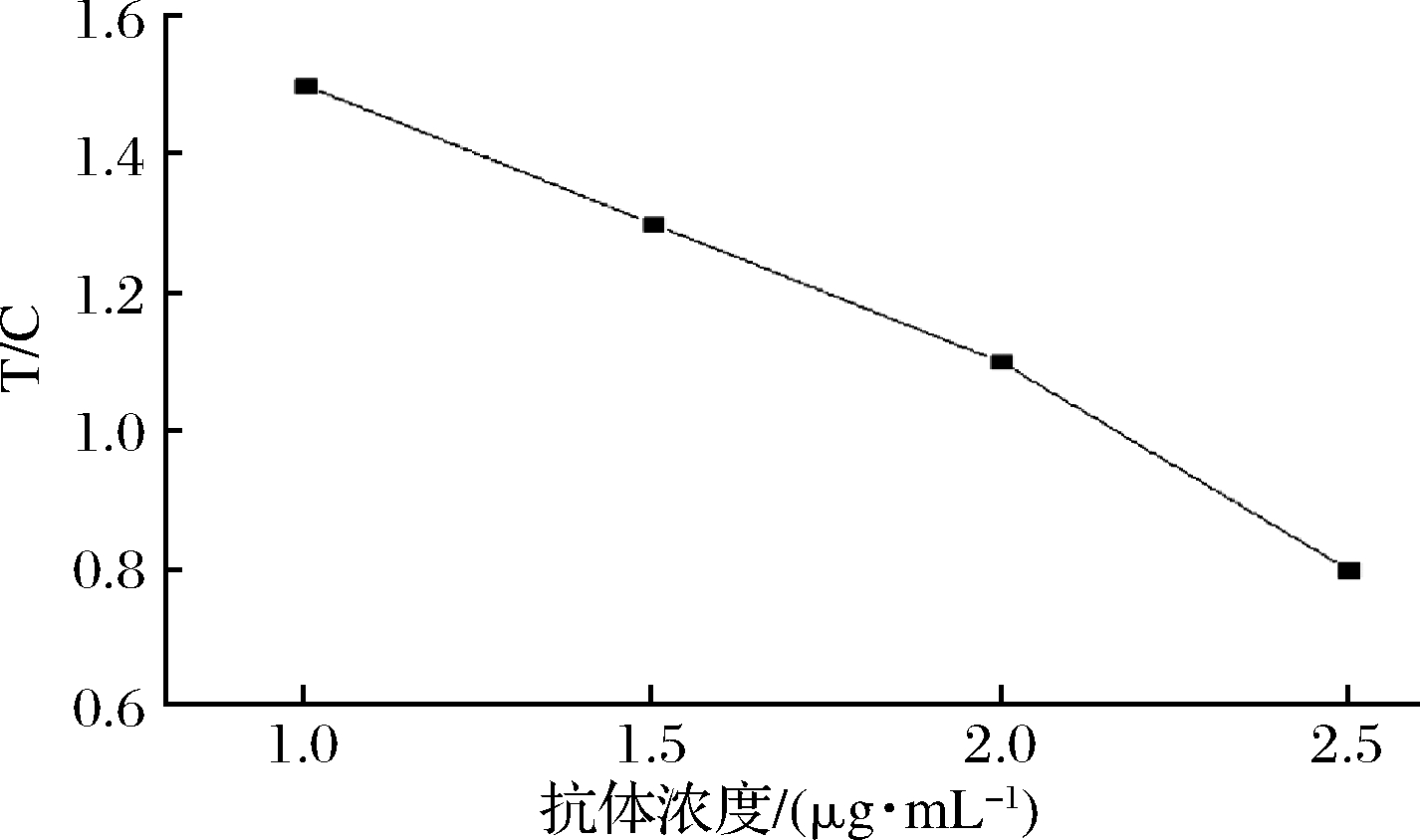
图6 质控线二抗浓度优化
Fig.6 Optimization of the concentration of goat anti-mouse
2.7 方法的检测限及特异性
把经HPLC确定的阴性的水果样品溶液,加入1 mg/mL的2,4-二氯苯氧乙酸、4-氯苯氧乙酸和2,4,5-三氯苯氧乙酸等结构类似物,使2,4-二氯苯氧乙酸的终质量浓度分别为0.005、0.01、0.02、0.05、0.1、0.2、0.5 μg/mL,4-氯苯氧乙酸的终质量浓度为0.01、0.02、0.05、0.10、0.20 μg/mL,2,4,5-三氯苯氧乙酸的终质量浓度为0.1、0.2、0.4、0.6 μg/mL。按照最优条件进行层析卡检测。通过观察T线和C线,判定结果的阴阳性。同时检测2,4-二氯苯氧乙酸结构类似物,计算交叉反应率,判断mwLFIA方法的特异性。结果如图7和表2所示,mwLFIA方法的检测限(消线值)为0.05 μg/mL,其结构类似物 4-氯苯氧乙酸为0.2 μg/mL,2,4,5-三氯苯氧乙酸为0.5 μg/mL,同时具有检测时间短、操作简单、特异性好的优点。
表2 mwLFIA方法的检测限及特异性
Table 2 Limit of detection and specificity of mwLFIA
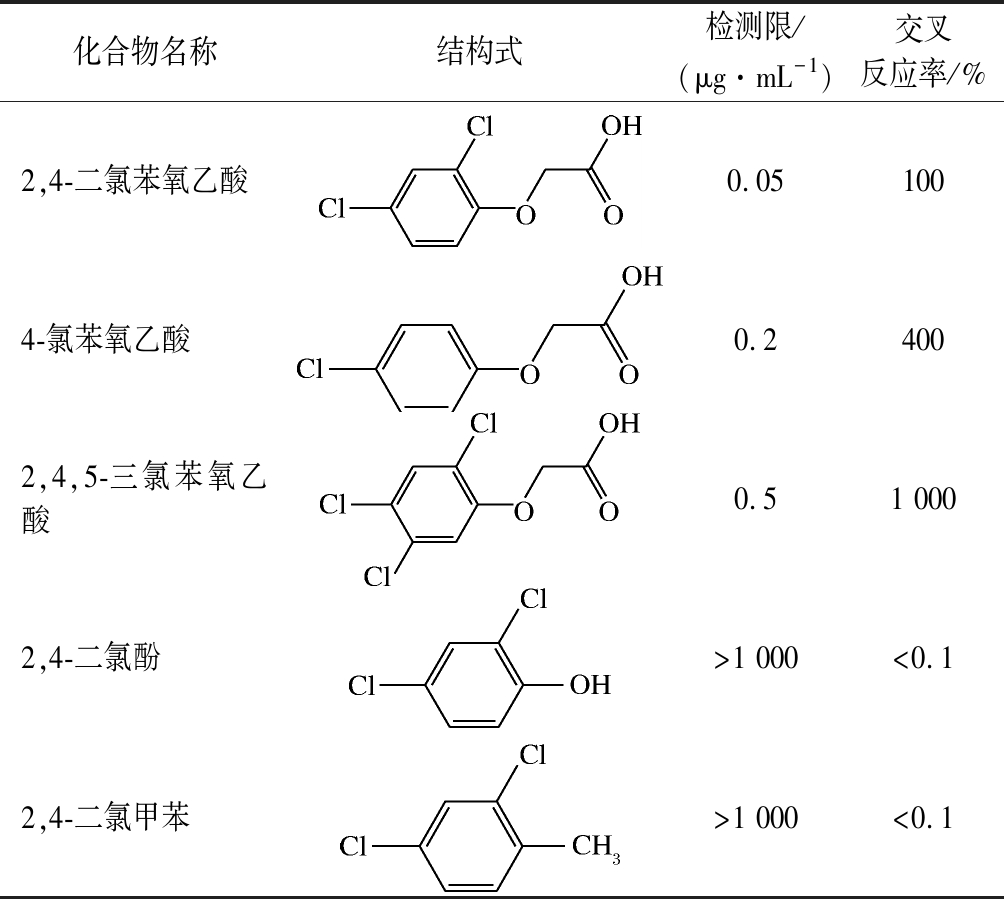
化合物名称结构式检测限/(μg·mL-1)交叉反应率/%2,4-二氯苯氧乙酸0.051004-氯苯氧乙酸0.24002,4,5-三氯苯氧乙酸0.51 0002,4-二氯酚>1 000<0.12,4-二氯甲苯>1 000<0.1
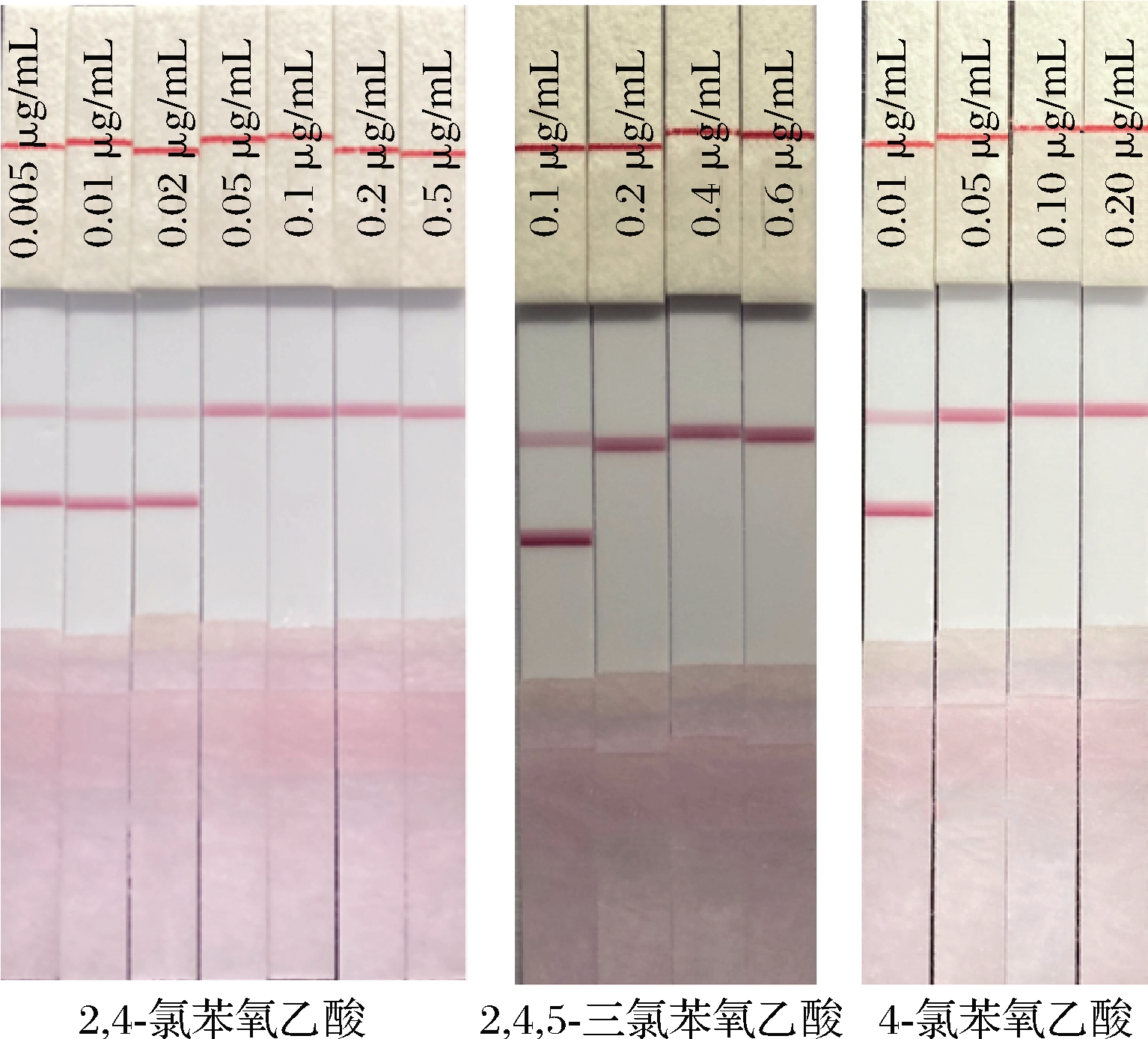
图7 mwLFIA方法的检测限及特异性
Fig.7 Limit of detection and specificity of mwLFIA
2.8 实际样品分析
分别向阴性的芒果中,添加2,4-二氯苯氧乙酸,使添加质量浓度分别为0.01、0.05、0.10、0.25 μg/mL,同时按照确定好的样品前处理方法处理在周边不同商店购买的番茄(S1、S2)、豆芽(S3、S4)、芒果(S5、S6)和柑橘(S7、S8)等未知样品,使用mwLFIA和HPLC同时测定。在标准品的添加实验中,经HPLC确证,mwLFIA的灵敏度未受影响,为0.05 μg/mL。mwLFIA对实际未知样品检测阴阳性符合率与HPLC的结果一致,结果如表3和图8所示,说明本研究建立的针对2,4-二氯苯氧乙酸的mwLFIA方法能够用于实际样品的检测。
表3 mwLFIA实际样品分析结果
Table 3 The determination results for sample by mwLFIA and HPLC
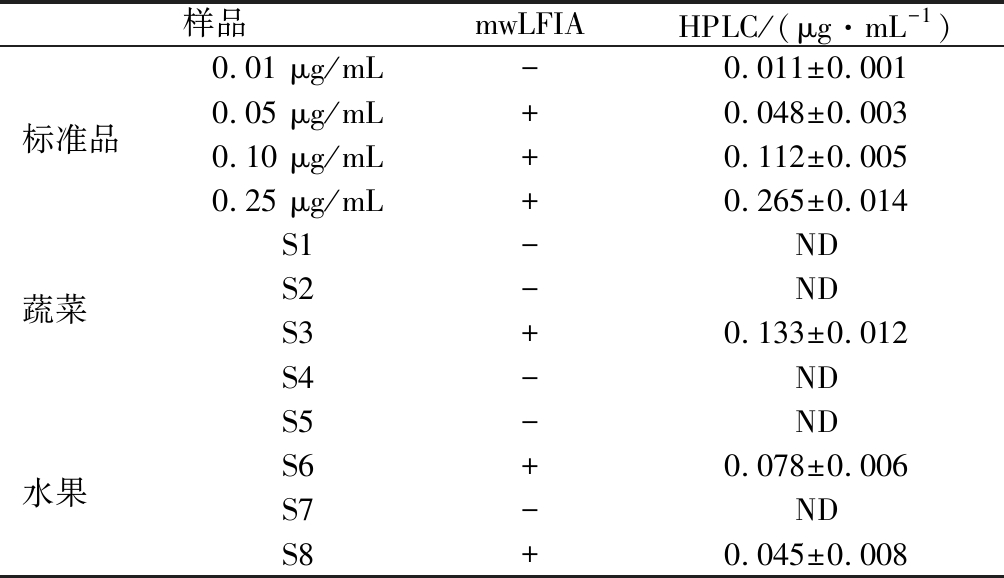
样品mwLFIAHPLC/(μg·mL-1)0.01 μg/mL-0.011±0.001标准品0.05 μg/mL+0.048±0.0030.10 μg/mL+0.112±0.0050.25 μg/mL+0.265±0.014S1-ND蔬菜S2-NDS3+0.133±0.012S4-NDS5-ND水果S6+0.078±0.006S7-NDS8+0.045±0.008
注:“+”为阳性,“-”为阴性,“ND”为未检出
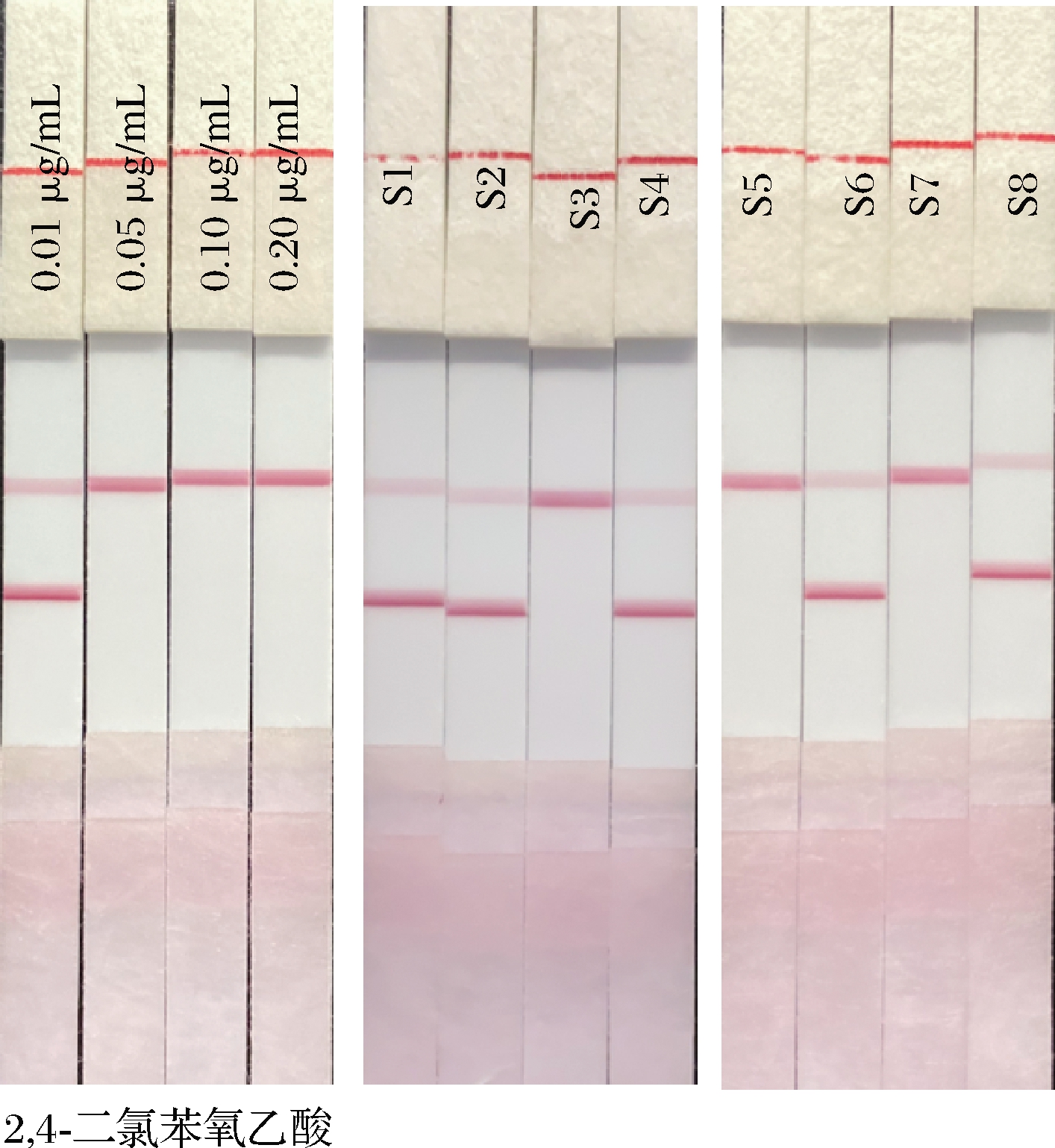
图8 mwLFIA实际样品分析结果
Fig.8 The determination results for sample by mwLFIA and HPLC
3 结论
本研究制备了识别2,4-二氯苯氧乙酸的特异性抗体,建立了蔬菜和水果中2,4-二氯苯氧乙酸残留检测的mwLFIA 方法,并且能够同时检测其结构类似物,其中2,4-二氯苯氧乙酸的消线值为0.05 μg/mL,4-氯苯氧乙酸的消线值为0.2 μg/mL,2,4,5-三氯苯氧乙酸的消线值为0.5 μg/mL,实际样品的分析检测结果与与HPLC法检测结果一致。本方法前处理简单,灵敏快速,适用于蔬菜和水果中2,4-二氯苯氧乙酸残留现场快速筛查。
[1] 杨婕, 黄少文, 孙远明, 等.4-氯苯氧乙酸钠对绿豆芽生长的影响及其残留分析[J].食品工业科技, 2015, 36(15):104-108.
YANG J, HUANG S W, SUN Y M, et al.Analysis of sodium 4-chlorophenxyacetate on mung bean sprouts growth and residue[J].Science and Technology of Food Industry, 2015, 36(25):104-108.
[2] 刘红, 曾志杰, 李传勇, 等.4-氯苯氧乙酸钠对小鼠的毒性及其残留分析[J].食品科学, 2016, 37 (3):197-204.
LIU H, ZENG Z J, LI C Y, et al.Acute and accumulative toxicity and detection of residual sodium 4-chlorophenoxyacetate in mice[J].Food Science, 2016, 37(3):197-204.
[3] 刘红, 曾志杰, 李传勇, 等.4-氯苯氧乙酸钠对小鼠的亚急性毒性及残留检测分析[J].食品安全质量检测学报, 2019, 10(20):6 829-6 836.
LIU H, ZENG Z J, LI C Y, et al.Subacute toxicity and detection of residual sodium 4-chlorophenoxyacetate in mice[J].Journal of Food Safety & Quality, 2019, 10(20):6 829-6 836.
[4] 龚睿蓉,金悦敏.气相色谱法测定豆芽中2,4-二氯苯氧乙酸残留量[J].农业工程,2016,6(3):46-49.
GONG R R, JIN Y M.Determination of 2,4- dichlorophenoxyacetic acid residue in bean sprouts by gas chromatography[J].Agricultural Engineering, 2016, 6(3):46-49.
[5] LIU M, XIE Y, LI H Y, et al.Multiresidue determination of 29 pesticide residues in pepper through a modified QuECHERS method and gas chromatography mass spectrometry[J].Biomedical Chromatography, 2016, 30(10):1 686-1 695.
[6] 段丹丹, 马青青, 张利锋, 等.气相色谱串联质谱检测豆芽中生长调节剂残留[J].食品工业, 2017, 38(3):265-268.
DUAN D D, MA Q Q, ZHANG L F, et al.Determination of growth regulators in bean sprouts by gas chromatography mass spectrometry[J].Food Industry, 2017, 38(3):265-268.
[7] 马瑜璐,朱斌,徐昕荣,等.HPLC法检测豆芽、芒果、番茄中2,4-二氯苯氧乙酸的残留量[J].广州化工,2013,15:166-167.
MA Y L, ZHU B, XU X R, et al.Determination of 2,4- dichlorophenoxyacetic acid residue in bean sprouts, mango and tomato using high performance liquid chromatography[J].Guangzhou Chemical Industry, 2013,15:166-167.
[8] 韦航,邹强,荣杰峰,等.高效液相色谱-串联质谱同时测定豆芽中8 种生长调节剂残留量[J].广州化工,2016,23:118-126.
WEI H, ZOU Q, RONG J F,et al.Determination of eight growth regulators in bean sprouts by HPLC-MS/MS[J].Guangzhou Chemical Industry, 2016,23:118-126.
[9] 候德莉, 梁振纲, 陈文慧, 等.分散固相萃取-HPLC-MS/MS 法测定热带水果中4-氯苯氧乙酸[J].食品工业, 2019,40(12):301-304.
HOU D L, LIANG Z G, CHEN W H, et al.Determination of 4-chlorophenoxyacetic acid in tropical fruit by DSPE-HPLC-MS/MS[J].Food Industry, 2019,40(12):301-304.
[10] 胡志国, 钟彩丽, 何林才, 等.超高效液相色谱串联四极杆质谱测定豆芽中的4-氯苯氧乙酸[J].山东化工, 2019, 48(8):83-84.
HU Z G, ZHONG C L, HE L C, et al.Determination of 4-chlorophenoxyacetic acid in bean sprouts by UPLC-MS/MS[J].Shandong Chemical Industry, 2019, 48(8):83-84.
[11] 郭立净, 王赛楠.液相色谱-高分辨质谱法测定豆芽中4-氯苯氧乙酸的不确定度评估[J].食品安全质量检测学报,2020,11(15):5 203-5 208.
GUO L J,WANG S N.Uncertainty evaluation for determination of 4-chlorophenoxyacetic acid in bean sprouts by liquid chromatography- high resolution mass spectrometry[J].Journal of Food Safety & Quality,2020,11(15):5 203-5 208.
[12] WANG X Y, YU J L, WU X Q, et al.A molecular imprinting-based turn-on ratiometricfluorescence sensor for highly selective and sensitive detection of 2,4-dichlorophenoxyacetic acid (2,4-D)[J].Biosensors & Bioelectronics,2016,81:438-444.
[13] 卫晓丹, 祝永卫, 张萍, 等.2,4-二氯苯氧乙酸的表面增强拉曼光谱快速检测[J].农药, 2018, 57(10):739-741.
WEI X D, ZHU Y W, ZHANG P, et al.Rapid detection of 2,4-D by surface-enhanced raman spectroscopy[J].Agrochemical, 2018, 57(10):739-741.
[14] 余若祯,施汉昌,何苗,等.2,4-二氯苯氧乙酸完全抗原和抗体的制备[J].中国环境科学 2005,25(3):288-292.
YU R Z, SHI H C, HE M,et al.Preparation of complete anigen and antibody for 2,4-dichlorophenoxyacetic acid[J].China Environmental Science, 2005,25(3):288-292.
[15] 魏茂琼, 刘宏程, 林涛,等.直接竞争 ELISA 法检测蔬菜中2,4-二氯苯氧乙酸[J].食品安全质量检测学报,2015,6(12):4 961-4 965.
WEI M Q, LIU H C, LIN T, et al.Detection of 2,4-dichlorophenoxyacetic acid in vegetables by direct competitive ELISA method[J].Journal of Food Safety & Quality, 2015,6(12):4 961-4 965.
[16] 王乾龙,丁立生,王甜甜,等.直接竞争ELISA法快速检测豆芽中2,4-二氯苯氧乙酸的残留[J].食品科技,2017,42(5):290-295.
WANG Q L, DING L S, WANG T T, et al.Direct competitive ELISA for the fast detection of residual 2,4-dichlorophenoxyacetic in bean sprouts[J].Food Science and Technology, 2017,42(5):290-295.
[17] CHEN Y, KONG D, LIU L, et al.Development of an ELISA and immunochromatographic assay for tetracycline, oxytetracycline, and chlortetracycline residues in milk and honey based on the class-specific monoclonal antibody[J].Food Analytical Methods, 2016, 9(4):905-914.
[18] WANG C, HOU F, MA Y.Simultaneous quantitative detection of multiple tumor markers with a rapid and sensitive multicolor quantum dots based immunochromatographic test strip[J].Biosensors and Bioelectronics, 2015, 68:156-162.
[19] LIANG X, FANG X, YAO M, et al.Direct competitive chemiluminescence immunoassays based on gold-coated magnetic particles for detection of chloramphenicol[J].Luminescence, 2016, 31(1):168-172.
[20] LI C, WEN K, MI T, et al.A universal multi-wavelength fluorescence polarization immunoassay for multiplexed detection of mycotoxins in maize[J].Biosensors and Bioelectronics, 2016, 79:258-265.
[21] 邹婷婷,杨金易,徐振林,等.保健酒与口服液中他达拉非类药物微孔侧流免疫层析检测方法研究[J].分析化学,2019,47 (8):1 249-1 257.
ZOU T T, YANG J Y, XU Z L, et al.Detection of tadalafil and its analogues in health wine and oral liquid by microwell lateral flow immunochromatography assay[J].Chinese Journal of Analytical Chemistry, 2019,47(8):1 249-1 257.
[22] PENG J,LIU L Q,XU L G, et al.Gold nanoparticle-based paper sensor for ultrasensitive and multiple detection of 32 (fluoro)quinolones by one monoclonal antibody[J].Nano Research, 2017, 10(1):108-120.