蜂蜜作为一种营养丰富的天然保健品,深受广大消费者青睐。蜂蜜除了果糖、葡萄糖外,还含有各种维生素、矿物质、氨基酸、多酚类、黄酮类、多糖、活性酶和类胡萝卜素等活性物质,因此,蜂蜜具有抗氧化、抗菌、促进心脑和血管功能等生理功能[1-2],常服用蜂蜜对心脏病、高血压等疾病都有良好的辅助医疗作用。水溶性维生素是人体维持正常生理功能所必须的一类微量有机物质,适量摄取对生长、代谢、发育都起到了积极的促进作用。水溶性维生素检测方法主要包括微生物方法[3-4]、液相色谱法[5-12]和液相色谱-串联质谱法[13-17]。微生物法灵敏度高但步骤繁琐、检验周期长。液相色谱法前处理相对简单,但多种维生素同时检测存在一定困难,主要因为紫外检测器选择性较差,易受基质干扰;部分化合物没有生色基团,紫外检测器灵敏度较低,经常需要衍生化操作,衍生条件限制了多种化合物的同时检测。液相色谱-串联质谱法具有高灵敏度、高精确度、高通量的特点,已广泛应用于多种食品基质中水溶性维生素的测定。
对水溶性维生素检测的报道大多集中在饮料[5,11-13]、保健品[6]、婴幼儿配方食品[14-16]、特殊医学配方食品[17]等基质,对于蜂蜜中多种水溶性维生素含量测定的研究较少[7,18-20]。因维生素化学结构及性质差异大,已报道的文献方法大多未采取净化措施。液相色谱-串联质谱法在选择性和灵敏度方面优势明显,但基于其检测原理,基质效应(matrix effect,ME)很容易影响定量结果的准确性。同位素内标是解决基质影响最好的办法,但内标价格昂贵,且未完全普及。为有效解决ME对蜂蜜中多种维生素定量结果的影响,本文建立了以甲酸铵溶液作为提取溶剂,HLB固相萃取柱进行净化的前处理方法。该过程有效去除了蜂蜜中糖分、氨基酸等物质对目标物的影响,实现了蜂蜜中5种水溶性维生素的准确定量分析。
本研究利用超高效液相色谱-串联质谱仪建立了蜂蜜中维生素B1、维生素B2(核黄素)、吡哆醇、泛酸维生素B5)和生物素(维生素B7)的分析方法。该方法前处理过程简单,回收率和精密度满足方法确认要求。除生物素灵敏度与国家标准[4]相当外,其他化合物的灵敏度比现有国家标准[8-10]高10~20倍。蜂蜜中维生素是其天然品质的体现,属于微量营养成分,其含量的检测对方法的灵敏度要求较高。本研究建立的方法既能提供较高的灵敏度,又能实现多种维生素同时检测,非常适用于蜂蜜中多种水溶性维生素含量的同时测定。
1 材料与方法
1.1 仪器、试剂与材料
LC-30AD-8050超高效液相色谱-串联质谱仪(配有电喷雾电离源),日本Shimadzu公司;3-18K台式高速离心机,德国Sigma公司;MS303S电子天平,瑞士METTLER TOLEDO公司;MS3型旋涡混合器,德国IKA公司;SB-800DTD超声清洗仪,宁波新芝生物科技股份有限公司;Milli-Q超纯水系统,美国Millipore公司。
甲醇、甲酸、甲酸铵(色谱纯),德国Merck公司;盐酸、乙醇(分析纯),国药集团化学试剂有限公司;维生素B1(硫胺素盐酸盐)(纯度为95.0%)、生物素(纯度为99.9%)标准品,德国Dr.Ehrenstorfer公司;泛酸(泛酸钙)(纯度为99.0%)、维生素B2(纯度为99.3%)、吡哆醇(纯度为99.9%)标准品,北京振翔科技有限公司;HLB固相萃取柱(200 mg,6 mL),美国Waters公司;实验用水为超纯水;实验用蜂蜜,15批次为蜂场采集样本,15批次为淘宝、京东等网络途径购买样本。
1.2 样品处理
样品提取:准确称取2.5 g试样(精确至0.001 g)于25 mL比色管中,加入20 mL提取液涡旋混匀至蜂蜜完全溶解,冰水浴超声15 min,取出后恢复至室温,用提取液定容至刻度,摇匀,得到试样溶液。若样品中有少量花粉,可用滤纸过滤,收集滤液待用。
样品净化:依次用5 mL甲醇,5 mL水活化HLB固相萃取柱。移取1 mL上清液,以不高于1.0 mL/min的流速全部通过固相萃取柱,弃去流出液;用1 mL提取液淋洗,弃去淋洗液,将小柱抽干;用1 mL甲醇洗脱并收集全部洗脱液。40 ℃氮吹至近干,初始流动相定容至1 mL,涡旋混匀后,经微孔滤膜过滤,供液相色谱-串联质谱仪分析测定。试验过程应在避光环境下进行。
1.3 LC-MS/MS条件
1.3.1 色谱条件
色谱柱:Waters HSS T3柱(100 mm×2.1 mm,1.8 μm),或性能相当者;流动相:A为20 mmol/L甲酸铵溶液,B为甲醇,洗脱梯度见表1;流速:0.35 mL/min;柱温:40 ℃;进样量:2 μL。
表1 UPLC梯度洗脱程序
Table 1 Gradient elution program for UPLC separation

时间/min流动相A/%流动相B/%09910.59912928310904.929859918991
1.3.2 质谱条件
离子源:电喷雾离子源(ESI源);检测方式:多反应监测(multiple reation monitoring,MRM);扫描方式:正离子模式扫描;雾化气流量:3 L/min;加热气流量:10 L/min;接口温度:300 ℃;DL管温度:250 ℃;加热块温度:400 ℃;干燥气流量:10 L/min。
5种维生素的定量离子对、定性离子对、驻留时间、Q1 Pre 偏差、Q3 Pre 偏差见表2。
2 结果与分析
2.1 仪器条件的优化
这5种维生素化学结构中均含有伯胺、仲胺基团或含氮杂环结构,易被电离成正离子。本实验采用电喷雾离子源,在正离子扫描模式下对化合物进行母离子扫描,获得化合物的准分子离子峰;在产物离子扫描模式下,以各个化合物的准分子离子峰为母离子,进行二级质谱扫描,获得碎片离子信息,选择丰度较强,基质干扰较小的两对离子为为定性定量离子;在MRM模式下,优化碰撞能等质谱参数,优化后的质谱条件见表2。
表2 五种维生素质谱检测条件
Table 2 MS/MS parameters of 5 kinds of vitamins
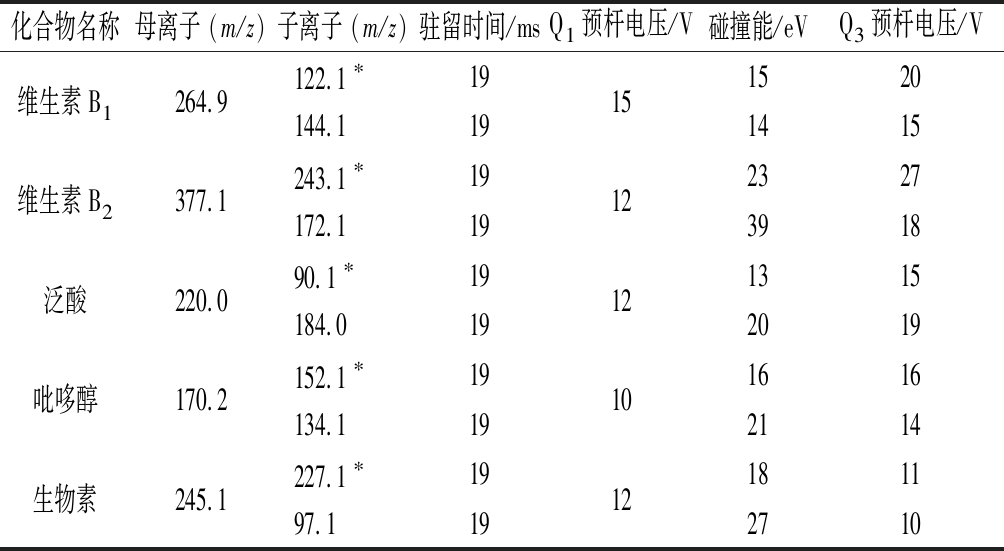
化合物名称母离子 (m/z)子离子 (m/z)驻留时间/msQ1预杆电压/V碰撞能/eVQ3预杆电压/V维生素B1264.9122.1∗19151520144.1191415维生素B2377.1243.1∗19122327172.1193918泛酸220.090.1∗19121315184.0192019吡哆醇170.2152.1∗19101616134.1192114生物素245.1227.1∗1912181197.1192710
注:*表示定量离子
维生素B1、吡哆醇和泛酸极性较强,在常规C18柱上保留较弱。本实验选择了Waters HSS T3色谱柱进行分离,该色谱柱对极性化合物保留较强。流动相组成能够影响目标化合物的分离、峰形和离子化效率,在相同的梯度洗脱条件下,分别考察甲醇-0.1%甲酸、甲醇-甲酸铵、甲醇-甲酸铵(含0.1 %甲酸)、乙腈-甲酸铵等4种流动相在HSS T3 色谱柱上对目标化合物分离情况、灵敏度、峰形的影响。结果发现甲酸和酸化甲酸铵做流动相时,维生素B1保留时间在1 min左右,峰形拖尾;泛酸在酸性条件下色谱保留更好但响应值低。甲酸铵做流动相时各化合物保留时间适中,峰形对称,且响应值均比甲酸条件下更高。当有机相为乙腈时,保留时间稍短,目标物峰形和响应值变化不大。综上,本研究选择甲醇-甲酸铵体系进行色谱分离。
研究还考察了10、20和50 mmol/L这3个浓度水平的甲酸铵做流动相时对目标物的影响。发现随着盐浓度增加,泛酸保留时间逐渐由2.31 min增加至2.49 min,响应值也明显增加,维生素B1、维生素B2、吡哆醇和生物素受盐浓度影响很小。盐浓度越高在色谱系统析出的风险越大,流动相中盐浓度的增加也会增加质谱离子源部分的雾化难度。在20 mmol/L条件下,泛酸响应值已很好,完全满足蜂蜜的检测需求,因此,最终选择甲醇-20 mmol/L甲酸铵为流动相。通过优化梯度洗脱程序,使目标物与杂质组分有效地分离,峰形良好,混合标准溶液的谱图见图1。
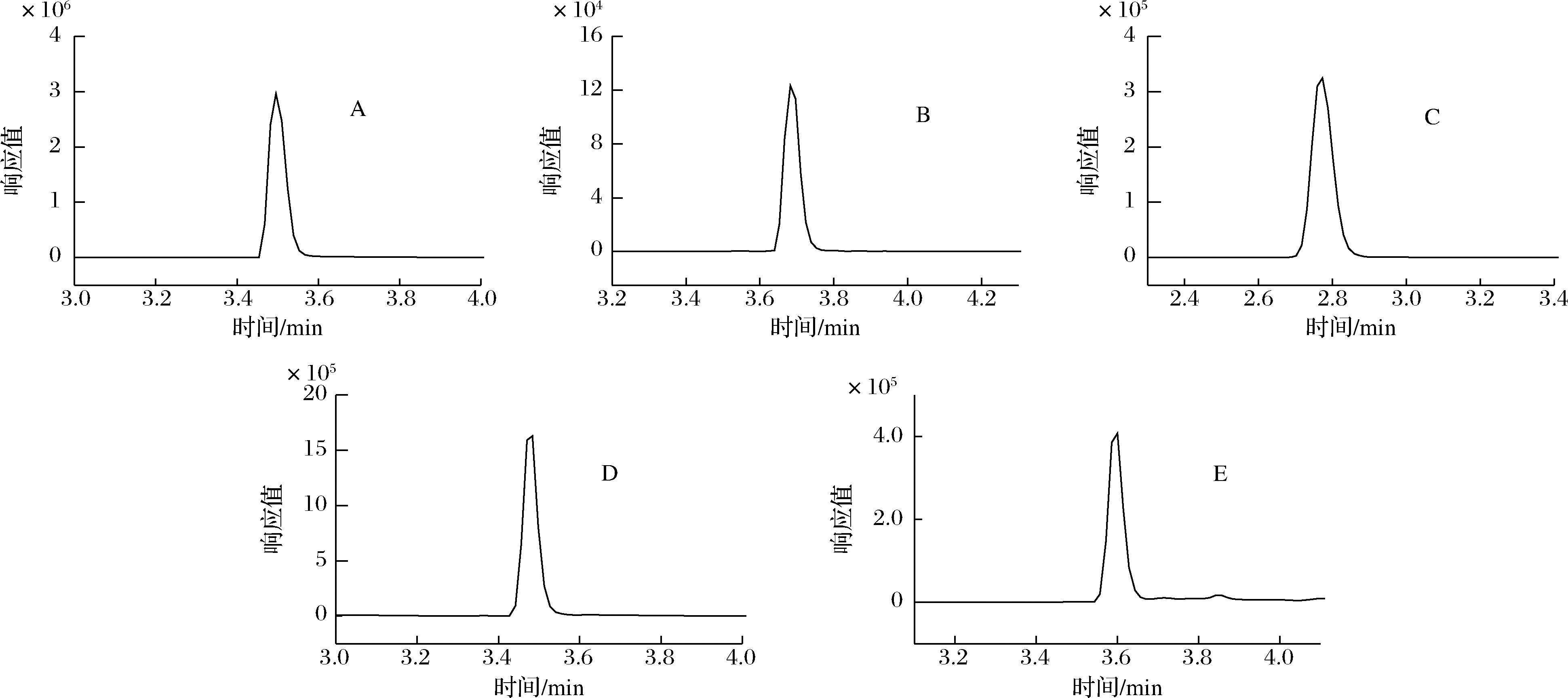
A-维生素B1;B-维生素B2;C-泛酸;D-吡哆醇;E-生物素
图1 五种维生素标准溶液MRM色谱图
Fig.1 MRM chromatograms of 5 kinds of vitamins standard solution
2.2 前处理条件的优化
2.2.1 提取溶剂的选择
5种待测目标物均易溶于水,在酸性或中性溶液中稳定性较好。蜂蜜中大量的糖分、氨基酸、矿物质等也易溶于水,水系溶剂能使样品均匀分散,更有利于目标物的提取,为此本实验选择不同pH值的水溶液作为提取溶剂。分别考察了0.1 mol/L盐酸溶液(提取液1)、0.1%甲酸溶液(提取液2)、pH值4.5的甲酸-甲酸铵溶液(提取液3)、20 mmol/L甲酸铵溶液(提取液4)和纯水(提取液5)5种提取溶剂的提取效率,结果如图2所示。低pH值条件下,维生素B1和吡哆醇均呈离子化状态,影响了其在固相萃取柱(solid phase extraction,SPE)SPE柱上的保留,回收率明显偏低;pH低于4.5时生物素回收率较低,甲酸铵和水作为提取剂时生物素回收率无区别。因蜂蜜中含有多种有机酸,用纯水做为提取溶剂时,蜂蜜的提取溶液呈酸性,维生素B1回收率较低。维生素B2维生素在提取剂2中,基质增强回收偏高,在剩余4种提取溶剂中回收率都很好。综上,本实验选择20 mmol/L甲酸铵溶液作为提取溶剂。
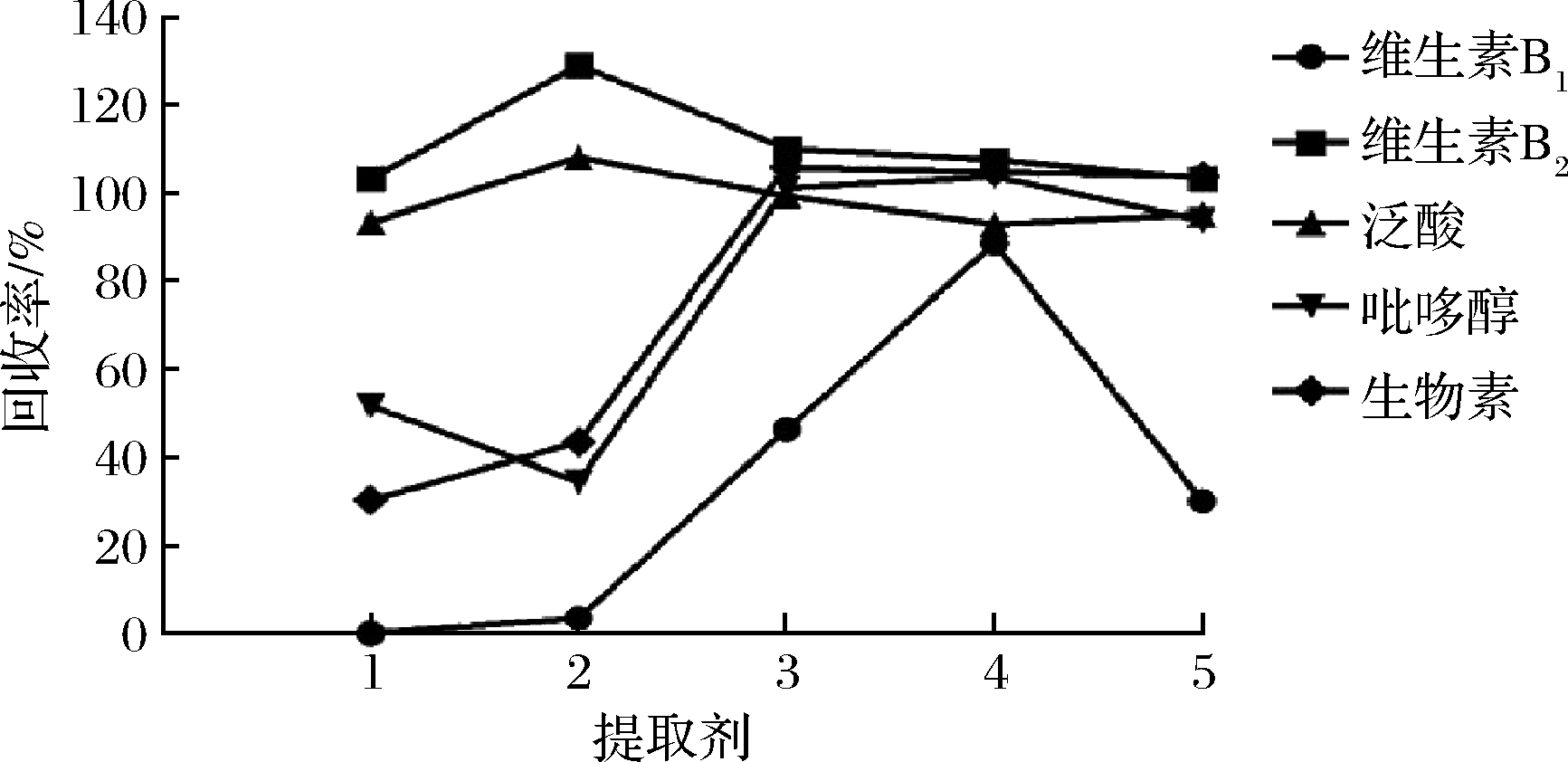
图2 不同提取剂对5种维生素回收率的影响
Fig.2 Effect of different extraction solvents on recoveries of five vitamins
2.2.2 固相萃取柱的选择
蜂蜜中含有大量的果糖和葡萄糖,如果不进行净化,很容易在离子源中碳化,出现离子传输管堵塞等问题,影响目标物的离子化过程,降低其离子化效率,从而影响分析结果的准确性。SPE柱因具有简单、快速、高效等特点被广泛应用于多种食品基质中目标物净化和富集。本实验考察了Waters Oasis HLB(200 mg,6 mL)、PRiME HLB(200 mg,6 mL)和C18(500 mg,6 mL)这3种固相萃取柱对5种维生素回收率的影响(见图3)。结果表明维生素B1和泛酸在PRiME HLB的上样和淋洗过程中损失太多,回收率偏低,不能满足检测需求。维生素B1和生物素在C18上回收率不足80%,泛酸和吡哆醇在HLB和C18回收率接近,维生素B2用C18净化后回收率偏高,经确认是基质增强明显造成的。HLB固相萃取柱是在聚合物上键和官能团,在去除糖类、蛋白等杂质上有一定的优势,5种化合物均能得到很好地保留,回收率在85%以上,而C18柱是硅胶基体,不耐干涸,净化过程需要更严格的控制,综合考虑,本研究选择HLB柱作为净化柱。
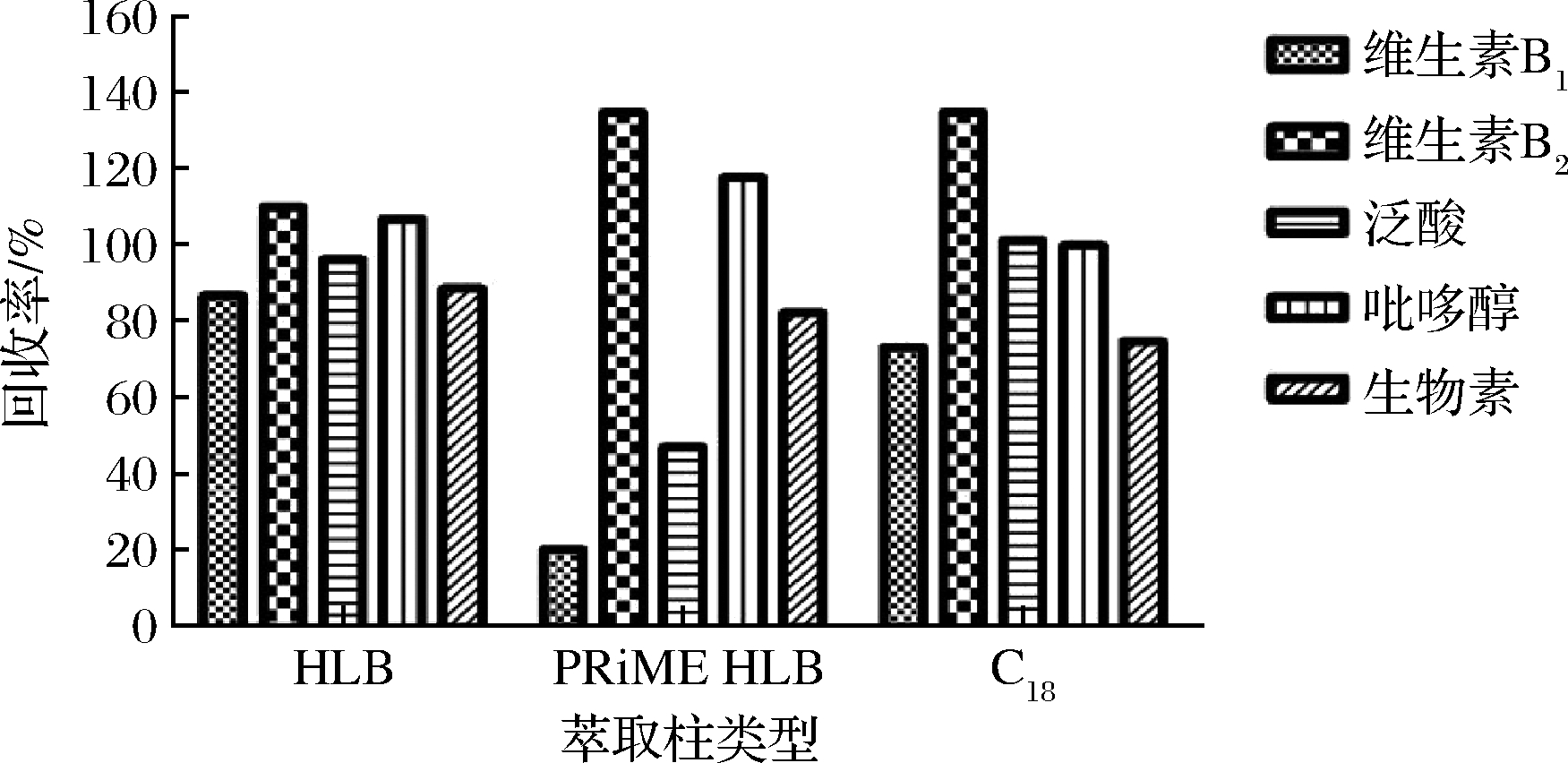
图3 不同固相萃取柱对5种维生素回收率的影响
Fig.3 Effect of different solid phase extraction columns on recoveries of five vitamins
研究还对60、200和500 mg这3种规格型号的HLB柱对目标物的回收率影响进行了考察。结果发现60 mg填料太少,对目标物保留弱,在上样和淋洗过程中维生素B1、泛酸均有较大程度损失,维生素B1的回收率为36.7%,泛酸的回收率不足5%;200 mg和500 mg的2种填料的回收率几乎无差异,基于经济考虑,本研究最终选择Waters Oasis HLB(200 mg,6 mL)作为净化柱。
2.2.3 上样体积和洗脱液体积的优化
确定固相萃取柱后,经进一步比较、优化了上样体积和洗脱用甲醇的体积对回收率和ME的影响。实验选取了0.5、1和2 mL这3个上样体积进行比较。结果发现上样体积为2 mL时,泛酸ME明显增强,上样体积对其他目标物影响不大,为保证目标物的灵敏度,选择上样体积为1 mL。在上样体积为1 mL 的条件下,分别采用0.5、1和2 mL甲醇对5种目标物进行洗脱,结果发现,当甲醇含量为0.5 mL时目标物回收率均低于50%;当洗脱体积为1 mL和2 mL时,5种目标物回收率无差异,洗脱液体积增加会延长氮吹时间,同时还可能将更多的杂质一起洗脱下来,因此最终选择1 mL甲醇进行洗脱。
2.3 方法学验证
2.3.1 线性范围、检出限与定量限
将混合标准工作溶液注入超高效液相色谱-串联质谱仪测定,获得标准溶液的质量色谱图。以定量离子的峰面积(y)对其质量浓度(x)作标准曲线,得到线性回归方程。分别向蜂蜜样品中加入10、20、50和100 μg/kg的标准物质,以信噪比S/N≥3确定方法的检出限为20 μg/kg,以信噪比S/N≥10确定方法的定量限为50 μg/kg。5种水溶性维生素的线性范围、回归方程、线性相关系数、方法检出限(limit of detection,LOD)和定量限(limit of quantification,LOQ)见表3。在质量浓度5~200 ng/mL范围内,定量离子的峰面积与质量浓度之间呈良好的线性关系,相关系数均大于0.99。洋槐蜜中5种维生素定量限水平的多反应监测色谱图如图4所示。
表3 五种维生素的线性范围、线性方程、相关系数、 检出限及定量限
Table 3 Linear ranges, the linear equations,correlation coefficients,LODs and LOQs of five vitamins
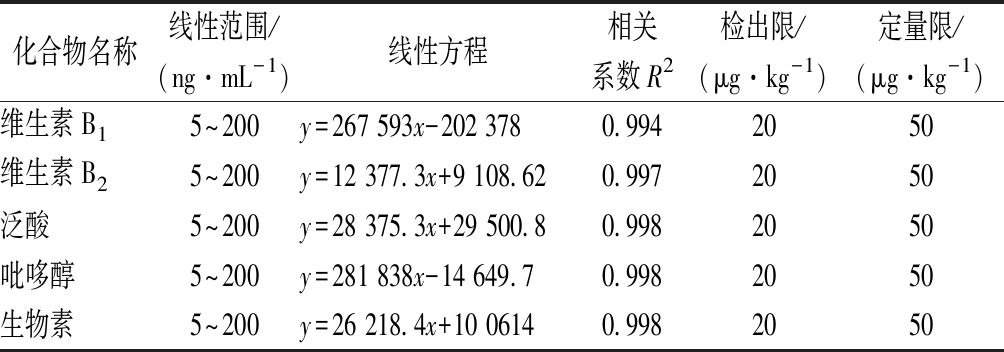
化合物名称线性范围/(ng·mL-1)线性方程相关系数R2检出限/(μg·kg-1)定量限/(μg·kg-1)维生素B15~200y=267 593x-202 3780.9942050维生素B25~200y=12 377.3x+9 108.620.9972050泛酸5~200y=28 375.3x+29 500.80.9982050吡哆醇5~200y=281 838x-14 649.70.9982050生物素5~200y=26 218.4x+10 06140.9982050
2.3.2 回收率与精密度
选择5种维生素含量都较低的洋槐蜜作为空白样品,向此样品中添加低、中、高3个浓度水平的标准溶液,每个水平做6个平行实验,测定5种维生素的回收率,考察方法的回收率和精密度(表4)。由表4可知,蜂蜜中5种维生素的加标回收率在90.2%~108.8%,相对标准偏差为1.49%~10.93%,方法的回收率和精密度满足微量分析的要求。
表4 五种维生素的回收率和精密度(n=6)
Table 4 Recoveries and relative standard deviations of five vitamins in acacia honey(n=6)
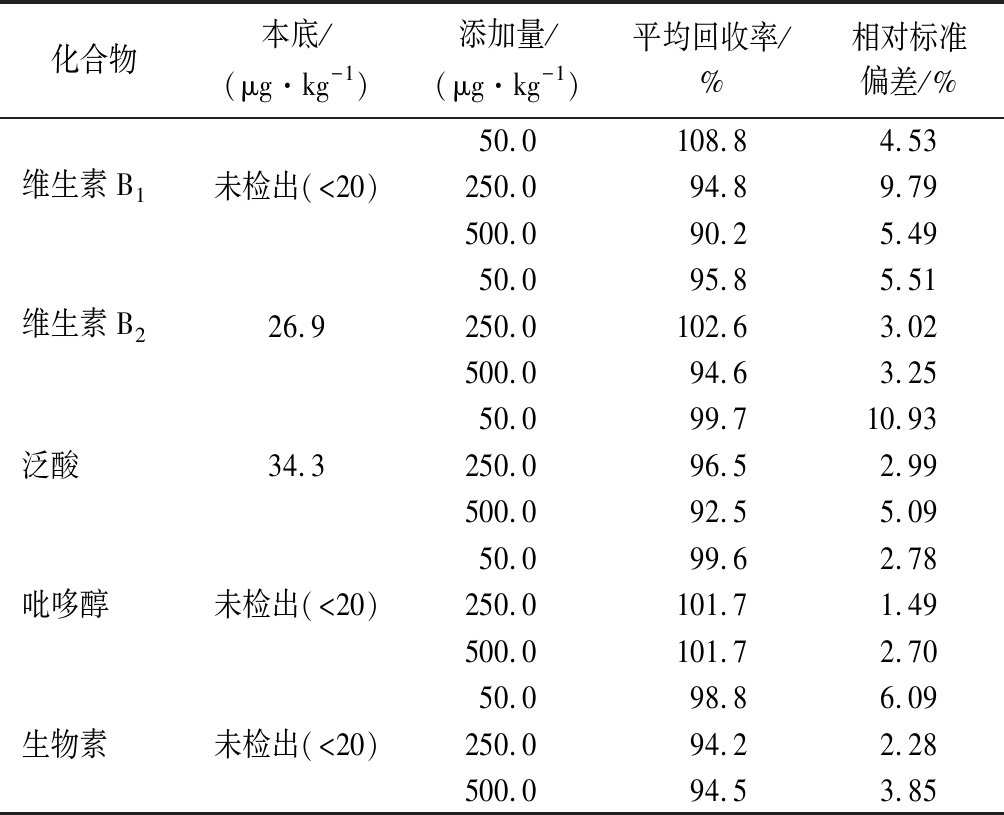
化合物本底/(μg·kg-1)添加量/(μg·kg-1)平均回收率/%相对标准偏差/%50.0108.84.53维生素B1未检出(<20)250.094.89.79500.090.25.4950.095.85.51维生素B226.9250.0102.63.02500.094.63.2550.099.710.93泛酸34.3250.096.52.99500.092.55.0950.099.62.78吡哆醇未检出(<20)250.0101.71.49500.0101.72.7050.098.86.09生物素未检出(<20)250.094.22.28500.094.53.85
2.4 基质效应
液相色谱-串联质谱检测过程中一般都存在一定的基质效应ME,常需要通过ME来评价方法的灵敏度和选择性。取空白蜂蜜基质样品,按1.2的步骤制备空白基质溶液。分别用基质溶液和定容溶剂稀释标准储备液,得到同浓度水平的测定液。分别测定上述2种溶液中目标成分的响应值,计算两者的相对比值来评价ME,如公式(1)所示:
(1)
ME绝对值越大基质效应越强。
蜂蜜中5种维生素的基质效应见图5,结果表明,吡哆醇基本无基质效应,维生素B1、维生素B2、泛酸和生物素的ME的绝对值小于10%,满足定量需求。因此,本方法采用纯溶剂标准曲线定量,减少了匹配相同空白基质的难操作性及不同空白样匹配带来的差异性。

A-维生素B1;B-维生素B2;C-泛酸;D-吡哆醇;E-生物素
图4 洋槐蜜中5种维生素定量限水平的多反应监测色谱图
Fig.4 MRM chromatogram showing the LOQs for five vitamins spiked in acacia honey
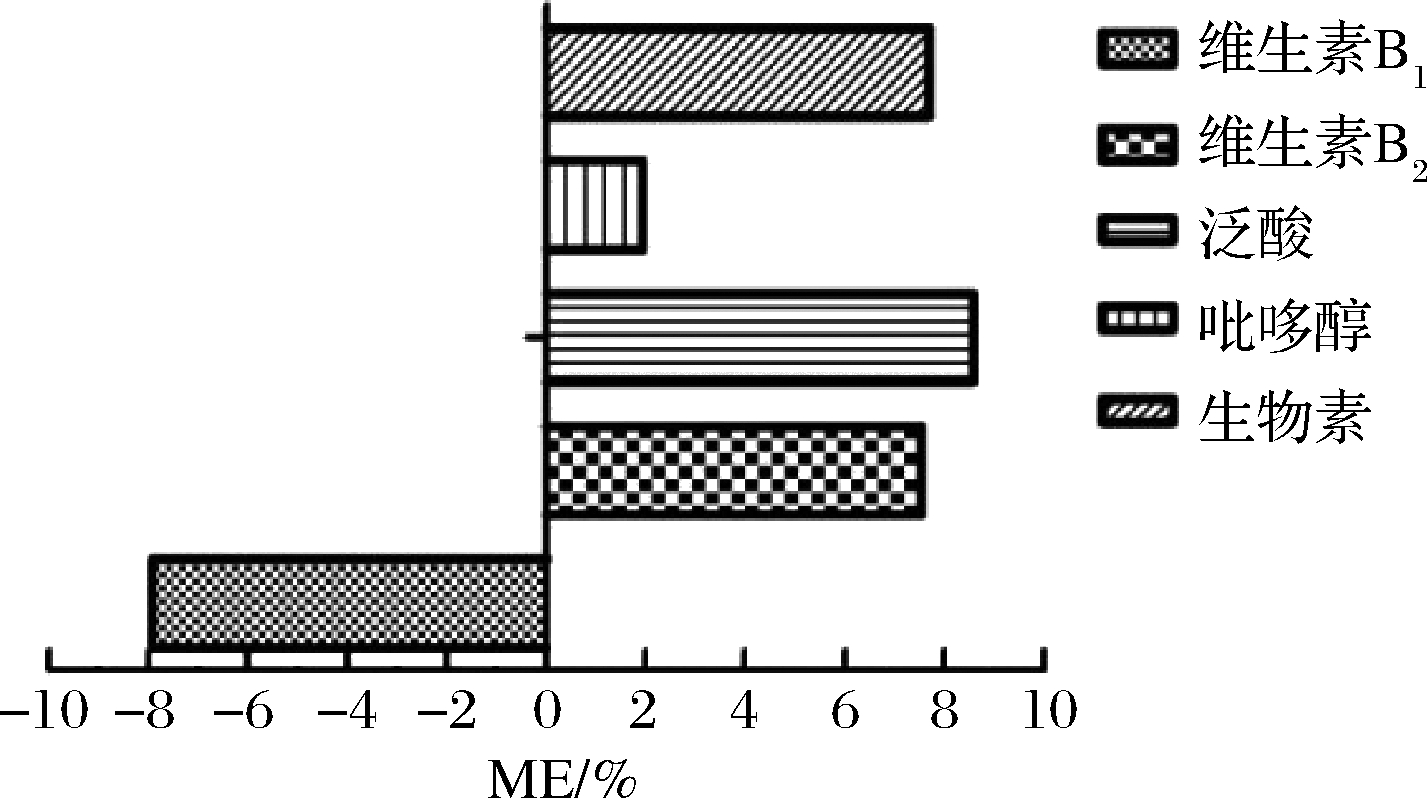
图5 蜂蜜中5种维生素基质效应评价图
Fig.5 Matrix effects in UPLC-MS/MS analysis of five vitamins in honey
2.5 实际样品测定
采用本研究建立的分析方法对蜂场采集的15批次蜂蜜样品和网络采购的15批次蜂蜜样品进行分析。结果表明,30批次蜂蜜中维生素B1和生物素含量均低于定量限;维生素B2检出率为10%,含量分别为74.6、80.7和315.8 μg/kg;2个网购的蜂蜜样品中泛酸检测值在检出限和定量限之间,剩余28个样品含量范围是70.7~1 774.3 μg/kg;9个蜂蜜样品中吡哆醇低于定量限,21个样品蜂蜜中吡哆醇的含量范围是58.3~658.4 μg/kg。
3 结论
本研究建立了超高效液相色谱-串联质谱法测定蜂蜜中5种水溶性维生素的分析方法。该方法以甲酸铵溶液作为提取溶剂,HLB固相萃取柱对目标物进行净化,可明显减少基质影响;以HSS T3色谱柱进行目标物的分离,目标物保留适中,峰形对称;方法的回收率、精密度和灵敏度均能满足各类检测要求,可应用于蜂蜜中5种水溶性维生素的同时检测,大幅提高了检测效率。
[1] 宿书芳,薛霞,公丕学,等.超高效液相色谱-串联质谱法检测蜂蜜中的内源性酚酸和黄酮类物质[J].现代食品科技,2018,34(8):260-266.
SU S F, XUE X, GONG P X, et al.Determination of endogenous phenolic acids and flavonoids in honey by UPLC/MS/MS[J].Modern Food Science & Technology,2018,34(8):260-266.
[2] 刘鹏.蜂蜜内部营养成分及有毒有害物质的调查及研究进展[J].现代食品,2017 (4):55-57.
LIU P.The Progress of the investigation and research of honey internal nutrients and toxic and harmful substances[J].Modern Food,2017(4):55-57.
[3] 国家卫生和计划生育委员会.GB 5009.210—2016 食品安全国家标准 食品中泛酸的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 5009.210—2016 National food safety standard Determination of pantothenic acid in food[S].Beijing:China Standards Press, 2016.
[4] 国家卫生和计划生育委员会.GB 5009.259—2016 食品安全国家标准 食品中生物素的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 5009.259—2016 National food safety standard Determination of biotin in food[S].Beijing:China Standards Press, 2016.
[5] 蒋俊树,赵彬.高效液相色谱法测定能量饮料中多种水溶性维生素[J].食品科学,2008,29(12):635-637.
JIANG J S, ZHAO B.Establishment of HPLC method for determination of seven water-soluble vitamins in energy beverage[J].Food Science,2008,29(12):635-637.
[6] 陈毓芳,林海丹,吴宏中,等.高效液相色谱法同时测定保健食品中11种功效成分[J].食品科学,2015,36(8):244-249.
CHEN Y F, LIN H D, WU H Z, et al.Simultaneous determination of 11 functional components in health foods by high performance liquid chromatography[J].Food Science,2015,36(8):244-249.
[7] 徐玲云.利用高效液相色谱外标法测定蜂产品中水溶性维生素[J].中国养蜂,1988(4):6-7.
XU L Y.Determination of five water-soluble vitamins in honey product by HPLC with external standard method[J].Apiculture of China,1988(4):6-7.
[8] 国家卫生和计划生育委员会.GB 5009.84—2016 食品安全国家标准 食品中维生素B1的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 5009.84—2016 National food safety standard Determination of vitamin B1 in food[S].Beijing:China Standards Press, 2016.
[9] 国家卫生和计划生育委员会.GB 5009.85—2016 食品安全国家标准 食品中维生素B2的测定.[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 5009.85—2016 National food safety standard Determination of vitamin B2 in food[S].Beijing:China Standards Press, 2016.
[10] 国家卫生和计划生育委员会.GB 5009.154—2016 食品安全国家标准 食品中维生素B6的测定.[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission.GB 5009.154—2016 National food safety standard Determination of vitamin B6in food[S].Beijing:China Standards Press, 2016.
[11] 何海彤,周铭林,伍志航.高效液相色谱法同时检测维生素功能饮料中16种成分[J].食品工业,2019,40(2):289-293.
HE H T,ZHOU M L,WU Z H.Simultaneous determination of 16 kinds of ingredients in vitamins functional beverages by high performance liquid chromatography.[J].The Food Industry,2019,40(2):289-293.
[12] 宋萍萍,曹江平,刘书慧.反相高效液相色谱法测定果醋中的8种维生素[J].食品科学,2012,33(12):181-184.
SONG P P,CAO J P, LIU S H, et al.Determination of eight water-soluble vitamins in fruit vinegar by RP-HPLC[J].Food Science,2012,33(12):181-184.
[13] 朱晓玲,张苗,王会霞,等.功能饮料、保健食品中11种水溶性维生素测定的HPLC-MS/MS方法研究[J].食品科技,2017,42(7):294-300.
ZHU X L, ZHANG M, WANG H X, et al.Determination of 11 kinds of water-soluble vitamins in function beverage and food supplements by high performance liquid chromatography-tandem mass spectrometry.[J].Food Science and Technology,2017,42(7):294-300.
[14] 陈美君,王旻,亢美娟,等.超高压液相色谱-串联质谱法同时测定婴幼儿配方乳粉中11种B族维生素[J].食品科学,2016,37(4):144-153.
CHEN M J, WANG M, KANG M J, et al.Simultaneous determination of 11 B vitamins in infant formula by UPLC-MS/MS[J].Food Science,2016,37(4):144-153.
[15] CELLAR N A, MCCLURE S C, SALVATI L M et al.A new sample preparation and separation combination for precise,accurate, rapid, and simultaneous Determination of vitamins B1, B2, B3,B5, B6, B7, and B9 in infant formula and related nutritionals by LC-MS/ MS[J].Analytica Chimica Acta,2016,934:180-185.
[16] 严华,崔凤云,别玮,等.超高效液相色谱-同位素稀释质谱法同时测定婴幼儿配方奶粉中10种水溶性维生素[J].食品安全质量检测学报,2020,11(17):5 871-5 878.
YAN H,CUI F Y,BIE W, et al.Simultaneous determination of 10 kinds of water soluble vitamins in infant formula by ultra performance liquid chromatography-isotope dilution mass spectrometry[J].Journal of Food Safety & Quality,2020,11(17):5 871-5 878.
[17] 孙学文,刘莹莹,谢军,等.超高效液相色谱-串联质谱法同时测定特殊医学用途配方食品中9种水溶性维生素[J].中国食品药品监管,2020(4):54-59.
SUN X W,LIU Y Y,XIE J, et al.Simultaneous determination of 9 kinds of water soluble vitamins in foods for special medical purpose by ultra performance liquid chromatography-isotope dilution mass spectrometry[J].China Food & Drug Administration Magazine,2020 (4):54-59.
[18] CIULUA M, SOLINAS S, FLORIS I, et al.RP-HPLC determination of water-soluble vitamins in honey[J].Talanta,2011,83 (3):924-929.
[19] VIRGINIA L R, SOLEDAD V, AMELIA V, et al.Analysis of water-soluble vitamins in honey by isocratic RP-HPLC[J].Food Analytical Methods,2013, 6:488-496.
[20] 何敏恒,李秀英,曾令浩,等.同位素稀释-超高效液相色谱-串联质谱法检测蜂蜜中泛酸含量[J].中国酿造,2015,34(4):157-160.
HE M H, LI X Y, ZENG L H, et al.Determination of pantothenic acidin honey isotope dilution-ultra performance liquid chromatography-tandem mass spectrometry[J].China Brewing,2015,34(4):157-160.