天然蛋白存在着溶解度低、凝胶性差、起泡性弱、易致敏等缺点,采用酶法技术改变蛋白结构,改善其特性,以提高食品品质,扩大销售范围。酶法改性是利用酶催化蛋白水解或蛋白交联,从而使得蛋白分子发生水解或蛋白分子间(内)发生交联,来达到改变蛋白的功能特性的目的。目前,催化蛋白交联的酶主要有以下4类:转谷氨酰胺酶(transglutaminase,TGase)、酚氧化酶、过氧化物酶、赖氨酰氧化酶。其中,TGase研究的较为深入。如表1所示,该酶催化底物广泛,性能改善明显。
表1 转谷氨酰胺酶对食品性能的影响
Table 1 Effect of transglutaminase on food properties
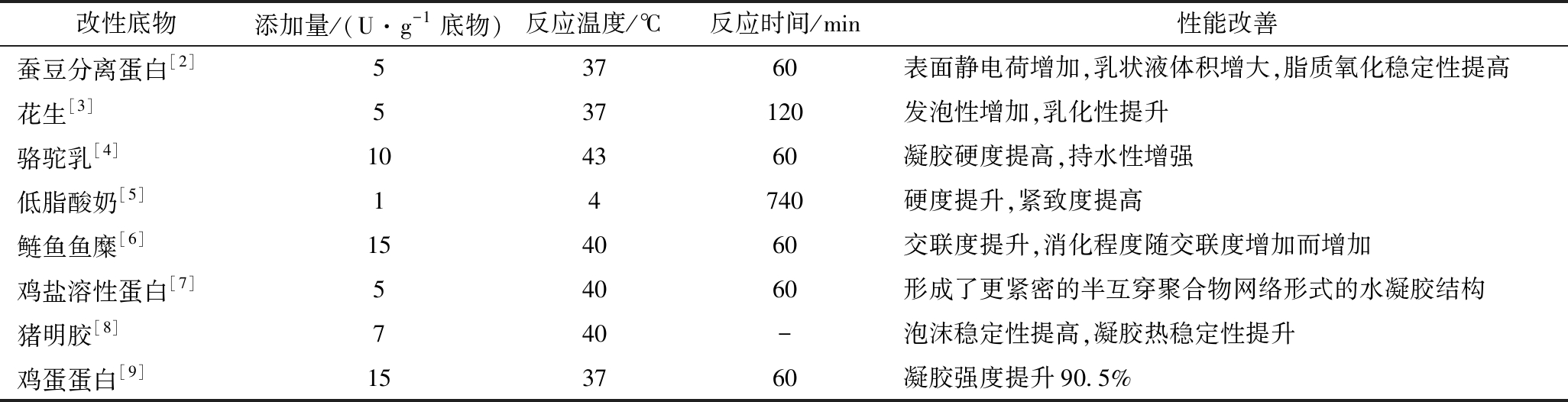
改性底物添加量/(U·g-1底物)反应温度/℃反应时间/min性能改善蚕豆分离蛋白[2]53760表面静电荷增加,乳状液体积增大,脂质氧化稳定性提高花生[3]537120发泡性增加,乳化性提升骆驼乳[4]104360凝胶硬度提高,持水性增强低脂酸奶[5]14740硬度提升,紧致度提高鲢鱼鱼糜[6]154060交联度提升,消化程度随交联度增加而增加鸡盐溶性蛋白[7]54060形成了更紧密的半互穿聚合物网络形式的水凝胶结构猪明胶[8]740-泡沫稳定性提高,凝胶热稳定性提升鸡蛋蛋白[9]153760凝胶强度提升90.5%
TGase根据来源不同可以将转谷氨酰胺酶分为内源性转谷氨酰胺酶及微生物来源转谷氨酰胺酶(microbial transglutaminase,MTGase)。内源性转谷氨酰胺酶在自然界中存在广泛,但从植物或动物中提取得到的该酶产量低、提纯难且催化反应依赖Ca2+。相比于MTGase,内源性转谷氨酰胺酶催化活性位点被Cys残基和Try残基组成的氢键覆盖,只有当底物中存在Ca2+,才能发生构象变化,暴露出活性位点;而MTGase催化活性位点上的Cys64能够充分暴露在溶剂中,因此反应不需要依赖Ca2+且反应迅速[1]。TGase在参与催化反应时,酰基供体为该酶肽链上谷氨酰残基的γ-酰基,酰基受体可以为赖氨酸上的ε-氨基、伯氨基和水。根据受体的不同,反应可分为蛋白质交联反应,酰基转移反应和脱酰胺基反应。各反应对蛋白特性的影响如图1所示。本文将从蛋白功能特性、其他特性及与新技术复合使用3个方面进行阐述。
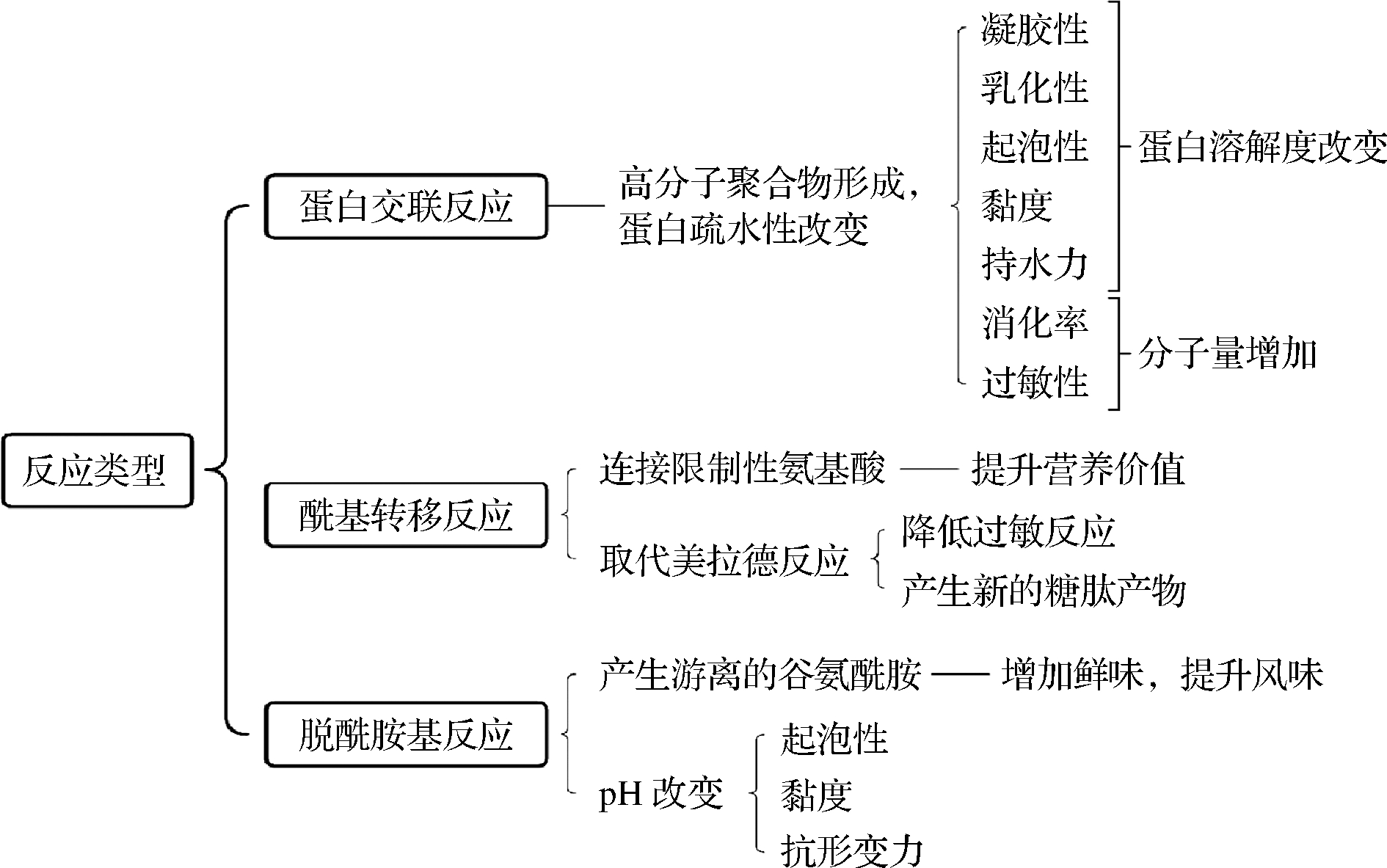
图1 TGase催化食品蛋白改性反应及机制
Fig.1 Modification reactions and mechanisms of food protein catalyzed by TGase
1 转谷氨酰胺酶对食品蛋白功能特性的影响
1.1 凝胶性
凝胶是介于固体和液体之间的中间状态,通过共价或非共价键交联聚合物分子,形成能够截留水或其他小分子物质的三维网络结构,是食品蛋白重要功能特性之一。与传统的热致凝胶相比,TGase可催化低浓度蛋白,甚至不能成胶的蛋白溶液形成凝胶,且凝胶的凝胶强度和弹性模量远远大于相同条件下的热致凝胶。蛋白的凝胶作用可以形成独特物理状态的食物,如豆腐、酸乳、干酪等。
在豆制品中,酶较易催化7S球蛋白聚合,不易使11S球蛋白聚合;且只能使蛋白中的酸性亚基聚合,几乎不能使其碱性亚基聚合[10]。这主要是因为7S球蛋白含有相对较高含量的谷氨酰胺和赖氨酸,而谷氨酰胺和赖氨酸是TGase的主要底物。TGase交联大豆分离蛋白有助于豆腐形成更持久的凝胶,并能更长久地保存豆腐的结构特性[11]。
在肉制品加工过程中,TGase通过交联作用,改变肌球蛋白重链结构,降低α-螺旋含量,增加β-折叠含量,有助于形成高分子聚合物,改善蛋白溶解度,从而改变蛋白凝胶性。在交联时,TGase的首要目标是肌球蛋白中的S1亚基。由于空间受限,肌球蛋白易被氧化。在轻度氧化条件下,TGase诱导的肌球蛋白交联区域在肌原纤维结构中由S1亚基向S2亚基转移[12]。TGase可以在轻度氧化时促进S2交联,S2可成为新的交联区域,该发现可应用于不需被抑制氧化的肉制品加工中。在所有肉制品加工过程中,TGase只会对肌球蛋白产生作用,对肌动蛋白没有明显影响[13]。
在乳制品中,TGase的主要作用蛋白还存有异议。有学者认为TGase对乳清蛋白的作用不明显,主要作用于κ-酪蛋白[14],因为其主要位于酪蛋白胶束的表面,接近酶催化位点。酪蛋白交联后,可防止尿素及柠檬酸的分离,对酸乳发酵等有一定的指导意义。在乳制品的加工中,凝乳酶的类型、TGase的添加顺序,酶的孵育时间都会影响乳制品的品质、出成率[15-16]。TGase在凝乳酶之前加入,会引起其与凝乳酶活性的竞争反应,从而使得产品品质下降[17]。但也有学者[18]研究发现在加入凝乳酶之前加入TGase,生产的奶酪,产量更高、质地更软。二者的矛盾可能是由凝乳酶的类型不同造成的。目前,研究乳制品多集中在中性条件,但是在酸性条件下的交联还未被深入探究。
1.2 持水力
持水力通常定义为蛋白截留水及储存水的能力,即蛋白与水的相互作用。水分是大多数食品中含量最高的组分,含量及分布状态通常影响着产品的嫩度、鲜度、货架期及风味等。SEIGHALANI等[19]研究了不同TGase水平对红罗非鱼鱼糜凝胶特性的影响,其结果表明TGase(0.30 U/g鱼糜)的交联作用提高鱼糜凝胶持水力,主要是因为形成的蛋白凝胶,网络结构致密均匀,从而截留住更多的水。TGase催化的脱酰胺反应,降低面包烘焙损失,蛋白质的亲水性增加,使得其与蛋白质重链聚合产生的强凝胶结构结合[20]。但是在玉米研究中发现,酶的脱酰胺作用普遍存在,底物中蛋白质和赖氨酸含量有限,阻碍了交联的形成,使得玉米面包的黏度降低。
因此,MTGase催化的脱胺反应和交联的形成直接影响不同蛋白质底物的持水力。与凝胶性相似,随着酶添加量的持续增加,酶添加量与持水力呈负相关。因为蛋白间和蛋白内的交联数越多,蛋白与水的相互作用越低,蛋白截留水越困难。
1.3 乳化特性
蛋白质的乳化特性影响着冰淇淋、蛋糕等食品的品质。在乳液体系中,蛋白质作为主要的表面活性剂,其较好的表面活性有助于分散相的形成和稳定。良好的表面活性剂必须具有以下特点:(1)快速进行界面吸附;(2)在界面上快速分散及重新定位;(3)在到达界面时,能与邻近分子相互作用,形成能够承受热冲击和机械冲击的、强而有黏性的黏弹性膜[21]。
TGase的交联和脱酰胺反应都影响着蛋白的乳化特性。交联反应使猪肉肌原纤维蛋白结构发生改变,促进分子聚集到油滴表面,产生静电排斥,从而阻止聚集、絮凝和油水两相分离,提高乳液的稳定性[22];在研究肌原纤维蛋白-非肉蛋白-橄榄油复合乳化液时,异型肽键的生成改变了蛋白表面基团的疏水基团/亲水基团的比率,可能改变蛋白构象,增加负电荷的数量,有助于在乳液界面形成更有弹性的蛋白膜,从而增加蛋白乳化稳定性[23];但有学者研究鲤鱼肌原纤维蛋白时发现,乳化性降低,交联反应破坏了蛋白与蛋白之间的热力学平衡,溶解性降低,平均粒径增加,乳化粒子减少[24]。综上,乳化特性的改变可能与交联度相关。此外,脱酰胺反应会导致pH下降,极性基团增加,进而促进蛋白质在水面上的展开[25]。范丽丽等[26]发现,在酶添加量为20 U/g,pH 7.0,温度55 ℃条件下,表面疏水性增强,提升了蛋白对油脂的吸附,改善了蛋白的乳化性。
2 转谷氨酰胺酶对食品蛋白其他特性的影响
2.1 致敏性
食物过敏是因为食物变应原进入身体后,自身免疫系统受到不良反应所产生的现象。目前,没有有效的方法来预防或根除食物过敏,过敏药物也只能通过缓解症状来减少不良反应的产生。食物中大多数过敏原为盐溶性蛋白,具有耐酸、耐蛋白酶酶解特性。利用TGase交联蛋白,产生大分子聚合物,改变蛋白表位,将暴露在表面的抗原表位包埋在蛋白分子内部,降低过敏反应。但交联过度会发生反作用,使蛋白过度聚集,形成较大的蛋白颗粒,从而产生致敏性[27]。MENG等[3]发现酶解后,花生水解物的免疫球蛋白E(immunoglobulin,IgE)结合能力下降,相比于酶水解,TGase交联对其致敏性无明显影响;但XING等[28]研究了TGase交联对乳酸菌介导牛奶-豆奶混合物致敏性的影响,发现酶交联可有效降低该生物豆腐的致敏性。FOTSCHKI等[29]研究TGase交联后的牛奶和马奶之间的致敏性差异时发现,改性后马奶的致敏性较低;其结果的差异主要是因为牛奶中存在TGase抑制剂,且马奶中致敏酪蛋白的含量低,仅为牛奶的1/4。综上致敏性的改变可能与交联度、底物的种类相关。当与酪氨酸酶联合使用时,也可显著降低虾原肌球蛋白的变应原性[30]。TGase与催化交联酶联合使用,可能有一定的协同作用,但两者之间的协同机理、交联位点的变化还需进一步探究。
2.2 消化性
TGase改性使蛋白产生不同数量的异型肽键,改变了肌球蛋白重链聚集度和凝胶网络结构的交联度,导致蛋白分子结构和蛋白-蛋白结合距离发生变化,形成稳定的、不同孔径的蛋白网络结构[31-32]。蛋白聚集体分子质量增加,会影响胃消化过程和营养物质传递,使机体保持一定的饱腹感,从而能够达到控制能量摄入的目的;这对研发低血糖生成指数(glycemic index,GI)食物具有一定的启示作用。FANG等[33]在探究TGase改性鲢鱼鱼糜消化过程中的营养物质氨基酸及肽的释放时发现,在消化30 min后,TGase交联的鱼糜凝胶消化率相比于未交联的更高,且增加了氨基酸及肽的释放量,即改性后的鱼糜凝胶营养价值较高。未来可进一步进行动态体外胃肠模型胃、肠消化实验和体内研究,探究TGase改性蛋白的消化机制和吸收特性。
人体TGase催化的脱酰胺反应中,谷蛋白去酰胺化会激活乳糜泻发病机制,这使得在小麦制品中添加TGase引起了争议。OGILVIE等[34]研究发现,在面包中添加TGase(0~2 000 U/kg)不会产生活性谷蛋白肽,即添加TGase不会造成风险。改性后的蛋白消化后,能释放多种生物活性肽,且多数具有抗氧化性、抗炎性,提高营养价值[35-36]。
2.3 风味
目前TGase改性多集中在对蛋白功能特性改变的研究上,对于风味的吸附及释放研究较少。挥发性成分的传质阻力的改变可以改变风味在蛋白凝胶中的整体平衡。风味与蛋白结合作用中,表征为疏水的可逆结合可以降低加工过程中的风味损失;TGase催化的异性肽键的不可逆结合,对去除异味具有重要的意义。风味的释放实际上是风味化合物在凝胶网络中的扩散过程,该过程与凝胶网络的结构性质、底物的种类相关。在牛乳的风味研究中,复合使用TGase与超高压技术,发现风味的组成和含量有了明显的改善[37]。这可能是因为其协同作用导致了一些活性位点的暴露。在小麦蛋白的滋味研究中,TGase与超声的复合使用,可以促进蛋白酶解液释放出更多的鲜甜味呈味物质[38]。但是仅单独的TGase交联的酶解液滋味评分较低,这可能是因为酶交联使得胰蛋白酶酶切位点掩蔽在内部,无法被酶切成小分子肽类。在牛肉粒的加工过程中,添加TGase,可以在一定程度上减少游离氨基酸的损失,增加风味前体物的含量,在后期的加工过程中表现出更多的特征风味[39]。但风味的释放与蛋白凝胶网络结构的内在关系还未被深入探究,可从凝胶网络结构的角度来阐述风味的控释机理。
酶催化酰基转移反应,可取代传统的糖基化反应,WANG等[40]研究了TGase的添加量对晚期糖基化终产物(advanced glycation end-products,AGEs)形成的影响,发现在TGase与壳寡糖的添加比例为1∶1(质量比)时,可抑制AGEs的形成,避免对产品色泽、营养和风味的破坏。TGase催化糖基化对抑制水产品中AGEs的形成是有效的,可进一步探究,使其成为一种有效合理的方法。
3 转谷氨酰胺酶与其他技术复合使用
3.1 物理技术
3.1.1 超声
超声辅助技术是食品蛋白改性中常见的一种技术,超声的空化效应产生的瞬时高温、高压,使蛋白的空间结构展开,破坏分子间的氢键,改善表面疏水性。食品经适当的超声预处理后,再经TGase改性,可有效改善食品的功能特性与风味。
采用超声[41]与TGase复合使用,提高了大豆-乳清混合蛋白的交联度、凝胶硬度、持水力。在预超声后,蛋白内部结构展开,暴露出更多的疏水结构,有利于酶的交联,形成更多的二硫键,从而形成致密规则的凝胶网络结构,提升持水力。其原因主要有以下几点:(1)在改性过程中,超声波空化引起气泡破裂,使得气泡周围区域的局部压力和温度升高,从而导致蛋白展开及肽键断裂,亲水性氨基酸残基暴露在水中,溶解度提高。(2)超声处理减小了大豆分离蛋白的粒径,蛋白构象发生改变,导致蛋白表面疏水性和游离巯基增加;这有利于TGase交联,形成可溶性蛋白聚集体,增强了蛋白-水的相互作用,提高了蛋白溶解度。(3)经超声和TGase催化后的凝胶蛋白较空白组对比后,能够形成致密的凝胶网络结构,这主要是因为蛋白分子发生交叠作用,缩小了彼此间的距离,使得网孔细小且均匀[42-44]。
风味的改善是利用酶法聚合及酶法降解双重改性方式,提高酶解蛋白呈味物质的释放量。在120 W超声15 min后,进行TGase交联5 h,小麦面筋蛋白-酵母混合液经酶解后的鲜味评分显著提高[38]。呈味肽物质提升,可能是由于超声后,β-转角降低,天门冬氨酸和谷氨酸是与其相关的氨基酸,即说明天门冬氨酸和谷氨酸被转换成为β-折叠和无规则卷曲这样的伸展结构,改变了蛋白的柔韧性,促进酶与胰蛋白酶酶切位点的结合,降解出更多的呈味肽;其次,也可能是因为酵母内源酶在TGase存在的交联环境下,发挥了催化作用,使超声后的蛋白结构更易被胰蛋白酶水解;此外,交联可能使超声后的蛋白再次发生了结构变化,酶切位点变得更加敏感,呈味物质被更好的释放出来。
3.1.2 微波
微波与TGase的联合使用包括3种方式:(1)对食品进行微波预处理后再进行适当的酶改性;(2)微波辐射TGase后,改性后的酶对食品进行催化;(3)同时进行微波辐射与酶改性。
秦新生[43]利用微波对大豆-小麦混合蛋白进行预处理后,再经TGase交联改性时发现,混合蛋白凝胶的凝胶强度、持水力得到显著提高。凝胶强度提升的主要原因为,在水中,微波对蛋白中的极性分子产生高频率振荡作用,使微波场能转化为热能,蛋白质温度升高,从而使得蛋白质分子间(内)的非共价键断裂,蛋白质二级、三级结构被破坏,空间结构变得疏散;这有利于酶交联,促进二硫键的形成及分子间的相互作用。其次,微波的极化效应,减小了蛋白的分子粒径,有利于形成致密均匀的微观结构。蛋白-水的相互作用增加,微波加热时的能量促进二硫键的形成,提升持水力[45]。
微波改性酶时发现,微波能改变TGase的空间结构,提高酶活,但是复合使用不一定能够产生协同效应[46]。使用微波辐射TGase,酶活相比于普通水浴提高了4.38%,微波辐射展开了酶的结构,暴露出更多的结合位点。对乳蛋白进行微波与TGase的复合改性研究时发现,同时使用可提高乳蛋白的聚集度、提升交联速度[47]。单独使用TGase时,乳清蛋白和酪蛋白聚合的时间较长;复合使用时,缩短了近1/3的时间;这可能是由于微波不仅提升了酶活,且辐射使蛋白结构展开,促进了TGase的交联作用。而有学者利用微波处理后的TGase进行催化肌原纤维蛋白时发现,其凝胶强度却低于水浴处理结果;这是与电磁场的快速变化阻碍了肌原纤维蛋白的展开及溶解,以及系统中生成了较多的二硫键进一步形成了空间位阻阻碍了酶的催化有关。
3.1.3 超高压
超高压技术被常被用作物理的非热加工的一种保藏技术。在近年来的研究中发现,超高压诱导胶凝作用,且相比于热诱导凝胶,具有更好的凝胶稳定性。在200~300 MPa时,高压诱导的鱼糜凝胶具有更好的持水力,且在贮藏过程中,凝胶的稳定性有所提升。
超高压技术与TGase联合使用时,鱼糜的凝胶强度、持水力显著增加;相比于单使用超高压或酶,联合使用时共聚物更多,产生协同效应[48]。但未说明超高压技术对酶空间构象的改变,可进一步深入探究超高压对酶内部结构的影响。QIN等[45]研究发现超高压对大豆分离蛋白/小麦蛋白预处理后,经TGase诱导交联的凝胶特性得到明显提高;在100~400 MPa的超高压预处理10 min后,大豆分离蛋白/小麦蛋白发生展开,使巯基及疏水性基团暴露在蛋白表面,升高了β-折叠和无规则卷曲的含量,促进了TGase交联,凝胶的储能模量提高、持水力增加,凝胶强度提高。在对小麦面筋蛋白乳液凝胶性质的研究时发现,超高压预处理有效降低油滴粒径、增加了比表面积,促进TGase交联,形成分子间/分子内的交联,使其形成均匀致密的凝胶网络结构,提高芳香物质的贮存稳定性,这对研究鱼糜风味的释放及香味物质的包埋具有一定的意义[49]。
3.2 化学交联剂
TGase与γ-聚谷氨酸复合使用时,二者存在协同作用,凝胶性及弹性改善效果优于单独使用的改善效果[50]。这是因为在复合使用时,γ-聚谷氨酸降解后暴露出Glu残基,TGase催化Glu残基与Lys残基交联,形成更多的非二硫共价键,而非二硫共价键与疏水相互作用在凝胶的三维网络结构中是维持有序的网络结构的主要作用力。ZHANG等[51]发现羧化纳米纤维素与TGase复合使用时,由于纳米纤维素的纳米尺寸使亲水基团暴露更多,且暴露的羧基的吸水力提高了蛋白的持水性,使得凝胶结构更加致密、凝胶强度增加。综上,化学交联剂通常与TGase具有协同作用,可改善凝胶质地,在复合凝胶或重组肉制品中有较好的应用前景。
4 展望
TGase作为蛋白质交联剂,可以改善食品功能特性、生化特性,提高凝胶性、持水性、乳化性等,降低致敏性、消化率,产生多种生物活性肽。但仍有一些问题有待进一步研究,目前对TGase的应用研究多集中在提高蛋白的功能特性上,酶交联的酰基转移反应、脱酰胺基反应研究较少,可加强对营养价值、风味释放及吸附方向上的研究;复合技术的使用也成为现阶段的研究热点,微波可提高TGase酶活,高压可提升TGase的交联度,辐射与TGase有协同作用,未来可以将TGase与其他新型物理技术联合使用提高蛋白功能特性;利用酶交联,将廉价植物蛋白与低值的碎肉重组可提升产品的营养价值及商业价值,为重组肉制品的发展提供参考。
[1] NOGUCHI K, ISHIKAWA K, YOKOYAMA K I, et al.Crystal structure of red sea bream transglutaminase[J].Journal of Biological Chemistry, 2001, 276(15):12 055-12 059.
[2] LIU C, DAMODARAN S, HEINONEN M.Effects of microbial transglutaminase treatment on physiochemical properties and emulsifying functionality of Faba bean protein isolate[J].LWT, 2019, 99:396-403.
[3] MENG S, TAN Y Q, CHANG S, et al.Peanut allergen reduction and functional property improvement by means of enzymatic hydrolysis and transglutaminase crosslinking[J].Food Chemistry, 2020, 302:125 186.
[4] CHEN C, WANG P J, ZHANG N, et al.Improving the textural properties of camel milk acid gel by treatment with trisodium citrate and transglutaminase[J].LWT, 2019, 103:53-59.
[5] GARC A-G
A-G MEZ B, ROMERO-RODR
MEZ B, ROMERO-RODR GUEZ
GUEZ  , V
, V ZQUEZ-ODÉRIZ L, et al. Physicochemical evaluation of low-fat yoghurt produced with microbial transglutaminase[J]. Journal of the Science of Food and Agriculture, 2018, 98(14):5 479-5 485.
ZQUEZ-ODÉRIZ L, et al. Physicochemical evaluation of low-fat yoghurt produced with microbial transglutaminase[J]. Journal of the Science of Food and Agriculture, 2018, 98(14):5 479-5 485.
[6] 焦阜欣, 杨小雪, 尹涛, 等.转谷氨酰胺酶诱导的鱼糜凝胶及其体外消化[J].食品科技, 2017,42(2):142-148.
JIAO F X, YANG X X, YIN T, et al.The in vitro digestion of transglutaminase induced surimi gel[J].Food Science and Technology, 2017,42(2):142-148.
[7] ZHANG X W, WANG W H, WANG Y N, et al.Effects of nanofiber cellulose on functional properties of heat-induced chicken salt-soluble meat protein gel enhanced with microbial transglutaminase[J].Food Hydrocolloids, 2018, 84:1-8.
[8] CALVARRO J, PEREZ-PALACIOS T, RUIZ J.Modification of gelatin functionality for culinary applications by using transglutaminase[J].International Journal of Gastronomy and Food Science, 2016, 5-6:27-32.
[9] 徐雅琴. 鸡蛋白粉的凝胶性质改性研究[D].无锡:江南大学, 2005.
XU Y Q.Modification of gelling properties of egg white powder[D].Wuxi:Jiangnan University, 2005.
[10] ZANG X D, LIU P, CHEN Y, et al.Improved freeze-thaw stability of o/w emulsions prepared with soybean protein isolate modified by papain and transglutaminase[J].LWT, 2019, 104:195-201.
[11] ZHANG M K, WANG P, ZOU M, et al.Microbial transglutaminase-modified protein network and its importance in enhancing the quality of high-fiber tofu with okara[J].Food Chemistry, 2019, 289:169-176.
[12] LI C Q,XIONG Y L.Disruption of secondary structure by oxidative stress alters the cross-linking pattern of myosin by microbial transglutaminase[J].Meat Science, 2015, 108:97-105.
[13] 李明奇, 贺稚非, 李洪军.微生物源谷氨酰胺转胺酶修饰蛋白质机理及其在食品方面的应用进展[J].食品与发酵工业, 2018, 44(12):274-280.
LI M Q, HE Z F, LI H J.Catalytic mechanisms of microbial transglutaminase in modification of protein and its applications in food processing[J].Food and Fermentation Industries, 2018, 44(12):274-280.
[14] NOGUEIRA M H, TAVARES G M, NOGUEIRA SILVA N F, et al.Physico-chemical stability of casein micelles cross-linked by transglutaminase as a function of acidic pH[J].Food Structure-Netherlands, 2019, 19:100 103.
[15] GARC A-G
A-G MEZ B, V
MEZ B, V ZQUEZ-ODÉRIZ L, MU
ZQUEZ-ODÉRIZ L, MU OZ-FERREIRO N, et al.Rennet type and microbial transglutaminase in cheese:Effect on sensory properties[J].European Food Research and Technology, 2020, 246(3):513-526.
OZ-FERREIRO N, et al.Rennet type and microbial transglutaminase in cheese:Effect on sensory properties[J].European Food Research and Technology, 2020, 246(3):513-526.
[16] TOPCU A, BULAT T, ÖZER B.Process design for processed Kashar cheese (a pasta-filata cheese) by means of microbial transglutaminase:Effect on physical properties, yield and proteolysis[J].LWT, 2020, 125:109 226.
[17] ROMEIH E, WALKER G.Recent advances on microbial transglutaminase and dairy application[J].Trends in Food Science and Technology, 2017, 62:133-140.
[18] MAZUKNAITE I, GUYOT C, LESKAUSKAITE D, et al.Influence of transglutaminase on the physical and chemical properties of acid milk gel and cottage type cheese[J].Journal of Food Agriculture and Environment, 2013, 11(3-4):119-124.
[19] SEIGHALANI F Z B, BAKAR J, SAARI N, et al.Thermal and physicochemical properties of red tilapia (Oreochromis niloticus) surimi gel as affected by microbial transglutaminase[J].Animal Production Science, 2017, 57(5):993-1 000.
[20] RENZETTI S, DAL BELLO F, ARENDT E K.Microstructure, fundamental rheology and baking characteristics of batters and breads from different gluten-free flours treated with a microbial transglutaminase[J].Journal of Cereal Science, 2008, 48(1):33-45.
[21] GASPAR A L C, DE G ES-FAVONI S P.Action of microbial transglutaminase (MTGase) in the modification of food proteins:A review[J].Food Chemistry, 2015, 171:315-322.
ES-FAVONI S P.Action of microbial transglutaminase (MTGase) in the modification of food proteins:A review[J].Food Chemistry, 2015, 171:315-322.
[22] JIANG J, XIONG Y L.Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science, 2013, 93(3):469-476.
[23] 卞君杰. TG酶对蛋白乳化特性的影响及在肌原纤维蛋白复合凝胶中的作用[D].扬州:扬州大学, 2016.
BIAN J J.The effect of transglutaminase on protein emulsification and its role in myofibrin complex gel[D].Yangzhou:Yangzhou University, 2016.
[24] 杜洪振, 孙钦秀, 杨振, 等.转谷氨酰胺酶对鲤鱼肌原纤维蛋白乳化活性和凝胶特性的影响[J].食品工业科技, 2019, 40(6):126-130;278.
DU H Z, SUN Q X, YANG Z, et al.Effect of transglutaminase on the emulsifying activity index and gel properties of common carp myofibrillar protein[J].Science and Technology of Food Industry, 2019, 40(6):126-130;278.
[25] DAMODARAN S, AGYARE K K.Effect of microbial transglutaminase treatment on thermal stability and pH-solubility of heat-shocked whey protein isolate[J].Food Hydrocolloids, 2013, 30(1):12-18.
[26] 范丽丽, 窦博鑫, 张晓琳, 等.大豆7S球蛋白的MTGase条件对其表面疏水性与功能特性、溶液性质的影响及相关性分析[J].食品工业科技, 2020, 41(5):52-57;62.
FAN L L, DOU B X, ZHANG X L, et al.Effect of MTGase conditions on surface hydrophobicity, functional properties and solution properties of soybean 7S globulin and correlation analysis of its indexes[J].Science and Technology of Food Industry, 2020, 41(5):52-57;62.
[27] 程伟, 陈红兵, 高金燕, 等.酶改性对食物蛋白质过敏原性的影响[J].食品科学, 2010, 31(23):391-394.
CHENG W, CHEN H B, GAO J Y, et al.A review of the effect of enzymatic modification on the allergenicity of food proteins[J].Food Science, 2010, 31(23):391-394.
[28] XING G L, GIOSAFATTO C V L, RUI X, et al.Microbial transglutaminase-mediated polymerization in the presence of lactic acid bacteria affects antigenicity of soy protein component present in bio-tofu[J].Journal of Functional Foods, 2019, 53:292-298.
[29] FOTSCHKI J, WR BLEWSKA B, FOTSCHKI B, et al.Microbial transglutaminase alters the immunogenic potential and cross-reactivity of horse and cow milk proteins[J].Journal of Dairy Science, 2020, 103(3):2 153-2 166.
BLEWSKA B, FOTSCHKI B, et al.Microbial transglutaminase alters the immunogenic potential and cross-reactivity of horse and cow milk proteins[J].Journal of Dairy Science, 2020, 103(3):2 153-2 166.
[30] WANG Y B, NI S Q, WANG C, et al.Cross-linking of shrimp tropomyosin catalyzed by transglutaminase and tyrosinase produces hypoallergens for potential immunotherapy[J].Food Function, 2019, 10(3):1 609-1 618.
[31] ROMANO A, GIOSAFATTO C V L, DI PIERRO P, et al.Impact of transglutaminase treatment on properties and in vitro digestibility of white bean (Phaseolus vulgaris L.) flour[J].Food Research International, 2016, 88:239-246.
[32] LI Y, XIONG S B, YIN T, et al.The gastric digestion kinetics of silver carp (Hypophthalmichthys molitrix) surimi gels induced by transglutaminase[J].Food Chemistry, 2019, 283:148-154.
[33] FANG M X, XIONG S B, HU Y, et al.In vitro pepsin digestion of silver carp (Hypophthalmichthys molitrix) surimi gels after cross-linking by Microbial Transglutaminase (MTGase)[J].Food Hydrocolloids, 2019, 95:152-160.
[34] OGILVIE O, ROBERTS S, SUTTON K, et al.The use of microbial transglutaminase in a bread system:A study of gluten protein structure, deamidation state and protein digestion[J].Food Chemistry, 2021, 340:127 903.
[35] WEE M S M, JEYAKUMAR HENRY C.Effects of transglutaminase on the protein network and in vitro starch digestibility of Asian wheat noodles[J].Foods, 2019, 8(12):12.
[36] GLUSAC J, ISASCHAR-OVDAT S, FISHMAN A.Transglutaminase modifies the physical stability and digestibility of chickpea protein-stabilized oil-in-water emulsions[J].Food Chemistry, 2020, 315:126 301.
[37] TSEVDOU M, SOUKOULIS C, CAPPELLIN L, et al.Monitoring the effect of high pressure and transglutaminase treatment of milk on the evolution of flavour compounds during lactic acid fermentation using PTR-ToF-MS[J].Food Chemistry, 2013, 138(4):2 159-2 167.
[38] 邹晶. 超声-TG酶交联改性对小麦面筋蛋白及酵母协同酶解特性研究[D].广州:华南理工大学, 2018.
ZOU J.Effect of ultrasonic-glutamine transaminase modification on enzymatic hydrolysis characteristics of wheat gluten and yeast[D].Guangzhou:South China University of Technology, 2018.
[39] 张孝刚, 唐玲, 江霞, 等.酶法重组牛肉粒加工过程的风味变化[J].食品工业, 2013, 34(10):136-141.
ZHANG X G, TANG L, JIANG X, et al.Flavor changes during the processing of enzymatic recom binant beef granules[J].The Food Industry, 2013, 34(10):136-141.
[40] WANG J, ZOU L, YUAN F Z, et al.Inhibition of advanced glycation endproducts during fish sausage preparation by transglutaminase and chitosan oligosaccharides induced enzymatic glycosylation[J].Food Function, 2018, 9(1):253-262.
[41] CUI Q, WANG X B, WANG G R, et al.Effects of ultrasonic treatment on the gel properties of microbial transglutaminase crosslinked soy, whey and soy-whey proteins[J].Food Science and Biotechnology, 2019, 28(5):1 455-1 464.
[42] DING X Y, ZENG N, ZHANG G W, et al.Influence of transglutaminase-assisted ultrasound treatment on the structure and functional properties of soy protein isolate[J].Journal of Food Processing and Preservation, 2019, 43(11):e14 203.
[43] 秦新生. 物理预处理-TG酶交联复合改性对大豆与小麦蛋白凝胶性质的影响研究[D].合肥:合肥工业大学, 2017.
QIN X S.Studies on the mechanism, emulsifying application of physical pretreatment and transglutaminase-set soy protein isolate and wheat gluten mixture gelation[D].Hefei:Hefei University pf Technology, 2017.
[44] 尹艺霖. 超声辅助TG酶处理对鲢鱼肌原纤维蛋白凝胶特性影响及应用研究[D].长春: 吉林农业大学, 2019.
YIN Y L.Effect of ultrasound assisted TG enzyme treatment on gel properties of myofibrillar protein from silver carp and its application[D].Changchun: Jilin Agricultural University, 2019.
[45] QIN X S, CHEN S S, LI X J, et al.Gelation properties of transglutaminase-induced soy protein isolate and wheat gluten mixture with ultrahigh pressure pretreatment[J].Food and Bioprocess Technology, 2017, 10(5):866-874.
[46] CAO H W, JIAO X D, FAN D M, et al.Catalytic effect of transglutaminase mediated by myofibrillar protein crosslinking under microwave irradiation[J].Food Chemistry, 2019, 284:45-52.
[47] CHEN C C, HSIEH J F.Microwave-assisted cross-linking of milk proteins induced by microbial transglutaminase[J].Scientific Reports, 2016, 6:39 040.
[48] GUO B Y, ZHOU A M, LIU G, et al.Changes of physicochemical properties of greater lizardfish (Saurida tumbil) surimi gels treated with high pressure combined with microbial transglutaminase[J].Journal of Food Processing and Preservation, 2019, 43(10):e14 150.
[49] 王炳智. 高压与TG酶处理对小麦面筋蛋白的凝胶性影响研究[D].合肥:合肥工业大学, 2019.
WANG B Z.Effect of high pressure and MTGase treatment on gel properties of wheat gluten[D].Hefei:Hefei University of Technology, 2019.
[50] 白登荣. γ-聚谷氨酸复合TGase对鸡肉肌原纤维蛋白功能特性的影响及机理研究[D].重庆:西南大学, 2018.
BAI D R.Effects and mechanism of γ-polyglutamic acid combined with transglutaminase on the functional properties of chicken myofibrillar protein[D].Chongqing:Southwest university, 2018.
[51] ZHANG X W,WANG W H,WANG Y N, et al.Effects of nanofiber cellulose on functional properties of heat-induced chicken salt-soluble meat protein gel enhanced with microbial transglutaminase[J].Food Hydrocolloids, 2018, 84:1-8.