果蔬采后仍是活生命体,因其含水量高、保护组织差而易受机械损伤,属于易腐烂商品,加之流通环节冗长、冷藏链设施不普及,因而采后腐损率较高。随着我国农产品冷链、冷藏库体系建设不断完善,采用冷链物流结合低温贮藏技术可以有效降低采后果蔬的腐损率[1-3]。其中低温贮藏作为广泛使用的采后技术之一,是果蔬采后处理的关键环节[1]。适宜的低温在减缓果蔬新陈代谢速率、减少品质劣化等方面起着重要作用,可以有效延长果蔬等农产品的保质期、减少经济损失[1,4]。
然而,研究发现低温虽能显著延长果蔬的贮藏期,但当对冷敏感的果蔬在冷藏温度下贮藏和运输时会产生低温胁迫,导致机体发生氧化损伤,造成植物细胞生理功能紊乱从而导致冷害现象的发生,其症状包括严重的点蚀、凹陷、水分流失、花萼变黑、局部区域浸水和腐烂等[5-8],冷害现象通常在果蔬从低温环境转移到室温环境一定时间后才会表现出来,这严重影响到果蔬的食用品质和商业价值[9]。研究发现,冷害现象是冷敏果蔬在低温贮藏期间遭受低温胁迫后产生严重细胞生理紊乱的外在表现,而低温胁迫通常主要引起植物机体氧化损伤[10]。
热处理是一种无毒、安全有效的可以控制采后生理紊乱,保持园艺作物质量的采后贮前预处理物理手段,热处理的应用被国内外学者认为是降低采后果蔬低温贮藏期间冷害发生的有效技术[11-15]。ENDO 等[8]和SUZUKI等[16]的研究表明,植物经过适当的热处理后产生耐热性的能力是通过增强其细胞机制介导的,该机制可防止植物在热胁迫下的氧化损伤;轻度的热应激会激活植物细胞中的信号传导途径,使植物细胞中抗氧化酶的稳态转录水平因轻度热应激而升高,在植物机体中引起抗氧化反应,并且在进入冷胁迫环境时该抗逆机制仍然起作用。因此,贮前热处理可以促使果蔬等园艺作物更加适应低温贮藏环境[11,17]。
本文概括了热处理对采后冷藏果蔬机体中活性氧(reactive oxygen species,ROS)清除系统的主要作用,综述了国内外学者关于热处理对采后果蔬低温贮藏期间ROS清除系统影响的研究进展,旨在为贮前热处理技术减轻采后果蔬低温贮藏期间氧化损伤、冷害现象的更深入研究提供理论依据。
1 采后果蔬低温贮藏期间活性氧清除系统变化
果蔬采后仍在进行新陈代谢等生命活动,代谢过程中不可避免的伴随着ROS的产生,包括超氧阴离子自由基![]() 羟自由基(·OH) 以及过氧化氢(H2O2)等,ROS自由基被国内外学者认为是一类会损伤植物机体中生物膜脂成分和蛋白质成分的毒性物质,进而引起植物细胞内膜脂过氧化、蛋白质变性损伤等反应,加速机体的衰老和死亡[4,8,12,18]。为应对这一不良变化,果蔬等高等植物在长期进化过程中在体内形成了复杂的ROS清除系统,能够消除ROS及氧化产生的有毒产物,使ROS自由基的产生与消除处于动态平衡,保护植物免受ROS的有害影响,在果实后熟衰老和对抗不良环境胁迫过程中有着极为重要的作用[18]。但由于果蔬等植物的生命活动极易受环境影响的特性,当对低温敏感的果蔬在较低的温度下(1~10 ℃)贮藏时会产生低温胁迫,低温胁迫会破坏果蔬机体中ROS的产生与抗氧化防御机制之间的平衡而造成氧化损伤[19],果蔬机体的细胞活动会受到扰乱,导致一系列生理变化,从而造成冷害现象的发生并最终导致暴露于低温的果蔬品质劣变乃至机体死亡[4],当ROS自由基的降解程度小于其产生程度时会造成ROS的积累,从而引起果蔬机体中细胞膜脂成分的氧化损伤和组织衰老,产生有毒的氧化产物,如多不饱和脂肪酸氧化的次级终产物丙二醛,其含量通常是植物受到氧化胁迫程度的指标[18,20]。因此在果蔬低温贮藏期间,维持其ROS的形成和消除之间的平衡至关重要。
羟自由基(·OH) 以及过氧化氢(H2O2)等,ROS自由基被国内外学者认为是一类会损伤植物机体中生物膜脂成分和蛋白质成分的毒性物质,进而引起植物细胞内膜脂过氧化、蛋白质变性损伤等反应,加速机体的衰老和死亡[4,8,12,18]。为应对这一不良变化,果蔬等高等植物在长期进化过程中在体内形成了复杂的ROS清除系统,能够消除ROS及氧化产生的有毒产物,使ROS自由基的产生与消除处于动态平衡,保护植物免受ROS的有害影响,在果实后熟衰老和对抗不良环境胁迫过程中有着极为重要的作用[18]。但由于果蔬等植物的生命活动极易受环境影响的特性,当对低温敏感的果蔬在较低的温度下(1~10 ℃)贮藏时会产生低温胁迫,低温胁迫会破坏果蔬机体中ROS的产生与抗氧化防御机制之间的平衡而造成氧化损伤[19],果蔬机体的细胞活动会受到扰乱,导致一系列生理变化,从而造成冷害现象的发生并最终导致暴露于低温的果蔬品质劣变乃至机体死亡[4],当ROS自由基的降解程度小于其产生程度时会造成ROS的积累,从而引起果蔬机体中细胞膜脂成分的氧化损伤和组织衰老,产生有毒的氧化产物,如多不饱和脂肪酸氧化的次级终产物丙二醛,其含量通常是植物受到氧化胁迫程度的指标[18,20]。因此在果蔬低温贮藏期间,维持其ROS的形成和消除之间的平衡至关重要。
HODGES等[19]、MITTLER[21]、王馨等[22]及王思奇[23]国内外学者研究发现植物机体抗氧化系统受环境调控显著,必要时适当施加胁迫可使植物机体氧化还原状态稳定。SHAROM 等[24]、SALTVEIT[25]学者认为低温贮藏虽能有效降低番茄等果蔬代谢水平、抑制ROS的产生从而延长贮藏期,但在低温贮藏期间,环境温度的大幅降低会使果蔬机体内的抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、还原性谷胱甘肽(glutathione,GSH) 及抗坏血酸(ascorbic acid,AsA)等物质的活性受到抑制从而导致果蔬活性氧清除能力减弱,使果蔬机体仍遭受氧化损伤且会产生冷害现象导致果实商业价值降低。为解决这一约束低温贮藏效果的现象,解越[26]、朱赛赛等[27]、李春晖等[28]及邵婷婷等[12]发现引入贮前热处理技术可有效上调低温贮藏期间青椒[12]、黄瓜[26]、西葫芦[27-28]等果实的抗氧化酶如CAT、SOD及APX等的活力,减少冷害的发生。果蔬低温贮藏过程中涉及到的ROS酶促清除系统主要包括:CAT、APX、SOD、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)、谷胱甘肽还原酶(glutathione reductase,GR)以及过氧化物酶(peroxidase,POD)等[29];果蔬低温贮藏过程中ROS非酶促清除系统主要包括GSH、AsA、脱氢抗坏血酸(dehydroascorbic acid,DHA)、单脱氢抗坏血酸(monodehydroascorbic acid,MDHA)等[18]。活性氧酶促与非酶促清除系统相互协调合作,维持着果蔬机体内部氧化-还原水平的动态平衡,保持了机体的正常生命活动[30]。如图1所示,SOD是植物细胞中直接清除超氧阴离子自由基的第一道防线,与POD、CAT以及APX等协同构成了植物机体活性氧清除系统的基础防线;其他抗氧化酶如GR、MDHAR和DHAR等与重要还原性物质AsA和GSH一起构成GSH-AsA循环,该循环在清除H2O2过程中起着重要作用[21,31-32]。
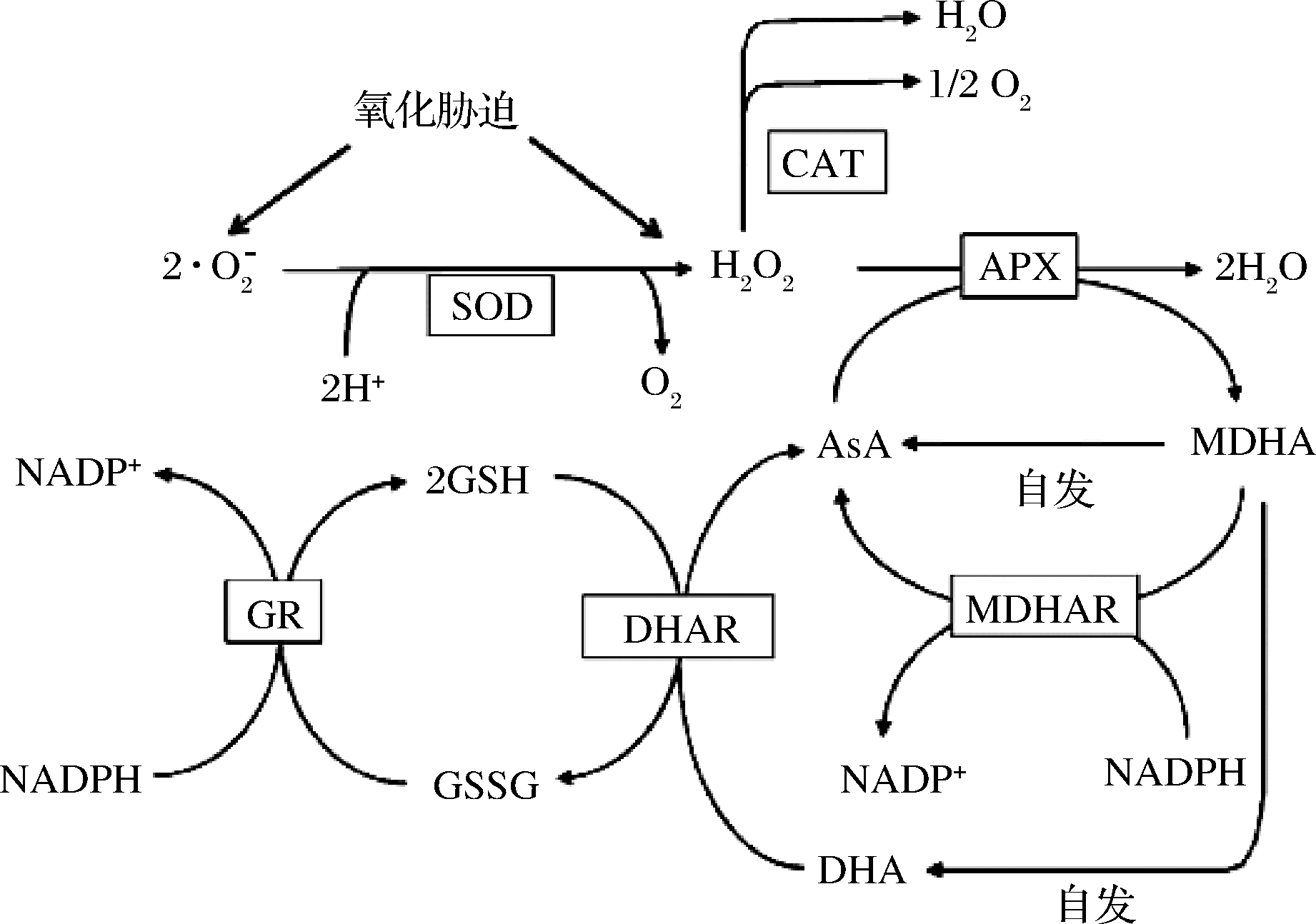
APX-抗坏血酸过氧化物酶;AsA-抗坏血酸;CAT-过氧化氢酶; MDHA-单脱氢抗坏血酸;MDHAR-单脱氢抗坏血酸还原酶; DHA-脱氢抗坏血酸(氧化型抗坏血酸);DHAR-脱氢抗坏血酸还原酶; GR-谷胱甘肽还原酶;GSH-谷胱甘肽;GSSG-氧化型谷胱甘肽; SOD-超氧化物歧化酶
图1 采后果蔬的主要活性氧清除系统[21,31]
Fig.1 The main active oxygen scavenging system in postharvest fruit and vegetables
2 热处理提高采后果蔬低温贮藏期间主要抗 氧化酶活性
果蔬等植物中主要的活性氧直接酶促清除机制由SOD、CAT、APX和POD等构成。SOD是植物体抵抗氧化胁迫的第一道防线,既能将 ![]() 歧化为O2和 H2O2,又能阻止
歧化为O2和 H2O2,又能阻止![]() 将 Fe3+重新还原成 Fe2+ 形成毒性更强的·OH,以消除超氧阴离子自由基对细胞的损伤,在细胞的活性氧清除机制中可能起主要作用。SOD 是一种被诱导酶,其水平会随着ROS自由基含量升高而上升[18,22]。APX与 CAT 是植物体内清除 H2O2 的主要酶类,两者协同作用将 H2O2 转化为 H2O 和 O2,进一步起到细胞解毒的作用。POD是普遍存在于高等植物中的酶,其具有多种生化功能,参与植物对冷、热等胁迫的反应[29],POD也催化H2O2的分解,但是POD的作用方式与CAT和APX不同,POD催化H2O2分解的同时会释放具有植物毒性的自由基而不是氧[33]。
将 Fe3+重新还原成 Fe2+ 形成毒性更强的·OH,以消除超氧阴离子自由基对细胞的损伤,在细胞的活性氧清除机制中可能起主要作用。SOD 是一种被诱导酶,其水平会随着ROS自由基含量升高而上升[18,22]。APX与 CAT 是植物体内清除 H2O2 的主要酶类,两者协同作用将 H2O2 转化为 H2O 和 O2,进一步起到细胞解毒的作用。POD是普遍存在于高等植物中的酶,其具有多种生化功能,参与植物对冷、热等胁迫的反应[29],POD也催化H2O2的分解,但是POD的作用方式与CAT和APX不同,POD催化H2O2分解的同时会释放具有植物毒性的自由基而不是氧[33]。
SOD广泛存在于叶绿体、线粒体、细胞质等多个部位,其辅基分别含有3种不同金属离子(Cu-Zn,Fe 或 Mn),是植物体内活性氧自由基清除体系的重要酶之一,能专一地清除超氧阴离子自由基,去除单线态氧,防止·OH的形成,SOD活性的高低在一定程度上能反映果实受到氧化损伤及衰老的程度[18,33-34]。陈楚英等[34]将新余蜜橘进行37 ℃、36 h 热空气处理后发现与对照相比,贮藏期间果实SOD 活性整体提高且SOD活性高峰延后出现。SHADMANI等[5]认为42 ℃、30 min 和 49 ℃、20 min的热水处理诱导了番木瓜在6 ℃低温贮藏下的抗冷性,其表现在SOD等抗氧化酶活性的提高。SHAO等[35]发现经过38 ℃热空气处理36 h的枇杷果实在4 ℃冷藏中的耐冷性得以增强,主要原因是提升了枇杷果实低温贮藏期间SOD和GR等的活性,减少了枇杷果实内部的氧化变质。李君兰等[36]将鲜枣经过45 ℃、2 h 热空气处理后再低温贮藏,结果发现低温贮藏前期显著增强了鲜枣 CAT 和 SOD 活性,延迟了SOD 活性高峰的出现并在低温贮藏中后期保持SOD的活性。赵昱瑄等[37]将黄瓜经39.4 ℃ 热水处理24.4 min后发现显著抑制了低温贮藏期间SOD 活性的下降,同时也抑制了![]() 的生成速率。类似地,热处理也提高了黄瓜[38]、西葫芦[27]等果实低温贮藏期间的SOD活性,减轻了果实在低温贮藏中遭受低温胁迫的程度。
的生成速率。类似地,热处理也提高了黄瓜[38]、西葫芦[27]等果实低温贮藏期间的SOD活性,减轻了果实在低温贮藏中遭受低温胁迫的程度。
CAT是果蔬中活性氧清除系统的主要酶之一,当果蔬机体受到氧化胁迫产生氧化应激反应时被激活。SEVILLANO等[39]使用基因改造策略对转基因番茄进行的分析证实了CAT同工型酶是抗氧化系统响应氧化应激而触发的关键元素。环境胁迫既能导致CAT活性的增强也能导致其减弱,这取决于胁迫的强度、持续时间和类型,当低温贮藏时的冷胁迫抑制CAT活性时,提供适当热胁迫的贮前热处理可能帮助植物细胞抵抗这一过程[29,40]。NASEF[41]对黄瓜进行55 ℃,5 min的短时热处理后再低温贮藏,结果发现低温贮藏期间该处理后黄瓜果实的CAT活性和抗冷性高于对照组。ZHANG等[42]研究发现,对西兰花进行热激处理后提高了其CAT 和其他抗氧化酶的活性,同时抑制了低温贮藏期间H2O2含量的增加。邵婷婷等[12]将青椒果实经过44 ℃热水处理12 min后进入4 ℃贮藏,结果发现青椒果实的冷害指数和失重率得以降低,可能是由于热处理激发了青椒果实中的CAT活性,从而提高了低温贮藏期间青椒果实清除ROS自由基的能力。WANG等[43]将香蕉果实进行52 ℃,3 min的热水处理,有效地减弱了香蕉在7 ℃ 贮藏下的冷害症状,并在低温贮藏期间维持了较高的 CAT活性。类似地,热处理诱导果蔬低温贮藏期间CAT活性的保持和增强、同时减轻低温贮藏期间冷害并抑制H2O2含量增加的现象在甜椒[8]、西葫芦[27,33]、黄瓜[37]和鲜枣[36]等果实中也有发现。
APX是分布于叶绿体、线粒体、微体和胞浆的植物细胞中分解H2O2的关键酶。APX利用2个抗坏血酸分子将H2O2还原成水,同时产生MDHA(图1),与SOD和CAT协同清除机体内的ROS,延缓和抑止植物细胞过氧化作用[22,31]。当植物暴露于各种环境胁迫中时,植物抵抗氧化胁迫的机制开始启动,如温度应激通常激活细胞信号传导途径和细胞反应,随后产生APX等氧自由基清除剂[44]。ENDO等[8]采用45 ℃热水处理甜椒15 min后再将其放入6 ℃冷藏,诱导了甜椒的耐寒性,显著提高了低温贮藏期间甜椒中APX活性并同时延缓了AsA含量的降低。WANG等[45]研究者发现,52 ℃热处理3 min后在 20 ℃放置1.5~6 h 的香蕉果实中APX活性和其基因的表达显著增强,放置后进入7 ℃低温贮藏时,香蕉果实APX 的基因表达也始终高于对照,这表明热激处理显著上调了香蕉果实细胞中抗氧化酶的稳态转录水平。赵昱瑄等[37] 在研究热处理对黄瓜果实不同部位活性氧代谢的影响时,发现热处理显著抑制了低温贮藏期间黄瓜尾部APX活性的下降。类似地,热处理诱导果蔬低温贮藏期间APX活性增强并延缓AsA水平下降的现象在香蕉[43]和番茄[29]等果实中也有表现。
POD广泛分布于植物界,除参与H2O2的清除过程外也参与如伤口愈合和木质化等生理过程[41],此外,早有BURRIS [46] 和WANG [33]研究发现 POD在分解过氧化氢的同时会产生新的自由基,因此国内外研究者对于POD活性怎样反映植物体内氧化损伤状态尚无定论。VICENTE等[47]研究者认为较高的POD活性反映了植物组织较高的损伤进程,而较低的POD活性表明组织的损伤较小;与此相一致的是WANG [33]早期发现热处理提高H2O2的消除程度的同时降低了西葫芦的POD活性,同样的,NASEF[41]发现在冷藏和模拟货架期期间,55 ℃短时热处理提高黄瓜耐冷性的同时其POD活性也低于对照组,且冷藏期间黄瓜中POD活性与冷害和电解质外渗率的发展呈正相关。而其他研究者持另一观点,DOORN 等[48]、IMAHORI等[29]认为 POD与防御非生物和生物胁迫有关,并且在胁迫条件下其作为有效的过氧自由基淬灭剂的角色占主导地位,因此环境的各种压力条件会导致植物体内POD活性的增加,BASSAL等[49]通过热水预处理提高了橙果低温贮藏过程中POD和CAT的活性,减少了低温贮藏过程中橙果实的冷害,朱赛赛等[27]国内学者通过热水处理诱导了西葫芦果实低温贮藏期间的抗冷性,其POD 活性在贮藏后期大幅度提升,使15 d 贮藏结束时,35 ℃ 热水处理 10 min 西葫芦的冷害程度明显低于对照。总之,国内外研究学者关于热处理对采后果蔬低温贮藏期间过氧化物酶活性趋势影响的研究结论并不完全一致,仍在探索过程中。
3 热处理维持采后果蔬低温贮藏期间AsA- GSH循环
植物体内的活性氧清除剂除几个关键的抗氧化酶外,还原物质如AsA和GSH以及维持它们生成水平的相关酶类(如MDHAR、DHAR、GR等)所构成的AsA -GSH循环在植物活性氧清除系统中也起着至关重要的作用[8,31]。AsA -GSH循环是果蔬等植物体内清除活性氧的重要途径,这一途径存在于植物细胞的多种细胞器中, 例如细胞质、叶绿体、线粒体等。AsA是果蔬机体中重要的抗氧化剂,具有强的还原性,在APX催化H2O2分解的过程中作为还原剂易被氧化成MDHA,但AsA与MDHA的转换是可逆的(图1)。MDHA还原生成AsA有3条路径:(1)可自发还原生成AsA;(2)可在MDHAR的催化下再生为AsA;(3)可自发氧化脱氢生成DHA,DHA可进一步在DHAR的催化下还原为AsA [21,31]。DHA具有强的氧化性,当植物细胞中DHA含量过高时会破坏细胞的氧化还原平衡,对植物机体造成氧化损伤[21]。DHAR是植物体内一种重要的抗氧化酶,也是植物AsA-GSH循环中能够促进AsA再生的关键酶,它可以催化DHA还原为AsA,从而保持细胞内AsA的动态平衡[50-51]。但同时DHAR易使GSH催化氧化为GSSG,GSSG含量过高时会破坏植物细胞氧化还原平衡,因此作为植物中AsA-GSH循环重要成员的GR就显得同样关键,GR是一种黄素酶,在植物机体许多组织都有分布,可催化GSSG还原为GSH从而维持植物细胞内充足的GSH水平[8,52]。
AsA作为果实重要的贮藏与营养品质的同时也是果蔬体内活性氧清除系统中的重要抗氧化物质。环境胁迫中低温或高温胁迫都可能会激活AsA的生物合成基因以及维持AsA合成前体物质的含量,这表明人为施加适当的温度胁迫时(如贮前热处理和低温贮藏)可能有助于植物体内AsA的生物合成[53-54]。IMAHORI等[29]的研究结果表明,与对照相比,52 ℃,15 min的热水处理明显提高了番茄果实中AsA的含量。马雪梅等[55]发现,经35~45 ℃ 热水处理10 min左右的草莓果实中AsA含量高于对照组,且在贮藏过程中维持了较高的AsA水平。李君兰等[36]在探究热空气处理对鲜枣的影响时发现45 ℃、2 h的热空气处理能保持鲜枣中AsA和TA的含量。马素娟[56]采用47 ℃,3 h的热空气处理,保持了杨梅果实较高的AsA含量,减少了果实重量损失。赵云峰等[54]通过50 ℃热水处理龙眼果实10 min后再低温贮藏,发现龙眼果肉AsA 含量高于对照,且在低温贮藏第4天和第8天达到显著水平,作者分析原因认为可能是热处理维持了较高水平的AsA合成前体物质,从而保持了低温贮藏期间龙眼果肉的抗氧化能力。类似地,在关于蜜橘[34]、火龙果[57]等果蔬热处理的研究中也发现了热处理诱导果蔬体内AsA含量的提高和维持。
MDHAR和DHAR是植物体中的AsA -GSH循环的重要组成部分,该循环是植物中ROS清除系统关键的一环。当AsA在植物组织中被氧化时会生成MDHA,MDHA会自发的进一步脱氢生成DHA,而MDHAR和DHAR作用便是分别负责直接从MDHA和DHA再生AsA。当植物在低温贮藏过程中遭受低温胁迫时会产生H2O2,H2O2作为ROS物质,其升高的信号会激活植物细胞信号传导系统,从而刺激MDHAR和DHAR活性的增加[8,58]。据SHIGENAGA等[59]报道热处理带来的适当热胁迫使果实产生了较高H2O2从而诱导了花椰菜中MDHAR和DHAR的激活;同样地,ENDO等[8]的研究发现热水处理后低温贮藏的甜椒果实中H2O2的含量短暂增加以及MDHAR和DHAR活性的增强。WANG等[60]在热空气处理桃果实时发现了MDHAR和DHAR转录水平短暂且急剧的上调,而这些影响被认为与热处理时较高的H2O2浓度有关,H2O2作为信号和基因表达的调节剂具有反应性,可增强应激反应和防御途径,因此,MDHAR和DHAR的较高活性对直接减少H2O2的积累也起着重要作用[60]。
GSH是由谷氨酸、半胱氨酸及甘氨酸组成的一种三肽,是一种重要的生物功能因子,它广泛分布于植物机体内,具有抗氧化、清除自由基的作用,在维持细胞生理功能方面起着重要的作用。GSH作为植物体活性氧清除系统中十分重要的非酶类抗氧化剂,是组成GSH- AsA循环的关键部分,其含量能直接指示果蔬抵抗活性氧有害影响的能力[61]。陈楚英等[34]研究 37 ℃、36 h 热空气处理对新余蜜橘采后活性氧代谢的影响时发现热处理维持了低温贮藏期间蜜橘果实较高的GSH含量。邵婷婷等[61]采用50 ℃强制对流热空气对青椒果实进行20 min的处理,发现能够推迟低温贮藏期间青椒果实的冷害发生时间以及保持其较高水平的GSH的含量,从而维持青椒果实AsA-GSH循环的动态平衡以提高其低温贮藏期间的活性氧清除能力。姜雪等[62]研究发现初始温度为25 ℃的西葫芦果实经43.3 ℃、28.4 min的热水处理后保持了GSH的高含量,维持了低温贮藏期间西葫芦果实的活性氧清除能力。
GR是生物体内氧化还原体系中最重要的酶之一,是维持细胞中GSH含量的关键酶。当GSH发生氧化生成GSSH时,GR在NADPH参与下可将GSSH转化为GSH,后者是维持细胞和组织氧化还原稳态的重要非酶类抗氧化物质[32],GR和GSH都是维持植物体活性氧清除系统中AsA -GSH循环必不可缺的重要物质。张腾国等[63]在研究逆境胁迫对油菜GR活性及其基因表达的影响时发现GR1和GR2基因的转录以及GR活性均受到低温和高温等环境胁迫的诱导,表明油菜GR在抵御低温和高温等环境胁迫过程中发挥着重要作用。GILL等[64]研究发现GR与植物的抗逆性有着密切联系,条件胁迫能诱导GR基因的表达, 诱导植物机体中GR活性的增加,从而维持植物机体抵御氧化损伤的能力。
4 总结与展望
果蔬采后仍在进行新陈代谢等生命活动,代谢过程中会伴随ROS的产生,而当环境条件改变时,果蔬的细胞活动也受到影响。低温贮藏是广泛应用的果蔬等园艺产品采后贮藏手段,可以有效地延长果蔬的贮藏期,但对低温敏感的果蔬在较低的温度下贮藏时不可避免的会产生低温胁迫,低温胁迫会破坏果蔬机体中ROS的产生与消除之间的平衡,导致ROS的积累从而导致果蔬机体的衰老与死亡。果蔬体内自身存在着抵抗氧化应激的ROS清除系统,由SOD、CAT、POD、APX以及AsA -GSH循环等构成。适度的热应激会激活植物细胞中的信号传导途径,并在植物中促进ROS清除系统,使果蔬在进入冷胁迫环境时仍处于高度防御氧化损伤的状态,因此贮前热水处理可以促使果蔬等园艺作物更加适应低温贮藏环境。
目前关于热处理调控果蔬ROS清除系统的研究只是从宏观上分析了低温贮藏期间果蔬机体抗氧化酶及抗氧化物质在不同热处理条件下含量的变化趋势,而对于热处理后果蔬细胞中的ROS信号传导途径、抗氧化酶的基因表达与转录水平变化等还研究较少。因此,需要进一步研究热处理如何增强采后果蔬细胞中的信号传导途径,以及活性氧信号分子对抗氧化酶基因表达的影响,为果蔬贮前热处理技术的应用提供更深入的理论依据。
[1] 杨杰, 王灵玲, 鲁雨轩.我国果蔬产业冷链物流运输研究[J].粮食科技与经济, 2020, 45(4):75-76.
YANG J, WANG L L, LU Y X.Research on cold chain logistics transportation of fruit and vegetable industry in my country[J].Grain Science and Technology and Economy, 2020, 45(4):75-76.
[2] 金珏雯, 穆月英, 韩一军, 等.中国特色农产品国际竞争力分析[J].农业展望, 2020, 16(4):127-134.
JIN J W, MU Y Y, HAN Y J, et al.Analysis of international competitiveness of agricultural products with Chinese characteristics[J].Agricultural Outlook, 2020, 16(4):127-134.
[3] 常丽娜, 韩星.我国果蔬冷链物流建设现状及发展建议[J].中国果菜, 2015, 35(2):5-10.
CHANG L N, HAN X.Present situation and suggestions of cold chain logistics of fruits and vegetables in China[J].China Fruit & Vegetable, 2015, 35(2):5-10.
[4] BOKHARY S U F, WANG L, ZHENG Y, et al.Pre-storage hot water treatment enhances chilling tolerance of zucchini (Cucurbita pepo L.) squash by regulating arginine metabolism[J].Postharvest Biology and Technology, 2020, 166:111 229.
[5] SHADMANI N, AHMAD S H, SAARI N,et al.Chilling injury incidence and antioxidant enzyme activities of Carica papaya L.‘Frangi’ as influenced by postharvest hot water treatment and storage temperature[J].Postharvest Biology and Technology, 2015, 99:114-119.
[6] HUAN C, HAN S, JIANG L, et al.Postharvest hot air and hot water treatments affect the antioxidant system in peach fruit during refrigerated storage[J].Postharvest Biology and Technology, 2017, 126:1-14.
[7] CARVAJAL F, PALMA F, JAMILENA M, et al.Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J].Postharvest Biology and Technology, 2015, 108:68-77.
[8] ENDO H, MIYAZAKI K, OSE K, et al.Hot water treatment to alleviate chilling injury and enhance ascorbate-glutathione cycle in sweet pepper fruit during postharvest cold storage[J].Scientia Horticulturae, 2019, 257:108 715.
[9] 郝佳诗, 王愈, 尹建云, 等.短波紫外线结合热处理对黄瓜冷害及抗氧化代谢的影响[J].浙江农林大学学报, 2018, 35(3):476-482.
HAO J S, WANG Y, YIN J Y, et al.Chilling injury and antioxidative metabolism in cucumber with combined UV-C and heat treatment[J].Journal of Zhejiang A&F University, 2018, 35(3):476-482.
[10] 张敏, 解越.采后果蔬低温贮藏冷害研究进展[J].食品与生物技术学报, 2016, 35(1):1-11.
ZHANG M, XIE Y.Research progress of chilling injury on post-harvest fruits and vegetables stored at low temperature[J].Journal of Food Science and Biotechnology, 2016, 35(1):1-11.
[11] LURIE S.Postharvest heat treatments[J].Postharvest Biology and Technology, 1998, 14:257-269.
[12] 邵婷婷, 张敏, 刘威.采后热水处理对青椒果实低温贮藏期间活性氧代谢及抗氧化物质的影响[J].食品与发酵工业, 2019,45(12):133-139.
SHAO T T, ZHANG M, LIU W.Effects of postharvest hot water treatment on active oxygen metabolism and antioxidative substances in green peppers during low temperature storage[J].Food and Fermentation Industries, 2019,45(12):133-139.
[13] ZHANG M, LIU W, LI C, et al.Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage[J].Scientia Horticulturae, 2019, 249:219-227.
[14] ENDO H, OSE K, BAI J, et al.Effect of hot water treatment on chilling injury incidence and antioxidative responses of mature green mume (Prunus mume) fruit during low temperature storage[J].Scientia Horticulturae, 2019, 246:550-556.
[15] AGHDAM M S, SEVILLANO L, FLORES F B, et al.Heat shock proteins as biochemical markers for postharvest chilling stress in fruits and vegetables[J].Scientia Horticulturae, 2013, 160:54-64.
[16] SUZUKI N, MITTLER R.Reactive oxygen species and temperature stresses:A delicate balance between signaling and destruction[J].Journal of Plant Physiology, 2006, 126:45-51.
[17] LURIE S, PEDRESCHI R.Fundamental aspects of postharvest heat treatments[J].Horticulture Research, 2014, 1:14 030.
[18] 王静, 孙广宇, 姬俏俏, 等.活性氧在果蔬采后衰老过程中的作用及其控制[J].包装与食品机械, 2015, 33(5):51-54;58.
WANG J, SUN G Y, JI Q Q, et al.The role of active oxygen in harvested fruits and vegetables during senescence and its control[J].Packaging and Food Machinery, 2015, 33(5):51-54;58.
[19] HODGES D M, LESTER G E, MUNRO K D, et al.Oxidative stress:Importance for postharvest quality[J].HortScience, 2004, 39:924-929.
[20] IMAHORI Y, TAKEMURA M, BAI J.Chilling-induced oxidative stress and antioxidant responses in mume (Prunus mume) fruit during low temperature storage[J].Postharvest Biology and Technology,2008, 49:54-60.
[21] MITTLER R.Oxidative stress, antioxidants and stress tolerance[J].Trends in Plant Science, 2002, 7:405-410.
[22] 王馨, 胡文忠, 陈晨, 等.活性氧在果蔬采后成熟衰老过程中的作用及几种气体处理对其影响的研究进展[J].食品工业科技, 2017, 38(5):375-379.
WANG X, HU W Z, CHEN C, et al.The role of reactive oxygen in harvested fruits and vegetables during maturation and senescence and the influences which handled by several gas treatments[J].Science and Technology of Food Industry, 2017, 38(5):375-379.
[23] 王思奇. 抗氧化系统调控甘薯贮藏特性的机制研究[D].合肥:合肥工业大学, 2019.
WANG S Q.Study on the mechanism of antioxidant system regulating the storage characteristics of sweet potato[D].Hefei:Hefei University of Technology, 2019.
[24] SHAROM M, WILLEMOT C, THOMPSON J E, et al.Chilling injury induces lipid phase changes in membranes of tomato fruit[J].Journal of Plant Physiology, 1994, 105:305-308.
[25] SALTVEIT M E.Chilling injury is reduced in cucumber and rice seedlings and in tomato pericarp discs by heat-shocks applied after chilling[J].Postharvest Biology and Technology, 2001, 21(2):169-177.
[26] 解越. 低温逆境下冷敏果实组织冷损伤及半致死温度的研究[D].上海:上海海洋大学, 2016.
XIE Y.Study on cold damage and semi-lethal temperature of cold sensitive fruit tissues under low temperature adversity[D].Shanghai:Shanghai Ocean University, 2016.
[27] 朱赛赛, 张敏, 艾文婷, 等.热水处理诱导西葫芦采后低温逆境抗冷性研究[J].食品工业科技, 2017, 38(7):325-330;339.
ZHU S S, ZHANG M, AI W T, et al.Study on hot water treatments for inducing cold tolerance of postharvest Cucurbita pepo L.during low temperature stress[J].Science and Technology of Food Industry, 2017, 38(7):325-330;339.
[28] 李春晖, 张敏, 艾文婷.不同温度场响应对西葫芦采后贮藏品质的影响[J].食品工业科技, 2018, 2:272-277.
LI C H, ZHANG M, AI W T.Effects of different temperature field responses on postharvest storage quality of Cucurbita pepo L.[J].Science and Technology of Food Industry, 2018, 2:272-277.
[29] IMAHORI Y, BAI J, BALDWIN E.Antioxidative responses of ripe tomato fruit to postharvest chilling and heating treatments[J].Scientia Horticulturae, 2016, 198:398-406.
[30] 高惠滢, 胡薇.生物体的抗氧化酶系统概述[J].生物学教学, 2018, 43(10):3-5.
GAO H Y, HU W.An overview of the antioxidant enzyme system in organisms[J].Biology Teaching, 2018, 43(10):3-5.
[31] ZUSHI K, MATSUZOE N, KITANO M.Developmental and tissue-specific changes in oxidative parameters and antioxidant systems in tomato fruits grown under salt stress[J].Scientia Horticulturae, 2009, 122(3):362-368.
[32] 马杰, 胡文忠, 毕阳, 等.鲜切果蔬活性氧产生和抗氧化体系代谢的研究进展[J].食品科学, 2013, 34(7):316-320.
MA J, HU W Z, BI Y, et al.Advances in active oxygen generation and antioxidant system of fresh-cut fruits and vegetables[J].Food Science, 2013, 34(7):316-320.
[33] WANG C Y.Effect of temperature preconditioning on catalase, peroxidase, and superoxide dismutase in chilled zucchini squash[J].Postharvest Biology and Technology:1995:67-76.
[34] 陈楚英, 周梦娇, 韩舒睿, 等.热空气处理对冷藏新余蜜橘活性氧代谢的影响[J].江西农业大学学报, 2014, 36(3):507-513.
CHEN C Y, ZHOU M J, HAN S R, et al.Effect of hot air flowing on reactive oxygen metabolism of Xinyu tangerine during cold storage[J].Acta Agriculturae Universitatis Jiangxiensis, 2014, 36(3):507-513.
[35] SHAO X, TU K.Hot air treatment improved the chilling resistance of loquat fruit under cold storage[J].Journal of Food Processing and Preservation, 2014, 38(2):694-703.
[36] 李君兰, 马勇, 康慧仁, 等.热空气处理对冷藏鲜枣衰老软化及相关酶活性的影响[J].现代食品科技, 2017, 33(3):237-243;236.
LI J L, MA Y, KANG H R, et al.Effects of hot-air treatment on the senescence and softening of fresh jujube fruits during cold storage[J].Modern Food Science and Technology, 2017, 33(3):237-243;236.
[37] 赵昱瑄, 张敏, 姜雪.短时热处理对低温逆境下黄瓜不同部位的冷害及活性代谢影响[J].食品与发酵工业, 2020, 46(7):180-187.
ZHAO Y X, ZHANG M, JIANG X.Effects of short time heat treatment on chilling injury and reactive oxygen metabolism in different parts of cucumber under low temperature[J].Food and Fermentation Industries, 2020, 46(7):180-187.
[38] 侯建设, 席玲芳, 李中华, 等.贮前热处理对2 ℃贮藏黄瓜抗冷性和自由基生物学的影响[J].食品与发酵工业, 2004, 33(5):138-142.
HOU J S, XI L F, LI Z H, et al.Effect of heat treatment before storage on cold resistance and free radical biology of cucumber stored at 2 ℃[J].Food and Fermentation Industries, 2004, 33(5):138-142.
[39] SEVILLANO L, SANCHEZ-BALLESTA M T, ROMOJARO F, et al.Physiological,hormonal and molecular mechanisms regulating vhilling injury in horticultural species.Postharvest technologies applied to rduce its impact.[J].Journal of the Science of Food and Agriculture, 2009, 89:555-573.
[40] SHARMA P, DUBEY R S.Drought induces oxidative stress and enhances the activities of antioxidant enzymes in growing rice seedlings[J].Plant Growth Regul, 2005, 46:209-221.
[41] NASEF I N.Short hot water as safe treatment induces chilling tolerance and antioxidant enzymes, prevents decay and maintains quality of cold-stored cucumbers[J].Postharvest Biology and Technology, 2018, 138:1-10.
[42] ZHANG Z, NAKANO K, MAEZAWA S.Comparison of the antioxidant enzymes of broccoli after cold or heat shock treatment at different storage temperatures[J].Postharvest Biology and Technology, 2009, 54(2):101-105.
[43] WANG H B, ZHANG Z Q, HUANG X M, et al.Hot water dipping induced chilling resistance of harvested banana fruit[J].Acta Horticulturae, 2008,804:513-522.
[44] WANG W, VINOCUR B, ALTMAN A.Plant responses to drought, salinity and extreme temperatures:towards genetic engineering for stress tolerance[J].Planta, 2003, 218:1-14.
[45] WANG H, ZHANG Z, XU L, et al.The effect of delay between heat treatment and cold storage on alleviation of chilling injury in banana fruit[J].Journal of the Science of Food and Agriculture, 2012, 92(13):2 624-2 629.
[46] BURRIS R H.Hydroperoxidase (peroxidases and catalases)[J].Encyclope Dia of Plant Physiology, 1960, 12:365-400.
[47] VICENTE A R, MARTINEZ G A, CHAVES A R, et al.Effect of heat treatment on strawberry fruit damage and oxidative metabolism during storage[J].Postharvest Biology and Technology, 2006, 40:116-122.
[48] DOORN W G, KETSA S.Cross reactivity between ascorbate peroxidase and phenol (guaiacol) peroxidase[J].Postharvest Biology and Technology, 2014, 95:64-69.
[49] BASSAL M, EL-HAMAHMY M.Hot water dip and preconsitioning treatments to reduce chilling injury and maintain postharvest quality of Navel and Valencia oranges during cold quarantine[J].Postharvest Biology and Technology, 2011, 60:186-191.
[50] CHEN Z, YOUG T E, LING J, et al.Increase vitamin C content of plant through enhanced ascorbate recycling[J].Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(6):3 525-3 530.
[51] DEUTSCH J C.Dehydroascorbic acid[J].Journal of Chromatography A, 2000, 881:299-307.
[52] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2011.
CAO J K, JIANG W B, ZHAO Y M.Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M].Beijing:China Light Industry Press,2011.
[53] MASSOT C, BANCEL D, LAURI F L, et al.High temperature inhibits ascorbate recycling and light stimulation of the ascorbate pool in tomato despite increased expression of biosynthesis genes[J].PLoS One, 2013,8:1-13.
[54] 赵云峰, 林河通, 王静, 等.热处理对龙眼果实采后生理和贮藏品质的影响[J].2014, 14(5):124-133.
ZHAO Y F, LIN H T, WANG J, et al.Effects of heat treatment on postharvest physiology and storage quality of longan fruit[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(5):124-133.
[55] 马雪梅, 吴朝峰, 路志芳.热水处理对草莓贮藏品质与抗氧化能力的影响[J].江苏农业科学, 2018, 46(2):128-132.
MA X M, WU C F, LU Z F.Effect of hot water treatment on strawberry storage quality and antioxidant capacity[J].Jiangsu Agricultural Sciences, 2018, 46(2):128-132.
[56] 马素娟. 采后热空气处理对杨梅果实冷藏期间品质及生理的影响[J].食品科技, 2015, 40(8):344-349.
MA S J.Effects of hot air treatment on postharvest physiology and quality of Chinese bayberry fruit[J].Food Science and Technology, 2015, 40(8):344-349.
[57] 巴良杰, 罗冬兰, 杨飒.热处理对采后火龙果低温贮藏期生理指标的影响[J].中国南方果树, 2018, 47(6):39-44.
BA L J, LUO D L, YANG S.Effect of heat treatment on physiological index of postharvest pitaya during low temperature storage[J].South China Fruits, 2018, 47(6):39-44.
[58] IMAHORI Y.Role of ascorbate peroxidase in postharvest treatments of horticultural crops[J].Oxidative Damage to Plants,2014:425-451.
[59] SHIGENAGA T, YAMAUCHI N, FUNAMOTO Y, et al.Effects of heat treatment on an ascorbate-glutathione cycle in stored broccoli (Brassica oleracea L.) florets[J].Postharvest Biology and Technologyl, 2005, 38:152-159.
[60] WANG K, SHAO X, GONG Y, et al.Effects of postharvest hot air treatment on gene expression associated with ascorbic acid metabolism in peach fruit[J].Plant Molecular Biology Reporter, 2014, 32:881-887.
[61] 邵婷婷, 姜雪, 张敏.贮前强制对流热空气处理对低温胁迫下青椒果实AsA-GSH 循环代谢的影响[J].食品与发酵工业, 2019, 45(18):65-72.
SHAO T T, JIANG X, ZHANG M.Effects of pre-storage forced convective hot air treatment on AsA-GSH cycle of green pepper in low temperature stress[J].Food and Fermentation Industries, 2019, 45(18):65-72.
[62] 姜雪, 张敏, 赵昱瑄.不同初始机体温度对热水处理西葫芦果实低温贮藏品质和活性氧代谢的影响[J].食品与发酵工业, 2020, 46(5):231-239.
JIANG X,ZHANG M,ZHAO Y,et al.Effects of different initial body temperatures on low-temperature storage quality and active oxygen metabolism of hot water treated zucchini fruit[J].Food and Fermentation Industries,2020,46(5):231-239.
[63] 张腾国, 聂亭亭, 孙万仓.逆境胁迫对油菜谷胱甘肽还原酶基因表达及其酶活性的影响[J].应用生态学报, 2018, 29(1):213-222.
ZHANG T G, NIE T T, SUN W C.Effects of diverse stresses on gene expression and enzyme activity of glutathione reductase in Brassica campestris[J].Chinese Journal of Applied Ecology, 2018, 29(1):213-222.
[64] GILL S, ANJUM N, HASANUZZAMAN M, et al.Glutathione and glutathione reductase:A boon in disguise for plant abiotic stress defense operations[J].Plant Physiology and Biochemistry, 2013, 70:204-212.