热休克蛋白(heat shock proteins,HSPs)又称为热应激蛋白,最早发现于1962年,它是指机体在环境温度高于生物体正常生长温度或生物体受到其他应激时产生的一类具有高度保守性的蛋白质,其中多数为伴侣蛋白[1]。这类蛋白质有助于蛋白质折叠、装配、转运,具有防止蛋白质在细胞中的聚集和降解,使细胞应对热和其他环境的损伤[2-3]等功能。有研究表明HSPs的部分生理功能会对肉的食用品质[4-5],尤其是嫩度产生重要影响[6]。
在肉类科学领域,首次提出sHSPs(small heat shock proteins,sHSPs)在肉嫩度中的作用是由于其抗细胞凋亡功能的假设,sHSPs可以通过干扰调节细胞凋亡的信号转导途径来增强细胞存活。近年来,随着sHSPs对肉嫩度的影响研究越来越多,sHSPs的其他生理功能对肉嫩度的影响得到了广泛关注。众多研究表明,sHSPs因其分子伴侣功能促进蛋白质的正确组装和折叠,适当重组异常折叠和变性的蛋白质,维持蛋白质结构稳定性;除此之外,sHSPs可与肌原纤维结合成为μ-钙蛋白酶的替代底物,减少肌原纤维蛋白的水解,与肉嫩度密切相关。上述sHSPs的生理功能是影响肉嫩度形成的关键因素,本文将系统阐述主要HSPs的结构及功能,以及其作为肉嫩度生物标记物的可能性,并从sHSPs对蛋白质聚合物形成、细胞骨架蛋白降解、细胞凋亡进程的调控3个方面分析其对肉嫩度的影响机制,以期为肉类科学领域研究提供方向,并为肉牛优质化生产提供理论参考。
1 HSPs概述
1.1 HSPs的分类、典型HSPs的结构及功能
HSPs有多种分类方法,按其单体分子大小可分为5类,分别为12 kDa~43 kDa、60 kDa、70 kDa、90 kDa和100 kDa左右,分别称为sHSPs、HSP60、HSP70、HSP90和HSP100。不同种类的HSPs其化学结构及功能有所差异,对肉品质的影响也有所不同,下面将对几种主要HSPs的结构和功能进行阐述。
HSP20、HSP27和αβ-晶体蛋白都属于sHSPs家族,作为分布最广泛但保守性最差的分子伴侣蛋白家族,其大多数蛋白质都具有以下共同特征,包括(1)位于C末端由约90个残基组成的保守α-晶体蛋白结构域,该结构域通常后跟一个短的变量序列WDPF结构域;(2)12 kDa~43 kDa的分子质量;(3)形成大的低聚物;(4)动态四元结构;(5)应激条件诱导和伴侣活性抑制蛋白质聚集。sHSPs分子质量的差异可以用WDPF结构域和α-晶体蛋白结构域中可变位点长度的差异以及可变C端的长度来解释(图1)。有研究表明,sHSPs可以通过在应激细胞中发挥分子伴侣作用、负调控应激诱导的细胞凋亡来维持蛋白质稳定进而影响肉的嫩度[6]。
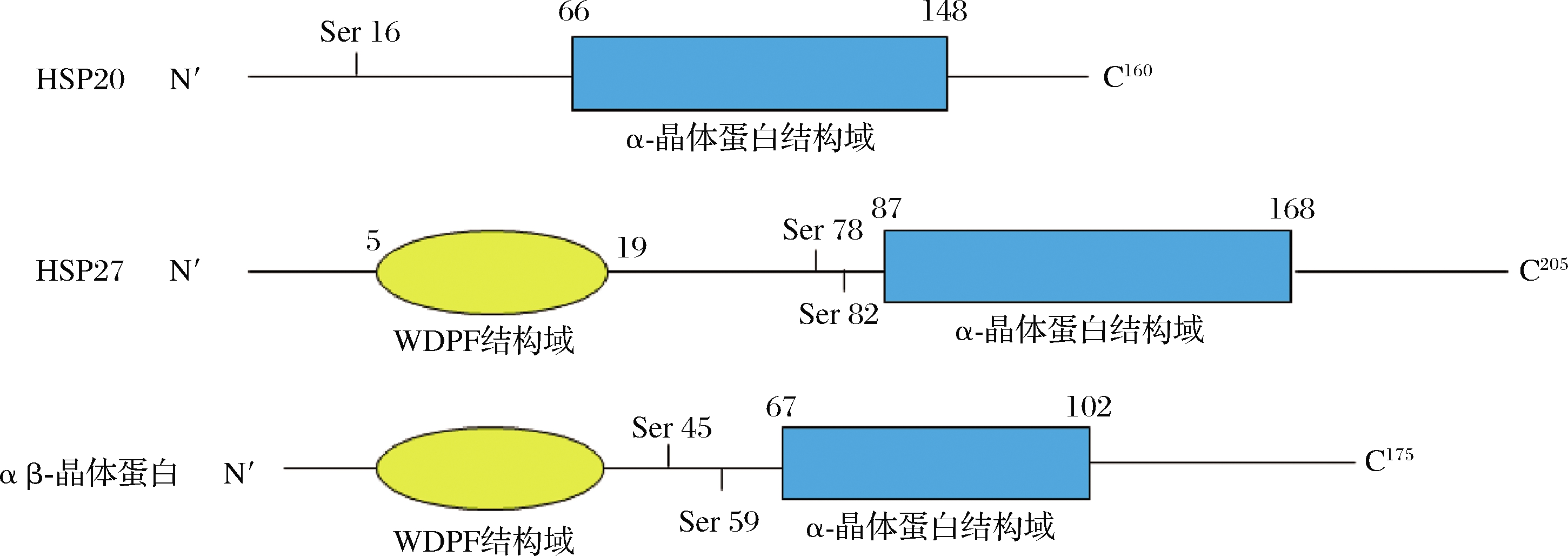
图1 HSP20、HSP27和αβ-晶体蛋白结构示意图[6]
Fig.1 Schematic structures of HSP20, HSP27 and αβ-crystallin[6]
HSP40家族成员分为I型、II型和III型。所有的HSP40蛋白都含有一个约由70个氨基酸残基构成的J结构域。在I型和II型HSP40蛋白中,J结构域位于N端,而在III型HSP40蛋白中,它可以位于蛋白序列的任何位置[7]。HSP40的J结构域可以与HSP70的三磷酸腺苷(adenosine triphosphate,ATP)酶结构域接触,进而刺激HSP70的ATP酶活性。除了J结构域,I型和II型HSP40在蛋白的C端都有一个肽结合片段。与其他两种类型HSP40结构不同的是,I型HSP40在J结构域和C末端肽结合片段之间含有锌结合结构域(图2)。HSP40作为HSP70的分子伴侣,是近年来备受关注的一种特殊的伴侣蛋白,可以促进蛋白质折叠和转运[7],并且也可作为肉嫩度的潜在分子标记物。
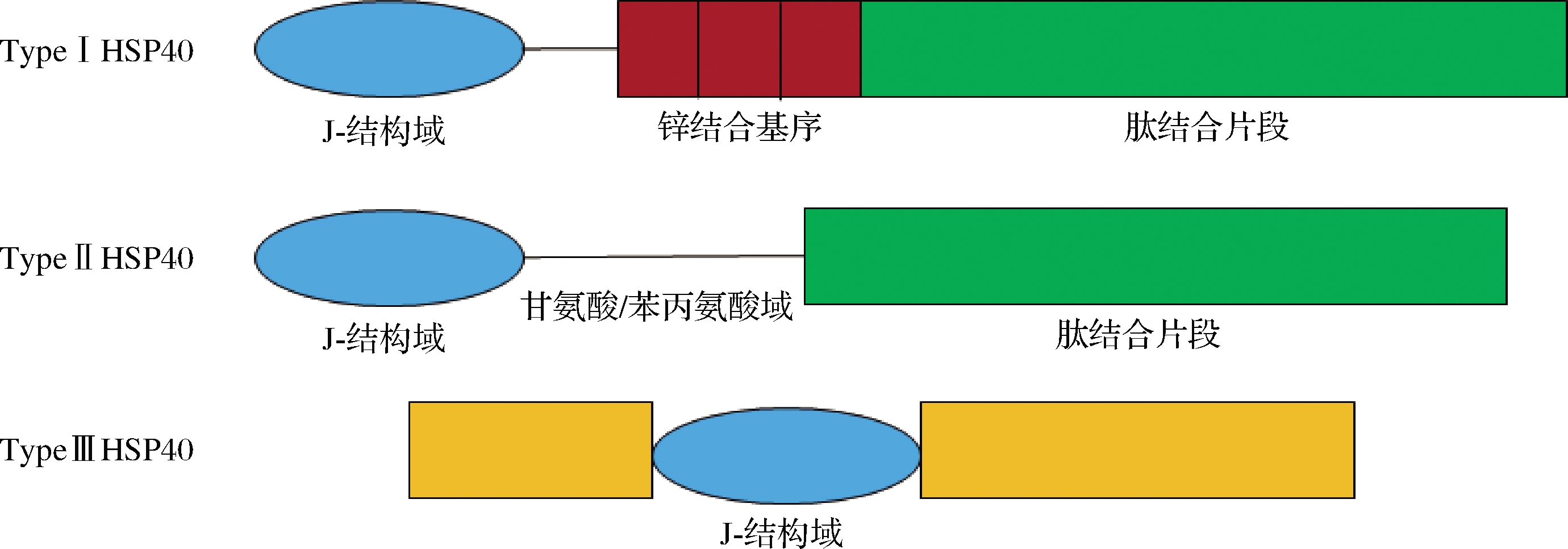
图2 HSP40家族结构示意图[7]
Fig.2 Schematic structures of HSP40 family[7]
HSP70氨基酸的一级结构可分为2个功能域,分子质量为45 kDa的N端域是ATP结合的结构域,控制ATP的结合过程,比羧基端具有更高的保守性;C端域是分子质量为25 kDa的底物结合结构域(包括15 kDa底物肽结合槽和10 kDa C端盖结构域),是多肽结合所必需的(图3),除此之外,C末端还包含一个保守的EEVD基序,该基序锚定了HSP40的C-末端肽结合片段[7]。基于HSP70的生物学功能,其在细胞内参与蛋白质的合成和运输、蛋白质的折叠、降解及调节过程,以维持细胞蛋白的稳定性,提高细胞对应激原的耐受性,使细胞维持正常的生理功能,具有分子伴侣、抑制活性氧的形成、抗细胞凋亡、免疫等作用[1,8]。

图3 HSP70结构示意图[7]
Fig.3 Schematic structures of HSP70[7]
HSP90由3个高度保守的结构域构成,N末端结构域包含ATP结合“口袋”,具有ATP酶活性;中间域含有大量疏水表面,与底物蛋白质的结合及其折叠相关;C端域含有特殊基序MEEVD,主要负责同源二聚体的形成[9-10](图4)。HSP90对于许多涉及细胞周期调控、信号转导以及细胞生长调控蛋白质的折叠、成熟及稳定是必需的,其功能主要依赖于ATP与HSP90结合后造成的HSP90构象重排以及ATP水解现象[11]。
图4 HSP90结构示意图[10]
Fig.4 Schematic structures of HSP90[10]
综上所述,不同类型HSPs由于其由不同的结构域组成,其生理学功能有着显著差异,但均可对蛋白质的折叠、运输等过程产生重要影响。
1.2 HSPs是肉嫩度的生物分子标记物
在宰后初期预测特定品质的最终结果对于肉类工业是有利的,其中嫩度一直是消费者追求的首要品质指标,因此寻找肉类嫩度的生物标记物具有重要意义[11]。
KIM等[12]通过二维凝胶电泳和质谱分析韩国本土牛背最长肌的蛋白质组学时发现,HSP27的表达水平与剪切力呈正相关(r=0.658,P<0.05),HSP27的下调可能增加肌动蛋白和肌球蛋白等肌肉蛋白的降解,从而改善肉的嫩度;孙金龙等[13]以经HSP27抑制剂处理的藏羊肉为研究对象时发现,HSP27能够显著抑制细胞凋亡酶3、细胞凋亡酶9的活性,进而抑制肌间线蛋白和肌钙蛋白-T的降解,抑制肌原纤维小片化的发生,抑制肌肉宰后成熟过程中的嫩化;JIA等[14]在鉴定嫩度不同的牛背最长肌样品中差异表达蛋白时发现,HSP70在2组样品中表达量存在差异。综上,HSPs因其维持蛋白质完整性、维持骨骼肌的结构和功能特性、抗细胞凋亡等功能,不利于肌动蛋白、肌球蛋白、肌间线蛋白等的降解,可作为肉嫩度的分子标记物[15],其表达量与肉嫩度呈不同程度的相关关系。
PICARD等[16]对来自不同品种、不同部位的牛肉蛋白相对丰度进行定量时发现HSPs与嫩度相关,但因肌肉和品种不同,相关关系存在一定差异。推测HSPs在不同程度上可以阻止细胞凋亡的发生以防止细胞损伤,从而在宰后肌肉变化中发挥重要作用,可在嫩度预测中得到应用;GUILLEMIN等[17]比较了夏洛莱公牛和阉牛的胸最长肌(longissimus thoracis,LT)和半腱肌(semitendinosus,ST)中24种牛肉嫩度标记物丰度的差异,发现公牛的αβ-晶体蛋白和HSP27含量显著高于阉牛,而阉牛中的HSP70含量显著高于公牛,LT肌肉中αβ-crystallin、HSP40和HSP70-1A的含量显著高于ST肌;CRAMER等[18-19]在确定sHSPs与双肌臀基因型和正常基因型羔羊的腰肉嫩度的关系时发现,与正常基因型相比,具有双肌臀基因的羔羊腰肉中肌间线蛋白、肌钙蛋白-T、μ-钙蛋白酶、HSP27降解产物显著减少,非活性半胱天冬酶含量高,细胞凋亡进程受到抑制,HSP27降解产物与剪切力呈负相关,因而其具有更高的剪切力,即更差的嫩度。基于以上研究可知,虽然所研究动物的品种和基因型存在一定差异,但均可发现HSPs与肉嫩度有显著相关性,并且在不同动物品种、基因型以及不同肌肉部位间中表现出不同的相关性[11,20],这也进一步说明HSPs可以作为肉嫩度的生物分子标记物。
2 sHSPs对肉嫩度的影响机制
肉的嫩度是指肉的柔软性,指肉在食用时口感的老嫩程度,是影响消费者购买欲望的最重要的食用品质之一。但是这种品质的特征具有不受控制的可变性,肌肉结构(结缔组织含量、组成和结构,肌原纤维类型,肌节长度)和生化特性(肌原纤维和细胞骨架蛋白的蛋白水解)被认为是影响牛肉嫩度变异性的主要因素[2,21-23]。sHSPs因其在蛋白质组装、蛋白质折叠和展开以及受损蛋白质的复性过程中发挥分子伴侣功能,从而维持细胞内稳态,抑制肌原纤维蛋白降解,进而影响肌肉宰后成熟过程中的嫩化[6,24]。已有研究从sHSPs对蛋白质聚合物形成、细胞骨架蛋白降解、抗细胞凋亡等方面探讨了sHSPs对肉嫩度的影响机制。
2.1 sHSPs可能通过对蛋白质聚合物形成的调控影响嫩度
基于sHSPs的分子伴侣特性,很多学者研究了sHSPs对蛋白质聚合物形成的影响。MORZEL等[25]发现HSP27的表达与宰后牛肉嫩度之间存在正相关关系,尽管其表观上对肌肉中的肌动蛋白分解具有保护作用,但其还与成熟过程中肌动蛋白的高度断裂有关,这种情况的发生可能是因为HSP27的存在抑制了肌肉在贮藏过程中肌动蛋白复合物的形成,使骨骼肌肌原纤维蛋白的化学物理的识别位点发生了改变,进而使蛋白酶活性增强。MALHEIROS等[26]利用蛋白质组学研究时也发现3种sHSPs在嫩度较好的肉中的表达量较高,研究认为这一结果与sHSPs的功能有关,高含量的sHSPs能够防止蛋白质的集聚,有利于肌原纤维蛋白的降解,而产生嫩度较好的肉。
以上研究说明,由于蛋白质聚集体的形成被认为是限制动物宰后蛋白质分解的一个因素,因此与限制蛋白质聚集体形成相关的高水平sHSPs可使肌原纤维蛋白原本的物理化学识别位点发生变化,增加酶作用的表面积,促进蛋白水解酶在肉类成熟过程中的作用,从而促进肌原纤维蛋白的水解,进而改善肉的嫩度,即sHSPs表达量与嫩度呈正相关。但sHSPs对肉嫩度影响机制的研究仍需从多个角度进行探究。
2.2 sHSPs可能通过对细胞骨架蛋白降解的调控影响嫩度
细胞骨架蛋白主要包括肌联蛋白、伴肌动蛋白、肌间线蛋白、肌钙蛋白-T等,这些蛋白可以确保肌原纤维间和肌原纤维内的连接,目前研究较多的与细胞骨架蛋白降解有关的酶类包括钙蛋白酶、组织蛋白酶、细胞凋亡酶与蛋白酶体,其对细胞骨架蛋白的水解作用与宰后肌肉嫩度改善密切相关[27-30]。
丁振江[2]使用外源性HSP27对宰后牛肉进行处理,借助十二烷基硫酸钠聚丙烯酰氨凝胶电泳和Western-blotting检测肌原纤维蛋白降解变化时发现,外源HSP27在宰后的前3 d可以抑制肌间线蛋白和肌钙蛋白-T的降解,稳定肌原纤维蛋白,与嫩度呈负相关;LOMIWES等[31]通过免疫沉淀法研究安格斯犊牛背最长肌中αβ-晶体蛋白、HSP20、HSP27与肌间线蛋白、肌联蛋白与μ-钙蛋白酶之间的关系时发现,外源的αβ-晶体蛋白降低了μ-钙蛋白酶活性,同时发现在与过量的αβ-晶状蛋白共同孵育的肌原纤维中,外源性μ-钙蛋白酶对肌间线蛋白和肌联蛋白的降解速率减慢,这表明αβ-晶体蛋白可能通过降低酶活性或作为酶的替代底物竞争性地抑制μ-钙蛋白酶诱导的肌联蛋白和肌间线蛋白降解。此外,HSP27也可能通过与μ-钙蛋白酶结合,降低μ-钙蛋白酶的活性[2]。
以上研究表明,sHSPs可以通过与肌原纤维蛋白结合成为μ-钙蛋白酶的替代底物,竞争性地抑制μ-钙蛋白酶诱导的肌原纤维蛋白降解,减少肌原纤维蛋白的酶促水解,对宰后细胞结构完整性有保护作用,与肉嫩度呈负相关。此外,部分sHSPs还可能通过与μ-钙蛋白酶结合,降低μ-钙蛋白酶的活性,同样减少由μ-钙蛋白酶诱导的肌原纤维蛋白降解(图5)。综上,从sHSPs对细胞骨架蛋白降解影响的角度来看,sHSPs与肉的嫩度呈负相关。但肉类嫩化是一个复杂的生化过程,涉及多种肌原纤维蛋白降解以及内源酶酶解作用,因此明确sHSPs对肌原纤维蛋白的保护作用以及其与多种内源酶的相互作用机理,还需要通过进一步的探索研究来确定。
2.3 sHSPs可能通过对细胞凋亡进程的调控影响嫩度
细胞凋亡酶属于半胱氨酸蛋白酶,主要参与细胞的凋亡过程。动物被宰杀后,机体出现缺血、缺氧环境,营养物质供应终止,肌肉不可避免地发生细胞凋亡,作为细胞程序性死亡的一个组成过程,细胞凋亡发挥着与有丝分裂相反但互补的作用[6]。近期有研究表明,HSPs作为具有抗凋亡作用的伴侣蛋白可以通过调节细胞凋亡进程进而影响肉的嫩度[32-33]。
当细胞暴露在高温、局部缺血、营养物质供应终止等应激环境时sHSPs表达尤为显著,能够发挥抗凋亡作用来影响嫩度。丁振江[2]使用外源性HSP27对牛肉进行处理,检测细胞凋亡酶3降解情况时发现HSP27可与细胞凋亡酶3结合并明显降低细胞凋亡酶3降解和活性。有学者提出假设,中间型极限pH组(5.8
综上,由于细胞凋亡在肌肉转化为肉的过程中发挥着重要的作用,因此细胞凋亡过程的进行与肉嫩度存在密切关系。基于sHSPs的抗凋亡功能,sHSPs能在细胞凋亡的多个途径中抵抗凋亡的发生,并对肉嫩度改善过程造成影响[35-36]。sHSPs可以与细胞凋亡酶3的底物结合,阻止底物蛋白质的降解,同时sHSPs还可直接与细胞凋亡酶3结合降低其生物活性,影响细胞凋亡进程。除此之外,sHSPs还可以直接与细胞色素C结合或封阻其释放[37],在凋亡开始时阻止凋亡小体的产生,同样,sHSPs还可以与影响凋亡的各种成分(Apaf-1,Bax,Bcl-2)相互作用,阻止细胞凋亡酶的激活,抑制肌间线蛋白的降解,阻止细胞凋亡(图5)。但肌肉转化过程中sHSPs对细胞凋亡进程的影响尚需深入研究以了解其对肉嫩度的详细影响机制。
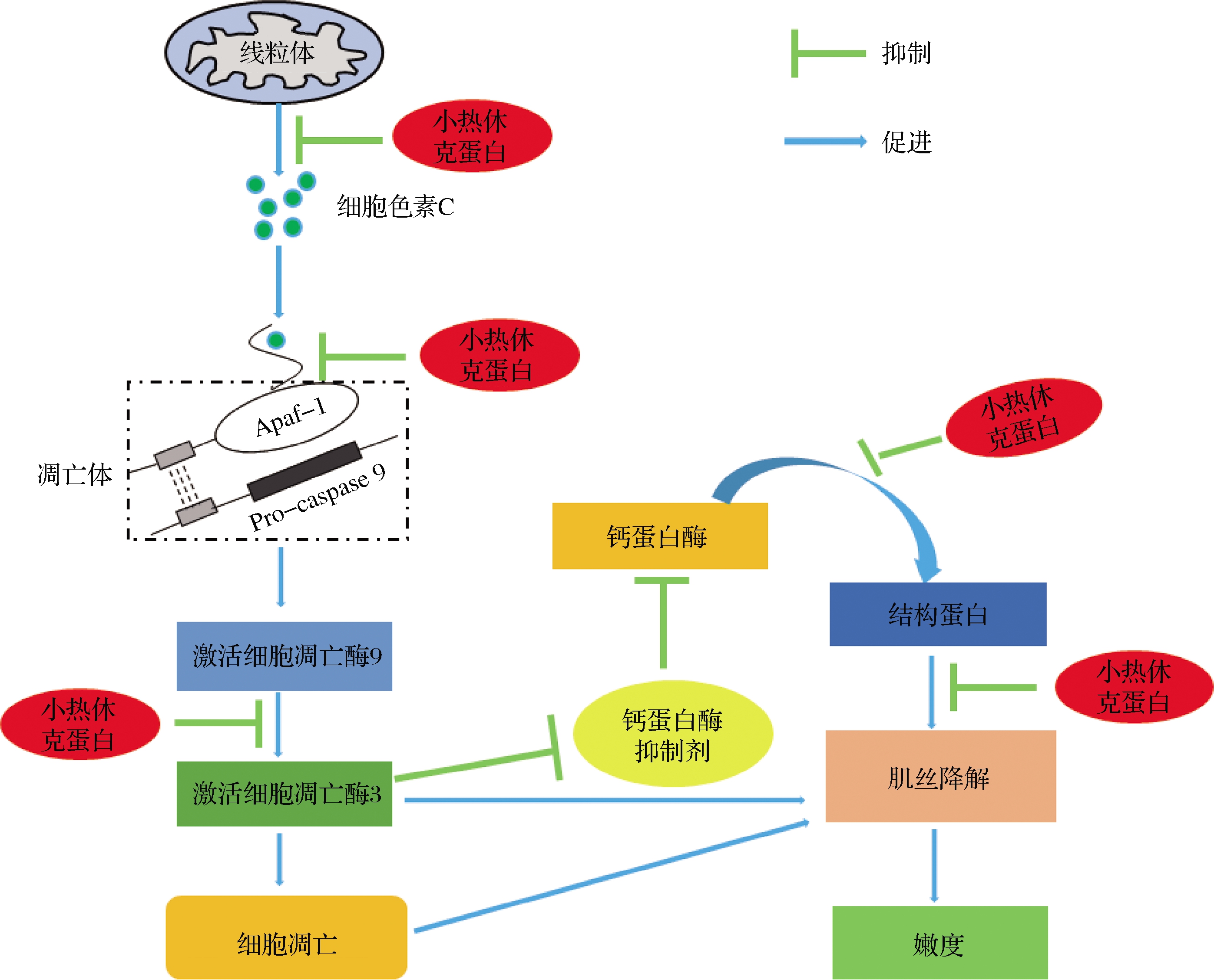
图5 小热休克蛋白对宰后肉嫩度影响机制示意图[17,32]
Fig.5 Schematic diagram of the effect of small heat shock protein on postmortem tenderness[17,32]
3 其他因素对HSPs表达的影响
HSPs的表达与肉的极限pH值、应激方式、动物基因型、品种以及肌肉部位等有关,这些相关性进一步对肉的嫩度产生影响。LOMIWES等[6]研究时发现,宰后成熟期间sHSPs表达量变化与肌肉极限pH值有关,中间型极限pH组牛肉sHSPs含量较高,且可结合μ-钙蛋白酶,并作为分子伴侣稳定肌原纤维结构,使得该组肉的嫩度较差。但李婕等[38]在对青海大通牦牛背最长肌成熟过程中剪切力与HSP27含量测定时发现在成熟过程中,HSP27表达量与牦牛肉剪切力值成负相关(与嫩度成正相关),尽管相关性差异并不显著,但却表明sHSPs对肉嫩度的影响可能与其他因素有一定关系。除了肌肉极限pH值外,应激方式、动物基因型、品种以及所用肌肉部位也能够显著影响HSPs在肌肉中的表达量,并进一步影响肉的嫩度。
3.1 pH值
牛屠宰放血后肌肉内氧气供应终止,ATP的分解、乳酸的产生会导致肌肉pH值的下降[39],当糖酵解酶活性钝化或糖原消耗殆尽时,糖酵解进程停止,pH值不再继续下降,此时的pH值即为宰后肌肉的极限pH值(ultimate pH,pHu)[40]。
LOMIWES等[41]在对高pHu(pH≥6.2)、中间pHu(5.8
在不同pHu肉中,sHSPs含量及降解情况不同,同时由于钙激活酶及组织蛋白酶等内源酶的最适pH不同,其活性在不同pHu肉中存在差异,因此内源酶水解活性及sHSPs含量等因素共同作用使得不同pHu肉中细胞骨架蛋白降解程度有所不同,肉嫩度也有一定差异。
3.2 宰前应激与宰后嫩化处理
动物的宰前应激一部分来源于情绪,比如人类的存在和环境的不熟悉引起的恐惧以及由于饲养群体的破坏引起的混乱;还有一部分与生理因素有关,如食物和水的缺乏、运输时间长或期间与设备、其他动物的碰撞造成的疼痛。宰前应激会降低肌肉糖原含量,导致新陈代谢加快,研究表明,宰前应激与肉的嫩度和多汁性有关[43]。其中运输应激和热应激是两种主要的应激方式。热应激是指机体在受到超过自身体温调节能力的环境刺激下所产生的非特异性应答反应,在热应激期间,HSPs的表达量上升提高热应激期间耐热性。
动物在运输过程中会受到多种应激,包括卡车运动、噪音、震动、离心力、光照条件的快速变化、冷热环境、空气质量以及水和饲料的短缺。袁建彬等[44]对经过运输应激后的肉牛的运输状态进行评估时发现,运输6 h后肉牛应激相关蛋白HSP70的浓度显著上调。
除了宰前应激会对HSPs表达量造成影响外,一些宰后嫩化处理方式也会影响sHSPs的表达。CONTRERAS-CASTILLO等[45]研究了电刺激对宰后贮藏过程中sHSPs浓度的影响,与未电刺激(not stimulated,NS)的肌肉相比,电刺激(electrical stimulation,ES)后1~2 d肌肉中αβ-晶体蛋白的丰度更高;宰后早期和后期成熟时,ES肌肉中的初始HSP20浓度明显高于NS肌肉;在成熟过程中,NS肌肉的肌原纤维中HSP27浓度逐渐升高,相比之下,ES细胞中HSP27的浓度仅在死后早期增加,在宰后约12 h达到高峰,在随后的时间点下降。
通过以上研究可以得出,运输应激、热应激等宰前应激和电刺激等宰杀过程中的处理方式能够显著影响HSPs在肌肉中的表达量。由于HSPs表达量的变化能够显著影响嫩度,因此,在牛肉生产过程中制定牛肉嫩度关键控制点时,应该注意宰前应激方式或电刺激强度对HSPs表达量的调控及进而对牛肉嫩度的影响。
3.3 动物品种、基因型、肌肉部位
HSPs在不同动物、不同肌肉部位中的表达量也有所不同。GUILLEMIN等[17]在比较夏洛莱公牛和阉牛的LT和ST中牛肉嫩度标记物丰度差异时,发现公牛的αβ-晶体蛋白和HSP27含量显著高于阉牛,而阉牛中的HSP70含量显著高于公牛;在比较两不同肌肉部位HSPs丰度时,发现LT肌肉中与嫩度相关的蛋白质具有更高的丰度;CRAMER等[19-20]等在确定sHSPs与双肌臀基因型和正常基因型羔羊的腰肉嫩度的关系时发现,与正常基因型相比,具有双肌臀基因的羔羊腰肉中HSP27降解产物显著减少,肌原纤维结构蛋白的蛋白水解较少,非活性半胱天冬酶含量高,其具有更高的剪切力,即更差的嫩度。MA等[46]研究牛不同肌肉部位成熟过程中肌原纤维蛋白水解变化时发现,在成熟过程中肌肉部位之间sHSPs降解速率和程度不同,进而呈现出不同的嫩化效果。
基于以上研究可知,HSPs在不同动物品种和基因型中表现出与嫩度不同的相关性,由此也进一步确定HSPs对肉的嫩度具有潜在影响。
4 结论与展望
sHSPs作为一种应激蛋白,其在肌肉向食用肉转化过程中的作用仍然是肉科学领域未探明的一个科学问题。sHSPs可以通过阻止蛋白质在细胞中的聚集,促进肌原纤维蛋白的降解,而有利于肉的嫩化。但是同时发现,sHSPs可与肌原纤维蛋白结合,竞争性抑制μ-钙蛋白酶诱导的肌原纤维蛋白降解;也可与μ-钙蛋白酶结合,降低其酶解活性而不利于肉嫩度的改善;除此之外,sHSPs因其抗细胞凋亡功能,可与细胞凋亡酶-3或其底物相结合,降低其生物活性,也可封阻细胞色素C的释放,影响细胞凋亡进程,抑制肌原纤维蛋白的降解,也不利于肉的嫩化。目前的研究结果表明,sHSPs与肉嫩度之间的确存在密切关系,但是这一关系是正面还是负面,仍存在很大争议,需要进一步的系统研究来确定。
此外,由于sHSPs是非ATP依赖型的伴侣蛋白,目前sHSPs对牛肉品质的影响机制较多的是以蛋白质组学进行的,因此是否可以利用代谢组学等技术寻找代谢通路中某些代谢产物的变化,研究高分子量的HSPs与牛肉品质之间的关系,进而从代谢通路的角度进一步解释HSPs对牛肉品质的影响机制,是该领域的一个新的研究思路。除此之外,由于肌肉pHu,运输应激、热应激等宰前应激和电刺激等宰杀过程中的处理方式、动物基因型、品种以及肌肉部位等均会对HSPs的表达量产生影响,因此如何在今后肉牛生产屠宰加工过程中控制pHu,减少应激产生,进而调控HSPs的表达量,或者以HSPs作为嫩度标记物而实现肉用动物良好基因型的筛选,将是肉类行业未来发展方向之一。
[1] 刘松松, 项阳, 王剑.热休克蛋白70在细胞凋亡途径中的作用研究进展[J].中国畜牧杂志, 2020, 56(8):45-49.
LIU S S, XIANG Y, WANG J.Effect of heat shock protein 70 on the process of cellular apoptosis[J].Chinese Journal of Animal Science, 2020, 56(8):45-49.
[2] 丁振江. 热休克蛋白27对宰后牛肉肌原纤维蛋白降解的调控机制研究[D].北京:中国农业科学院, 2018.
DING Z J.Regulatory mechanism of heat shock protein 27 on the degradation of myofibrils in post-mortem beef muscles[D].Beijing:Chinese Academy of Agricultural Sciences, 2018.
[3] 董福家, 陈倩, 孔保华, 等.肌肉中的小热休克蛋白及其对肌肉品质的影响[J].食品工业, 2015, 36(2):243-246.
DONG F J, CHEN Q, KONG B H, et al.Small heat shock proteins in meat and their effects on meat quality[J].Food Industry, 2015, 36(2):243-246.
[4] GAGAOUA M, TERLOUW E M C, MICOL D, et al.Understanding early post-mortem biochemical processes underlying meat color and pH decline in the longissimus thoracis muscle of young blond d′ aquitaine bulls using protein biomarkers[J].Journal of Agricultural and Food Chemistry, 2015, 63(30):6 799-6 809.
[5] GAGAOUA M, CLAUDIA TERLOUW E M, PICARD B.The study of protein biomarkers to understand the biochemical processes underlying beef color development in young bulls[J].Meat Science,2017,134:18-27.
[6] LOMIWES D, FAROUK M M, WIKLUND E, et al.Small heat shock proteins and their role in meat tenderness:A review[J].Meat Science, 2013, 96(1):26-40.
[7] LI J, QIAN X, SHA B, et al.Heat shock protein 40:Structural studies and their functional implications[J].Protein and Peptide Letters, 2009, 16(6):606-612.
[8] 彭乔烽, 陈朗, 马小梅, 等.热休克蛋白HSP70家族功能研究进展[J].甘肃畜牧兽医, 2019, 49(5):18-20.
PENG Q F, CHEN L, MA X M, et al.Research progress of heat shock protein hsp70 family function[J].Gansu Animal Husbandry and Veterinary, 2019, 49(5):18-20.
[9] 赵维洋, 王鹤飞, 禹媛, 等.HSP90细胞质亚型的分子结构、功能及与疾病的关系[J].生命的化学, 2019, 39(4):631-636.
ZHAO W Y, WANG H F, YU Y, et al.The hsp90 cytoplasmic isoforms:Structure, function and the role in disease[J].Chemistry of Life, 2019, 39(4):631-636.
[10] 李健, 孙丽华, 徐春艳, 等.热休克蛋白90的N端与ATP类似物的晶体结构揭示其功能调控[J].生物化学与生物物理进展, 2012, 39(10):995-1 002.
LI J, SUN L H, XU C Y, et al.Crystal structures of n-terminal domain of human hsp90 with ATP analogues reveal the functional regulation of hsp90[J].Progress in Biochemistry and Biophysics, 2012, 39(10):995-1 002.
[11] GAGAOUA M, CLAUDIA TERLOUW E M, BOUDJELLAL A, et al.Coherent correlation networks among protein biomarkers of beef tenderness:What they reveal[J].Journal of Proteomics,2015,128:365-374.
[12] KIM N K, CHO S, LEE S H, et al.Proteins in longissimus muscle of Korean native cattle and their relationship to meat quality[J].Meat Science, 2008, 80(4):1 068-1 073.
[13] 孙金龙, 师希雄, 黄峰, 等.藏羊肉宰后成熟过程中热休克蛋白27对肌原纤维蛋白及细胞凋亡酶的影响[J].食品科学, 2020, 41(3):5-8.
SUN J L, SHI X X, HUANG F, et al.Effect of hsp27 on myofibrillar proteins and caspases on Tibetan sheep meat tenderness during postmortem aging[J].Food Science, 2020, 41(3):5-8.
[14] JIA X, VEISETH K E, GROVE H, et al.Peroxiredoxin-6—A potential protein marker for meat tenderness in bovine longissimus thoracis muscle[J].Journal of Animal science, 2009, 87(7):2 391-2 399.
[15] MALHEIROS J M, ENRíQUEZ-VALENCIA C E, DA SILVA DURAN B O, et al.Association of CAST2, hsp90AA1, DNAJA1 and hspB1 genes with meat tenderness in Nellore cattle[J].Meat Science,2018,138:49-52.
[16] PICARD B, GAGAOUA M.Proteomic investigations of beef tenderness[J].Proteomics in Food Science, 2017:177-197.
[17] GUILLEMIN N, JURIE C, CASSAR-MALEK I, et al.Variations in the abundance of 24 protein biomarkers of beef tenderness according to muscle and animal type[J].Animal, 2011, 5(6):885-894.
[18] CRAMER T, PENICK M L, WADDELL J N, et al.A new insight into meat toughness of callipyge lamb loins-the relevance of anti-apoptotic systems to decreased proteolysis[J].Meat Science, 2018, 140:66-71.
[19] CRAMER T, KIM Y H, PENICK M, et al.Small heat shock protein 27 may be related to toughness in loins of callipyge lambs[J].Meat Science, 2016, 112:178.
[20] ROSA A F, MONCAU C T, POLETI M D, et al.Proteome changes of beef in Nellore cattle with different genotypes for tenderness[J].Meat Science,2018,138:1-9.
[21] ANNE L, LEBRET B, ISABELLE L, et al.How muscle structure and composition influence meat and flesh quality[J].The Scientific World Journal, 2016, 2016:1-14.
[22] ENGLAND E M, MATARNEH S K, SCHEFFLER T L, et al. New Aspects of Meat Quality. Chapter 4. Perimortal Muscle Metabolism and Its Effects on Meat Quality[M]. Sawston: Woodhead Publishing, 2017.
[23] ERTBJERG P, PUOLANNE E.Muscle structure, sarcomere length and influences on meat quality:A review[J].Meat Science,2017,132:139-152.
[24] BALDASSINI W A, BRAGA C P, CHARDULO L A, et al.Bioanalytical methods for the metalloproteomics study of bovine longissimus thoracis muscle tissue with different grades of meat tenderness in the Nellore breed (Bos indicus)[J].Food Chemistry,2015,169:65-72.
[25] MORZEL M, TERLOUW C, CHAMBON C, et al.Muscle proteome and meat eating qualities of longissimus thoracis of “blonde d′ aquitaine” young bulls:A central role of hsp27 isoforms[J].Meat Science, 2008, 78(3):297-304.
[26] MALHEIROS J M, BRAGA C P, GROVE R, et al.Influence of oxidative damage to proteins on meat tenderness using a proteomics approach[J].Meat Science, 2019,148:64-71.
[27] 杜曼婷. 蛋白质磷酸化介导的μ-钙蛋白酶活性变化机理[D].北京:中国农业科学院, 2018.
DU M T.Regulatory mechanism of μ-calpain activity by protein phosphorylation[D].Beijing:Chinese Academy of Agricultural Sciences, 2018.
[28] LANA A, ZOLLA L.Proteolysis in meat tenderization from the point of view of each single protein:A proteomic perspective[J].Journal of Proteomics, 2016:85-97.
[29] BHAT Z F, MORTON J D, MASON S L, et al.Role of calpain system in meat tenderness:A review[J].Food Science and Human Wellness, 2018, 7(3):196-204.
[30] CARLSON K B, PRUSA K J, FEDLER C A, et al.Postmortem protein degradation is a key contributor to fresh pork loin tenderness[J].Journal of Animal Science,2017,95(4):1 574-1 586.
[31] LOMIWES D, HURST S M, DOBBIE P, et al.The protection of bovine skeletal myofibrils from proteolytic damage postmortem by small heat shock proteins[J].Meat Science, 2014, 97(4):548-557.
[32] KIM Y H, MA D, SETYABRATA D, et al.Understanding postmortem biochemical processes and post-harvest aging factors to develop novel smart-aging strategies[J].Meat Science, 2018, 144:74-90.
[33] RAMOS P M, WRIGHT S A, DELGADO E F, et al.Resistance to pH decline and slower calpain-1 autolysis are associated with higher energy availability early postmortem in Bos taurus indicus cattle[J].Meat Science, 2020, 159:107 925.
[34] MO X M, LI L, ZHU P, et al.Up-regulation of hsp27 by ERα/Sp1 facilitates proliferation and confers resistance to apoptosis in human papillary thyroid cancer cells[J].Molecular & Cellular Endocrinology, 2016,431:71-78.
[35] LONGO V, LANA A, BOTTERO M T, et al.Apoptosis in muscle-to-meat aging process:The omic witness[J].Journal of Proteomics,2015,125:29-40.
[36] DING Z J, HUANG F, ZHANG C J, et al.Effect of heat shock protein 27 on the in vitro degradation of myofibrils by caspase-3 and μ-calpain[J].International Journal of Food Science & Technology,2017,53(1):121-128.
[37] KONG F, WANG H, GUO J, et al.Hsp70 suppresses apoptosis of brl cells by regulating the expression of bcl-2, cytochrome c, and caspase 8/3[J].In Vitro Cell Dev BiolAnim, 2016, 52(5):568-575.
[38] 李婕, 罗天林, 师希雄, 等.牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析[J].食品科学, 2016, 37(9):18-22.
LI J, LUO T L, SHI X X, et al.Correlation analysis between heat shock protein 27 expression and eating quality during postmortem aging of yak meat[J].Food Science, 2016, 37(9):18-22.
[39] MATARNEH S K, ENGLAND E M, SCHEFFLER T L, et al.The conversion of muscle to meat[J].Lawrie′s Meat Science (Eight Edition), 2017:159-185.
[40] 王晶, 罗欣, 朱立贤, 等.不同极限pH值牛肉品质差异及机制的研究进展[J].食品科学, 2019, 40(23):283-288.
WANG J, LUO X, ZHU L X, et al.Recent progress in understanding quality differences among beef with different ultimate pH and underlying mechanism[J].Food Science, 2019, 40(23):283-288.
[41] LOMIWES D, FAROUK M M, FROST D A, et al.Small heat shock proteins and toughness in intermediate pHu beef[J].Meat Science, 2013, 95(3):472-479.
[42] BALAN P, KIM Y H B, BLIJENBURG R.Small heat shock protein degradation could be an indicator of the extent of myofibrillar protein degradation[J].Meat Science, 2014, 97(2):220-222.
[43] REICHE A M, OBERSON J L, SILACCI P, et al.Pre-slaughter stress and horn status influence physiology and meat quality of young bulls[J].Meat Science, 2019, 158:107 892.
[44] 袁建彬, 薛琳琳, 高春柳, 等.运输应激对肉牛肝脏和脾脏中应激相关蛋白的影响[J].中国兽医学报, 2018(10):1 948-1 951.
YUAN J B, XUE L L, GAO C L, et al.Effect of transport stress on stress related proteins in liver and spleen of beef cattle[J].Chinese Journal of Veterinary Science, 2018(10):1 948-1 951.
[45] CONTRERAS-CASTILLO C J, LOMIWES D, WU G, et al.The effect of electrical stimulation on post mortem myofibrillar protein degradation and small heat shock protein kinetics in bull beef[J].Meat Science, 2016, 113:65-72.
[46] MA D Y, KIM Y H.Proteolytic changes of myofibrillar and small heat shock proteins in different bovine muscles during aging:Their relevance to tenderness and water-holding capacity[J].Meat Science, 2020, 163:108 090.