中国白酒按香型可分为浓香型、酱香型、清香型、凤香型和其他香型等[1]。其中,浓香型白酒以其“窖香优雅、绵甜爽净、酒体柔和协调”的特点深受消费者喜爱[2]。浓香型白酒生产是以高粱、玉米、糯米、小麦、大米5种粮食为主原料,在栖息于窖池中大量微生物的参与下,采用混蒸续渣工艺进行的多菌种混合固态发酵[1]。
经过长期发酵驯化,窖池中栖息着包括梭菌纲、拟杆菌纲、芽孢杆菌纲、甲烷杆菌纲、甲烷微菌纲等在内的多种厌氧微生物[1]。研究发现,浓香型白酒中风味化合物的组成是由其微生物多样性决定的[3]。据报道,浓香型白酒含有1 300多种不同的风味化合物[4],其中,己酸乙酯是使浓香型白酒风味独特的主要呈香物质,其含量直接影响浓香型白酒的价值和品质[1]。己酸乙酯是由己酸和乙醇经过酯化反应的产物[4],含量与窖池生态系统中的己酸菌密不可分,因此,己酸菌被普遍认为是浓香型白酒酿造中最重要的一类功能微生物[1-2]。
自发现浓香型曲酒主体香味成分为己酸乙酯以来,国内对窖池中己酸菌的研究在各酒厂陆续展开[5]。目前,对于己酸菌的研究主要集中在窖池生态系统中新型高效己酸菌的筛选[2, 6]、发酵条件调控[7- 8]、己酸代谢途径解析[9-10]、己酸菌在浓香型白酒酿造[5, 11]及其他领域的应用等[12-13]。本文针对浓香型白酒生态系统中己酸菌及其特性、己酸代谢途径、己酸菌应用等方面综述浓香型白酒己酸菌研究进展。
1 己酸菌种类及特性
己酸菌是能够以乙醇、乳酸、葡萄糖、D-半乳糖醇等为碳源,发酵积累己酸的一类微生物的总称。目前已报道的己酸菌主要为来自于梭菌纲梭菌属、梭菌纲瘤胃菌科及Negativicutes纲巨球型菌属细菌。己酸菌在环境系统中分布广泛,浓香型白酒生态系统、厌氧消化污泥、牛羊瘤胃和淤泥等中均有己酸菌存在。
1.1 来源于浓香型白酒生态系统的己酸菌及其特性
表1列出了部分分离于浓香型白酒生态系统的己酸菌种类及特性。
表1 分离于浓香型白酒生态系统的己酸菌种类及特性
Table 1 Species and characteristics of caproic acid-producing bacteria isolated from strong-flavor Baijiu ecosystem
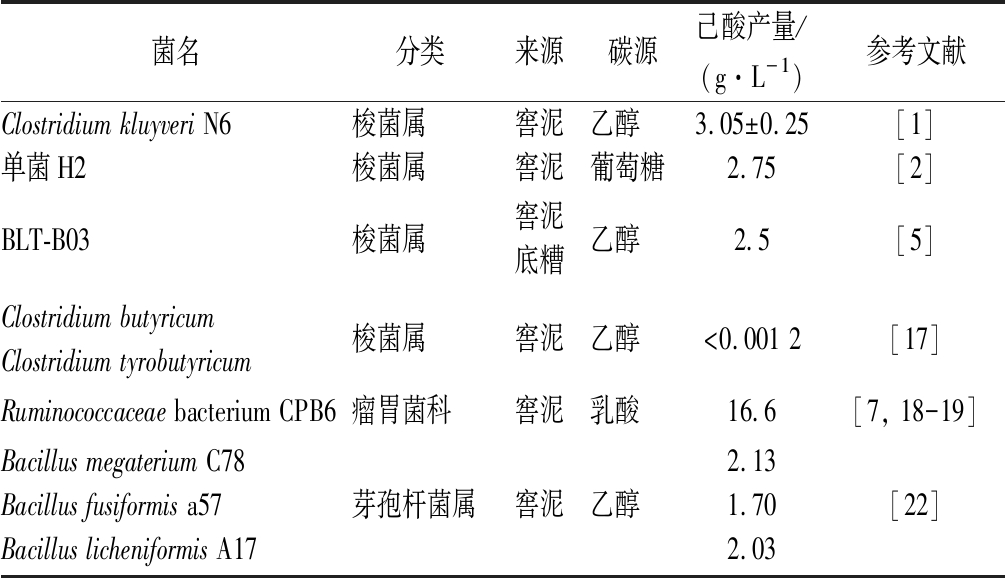
菌名分类来源碳源己酸产量/(g·L-1)参考文献Clostridium kluyveri N6梭菌属窖泥乙醇3.05±0.25[1]单菌H2梭菌属窖泥葡萄糖2.75[2]BLT-B03梭菌属窖泥底糟乙醇2.5[5]Clostridium butyricumClostridium tyrobutyricum梭菌属窖泥乙醇<0.001 2[17]Ruminococcaceae bacterium CPB6瘤胃菌科窖泥乳酸16.6[7, 18-19]Bacillus megaterium C78Bacillus fusiformis a57Bacillus licheniformis A17芽孢杆菌属窖泥乙醇2.131.702.03[22]
1.1.1 Clostridium kluyveri
C.kluyveri是具于代表性的己酸菌,在白酒窖泥、淤泥沉积物以及牛瘤胃中广泛存在[14]。BARKER[14]用乙醇和CO2为基质研究甲烷菌时发现一种鼓槌孢子型产己酸的菌株,产物为己酸、乙酸、丁酸。1942年被正式命名为C.kluyveri,C.kluyveri菌株专性厌氧,菌落形态呈圆形不规则状,菌落呈乳白色,边缘呈波状,表面光滑或突脐状,最适生长温度为30~35 ℃,在pH为7.0以上的碱性条件下生长良好。该菌以乙醇为电子供体,以醋酸盐和琥珀酸盐为电子受体[9],不能利用葡萄糖、乳糖等糖类,在发酵过程中产生气体。此外,C.kluyveri以乙醇和琥珀酸为底物,产生乙酸酯、丁酸酯和己酸酯[15];以乙酸和丙醇为底物,产生丙酸、戊酸、己酸和庚酸[16]。
1.1.2 Clostridium sp
随着生物技术的发展,对于菌株分类越来越科学细致。各个酒厂窖泥中都分离出不同产己酸的梭状芽孢杆菌[6, 17-20],菌体往往吸附在碳酸钙上,但在没有碳酸钙的条件下产己酸含量未下降,且多加碳酸钙不能提高己酸产量[1, 6]。除此之外,朱晓军[2]发现瘤胃球菌科梭菌属第Ⅳ簇单菌H2以葡萄糖为电子供体,根据实验现象猜测实际的浓香型白酒酿造体系中,C.kluyveri可能并不是己酸合成唯一的贡献者。
1.1.3 Ruminococcaceae bacterium
ZHU等[6]在分批补料发酵反应器中首次发现了利用乳酸高产己酸的菌株R. bacterium CPB6,在窖泥中发现该菌株属于Ruminococcaceae家族IV型梭状芽孢杆菌,以乳酸为电子供体[18]。该菌株最适pH为5.0~6.5,温度为30~40 ℃,可利用淀粉、麦芽糖、葡萄糖、丙酮酸等[19]。己酸生产和梭状芽孢杆菌簇IV之间为正相关关系[2]。目前对于产己酸梭状芽孢杆菌IV的代谢途径中链延长的基因和关键酶研究不多,有待完善。
1.1.4 浓香型白酒生态系统中其他己酸菌
除了以上几项研究得到的浓香型白酒生态系统中的常见己酸菌,赵辉等[20]在浓香型白酒窖泥中发现3株高产己酸的菌株Bacillus megaterium C78、Bacillus fusiformis a57及Bacillus licheniformis A17,相应最适pH值分别为7.0、6.5、7.0,最适温度分别为34、34、37 ℃。
1.2 来源于其他生态系统的己酸菌及其特性
己酸菌除了存在于在浓香型白酒生态系统中,在其他生态系统中关于己酸菌的研究也越来越多,如表2所示。
表2 分离于其他生态系统的己酸菌种类及特性
Table 2 Species and characteristics of caproic acid-producing bacteria isolated from other ecosystems
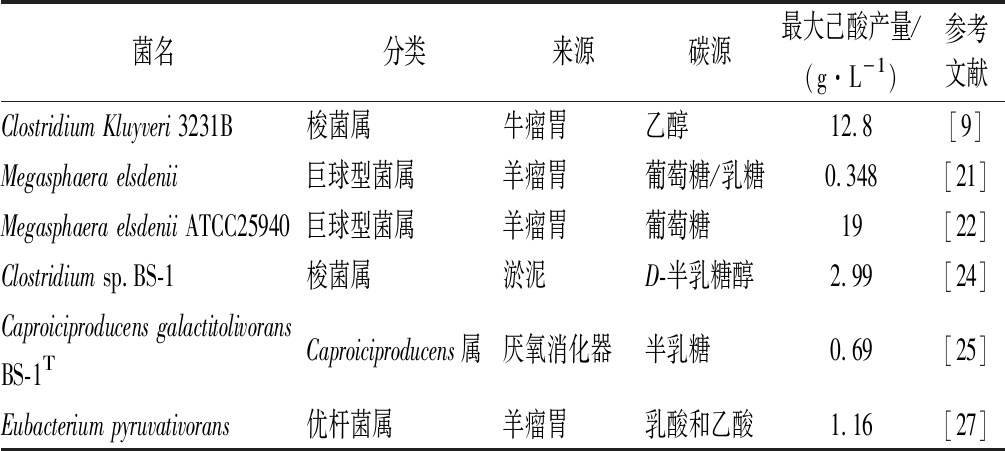
菌名分类来源碳源最大己酸产量/(g·L-1)参考文献Clostridium Kluyveri 3231B梭菌属牛瘤胃乙醇12.8[9]Megasphaera elsdenii巨球型菌属羊瘤胃葡萄糖/乳糖0.348[21]Megasphaera elsdenii ATCC25940巨球型菌属羊瘤胃葡萄糖19[22]Clostridium sp.BS-1梭菌属淤泥D-半乳糖醇2.99[24]Caproiciproducens galactitolivoransBS-1TCaproiciproducens属厌氧消化器半乳糖0.69[25]Eubacterium pyruvativorans优杆菌属羊瘤胃乳酸和乙酸1.16[27]
1.2.1 Megasphaera elsdenii
M. elsdenii主要存在于羊瘤胃和牛瘤胃中,可以葡萄糖、乳酸、果糖等为电子供体,可利用淀粉、甘露醇、麦芽糖等;产物主要有丁酸、己酸![]() 当以葡萄糖为底物时可产生丁酸和己酸,但不产生丙酸[21],且己酸产量达19 g/L[22]。葡萄糖培养基中菌体生长慢于在乳酸培养基中生长,乳酸的消耗促进菌体对葡萄糖的利用[21];当两者同时作为底物时,M.elsdenii T81更倾向于利用乳酸[23]。
当以葡萄糖为底物时可产生丁酸和己酸,但不产生丙酸[21],且己酸产量达19 g/L[22]。葡萄糖培养基中菌体生长慢于在乳酸培养基中生长,乳酸的消耗促进菌体对葡萄糖的利用[21];当两者同时作为底物时,M.elsdenii T81更倾向于利用乳酸[23]。
1.2.2 Clostridium sp. BS-1
从淤泥中筛选以D-半乳糖醇为碳源的厌氧微生物,过程中发现新型梭状芽孢杆菌IV属产己酸菌BS-1[24],后来被重新命名为Caproicproductens galacitolivorans[25];该菌株也可利用葡萄糖产己酸,但是己酸产量低于以半乳糖醇为底物时的产量。
1.2.3 Eubacterium limosum
E. limosum是一种从绵羊瘤胃液中分离到褐杆菌,通过检测耐热性,未观察到孢子[26]。该菌以甲醇、醋酸盐、半胱氨酸等为底物,当以甲醇、丁酸、CO2为原料对其进行培养时,己酸成为主要产物,且丁酸的产生与甲醇氧化的通量密切相关[23]。
1.2.4 Eubacterium pyruvativorans
WALLACE等[27]用胰酪蛋白水解物作为唯一碳源和能源,从绵羊瘤胃液中分离出以乳酸和乙酸为碳源的己酸菌E.pyruvativorans。其不是糖化菌,不利用乙醇且不完全利用乳酸,是利用丁酸和丙酸生成己酸和戊酸的细菌,利用丙酮酸通过反向β氧化途径获得ATP。
2 己酸菌的己酸代谢途径及代谢调控
2.1 己酸代谢途径
研究表明,某些厌氧细菌(如梭状芽孢杆菌)能够利用脂肪酸合成酶复合酶通过反向β氧化途径延长短链脂肪酸[9-10]。如图1所示,以乙醇为电子供体,在乙醇氧化偶联阶段消耗NAD+产生大量的还原型辅酶Ⅰ(nicotinamide adenine dinucleotide, NADH)生成乙酰辅酶A,通过底物水平磷酸化产生乙酸;当以乳酸为底物时,在乳酸氧化阶段代谢产生NADH和乙酰辅酶A[28]。羧酸链延长过程中产生的还原型辅酶Ⅰ(nicotinamide adenine dinucleotide, NADH)为合成己酸代谢过程中提供H+并促进电子流动,且代谢过程中乙酰辅酶A通过底物水平磷酸化促进ATP产生,为羧酸链延长提供能量[10]。
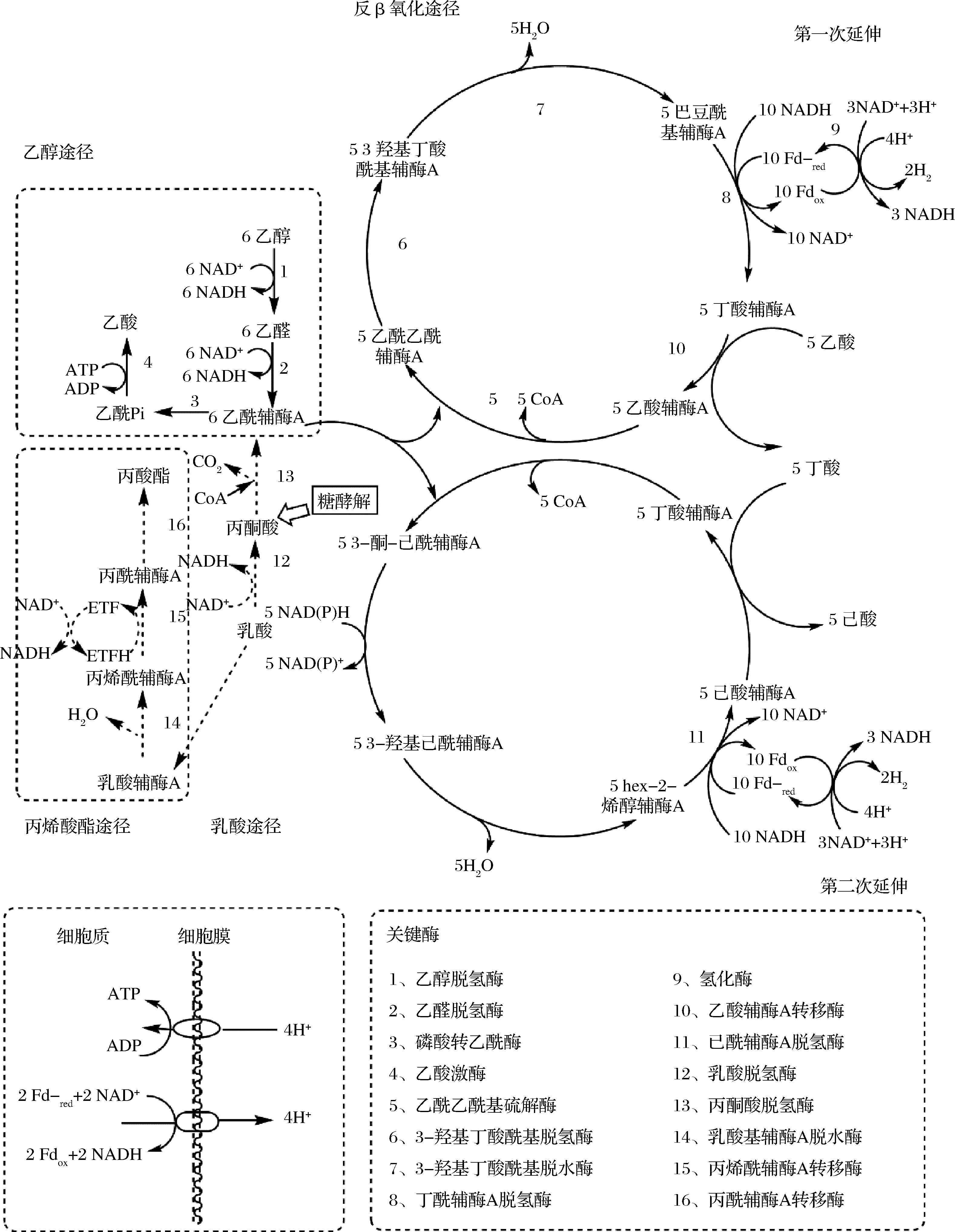
图1 以乙醇和乳酸为电子供体的己酸代谢途径[30]
Fig.1 Metabolic pathway of caproic acid with ethanol and lactic acid as electron donors 注:NADH为烟酰胺腺嘌呤二核苷酸的还原态,还原型辅酶Ⅰ;NAD+为烟酰胺腺嘌呤二核苷酸;NADPH为还原型烟酰胺腺嘌呤二核苷酸磷酸, 是一种辅酶,即还原型辅酶Ⅱ;NADP+为烟酰胺腺嘌呤二核苷磷酸,是还原型辅酶Ⅱ(NADPH)的氧化形式;ATP为腺嘌呤核苷三磷酸 (简称三磷酸腺苷);ADP为二磷酸腺苷;Fdox为氧化的铁氧化还原蛋白;Fdred为还原的铁氧化还原蛋白
研究得知,在反向β氧化的羧酸链延长反应中,碳水化合物初级厌氧发酵重要中间体乙醇和乳酸是己酸合成过程中有效的还原剂,且为最理想的电子供体[29]。链延长过程中的必要条件是存在大量还原性化合物为其提供能量和电子供体,如乙醇和乳酸等。
2.2 产己酸代谢途径竞争途径
在混合培养过程中,由于受到竞争途径的影响会导致链延长过程的稳定性降低,产己酸代谢途径的竞争路径如表3所示,此外,图1所示的丙烯酸酯合成丙酸盐途径也为产己酸代谢途径的竞争途径[31-32]。
表3 产己酸代谢途径竞争途径
Table 3 Competitive pathway of caproic acid metabolism

反应方程式竞争路径CH3COO-+H2O➝CH4+HCO-3乙酸氧化途径生成甲烷C2H5OH+H2O➝CH3COO- +H++2H2乙醇过度氧化成醋酸盐CxH2x+1COO-+2H2O➝C(x-2)H2(x-2)+1COO-+H++2H2中链脂肪酸氧化为醋酸盐
乙酸营养型甲烷的形成是通过消耗链延长的底物乙酸形成甲烷,乙酸消耗的过程与产己酸代谢途径形成竞争关系;中链脂肪酸消耗乙醇氧化为乙酸盐获得能量,这与其他生物消耗乙醇过程形成竞争关系;最终产物中链脂肪酸也会在脂肪酸氧化剂的作用下发生降解,造成产品的流失。丙烯酸酯竞争途径如图1所示,将乳酸转化为丙酸酯[32],在以乳酸为底物的M.elsdenii纯培养中丙烯酸酯竞争途径得到证实,并未生成己酸,发现在M.elsdenii对酸的利用中辅酶A转移酶活性发挥核心作用[33];研究表明,M.elsdenii不能利用葡萄糖产丙酸盐的主要原因是乳酸可以诱导合成乳酸外消旋酶,然而葡萄糖发酵的细胞不能合成乳酸外消旋酶[32]。因此,为得到高效产己酸代谢途径需要对其竞争途径加以控制以保证生产需求。
2.3 己酸菌的己酸代谢调控
通过乙醇氧化途径产己酸的微生物一直面对的主要问题是乙醇对微生物有一定的抑制作用,但用低浓度乙醇易导致己酸浓度低,经济效益不佳。除乙醇浓度会影响己酸产量,以乙酸和丁酸的混合物作为底物可以有效提高己酸产量[7]。DIENDER等[34]研究发现乙酸可促进中链脂肪酸合成,但是其具体功能仍不明确。
基于乙酸和乙醇含量对己酸产量的巨大影响,很多学者开始乙酸和乙醇浓度比与己酸产量关系的研究。YIN等[8]研究发现乙酸和乙醇浓度比与己酸的产量呈负相关,且发酵产己酸过程中必须有乙酸。但WEIMER等[9]和LIU等[35]的研究结果恰恰相反,推测乙酸的减少可能抑制己酸的生产。混菌培养产己酸过程中乙醇和丙酸的浓度比也会影响己酸产量,PIETER等[36]研究发现C.kluvveri与奇链延长混合菌群共同培养时,研究丙酸乙醇浓度比对最终产物光谱的影响,发现乙醇氧化成乙酸的量受乙醇和丙酸浓度比的影响,故乙醇、丙酸的比例高则会导致产物专一性较低,这一研究有利于任何乙醇驱动的链伸长反应。
通过乳酸氧化途径生产己酸的菌株中,乳酸含量会影响产物产量。研究发现以乳酸为唯一碳源和电子供体的产己酸菌株若最初乳酸含量过高,则最终产物会发生改变,变成丙酸;但是降低乳酸浓度后却没有发现己酸的积累,这一现象引发KUCEK等[37]的注意,认为初始乳酸值过高,乳酸转化为乳酰辅酶A,随后反应生成丙酰辅酶A促使丙酸生成。且当L-乳酸盐积累到诱导形成乳酰辅酶A时,由乳酸导向丙酮酸和偶数链延长产物将会很难实现,因此通过控制最初乳酸浓度对乳酸合成己酸的途径代谢控制十分重要。
2.4 己酸代谢途径的构建
Na-Rae[38]利用基因组尺度代谢网络重建技术构建M.elsdeniii基因组尺度代谢模型,更好地解析了在M.elsdeniii中己酸合成代谢途径。通过KEGG和Biocyc数据库中的代谢途径和生化反应初步构建在M.elsdeniii中己酸合成的基因组尺度代谢网络,经过通量分析模拟细胞代谢,研究不同细胞生长状态下产生己酸的分叉通路的通量分布,重建了己酸合成的基因组级代谢模型M.elsdenii iME375。研究提出3种酶:乙酰辅酶A水解/转移酶(acetyl-CoA hydrolase/transferase, cat)、铁氧化蛋白氧化还原酶和4-羟基丁基辅酶A脱水酶(4-hydroxybutyryl-CoA dehydratase, abfD)的存在可能会影响M.elsdenii最终产物的碳长度,而且以上这些酶都有助于酰基辅酶A的延长。最终,利用计算机模拟技术分析碳产量和氧化还原平衡,综合各种因素选择己酸高产代谢途径。
在代谢过程中,合成的丁酰-辅酶A可以通过β-酮硫解酶(β-ketothiolase, BktB)、3-羟基丁基辅酶A脱氢酶(3-hydroxybutyryl-CoA dehydrogenase, Hbd)、巴豆酸酶(crotonase, Crt)和反式烯酰辅酶A还原酶(trans-enoyl-CoA reductase, Ter)生成己酰-CoA[37]。CHEON等[39]首次构建由5~7个基因组成的产己酸通路,并将其整合进酵母菌株染色体中。通过修改己酸产量不稳定的1-己醇途径,采用了另一条链延长途径来保证稳定的己酸产量,并报道了一种新型有利于链延长的酶丙二酰辅酶A-酰基载体蛋白转酰酶(malonyl CoA-acyl carrier protein transacylase, MCT1)。通过整合7个基因乙酰辅酶A乙酰转移酶(acetyl CoA acetyltransferase, AtoB)、BktB、Crt、MCT1、Hbd、酰基辅酶A硫酯酶(acyl-CoA thioesterase, TES1)、Ter形成5个组合,完成在Kluyveromyces marxianus中己酸通路的构建,其中重组菌株H4A以半乳糖为底物生成己酸。
3 浓香型白酒生态系统中己酸菌与其他微生 物的关系
在浓香型白酒生态系统中,主要的产己酸微生物梭菌属细菌间,以及梭菌属细菌与其他微生物间存在种间相互作用。普遍认为,存在一种梭菌属细菌的产物可作为另一梭菌属细菌底物的种间互补代谢物质。例如,Clostridium ljungdahlii可以同化CO2和H2产生C.kluyveri发酵产己酸所需要的乙酸和乙醇[40]。此外,己酸菌与其他微生物存在物种间的氢转移。例如,甲烷菌可消除对己酸菌代谢产生反馈抑制作用的物质[41],因此,甲烷菌和己酸菌共培养时己酸产量提高[16]。然而,乳酸杆菌丰度与己酸生产呈负相关,高丰度的乳酸菌可以通过降低环境pH值、积累乳酸或分泌各种细菌素来抑制梭菌属微生物[42]。
研究发现,酵母菌与己酸菌共培养可有效促进己酸生产。嵇翔等[43]将C.kluyveri与酿酒酵母进行了混合培养,产量较纯培养提高了12.5%,酿酒酵母发酵过程中消耗氧气,促进丁酸产生和转化,提高己酸产量。万朕[5]研究得到相同结果,将己酸菌、丁酸菌以及酵母菌按照一定的比例混合成养窖菌液,可促进己酸生产。
作为固氮微生物的放线菌在与己酸菌共培养时可以提供氮源,放线菌产生的黑色素是产己酸的促进因子。曹新志等[44]将己酸菌和放线菌共培养,发现高浓度放线菌与己酸菌共培养会降低己酸的产量。栾兴社[45]发现链霉菌对己酸菌产己酸和产酯酵母生长都具有促进作用,且该菌具有较强的利用硫和硫化物的能力,提高了酒品质并为窖泥脱臭提供了新的生物技术。
4 己酸菌的应用
4.1 己酸菌在浓香型白酒酿造中的应用
窖泥质量关系着浓香型白酒的质量,窖泥是微生物发酵的温床,一般己酸菌在工业生产中的应用是通过调节窖泥中微生物微生态来实现的,根据窖泥中己酸菌的丰度及其产己酸能力使发酵过程中己酸乙酯含量不同,从而改善白酒品质,提高白酒在市场中的竞争力。
4.1.1 人工窖泥
人工窖泥的构建大部分是将分离出的己酸菌菌液加入窖泥、黄土、老窖泥、曲粉等中,并按照一定配比混合。将Clostridium guangxiense strain xsk1作为己酸菌来源进行应用,黄泥、粉末活性炭和颗粒活性炭载体人工窖泥己酸菌数量达到2.08×106 CFU/g[17]。鲁少文等[11]利用瘤胃科梭菌CPC-11制作人工窖泥并投入生产发酵35 d时,己酸乙酯含量较初始含量提升了2.74倍。
4.1.2 浓缩复合己酸菌液
浓缩复合菌液可以有效提高己酸含量,万朕[5]从窖泥中分离出来一株丁酸菌和一株己酸菌,发现丁酸菌在有醋酸盐和乙醇存在的培养基中产己酸。确定酯化最佳条件将产丁酸菌、产己酸菌及酵母2∶2∶3混合制成复合菌液投入生产,由最初3 100个己酸菌/g窖泥提高至48 000个己酸菌/g窖泥,达到增加己酸产量改善白酒品质的目的。科研工作者对于浓缩复合菌液[25, 28]应用于实际的研究越来越多,在工业生产中发挥出一定的积极作用。
4.2 己酸菌在其他领域的应用
己酸可通过一系列酮化和脱氢过程转化为燃料,生成的烷烃作为可以与其他化学物质混合生产生物柴油[10]。除发酵己酸外,己酸菌在废物利用方面具有广泛的应用,可将生活废料转化为能源为环境保护做出贡献。最新研究发现,以果蔬废弃物为原料,通过链延长将短链羧酸转化为中链羧酸达到果蔬垃圾的高利用度的生物处理[12]。菌株Clostridium carboxidivorans、Clostridium ragsdalei和Clostridium ljungdahlii可以从废料的气化或热解中获得乙醇和丁醇,Clostridium beijerinckii可以利用木质纤维素生成异丙醇和丁醇,Clostridium butyricum可以利用染料工业的副产物甘油高产1,3-丙二醇[13]。
5 展望
随着酿酒产业的发展,人们逐渐把目光投向重要功能性酿造微生物的研究,为己酸菌创造一个良好的生态环境,以达到促进浓香型白酒呈香物质己酸乙酯形成的目的。酿酒产业逐渐和生物科学技术相结合,出现很多关于己酸菌的分离筛选和菌株理化性质、代谢性质的研究。
关于己酸菌应用于窖池进行微生物结构调整达到提高酒品质的研究目前还不够全面,应该更加关注:(1)通过己酸菌代谢特征研究,从代谢途径进行研究提高己酸产量;(2)研究己酸菌共生菌株的代谢特征,寻找“增己降乳”菌株及代谢途径。并研究各个菌株代谢底物及中间代谢产物互相之间的关联性和协同性。
在掌握己酸菌基础理化性质和代谢特征的基础上,摸索产己酸能力强的菌株的最优培养条件,剖析己酸菌与其他菌株的共生关系,才能对护窖窖泥、提高酒品质菌液的配制准确把握。模拟固态发酵过程,观察微生态变化,将产己酸复合菌液投入生产应用实际,既可以使酿酒过程更加规范化、合理化、科学化,又可以应用于新窖池使窖泥中微生态不用经过漫长时间沉淀而迅速形成,提高工作效率;调整老化窖池的微生物结构,并为优化窖池窖泥途径和方法的探究提供坚实的理论基础。
[1] 胡晓龙. 浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
HU X L.Illuminating the correlation between anaerobic clostridial community diversity and quality of pit mud used for the production of Chinese strong-flavor liquor[D].Wuxi:Jiangnan University, 2015.
[2] 朱晓军. 浓香型白酒窖泥产酸菌群培养及新型己酸合成菌的鉴定与特性分析[D].无锡:江南大学,2018.
ZHU X J.Cultivation of acidogenic microbiota from pit mud and characterization of a novel caproate-producing bacterium in Chinese strong-aroma liquor fermentation[D].Wuxi:Jiangnan University, 2018.
[3] BOKULICH N A, BAMFORTH C W, MILLS D A.A review of molecular methods for microbial community profiling of beer and wine[J].Journal of the American Society of Brewing Chemists, 2012, 70(3):150-162.
[4] YAO F, YI B,SHEN C H, et al.Chemical analysis of the chinese liquor luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Scientific Reports, 2015, 5(1):1-6.
[5] 万朕. 窖泥功能菌筛选及DYH-1养窖液的应用研究[D].武汉:湖北工业大学,2011.
WAN Z.Isolation of function microorganism in the mud pit and the research of application for the DYH-1 pit solution[D].Wuhan:Hubei University of Technology, 2011.
[6] ZHU X Y, TAO Y, LIANG C, et al.The synthesis of n-caproate from lactate:A new efficient process for medium-chain carboxylates production[J].Scientific Reports, 2015, 5:14 360.
[7] SAN-VALERO P, FERN NDEZ-NAVEIRA
NDEZ-NAVEIRA  , VEIGA M C, et al.Influence of electron acceptors on hexanoic acid production by Clostridium kluyveri[J].Journal of Environmental Management, 2019, 242:515-521.
, VEIGA M C, et al.Influence of electron acceptors on hexanoic acid production by Clostridium kluyveri[J].Journal of Environmental Management, 2019, 242:515-521.
[8] YIN Y N, ZHANG Y F,KARAKASHEV D B, et al.Biological caproate production by Clostridium kluyveri from ethanol and acetate as carbon sources[J].Bioresour Technol, 2017, 241:638-644.
[9] WEIMER P J, STEVENSON D M. Isolation, characterization, and quantification of Clostridium kluyveri from the bovine rumen[J]. Applied Microbiology and Biotechnology, 2012, 94(2):461-466.
[10] SEEDORF H, FRICKE W F, VEITH B, et al.The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features[J].Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(6):2 128-2 133.
[11] 鲁少文, 魏翠翠, 李泽华, 等.新型己酸菌强化对人工窖泥培养过程中原核微生物群落结构及酸、酯含量的影响[J].应用与环境生物学报, 2020, 26(1):144-151.
LU S W, WEI C C, LI Z H, et al.Effects of a new caproic acid-producing bacteria on prokaryotic community structure and the acid ester content during the culture of artificial pit mud[J].Chinese Journal of Applied and Environmental Biology, 2020, 26(1):144-151.
[12] YU J N, HUANG Z X, WU P, et al.Performance and microbial characterization of two-stage caproate fermentation from fruit and vegetable waste via anaerobic microbial consortia[J].Bioresource Technololy, 2019, 284:398-405.
[13] LIBRATO V, BENVENUTI C,COELHO F, et al.Clostridium sp.as bio-catalyst for fuels and chemicals production in a biorefinery context[J].Catalysts, 2019, 9(11):963.
[14] BARKER H A.The production of caproic and butyric acids by the methane fermentation of ethyl alcohol[J].Archiv Für Mikrobiologie, 1937, 8(1-4):415-421.
[15] KENEALY W R, CAO Y, WEIMER P J.Production of caproic acid by cocultures of ruminal cellulolytic bacteria and Clostridium kluyveri grown on cellulose and ethanol[J].Applied Microbiology and Biotechnology, 1995, 44(3-4):507-513.
[16] KENEALY W R, WASELEFSKY D M.Studies on the substrate range of Clostridium kluyveri the use of propanol and succinate[J].Arch Microbiol, 1985, 141(3):187-194.
[17] 勾文君, 田源, 孔小勇, 等.洋河酒窖泥细菌群落结构与菌株产酸能力分析[J].微生物学通报, 2020, 47(6):1 651-1 661.
GOU W J, TIAN Y, KONG X Y, et al.Bacterial composition in pit mud of Yanghe liquor and identification of acid producing bacteria[J].Microbiology China, 2020, 47(6):1 651-1 661.
[18] ZHU X Y, ZHOU Y, WANG Y, et al.Production of high-concentration n-caproic acid from lactate through fermentation using a newly isolated Ruminococcaceae bacterium CPB6[J].Biotechnol Biofuels, 2017, 10(1):1-12.
[19] STR UBER H, LUCAS R, KLEINSTEUBER S.Metabolic and microbial community dynamics during the anaerobic digestion of maize silage in a two-phase process.[J].Applied and Environmental Microbiology, 2016, 100(1):479-491.
UBER H, LUCAS R, KLEINSTEUBER S.Metabolic and microbial community dynamics during the anaerobic digestion of maize silage in a two-phase process.[J].Applied and Environmental Microbiology, 2016, 100(1):479-491.
[20] 赵辉, 敞颜, 王葳, 等.浓香型白酒窖泥中高产己酸兼性厌氧细菌的分离鉴定[J].食品科学, 2012, 33(5):177-182.
ZHAO H, CHANG Y, WANG W, et al.Isolation and identification of facultative anaerobic strains with high yield of hexanoic acid from luzhou-flavor liquor pit mud[J].Food Science, 2012, 33(5):177-182.
[21] MAROUNEK M, FLIEGROVA K, BARTOS S.Metabolism and some characteristics of ruminal strains of Megasphaera elsdenii[J].Applied and Environmental Microbiology, 1989, 55(6):1 570-1 573.
[22] RODDICK F A, BRITZ M L.Production of hexanoic acid by free and immobilised cells of Megasphaera elsdenii:Influence of in-situ product removal using ion exchange resin[J].Journal of Chemical Technology & Biotechnology, 1997, 69(3):383-391.
[23] LOUBIERE P, PACAUD S, GOMA G, et al.The effect of formate on the acidogenic fermentation of methanol by Eubacterium limosum[J].Journal of General and Applied Microbiology, 1987, 33(6):463-470.
[24] JEON Y, KIM B C, YOUNGSOON UM Y, et al.Production of hexanoic acid from d -galactitol by a newly isolated Clostridium sp.bs-1[J].Applied Microbiology and Biotechnology, 2010, 88(5):1 161-1 167.
[25] KIM B C, JEON B S, KIM S, et al.Caproiciproducens galactitolivorans gen.nov., sp.nov., a bacterium capable of producing caproic acid from galactitol, isolated from a wastewater treatment plant[J].International Journal of Systematic and Evolutionary Microbiology, 2015, 65(12):4 902-4 908.
[26] GENTHNER B R, DAVIS C L, BRYANT M P.Features of rumen and sewage sludge strains of Eubacterium limosum, a methanol- and H2-CO2-utilizing species[J].Applied and Environmental Microbiology, 1981, 42(1):12-19.
[27] WALLACE R J, CHAUDHARY L C, MIYAGAWA E, et al.Metabolic properties of Eubacterium pyruvativorans, a ruminal ‘hyper-ammonia-producing’ anaerobe with metabolic properties analogous to those of Clostridium kluyveri[J].Microbiology, 2004, 150(9):2 921-2 930.
[28] SPIRITO C M, RICHTER H, RABAEY K, et al.Chain elongation in anaerobic reactor microbiomes to recover resources from waste[J].Current Opinion in Biotechnology, 2014, 27:115-122.
[29] CAVALCANTE W D A,LEIT O R C, GENHERING T A, et al.Anaerobic fermentation for n-caproic acid production:A review[J].Process Biochemistry, 2017, 54:106-119.
O R C, GENHERING T A, et al.Anaerobic fermentation for n-caproic acid production:A review[J].Process Biochemistry, 2017, 54:106-119.
[30] WU Q L,BAO X,GUO W Q, et al.Medium chain carboxylic acids production from waste biomass:Current advances and perspectives[J].Biotechnology Advances, 2019, 37(5):599-615.
[31] GROOTSCHOLTEN T I M, STRIK D P B T B, STEINBUSCH K J J, et al.Two-stage medium chain fatty acid (MCFA) production from municipal solid waste and ethanol[J].Applied Energy, 2014, 116:223-229.
[32] HINO T, KURODA S.Presence of lactate dehydrogenase and lactate racemase in Megasphaera elsdenii grown on glucose or lactate[J].Applied and Environmental Microbiology, 1993, 59(1):255-259.
[33] PRABHU R, ALTMAN E, EITEMAN M A.Lactate and acrylate metabolism by Megasphaera elsdenii under batch and steady-state conditions[J].Applied and Environmental Microbiology, 2012, 78(24):8 564-8 570.
[34] DIENDER M, STAMS A J M, SOUSA D Z.Production of medium-chain fatty acids and higher alcohols by a synthetic co-culture grown on carbon monoxide or syngas[J].Biotechnology for Biofuels, 2016, 9(1):82.
[35] LIU Y H, LYU F,SHAO L M, et al.Alcohol-to-acid ratio and substrate concentration affect product structure in chain elongation reactions initiated by unacclimatized inoculum[J].Bioresource Technology, 2016, 218:1 140-1 150.
[36] CANDRY P, ULCAR B, PETROGNANI C, et al.Ethanol:Propionate ratio drives product selectivity in odd-chain elongation with Clostridium kluyveri and mixed communities[J].Bioresource Technology, 2020, 313:123 651.
[37] LEE N R,LEE C H,LEE D Y.Conversion of l-lactate into n-caproate by a continuously fed reactor microbiome[J].Water Research, 2016, 93:163-171.
[38] NA-RAE LEE, CHOONG HWAN LEE, DONG-YUP LEE, et al.Genome-scale metabolic network reconstruction and in silico analysis of hexanoic acid producing Megasphaera elsdenii[J].Microorganisms, 2020, 8(4):539.
[39] CHEON Y, KIM J S,PAPK J B, et al.A biosynthetic pathway for hexanoic acid production in Kluyveromyces marxianus[J].Journal of Biotechnology, 2014, 182-183:30-36.
[40] RICHTER H, MOLITOR B, DIENDER M, et al.A narrow pH range supports butanol, hexanol, and octanol production from syngas in a continuous Co-culture of Clostridium ljungdahlii and Clostridium kluyveri with in-line product extraction[J].Front Microbiology, 2016, 7:1 773.
[41] 叶光斌, 罗惠波, 杨晓东, 等.基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J].食品科学, 2013, 34(17):176-181.
YE G B, LUO H B, YANG X D, et al.Community structure of prokaryotes in pit mud of Lu-flavor liquor from Luzhou prefecture based on culture-independent approach[J].Food Science, 2013, 34(17):176-181.
[42] TAO Y, LI J B, RUI J P, et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of chinese strong-flavored liquor[J].Applied and Environmental Microbiology, 2014, 80(7):2 254-2 260.
[43] 嵇翔, 徐岩, 穆晓清, 等.克氏梭菌和酿酒酵母混合培养提高己酸产量[J].食品与生物技术学报, 2017, 36(9):922-926.
JI X, XU Y, MU X Q, et al.Improvement of caproic acid production in the mixed culture of Clostridium kluyveri and Saccharomyces cerevisiae[J].Journal of Food Science and Biotechnology, 2017, 36(9):922-926.
[44] 曹新志, 黄春萍, 熊俐, 等.共培养对己酸菌生长代谢影响的初步研究[J].中国酿造, 2010,29(11):35-38.
CAO X Z, HUANG C P, XIONG L, et al.Effect of co-cultivation on growth and metabolism of caproic acid bacteria[J].China Brewing, 2010,29(11):35-38.
[45] 栾兴社. 曲酒发酵池中兼性自养型链霉菌的分离与特征研究[J].食品与发酵工业, 2001,27(11):17-20.
LUAN X S.Study on isolation and characteristics of facultatively autotrophic streptomyces in fermentation pit of Daqu chinese liquor[J].Food and Fermentation Industries, 2001,27(11):17-20.