直链麦芽低聚糖是由2~10个葡萄糖分子以α-1,4糖苷键链接而成的直链低聚糖,是以淀粉为主要原料,由特异性的直链麦芽低聚糖生成酶经过酶解、转苷等过程而得到的一种小分子糖,具有独特的理化特性和生理功能,在食品、医药、化工等领域有着广泛的应用[1]。但目前酶法制备直链麦芽低聚糖工业中还存有不足,如生产效率低,生产周期普遍在24 h以上;间歇批量式生产后需对产物进行灭酶处理,得到目的产物前需对产物进行分离提纯等,造成大量能源损耗[2]。
酶膜反应器的应用则可在一定程度上解决上述问题,酶膜反应分离技术是在反应过程中即可将产物与酶和底物分离开的一种新型反应技术[3],其原理可概括为在酶促反应过程中,通过将反应体系与膜分离设备进行耦联,在压力驱动下使反应体系中的部分或全部产物从反应体系中选择性分离,一定程度上解除产物抑制,加快反应进程,达到边生产边分离的生产模式[4-5]。
但在实际生产过程中,在淀粉及多糖类高黏度的底物环境下,膜组件会因机械作用或理化作用而引起污染物的沉积、吸附,从而出现膜污染现象,进而造成膜的处理能力下降,生产效率降低[6],因此有效避免及消除膜污染是膜分离技术能否进一步扩宽应用范围的重要因素。HERMIA[7]最早提出了4种典型的膜污染模型理论;随后FIELD等[8]在其基础上对模型及应用范围进行修正和优化;杨文澜[9]研究了不同孔径的陶瓷膜在处理生活污水过程中的污染形成机理,认为不同孔径的陶瓷膜受不同污染模型主导;张翼[10]将被啤酒灭菌废水所污染的陶瓷膜利用高压水及无机试剂浸泡后,使陶瓷膜通量恢复至90%左右;LEE等[11]应用超声技术将被污染的陶瓷膜通量最高恢复至94.2%。但目前关于由淀粉及多糖类污染物造成的膜污染机制及膜再生方面的研究还鲜有报道[12]。
本文主要针对以20% (质量分数)玉米淀粉为底物,应用酶膜反应器制备直链麦芽低聚糖工艺中出现的膜污染现象,对陶瓷膜污染机制进行分析,并在此基础上研究不同清洗方案对污染后陶瓷膜的再生效果,以期为陶瓷膜在淀粉糖工业中的膜污染及膜再生提供指导。
1 材料与方法
1.1 实验材料
食用玉米淀粉(含水质量分数11.63%),山东寿光巨能金玉米开发有限公司;直链麦芽低聚糖生成酶(malto-oligosaccharide-forming amylase,MFA酶)(酶活力120 U/mL),本实验室发酵所得;耐高温α-淀粉酶(酶活力7 000 U/mL),江苏省博利生物制品有限公司;NaOH、柠檬酸、NaClO等其他试剂均为分析纯,国药集团化学试剂有限公司。
1.2 实验设备
CeraMem-0100陶瓷膜/管式膜小试设备,膜组件为多通道管式陶瓷膜,膜长500 mm,有效膜面积为0.12 m2,平均孔径20 nm,新膜纯水通量约为255 L/(m2·h)(水温25 ℃,压力0.1 MPa,循环流速1 000 L/h条件下测得,下同),厦门福美科技有限公司;HH-601型超级水浴设备,常州金坛良友仪器有限公司。完整设备由反应罐、超滤泵、膜组件、收集罐等组成,如图1所示。
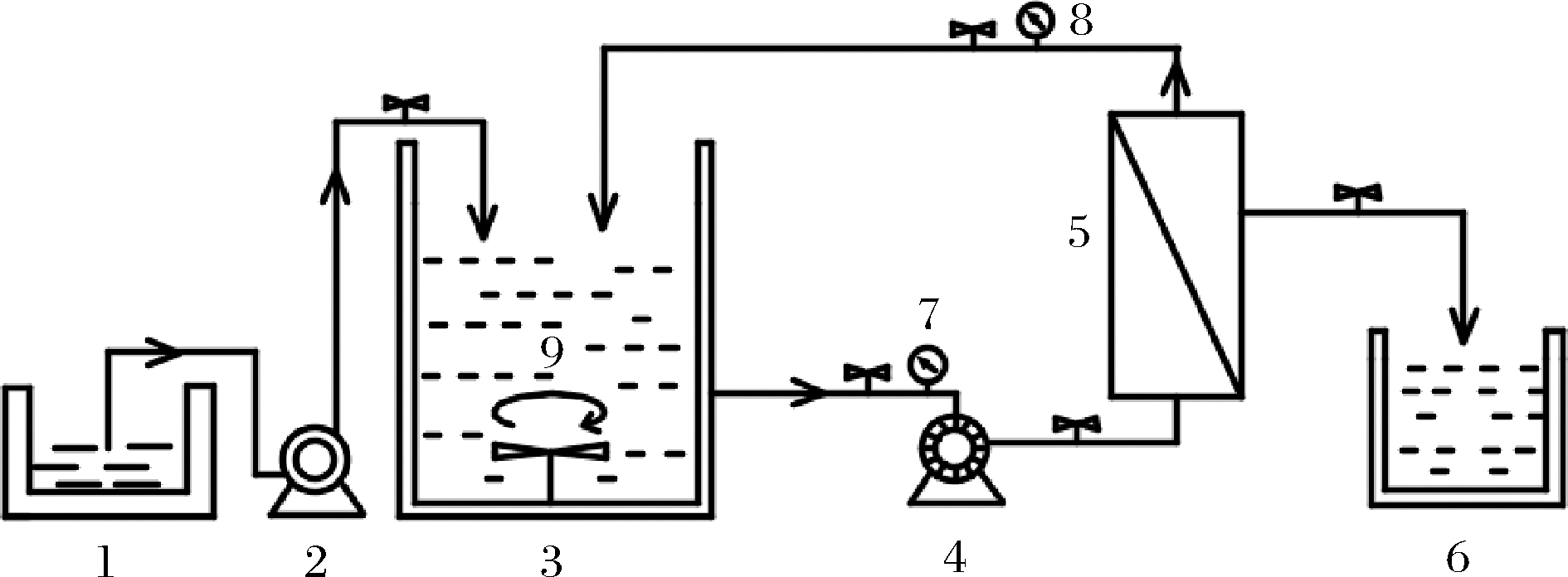
1-恒温水槽;2-蠕动泵;3-反应罐;4-超滤泵;5-膜组件; 6-收集罐;7-进料力表;8-流量计;9-搅拌桨
图1 应用膜反应器制备直链麦芽低聚工艺流程图
Fig.1 Process flow chart of preparing linear malt-oligomerization using membrane reactor
实验过程中可通过调节设备频率及循环阀门的开度调整设备压力等各项参数,管路结构如图2所示。
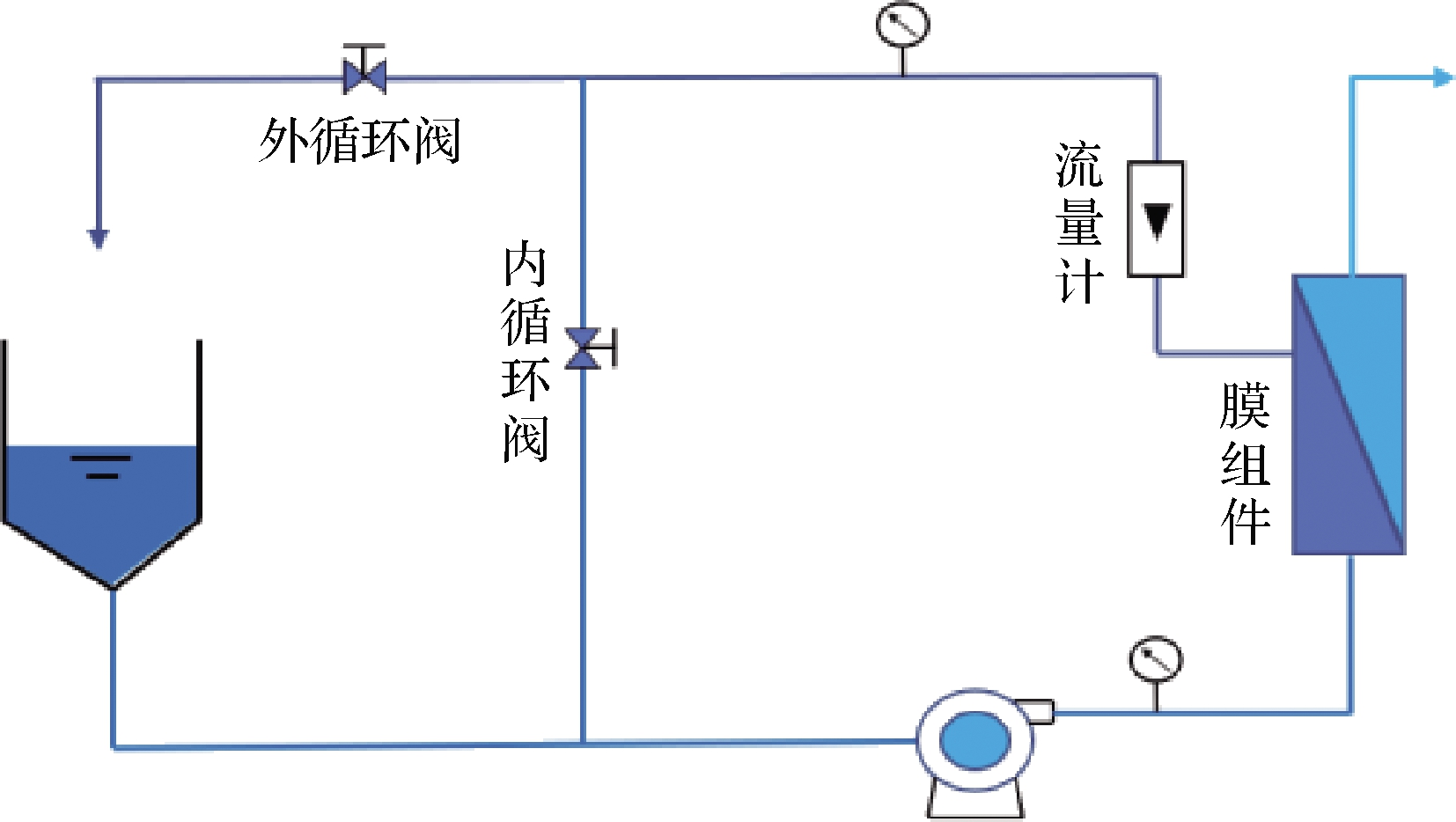
图2 设备管路结构图
Fig.2 Equipment pipeline structure diagram
1.3 实验方法
1.3.1 渗透通量的测定
渗透通量,指单位时间内,透过单位膜面积的渗透液的体积,按公式(1)计算:
(1)
式中:J,渗透通量,L/(m3·h);V,渗透液体积,L;A,有效膜面积,m2;t,过膜时间,h。
1.3.2 渗透通量恢复率的测定
渗透通量恢复率,指污染后的膜组件经清洗后渗透通量的恢复效果,本实验在25 ℃、压力0.1 MPa下以纯水为介质进行测定[13],按公式(2)计算:
(2)
式中:r,渗透通量恢复率;JQ,膜经清洗后的纯水渗透通量,L/(m2·h);J0,新膜的纯水渗透通量,L/(m2·h)。
1.3.3 膜清洗流程
对污染后的陶瓷膜采用3步清洗方案,首先在反应结束后先用清水完全顶出残余物料,然后向反应罐中再加入清水,遵循低压高流速原则[14]进行清洗,调节设备参数使清洗条件保持在物料流速1 000 L/h、过膜压力0.1 MPa,同时外循环阀门开度调至最大,此条件下充分循环冲洗40 min 后排出污水;随后加入不同清洗剂并调至其对应清洗温度循环清洗40 min,排出物料;最后再加入清水60 ℃同条件循环40 min。
1.3.4 数据处理
实验结果为3次独立实验的平均值,用平均值和标准偏差表示。采用Origin Pro 8.0软件分析数据和作图,用SPSS 20.0和STATISTICA 12.0软件进行统计学分析和非标准模型拟合分析(P<0.05)。
2 结果与分析
2.1 污染物来源及组成
该陶瓷膜设备所运行的环境为:20%(质量分数)玉米淀粉在MFA酶的催化作用下制备直链麦芽低聚糖体系,经产物分析发现有95%的淀粉底物被水解成小分子低聚糖并被分离出体系,所用MFA酶液为粗酶液,其中含有少量碳源、氮源等不溶物,反应结束时料液中总固体含量约为1%~2%;该MFA酶分子质量为58 kDa,绝大部分酶蛋白分子被拦截在截留侧,且玉米淀粉中同样含有少量蛋白成分;反应结束后体系pH值为5.5~6.3。综合分析,在实验中造成陶瓷膜污染的主要成分为淀粉、多糖和少量蛋白。
2.2 膜污染理论模型及污染机制分析
在HERMIA[7]、FIELD等[8]的理论基础上,经过后人对模型的不断优化,最终逐渐形成了适用于错流过滤的4种基本污染理论模型,即滤饼模型(cake filtration model)、部分堵塞模型(intermediate blocking model)、完全堵塞模型(complete blocking model)和内部堵塞模型(internal blocking model)[15],如图3所示。
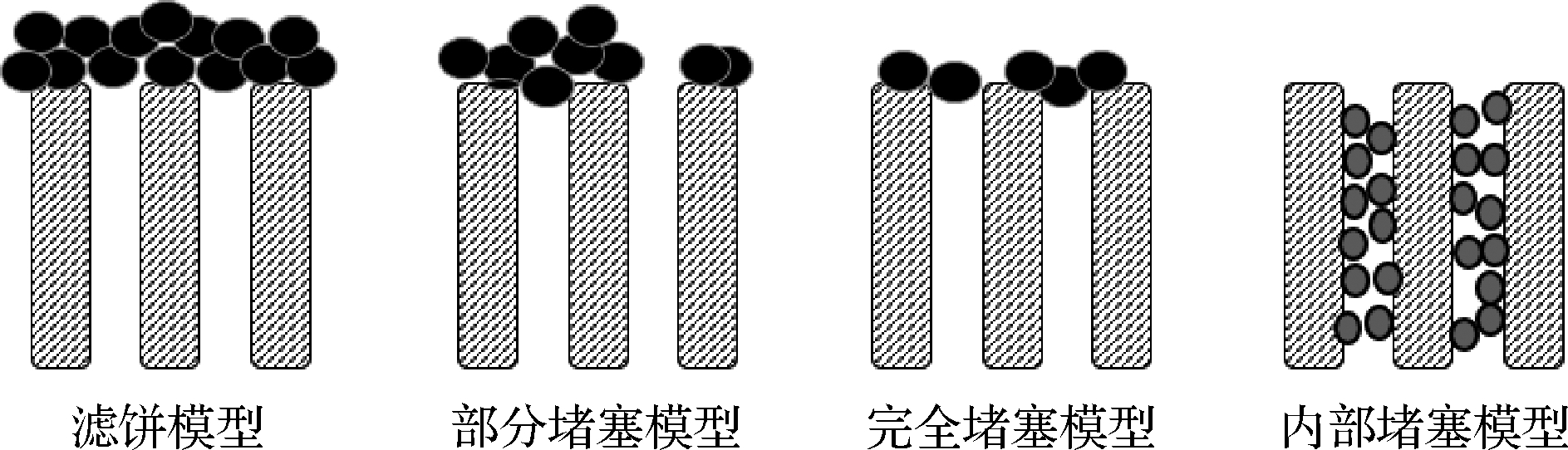
图3 四种典型的膜污染模型
Fig.3 Four typical membrane fouling models
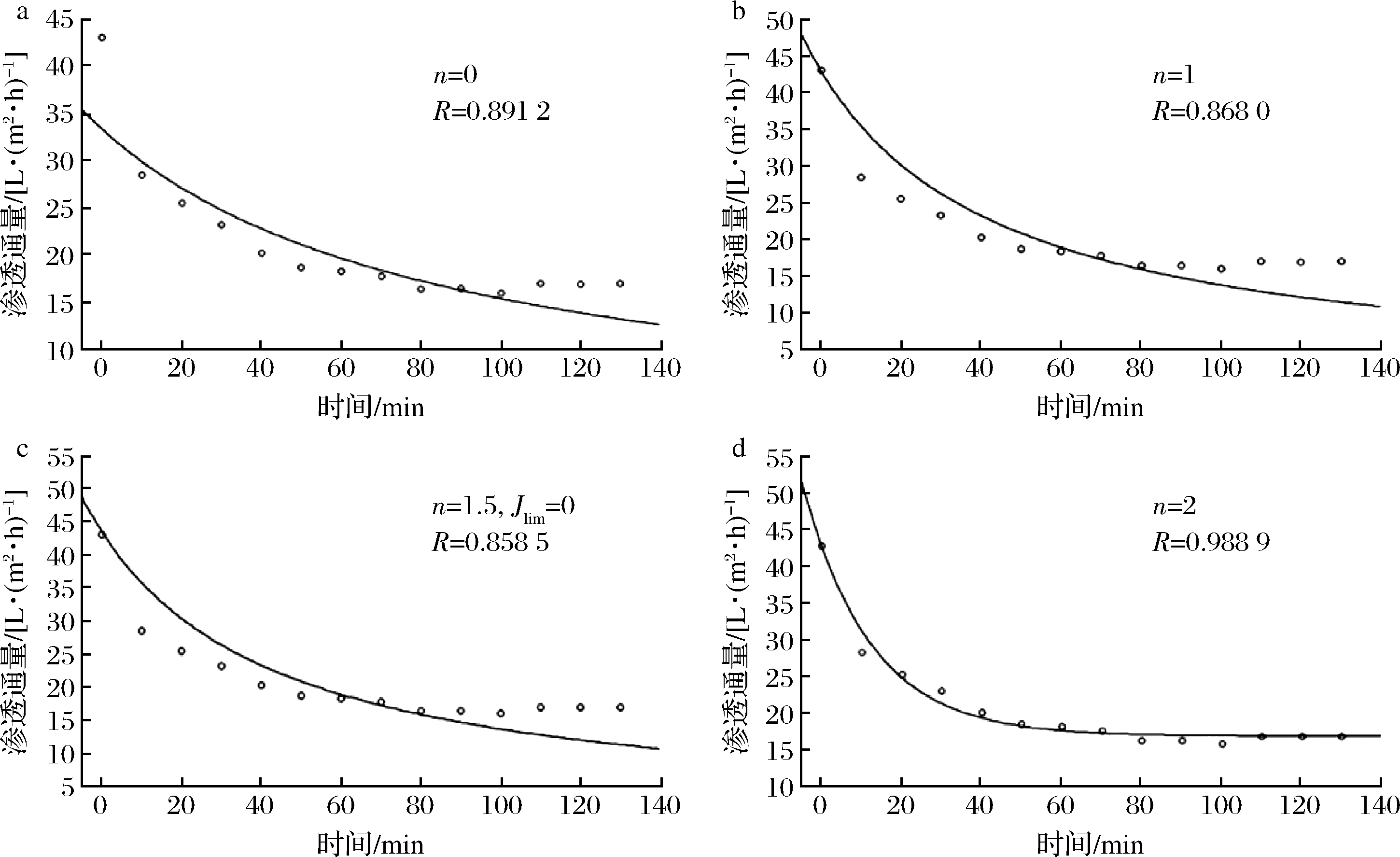
(1)滤饼模型:当污染物颗粒粒径大于膜孔径时,料液中的大分子物质和凝胶类物质在膜表面发生沉积和絮凝,形成一定面积、一定厚度的滤饼污染层,造成膜渗透通量下降,对应模型如公式(3)所示(n=0):
(3)
式中:G即K0,模型常数;Jlim,稳态时的渗透通量,L/(m2·h);J,反应结束后的渗透通量,L/(m2·h);J0,反应初始时膜渗透通量,L/(m2·h);t,反应时间,min;n,模型参数[16](下同)。
(2)部分堵塞模型:当污染物粒径小于孔径1~2的数量级时,污染物以“架桥”的方式在膜孔附近沉积但并不完全堵塞膜孔[9, 17],此时污染物逐渐在膜表面形成沉积层。如公式(4)所示(n=1):
(4)
式中:σ即K1,模型常数。
(3)完全堵塞模型:当物料中的污染物粒径与膜孔径相近时,形成的污染类型,此时污染物将部分膜孔完全“封死”,对膜的处理能力造成较大影响。如公式(5)所示(n=2):
J=Jlim+(J0-Jlim)e-K2t
(5)
式中:K2,模型常数。
(4)内部堵塞模型:污染物粒径小于孔径3个数量级时形成的污染[17],污染物通过机械作用或吸附作用附着在膜孔内部,并随着时间的延续不断累积,影响膜的分离特性,模型如公式(6)所示(n=1.5,Jlim=0):
(6)
式中:[(KS′/2)A0.5]整体即K1.5,模型常数[16]。
为更好地分析陶瓷膜反应器水解玉米淀粉过程中的膜污染机制,应用STATISTICA 12.0软件对上述4种非标准模型进行非线性回归拟合分析,当模型参数n分别为0、1、1.5、2时,对应的拟合结果如图4所示,滤饼模型、部分堵塞模型、内部堵塞模型、完全堵塞模型的拟合度R分别为0.892 1、0.868 0、0.858 5和0.988 9;模型系数Kn分别为1.73×10-4、2.35×10-3、5.88×10-2、2.48×10-4。说明该体系中,完全堵塞模型占主导地位,与此同时其他3种污染方式共存,且影响程度较为接近。在反应初期,淀粉底物以大分子形式出现,最先在膜表面形成污染层,使膜通量快速下降,随着反应的进行,污染物被酶水解分子质量逐渐减小,当污染物粒径与膜孔径相近时,部分膜孔被污染物完全堵塞,而更小粒径的污染物则较难进一步进入孔内形成污染使得其拟合度R值最小[18]。
针对上述污染机制,初步确定了几种清洗方案及操作条件如表1所示,该体系下污染物多为水解后残留的淀粉大分子、多糖类物质和少量蛋白,较高温度的纯水对其具有较好的溶解性,可起到一定的清洗效果;王恺等[19]研究发现柠檬酸与淀粉发生酯化反应形成的柠檬酸酯淀粉,其黏度发生明显降低,对污染物有一定的清除效果;NaOH溶液及NaOH与NaClO的复配溶液,可使污染物凝胶层和吸附层发生松动,氧化剂对蛋白质、脂类等有机物的去除可起到增强的效果[14],对该体系下的污染物有一定的清洁作用;α-淀粉酶具有强水解作用,可水解淀粉大分子,起到清除污染层、恢复膜通量的效果。基于上述理论,将清洗方案确定为纯水清洗、柠檬酸清洗、NaOH清洗、NaOH和NaClO的复配清洗以及α-淀粉酶清洗。
表1 不同膜清洗方案及操作条件
Table 1 Different membrane cleaning programs and operating conditions
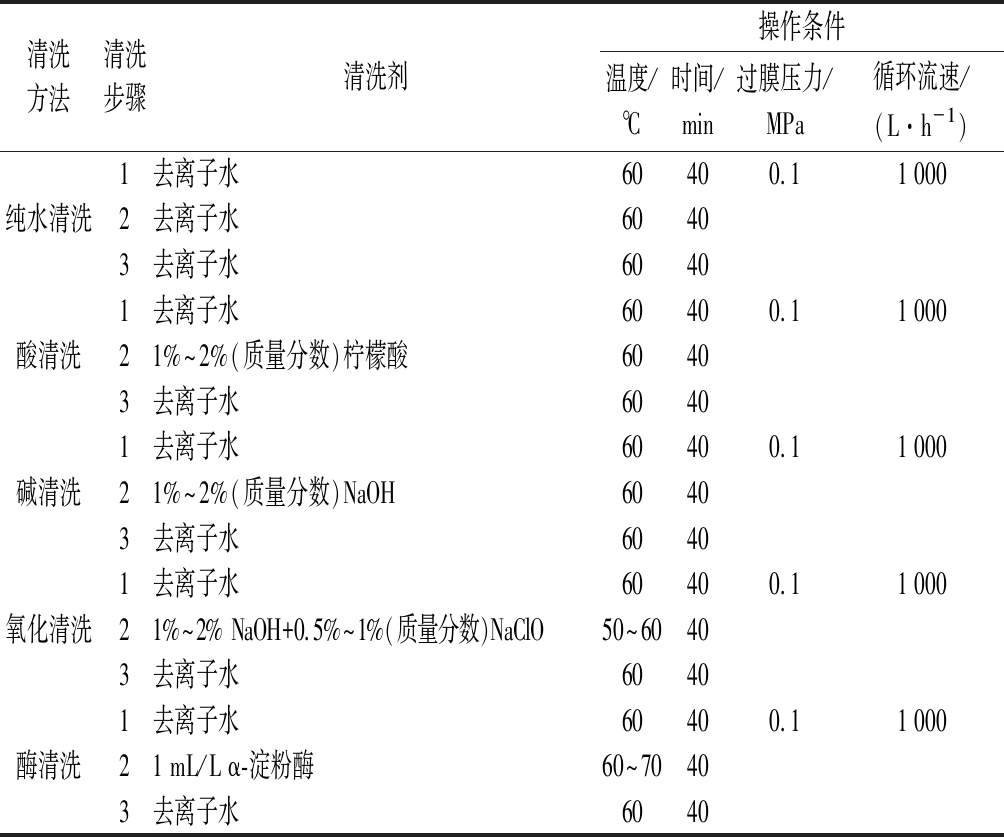
清洗方法清洗步骤清洗剂操作条件温度/℃时间/min过膜压力/MPa循环流速/(L·h-1)1去离子水60400.11 000纯水清洗2去离子水60403去离子水60401去离子水60400.11 000酸清洗21%~2%(质量分数)柠檬酸60403去离子水60401去离子水60400.11 000碱清洗21%~2%(质量分数)NaOH60403去离子水60401去离子水60400.11 000氧化清洗21%~2% NaOH+0.5%~1%(质量分数)NaClO50~60403去离子水60401去离子水60400.11 000酶清洗21 mL/L α-淀粉酶60~70403去离子水6040
2.3 纯水清洗
应用纯水对污染后的陶瓷膜进行清洗复性,过程如图5所示,清洗开始阶段,膜渗透通量恢复率随清洗时间的延长不断恢复,此过程中高温高流速的清水可洗去设备及管路中的部分残余物料,在高流速的作用下膜表面的污染物沉积层和凝胶层发生松动,并随物料排出体系;第二阶段将废水排出体系后,加入新的纯水继续清洗40 min,发现其渗透通量继续提高。原因可能是第一阶段所用水中混合了大量残余污染物,使得渗透通量难以继续提高,但纯水对膜孔内污染物及蛋白等有机类污染物的清洁效率有限,导致第三阶段渗透通量恢复率依旧没有明显提升。清洗结束后,渗透通量恢复率仅为71.53%。
a-滤饼模型拟合曲线;b-部分堵塞模型拟合曲线;c-内部堵塞模型拟合曲线;d-完全堵塞模型拟合曲线
图4 四种污染模型拟合曲线
Fig.4 Fitting curves of four pollution models
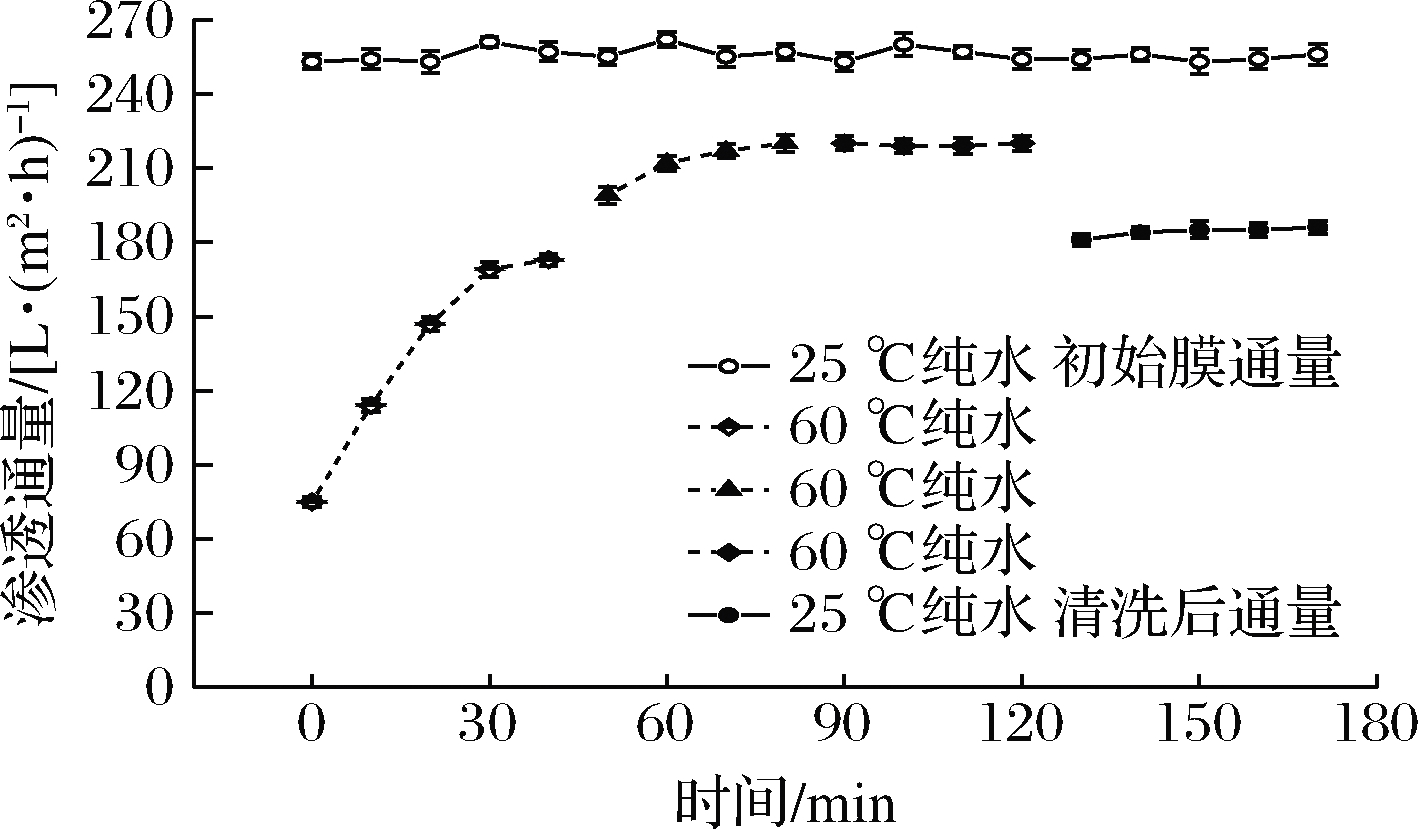
图5 纯水清洗对膜通量恢复的影响
Fig.5 The effect of pure water cleaning on membrane flux recovery
2.4 柠檬酸清洗
将膜清洗过程中第二阶段所用清洗剂改为1.5%的柠檬酸溶液,结果如图6所示,经过3个阶段清洗,最终在25 ℃下测得纯水通量为227 L/(m2·h)。原因可能是较低的pH值可在一定程度上提高淀粉分子的溶胀程度,提高淀粉的溶解度,而柠檬酸上的羧基可与淀粉分子上的羟基发生酯化反应形成柠檬酸酯淀粉[20],降低淀粉黏度[19],加之该体系下的玉米淀粉已经过糊化,暴露出更多的活性末端,有利于与柠檬酸的结合;同时,在酸性条件下,柠檬酸会使淀粉及多糖类物质会发生一定程度的降解,使污染物溶解度提高,有利于膜通量的恢复[21]。最终膜渗透通量恢复率达到86.92%,但仍未达到90%以上,可能原因为一方面该条件未能充分达到酯化反应所需条件[20],淀粉与柠檬酸的酯化程度有限;另一方面陶瓷膜在酸性条件下膜孔收缩,膜强度提高[22],未能有效除去孔内的污染物,从而使得渗透通量没能恢复至更高水平。
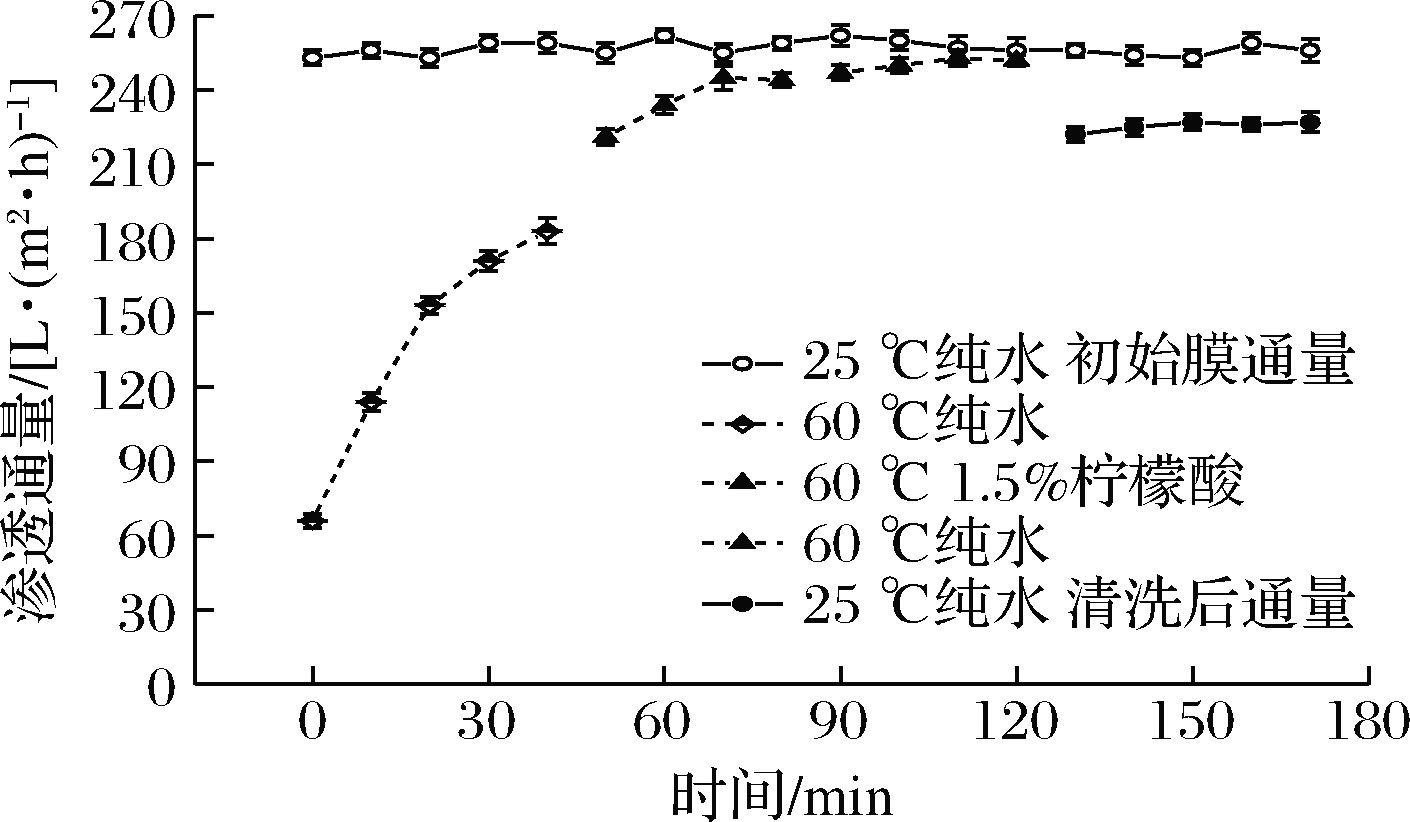
图6 柠檬酸清洗对膜通量恢复的影响
Fig.6 The effect of citric acid cleaning on membrane flux recovery
2.5 碱清洗
将膜清洗过程中第二阶段清洗剂改为1%~2%的NaOH溶液,结果如图7所示,经过前2个阶段的清洗后,改用纯水在同条件下清洗40 min发现膜通量相较于酸清洗明显提高,甚至超过25 ℃下新膜的纯水通量,原因可能是60 ℃较高的水温会使模孔径发生可逆扩张,通量增大;随后排净废液,并使体系pH恢复至中性。测得25 ℃下纯水通量达到245 L/(m2·h),膜渗透通量恢复率达到95.7%。谷磊等[14]利用0.5%~1%的NaOH溶液在高流速下清洗被污染的陶瓷膜,使陶瓷膜通量恢复至96%以上,认为强碱清洗剂可破坏蛋白的凝结状态,改变蛋白的堆积结构,对膜表面及膜孔内的污染物都有着良好的清洁效果。而本实验中所用MFA酶分子质量为58 kDa,较为接近膜的截留分子质量50 kDa,生产过程中在压力的作用下易使酶蛋白进入膜孔形成污染,而NaOH溶液不仅可以使陶瓷膜膜孔充分放松,有利于对孔内污染物的清洗[22],同时可使污染物中的蛋白质变性,使其聚集结构变得松散,促进其溶出,从而起到清洗膜表面和膜孔内部的双重作用[23]。
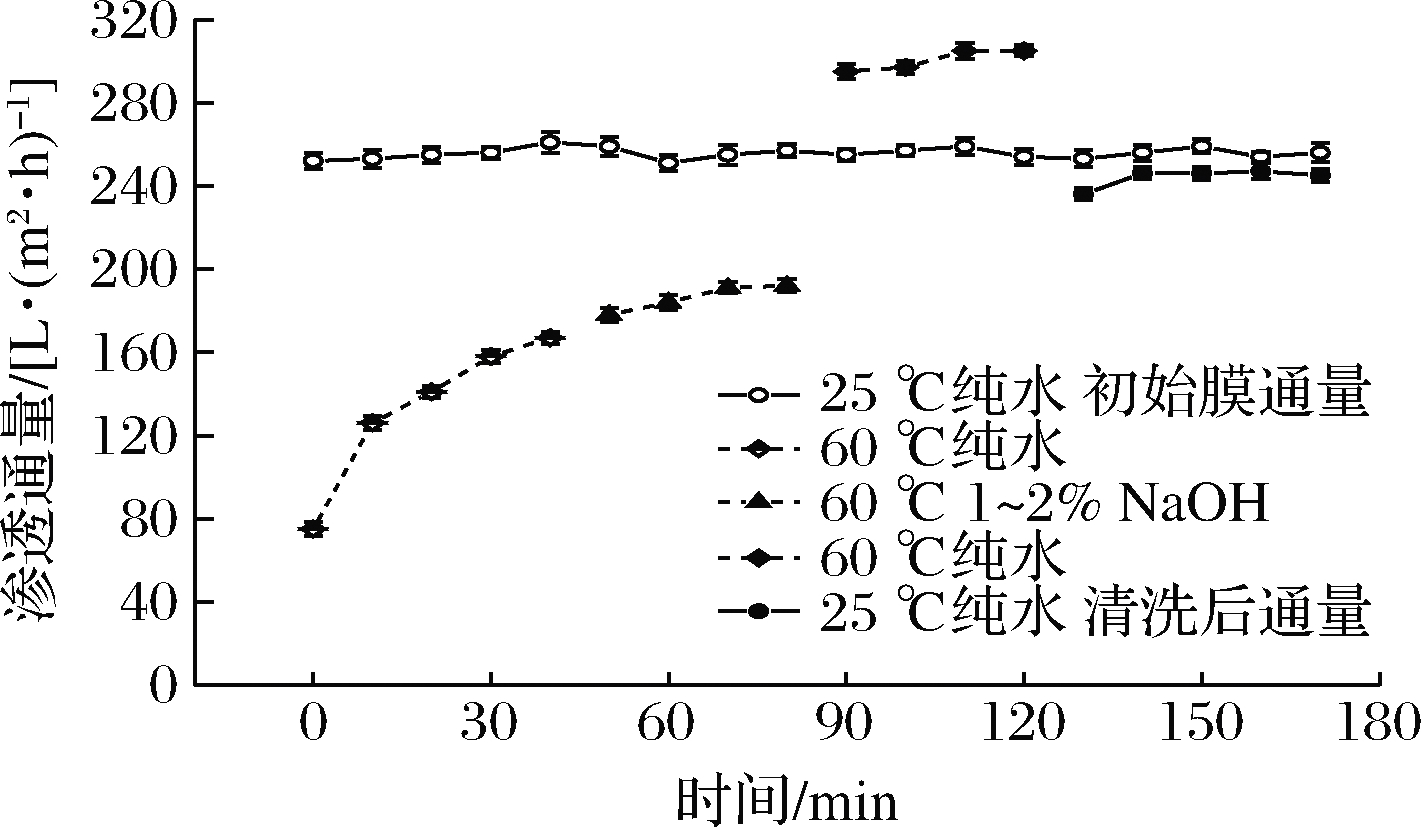
图7 NaOH清洗对膜通量恢复的影响
Fig.7 The effect of NaOH solution cleaning on membrane flux recovery
2.6 氧化剂清洗
将第二步所用试剂改为1%~2%的NaOH和0.5%~1%的NaClO复配溶液,并将pH值调至11~12,结果如图8所示,第二阶段清洗40 min后发现渗透通量也超过25 ℃下的新膜通量;当温度降至25 ℃时,膜纯水渗透通量达到254 L/(m2·h),通量恢复率接近100%。章小同等[24]利用2%的NaOH和0.5%的NaClO混合溶液,清洗被含有一定浓度蛋白的淀粉糖桨所污染的陶瓷膜发现,二者复配使用可对膜表面及孔内的有机类污染物和糖浆起到良好的去除效果,最终使膜通量恢复至100%,与本实验结果较为接近。因为氧化剂NaClO与NaOH共同使用,在强碱性条件下使膜孔放松,提高了对孔内污染物的清洗强度,同时在强氧化剂的作用下,加剧了蛋白变性,使污染物更易溶出,有效去除了孔内的沉积层和凝胶层,二者复配使用优于单独清洗[18]。但该清洗方法成本相对较高,且废液pH值在10以上,对环境存在一定的污染性,需中和处理后进行排放,后续有待对二者浓度及配比进行进一步研究,以降低成本和减小对环境的污染。
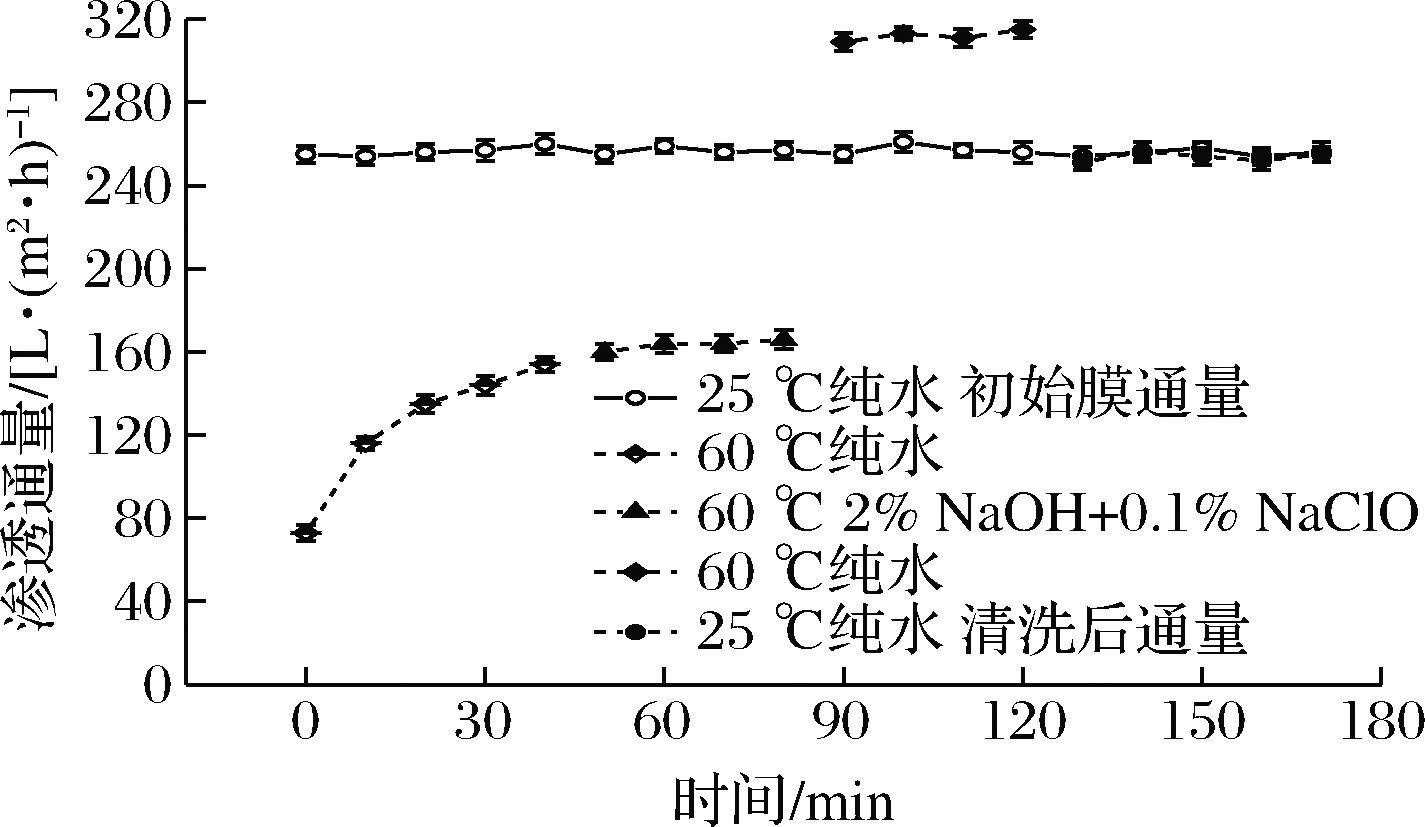
图8 氧化剂清洗对膜通量恢复的影响
Fig.8 The effect of oxidant cleaning on membrane flux recovery
2.7 淀粉酶清洗
将第二步所用试剂改为1 mL/L的α-淀粉酶,结果如图9所示,最终将体系温度降至25 ℃测得纯水通量为236 L/(m2·h),膜渗透通量恢复率达到92.31%。原因在于α-淀粉酶具有较强的水解能力,可以水解未充分反应的淀粉大分子[25],污染物中大部分均可被该酶水解。经实验室测定,该高温α-淀粉酶在70~80 ℃时酶活力可达到80%以上,且在高流速下,由于物料与膜表面的摩擦作用,会使体系温度略有提高[22],可进一步提高该酶的催化活力。但由于酶对膜孔内污染物和蛋白的清洗效果有限,使得最终膜渗透通量恢复率未能达到更高水平。赵延均等[26]先利用胰蛋白酶,后利用NaOH溶液清洗被蛋白和固形物污染的超滤膜发现,两步清洗效果优于二者单独清洗,最终使膜通量恢复至95%以上。二者共同使用,一方面弥补了酶对于孔内污染物清洁能力的不足,另一方面酶对其底物的作用效率高于无机试剂;第二步NaOH可同时将第一步中的蛋白酶充分去除,避免了二次污染。后续研究中可借鉴此方案来进一步提高清洗效果,降低清洗成本。
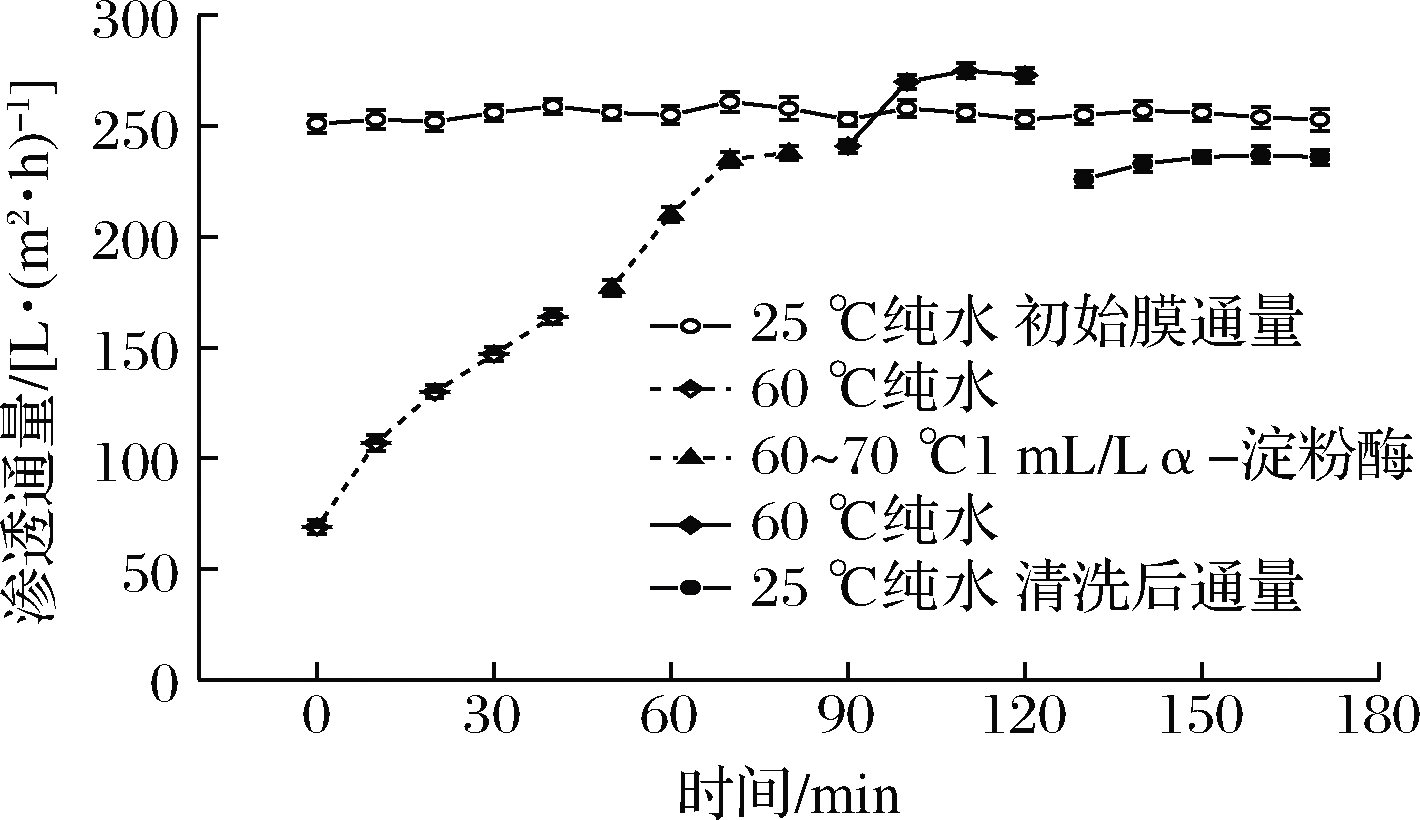
图9 淀粉酶清洗对膜通量恢复的影响
Fig.9 The effect of amylase cleaning on membrane flux recovery
3 结论
本文对于应用陶瓷膜反应器制备直链麦芽低聚糖体系中发生的膜污染,通过模型拟合,发现其污染机制受完全堵塞模型所主导,其他3种污染并存。在此基础上,用常见的清洗剂对其进行膜复性,结果表明,纯水和柠檬酸清洗后膜通量未能恢复至90%以上;1 mL/L的α-淀粉酶清洗剂可使膜通量恢复至92.31%;碱清洗剂和氧化清洗剂可使膜通量恢复至95%以上,是比较理想的清洗方案,NaOH和NaClO复配使用清洗效果优于NaOH单独使用,清洗后膜通量接近100%。综合分析,对于由淀粉、多糖及少量蛋白所造成的膜污染,加酶清洗适用于膜的日常清洁,氧化清洗则适用于长期或高强度生产后的膜复性。
[1] PAN S H, DING N, REN J Y, et al.Maltooligosaccharide-forming amylase:Characteristics, preparation, and application[J].Biotechnology Advances, 2017, 35(5):619-632.
[2] SATYAWALI Y, VANBROEKHOVEN K, DEJONGHE W.Process intensification:The future for enzymatic processes?[J].Biochemical Engineering Journal, 2017, 121:196-223.
[3] SU Z R, LUO J Q, LI X H, et al.Enzyme membrane reactors for production of oligosaccharides:A review on the interdependence between enzyme reaction and membrane separation[J].Separation and Purification Technology, 2020, 243:116 840.
[4] KE,DZIDRA P,LETHANH J, LEWANDOWICZ G, et al.An attempt to application of continuous recycle membrane reactor for hydrolysis of oxidised derivatives of potato starch[J].Journal of Membrane Science, 2006, 282(1-2):14-20.
[5] PAOLUCCI-JEANJEAN D, BELLEVILLE M P, RIOS G M.A comprehensive study of the loss of enzyme activity in a continuous membrane reactor-application to starch hydrolysis[J].Journal of Chemical Technology and Biotechnology, 2001, 76(3):273-278
[6] GRZEOEKOWIAK-PRZYWECKA ![]() L.Continuous potato starch hydrolysis process in a membrane reactor with tubular and hollow-fiber membranes[J].Desalination, 2005, 184(1-3):105-112.
L.Continuous potato starch hydrolysis process in a membrane reactor with tubular and hollow-fiber membranes[J].Desalination, 2005, 184(1-3):105-112.
[7] HERMIA J.Constant pressure blocking filtration laws applications to power-law non-Newtonian fluids[J].Transactions of the Institution of Chemical Engineers, 1982, 60(5):183-187.
[8] FIELD R W, WU D, HOWELL J A, et al.Critical flux concept for microfiltration fouling[J].Journal of Membrane Science, 1995, 100(3):259-272.
[9] 杨文澜. 陶瓷膜生物反应器处理生活污水膜污染后再生方法的研究[J].环境工程学报, 2009, 3(1):119-122.
YANG W L, Study on regeneration of ceramic membrane bioreactor for domestic wastewater treatment[J].Chinese Journal of Environmental Engineering, 2009, 3(1):119-122.
[10] 张翼. 啤酒灭菌废水膜污染分析及膜清洗方法研究[J].清洗世界, 2020, 36(10):15-16;19.
ZHANG Y, Analysis of membrane pollution of beer sterilization wastewater and study on membrane cleaning treatment[J].Cleaning World, 2020, 36(10):15-16;19.
[11] LEE K M, DOAN H, EIN-MOZAFFARI F.Intermittent ultrasound-assisted ceramic membrane fouling control in ultrafiltration[J].The Canadian Journal of Chemical Engineering, 2020, 98(8):1 648-1 667.
[12] MOHAMMAD A W, NG C Y,LIM Y P,et al.Ultrafiltration in food processing industry:Review on application, membrane fouling, and fouling control[J].Food and Bioprocess Technology, 2012, 5(4):1 143-1 156.
[13] LEE S J, DILAVER M, PARK P K, et al.Comparative analysis of fouling characteristics of ceramic and polymeric microfiltration membranes using filtration models[J].Journal of Membrane Science, 2013, 432:97-105.
[14] 谷磊,刘有智,申红艳,等.陶瓷膜处理乳化悬浮液过程中的膜清洗工艺[J].化工进展, 2007, 26(2):226-229.
GU L, LIU Y Z, SHEN H Y, et al.Cleaning of ceramic membranes in filtration of emulsified suspension[J].Chemical Industry and Engineering Progress, 2007, 26(2):226-229.
[15] IRITANI E, KATAGIRI N.Developments of blocking filtration model in membrane filtration[J].KONA Powder and Particle Journal, 2016, 33:179-202.
[16] DE BARROS S T D, ANDRADE C M G, MENDES E S, et al.Study of fouling mechanism in pineapple juice clarification by ultrafiltration[J].Journal of Membrane Science, 2003, 215(1-2):213-224.
[17] 陈琦. 酶促反应与膜分离耦合生产核苷酸-循环式酶膜反应器的应用[D].南京:南京工业大学, 2009.
CHEN Q.Preparation of nucleotides by coupling enzyme catalysis with membrane separation-application of recirculated enzymatic membrane reactor[D].Nanjing:Nanjing University of Technology, 2009.
[18] LI C,SUN W J,LU Z D.Ceramic nanocomposite membranes and membrane fouling:A review[J].Water Research, 2020, 175:115 674.
[19] 王恺,郑黎静.柠檬酸酯淀粉的制备及性质研究[J].粮食与油脂, 2020, 33(11):85-89.
WANG K, ZHENG L J.Study on the preparation and properties of citrate starch[J].Cereals and Oils, 2020, 33(11):85-89.
[20] 王步枢. 柠檬酸淀粉酯及其复合变性淀粉制备与性质研究[D].雅安:四川农业大学, 2012.
WANG B S.Study on the preparation, properties of citrate starch and compound modified starch[D].Ya′an:Sichuan Agriculture University, 2012.
[21] 邱宏端, 朱斌.酸水解海带多糖与饮料配方的优化策略[J].福州大学学报(自然科学版), 1996,24(3).DOI:10.1007/BF02951625.
QIU H D, ZHU B.Optimization of processing and prescription for the preparation of kelp drink[J].Journal of Fuzhou University (Natural Science Edition), 1996,24(3).DOI:10.1007/BF02951625.
[22] ALRESHEEDI M T,BARBEAU B,BASU O D.Comparisons of NOM fouling and cleaning of ceramic and polymeric membranes during water treatment[J].Separation and Purification Technology, 2019, 209:452-460.
[23] LI W, LING G Q, LEI F H, et al.Ceramic membrane fouling and cleaning during ultrafiltration of limed sugarcane juice[J].Separation and Purification Technology, 2018, 190:9-24.
[24] 章小同,王道龙,赵士明,等.陶瓷膜在淀粉糖澄清工艺中的应用研究[J].中国酿造, 2019, 38(5):184-187.
ZHANG X T, WANG D L, ZHAO S M, et al.Application of ceramic membrane in starch sugar clarification process[J].China Brewing, 2019, 38(5):184-187.
[25] ROLDAN-CRUZ,CARCIA-HERNANDEZ A, ALVAREZ-RAMIREZ J, et al.Effect of the stirring speed in the in vitro activity of α-amylase[J].Food Hydrocolloids, 2021, 110:106 127.
[26] 赵延军,吴开芬,王正军.用酶溶液清洗被酱油污染的超滤膜研究[J].水处理技术, 1999, 25(6):317-324.
ZHAO Y J, WU K F, WANG Z J.An enzymatic approach to clean ultrafiltration membrane fouled by soy sauce[J].Technology of Water Treatment, 1999, 25(6):317-324.