凝乳酶(milk-clotting enzymes,MCEs)在干酪生产过程中具有极其重要的作用,它不仅具有凝乳功能,而且能参与干酪成熟过程中的蛋白水解,从而影响干酪的风味与品质[1]。随着干酪需求量的不断增加,传统小牛皱胃酶的供应已经出现严重短缺。因而,传统小牛皱胃酶的替代品已被广泛研究,而微生物源凝乳酶是其替代品研究的热点[2]。许多微生物来源(如霉菌和细菌)的胞外蛋白酶都具有凝乳功能且性质各异,其中米黑霉凝乳酶已被广泛接受[3-4]。较植物和动物来源的凝乳酶,微生物来源的凝乳酶具有凝乳活力高、性能多样化、生产周期短、生产成本低、便于基因改造等优点[2]。相对于真菌的固态发酵,细菌深层发酵产酶更容易自动化控制[5]。目前干酪市场需求量的增大不断推进小牛皱胃酶替代品的研发,许多微生物凝乳酶虽然不能直接替代小牛皱胃酶,但是可以作为小牛皱胃酶的辅剂或干酪催熟剂,甚至有些可以用于开发新型乳制品[6]。AN等[1]用解淀粉芽孢杆菌中提取的微生物凝乳酶和小牛皱胃酶制作切达干酪并进行比较,发现二者成分差别不大。YANG等[7]利用枯草芽孢杆菌提取凝乳酶并运用于青藏高原所产的牦牛乳中,发现其在牦牛乳品工业中具有一定的潜力。
在凝乳过程中,影响凝乳的因素有很多,包括凝乳温度、凝乳pH、钙离子浓度、酶添加量等[8]。不同来源的凝乳酶对温度的要求不同[9],RAJESH等[10]报道的Bacillus subtilis MTCC 10422凝乳酶最适温度为45 ℃;AHMED等[11]发现Bacillus licheniformis 5A5凝乳酶在75 ℃ 条件下活性最高。温度对凝乳酶特性的影响极为重要,例如通过影响粒子碰撞频率,从而影响凝乳速率。温度过低会导致胶束稳定性增加,妨碍胶束的聚集,温度过高又会导致凝乳酶失活[12]。此外,温度会影响凝乳活性、乳清的排出、凝块的硬度、奶酪的出品率等[13]。
本研究利用地衣芽孢杆菌D3.11凝乳酶,探究不同温度条件下凝乳过程中的浊度、黏度、乳清OD值、持水力、流变学特性以及微观结构的变化规律,并与商品酶作比较,为后期凝乳酶在奶酪中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜荷斯坦牛乳,甘肃农业大学奶牛场;地衣芽孢杆菌 D3.11,由本实验室分离纯化并保藏于中国典型培养物保藏中心(保藏编号为 CGMCC 3289);麸皮,淮南鸿汶农业发展有限公司;商品凝乳酶(由70%皱胃酶和30%牛胃蛋白酶组成,活力为100 000 U/g),深圳富晟生物科技有限公司;纤维素透析袋(12 000~14 000 Da),上海源叶生物科技有限公司。
1.1.2 试剂
尼罗红(超级纯),梯希爱(上海)化城工业发展有限公司;无水乙醇(分析纯),甘肃易飞仪器科技有限公司。其他试验试剂均为国产分析纯。
1.1.3 培养基
斜面种子培养基(g/L):牛肉膏3,NaCl 5,蛋白胨10,琼脂15,pH 7.2~7.4。
麸皮培养基:麸皮18 g,水100 mL,煮沸10 min,然后用4层纱布过滤,将滤液补水至100 mL,121 ℃灭菌25 min,pH值自然。
液体培养基(g/L):牛肉膏3,NaCl 5,蛋白胨10,pH 7.2~7.4。
1.2 仪器与设备
754 PC型紫外可见分光光度计,上海光谱仪器有限公司;LVDV-1型数字旋转黏度计,上海方瑞仪器有限公司;LSM 800型激光扫描共聚焦显微镜,卡尔·蔡司股份公司;Discovery HR-1型混合流变仪,美国TA Instruments公司;真空冷冻干燥机,Scientz-ND宁波新芝生物科技股份有限公司;TGL-20型高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;SW-CJ-2FD型超净工作台,苏州净化设备有限公司。
1.3 菌株发酵试验
1.3.1 菌种活化
将实验室斜面保藏的Bacillus licheniformis菌种转接至斜面种子培养基上,恒温培养箱中37 ℃培养24 h,接入液体培养基,37 ℃、175 r/min培养24 h。
1.3.2 粗酶液的发酵
将活化后的液体种子以4%的接种量接入麸皮发酵基中,37 ℃摇床(转速175 r/min)培养72 h,8 000 r/min离心10 min后得到粗酶液。
1.3.3 地衣芽孢杆菌凝乳酶的制备
向粗酶液中边缓慢搅拌边加硫酸铵细粉末,磁力搅拌2 h,使硫酸铵充分溶解,饱和度达到20%。4 ℃离心15 min,收集上清液,缓慢加入硫酸铵至饱和度达到75%;4 ℃冰箱中静置过夜,8 000 r/min离心10 min,收集沉淀。将沉淀溶于0.05 mol/L,pH为6.2 的磷酸缓冲液中,置于透析袋中,在4 ℃条件下透析20 h。将透析后的酶液,倒入铝盒置于真空冷冻干燥机冻干23 h,收集酶粉,-20 ℃保存。
1.3.4 酶液的配制
称取一定量的酶粉,溶解于磷酸缓冲液(0.05 mol/L,pH 6.2)中,将其酶活力调整为155 Su/mL,不同温度条件下预热5 min备用。
1.3.5 脱脂乳的制备
新鲜荷斯坦牛乳4 000 r/min离心35 min去除上层脂肪,加0.02%(质量分数)叠氮钠备用。
1.4 不同温度对凝乳酶的影响
1.4.1 黏度的测定
参照孔学民等[14]的方法。将脱脂乳分别水浴预热至25、30、35、40、45、50 ℃,取不同温度下乳样50 mL,加入酶液,充分混匀,每隔10 min测定体系黏度值。
1.4.2 浊度的测定
参照MIZUNO等[15]的方法。将脱脂乳分别水浴预热至25、30、35、40、45、50 ℃,取不同温度下乳样各5 mL,加入酶液,充分混匀,每隔5 min取适量样品稀释,紫外可见光分光光度计测定体系在450 nm处的透光率(T),以(100-T)%代表浊度。
1.4.3 流变学特性的测定
参照ZHANG等[16]的方法,略作修改。分别取不同温度条件下乳样4 mL,加0.4 mL酶液,混匀30 s后立即转移到流变仪玻耳帖平板上,进行时间扫描。测试温度分别为25、30、35、40、45、50 ℃,测试探头为60 mm平行板,间隙1 000 μm,频率1 Hz,应力0.1 Pa,采点间隔5 s,测定时长60 min。所有测试均在线性黏弹性区域内,测定参数是储能模量(G′)。
1.4.4 持水力的测定
参照GB 5009.239—2016[3]的方法。取5 mL脱脂乳置于10 mL离心管中,分别在25、30、35、40、45、50 ℃条件下凝乳30 min, 4 ℃、7 000 r/min离心10 min,取上清液称重,代入公式(1)得到乳样持水力:
持水力![]()
(1)
1.4.5 乳清OD值的测定
参照李伟等[17]的方法。取待测乳样5 mL置于10 mL离心管中,分别在25、30、35、40、45、50 ℃条件下凝乳30 min, 4 ℃、7 000 r/min离心10 min,取上层排出的乳清,721紫外可见分光光度计测定乳清在500 nm处的吸光值。
1.4.6 凝块微观结构的测定
参考LOPEZ等[18]的方法。在脱脂乳中分别添加2种酶,凝乳60 min,使用不锈钢刀片从凝乳样品切取4 mm×5 mm×2 mm的薄片,置于带槽载玻片上,滴加2滴尼罗红乙醇溶液(0.1 g/L)于暗室中染色6 min;染色结束后,用蒸馏水冲洗染料,然后盖上盖玻片在显微镜下观察。
1.4.7 数据处理
试验数据用SPSS 19.0软件进行显著性和相关性分析,Origin 8.0软件进行绘图。每组实验平行测定3次。
2 结果与分析
2.1 凝乳过程中黏度的变化
图1为不同温度条件下,地衣芽孢杆菌D3.11凝乳酶和商品酶在凝乳过程中的黏度变化情况。由图1可以看出,在25、30、35、40 ℃条件下,2种酶凝乳过程中黏度均先增大,而后保持稳定。当凝乳温度为25 ℃时,地衣芽孢杆菌D3.11凝乳酶体系的黏度在30 min时达到最大值3 343 mPa·s,商品酶体系的黏度值也在30 min时达到最大值3 351 mPa·s;当凝乳温度为30 ℃时,2种酶作用的体系黏度值均稳定上升,在30 min时达到最大值,地衣芽孢杆菌D3.11凝乳酶体系的最大值为3 143 mPa·s,商品酶体系的最大值为3 201 mPa·s;35 ℃条件下,10 min时2种体系的黏度值达到峰值,此时,地衣芽孢杆菌D3.11凝乳酶体系的黏度值为3 396 mPa·s,商品酶体系的黏度值为3 349 mPa·s;当温度为40 ℃时,凝乳10 min后2种酶体系的黏度值达到峰值并保持稳定,此时地衣芽孢杆菌D3.11凝乳酶体系的黏度值为3 380 mPa·s,商品酶体系的黏度值为3 371 mPa·s,这表明在40 ℃条件下,地衣芽孢杆菌D3.11凝乳酶与商品酶的凝乳效果差异不大;在45 ℃条件下,凝乳10 min时商品酶体系黏度达到最大值3 379 mPa·s,地衣芽孢杆菌体系凝乳酶黏度值为3 330 mPa·s,凝乳40 min后2种酶体系黏度值均下降,且商品酶体系比地衣芽孢杆菌体系下降的更快;当凝乳温度为50 ℃时,商品酶体系的黏度值普遍低于地衣芽孢杆菌D3.11凝乳酶体系的黏度值,且达到峰值后,商品酶体系的黏度值下降速度更快。综上,随着凝乳温度的升高,蛋白质之间的相互作用不断增强,酪蛋白胶束间距离的缩小以及蛋白分子聚集体体积的增大,最终导致体系黏度的增加,且随着凝乳时间的延长,酶凝胶形成的同时,乳清不断析出,导致在测定时黏度值达到最大后下降,这与ZHAO等[19]的研究结果保持一致。
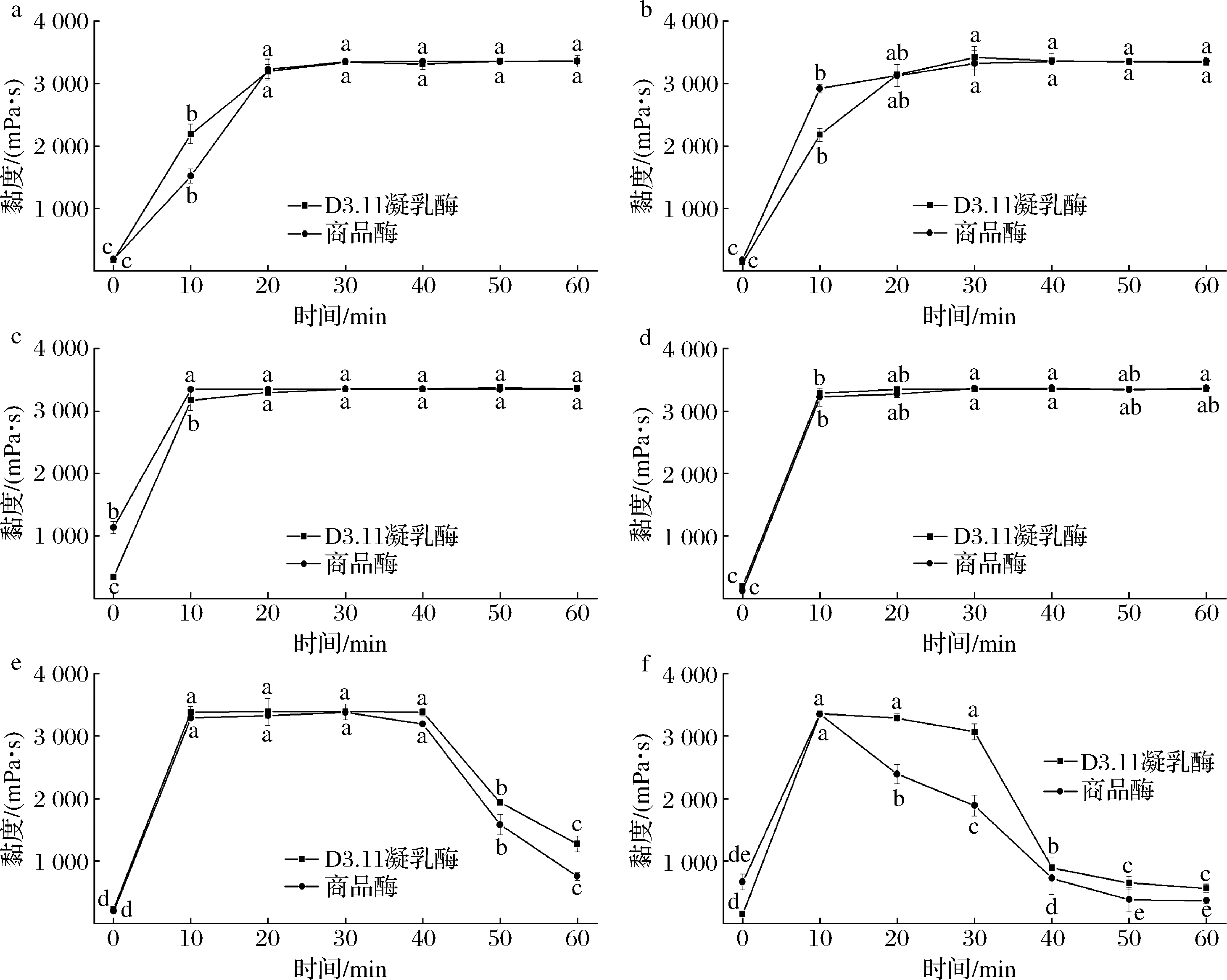
a-25 ℃;b-30 ℃;c-35 ℃;d-40 ℃;e-45 ℃;f-50 ℃;
图1 不同温度条件下凝乳过程中黏度的变化
Fig.1 Change of viscosity during the skimmed milk coagulation process under different temperature 注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 凝乳过程中浊度的变化
浊度值表示酪蛋白胶束的聚集程度[20],浊度值越大,酪蛋白胶束聚集程度越大,胶体溶液对光透过率越低[15]。由图2可知,30、35、40、45 ℃条件下,随着凝乳温度的上升,添加地衣芽孢杆菌D3.11凝乳酶与商品酶的2种反应体系的浊度逐渐增大。当凝乳温度为25、30、35、40、45、50 ℃时,前10 min内商品酶体系浊度增长率分别为54.58%、46.17%、25.15%、22.54%、22.12%、14.72%;地衣芽孢杆菌凝乳酶体系浊度增长率分别为37.54%、32.35%、35.16%、28.45%、17.82%、10.96%。这表明,凝乳温度越高,2种酶体系的浊度增长率越低,且商品酶体系的增长率大于地衣芽孢杆菌凝乳酶体系的增长率。在25 ℃条件下,凝乳15 min后浊度值显著降低(P<0.05),可能是因为温度较低,凝乳酶活力较低,酪蛋白胶束聚集松散不稳定[20];在50 ℃条件下,凝乳10 min后浊度值显著降低(P<0.05),这是由于凝乳温度高于适宜温度导致凝乳酶活力下降,说明温度过高会降低凝乳效果。综上所述,凝乳过程中,凝乳酶对温度比较敏感,适宜的凝乳温度对凝乳体系浊度的变化极为关键[21]。

a-25 ℃;b-30 ℃;c-35 ℃;d-40 ℃;e-45 ℃;f-50 ℃
图2 不同温度条件下浊度的变化
Fig.2 Change of Turbidity under different temperature
2.3 凝乳过程中的流变学特性
G′,又称弹性模量,指在振动条件下每个应变周期所储存的能量大小,代表凝乳网状结构的强度。凝乳过程中G′的减小表示凝乳结构中键合强度与数目减少,酪蛋白之间的融合作用会导致凝乳结构在剪切作用下遭到破坏[22]。
图3为商品酶和地衣芽孢杆菌D3.11凝乳酶凝乳体系的G′变化情况。当温度为25 ℃时,2种酶体系的G′均随时间的延长逐渐上升,这是由于低温度下凝乳酶活力较低,酶解κ-酪蛋白速率较慢,导致G′变化缓慢[21];当温度>25 ℃时,不同温度条件下2种凝乳酶体系的G′均随时间的延长先上升,达到最大值后下降;在30、35、40、45、50 ℃条件下,商品酶体系G′的峰值分别为116.81、269.01、191.09、109.11、55.06 Pa,到达峰值的时间分别是2 760、2 710、1 438、967、594 s;地衣芽孢杆菌凝乳酶体系G′的峰值分别为145.06、232.91、187.03、142.06、42.35 Pa,到达峰值的时间分别是1 981、1 103、832、649、568 s。这说明,随着凝乳温度的上升,凝乳时间提前,2种酶体系的最大G′不断下降,其中,地衣芽孢杆菌体系比商品酶体系的凝乳时间分别提前了779、1 607、606、318、26 s。当温度>40 ℃后,2种酶体系的G′下降迅速,这是由于随着时间的延长,凝乳酶活力下降,且过高的温度还会导致添加凝乳酶后立即凝乳,使凝乳酶混合不均匀,影响凝乳效果,与黄东旭等[23]的研究结果基本一致。
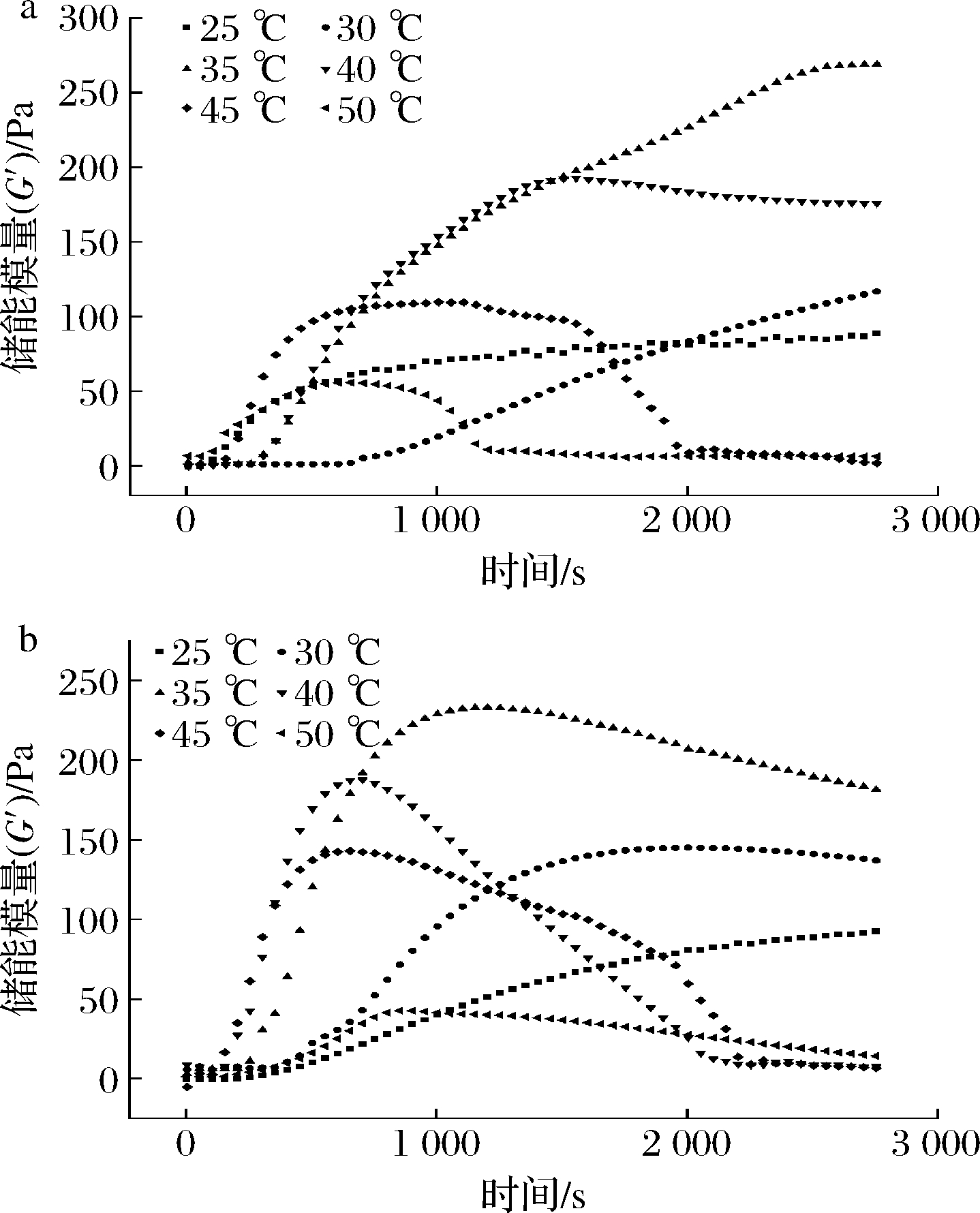
a-商品酶体系;b-地衣芽孢杆菌凝乳酶体系
图3 不同温度条件下储能模量G′的变化
Fig.3 Change of storage modulus inenzyme coagulation process under different temperature
2.4 持水力变化
持水力越大,说明体系中束缚水含量越多[24]。由图4可知,2种酶作用下,体系持水力均随温度的上升呈先上升后下降的趋势。当凝乳温度为25、30、35 ℃时,商品酶体系的持水力为87.82%、94.00%、97.33%,地衣芽孢杆菌体系的持水力为87.64%、91.70%、93.34%,2种酶体系的持水力均显著上升(P<0.05);当凝乳温度为40、45、50 ℃时,商品酶体系的持水力为91.64%、90.48%、88.06%,地衣芽孢杆菌体系的持水力为92.33%、90.85%、90.36%,2种酶体系的持水力均显著下降(P<0.05),由此得出,当温度>40 ℃时,2种酶体系的持水力随温度升高逐渐减小,这可能是温度超过了凝乳酶的最适作用温度,蛋白质胶束的网状结构被破坏,水合作用降低,形成的凝块收缩脱水,与孙金威等[25]的研究结果基本一致。
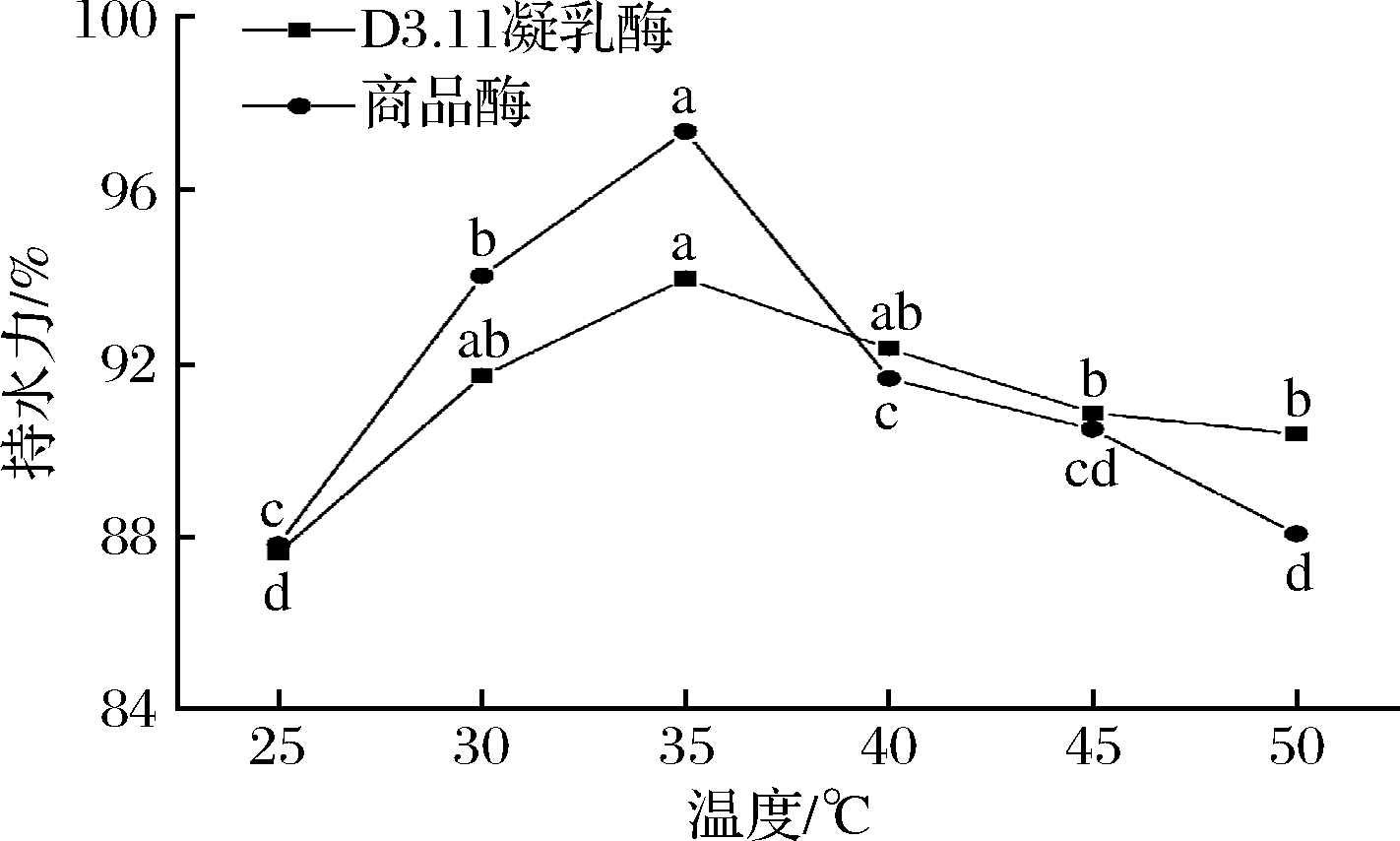
图4 不同温度条件下持水力的变化
Fig.4 Change of water-holding capacity under different temperature
2.5 乳清OD值的变化
乳清OD值是凝乳过程中排出乳清的吸光值,乳清OD值越小,表示乳清中蛋白质量分数越低。由图5可知,在25、30、35、40、45、50 ℃条件下,商品酶体系的乳清OD值分别为0.224、0.281、0.340、0.348、0.413、0.422,说明商品酶体系的乳清OD值随温度升高显著增大(P<0.05);地衣芽孢杆菌酶体系的乳清OD值分别为0.231、0.360、0.372、0.384、0.462、0.479,说明地衣芽孢杆菌凝乳酶体系的乳清OD值随温度升高显著增大(P<0.05)。在不同温度条件下,地衣芽孢杆菌凝乳酶体系的乳清OD值均大于商品酶体系。据雒亚洲等[26]研究表明,随着温度的升高,凝块收缩的速度加快并伴有乳清析出。当温度>40 ℃时,乳清OD值迅速增大,这是由于温度过高使凝乳酶失活严重,与AMARO-HERNANDEZ等[27]的研究结果一致。
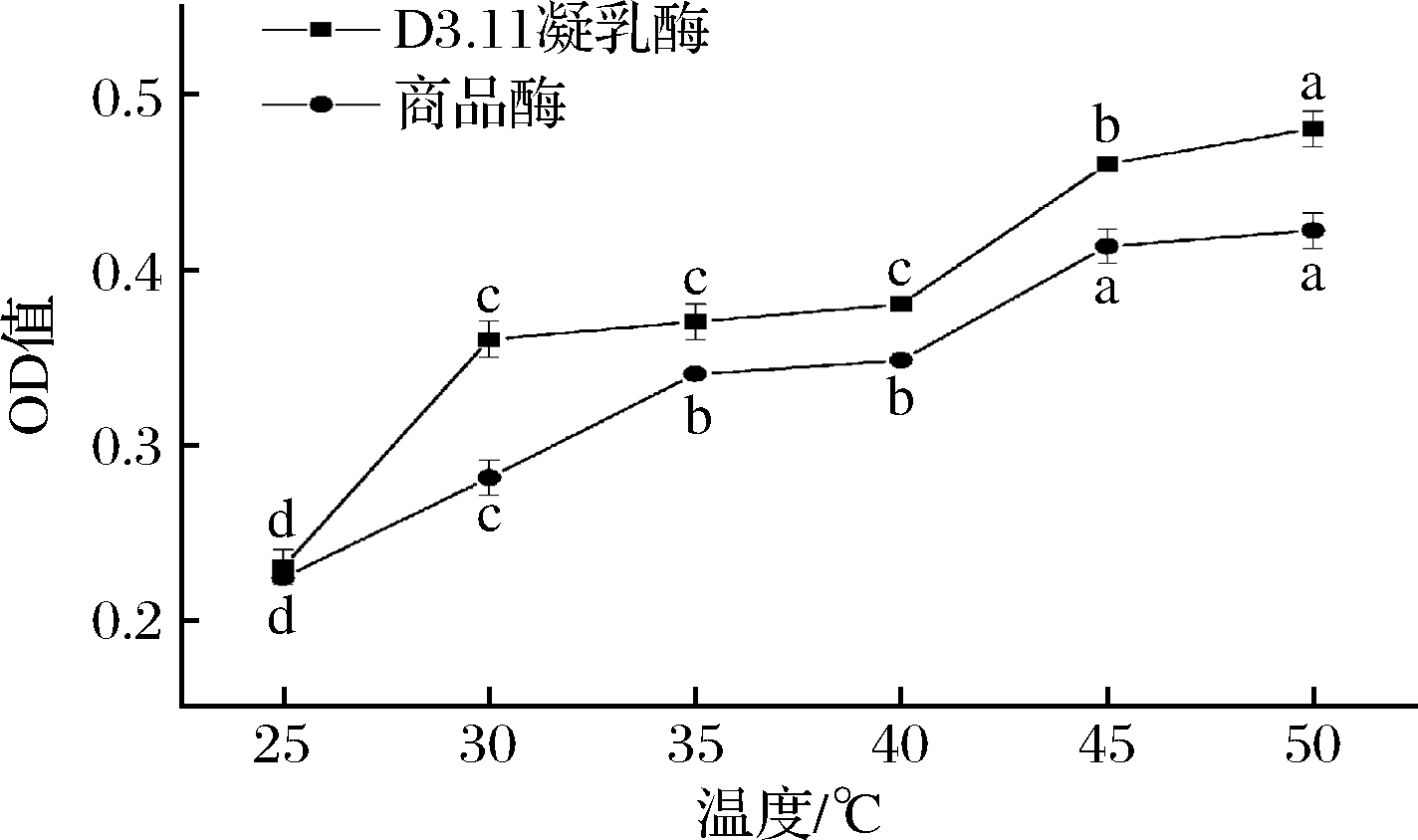
图5 不同温度条件下乳清OD值的变化
Fig.5 Change of whey OD value under different temperature
2.6 温度对凝乳微观结构的影响
图6为激光共聚焦显微镜下呈现的不同温度下凝乳的微观结构。由图6可知,在30 ℃条件下形成的2组凝块蛋白微粒聚集紧密,孔隙较小;40 ℃条件下,2组凝块蛋白微粒聚集的更加明显,蛋白微粒间交叉连接更多,网络结构的孔隙更小;50 ℃条件下,孔隙明显比其他温度下的样品更多、更大,说明蛋白微粒间的相互作用加强,结构呈紧缩状态。这是由于蛋白微粒间的相互作用强烈依赖于温度[28],高温下,疏水相互作用增强导致蛋白微粒收缩[29],与范金波等[30]的研究结果基本一致。在30和40 ℃条件下,商品酶组比地衣芽孢杆菌凝乳酶组蛋白微粒聚集的更紧密,孔隙更小;而当温度达到50 ℃时,商品酶组的网络结构比地衣芽孢杆菌组的孔隙大,结构更疏松。

a、d-30℃地衣芽孢杆菌凝乳酶、商品酶凝乳的微观结构; b、e-40℃地衣芽孢杆菌凝乳酶、商品酶凝乳的微观结构; c、f-50℃地衣芽孢杆菌凝乳酶、商品酶凝乳的微观结构
图6 不同温度下凝乳的微观结构
Fig.6 Microstructure of curds at different temperatures 注:图中红色部分为被尼罗红染色的乳蛋白,黑色部分即孔隙为水相
3 结论
本实验在不同温度条件下,比较分析了地衣芽孢杆菌D3.11凝乳酶与商品酶的凝乳性能情况。结果表明,在凝乳过程中,随着凝乳温度的升高,蛋白质之间的相互作用不断增强,2种酶体系的黏度值逐渐增大,温度较高时,长时间凝乳会导致体系黏度值下降;在30~45 ℃时2种酶体系的浊度随温度升高显著增大(P<0.05);在35和40 ℃条件下,OD值相近且不显著(P>0.05);流变学特性表明,随着凝乳温度的上升,2种酶体系的最大G′不断下降,且商品酶体系比地衣芽孢杆菌体系的G′下降快;在35 ℃时2种酶体系的持水力均达到最大;2种酶体系的乳清OD值均随温度的升高而显著增大(P<0.05);微观结构表明在40 ℃条件下,2种酶的凝乳效果最好,且商品酶组比地衣芽孢杆菌凝乳酶组蛋白微粒聚集的更紧密,孔隙更小。综上所述,凝乳温度在凝乳过程中,具有极其重要的作用,结合相关指标的测定情况可知,在实际的应用过程中,确定其最适温度需结合多个角度的考量,可以考虑按一定比例将2种凝乳酶复配使用,以达到最佳的凝乳性能。
[1] AN Z G, HE X L, GAO W D, et al.Characteristics of miniature cheddar-type cheese made by microbial rennet from Bacillus amyloliquefaciens:A comparison with commercial calf rennet[J].Journal of Food Science, 2014, 79(2):M214-M221.
[2] 杭锋, 洪青, 王钦博, 等. 凝乳酶的研究进展[J]. 食品科学, 2016, 37(3):273-279.
HANG F, HONG Q, WANG Q B, et al. Advances in research on milk-clotting enzymes[J]. Food Science, 201637(3):273-279.
[3] 中华人民共和国卫生部. GB 5009.239—2016 食品安全国家标准 乳和乳制品酸度的测定[S].北京:中国农业出版社, 2016.
Ministry of Health of the People′s Republic of China.GB 5009.239—2016 National food safety standard determination of acidity in milk and milk products[S].Beijing:China Agricultural Press, 2016.
[4] NEELAKANTAN S, MOHANTY A K, KAUSHIK J K.Production and use of microbial enzymes for dairy processing:A review[J].Current Science,1997, 77(1):143-148.
[5] DUTT K, MEGHWANSHI G K, GUPTA P, et al.Role of casein on induction and enhancement of production of a bacterial milk clotting protease from an indigenously isolated Bacillus subtilis[J].Letters in Applied Microbiology, 2008, 46(5):513-518.
[6] 普燕, 张富春. 干酪用牛凝乳酶替代品的研究进展[J]. 食品与发酵工业, 2015, 41(5):227-234.
PU Y, ZHANG F C. Research progress of the calf rennet substitutes for cheese-making[J]. Food and Fermentation Industries, 2015, 41(5):227-234.
[7] LI Y,LIANG S, ZHI D J, et al.Purification and characterization of Bacillus subtilis milk-clotting enzyme from Tibet Plateau and its potential use in yak dairy industry[J].European Food Research & Technology, 2012, 234(4):733-741.
[8] SOODAM K, GUINEE T P.The case for milk protein standardisation using membrane filtration for improving cheese consistency and quality[J].International Journal of Dairy Technology, 2018, 71(2):277-291.
[9] 张卫兵. 甘南牧区产凝乳酶细菌的筛选、产酶条件、酶学特性及应用研究[D]. 兰州: 甘肃农业大学, 2014.
ZHANG W B. Study on screening, conditions for enzyme production, enzymatic characteristics and application of rennet producing bacteria from Gannan pastoral area[D]. Lanzhou: Gansu Agricultural University, 2014.
[10] RAJESH K N, BHUSHAN B, PAL A, et al.Purification, physico-chemico-kinetic characterization and thermal inactivation thermodynamics of milk clotting enzyme from Bacillus subtilis MTCC 10422[J].LWT - Food Science and Technology, 2016, 65:652-660.
[11] AHMED S A, HELMY W A.Comparative evaluation of Bacillus licheniformis 5A5 and Aloe variegata milk-clotting enzymes[J].Brazilian Journal of Chemical Engineering, 2012,29(1):69-76.
[12] GUINEE T P, FENELON M A, MULHOLLAND E O, et al.The influence of milk pasteurization temperature and pH at curd milling on the composition, texture and maturation of reduced fat cheddar cheese[J].International Journal of Dairy Technology, 1998, 51(1):1-10.
[13] FOX P F, GUINEE T P, COGAN T M, et al. Enzymatic Coagulation of Milk[M].Boston: Springer US, 2016:185-229.
[14] 孔学民, 李丽丽, 白文娟, 等.Mozzarella干酪凝乳过程中理化特性及微观结构的变化[J].湖南农业大学学报(自然科学版), 2009, 35(5):549-553;557.
KONG X M, LI L L, BAI W J, et al.Changes of physico-chemical properties and microstructure of Mozzarella cheese during coagulation[J].Journal of Hunan Agricultural University (Natural Sciences), 2009, 35(5):549-553;557.
[15] MIZUNO R, LUCEY J A.Effects of emulsifying salts on the turbidity and calcium-phosphate-protein interactions in casein micelles[J].Journal of Dairy Science, 2005, 88(9):3 070-3 078.
[16] ZHANG Y, LI Y, WANG P J, et al.Rennet-induced coagulation properties of yak casein micelles:A comparison with cow casein micelles[J].Food Research International, 2017, 102:25-31.
[17] 李伟, 吴槟, 李金宝, 等. 钙试剂和温度对农家干酪品质及乳清OD值的影响[J]. 中国乳品工业, 2011, 39(8):25-27.
LI W, WU B, LI J B, et al. Study of the process optimization of cottage cheese[J]. China Dairy Industry, 2011, 39(8):25-27.
[18] LOPEZ C, CAMIER B, GASSI J Y.Development of the milk fat microstructure during the manufacture and ripening of Emmental cheese observed by confocal laser scanning microscopy[J].International Dairy Journal, 2007, 17(3):235-247.
[19] ZHAO Z, CORREDIG M.Influence of sodium chloride on the colloidal and rennet coagulation properties of concentrated casein micelle suspensions[J].Journal of Dairy Science, 2016, 99(8):6 036-6 045.
[20] 杨佐毅, 李理, 梁世中, 等. 新型大豆奶酪的研制及其水解特性[J]. 现代食品科技, 2005, 21(4):41-44.
YANG Z Y, LI L, LIANG S Z, et al. Studies on the starter and hydrolysis properties of a novel soybean cheese[J]. Modern Food Science and Technology, 2005, 21(4):41-44.
[21] 罗洁, 任发政, 王紫薇, 等. 干酪质构与风味控制技术研究进展[J]. 农业机械学报, 2016, 47(1):190-201;208.
LUO J, REN F Z, WANG Z W, et al. Advances in control technology of cheese quality and texture[J]. Transactions of the Chinese Society for Agricultural Machinery, 2016, 47(1):190-201;208.
[22] LUCEY J A.The relationship between rheological parameters and whey separation in milk gels[J].Food Hydrocolloids, 2001, 15(4-6):603-608.
[23] 黄东旭, 姜亦超, 胡新新, 等. 以大豆为主要原料制备新鲜豆乳干酪的工艺研究[J]. 食品工业, 2017, 38(9):99-103.
HUANG D X, JIANG Y C, HU X X, et al. Research on the process technology of fresh soy-milk cheese using soybeans[J]. The Food Industry, 2017, 38(9):99-103.
[24] 谢晶, 杨茜. 生物抗氧化剂结合超高压技术对冷藏带鱼的保鲜效果[J]. 食品与发酵工业, 2015, 41(8):192-197.
XIE J, YANG X. Effects of natural antioxidants and high pressure treatment(HHP) on the quality characteristics of Trichiurus lepturus during refrigerated storage[J]. Food and Fermentation Industries, 2015, 41(8):192-197.
[25] 孙金威, 杨晓凤, 李启明, 等.稀奶油对农家干酪品质的影响[J].食品与发酵科技, 2019, 55(4):122-127.
SUN J W, YANG X F, LI Q M, et al.Effect of thin cream on the quality of cottage cheese[J].Food and Fermentation Sciences & Technology, 2019, 55(4):122-127.
[26] 雒亚洲, 高晶晶, 蒋阿宁. 天然干酪生产中凝乳形成的基本机理[J]. 农产品加工(学刊), 2008(9):10-11.
LUO Y Z, GAO J J, JIANG A N. The basic mechanism of the curd formation in natural cheese production[J]. Academic Periodical of Farm Products Processing, 2008(9):10-11.
[27] AMARO-HERN NDEZ J C, OLIVAS G I, ACOSTA-MU
NDEZ J C, OLIVAS G I, ACOSTA-MU IZ C H, et al.Structure rearrangement during rennet coagulation of milk modifies curd density[J].Journal of Dairy Science, 2020, 103(4):3 088-3 094.
IZ C H, et al.Structure rearrangement during rennet coagulation of milk modifies curd density[J].Journal of Dairy Science, 2020, 103(4):3 088-3 094.
[28] BANSAL N, FOX P F, MCSWEENEY P L H.Aggregation of rennet-altered casein micelles at low temperatures[J].Journal of Agricultural & Food Chemistry, 2007, 55(8):3 120-3 126.
[29] CARLSON A, HILL G C, OLSON N F.The coagulation of milk with immobilized enzymes:A critical review[J].Enzyme & Microbial Technology, 1986, 8(11):642-650.
[30] 范金波, 侯宇, 黄训文, 等. 加工条件对生姜蛋白酶凝乳物化性质的影响[J]. 食品与发酵工业, 2014, 40(4):59-63.
FAN J B, HOU Y, HUANG X W, et al. The effect of processing conditions on the physicochemical properties of ginger protease curd[J]. Food and Fermentation Industries, 2014, 40(4):59-63.