茅莓(Rubus parvifolius L.)是蔷薇科悬钩子属植物,又名三月泡、红梅消,其分布广泛,资源丰富,颇具观赏价值。茅莓的果实可以食用,酸甜多汁,富含VC、总酸及蛋白质等,具有较高的开发价值,常被用于酿酒、制醋及饮料中[1-2]。如翟明昌等[3]以茅莓、枸杞为原料制作了一款酸甜可口、营养价值高的保健功能果汁饮料。另外,茅莓还可入药,根据《中药大辞典》[4]中记载,茅莓全草可当药物使用,具有清热凉血、利尿消肿等多种功能功效。
茅莓根是茅莓的根部,是一种民间传统的中药材。传统药理学显示,茅莓根提取物及其萃取组分具有较好的抗炎[5]和抗氧化[6]作用;化学成分研究表明,茅莓根的主要药用成分为黄酮类化合物、三萜及三萜皂苷等。如MEI等[7]采用硅胶柱层析法和核磁共振波谱对茅莓根进行提取和鉴定,从中分离得到神经酰胺、蒽醌类化合物和三萜类化合物;CAO等[8]通过小鼠实验发现茅莓总皂苷可以抑制恶性黑色素瘤细胞的侵袭、迁移和转移,具有一定的抗肿瘤作用。目前,关于茅莓根的研究主要集中在其化学成分上,对茅莓根的抗氧化活性和α-葡萄糖苷酶、乙酰胆碱酯酶酶抑制作用的研究较少。现代医学主要是通过抑制体内的α-葡萄糖苷酶活性和乙酰胆碱酯酶活性来分别治疗糖尿病和阿尔茨海默症(Alzheimer′s disease,AD),而研究表明,AD、糖尿病等疾病的发生可能与人体内自由基氧化应激反应有一定的相关性[9]。因此,研究茅莓根的抗氧化活性和α-葡萄糖苷酶、乙酰胆碱酯酶酶抑制作用,可为预防糖尿病和老年痴呆提供一定的参考价值。
为了进一步挖掘茅莓根的食用和药用价值,本文以茅莓根的甲醇提取物为研究对象,分析其总酚、总黄酮含量,并测定其体外抗氧化活性和对α-葡萄糖苷酶以及乙酰胆碱酯酶的抑制能力,来评价其抗氧化、降血糖和防老年痴呆的潜力,可为茅莓根资源的高效利用和进一步开发提供数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
供试材料于2018年购自安徽毫州,经西南林业大学植物学教研室戚建华副教授鉴定为茅莓的根部。
1.1.2 主要试剂
α-葡萄糖苷酶、阿卡波糖、加兰他敏(galanthamine,GLTM)、4-甲基伞形酮-α-D-吡喃葡萄糖苷(4-methylumbelliferyl-α-D-glucopyranoside,4-MUG)、电鳗乙酰胆碱酯酶(acetylcholinesterase,AChE)、碘化硫代乙酰胆碱(acetylthiocholineiodide,ATCI)、5,5′-二硫代双(2-硝基苯甲酸)[5,5-dithiobis(2-nitrobenzoicacid),DTNB],Sigma-Aldrich公司;奎诺二甲基丙烯酸酯(Trolox)、VC、ABTS、DPPH、2,4,6-三吡啶基三嗪[2,4,6-tris(2-pyridyl)-s-triazine,TPTZ]、2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT),Solarbio公司;过硫酸钾、甲醇、H2O2、FeSO4、FeCl3、NaOH、CuSO4、K2SO4、浓硫酸、盐酸等均为国产分析纯。
1.1.3 仪器与设备
SHB-III循环水式多用真空泵,郑州长城科工贸有限公司;TGL-10C高速台式离心机,上海安亭科学仪器厂;U410-86超低温冰箱,艾本德生物仪器有限公司;SYNERGY H1多功能酶标仪,美国BIOTEK公司;YB-250A高速多功能粉碎机,永康市速锋工贸有限公司;SG5200HDT型超声波清洗器,上海冠特超声仪器有限公司。
1.2 样品的制备
晒干的茅莓根经粉碎后过40目筛,取1 g茅莓根粉末,按照料液比1∶20(g∶mL)向粉末中加入体积分数为70%的甲醇溶液,在超声波为300 W、温度为50 ℃的条件下提取60 min。将提取物进行抽滤,滤渣再重新提取抽滤1次,合并2次滤液,在50 ℃下真空浓缩,用体积分数为70%的甲醇溶液定容至10 mL,制得茅莓根粗提物(Rubus parvifolius L.root extract,RRE)[10]。
1.3 有效成分及体外抗氧化活性的测定
1.3.1 总酚含量测定
采用Folin-Ciocalteu法测定总酚含量[11]。取20 μL 样品溶液于96孔酶标板,加入20 μL 0.5 mol/L的福林酚溶液,混合5 min后加入160 μL 75 mg/mL的Na2CO3溶液,避光反应25 min后于765 nm下测定吸光值,以等体积的蒸馏水代替Na2CO3溶液作为对照组。配制质量浓度分别为10、20、40、60、80和100 μg/mL 的没食子酸溶液,在相同条件下测定吸光值,并以没食子酸质量浓度为横坐标,吸光值为纵坐标来绘制标准曲线。其回归方程为y=0.004 8x+0.019 5(R2=0.997 3),可根据没食子酸标准曲线计算RRE中总酚含量,结果以mg GAE/g表示。
1.3.2 总黄酮含量测定
参照吴昆明等[12]的方法测定样品中的总黄酮含量。取40 μL样品溶液于96孔酶标板,加入20 μL 30 mg/mL的Na2NO2溶液,在室温下放置反应6 min后加入20 μL 60 mg/mL的Al(NO3)3溶液,接着室温下反应6 min后再加入140 μL 40 mg/mL的NaOH溶液和60 μL体积分数为70%的甲醇溶液,静置反应15 min后于510 nm下测定吸光值,以等量体积分数为70%的甲醇溶液分别代替Na2NO2溶液和Al(NO3)3溶液作为对照组。配制质量浓度为0.1、0.2、0.4、0.6、0.8和1.0 g/L的芦丁溶液,在相同条件下测定吸光值,并以芦丁质量浓度为横坐标,吸光值为纵坐标来绘制标准曲线。其回归方程为y=1.003 2x+0.011 2(R2=0.996 9),可根据芦丁标准曲线计算RRE中总黄酮含量,结果以mg Rutin/g表示。
1.3.3 DPPH自由基清除能力
取100 μL样品溶液于96孔酶标板,加入100 μL DPPH溶液充分混合,避光反应30 min后在517 nm处测定其吸光值(As),以体积分数为70%的甲醇溶液代替样品溶液进行反应的吸光值为Ac,以体积分数为70%的甲醇溶液代替DPPH溶液进行反应的吸光值为Ab。以VC和BHT为阳性对照,并按公式(1)计算样品的DPPH自由基清除率[11]:
DPPH自由基清除率![]()
(1)
以不同质量浓度(0~0.025 g/L)的Trolox的甲醇溶液作为标准品,以Trolox的质量浓度为横坐标,DPPH自由基清除率为纵坐标作标准曲线,其回归方程为y=4.554 4x-1.276 1(R2=0.993 0)。利用标准曲线计算样品的Trolox当量,该数值代表RRE的DPPH自由基清除能力。
1.3.4 ABTS阳离子自由基清除能力
取50 μL样品溶液于96孔酶标板,加入200 μL ABTS溶液充分混合,在室温下避光反应6 min后在734 nm处测定其吸光值(As),以体积分数为70%的甲醇溶液代替样品溶液进行反应的吸光值为Ac,以体积分数为70%的甲醇溶液代替ABTS溶液进行反应的吸光值为Ab,以VC和BHT为阳性对照,并按公式(2)计算样品的ABTS阳离子自由基清除率[11]:
ABTS阳离子自由基清除率![]()
(2)
以不同质量浓度(0~0.05 g/L)的Trolox的甲醇溶液作为标准品,以Trolox溶液的质量浓度为横坐标,ABTS阳离子自由基清除率为纵坐标作标准曲线,其回归方程为y=1.172 6x+2.247 0(R2=0.996 2)。利用标准曲线计算样品的Trolox当量,该数值代表RRE的ABTS阳离子自由基清除能力。
1.3.5 超氧阴离子自由基清除能力
参考陈青青等[13]的方法略作修改,采用邻苯三酚自氧化法测定超氧阴离子自由基清除能力。取20 μL样品溶液于96孔酶标板,加入240 μL Tris-HCl缓冲液,在25 ℃温育10 min。之后再加入20 μL 邻苯三酚溶液,混合振荡10 s,每隔1 min在325 nm下测定吸光值(As),共测定5 min。以60 mmol/L Tris-HCl缓冲液溶液代替样品溶液进行反应测定吸光值为Ac,以50 mmol/L Tris-HCl缓冲液代替邻苯三酚溶液进行反应测定吸光值为Ab。以VC和BHT为阳性对照,并按公式(3)计算超氧阴离子自由基清除率:
超氧阴离子自由基清除率![]()
(3)
以不同质量浓度(0~500 g/L)的Trolox的甲醇溶液为标准品,以Trolox溶液的质量浓度为横坐标,超氧阴离子自由基清除能力为纵坐标作标准曲线,其回归方程为y=0.126 4x-1.384 6(R2=0.994 5)。利用标准曲线计算样品的Trolox当量,该数值代表样品的超氧阴离子自由基清除能力。
1.3.6 铁还原能力
参考刘江等[14]的方法略作修改,取30 μL样品溶液于96孔酶标板,加入240 μL FRAP溶液(由300 mmol/L pH 3.6的醋酸钠缓冲液、10 mmol/L TPTZ溶液和20 mmol/L FeCl3组成)充分混合,在37 ℃避光反应10 min后在593 nm处测定吸光值(As),以体积分数70%的甲醇溶液代替样品溶液进行反应测定吸光值为Ac,以体积分数为70%的甲醇溶液代替FRAP溶液进行反应测定吸光值为Ab,以VC和BHT为阳性对照,并按公式(4)计算样品的铁还原能力:
铁还原能力![]()
(4)
以不同质量浓度(0~0.1 g/L)的FeSO4溶液作为标准品,以FeSO4溶液的质量浓度为横坐标,吸光值为纵坐标作标准曲线,其回归方程为y=0.004 7x+0.059 3(R2=0.993 1)。利用标准曲线计算样品中的FeSO4当量,该数值代表RRE的铁还原能力。
1.4 α-葡萄糖苷酶活性抑制能力
参考LIAO等[15]的方法略作修改,取50 μL样品溶液于96孔酶标板,加入20 μL α-葡萄糖苷酶溶液和50 μL 4-MUG充分混匀,37 ℃避光反应20 min后加入100 μL 甘氨酸钠溶液并振荡30 s终止反应,采用荧光分光光度计测定其在激发波长355 nm,发射波长460 nm处的荧光强度,以阿卡波糖为阳性对照,结果以抑制率表示,采用Origin软件计算抑制率达到50%所需要样品的半抑制质量浓度(half maximal inhibitory concentration,IC50),其中,IC50值越小,则代表α-葡萄糖苷酶活性抑制能力越高。按照公式(5)计算RRE中的α-葡萄糖苷酶抑制率:
α-葡萄糖苷酶抑制率![]()
(5)
式中:As是样品的荧光值;Ac是以样品溶剂代替样品的反应体系的荧光值(控制组);Ab是以磷酸钾缓冲液代替酶液的反应体系的荧光值(空白组)。
1.5 乙酰胆碱酯酶活性抑制能力
参考MALAR等[16]的方法略作调整,取50 μL样品溶液于96孔酶标板,加入90 μL ATCI溶液和DTNB溶液的混合液于30 ℃下温育10 min,加入20 μL乙酰胆碱酯酶溶液充分混匀后,再加入50 μL磷酸钠缓冲液振荡10 s终止反应。每隔1 min在405 nm下测定1次吸光值,共测5次,每次测定前振荡10 s,以加兰他敏为对照,结果以抑制率表示,采用Origin软件计算样品的IC50值,其中,IC50值越小,则代表乙酰胆碱酯酶活性抑制能力越高。根据公式(6)计算RRE中的乙酰胆碱酯酶抑制率:
乙酰胆碱酯酶抑制率![]()
(6)
式中:As是样品的吸光值;Ac是以样品溶剂代替样品的反应体系的吸光值(控制组);Ab是以磷酸钾缓冲液代替酶液的反应体系的吸光值(空白组)。
1.6 数据分析
所有实验均重复3次以上,实验数据以平均值±标准偏差表示。采用Origin 8.6软件分析和作图,SPSS 22.0软件进行显著性分析,P<0.05认为样品间具有显著性差异。
2 结果与分析
2.1 总酚、总黄酮含量
酚类物质是植物次生代谢的产物,可有效清除人体内过量的自由基,延缓人体衰老,降低慢性疾病发生。近年来,天然植物多酚以通过清除过多的自由基来保护人类免受疾病威胁,已经成为安全、有效抗氧化剂的新来源[17]。根据没食子酸标准曲线计算出RRE的总酚含量为(446.392±51.707) mg GAE/g,约是其同属植物华东覆盆子嫩叶的6.4倍[13],甘扎嘎日果的7.1倍[18];天然来源的黄酮类化合物具有显著的生物活性,对人体具有抗氧化、抗突变、抗癌和保护血管等功效[19]。根据芦丁标准曲线计算出RRE的总黄酮含量为(638.337±124.537) mg Rutin/g,约是同属植物山莓茎皮的22.2倍[20],华东覆盆子老叶的7.3倍[13]。结果表明,RRE中含有丰富的酚类物质和黄酮类物质,可以作为一种新型高抗氧化膳食补充剂。
2.2 体外抗氧化活性
2.2.1 DPPH自由基清除能力
DPPH是一种稳定和良好定性的有机自由基,DPPH的醇溶液会释放稳定的自由基,在517 nm处有最大强度的吸收峰,故常用于表征样品抗氧化活性的强弱程度[21]。由图1可知,RRE的DPPH自由基清除能力[(871.878±89.338) mg Trolox/g]显著高于VC[(287.707±8.424) mg Trolox/g]和BHT[(87.249±5.837) mg Trolox/g](P<0.05),表明RRE对DPPH自由基具有较强的清除能力,呈现出较强的体外抗氧化能力。RRE的DPPH自由基清除能力强于同属植物覆盆子的甲醇酸相、乙酸乙酯相提取物[22],具有良好的抗氧化活性。结合表1的相关性分析可知,DPPH自由基清除能力与样品中的总酚和黄酮含量都具有很高的相关性,可以通过对RRE的组分进行更深入的分析研究,为制作新型天然抗氧化剂提供新思路。
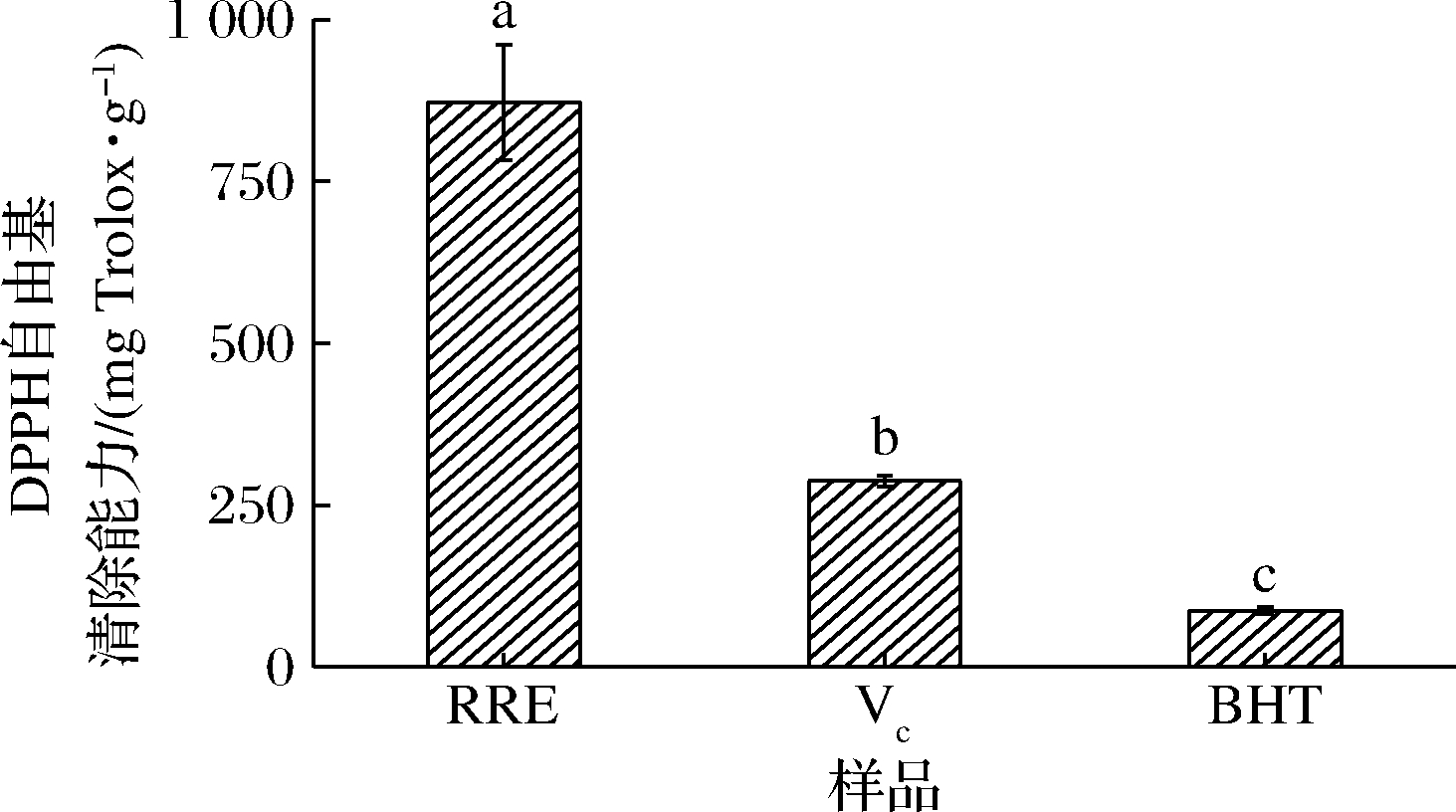
图1 样品与对照物的DPPH自由基清除能力
Fig.1 The DPPH radical scavenging ability of sample and control 注:不同小写字母代表显著性差异(P<0.05)(下同)
表1 总酚、总黄酮与体外抗氧化实验结果之间的相关性分析
Table 1 The correlation analyses between total phenolics, total flavonoids and in vitro antioxidant experiment
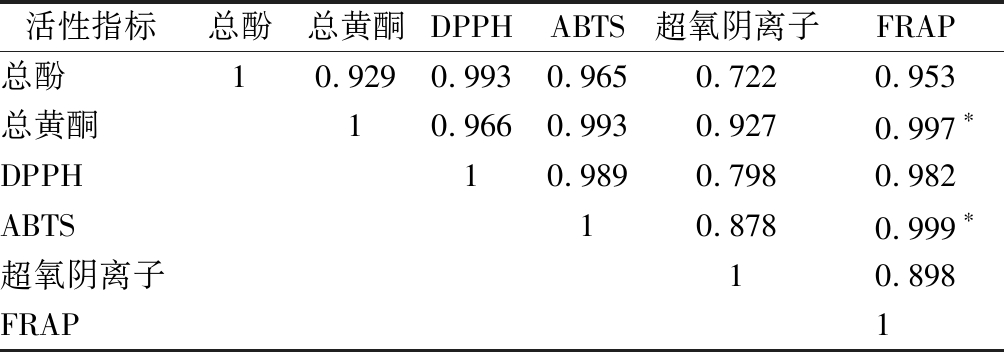
活性指标总酚总黄酮DPPHABTS超氧阴离子FRAP总酚10.9290.9930.9650.7220.953总黄酮10.9660.9930.9270.997∗DPPH10.9890.7980.982ABTS10.8780.999∗超氧阴离子10.898FRAP1
注:*为差异显著(P<0.05)
2.2.2 ABTS阳离子自由基清除能力
ABTS经活性氧氧化会产生稳定的阳离子自由基,呈现出蓝绿色,并在波长734 nm处有最大吸收峰,如样品溶液与ABTS阳离子自由基发生反应,使该反应体系褪色,则可说明该样品中某些成分具有ABTS阳离子自由基清除活性,可以反映样品的抗氧化能力[23]。由图2可知,清除ABTS阳离子自由基的能力大小依次为VC[(9 583.422±1 376.617)mg Trolox/g]>BHT[(6 042.451±1 298.696)mg Trolox/g]>RRE[(1 177.854±87.024)mg Trolox/g],虽然低于阳性对照VC和BHT(P<0.05),但其清除能力仍强于同属植物黑果悬钩子的茎部[24]。与阳性对照相比,RRE的ABTS阳离子自由基清除能力的结果与DPPH自由基清除能力的结果有所差异,原因在于两者的机理之间不同[23],VC和BHT更有利于清除ABTS阳离子自由基。研究表明,植物中的酚类物质是清除ABTS阳离子自由基的主要活性成分[25],结合表1的相关性分析,ABTS阳离子自由基清除能力与样品中总酚含量之间具有很高的相关性,而RRE中酚类化合物含量丰富,说明RRE具有一定的ABTS阳离子自由基清除能力。
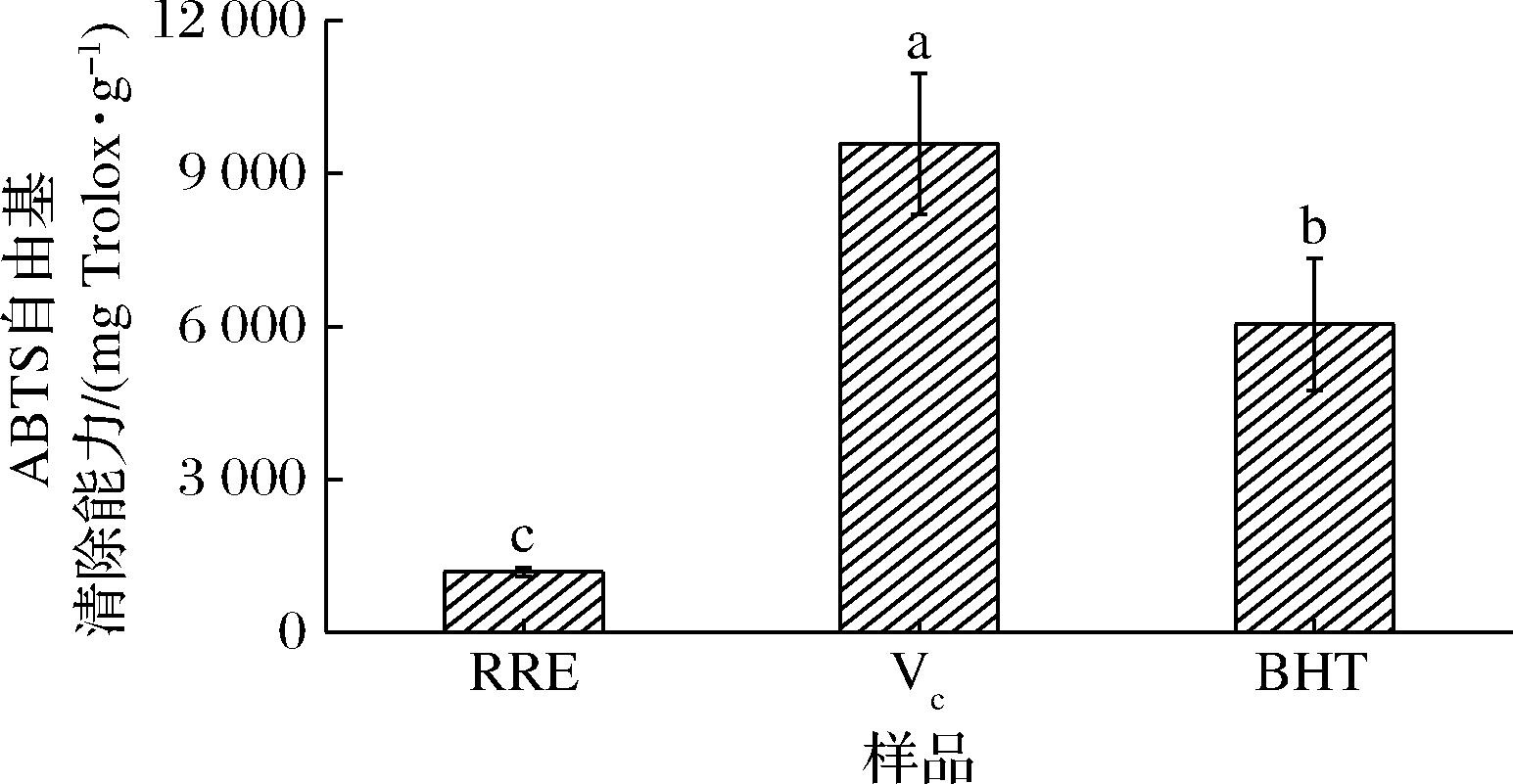
图2 样品与对照物的ABTS阳离子自由基清除能力
Fig.2 The ABTS+ radical scavenging ability of sample and control
2.2.3 超氧阴离子自由基清除能力
超氧阴离子自由基可以诱导生物体内的氧化应激和脂质过氧化,当生物体内超氧阴离子自由基过量时,会破坏血脑屏障和使细胞死亡,增加脑出血的可能,严重地威胁人类健康[26]。所以超氧阴离子自由基清除能力的强弱是评价样品抗氧化能力的一个重要指标。由图3可知,超氧阴离子自由基清除能力大小依次为VC[(1 513.921±30.717) mg Trolox/g]>RRE[(419.928±54.146) mg Trolox/g]>BHT[(247.193±15.159) mg Trolox/g]。相关性分析显示,RRE中超氧阴离子自由基清除能力与总黄酮含量相关性最高,与总酚含量的相关性不高。RRE的超氧阴离子自由基清除能力优于BHT(P<0.05),可较好地清除超氧阴离子自由基,表明RRE中某些组分具有开发为食品抗氧化剂的潜力,可以有效延缓食品氧化。
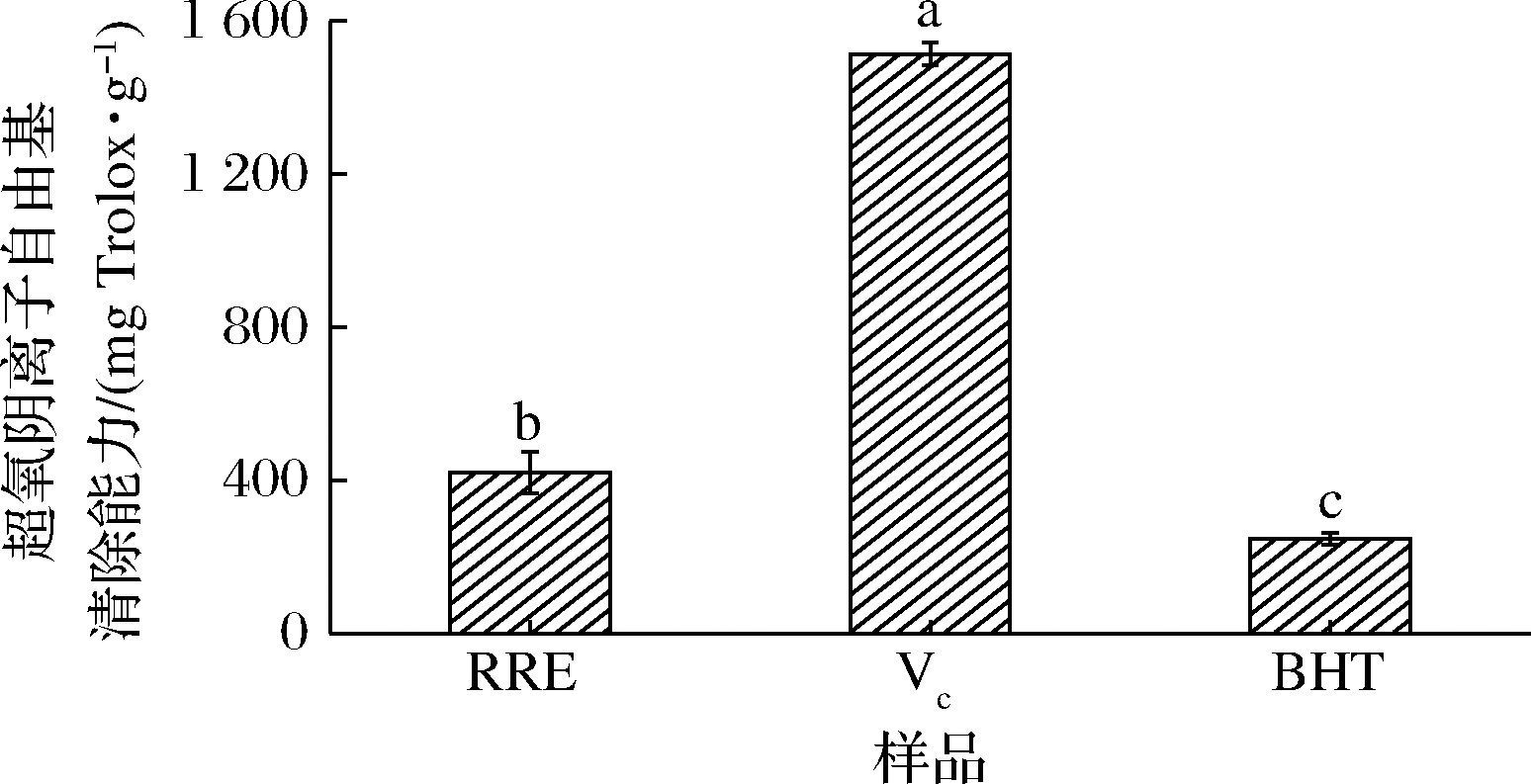
图3 样品与对照物的超氧阴离子自由基清除能力
Fig.3 The superoxide anion radical scavenging ability of sample and control
2.2.4 铁还原能力
FRAP法是基于氧化还原的比色法,在酸性条件下,Fe3+与TPTZ形成Fe3+-TPTZ复合物,其在还原物质的作用下会被还原为二价铁,呈现蓝色,并在593 nm处具有最大吸收峰。因此,在此波长下进行吸光值变化的检测,可以反映出样品铁还原的能力[27]。由图4可知,铁还原能力大小依次为VC[(2 016.666±28.151) mg Trolox/g]>RRE[(1 827.378±222.059) mg Trolox/g]>BHT[(1 243.333±33.664) mg Trolox/g],RRE的铁还原能力较强,与VC相比无显著性差异(P>0.05),并显著高于BHT(P<0.05),相关性分析也表明,FRAP与样品中的总酚、总黄酮含量的相关性均较高,其相关性系数分别达到了0.953和0.997,结合样品清除DPPH自由基、ABTS阳离子自由基和超氧阴离子自由基的实验结果可以得出,RRE是一种较好的天然抗氧化资源。
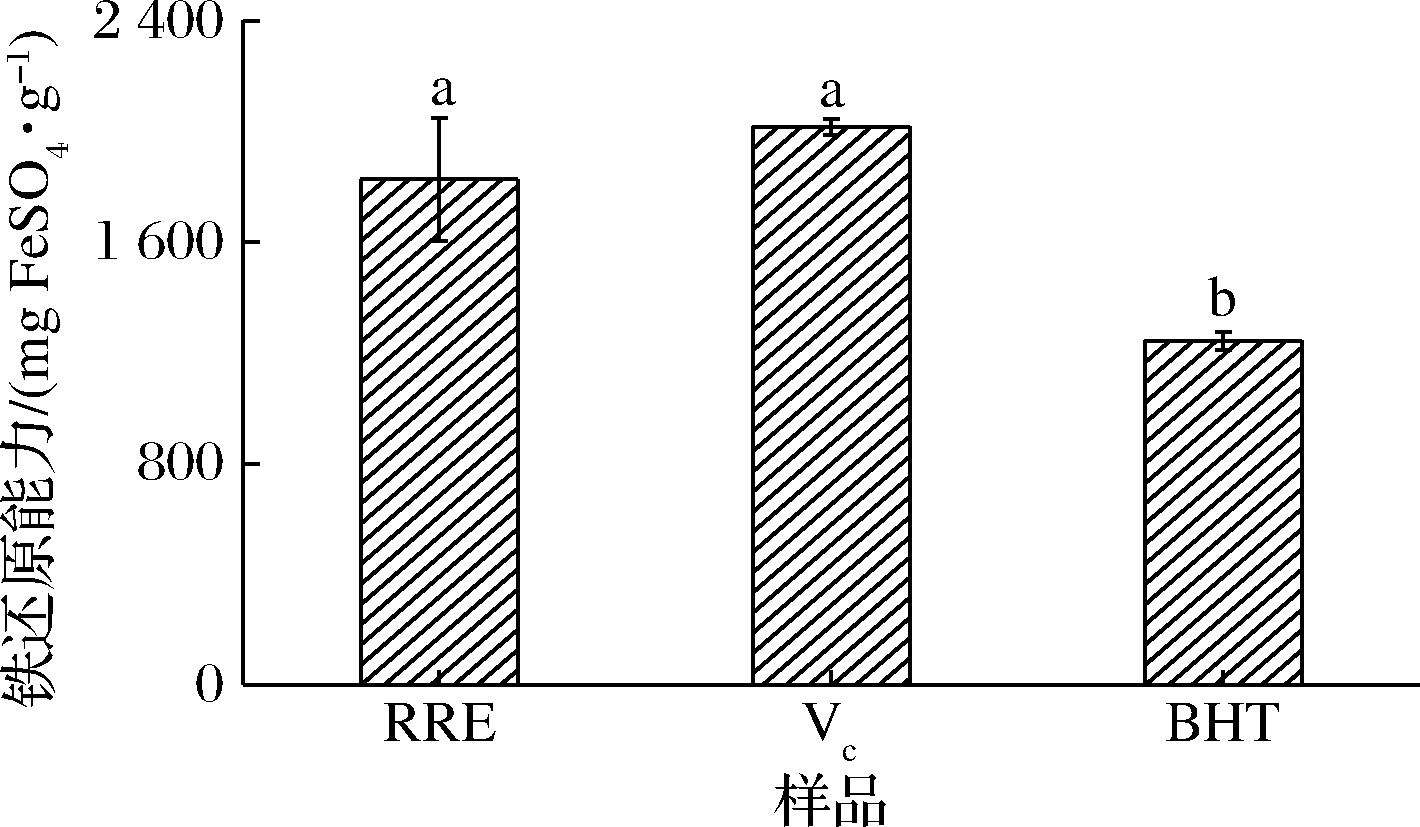
图4 样品与对照物的FRAP能力
Fig.4 The FRAP ability of sample and control
2.3 α-葡萄糖苷酶活性抑制能力
治疗糖尿病的关键措施是控制并降低患者的血糖含量,主要是通过抑制小肠上α-葡萄糖苷酶的活性,从而降低对摄入的碳水化合物的消化,延缓人体对葡萄糖的吸收来治疗糖尿病。目前,国内市场上主要的α-葡萄糖苷酶抑制剂是阿卡波糖,它对Ⅱ型糖尿病有确切的疗效[28]。通过测定样品的α-葡萄糖苷酶活性抑制能力,从而评估其潜在的抗糖尿病能力。由图5可知,在一定的质量浓度范围内,α-葡萄糖苷酶抑制能力与样品质量浓度存在明显的剂量-效应关系,随样品的质量浓度的增大而升高,其IC50值为(1.314±0.070) mg/mL,高于糖尿病临床治疗物阿卡波糖的IC50值(0.487±0.098)mg/mL(P<0.05)。但从图5也可以看出,RRE还是具有一定的α-葡萄糖苷酶抑制能力,且呈现剂量依赖性,可以对其活性成分进行富集和分离纯化,以评估其单体化合物的α-葡萄糖苷酶抑制能力。
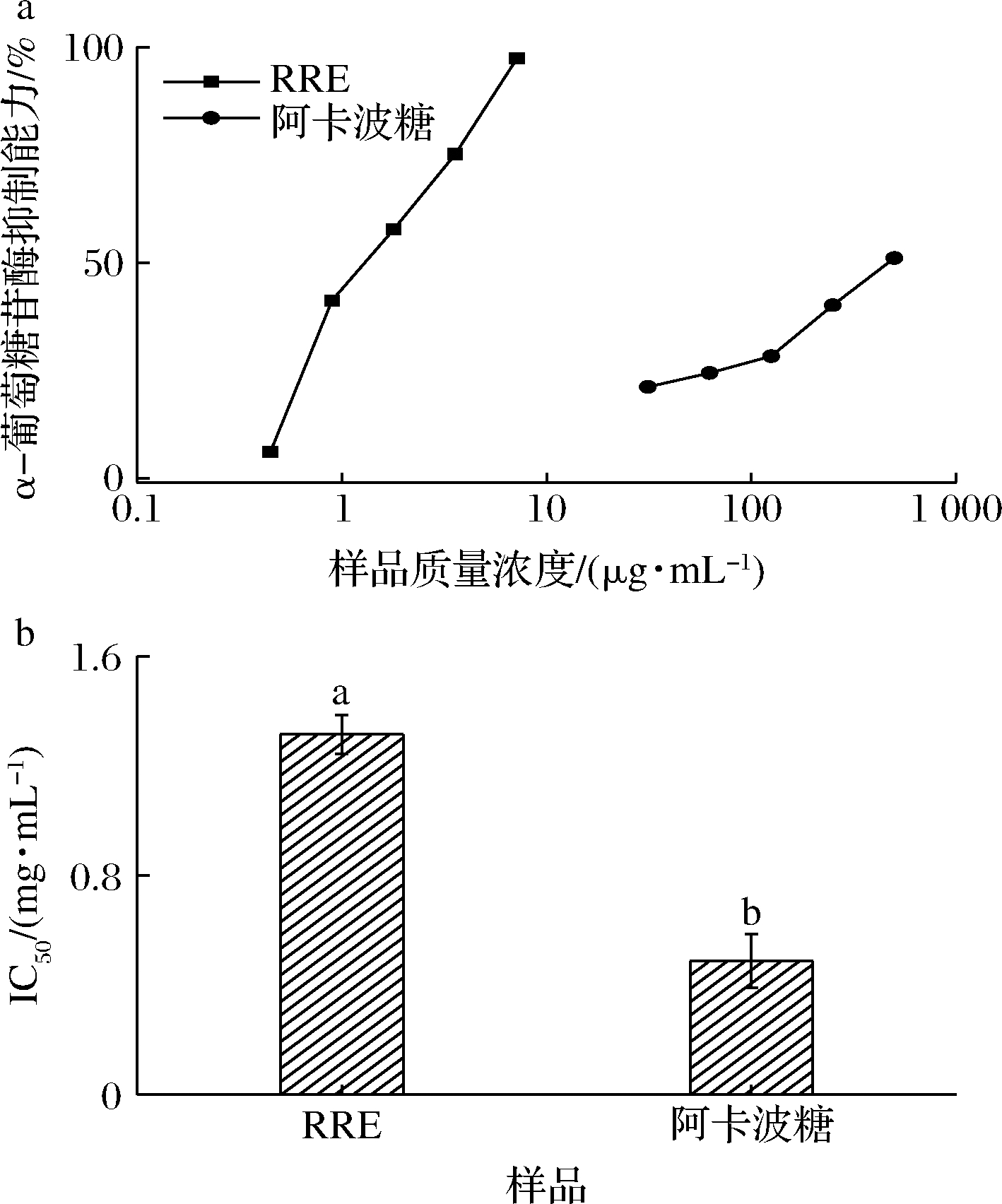
a-α-葡萄糖苷酶清除率;b-IC50值
图5 样品的α-葡萄糖苷酶抑制能力
Fig.5 The α-glucosidase inhibition of sample
2.4 乙酰胆碱酯酶活性抑制能力
AD又被称为老年痴呆症,是一种在老年人中常见的进行性发展的神经系统退行性疾病,主要的临床表现有记忆受损和认知功能减退,严重影响患者的生活质量。发生AD的关键原因在于患者大脑中神经递质乙酰胆碱的缺失,而乙酰胆碱酯酶可催化乙酰胆碱的裂解,使其缺失的速度加快。加兰他敏是乙酰胆碱酯酶的竞争性可逆抑制剂,常被用于临床治疗AD的研究[29]。由图6可知,在一定质量浓度范围内,RRE的乙酰胆碱酯酶抑制能力与其质量浓度呈正相关,并呈现剂量依赖性,RRE的乙酰胆碱酯酶抑制能力的IC50值为(403.347±18.162) μg/mL,同样也高于加兰他敏(1.062±0.128) μg/mL(P<0.05),也远高于黄柏、元胡等中草药乙酸乙酯提取物的295.12、29.09 mg/L[30]。
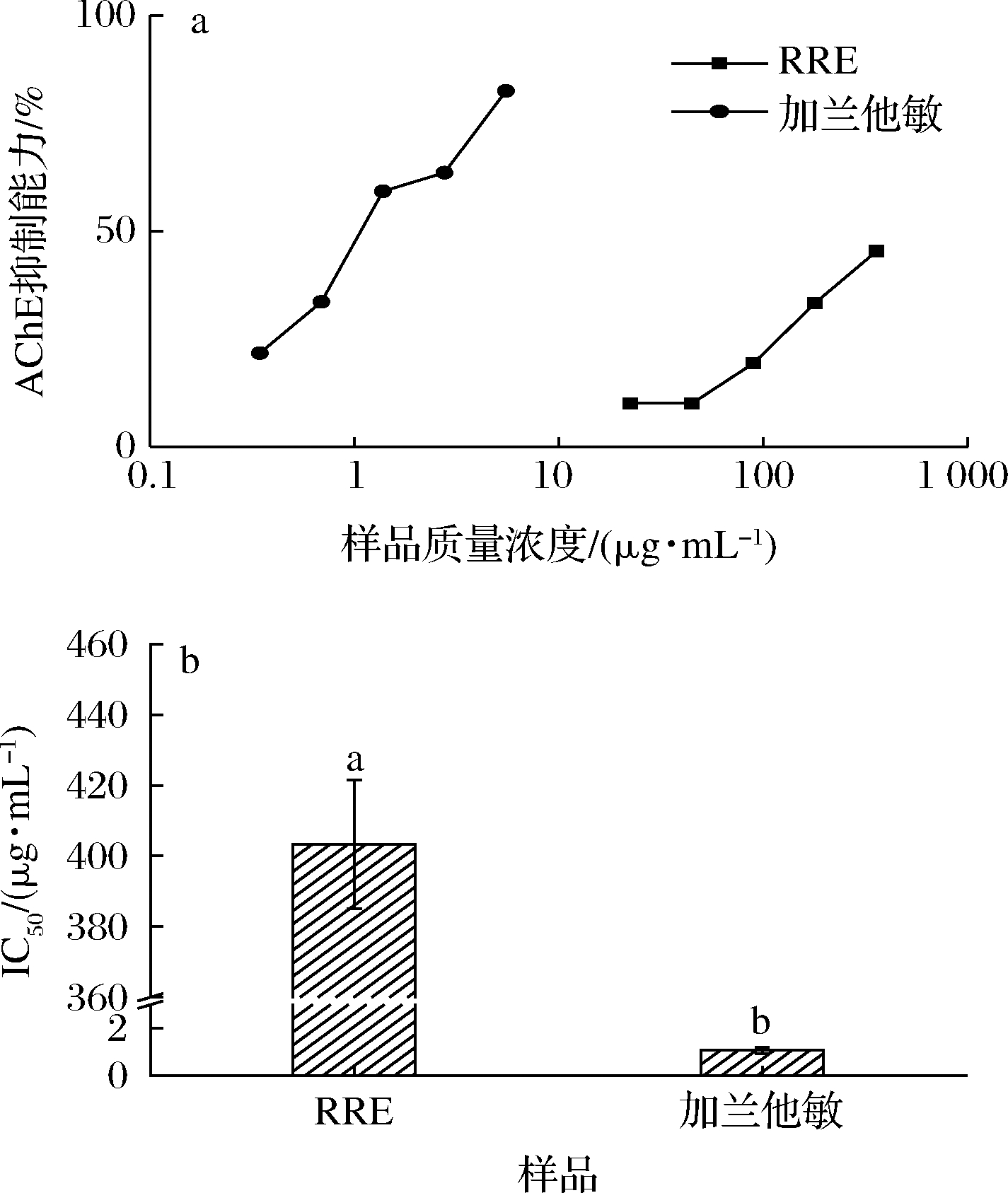
a-AchE酶清除率;b-IC50值
图6 样品的AChE抑制能力
Fig.6 The AChE inhibition of sample
3 结论
本研究对悬钩子属茅莓的根部粗提物的有效成分、体外抗氧化活性、α-葡萄糖苷酶和乙酰胆碱酯酶的抑制能力进行了研究。结果表明,RRE总酚含量为446.392 mg GAE/g,总黄酮含量为638.337 mg Rutin/g。体外抗氧化试验的结果为DPPH自由基清除能力为871.878 mg Trolox/g,ABTS阳离子自由基清除能力为1 177.854 mg Trolox/g,铁还原能力为1 827.378 mg FeSO4/g,超氧阴离子自由基清除能力为419.928 mg Trolox/g。RRE的α-葡萄糖苷酶抑制能力的IC50值为1.314 mg/mL,乙酰胆碱酯酶抑制能力的IC50值为403.347 μg/mL。结果表明,茅莓根具有较强的体外抗氧化能力和α-葡萄糖苷酶和乙酰胆碱酯酶抑制能力,可能与茅莓根体内含量丰富的酚类物质、黄酮类物质有关,具有开发成天然抗氧化剂和降血糖、预防老年痴呆的药物的潜力。后续拟对RRE进行分离纯化和结构鉴定等工作,将其运用在食品、药品领域中,对茅莓根的开发利用具有重要的意义。
[1] 王朝婷, 姜涛, 何坤明, 等.梵净山野生茅莓果的感官评价及营养成分分析[J].农产品加工, 2018(2):38-39:43.
WANG C T, JIANG T, HE K M, et al.Analysis of the nutrition components of wild raspberries in mount Fanjing[J].Agricultural Products Processing, 2018(2):38-39;43.
[2] 张旭, 蒋丹, 王娟, 等.茅莓根化学成分研究[J].中国药学杂志, 2016, 51(23):1 999-2 004.
ZHANG X, JIANG D, WANG J, et al.Chemical constituents from the roots of Rubus parvifolius[J].Chinese Pharmaceutical Journal, 2016, 51(23):1 999-2 004.
[3] 翟明昌, 吴枫楠, 高美卉.枸杞茅莓保健饮料的制作[J].山东食品发酵, 2008(2):52-54.
ZHAI M C, WU F N, GAO M H.Preparation of Lycium chinense and Rubus parvifolius juice health drink[J].Shandong Food Ferment, 2008(2):52-54.
[4] 南京中医药大学. 中药大辞典[M].上海:上海科学技术出版社, 2006.
Nanjing University of Chinses Medicine.Chinese Materia Medica Dictionary[M].Shanghai:Shanghai Scientific & Technical Publishers, 2006.
[5] 杨柳青, 康力, 黄镛.茅莓根,茎,叶不同药用部位抗炎作用的比较[J].北方药学, 2016,13(7):131-133.
YANG L Q, KANG L, HUANG Y.The study of the effectanti-inflammatoryof roots,stems and leaves from Rubus parvifolius L.[J].Journal of North Pharmacy, 2016,13(7):131-133.
[6] 郑红,刘德胜,丁媛媛,等.茅莓黄酮体外抗氧化活性研究[J].湖北农业科学, 2013, 52(23):5 828-5 831.
ZHENG H, LIU D S, DING Y Y, et al.Antioxidant activities in vitro of flavonoids extracted from Rubus parvifolius L.[J].Hubei Agricultural Sciences, 2013, 52(23):5 828-5 831.
[7] MEI Q X, CHEN X L, XIA X, et al.Isolation and chemotaxonomic significance of chemical constituents from Rubus parvifolius[J].Chinese Herbal Medicines, 2016, 8(1):75-79.
[8] CAO J F, ZHAO X, MA Y, et al.Total saponins from Rubus parvifolius L.Inhibits cell proliferation, migration and invasion of malignant melanoma in vitro and in vivo[J].Bioscience Reports, 2021, 41(1).DOI:10.1042/BSR20201178.
[9] 张雪春, 刘江, 吴鑫, 等.微波辅助提取蛇莓多酚及其体外抗氧化、抑制α-葡萄糖苷酶和乙酰胆碱酯酶能力研究[J].西南农业学报, 2018, 31(6):1 171-1 179.
ZHANG X C, LIU J, WU X, et al.Microwave-assisted extraction, in vitro antioxidant activity, α-glucosidase inhibition and acetylcholinesterase inhibition of Duchesnea indica polyphenols[J].Southwest China Journal of Agricultural Sciences, 2018, 31(6):1 171-1 179.
[10] 张雪春, 廖靖怡, 谢颖欣, 等.藜麦提取物的抗氧化活性及藜麦红豆复合饮料的研制[J].生物加工过程, 2018, 16(3):91-101.
ZHANG X C, LIAO J Y, XIE Y X, et al.Determination of in vitro antioxidant capacity of quinoa extracts and preparation of azuki bean-quinoa beverage[J].Chinese Journal of Bioprocess Engineering, 2018, 16(3):91-101.
[11] ZHANG L, TU Z C, XIE X, et al.Antihyperglycemic, antioxidant activities of two acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS:New natural sources of functional constituents[J].Industrial Crops & Products, 2016, 89:522-532.
[12] 吴昆明, 凌阿静, 胡新中, 等.干燥方式对苦荞麦芽色泽、多酚及抗氧化活性的影响[J].食品与发酵工业, 2016, 42(11):115-120.
WU K M, LING A J, HU X Z, et al.Effects of drying methods on color, polyphenol content and antioxidant activity of tartary buckwheat sprouts[J].Food and Fermentation Industries, 2016, 42(11):115-120.
[13] 陈青青, 李柯, 唐晓清, 等.华东覆盆子果、茎与叶的酚类成分及抗氧化活性分析[J].食品科学, 2020, 41(24):209-215.
CHEN Q Q, LI K, TANG X Q, et al.Analysis of phenolic composition and antioxidant activities in fruits, stems and leaves of Rubus chingii Hu[J].Food Science, 2020, 41(24):209-215.
[14] 刘江, 程群, 王振兴, 等.云南乳饼中乳酸菌的筛选及其功能活性[J].食品与发酵工业, 2020, 46(4):160-166.
LIU J, CHENG Q, WANG Z X, et al.Screening and functional activity of lactic acid bacteria in Yunnan milk cake[J].Food and Fermentation Industries, 2020, 46(4):160-166.
[15] LIAO H, BANBURY L.Different proportions of huangqi (Radix astragali mongolici) and honghua (Flos carthami) injection on α-glucosidase and α-amylase activities[J].Evidence-Based Complementray and Alternative Medicine, 2015.DOI:10.1155/2015/785193.
[16] MALAR D S, SHAFREEN R B, PANDIAN S K, et al.Cholinesterase inhibitory, anti-amyloidogenic and neuroprotective effect of the medicinal plant Grewia tiliaefolia-an in vitro and in silico study[J].Pharmaceutical Biology, 2017, 55(1):381-393.
[17] VACCA R A, VALENTI D, CACCAMESE S, et al.Plant polyphenols as natural drugs for the management of down syndrome and related disorders[J].Neuroscience and Biobehavioral Reviews, 2016, 71:865-877.
[18] 热增才旦, 李杰加, 周加本, 等.甘扎嘎日果总酚纯化工艺及抗氧化活性[J].食品科技, 2019, 44(11):259-266.
REZEN C D, LI J J, ZHOU J B, et al.Purification process and antioxidant activity of phenol in Kandra kari[J].Food Science and Technology, 2019, 44(11):259-266.
[19] KOPUSTINSKIENE D M, JAKSTAS V, SAVICKAS A, et al.Flavonoids as anticancer agents[J].Nutrients, 2020, 12(2):457.
[20] 石登红, 蒋华梅, 刘燕, 等.山莓茎皮总黄酮的提取及其抗氧化活性[J].贵州农业科学, 2015, 43(6):36-39;43.
SHI D H, JIANG H M, LIU Y, et al.Extraction of flavonoids from Rubus corchorifolius bark and its antioxidant activity[J].Guizhou Agricultural Sciences, 2015, 43(6):36-39;43.
[21] MOLYNEUX P.The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant[J].Songklanakarin Journal of Science and Technology, 2004, 26(2):211-219.
[22] 张乃丹. 覆盆子多酚提取工艺及不同溶剂提取物抗氧化抑菌活性[D].杭州:浙江农林大学, 2013.
ZHANG N D.Study on Raspberry polyphenols extraction and different solvent extracts antioxidant antibacterial activity[D].Hangzhou:Zhejiang A&F University, 2013.
[23] WANG R J, HU M L.Antioxidant capacities of fruit extracts of five mulberry genotypes with different assays and principle components analysis[J].Journal of Food Properties, 2011, 14(1):1-8.
[24] 李转红, 郭寒, 徐文斌, 等.新疆3种植物不同提取部位的抗氧化活性及其对PTP1B的抑制作用[J].中国实验方剂学杂志, 2015,21(19):28-33.
LI Z H, GUO H, XU W B, et al.Antioxidant activities and PTP1B inhibitory effect of different extracts from three Xinjiang plants[J].Chinese Journal of Experimental Traditional Medical Formulae, 2015,21(19):28-33.
[25] ZHANG L, TU Z C, WANG H, et al.Antioxidant activity and phenolic acids profiles of Artemisia selengensis turcz extracted with various methods by HPLC-QTOF-MS/MS[J].Journal of Food Biochemistry, 2016, 40(4):603-612.
[26] YU G, ZHANG S J, FAN M C, et al.Ultrasound-assisted extraction and comparison of extraction methods based on antioxidant activities of polysaccharides from flammulina velutipes[J].Journal of Food Measurement and Characterization, 2017, 11(4):1 752-1 760.
[27] CACIQUE A P, BARBOSA É S, DEPINHO G P, et al.Miniaturized methodologies for determining the total phenol and flavonoid concentrations and the antioxidant activity[J/OL].Food Analytical Methods, 2021.DOI:10.1007/S12161-020-01934-W.
[28] ZHANG L, ZHU M F, TU Z C, et al.α-glucosidase inhibition, anti-glycation and antioxidant activities of Liquidambar formosana Hance leaf, and identification of phytochemical profile[J].South African Journal of Botany, 2017, 113:239-247.
[29] CHEN Y.Research progress in the pathogenesis of Alzheimer′s disease[J].Chinese Medical Journal (English Edition), 2018, 131(13):1 618-1 624.
[30] 周思多, 王晓, 冯金红, 等.基于微量筛选模型的48种中草药提取物乙酰胆碱酯酶抑制活性筛选及评价[J].天然产物研究与开发, 2015, 27(2):328-332;354.
ZHOU S D, WANG X, FENG J H, et al.Screening and evaluation of acetylcholinesterase inhibitory activity based on microscale screening model of 48 traditional chinese medicines[J].Natural Product Research and Development, 2015, 27(2):328-332;354.