即食食品是一类以肉、蛋、粮食、蔬菜等为原料,根据消费者饮食需要加工制作而成,打开即可食用的食品[1]。然而,由于即食食品需要经过工业化生产,在加工、运输、贮藏、销售[2]等环节中易受到微生物污染[3-5],因而需要在烹饪、包装之后再进行严格的杀菌。近年来即食食品微生物超标导致食物中毒的现象不断发生,对人们身体健康产生了很大的威胁[6]。
蜡样芽孢杆菌(Bacillus cereus)在自然界分布广泛[7],能够产生抗性极强的芽孢,当数量超过103CFU/g时即可能引起人呕吐和腹泻,从而对消费者健康造成威胁[8]。成都市市售食品中蜡样芽胞杆菌污染达17.6%[9],在猪肉[10]等食品中也检测出较高的蜡样芽孢杆菌污染率[11],其中熟肉制品污染风险较高[12]。因此,如何保证即食食品的安全性,有效杀死即食食品中的蜡样芽孢杆菌,已成为即食食品安全控制的重要问题。
即食食品的杀菌技术主要包括热杀菌和非热杀菌技术,非热杀菌包含低温等离子体、超高压[13]和脉冲强光[14-15]等,但热杀菌技术仍是目前最普遍和高效的杀菌方式。在食品生产中,高温高压杀菌会严重破坏食品的品质,影响口感。在食品中添加抗菌剂也是食品安全控制的重要手段之一,化学抗菌剂会产生一定的毒副作用,天然抗菌剂是从植物、动物或微生物中提取出来的天然无毒物质[16],其中,肉桂醛是肉桂精油的主要成分,具有香味,是绿色安全的天然抗菌剂[17-18],对金黄色葡萄球菌[19]、大肠杆菌[20]、李斯特菌[18]等食源性致病菌都具有良好的抑制作用。王舒叆等[21]研究了肉桂醛对蜡样芽孢杆菌的抑制效果,发现肉桂醛是一种具有广阔应用前景的天然抗菌剂,抑菌效果好于乳酸链球菌素。
随着信息化的发展,预测微生物学发展迅速,通过建立数学模型可简单快速地预测不同环境因子下致病菌的生长和失活规律,从而对食品的货架期和杀菌效率进行有效预测[22]。虽然目前国内外学者使用预测微生物模型拟合蜡样芽孢杆菌的生长曲线的研究已有报道[23],但有关即食牛肉中蜡样芽孢杆菌热失活模型的研究尚未见报道。
本研究以即食牛肉为载体,研究不同低强度热处理条件下,不同浓度的肉桂醛对蜡样芽孢杆菌热失活动力学的影响,建立其热失活一级模型和二级模型,以期为即食食品安全控制技术的建立提供参考。
1 材料与方法
1.1 试剂与材料
肉膏蛋白胨肉汤(luria bertani,LB)、胰蛋白胨大豆琼脂(tryptose soya agar,TSA)、平板计数琼脂(plate count agar,PCA)、酵母浸粉(yeast extract,YE)、磷酸盐缓冲液(phosphate buffer saline,PBS),北京路桥技术股份有限公司;氯化钠(分析纯),天津市德恩化学试剂有限公司;肉桂醛(纯度99%),吉安市国光香料厂;蜡样芽孢杆菌CMCC(B)63303,中国医学微生物菌种保藏管理中心;牛肉糜、食盐、味精,购自郑州当地的双汇超市。
1.2 仪器与设备
SX-500高压蒸汽灭菌锅,日本 Tomy 公司;JJ-CJ-1FD洁净工作台,苏州净化有限公司;MX-S混合仪,大龙兴创实验仪器有限公司;LHP-250智能恒温恒湿培养箱,上海鸿都电子科技有限公司;TGL-16G高速台式离心机,上海安亭科技仪器厂;移液枪(10~1 000 μL),德国 Eppendorf 公司;SCIENTZ-11无菌均质器,宁波新芝生物科技股份有限公司;SHZ-82A水浴恒温振荡器,金坛医疗仪器厂。
1.3 实验方法
1.3.1 菌种保藏与菌悬液的制备
蜡样芽孢杆菌CMCC(B)63303于-80 ℃的甘油管中保藏。在无菌条件下,将贮存的蜡样芽孢杆菌接种到营养琼脂平板(TSA+0.6%YE)上,37 ℃下培养10 h,挑取单菌落至无菌的肉汤培养基(LB+0.6%YE)中,150 r/min 37 ℃摇床上培养10 h至指数后期(约108~109 CFU/mL)。放在4 ℃冰箱备用。
1.3.2 即食牛肉的制作
新鲜牛肉糜购自郑州当地的双汇超市,随后立即保存在-30 ℃冰箱中,本研究选择牛肉糜作为原材料,主要因为牛肉糜可作为预制菜肴产品的主要成分,且可以与抗菌剂均匀混合,从而充分发挥其作用。使用前,将牛肉解冻,使用纱布包裹,清水清洗3次,除去肉中血水,100 g的肉糜使用1 000 mL的盐水进行煮制,加盐量为5 g/L,味精为1 g/L,煮制时间为15 min。煮制结束后将肉粒捞出除去多余汤汁,尽快放入无菌自封袋中,放置无菌操作台进行分装,经PCA检测细菌为阴性。
1.3.3 肉桂醛的添加和蜡样芽孢杆菌的接种
将煮好的牛肉糜在无菌操作台中进行分装,每个无菌均质袋装10 g左右的牛肉糜,添加肉桂醛使其质量分数分别为0%、0.1%、0.5%、1.0%[18]。将两者充分混匀后,再每袋添加100 μL菌液,使初始菌落数约为108 CFU/g,进行充分搅拌,压平,厚度为1 mm左右,袋内尽量不要有空气,最后密封。
1.3.4 热处理
将准备好的样品放在预热好的恒温水浴锅中进行热处理,水浴的温度分别为55、60、65、70 ℃,经过热处理后立即放入冰水中降温,并尽快进行计数。
1.3.5 蜡样芽孢杆菌的计数
将处理后的样品,在无菌条件下加入90 mL的0.85%无菌生理盐水,以11 次/s拍打5 min。取100 μL菌悬液经梯度稀释后,进行涂布,每个处理3个平行,放置在37 ℃培养。
1.3.6 数据处理与曲线拟合
使用Microsoft Excel 2016进行平均数、STDEV的计算和图表的绘制。一级模型使用IPMP2013软件进行曲线拟合。weibull模型如公式(1)所示:
(1)
式中:t为时间,Y0为初始菌落数,CFU/g;Y(t)为在时间t时的菌数,CFU/g;D和α为图形参数。
二级模型是建立菌落数与温度和浓度之间的关系。t5.0是菌落数降低5 lgCFU/g所需要的时间,可以用来评价杀菌效果[18]。多项式模型如公式(2)所示:
lnt5.0=a+b×(eΤ+fC)+c×(eΤ+fC)2+d×(eΤ+fC)3
(2)
式中:a、b、c、d、e、f均为模型参数;T为处理的温度,℃;C为肉桂醛的浓度,%。
1.3.7 二级模型的评价
为了验证建立模型的可靠性,使用准确度(Af)和偏差度(Bf)、均方根误差(root mean squared error,RMSE)对预测值和实测值进行检验分析。Af的值越接近于1,说明准确度越高;Bf越趋近于1,说明模型的偏差度越小。RMSE表示模型的适用性,该值越接近于0,说明模型越适用[24]。表达式如公式(3)~公式(5)所示:
(3)
(4)
(5)
2 结果与分析
2.1 即食牛肉中蜡样芽孢杆菌热失活初级模型的建立
为了研究不同温度下肉桂醛对即食牛肉中蜡样芽孢杆菌热失活的影响,选择55、60、65、70 ℃这4个温度进行研究,使用IPMP2013软件对数据进行拟合,拟合结果如表1和图1所示。误差平方和(sum of squares due to error,SSE)、均方误差(mean squared error,MSE)、RMSE和Residual stdev的值均接近于0,Af和Bf的值趋近于1,可以得出weibull模型对即食牛肉中蜡样芽孢杆菌的热失活曲线拟合效果好,准确度较高,能更好的预测蜡样芽孢杆菌的热失活规律。PEREIRA等[25]采用weibull模型对可可豆中蜡样芽孢杆菌孢子的热失活曲线进行了拟合,结果也表明该模型拟合效果较好。
表1 使用weibull模型模拟即食牛肉中蜡样芽孢杆菌的 热失活参数及菌落数降低5 lgCFU/g所需要的时间
Table 1 Use the weibull model to simulate the heat inactivation parameters of B.cereus in ready-to-eat beef and the time required to reduce the number of colonies by 5 lgCFU/g
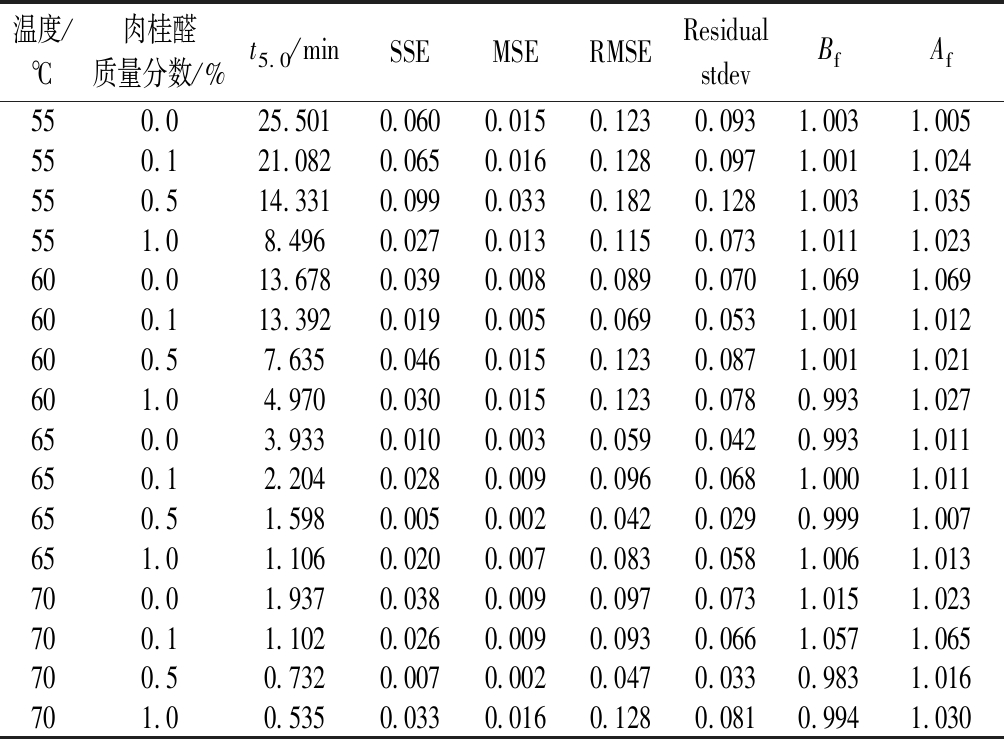
温度/℃肉桂醛质量分数/%t5.0/minSSEMSERMSEResidual stdevBfAf550.025.5010.0600.0150.1230.0931.0031.005550.121.0820.0650.0160.1280.0971.0011.024550.514.3310.0990.0330.1820.1281.0031.035551.08.4960.0270.0130.1150.0731.0111.023600.013.6780.0390.0080.0890.0701.0691.069600.113.3920.0190.0050.0690.0531.0011.012600.57.6350.0460.0150.1230.0871.0011.021601.04.9700.0300.0150.1230.0780.9931.027650.03.9330.0100.0030.0590.0420.9931.011650.12.2040.0280.0090.0960.0681.0001.011650.51.5980.0050.0020.0420.0290.9991.007651.01.1060.0200.0070.0830.0581.0061.013700.01.9370.0380.0090.0970.0731.0151.023700.11.1020.0260.0090.0930.0661.0571.065700.50.7320.0070.0020.0470.0330.9831.016701.00.5350.0330.0160.1280.0810.9941.030
当肉桂醛浓度相同时,温度越高,蜡样芽孢杆菌的菌落数降低5 lgCFU/g所需要的时间越短。添加1%的肉桂醛与不添加肉桂醛的样品相比,蜡样芽孢杆菌的t5.0在55、60、65、70 ℃下分别减少了17、8.71、2.83、1.4 min。同时,在相同温度下,肉桂醛的浓度越高,t5.0也逐渐减小,菌落数的降低速度越快,说明肉桂醛的使用降低了即食牛肉中蜡样芽孢杆菌的热抵抗能力。
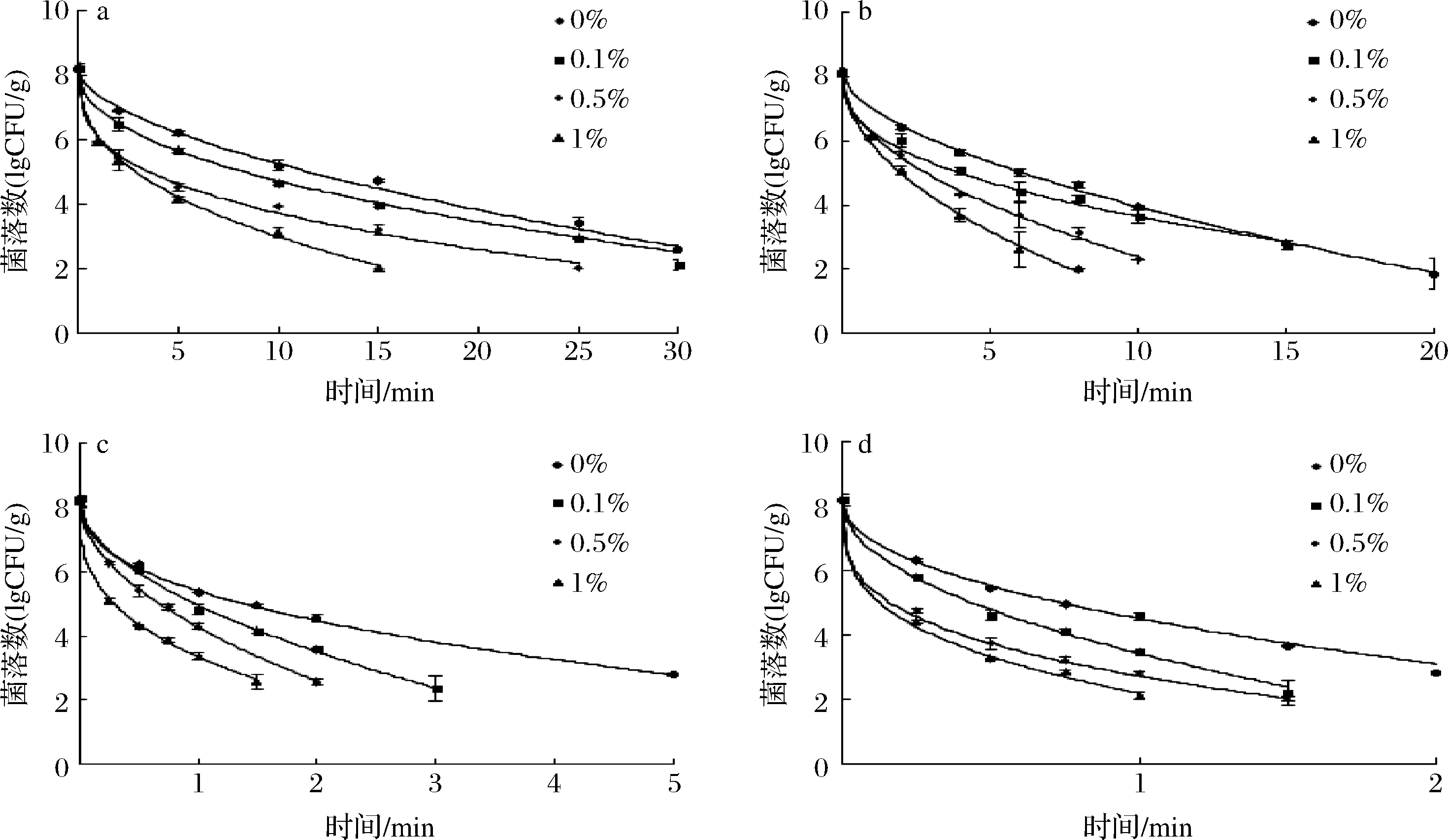
a-55℃;b-60℃;c-65℃;d-70℃
图1 不同温度下添加肉桂醛的即食牛肉中蜡样芽孢杆菌的热失活weibull模型拟合曲线图
Fig.1 Weibull model fitting curve of thermal inactivation of B.cereus in ready-to-eat beef with cinnamaldehyde at different temperatures
2.2 二级模型的建立
根据实验数据,本研究采用多项式方程拟合了蜡样芽孢杆菌的热失活二级模型,拟合曲线如图2所示。采用该多项式二级模型,也成功拟合了温度和抗菌剂对金黄色葡萄球菌生长的影响规律[26]。将一级模型拟合所得到的参数带入公式(2)中,得到二级模型的拟合公式: lnt5.0=-50.748+43.562×(0.058T+0.333C)-11.805×(0.058T+0.333C)2+1.026×(0.058T+0.333C)3。
天然抗菌剂肉桂醛主要通过破坏细胞结构,使内溶物流出导致细胞凋亡[27]。由图2可知肉桂醛的质量分数越大,lnt5.0逐渐下降,不同温度之间下降趋势较为一致;随着温度的升高,lnt5.0呈现阶梯式下降,温度越高,lnt5.0的值越小,蜡样芽孢杆菌的下降速率越快。本研究结果说明肉桂醛能明显降低即食牛肉中蜡样芽孢杆菌的热抗性,提高杀菌效果。
2.3 二级模型的评价
通过计算RMSE、R2、Af和Bf判断二级模型的拟合结果(表2),R2、Af、Bf均接近于1,RMSE的值趋近于0,说明多项式方程拟合二级模型拟合的准确度较高,偏差度较小[28]。由图3可知,残差值呈正态分布的关系,说明多项式模型的拟合结果可靠,能较准确地预测一定温度和肉桂醛条件下即食牛肉中蜡样芽孢杆菌的热杀菌动力学规律。
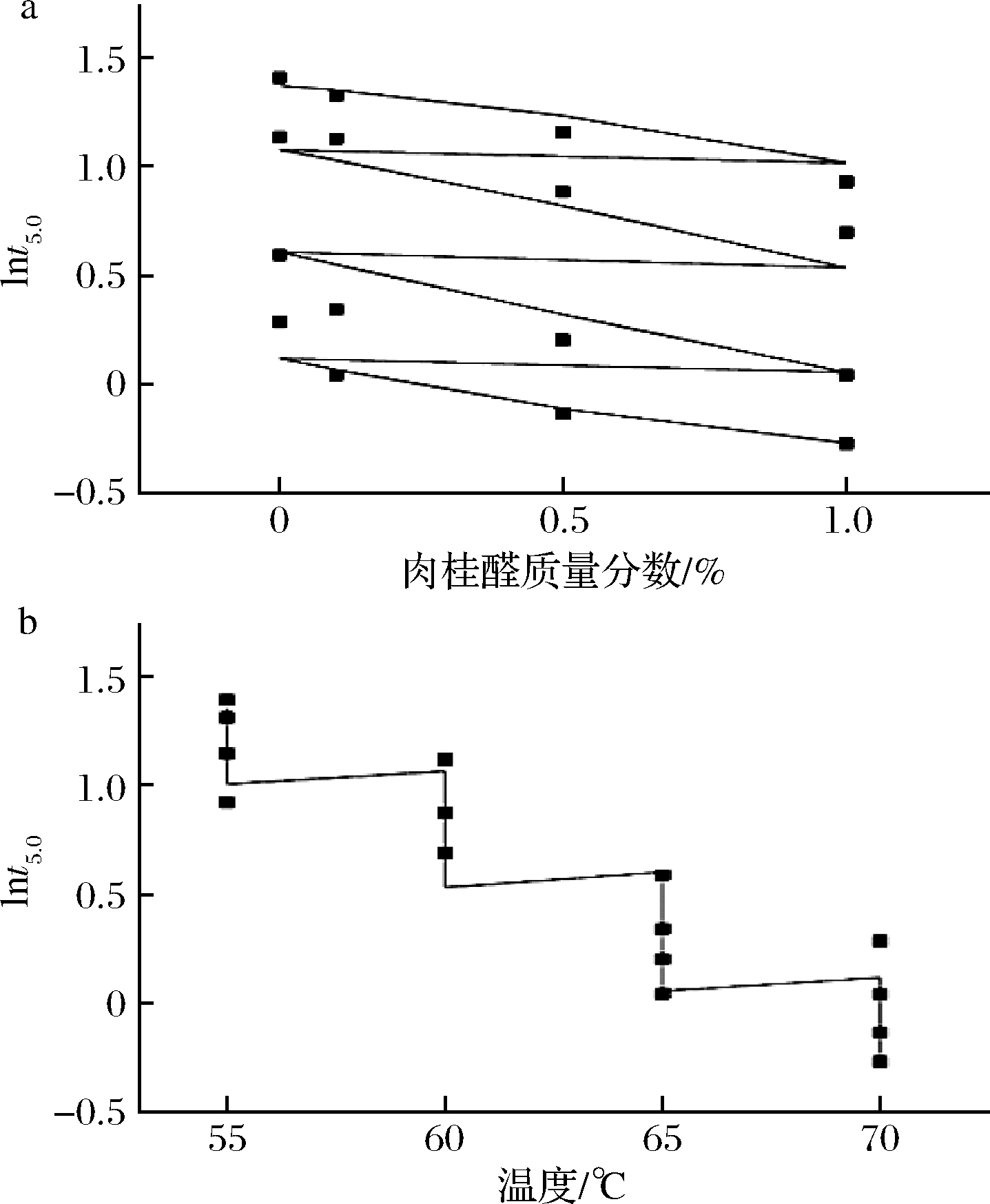
a-肉桂醛浓度;b-温度
图2 温度和肉桂醛浓度与lnt5.0的二级模型拟合图
Fig.2 Fitting diagram of temperature and cinnamaldehyde concentration with lnt5.0 secondary model
表2 多项式模型的拟合结果
Table 2 Fitting results of polynomial models
参数名称RMSER2AfBf数值0.0950.9681.0151.240
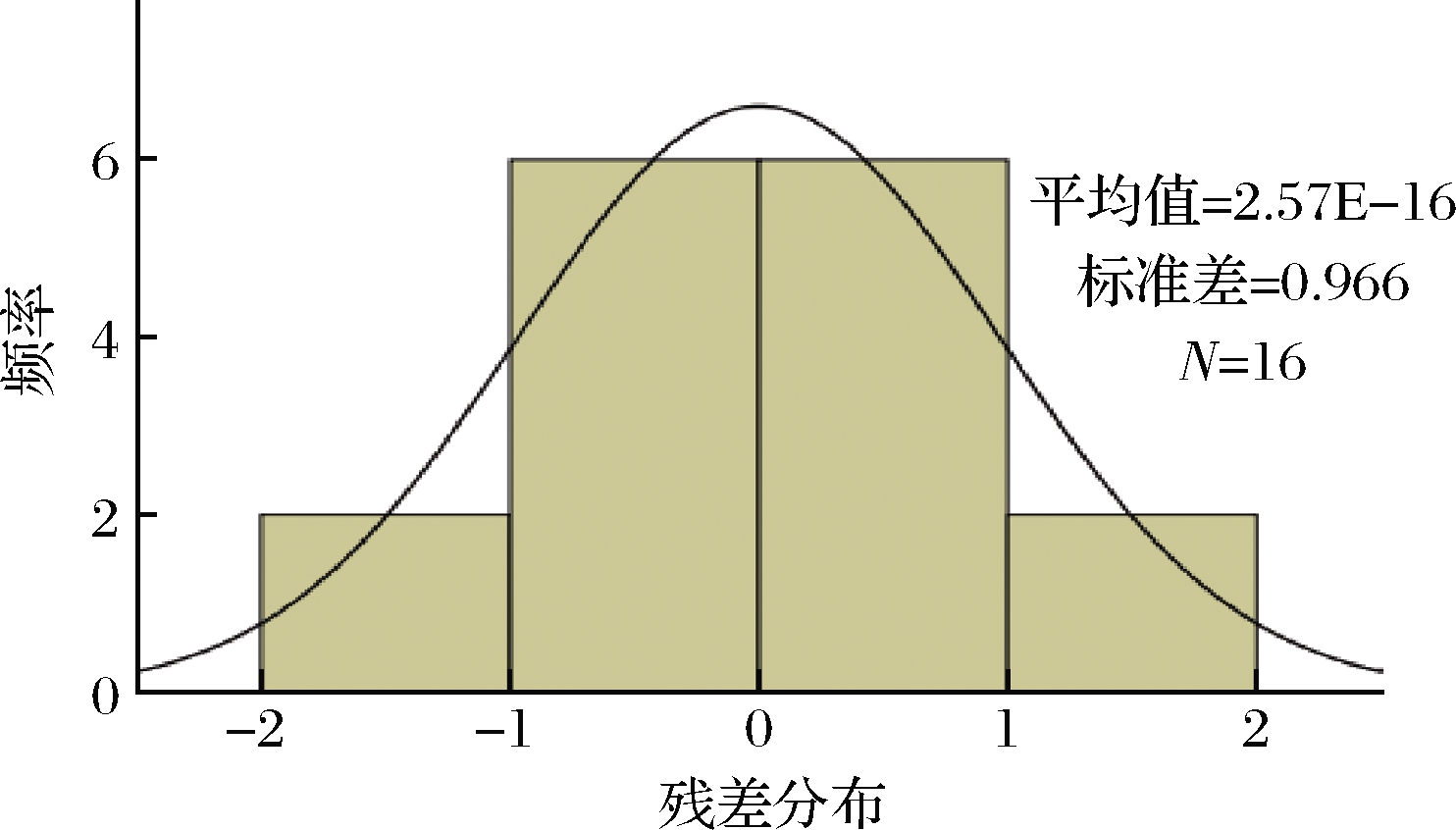
图3 残差分布的验证结果
Fig.3 Validation results for residual distribution
3 结论
本研究分析了天然抗菌剂肉桂醛与热杀菌技术结合对蜡样芽孢杆菌的抑制效果,结果表明肉桂醛的使用降低了蜡样芽孢杆菌对温度的抵抗能力,能够降低即食食品的热杀菌强度,减少对食品品质的影响。并使用weibull和多项式方程分别建立一级和二级模型,并通过参数RMSE、R2、Af、Bf以及残差分布图评价模型拟合效果,所建立的低强度热杀菌模型,可为即食食品安全控制技术的建立提供参考。
[1] 冯海红, 易建勇, 毕金锋, 等.高静压处理对预制绿芦笋品质的影响[J].食品工业科技, 2016, 37(13):101-106;111.
FENG H H, YI J Y, BI J F, et al.Effect of high hydrostatic pressure treatment on the quality of green asparagus[J].Food Industry Technology, 2016, 37(13):101-106;111.
[2] KUKLECI E, SMULDERS FRANS J M, HAMIDI A, et al.Prevalence of foodborne pathogenic bacteria, microbial levels of hygiene indicator bacteria, and concentrations of biogenic amines in ready-to-eat meat products at retail in the Republic of Kosovo[J].Journal of Food Protection, 2019, 82(7):1 135-1 140.
[3] 尤祯丹, 陈传君, 蒋玉涵, 等.即食食品中单增李斯特氏菌快速检测技术的研究进展[J].食品工业科技, 2020, 41(10):358-362.
YOU Z D, CHEN C J, JIANG Y H, et al.Rapid detection of Listeria monocytogenes in ready to eat foods[J].Food Industry Science and Technology, 2020, 41(10):358-362.
[4] IANNETTI L, ACCIARI V A, ANTOCI S, et al.Listeria monocytogenes in ready-to-eat foods in Italy:Prevalence of contamination at retail and characterisation of strains from meat products and cheese[J].Food Control, 2016, 68:55-61.
[5] KARINA P, MILDE-BUSCH A, SCHMICH P, et al.Risk factors for sporadic non-pregnancy associated Listeriosis in Germany-Immunocompromised patients and frequently consumed ready-to-eat products[J].Plos One, 2015, 10(11):e0 142 986.
[6] JENNIFER S C, CORREA M M, ACEVES-DIZE A E, et al.Genomic and toxigenic heterogeneity of Bacillus cereus sensu lato isolated from ready-to-eat foods and powdered milk in day care centers in Colombia[J].Foodborne Pathogens and Disease, 2020, 17(5):340-347.
[7] 黄子彧, 林莹莹, 宋思家, 等.清除蜡样芽孢杆菌生物被膜的CIP程序优化[J].食品科学, 2020, 41(14):138-145.
HUANG Z J, LIN Y Y, SONG S J, et al.Optimization of CIP program for removal of Bacillus cereus biofilm[J].Food Science, 2020, 41(14):138-145.
[8] CARROLL L M, WIEDMANN M, MUKHERJEE M, et al.Characterization of emetic and diarrheal Bacillus cereus strains from a 2016 foodborne outbreak using whole-genome sequencing:Addressing the microbiological, epidemiological, and bioinformatic challenges[J].Frontiers in Microbiology, 2019, 10:144.
[9] 白凤岚, 罗梦幽, 屈云, 等.成都市市售食品中蜡样芽胞杆菌污染状况与毒力基因分析[J].中国食品卫生杂志, 2019, 31(5):429-434.
BAI F L, LUO M Y, QU Y, et al.Contamination status and virulence gene analysis of Bacillus cereus in Chengdu market food[J].Chinese Journal of Food Hygiene, 2019, 31(5):429-434.
[10] OWUSU-ANSAH P, YU X J, OASE R, et al.Optimization of thermosonication on Bacillus cereus from pork:Effects on inactivation and physicochemical properties[J].Journal of Food Process Engineering, 2020, 43(6):e13 401.
[11] CHANG H S, SONG K Y, KIM Y J, et al.Influence of sodium reduction and storage temperature on the growth of total microbes and Bacillus cereus in naturally contaminated hamburger patty and loaf bread[J].Food Science and Biotechnology, 2020,29:1 433-1 438.
[12] YU S B, YU P F, WANG J, et al.A study on prevalence and characterization of Bacillus cereus in ready-to-eat foods in China[J].Frontiers in Microbiology, 2019, 10:3 034.
[13] 贾蒙, 成传香, 王鹏旭, 等.超高压技术在果蔬汁杀菌中的应用[J].食品与发酵工业, 2019, 45(12):257-264.
JIA M, CHENG C X, WANG P X, et al.Application of ultra high pressure technology in sterilization of fruit and vegetable juice[J].Food and Fermentation Industries, 2019, 45(12):257-264.
[14] 吴凯为, 蔡文琪, 张成东, 等.脉冲强光杀菌技术在食品保鲜领域的研究进展[J].食品工业科技, 2019, 40(5):295-299.
WU K W, CAI W Q, ZHANG C D, et al.Research progress of pulsed strong light sterilization technology in food preservation field[J].Food Industry Science and Technology, 2019, 40(5):295-299.
[15] 白妍, 葛雨珺, 向迎春, 等.非热杀菌技术杀灭食品中芽孢效能及机理研究进展[J].食品科学, 2019, 40(15):314-322.
BAI Y, GE Y J, XIANG Y C, et al.Research progress on the efficacy and mechanism of non-thermal sterilization technology in killing spores in food[J].Food Science, 2019, 40(15):314-322.
[16] 张庆霞. 植物源防腐剂的抑菌机理及其在生鲜湿面保鲜中的应用[J].食品与发酵工业,2020,46(21):310-316.
ZHANG Q X.Antibacterial mechanism of plant preservatives and its application in fresh wet noodle preservation[J].Food and Fermentation Industries,2020,46(21):310-316.
[17] 包俊青, 唐亚丽, 卢立新, 等.肉桂醛对明胶基肠衣膜的性能影响[J].食品科学, 2019, 40(14):1-6.
BAO J Q, TANG Y L, LU L X, et al.Effect of cinnamaldehyde on properties of gelatin based casing membrane[J].Food Science, 2019, 40(14):1-6.
[18] WANG Y, LI X, LU Y, et al.Synergistic effect of cinnamaldehyde on the thermal inactivation of Listeria monocytogenes in ground pork[J].Food Science and Technology International, 2020, 26(1):28-37.
[19] 卢杨柳, 马静一, 艾志录, 等.含肉桂醛猪肉糜中金黄色葡萄球菌热失活模型的建立[J].中国食品学报, 2019, 19(9):195-201.
LU Y L, MA J Y, AI Z L, et al.Establishment of heat inactivation model of Staphylococcus aureus in pork surimi containing cinnamaldehyde[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(9):195-201.
[20] ALVES D, CERQUEIRA M A, PASTRANA L M, et al.Entrapment of a phage cocktail and cinnamaldehyde on sodium alginate emulsion-based films to
Fight food contamination by Escherichia coli and Salmonella Enteritidis[J].Food Research International, 2020, 128:108 791.
[21] 王舒叆, 王子元, 张敏.不同抑菌剂对青稞鲜湿面中蜡样芽孢杆菌的抑制作用[J].食品科学, 2020, 41(13):206-211.
WANG S Y, WANG Z Y, ZHANG M.Inhibition of different antimicrobial agents on Bacillus cereus in highland barley fresh wet noodles[J].Food Science, 2020, 41(13):206-211.
[22] 冯晓慧, 王庆国, 王仁欢, 等.牛肉中单增李斯特菌的热失活模型[J].微生物学报, 2011, 51(5):684-691.
FENG X H, WANG Q G, WANG R H, et al.Heat inactivation model of Listeria monocytogenes in beef[J].Acta Microbiologica Sinica, 2011, 51(5):684-691.
[23] 魏超, 代晓航, 郭灵安, 等.蜡样芽孢杆菌在草莓中的生长及预测模型的建立[J].现代食品科技, 2019, 35(9):291-296.WEI C, DAI X H, GUO L A, et al.Growth of Bacillus cereus in strawberry and establishment of prediction model[J].Modern Food Science and Technology, 2019, 35(9):291-296.
[24] 郭全友, 刘玲, 李保国, 等.Nisin、ε-聚赖氨酸和温度对枯草芽孢杆菌失活动力学的影响[J].食品与发酵工业, 2019, 45(11):58-64;70.
GUO Q Y, LIU L, LI B G, et al.Effects of Nisin, ε-polylysine and temperature on the inactivation kinetics of Bacillus subtilis[J].Food and Fermentation Industries, 2019, 45(11):58-64;70.
[25] PEREIRA A P M, A H A S, FRéDéRIC CARLIN B, et al.Inactivation kinetics of Bacillus cereus and Geobacillus stearothermophilus spores through roasting of cocoa beans and nibs[J].LWT, 2019, 111:394-400.
[26] 索标, 赵雅健, 李真, 等.单辛酸甘油酯对即食湿面中金黄色葡萄球菌的抑制模型[J].中国食品学报, 2019, 19(5):191-200.
SUO B, ZHAO Y J, LI Z, et al.Inhibition model of monooctanoate glyceride on Staphylococcus aureus in instant wet noodles[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19 (5):191-200.
[27] OUYANG Q, DUAN X F, LI L, et al.Cinnamaldehyde exerts its antifungal activity by disrupting the cell wall integrity of Geotrichum citri-aurantii[J].Frontiers in Microbiology, 2019.DOI:10.3389/fmicb.2019.00055.
[28] ROCHA-PIMIENTA J, MARTILLANES S, RAM REZ R, et al. Bacillus cereus spores and Staphylococcus aureus sub.aureus vegetative cells inactivation in human milk by high-pressure processing[J].Food Control, 2020, 113:107 212.
REZ R, et al. Bacillus cereus spores and Staphylococcus aureus sub.aureus vegetative cells inactivation in human milk by high-pressure processing[J].Food Control, 2020, 113:107 212.