肌肉蛋白中50%~60%为盐溶性的肌原纤维蛋白(myofibrillar protein,MP),通常2%~3%的NaCl能够溶解MP并在热诱导的作用下形成凝胶,对肉糜制品的品质有着至关重要的影响。NaCl是形成热诱导凝胶的关键因素,但过量钠摄入会损害人体健康,因此既能保证肉品凝胶特性又能降低钠含量的食盐替代研究逐渐成为热点,其中以氨基酸与KCl的复合物部分替代效果较好。GUO等[1]研究发现L-赖氨酸和 L-组氨酸能够引起二级结构的转化并增加肌球蛋白的溶解度,张建华等[2]研究发现随添加比例的升高,HL-低钠盐的MP凝胶强度、保水性和弹性模量显著升高。但马志方[3]研究发现在成熟后期,低钠盐组金华火腿的蛋白降解指数显著高于食盐组,表明食盐替代物可能会加速蛋白氧化,最终导致肉制品的保水性、嫩度、风味和营养价值等品质以及贮藏特性的改变[4]。
香辛料是一种天然抗氧化剂,目前大量研究表明香辛料有较好的抗氧化特性,CHEN等[5]研究发现0.03%的丁香提取物能显著抑制Fenton氧化体系的蛋白氧化。JONGBERG等[6]研究表明高浓度的绿茶提取物能阻止二硫键的生成,破坏肉糜凝胶特性。其抗氧化作用主要通过清除自由基实现,作用机理主要有:(1)直接与自由基反应;(2)间接消耗容易生成自由基的物质;(3)抑制与产生自由基相关的酶的活性[7]。目前关于香辛料改善低钠盐MP氧化体系凝胶特性的研究未有报道,因此本试验以MP为原料,添加2.5%(质量分数)低钠盐加速氧化体系作对照组,探讨添加量为0.03%(质量分数)的4种香辛料(丁香、花椒、迷迭香和肉豆蔻)对其凝胶特性的影响,进而初步探索香辛料对低钠盐MP氧化体系凝胶的影响机理,为香辛料在低钠盐MP凝胶中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
鹅肉,浙江省绍兴市天天肉食品有限公司;香辛料提取物(丁香、花椒、迷迭香、肉豆蔻),南京草本源生物有限公司;HL-低钠盐(氯化钾45.2%,氯化钠42.8%,葡萄糖酸钠3.5%, L-赖氨酸 7.0%,L-组氨酸 1.5%),自配。
1.2 仪器与设备
TGL-16型医用冷冻离心机,四川蜀科仪器有限公司;FSH-Ⅱ型高速电动匀浆器,江苏金坛市环宇科学仪器厂;SYNERGYH1MG型全波长酶标仪,美国基因公司;HH-S数显恒温水浴锅,常州普天仪器制造有限公司;TA-XT Plus质构仪,英国Stable Micro System公司;MCR302模块化旋转与界面流变仪,德国Anton公司。
1.3 实验方法
1.3.1 原料预处理
选取120 d龄的白条鹅,清洗干净,剔除筋膜、脂肪及结缔组织后切碎,于-20 ℃的冰箱保存待用。
1.3.2 肌原纤维蛋白的提取
参考张建华等[2]的方法,4 ℃保存,48 h内用完。以牛血清蛋白作标准曲线,双缩脉法测定蛋白质浓度。
1.3.3 多酚含量的测定
采用Folin-酚法[8],配制100 μg/mL没食子酸标准储备液,分别吸取0.3、0.4、0.5、0.6、0.7 mL标准储备液于10 mL比色管中。加入0.2 mL Folin-酚试剂混匀,加入0.5 mL 饱和碳酸钠溶液,用蒸馏水稀释至10 mL。27 ℃水浴1 h后,于波长765 nm处测定吸光度值。绘制得到标准曲线,所得回归方程为:y=0.006 3x+0.044 8,R2=0.996 7。
准确称取0.1 g香辛料提取物定容至25 mL,吸取0.5 mL提取溶液于10 mL比色管中。根据标准曲线制作方法测定样品的吸光度值。根据回归方程计算多酚含量,单位为 mg GAE/g。
1.3.4 香辛料处理低钠盐氧化肌原纤维蛋白
参照TAKAI等[9]的方法略作修改,将上述MP加入到混合溶液中(0.5 mol/L KCl,10 μmol/L FeCl3,100 μmol/L 抗坏血酸,5 mmol/L H2O2溶液,pH=6.0),并以4 500 r/min的速度匀浆30 s后调节浓度至15 mg/mL。将MP分为5组,以未添加香辛料的质量分数为2.5%的低钠盐为对照,在2.5%低钠盐的基础上添加0.03%(质量分数,下同)的4种香辛料为处理组,分别为0.03%丁香、0.03%花椒、0.03%迷迭香、0.03%肉豆蔻。在4 ℃条件下分别氧化24、48和72 h后进行指标测定。
1.3.5 肌原纤维蛋白凝胶的制备
参照付渊[10]的方法,将上述MP溶液置于水浴锅中,以2 ℃/min使其温度从25 ℃逐渐升高至40 ℃,恒温处理30 min,再加热至80 ℃,保温30 min,然后将溶液取出冷却,于4 ℃冰箱中冷藏过夜。进行测定之前将MP凝胶在室温下放置30 min。
1.3.6 凝胶强度的测定
参照徐幸莲[11]的方法略作修改。采用TA-XT Plus型质构仪进行测定,参数设置:探头型号P/0.5,测前速度2 mm/s,测试速度1.0 mm/s,测后速度1.0 mm/s,触发力5 g,变性率为40%。
1.3.7 凝胶保水性的测定
参照MA[12]的方法略作改动。将MP凝胶在4 ℃、3 000 r/min离心10 min,去除水分并称重。保水性表示为离心前后凝胶质量的比值。
1.3.8 凝胶蒸煮损失率的测定
蒸煮前离心管的质量记为M(g)、离心管和MP的质量记为M1(g),蒸煮后去除水分的离心管和MP的质量记为M2(g),MP凝胶的蒸煮损失率按公式(1)计算:
蒸煮损失率![]()
(1)
1.3.9 凝胶化学作用力的测定
参照G MEZ-GUILLÉN等[13]的方法略作修改。配制5种溶液,A溶液:1 g MP凝胶与9 mL 0.05 mol/L的NaCl溶液;b溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液;C溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液+1.5 mol/L尿素混合溶液;D溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液+8 mol/L尿素混合溶液;E溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液+8 mol/L尿素+1.5 mol/L β-巯基乙醇混合溶液。
MEZ-GUILLÉN等[13]的方法略作修改。配制5种溶液,A溶液:1 g MP凝胶与9 mL 0.05 mol/L的NaCl溶液;b溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液;C溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液+1.5 mol/L尿素混合溶液;D溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液+8 mol/L尿素混合溶液;E溶液:1 g MP凝胶与9 mL 0.6 mol/L NaCl溶液+8 mol/L尿素+1.5 mol/L β-巯基乙醇混合溶液。
将上述5种溶液混匀后在4 ℃ 下静置120 min,10 000×g离心10 min后采用考马斯亮蓝法测定上清液的蛋白质含量。离子键含量为B溶液与A溶液蛋白质含量差值;氢键含量为C溶液与B溶液蛋白质含量差值;疏水相互作用含量为D溶液与C溶液蛋白质含量差值;二硫键含量为E溶液与D溶液蛋白质含量差值。
1.3.10 流变特性的测定
将MP溶解在0.5 mol/L氯化钾氧化体系中,配制质量浓度为40 mg/mL的MP溶液。参数设置为:夹具60 mm,上下板间隙1 mm。升温程序为25~80 ℃,升温速率为1 ℃/min,80 ℃保持10 min,振荡频率为1 Hz,应力振幅为0.01;动态频率程序为1~16 Hz,测试温度为 25 ℃,应变为 1%。测定流变的储能模量(G′)。
1.4 数据处理
采用Microsoft Excel 2016进行数据计算,SPSS 19.0进行方差分析(Duncan法)和显著性检验(P<0.05),采用Origin 2019b进行图像处理。试验数据采用平均值±标准差形式。
2 结果与分析
2.1 香辛料提取物的多酚含量
由图1可知,香辛料提取物的多酚含量差异显著(P<0.05),且含量遵循以下顺序:迷迭香>丁香>肉豆蔻>花椒,表明不同香辛料提取物的抗氧化差异可能与多酚含量有关。
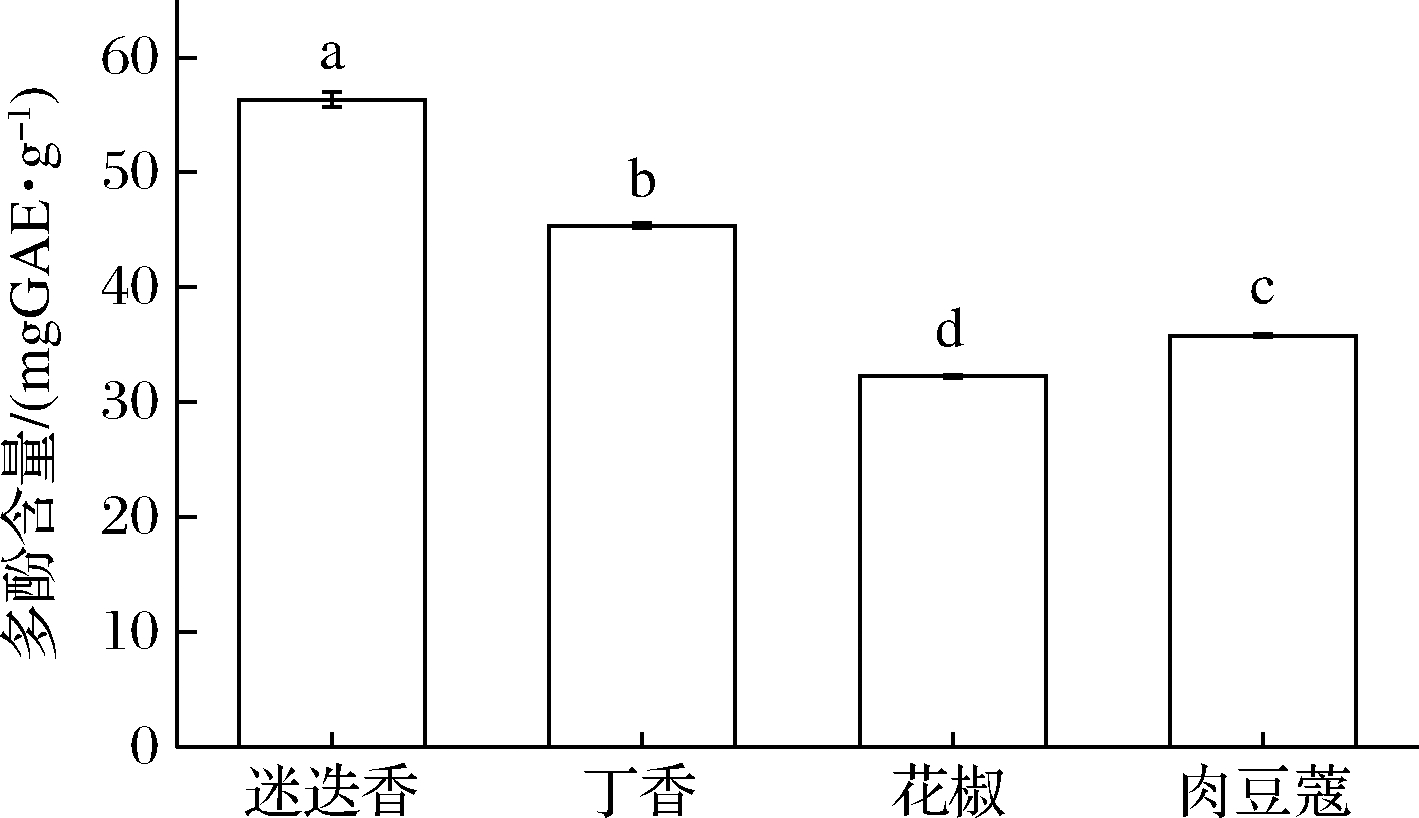
图1 香辛料提取物多酚含量
Fig.1 Polyphenol content in the spices 注:a~d表示不同香辛料中多酚含量差异显著
2.2 香辛料对低钠盐MP凝胶强度的影响
由图2可知,添加香辛料的低钠盐MP凝胶强度在氧化周期内显著降低(P<0.05),与对照组变化一致,这是因为疏水基团随氧化加剧而大量暴露,导致蛋白无法与水形成致密的凝胶结构从而降低低钠盐MP凝胶强度[14]。同一氧化时间,添加迷迭香的低钠盐MP凝胶强度均显著高于对照组(P<0.05),添加丁香和肉豆蔻的低钠盐MP氧化48 h后、花椒低钠盐MP氧化72 h后的凝胶强度也显著高于对照组(P<0.05);说明香辛料的添加有利于低钠盐MP凝胶的形成,且添加迷迭香改善低钠盐MP凝胶强度的效果最佳。原因在于香辛料提取物具有抗氧化成分,能抑制蛋白氧化,使凝胶结构的破坏程度降低,结构紧凑;也有可能是香辛料提取物添加到MP后,在加热时共价交联形成混合凝胶,使凝胶更加致密,进而增加凝胶强度[15]。迷迭香提取物多酚含量更高,抗氧化活性更高,对蛋白氧化的抑制作用更明显。
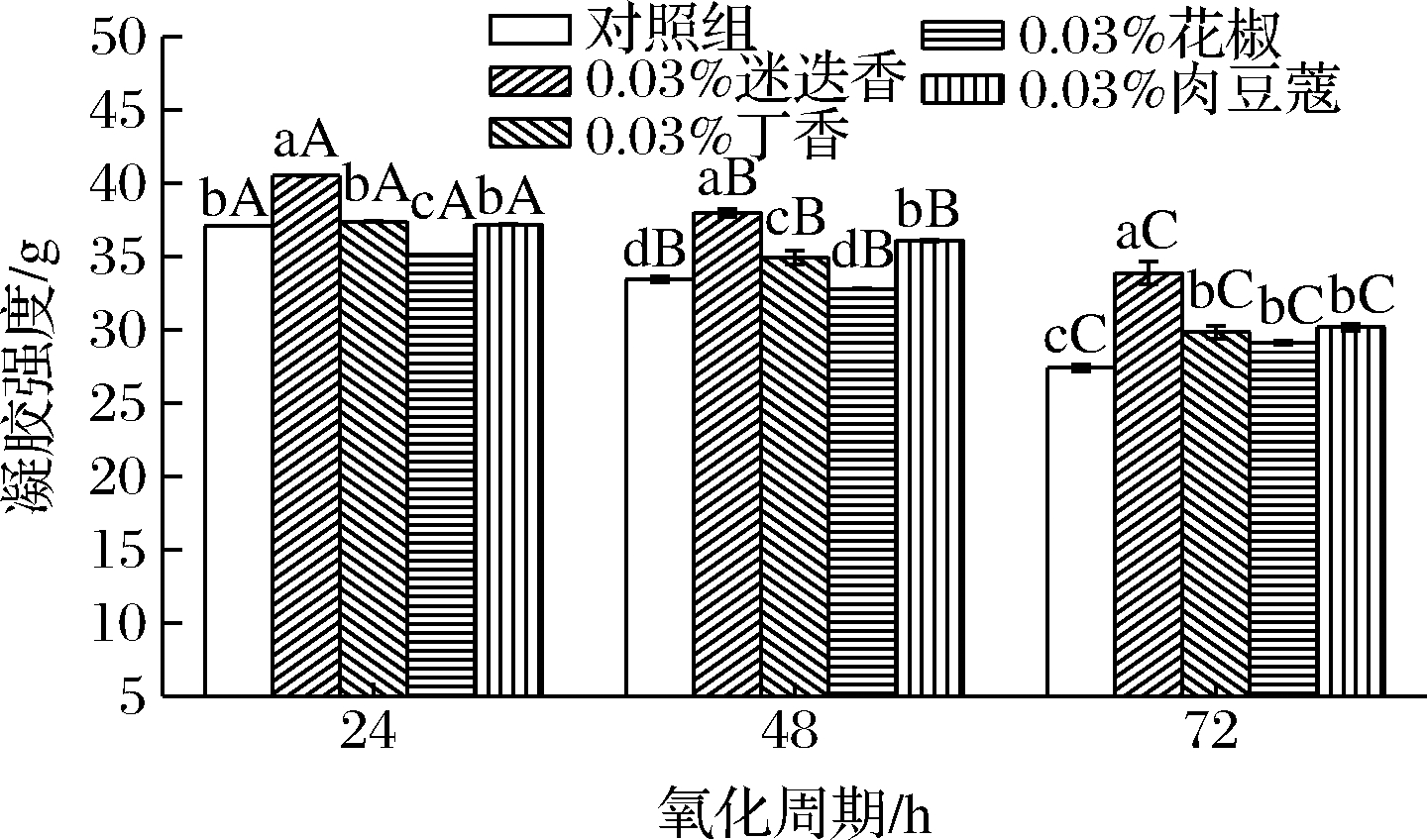
图2 香辛料对低钠盐MP凝胶强度的影响
Fig.2 Effect of spices on strength of low sodium salt myofibrillar protein gel 注:A~C表示不同氧化周期之间差异显著;a~g表示在 同一周期内不同处理组之间差异显著(下同)
2.3 香辛料对低钠盐MP凝胶保水性的影响
由图3可知,添加香辛料的低钠盐MP保水性在氧化周期内显著降低(P<0.05),与对照组变化一致,说明氧化应激会损害MP的胶凝能力[16];香辛料添加组在同一氧化时间的保水性均显著高于对照组(P<0.05),且添加迷迭香的低钠盐MP凝胶保水性显著高于其他香辛料添加组(P<0.05),花椒和肉豆蔻的低钠盐MP凝胶保水性最低、且差异不显著(P>0.05),说明香辛料的添加能改善低钠盐MP凝胶保水性,且添加迷迭香后提高低钠盐MP凝胶保水性的效果最佳。
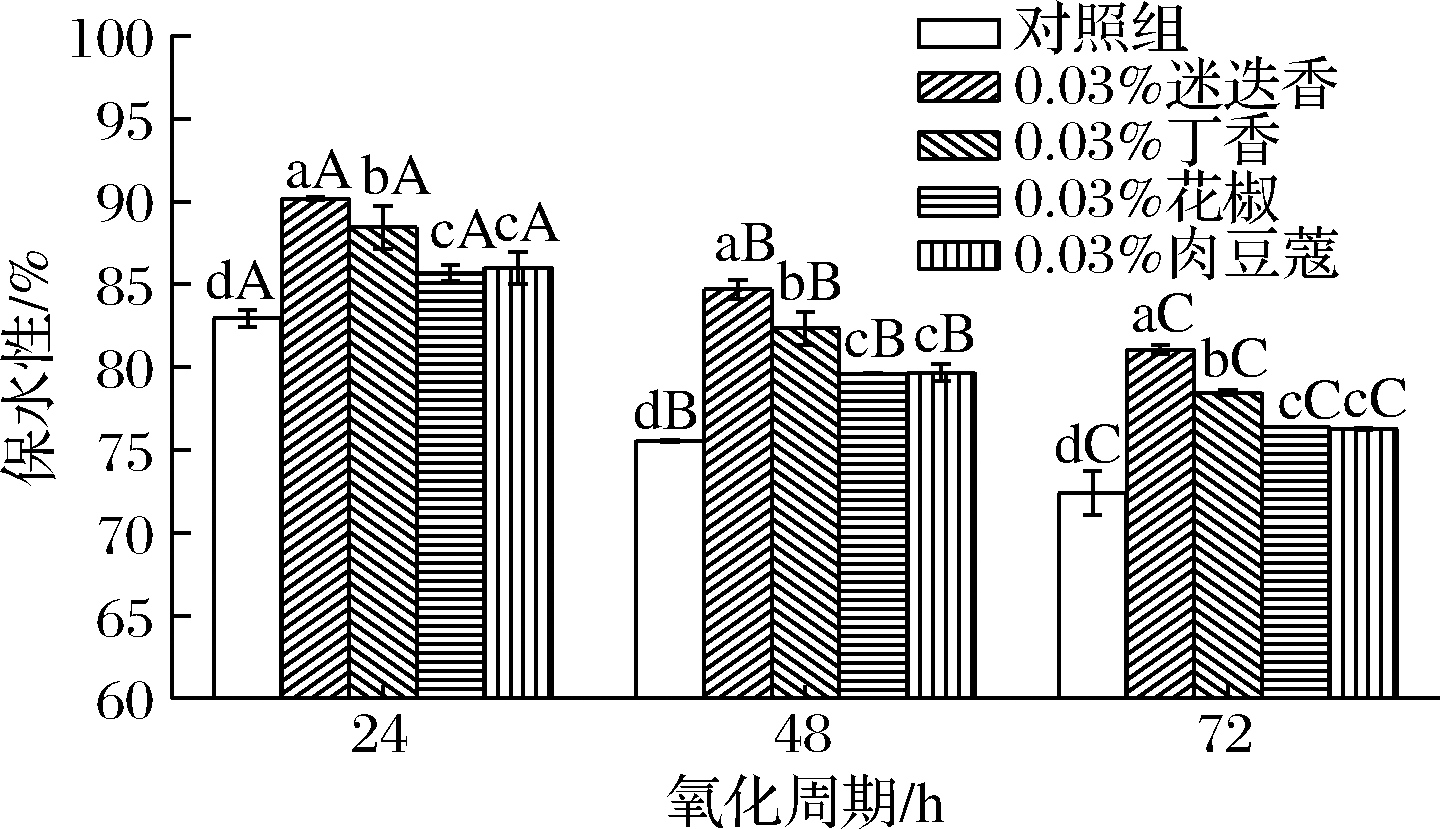
图3 香辛料对低钠盐MP凝胶保水性的影响
Fig.3 Effect of spices on water retention of low sodium salt myofibrillar protein gel
保水性与多汁性和质地有关,是肉制品的重要品质特征[17]。凝胶保水性取决于化学作用力,例如交联、疏水相互作用和氢键等,因此蛋白结构的展开和蛋白间的相互作用均能引起MP凝胶保水性的变化[18]。香辛料作为一种天然抗氧化剂,含有多酚黄酮等抗氧化物质。张慧芸等[19]研究发现适当添加酚类物质能够提高蛋白交联能力,增强MP凝胶网络结构从而使保水效果更好,这与本试验结果一致。这是因为多酚物质的羟基能与蛋白质的二硫键和非二硫键相互作用使蛋白结构更稳定[20],从而使MP的凝胶保水性增强。
2.4 香辛料对低钠盐MP凝胶蒸煮损失率的影响
由图4可知,添加香辛料的低钠盐MP蒸煮损失率在氧化周期内显著升高(P<0.05),与对照组变化一致;同一氧化时间,添加迷迭香的低钠盐MP凝胶蒸煮损失率均显著低于对照组(P<0.05),添加丁香和肉豆蔻的低钠盐MP氧化48 h后、花椒低钠盐MP氧化72 h后的凝胶蒸煮损失率也显著低于对照组(P<0.05);说明香辛料的添加能降低低钠盐MP凝胶蒸煮损失率,且添加迷迭香后低钠盐MP凝胶蒸煮损失率降低的程度最高。曹云刚等[21]研究发现MP溶解度随氧化强度的增大而减小,蛋白溶解度的降低能增大MP凝胶间隙,使得蒸煮损失率大大提高,这与本试验结果一致。香辛料的添加能够减轻蛋白氧化程度,从而提高蛋白溶解度,花椒提取物的多酚含量显著低于迷迭香提取物,因而对蛋白氧化的抑制程度低。MONTERO等[22]研究表明0.03%迷迭香提取物抑制蛋白氧化的效果比0.03%花椒提取物更显著,与本试验结果一致。
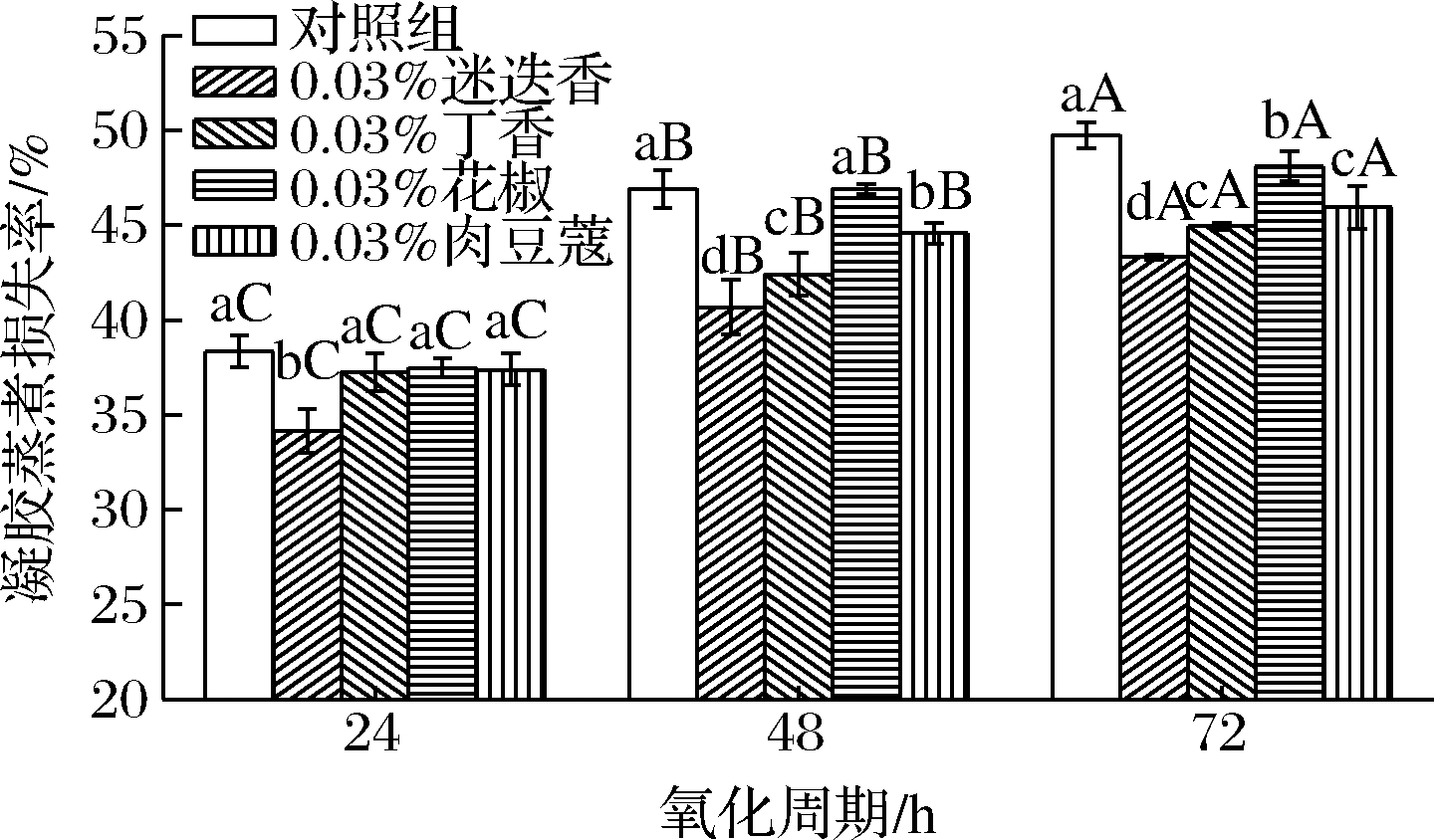
图4 香辛料对低钠盐MP凝胶蒸煮损失率的影响
Fig.4 Effect of spices on cooking loss of low sodium salt myofibrillar protein gel
2.5 香辛料对低钠盐MP凝胶化学作用力的影响
由图5可知,MP凝胶的化学作用力由大到小依次为:疏水相互作用>二硫键>氢键>离子键,因此疏水相互作用、二硫键和氢键是维持低钠盐MP凝胶的主要作用力,离子键相互作用较小。添加香辛料的低钠盐MP凝胶离子键、氢键和二硫键含量在氧化周期内显著降低(P<0.05)、疏水相互作用含量显著升高(P<0.05),与对照组变化一致;同一氧化时间,香辛料添加组的低钠盐MP凝胶离子键、氢键和二硫键含量显著高于对照组(P<0.05),疏水相互作用含量显著低于对照组(P<0.05);说明香辛料能改善低钠盐MP凝胶的化学作用力,且不同种类的香辛料对其有显著差异的影响(P<0.05),离子键、氢键和二硫键含量遵循以下顺序:迷迭香>丁香>肉豆蔻>花椒添加组,疏水相互作用含量如下:迷迭香<丁香<肉豆蔻<花椒添加组。
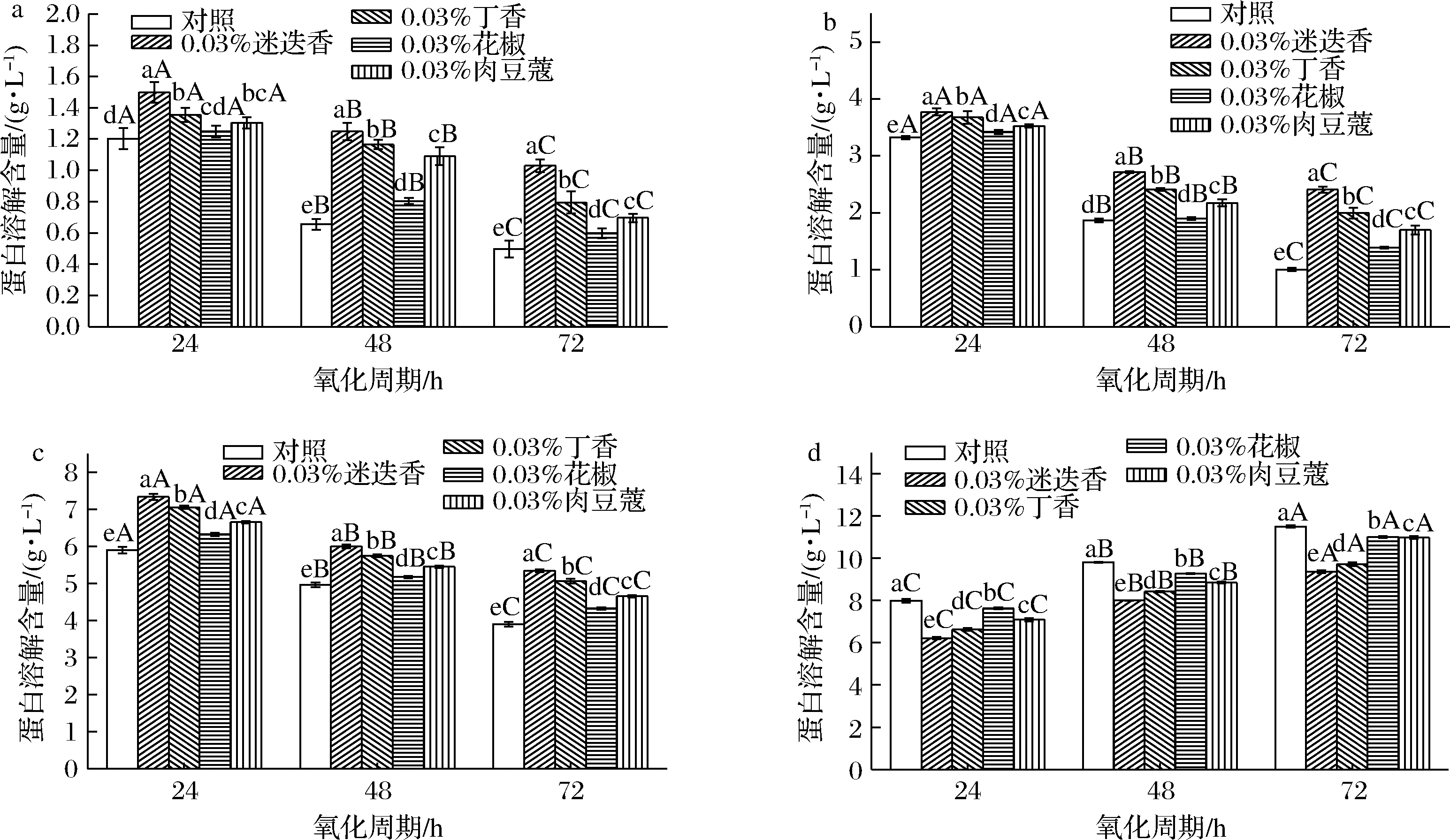
a-离子键;b-氢键;c-二硫键;d-疏水相互作用
图5 香辛料对低钠盐MP凝胶化学作用力的影响
Fig.5 Effect of spices on the chemical action of low sodium salt myofibrillar protein gel
蛋白结构与化学作用力紧密关联,热诱导能够平衡蛋白分子间的化学作用力从而形成稳定的MP凝胶结构[23]。但蛋白氧化能使氨基酸侧链基团暴露、化学键破坏以及多肽链断裂等从而引发一系列反应[24],疏水相互作用含量的增加可能是由于疏水基团的大量暴露并聚集[25],离子键的减少可能是氧化促进了离子键的断裂,蛋白质结构的展开使得与氢键相关的α-螺旋含量下降可能导致氢键含量的减少[26],巯基暴露后可能发生不可逆氧化反应导致二硫键含量的减少[27]。香辛料的加入使得化学作用力较为平衡,从而提高MP凝胶形成能力,这是因为香辛料含有多酚类物质,能在一定程度上抑制蛋白氧化,从而减少氨基酸基团如疏水基团的暴露以及离子键的断裂;植物多酚还能以氢键和疏水相互作用等方式与蛋白相互作用,进而影响蛋白性质[28]。
2.6 香辛料对低钠盐MP温度扫描弹性模量的影响
储能模量(G′)又称弹性模量,反映样品的弹性。蛋白凝胶的G′越大,弹性越好,越有利于形成MP凝胶[29]。由图6可知,添加香辛料的低钠盐MP凝胶G′在氧化周期内显著降低(P<0.05),与对照组变化一致,说明氧化能降低凝胶形成能力;同一氧化时间,添加香辛料的G′高于对照组,说明香辛料对低钠盐MP凝胶形成有促进作用。这可能是由于香辛料提取物与MP相互作用后结合位点增加,增大了蛋白质与酚的交联密度,生成大分子聚合物,从而导致G′增大[30-32]。贾娜等[33]研究发现在一定NaCl浓度下,添加迷迭香提取物可以提高MP凝胶G′,这与本试验结果一致。40~50 ℃时,香辛料添加组的G′与对照组差异不显著,这可能是因为加热初期香辛料的加入导致MP头部聚集减少且尾部聚集增加,蛋白分子运动加剧因而流动性增加。不同香辛料对流变的影响不同,由高到低依次是:迷迭香>丁香>肉豆蔻>花椒添加组,这与低钠盐MP凝胶强度和保水性的变化趋势一致。
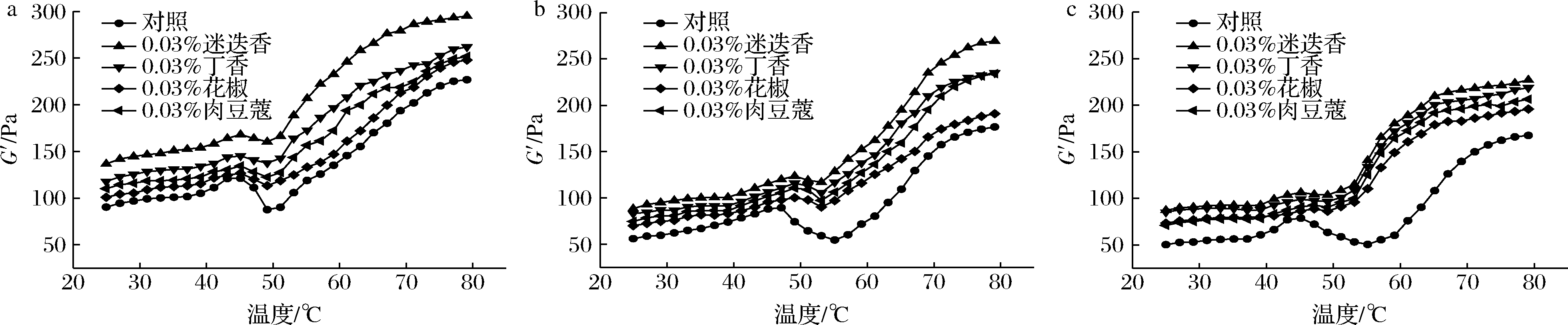
a-氧化24 h;b-氧化48 h;c-氧化72 h
图6 香辛料对低钠盐MP凝胶温度扫描G′的影响
Fig.6 Effect of spices on the intermittent elastic modulus of low sodium salt myofibrillar protein gel
2.7 香辛料对低钠盐MP频率扫描弹性模量的影响
由图7可知,添加香辛料的MP凝胶G′在氧化周期内显著降低(P<0.05),与对照组变化一致,这与2.6结论相似,在0~2 Hz时急剧升高,2 Hz以后则几乎保持不变;同一氧化时间,添加香辛料的MP凝胶G′显著高于对照组(P<0.05),且对MP凝胶的形变频率几乎没有影响,说明香辛料提取物的加入更有利于优质MP凝胶的形成,凝胶形成能力遵循以下顺序:迷迭香>丁香>肉豆蔻>花椒添加组,表明不同抗氧化成分和含量对MP凝胶的影响不同。有研究[34]发现添加高浓度的迷迭香酸(1.25 mmol/L)会使MP凝胶的流变曲线趋于平缓因而不能形成凝胶,说明香辛料提取物的添加需要在一定的浓度范围内。
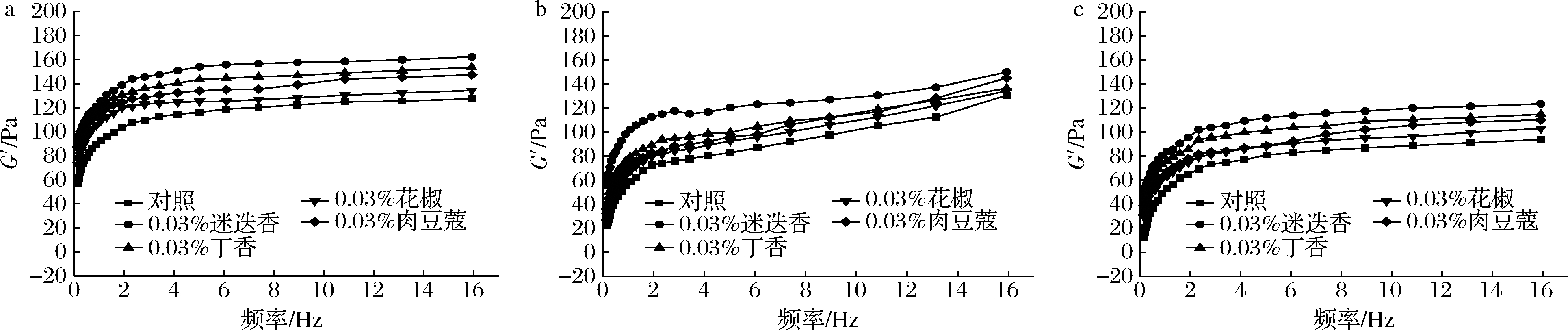
a-氧化24 h;b-氧化48 h;c-氧化72 h
图7 香辛料对低钠盐MP凝胶频率扫描G′的影响
Fig.7 Effect of spices on the frequency elastic modulus of low sodium salt myofibrillar protein gel
3 结论
氧化周期(72 h)内,添加4种香辛料的2.5%低钠盐MP凝胶特性显著降低(P<0.05),与对照组的变化一致;但香辛料能提高低钠盐MP的凝胶形成能力,使疏水相互作用含量降低,二硫键和氢键含量升高,维持MP凝胶稳定的三维网络结构,从而提高MP凝胶强度、保水性和G′,降低蒸煮损失率,且4种香辛料的凝胶形成能力按照以下顺序:迷迭香>丁香>肉豆蔻>花椒添加组。
香辛料能不同程度地抑制MP氧化,减少蛋白氧化程度,维持蛋白的空间结构和功能特性,改善MP凝胶特性,从而有利于优质MP凝胶的形成,但香辛料抗氧化物质及含量不同会对低钠盐MP凝胶产生不同的影响。在今后的研究中,应进一步研究香辛料对低钠盐蛋白结构和功能特性的影响,并探讨香辛料在不同类型的低钠盐中对凝胶特性的影响。
[1] GUO X Y, PENG Z Q, ZHANG Y W, et al.The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J].Food Chemistry, 2015, 170(6):212-217.
[2] 张建华, 夏杨毅.氧化条件下 HL-低钠盐对鹅肉肌原纤维蛋白凝胶特性的影响[J].食品与发酵工业, 2020, 46(10):166-172.
ZHANG J H, XIA Y Y.Effect of HL-low sodium salt on the gel properties of goose meat myofibrillar protein under oxidative conditions[J].Food and Fermentation Industries, 2020, 46(10):166-172.
[3] 马志方. 低钠传统金华火腿加工过程中脂质和蛋白质水解及氧化的研究[D].南京:南京农业大学, 2016.
MA Z F.Study on the hydrolysis and oxidation of lipide and protein in low sodium traditional jinhua ham during processing[D].Nanjing:Nanjing Agricultural University, 2016.
[4] LORENZO J M, VARGAS F C, STROZZI I, et al.Influence of pitanga leaf extracts on lipid and protein oxidation of pork burger during shelf-life[J].Food Research International, 2018, 114(12):47-54.
[5] CHEN H, DIAO J, LI Y, et al.The effectiveness of clove extracts in the inhibition of hydroxyl radical oxidation-induced structural and rheological changes in porcine myofibrillar protein[J].Meat Science, 2015,111(7):60-66.
[6] JONGBERG S, TERKELSEN L S, MIKLOS R, et al.Green tea extract impairs meat emulsion properties by disturbing protein disulfide cross-linking[J].Meat Science, 2015, 100(2):2-9.
[7] 李云龙, 赵月亮, 范大明, 等.香辛料中植物化合物对肉制品品质及健康功效影响研究进展[J/OL].食品科学,2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1522.190.html.
LI Y L, ZHAO Y L, FAN D M, et al.Effects of phytochemicals from spices on quality attributes and health benefits of meat products:A review[J/OL].Food Science, 2021.http://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1522.190.html.
[8] 涂宗财, 傅志丰, 王辉, 等.红薯叶不同溶剂提取物抗氧化性及活性成分鉴定[J].食品科学, 2015, 36(17):1-6.
TU Z C, FU Z F, WANG H, et al.Comparison of antioxidant activities of various solvent extracts of sweet potato (Ipomoea batatas (L.) Lam.) leaves and identification of antioxidant constituents of the merthanol extract[J].Food Science, 2015, 36(17):1-6.
[9] TAKAI E, YOSHIZAWA S, EJIMA D, et al.Synergistic solubilization of porcine myosin in physiological salt solution by arginine[J].International Journal of Biological Macromolecules, 2013, 62(11):647-651.
[10] 付渊. L-精氨酸、L-赖氨酸对鸡胸肉中肌球蛋白凝胶特性的影响[D].合肥:合肥工业大学, 2016.
FU Y.Study on the influences of L-Lys/L-Arg on the gel properties of chicken breast myosin[D].Heifei:Heifei University of Technology, 2016.
[11] 徐幸莲. 兔骨骼肌肌球蛋白热诱导凝胶特性及成胶机制研究[D].南京:南京农业大学, 2003.
XU X L.Study on heated-induced gelation properties and gel forming mechanism of myosin from rabbit skeletal muscles[D].Nanjing:Nanjing Agricultural University, 2003.
[12] MA F.Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2 and k-carrageenan[J].Meat Science, 2013, 95(1):22-26.
[13] G MEZ-GUILLÉN M C, BORDER
MEZ-GUILLÉN M C, BORDER AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine(Sardina pilchardus) muscle gels[J].LWT-Food Science and Technology, 1997, 30(6):602-608.
AS A J, MONTERO P.Chemical interactions of nonmuscle proteins in the network of sardine(Sardina pilchardus) muscle gels[J].LWT-Food Science and Technology, 1997, 30(6):602-608.
[14] JIA N, WANG L, SHAO J, et al.Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science, 2017, 127(5):45-50.
[15] 王鹏, 穆雅慧, 何思宁, 等.牛骨胶原水解物抑制鲢鱼肌原纤维蛋白氧化和增强凝胶特性研究[J/OL].食品工业科技,2021.https://doi.org/10.13386/j.issn1002-0306.2020080092.
WANG P, MU Y H, HE S N, et al.Oxidation inhibition and gel properties enhancement of myofibrillar protein from silver carp by bovine-bone collagen hydrolysate[J/OL].Science and Technology of Food Industry,2021.https://doi.org/10.13386/j.issn1002-0306.2020080092.
[16] LYU Y, FENG X, WANG Y, et al.The gelation properties of myofibrillar proteins prepared with malondialdehyde and (-)-epigallocatechin-3-gallate[J/OL].Food Chemistry, 2020.https://doi.org/10.1016/j.foodchem.2020.127817.
[17] JIANG Y, LI D H, TU J C, et al.Mechanisms of change in gel water-holding capacity of myofibrillar proteins affected by lipid oxidation:The role of protein unfolding and cross-linking[J/OL].Food Chemistry,2020.https://doi.org/10.1016/j.foodchem.2020.128587.
[18] ZHANG Z, YANG Y, TANG X, et al.Chemical forces and waterholding capacity study of heat-induced myofibrillar protein gel as affected by high pressure[J].Food Chemistry, 2015, 188(12):111-118.
[19] 张慧芸, 吴静娟, 郭新宇.多酚对猪肉肌原纤维蛋白氧化和凝胶特性的影响[J].食品科学, 2016, 37(21):43-47.
ZHANG H Y, WU J J, GUO X Y.Effect of polyphenols on the oxidation and gel properties of pork myofibrillar protein[J].Food Science, 2016, 37(21):43-47.
[20] RATTAYA S, BENJAKUL S, Prodpran T.Properties of fish skin gelatin film incorporated with seaweed extract[J].Journal of Food Engineering, 2009, 95(1):151-157.
[21] 曹云刚, 马文慧, 艾娜丝, 等.氧化强度对肌原纤维蛋白结构及凝胶性能的影响[J].食品科学, 2019, 40(20):21-27.
CAO Y G, MA W H, AI N S, et al.Effects of different oxidation intensities on the structure and gel properties of myofibrillar protein[J].Food Science, 2019, 40(20):21-27.
[22] MONTERO P, GIMÉNEZ B, PÉREZ-MATEOS M, et al.Oxidation stability of muscle with quercetin and rosemary during thermal and high-pressure gelation[J].Food Chemistry, 2005, 93(1):17-23.
[23] 王静宇, 胡新, 刘晓艳, 等.肌原纤维蛋白热诱导凝胶特性及化学作用力研究进展[J].食品与发酵工业, 2020, 46(8):300-306.
WANG J Y, HU X, LIU X Y, et al.Advances in heat-induced gel properties and chemical forces of myofibrillar protein gel[J].Food and Fermentation Industries, 2020, 46(8):300-306.
[24] 袁凯, 张龙, 谷东陈, 等.肉品中的蛋白质氧化机制及其影响因素[J].食品科学, 2018, 39(5):329-335.
YUAN K, ZHANG L, GU D C, et al.A review of mechanisms and factors affecting protein oxidation in meat[J].Food Science, 2018, 39(5):329-335.
[25] 张自业. 盐和超高压处理对肌原纤维蛋白凝胶特性与作用力的影响及调控机理研究[D].南京:南京财经大学, 2016.
ZHANG Z Y.Study on effects of salt and high pressure treament on properties and chemical forces of myofibrillar protein gel and the regulation mechanism[D].Nanjing:Nanjing University of Finance and Economics, 2016.
[26] 陈雪珂. 肌球蛋白凝胶化过程中与迷迭香酸的互作机制及其对蛋白理化特性的影响[D].重庆:西南大学, 2019.
CHEN X K.Interaction mechanism of myosin with rosmarinic acid during gelation and its effect on protein physicochemical properties[D].Chongqing:Southwest University, 2019.
[27] THOMAS J A, MALLIS R J.Aging and oxidation of reactive protein sulphydryls[J].Experimental Gerontology, 2001, 36 (9):1 519-1 526.
[28] 刘丹, 贾娜, 杨磊, 等.3种不同香辛料提取物对猪肉肌原纤维蛋白功能特性的影响[J].食品科学, 2017, 38(15):14-19.
LIU D, JIA N, YANG L, et al.Influence of three different spice extracts on functional characteristics of pork myofibrillar protein[J].Food Science, 2017, 38(15):14-19.
[29] 贾娜, 张风雪, 孙嘉, 等.亚麻籽胶对儿茶素-肌原纤维蛋白热诱导凝胶特性的影响[J].食品科学, 2019, 40(20):1-7.
JIA N, ZHANG F X, SUN J, et al.Effect of flaxseed gum on heat-induced gel properties of catechins-myofibrillar protein[J].Food Science, 2019, 40(20):1-7.
[30] YAN M Y, LI B F, ZHAO X, et al.Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J].Food Hydrocolloids, 2011, 25(5):907-914.
[31] SENGUPTA P, SARDAR P S, ROY P, et al.Investigation on the interaction of Rutin with serum albumins:Insights from spectroscopic and molecular docking techniques[J].Journal of Photochemistry and Photobiology B:Biology, 2018, 183:101-110.
[32] SAITO H, TAGUCHI T, AOKI H, et al.pH-Responsive swelling behavior of collagen gels prepared by novel crosslinkers based on naturally derived di-or tricarboxylic acids[J].Acta Biomaterialia, 2007, 3(1):89-94.
[33] 贾娜, 谢振峰, 李儒仁, 等.迷迭香提取物与NaCl协同改善肌原纤维蛋白凝胶特性[J].食品科学, 2018, 39(3):28-33.
JIA N, XIE Z F, LI R R, et al.Synergistic improvement of myofibrillar protein gel properties by combination of rosemary extract and NaCl[J].Food Science, 2018, 39(3):28-33.
[34] TANG C, ZHANG W, ZOU Y, et al.Influence of RosA-protein adducts formation on myofibrillar protein gelation properties under oxidative stress[J].Food Hydrocolloids, 2017, 67(6):197-205.