α-酮异己酸是亮氨酸的无氮替代物,可作为慢性肾脏疾病和乙型肝炎病毒感染治疗的组成部分,为患者提供每日所需的L-亮氨酸[1],具有促进胰岛素分泌[2-3],抑制胰高血糖素分泌[4-5],减少体内氮消耗,促进肌肉合成[6-7],降低肌肉分解的作用[8-9],在食品、医药、饲料等方面应用广泛[10]。
α-酮异己酸最常用的生产方法是化学合成法,包括用二乙基草酰胺与格氏试剂加成产物的水解反应、双羰基化法和海因法等[11]。这些方法均需高成本的催化剂或特殊的起始结构,使得α-酮异己酸的生产成本较高。其次,还需使用有毒反应物,对环境造成严重危害。目前,生物法合成α-酮异己酸的研究越来越多,主要是发酵法和全细胞转化法[12]。BÜCKLE-VALLANT等[13]通过代谢工程改造谷氨酸棒杆菌实现了α-酮异己酸的直接发酵生产,但产量低(9.23 g/L),还存在副产物α-酮异戊酸及氨基酸缺陷型问题。为解决氨基酸缺陷型问题,改变了转氨酶B编码基因ilvE的起始密码子并将不同拷贝的基因整合到基因组上,α-酮异己酸含量达到6.1 g/L,但这种方法并没有完全解决氨基酸缺陷问题,且发酵过程仍需添加多种昂贵的氨基酸,副产物也较多[14],由此可见,基于代谢工程的α-酮异己酸合成方法存在产量低、副产物多,且需要添加多种昂贵氨基酸,不适合工业化生产。
全细胞转化法由于副产物少、操作简单、合成步骤少,而且反应过程中,无需添加有毒化学原料,产品纯度高,易于分离纯化,更适合工业化生产。普通变形杆菌Proteus vulgaris来源的膜结合型L-氨基酸脱氨酶(L-amino acid deaminase,L-AAD)能够催化L-亮氨酸脱氨基生成α-酮异己酸而不产生H2O2,从而减少对宿主细胞生长的影响[15-16],已被广泛应用于各种α-酮酸的合成,如苯丙酮酸[17]、α-酮异戊酸[18]、α-酮戊二酸[19-20]、α-酮基-γ-甲基硫代丁酸[21]和α-酮异己酸[22]。图1所示为P.vulgaris 来源的L-AAD脱氨基反应过程中的元素以及α-酮异己酸和L-亮氨酸之间化学结构的变化。
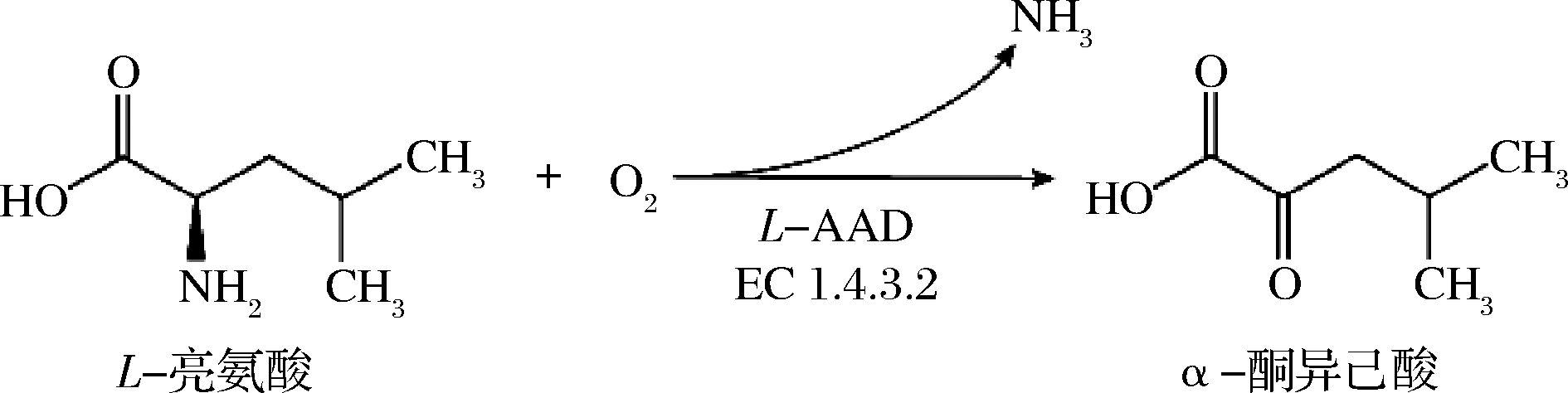
图1 P.vulgaris 来源的L-AAD的脱氨基反应
Fig.1 Deamination reaction of L-AAD from P.vulgaris
目前,ZHU等[23]利用不透明红球菌 DSM 43250进行全细胞转化合成产量达1.27 g/L的α-酮异己酸。SONG等[24]将P.vulgaris来源的L-AAD在大肠杆菌异源表达,以构建的重组菌的菌体作为全细胞催化剂转化L-亮氨酸获得69.1 g/L的α-酮异己酸。之后,通过使用不同拷贝数的质粒、调节起始密码子下游的mRNA组成、设计核糖体结合位点序列这3种策略实现了α-酮异己酸的更高产,产量达到86.55 g/L[25]。
虽然,在大肠杆菌中α-酮异己酸产量已达到较高水平,但大肠杆菌可能会将不符合食品卫生要求的有害物质带入产品中,因此,需构建背景清晰的食品级表达系统,以实现α-酮异己酸的安全生产。枯草芽孢杆菌是非致病性细菌,被美国食品药物管理局普遍认为是GRAS(Generally Recognized As Safe)菌株。此外,目前还没有P.vulgaris 来源的L-AAD在枯草芽孢杆菌中异源表达以合成α-酮异己酸的相关研究报道。因此,本研究选用食品安全性菌株Bacillus subtilis 168作为宿主细胞,异源表达了P.vulgaris 来源的L-AAD,构建了重组菌株B.subtilis 168/pMA5-lad。之后,针对全细胞生物合成α-酮异己酸的催化体系进行优化,并将固定化细胞技术用于α-酮异己酸的生物合成,实现了以L-亮氨酸为底物一步法生物合成α-酮异己酸,为α-酮异己酸及其他重要α-酮酸的工业化安全合成提供了一种新策略。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究中所用到的质粒pMA5、菌株Escherichia coli JM109、Bacillus subtilis 168均为本实验室保藏。pUC57-lad质粒为苏州金唯智生物科技有限公司人工合成。
1.1.2 实验试剂
BamH I、Mlu I限制性快切酶、10 000 bp核酸marker和蛋白Marker,大连宝生物公司;高保真酶、同源重组酶克隆试剂盒,南京诺维赞生物科技有限公司;小量质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒,上海捷瑞生物工程有限公司;α-酮异己酸标品,Sigma公司;L-亮氨酸、海藻酸钠、CaCl2及培养基原料,国药。
1.1.3 培养基
LB培养基:蛋白胨 1%、酵母提取物 0.5%和氯化钠 1%,固体培养基则加1.5%~2.0%的琼脂粉,根据需要加入相应浓度抗生素。
种子培养基:蛋白胨1%、酵母提取物0.5%、K2HPO4 0.23%、KH2PO40.17、MgSO40.075%、NaCl 0.5%,pH 6.8~7.0,根据需要加入相应浓度抗生素。
发酵培养基:大豆蛋白胨1%、玉米浆0.5%、柠檬酸铵0.3%、葡萄糖4%、K2HPO4 0.23%、KH2PO4 0.17%、MgSO4 0.075%、NaCl 0.5%,pH 6.8~7.0,根据需要加入相应浓度抗生素。
注:培养基配方中的“%”均为质量分数。
1.2 实验方法
1.2.1 重组菌株B.subtilis 168/pMA5-lad的构建
将NCBI数据库查询到的P.vulgaris来源的L-氨基酸脱氨酶编码基因lad(GeneBank登录号:AB030003.1)序列提交至苏州金唯智生物科技有限公司进行合成,并进行密码子优化,以利于其在B.subtilis 168的异源表达。
以公司提供的pUC57-lad重组质粒为模板,以lad-F:gtgaaatcagggggatccatggccattagccgccgc(BamH I)和lad-R:tcgacctctagaacgcgtttaaaaacgatataaagaaaacggct-tcggg(Mlu I)为引物进行PCR扩增,PCR产物纯化后与经BamH I和Mlu I双酶切线性化的pMA5质粒进行连接并转化E.coli JM109感受态细胞,涂布含50 μg/mL氨苄青霉素的LB平板上,于37 ℃培养箱倒置培养8~12 h。挑取转化子进行培养,提取重组质粒进行单双酶切验证,验证正确的重组质粒送苏州金唯智生物科技有限公司进行测序分析,测序正确的重组质粒命名为pMA5-lad。
将重组质粒pMA5-lad转化B.subtilis 168感受态细胞,涂布至含50 μg/mL卡那霉素的LB平板上,于37 ℃培养箱倒置培养8~12 h。挑取转化子进行菌落PCR验证,验证正确的重组菌株命名为B.subtilis 168/pMA5-lad。
1.2.2 L-AAD的表达
首先,将冻管保存的B.subtilis 168/pMA5-lad重组菌株在含50 μg/mL卡那霉素的LB平板上划线活化,挑取单菌落转接10 mL 50 μg/mL卡那霉素的LB液体培养基,37 ℃、200 r/min下培养8~12 h后,按10%(体积分数)接种量转接50 mL含相同浓度的LB液体培养基,37 ℃、180 r/min下培养24 h,以诱导 L-AAD的表达。之后,在4 ℃、10 000 r/min下离心10 min收集细胞,弃去培养基,细胞菌体用5 mL 20 mmol/L Tris-HCl缓冲液(pH 7.0)洗2次。最后,将细胞菌体悬浮于5 mL 20 mmol/L Tris-HCl缓冲液(pH 7.0)中并用超声破碎仪进行破碎,破碎液在4 ℃下离心20 min,收集上清液,用于后续的SDS-PAGE分析和酶活力测定。对照菌株B.subtilis 168/pMA5按照同样的方法进行诱导表达。
1.2.3 酶活力测定与底物特异性研究
用20 mmol/L、pH 7.0的Tris-HCl缓冲液配制浓度为10 mmol/L的18种氨基酸溶液。取500 μL 10 mmol/L的各氨基酸溶液与20 μL粗酶液进行混合,37 ℃反应20 min后加入450 μL 20%三氯乙酸溶液,室温下反应30 min,继续添加200 μL 20 mmol/L的2,4-二硝基苯肼并混合均匀,室温下反应15 min,可获得棕红色二硝基苯肼。随后,添加4 mL 0.8 mol/L NaOH溶液并于室温下反应15 min。最后,离心,取上清液测![]() 以不添加L-AAD的样品为空白对照,以A520最高的定义为100%,每个反应重复3次。
以不添加L-AAD的样品为空白对照,以A520最高的定义为100%,每个反应重复3次。
1.2.4 全细胞生物催化剂的制备
首先,将冻管保存的B.subtilis 168/pMA5-lad重组菌株在含50 μg/mL卡那霉素的LB平板上划线活化,挑取单菌落转接10 mL 50 μg/mL卡那霉素的种子培养基,37 ℃、200 r/min下培养8~12 h后,按10%(体积分数)接种量转接100 mL含相同浓度卡那霉素的发酵培养基,37 ℃、180 r/min下培养24 h,以诱导L-AAD表达。之后,在4 ℃、10 000 r/min下离心10 min收集细胞,弃去培养基,用 20 mmol/L Tris-HCl缓冲液(pH 7.0)洗涤菌体2次。最后,将重组枯草芽孢菌体悬浮于20 mmol/L Tris-HCl缓冲液(pH 7.0),测定OD600,并转化为细胞干重(DCW),转化公式为(1):
DCW/(g·L-1)=0.444 2×OD600-0.021
(1)
1.2.5 全细胞催化条件优化
(1)菌体浓度的优化
分别投加不同量的重组枯草芽孢杆菌的菌体于含有100 mmol/L L-亮氨酸的50 mL 20 mmol/L Tris-HCl缓冲液(pH 7.0)中,使反应体系中菌体终质量浓度分别为5、10、15、20和25 g/L,37 ℃下反应24 h,离心取上清液,HPLC检测α-酮异己酸浓度。
(2)反应温度的优化
用含100 mmol/L L-亮氨酸的50 mL 20 mmol/L Tris-HCl缓冲液(pH 7.0)重悬重组枯草芽孢杆菌的菌体,使菌体质量浓度维持在20 g/L,不同温度(25、30、35、40、45、50、55 ℃)下反应24 h,离心取上清液,HPLC检测α-酮异己酸浓度。
(3)反应pH的优化
将20 g/L重组枯草芽孢杆菌菌体和100 mmol/L L-亮氨酸溶解于不同pH(6.0、7.0、8.0、8.5、9.0、9.5、10.0、10.5和11.0)的50 mL KH2PO4-K2HPO4缓冲液中,于45 ℃下反应24 h,离心取上清液,HPLC检测α-酮异己酸浓度。
(4)底物L-亮氨酸浓度的优化
在含有20 g/L重组枯草芽孢杆菌菌体的50 mL 20 mmol/L Tris-HCl缓冲液(pH 10.0)中,分别投加不同量的L-亮氨酸,使L-亮氨酸终浓度为50、75、100、125和150 mmol/L,45 ℃下反应24 h,离心取上清液,HPLC检测α-酮异己酸浓度。
1.2.6 金属离子对全细胞催化体系的影响
在含有20 g/L重组枯草芽孢杆菌菌体、100 mmol/L L-亮氨酸的50 mL 20 mmol/L Tris-HCl缓冲液(pH 10.0)中添加5 mmol/L Ca2+、Fe2+、Mg2+、Na+、Ba2+、Cu2+、Li+和Al3+),于45 ℃下反应24 h,离心取上清液,HPLC检测α-酮异己酸浓度,以评估不同金属离子对全细胞生物催化体系的影响。以不添加任何离子的反应混合物作为对照。
1.2.7 细胞固定化
将重组枯草芽孢杆菌细胞与30 g/L海藻酸钠溶液按1∶1比例进行混合,用带有针头的注射器将混合液滴入到预冷的CaCl2溶液(136 mmol/L)中,4 ℃下放置1 h,使所得珠粒硬化,然后过滤,收集固定化细胞并用无菌水洗涤2次,以去除过量的Ca2+和未结合的细胞[19]。
利用游离细胞及固定化细胞作为全细胞催化剂,重复批次进行转化,测试全细胞催化剂的可回收性,即可再利用性。反应在装有1 g游离细胞/固定化细胞的50 mL/500 mL三角瓶中进行(DCW终质量浓度20 g/L),45 ℃、200 r/min摇床反应24 h,离心,回收上清液,HPLC检测α-酮异己酸浓度。然后将反应溶液分别继续加入到相应的细胞沉淀中,45 ℃、200 r/min摇床反应24 h,离心,回收上清液,HPLC检测α-酮异己酸浓度。共重复3个循环,将第1次转化结束时,转化液中α-酮异己酸的含量定义为100%。
1.2.8 α-酮异己酸的HPLC检测分析
采用伯乐AminexHPX-87H(300 mm×7.8 mm,9 μm)色谱柱,流动相为5 mmol/L的H2SO4溶液,流速为0.6 mL/min,柱温为35 ℃,进样量10 μL,在紫外检测波长203 nm下检测α-酮异己酸含量[19]。
2 结果与分析
2.1 B.subtilis 168/pMA5-lad重组菌株的构建与表达
以lad-F和lad-R为引物,以pUC57-lad质粒为模板,PCR扩增获得含同源臂的lad基因片段,基因大小为1 416 bp,回收后的lad基因片段与pMA5线性化质粒进行同源重组连接,连接产物转化E.coli JM109。提取重组质粒并进行单双酶切验证(图2-a),验证正确的重组质粒送公司进行测序分析,测序正确的重组质粒命名为pMA5-lad。重组质粒pMA5-lad转化B.subtilis 168感受态细胞,转化子菌落PCR验证正确的重组菌株命名为B.subtilis 168/pMA5-lad(图2-b)。
P.vulgaris来源的L-氨基酸脱氨酶是一种膜结合型蛋白,用1.2.2所述方法进行L-AAD的诱导表达,SDS-PAGE结果显示,B.subtilis 168/pMA5-lad上清液在51 kDa附近有条带加粗,即L-AAD成功实现了在B.subtilis 168中的异源表达(图2-c)。

a-重组质粒单双酶切验证结果,泳道M:10 000 bp核酸Marker,泳道1、3、5为重组质粒单酶切验证结果,泳道2、4、6为重组质粒双酶切验证结果;b-泳道M:10 000 bp核酸Marker,泳道1、2、3、4为转化子菌落PCR验证结果;c-L-AAD在B.subtilis 168中的表达,泳道1为重组菌株B.subtilis 168/pMA5-lad细胞破碎上清液,泳道2为对照菌株B.subtilis 168/pMA5细胞破碎上清液
图2 重组菌株B.subtilis 168/pMA5-lad的构建与表达
Fig.2 Construction and expression of recombinant strain B.subtilis 168/pMA5-lad
2.2 L-AAD酶的酶活测定与底物特异性研究
不同来源的L-AAD的底物类型不同,一般多数L-AAD的底物范围较广(主要是天然氨基酸),来自厚叶藻类(Amphiroa crassissima)的 L-AAD 可以催化脂肪族、芳香族、基本的、硫化的、γ-羧化的氨基酸[27]。来自老鼠肾脏的 L-AAD 可以催化像S-腺苷-L-高半胱氨酸、高半胱氨酸、腺苷蛋氨酸等天然氨基酸衍生物[28]。来自不透明红球菌的 L-AAD 底物范围更广,不仅可以利用20种常见氨基酸,而且还能利用19种氨基酸衍生物[29]。接下来,对P.vulgaris来源的L-AAD进行功能验证,同时测试其底物特异性,探索研究了L-AAD对亮氨酸、异亮氨酸、天冬氨酸、丙氨酸、苯丙氨酸、甲硫氨酸、色氨酸、精氨酸、谷氨酸、瓜氨酸、丝氨酸、脯氨酸、组氨酸、酪氨酸、缬氨酸、赖氨酸、苏氨酸和半胱氨酸这18种氨基酸的底物特异性,结果显示,P.vulgaris来源的L-AAD的底物范围较广,其中,对丝氨酸的特异性最高,其次是丙氨酸、异亮氨酸和亮氨酸(图3),以A520最高的定义为100%。

图3 L-AAD的底物特异性
Fig.3 Substrate specificity of L-AAD
2.3 全细胞催化条件的优化
2.3.1 菌体浓度的优化
菌体浓度在一定程度上反映了酶的含量,因此,测试了不同菌体质量浓度(5、10、15、20和25 g/L)对生物转化合成 α-酮异己酸的影响,结果如图4所示,DCW在5~20 g/L范围内,随着DCW质量浓度增大,反应体系中L-AAD增多,生化反应过程加快,α-酮异己酸含量逐渐增多。DCW质量浓度达20 g/L时,α-酮异己酸含量达到最高,为1.59 g/L。当DCW质量浓度高于20 g/L时,可能是菌体质量浓度过高时,菌体的生长也需要大量的氧气,L-AAD氧化脱氨反应也是一个耗氧过程,不利于脱氨反应的进行,因此,α-酮异己酸含量逐渐下降,即高细胞密度不利于生物转化合成α-酮异己酸。由此可见,全细胞生物转化合成 α-酮异己酸的最适菌体质量浓度为20 g/L。

图4 菌体浓度对全细胞催化反应的影响
Fig.4 The effect of cell concentration on whole-cell catalytic reaction
2.3.2 反应温度的优化
温度通过影响酶促反应速率进而影响α-酮异己酸的合成。控制初始pH 7.0、底物L-赖氨酸浓度为100 mmol/L、菌体量DCW为20 g/L,分别在25、30、35、40、45和55 ℃下进行全细胞转化合成α-酮异己酸,结果如图5所示。在25~45 ℃范围内,α-酮异己酸的含量随着温度升高而升高,当温度为45 ℃时,α-酮异己酸的含量最高,为1.92 g/L。而温度高于45 ℃时,α-酮异己酸的含量则逐渐下降。由此可见,全细胞生物转化合成 α-酮异己酸的最适反应温度为45 ℃,这可能与L-AAD的最适反应温度有关。

图5 反应温度对全细胞催化反应的影响
Fig.5 The effect of reaction temperature on whole-cell catalytic reaction
2.3.3 反应pH的优化
维持反应温度45 ℃、底物L-赖氨酸浓度为100 mmol/L、菌体量DCW为20 g/L,其他条件相同情况下,在初始pH分别为6.0、7.0、8.0、8.5、9.0、9.5、10.0、10.5和11.0下进行全细胞转化合成α-酮异己酸,结果如图6所示。在pH 6.0~10.0范围内,α-酮异己酸的含量随着pH升高而升高,当pH为10.0时,α-酮异己酸的含量最高,为2.27 g/L。而pH高于10.0时,α-酮异己酸的含量则逐渐下降。由此可见,全细胞生物转化合成 α-酮异己酸的最适反应pH为10.0,可能与L-AAD的最适反应pH有关。
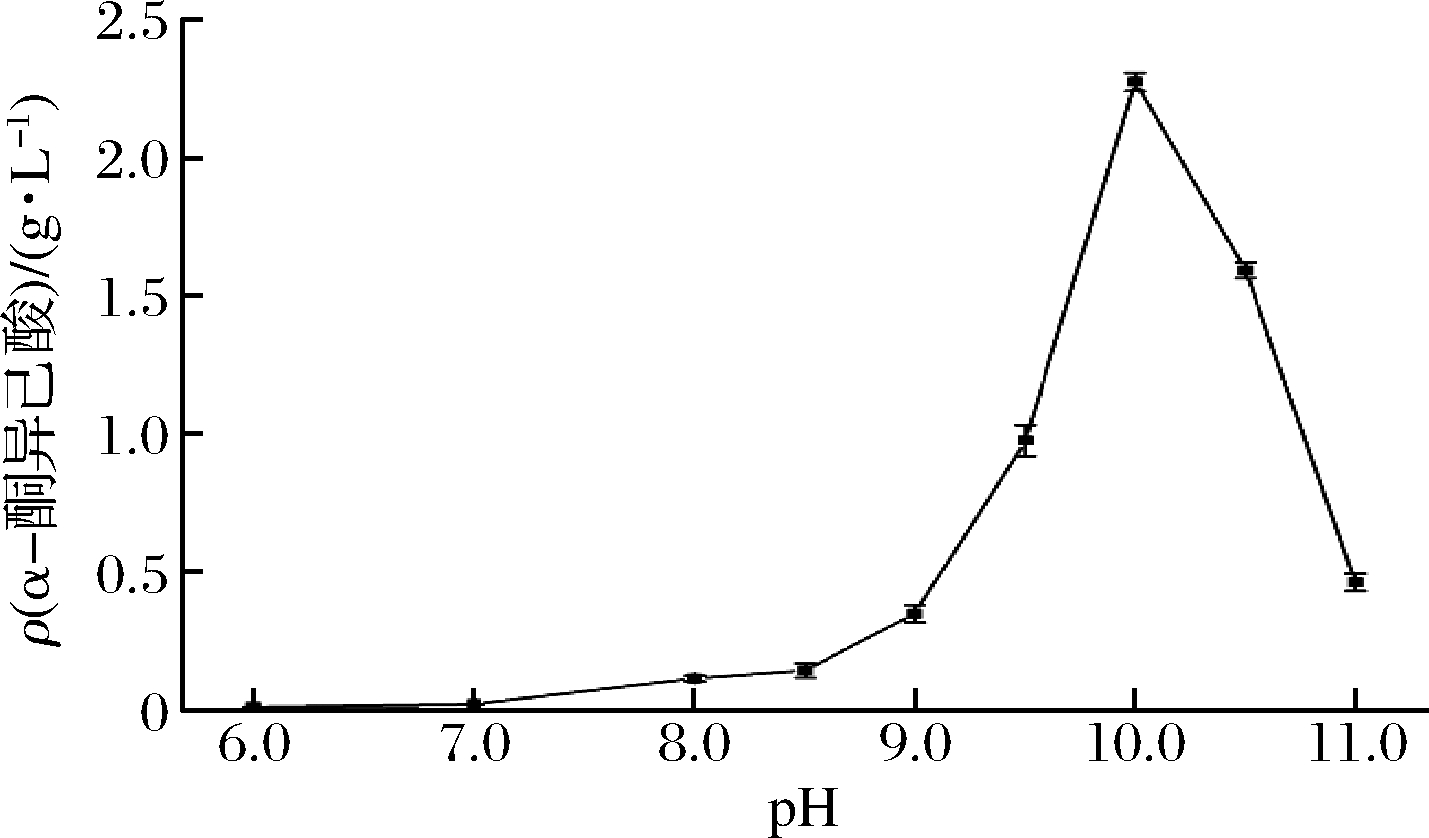
图6 反应pH对全细胞催化反应的影响
Fig.6 The effect of reaction pH on whole-cell catalytic reaction
2.3.4 底物L-亮氨酸浓度的优化
底物L-亮氨酸浓度是全细胞转化合成α-酮异己酸的重要因素。控制反应温度45 ℃、初始pH 10.0、菌体量DCW为20 g/L,在底物L-赖氨酸浓度分别为50、75、100、125和150 mmol/L条件下进行生物转化,考察底物L-亮氨酸浓度对全细胞转化合成α-酮异己酸的影响,结果如图7所示。底物在较低浓度50~100 mmol/L浓度范围内,L-AAD的催化效率逐渐提高,α-酮异己酸浓度随底物浓度升高而升高;底物浓度超过100 mmol/L时,可能L-AAD酶活性受到抑制,L-AAD酶活性降低,生物转化过程变慢,α-酮异己酸浓度降低。由此可见,全细胞生物转化合成 α-酮异己酸的最适底物L-亮氨酸浓度为100 mmol/L,此时,α-酮异己酸含量高达2.27 g/L。

图7 底物L-亮氨酸浓度对全细胞催化反应的影响
Fig.7 The effect of substrate concentration of L-leucine on whole-cell catalytic reaction
2.4 金属离子对全细胞催化体系的影响
测试了分别添加5 mmol/L CaCl2、FeCl2、MgCl2、NaCl、BaCl2、CuCl2、LiCl和AlCl3对全细胞转化合成α-酮异己酸的影响,结果如图9所示。Ca2+、Fe2+、Ba2+和Cu2+的存在抑制了L-AAD酶的活性,不利于全细胞转化合成α-酮异己酸,而Mg2+、Na+、Li+和Al3+的存在对L-AAD酶的活性起激活作用,因此,促进了α-酮异己酸的合成(图8),尤其是Mg2+的存在,使得α-酮异己酸浓度提高了60.79%。

图8 不同金属离子对全细胞催化反应的影响
Fig.8 The effect of different metal ions on whole-cell catalytic reaction
2.5 细胞固定化
细胞固定化是提高全细胞生产率的常用技术,固定化细胞比游离细胞更容易分离细胞和产物。另外,细胞的固定化允许连续操作而无需细胞冲洗和稀释反应溶液,这可以用来克服由于高浓度的底物或产物而产生的任何抑制作用[30]。
本文研究了细胞固定化对生物转化合成α-酮异己酸的影响。从图9-a可以看出,控制条件完全一致情况下,固定化细胞转化所获得的α-酮异己酸含量(2.56 g/L)要率低于游离细胞转化所获得的α-酮异己酸含量(3.66 g/L),这可能是固定化细胞生物催化剂由于受到海藻酸钠屏蔽作用,减少了基质和细胞之间的接触面积,因此,反应速率有所下降,α-酮异己酸含量降低。

a-细胞固定化对全细胞转化合成α-酮异己酸的影响;b-游离细胞及固定化细胞的重复批次转化
图9 全细胞催化剂的固定化及重复批次转化
Fig.9 Immobilization of whole-cell catalyst and repeated batch conversion
但是,固定化细胞催化剂在重复3次转化中显示出优异的性能(图9-b),再利用率提高了37.3%。这是由于L-AAD与海藻酸钠的交联作用使得L-AAD更加稳定,可保护细胞免受外部环境影响。
3 讨论
本文首次成功实现了P.vulgarise来源的L-AAD在食品安全菌株B.subtilis 168中的异源表达,构建了重组枯草芽孢杆菌B.subtilis 168/pMA5-lad,以20 g/L的重组枯草芽孢杆菌B.subtilis 168/pMA5-lad菌体作为全细胞催化剂,在L-亮氨酸浓度100 mmol/L、反应温度45 ℃、pH 10.0、MgCl2浓度5 mmol/L的最优转化条件下,连续转化24 h,可实现一步法生物合成α-酮异己酸,α-酮异己酸含量达3.66 g/L,产率为0.15 g/(L·h),在细胞固定化及重复批次转化实验中,固定化细胞的再利用率提高了37.3%。
BÜCKKE-VALLANT等[13]利用谷氨酸棒杆菌直接发酵获得了9.23 g/L的α-酮异己酸,产率达0.17 g α-酮异己酸/g葡萄糖,存在副产物多及氨基酸缺陷问题;之后,为解决氨基酸缺陷问题构建的谷氨酸棒杆菌直接发酵可获得6.1 g/L的α-酮异己酸,产率却仅为0.014 g α-酮异己酸/g葡萄糖,而且未完全解决氨基酸缺陷问题[14]。虽然,目前,大肠杆菌全细胞转化合成α-酮异己酸的产量已高达86.55 g/L,产率达到3.6 g/(L·h)[25],处于较高水平,但大肠杆菌可能会将不符合食品卫生要求的有害物质带入产品中,限制了α-酮异己酸在食品、医药行业的应用。本研究构建的可实现α-酮异己酸安全生产的重组枯草芽孢杆菌,虽然产量不高,仅达3.66 g/L,且产率仅为0.15 g/(L·h),但为α-酮异己酸的工业化安全生产提供了一种新策略。在接下来研究中,将会对L-AAD的结构和功能进行分析,采取有效策略,对L-AAD进行理性改造,以进一步提高L-AAD的酶活水平,提高生物转化效率,进而提高α-酮异己酸的产量。
[1] APARICIO M,BELLIZZI V,CHAUVEAU P,et al.Keto acid therapy in predialysis chronic kidney disease patients:Final consensus[J].Journal of Renal Nutrition,2012,22(supp 1):S22-S24.
[2] ZHOU Y,JETTON T.L,GOSHORN S,et al.Transamination is required for α-Ketoisocaproate but not leucine to stimulate insulin secretion[J].Journal of Biological Chemistry,2010,285(44):33 718-33 726.
[3] YANG J C,CHI Y J,BURKHARDT B R,et al.Leucine metabolism in regulation of insulin secretion from pancreatic beta cells[J].Nutrition Reviews,2010,68(5):270-279.
[4] LECLERCQ-MEYER V,MARCHAND J,LECLERCQ R,et al.Interactions of α-ketoisocaproate,glucose and arginine in the secretion of glucagon and insulin from the perfused rat pancreas[J].Diabetologia,1979,17(2):121-126.
[5] HEISSIG H,URBAN K A,HASTEDT K,et al.Mechanism of the insulin-releasing action of α-ketoisocaproate and related α-keto acid anions[J].Molecular Pharmacology,2005,68(4):1 097-1 105.
[6] MITCH W E,CHAN W.α-Ketoisocaproate stimulates branched-chain amino acid transaminase in kidney and muscle[J].American Journal of Physiology-Endocrinology and Metabolism,1979,236(5):E514.
[7] BARAZZONI R,MEEK S E,EKBERG K,et al.Arterial KIC as marker of liver and muscle intracellular leucine pools in healthy and type 1 diabetic humans[J].American Journal of Physiology-Endocrinology and Metabolism,1999,277(2):E238.
[8] HASSELGREN P O.Protein Synthesis and Degradation in Skeletal Muscle From Septic Rats[J].Archives of Surgery,1988,123(5):640.
[9] NAKASHIMA K,YAKABE Y,ISHIDA A,et al.Suppression of myofibrillar proteolysis in chick skeletal muscles by α-ketoisocaproate[J].Amino Acids,2006,33(3):499-503.
[10] 程申, 张颂红,贠军贤.α-酮异己酸的生物合成研究进展[J].化学进展,2018,37(12):4 821-4 829.
CHENG S,ZHANG S H,YOU J X.Recent advances in microbial synthesis of α-ketoisocaproate[J].Progress in Chemistry Industry,2018,37(12):4 821-4 829.
[11] COOPER A J L,GINOS J Z,MESITER A.Synthesis and properties of the α-keto acids[J].Chemical Reviews,1983,83(3):321-358.
[12] 刘立明, 袁宇翔,刘佳,等.一种酶法催化高产α-酮异己酸的方法:CN108587993B[P].2020-08-04.
LIU L M,YUAN Y X,LIU J,et al.An enzymatic method to catalyze high production of α-ketoisocaproic acid:China,201810377203.0[P].2 018-04-25.
[13] BÜCKLE-VALLANT V,KRAUSE F S,MESSERSCHMIDT S,et al.Metabolic engineering of Corynebacterium glutamicum for 2-ketoisocaproate production[J].Applied Microbiology and Biotechnology,2014,98(1):297-311.
[14] VOGT M,HAAS S,POLEN T,et al.Production of 2-ketoisocaproate with Corynebacterium glutamicum strains devoid of plasmids and heterologous genes[J].Microbial Biotechnology,2015,8(2):351-360.
[15] JU Y C,TONG S L,GAO Y X,et al.Crystal structure of a membrane-bound L-amino acid deaminase from Proteus vulgaris[J].Journal of Structural Biology,2016,195(3):306-315.
[16] YU Z L,QIAO H.Advances in non-snake venom L-amino acid oxidase[J].Applied Biochemistry and Biotechnology,2012,167(1):1-13.
[17] HOU Y,HOSSAIN G S,LI J H,et al.Combination of phenylpyruvic acid(PPA)pathway engineering and molecular engineering of L-amino acid deaminase improves PPA production with an Escherichia coli whole-cell biocatalyst[J].Applied Microbiology and Biotechnology,2016,100(5):2 183-2 191.
[18] PEI S S,RUAN X B,LIU J,et al.Enhancement of α-ketoisovalerate production by relieving the product inhibition of L-amino acid deaminase from Proteus mirabilis[J].Chinese Journal of Chemical Engineering,2020,28:2 190-2 199.
[19] HOSSAIN G S,LI J,SHIN H D,et al.Bioconversion of L-glutamic acid to α-ketoglutaric acid by an immobilized whole-cell biocatalyst expressing L-amino acid deaminase from Proteus mirabilis[J].Journal of Biotechnology,2014,169:112-120.
[20] HOSSAIN G S,LI J,SHIN H D,et al.Improved production of α-ketoglutaric acid(α-KG)by a Bacillus subtilis whole-cell biocatalyst via engineering of L-amino acid deaminase and deletion of the α-KG utilization pathway[J].Journal of Biotechnology,2014,187:71-77.
[21] HOSSAIN G S,LI J,SHIN H D,et al.One-step biosynthesis of α-keto-γ-methylthiobutyric acid from L-methionine by an Escherichia coli whole-cell biocatalyst expressing an engineered L-amino acid deaminase from Proteus vulgaris[J].PLoS One,2014,9(12):e114291.
[22] LIU J J,LI J H,SHIN H D,et al.Protein and metabolic engineering for the production of organic acids[J].Bioresource Technology,2017,239:412-421.
[23] ZHU Y H,LI J H,LIU L,et al.Production of α-ketoisocaproate via free-whole-cell biotransformation by Rhodococcus opacus DSM 43250 with L-leucine as the substrate[J].Enzyme and Microbial Technology,2011,49(4):321-325.
[24] SONG Y,LI J,SHIN H D,et al.One-step biosynthesis of α-ketoisocaproate from L-leucine by an Escherichia coli whole-cell biocatalyst expressing an L-amino acid deaminase from Proteus vulgaris[J].Scientific Reports,2015,5(1):12614.
[25] SONG Y,LI J H,SHIN H D,et al.Tuning the transcription and translation of L-amino acid deaminase in Escherichia coli improves α-ketoisocaproate production from L-leucine[J].PLoS One,2017,12(6):e0179229.
[26] SINGH S,GOGOI B K,BEZBARUAH R L.Optimization of medium and cultivation conditions for L-amino acid oxidase production by Aspergillus fumigatus[J].Canadian Journal of Microbiology,2009,55(9):1 096-1 102.
[27] ITO K,HORI K,MIYAZAWA K.Purification and some properties of L-amino acid oxidase from Amphiroa crassissima Yendo[C].Twelfth International Seaweed Symposium, 1987.DOI:10.1007/978-94-009-4057-4_83.
[28] BLANCHARD M,GREEN D E,NOCITO V,et al.L-Amino acid oxidase of animal tissue[J].Journal of Biological Chemistry,1944,155(2):421-440.
[29] FAUST A,NIEFIND K,HUMMEL W,et al.The structure of a bacterial L-amino acid oxidase from Rhodococcus opacus gives new evidence for the hydride mechanism for dehydrogenation[J].Journal of Molecular Biology,2007,367(1):234-248.
[30] ISHIGE T,HONDA K,SHIMIZU S.Whole organism biocatalysis[J].Current Opinion in Chemical Biology,2005,9(2):174-180.