芸豆,学名菜豆(Phaseolus vulgaris Linn.sp),属豆科(Leguminosae)菜豆属(Phaseolus),是一年生草本植物的籽粒[1]。我国芸豆种植面积在世界范围内排名第三[2],年总产量约8~9 万t,主要分布在黑、蒙、冀、晋、甘、新、川、滇、黔等地[3]。芸豆中蛋白质含量为17.91%~22.03%,脂肪含量为2.56%~8.46%,总糖含量4.50%~5.42%[4],并且含有丰富的维生素与矿物质[5]。
1945年,BOWMAN[6]首次在芸豆中发现α-淀粉酶抑制剂(α-amylase inhibitor,α-AI),α-AI是一种糖蛋白[7],可与淀粉酶形成复合物,从而有效抑制其活性[8],阻碍碳水化合物水解与消化,进而降低血糖水平[9],可作为降糖控糖食品的原料。芸豆α-AI纯品提取过程复杂、周期长、成本高[10],其水提物提取简单,对α-淀粉酶也具有较强的抑制效果,但其中存在凝集素[9],会促使红细胞凝集,引起小肠表面绒毛细胞病变,影响消化吸收,进而对机体免疫功能造成损害[11]。目前常用降低凝集素活力的方法有热处理[12]、超高压处理[13]、辐照处理[12]以及调控pH[14]等。其中超高压与辐照处理成本较高,且无法完全去除;而热处理及调控pH在去除凝集素活力的同时,也将芸豆α-AI活力完全去除[15],无法在保留提取物α-淀粉酶抑制活力的同时去除凝集活力。
针对目前存在的问题,本研究计划通过在控制pH与温度等条件时,同时添加蛋白酶,在最大程度保留提取物α-淀粉酶抑制活力并去除凝集活力。以花芸豆为原料,α-淀粉酶抑制率与凝集活力为指标,在筛选出最佳用酶的基础上,优化提取物的制备工艺。另外,研究了提取物对日常主食估计血糖生成指数(estimated glycemic index,eGI)的影响。
1 材料与方法
1.1 材料与试剂
花芸豆由国家现代农业产业技术体系食用豆体系提供;面包、米饭、白馒头及玉米馒头,当地超市;2%兔血红细胞,上海源叶生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、菠萝蛋白酶、木瓜蛋白酶、酸性蛋白酶,北京索莱宝生物有限公司;中性蛋白酶、碱性蛋白酶,日本天野酶制品株式会社;α-淀粉酶、胃蛋白酶、胰蛋白酶,美国Sigma公司。
1.2 仪器与设备
CT410旋风式样品磨,福斯赛诺分析仪器(苏州)有限公司;SP-Max 2300A光吸收型全波长酶标仪,上海闪谱生物科技有限公司;LUX-24数显恒温水浴锅,北京陆希科技有限公司;LXJ-ⅡB低速大容量多管离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 花芸豆粗提物的制备与工艺优化
将经旋风磨磨粉,过60目筛后的花芸豆粉与去离子水以料液比1∶5(g∶mL)的比例混合,室温下搅拌提取2 h,8 000 r/min离心30 min,收集上清液,随后分别加入菠萝蛋白酶、木瓜蛋白酶、酸性蛋白酶、中性蛋白酶和碱性蛋白酶,根据各蛋白酶最适条件反应1 h,以α-淀粉酶抑制活力与凝集活力为指标确定最佳酶。
以凝集活力与α-淀粉酶抑制率为指标,进行时间(30、60、90、120、150 min)、pH(2、2.5、3、3.5、4)、温度(30、40、50、60、70 ℃)和酶底比(500、1 000、1 500、2 000、2 500 U/g)单因素试验,因为本实验主要目的是制得无凝集活力的花芸豆提取物,因此在单因素试验的基础上,以去除凝集活力为主要目的,兼顾α-淀粉酶抑制率进行L9(34)正交试验。
1.3.2 α-淀粉酶抑制率测定
α-淀粉酶抑制率的测定参考YANG等[16]的方法稍作修改。将0.25 mL猪胰α-淀粉酶溶液(1.5 U/mL)和0.25 mL适当稀释的芸豆提取液在37 ℃水浴中孵育10 min,加入10 g/L可溶性淀粉0.25 mL,准确反应5 min后立刻加入1.0 mL DNS溶液终止反应。将混合物置于沸水浴中10 min,随后在冰浴中冷却至室温,用5 mL去离子水稀释后在540 nm波长处测定吸光度。
1.3.3 凝集活力测定
凝集活力的测定参考HE等[17]的方法稍作修改。在96孔“V”型板的每1孔中加入50 μL 磷酸缓冲盐溶液(10 mmol/L,pH 7.4),在第1孔加入提取液,混匀后取出50 μL加入第2孔,混匀,以此类推,倍比稀释,第12孔取出50 μL溶液弃去,最后在各孔中加入2%兔血红细胞50 μL,4 ℃条件下静置2 h后观察血凝结果。凝集活力按公式(1)计算:
凝聚活力![]()
(1)
式中:n,96孔“V”型板中显示血凝的最高孔数,n=0表示无凝集活力;ρ,样品蛋白质量浓度,mg/mL,V,添加到每孔的样品体积,mL。
1.3.4 总淀粉含量测定
采用Megazyme assays Kit(K-TSTA)试剂盒法测定。
1.3.5 蛋白浓度的测定
采用LORRY法[18],以牛血清蛋白为标准蛋白。
1.3.6 模拟胃肠道处理对提取物α-淀粉酶抑制率的影响
模拟胃肠处理主要参考让一峰等[19]的方法稍作修改。将经过处理后的提取物于37 ℃金属浴中振摇,用1 mol/L HCl溶液调节pH至2并加入胃蛋白酶来模拟胃环境,用1 mol/L NaOH溶液调节pH至8.2并加入胰蛋白酶来模拟肠环境。各反应120 min后回调温度与pH,测定其对α-淀粉酶的抑制率。
1.3.7 血糖生成指数的测定
按照FERRER-MAIRAL等[20]的方法测定血糖生成指数,并做了适当修改。准确称取样品(含淀粉50 mg),添加花芸豆提取物,添加α-淀粉酶,于37 ℃金属浴中振摇2 min,调节pH至2,加入胃蛋白酶,37 ℃金属浴中振摇60 min,中和调节pH,加入α-淀粉酶与胰蛋白酶,在0、10、20、30、60、90、120、180、240 min处取样,沸水浴5 min灭酶活性后离心,取上清液进行葡萄糖含量测定。参考GO I等[21]的方法建立非线性模型,淀粉水解动力学按公式(2)计算:
I等[21]的方法建立非线性模型,淀粉水解动力学按公式(2)计算:
C=C∞×(1-(exp-kt))
(2)
式中:C,C∞,k分别表示各时间点的淀粉水解率、最终水解率和动力学常数。水解指数(HI)为样品的水解曲线的面积与葡萄糖相应面积的百分比。估计血糖生成指数按公式(3)[22]计算:
eGI=0.862×HI+8.198
(3)
1.3.8 数据分析
实验重复3次,数据为平均值±标准偏差。使用SPSS 21.0软件进行显著性分析,使用Origin 2018进行做图。
2 结果与分析
2.1 不同蛋白酶对芸豆提取物α-淀粉酶抑制活力和凝集活力的影响
不同蛋白酶处理结果见表1。在α-淀粉酶抑制活力方面,菠萝蛋白酶、木瓜蛋白酶与中性蛋白酶对提取物抑制活力无显著影响(P>0.05),且凝集活力保留超过95%;碱性蛋白酶处理后,提取物抑制率保留率为80.30%,凝集活力保留超过90%;酸性蛋白酶处理效果较好,提取物α-淀粉酶抑制率保留率为85.89%,推测活力降低的主要原因是酸性环境与温度的协同作用[15],凝集活力降低至6.97%,原因可能是酸性蛋白酶在酶解凝集素的同时,pH对温度诱导的凝集素的失活也具有协同效应[23]。因此,选择酸性蛋白酶进行后续研究。
表1 不同蛋白酶对花芸豆提取物α-淀粉酶抑制活力与凝集活力的影响
Table 1 Effect of different proteases on α-amylase inhibitory activity and lectin activity of kidney bean extract
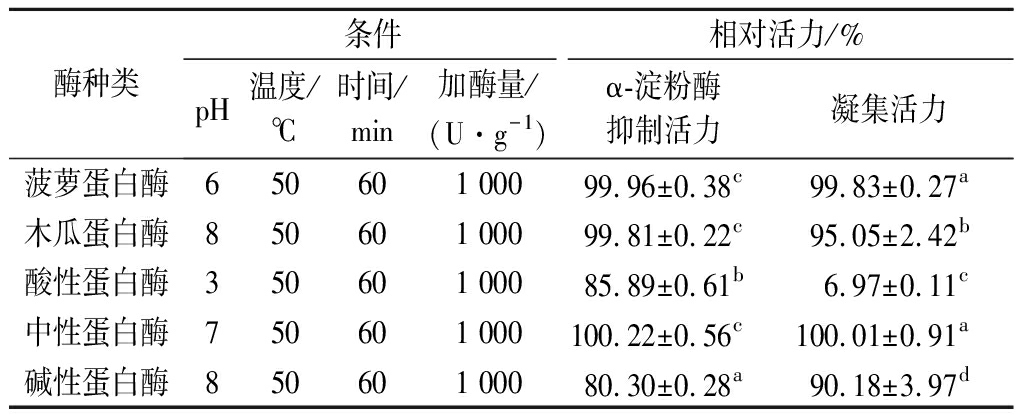
酶种类条件相对活力/%pH温度/℃时间/min加酶量/(U·g-1)α-淀粉酶抑制活力凝集活力菠萝蛋白酶65060100099.96±0.38c99.83±0.27a木瓜蛋白酶85060100099.81±0.22c95.05±2.42b酸性蛋白酶35060100085.89±0.61b6.97±0.11c中性蛋白酶750601000100.22±0.56c100.01±0.91a碱性蛋白酶85060100080.30±0.28a90.18±3.97d
注:相对活力=处理后活力/未处理活力,不同字母表示差异显著(P<0.05)(下同)
2.2 花芸豆α-淀粉酶抑制提取物制备工艺优化
2.2.1 pH的影响
在温度50 ℃、时间60 min、加酶量1 000 U/g条件下,研究了pH对花芸豆粗提液α-淀粉酶抑制活力与凝集活力的影响,结果以相对活力表示。如图1所示,在α-淀粉酶抑制活力方面,随着pH在2~4范围内升高,提取物α-淀粉酶抑制活力呈现出先下降后升高的趋势,在pH 3.5时抑制活力保留率最低为87.53%,此时凝集活力保留11.65%。在pH 3条件下,凝集活力保留率最低仅为5.76%,这可能是因为酸与热的协同作用会使粗提物中凝集素活力显著降低[23],同时pH变化过程中酸性蛋白酶活力也发生改变[24]。综合考虑,选择处理pH值为3。
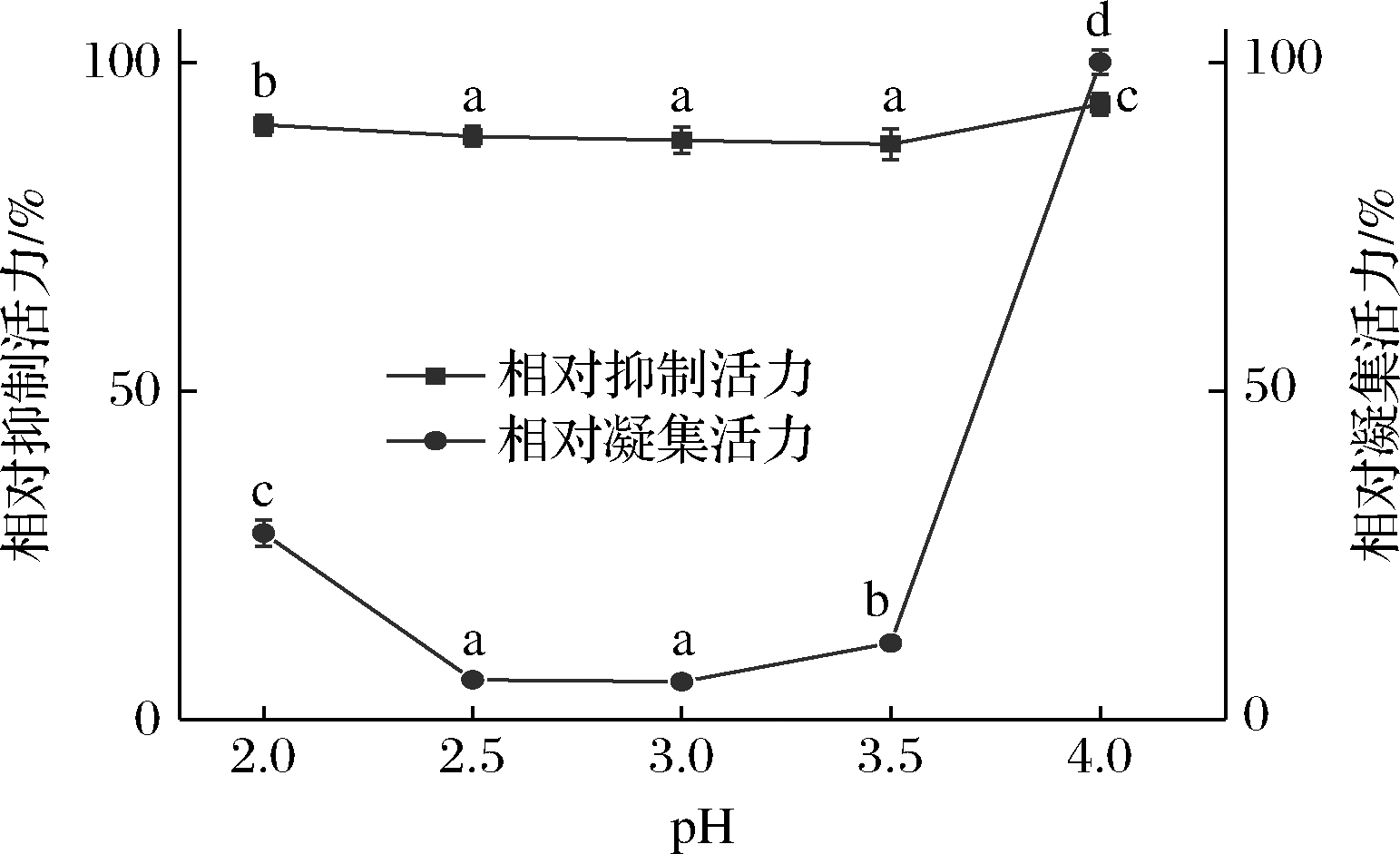
图1 pH对花芸豆提取物α-淀粉酶抑制活力与凝集活力的影响
Fig.1 Effect of pH on α-amylase inhibitory activity and lectin activity of kidney bean extract
2.2.2 温度的影响
由图2可知,在加酶量1 000 U/g、时间60 min、pH 3条件下,随着温度的升高,花芸豆提取物对α-淀粉酶的抑制活力与凝集活力均呈现降低趋势。当温度为30 ℃,提取物抑制活力与凝集活力保留率约为90%。温度升高至40 ℃,抑制活力变化不显著,凝集活力保留率降低至86.06%。温度>50 ℃时,抑制活力随着温度的升高显著降低(P<0.05),这是因为芸豆α-AI热稳定性较低,随着温度的升高,活力降低[7]。当温度达到70 ℃时,抑制活力保留81.87%。此时凝集活力保留率仅为0.16%。综合考虑,选择温度为70 ℃。

图2 温度对花芸豆提取物α-淀粉酶抑制活力与凝集活力的影响
Fig.2 Effect of temperature on α-amylase inhibitory activity and lectin activity of kidney bean extract
2.2.3 时间的影响
在加酶量1 000 U/g、温度50 ℃、pH 3条件下,处理时间对花芸豆提取液α-淀粉酶抑制活力与凝集活力的影响如图3所示。在60 min内,随着处理时间的增加,提取液对α-淀粉酶的抑制活力呈现降低的趋势,当时间>60 min时,抑制活力不再变化,保留率约为87.22%,此时凝集活力也趋于稳定,不再随着时间的增加而变化,保留率约为5.51%。综合考虑,处理时间选择60 min。
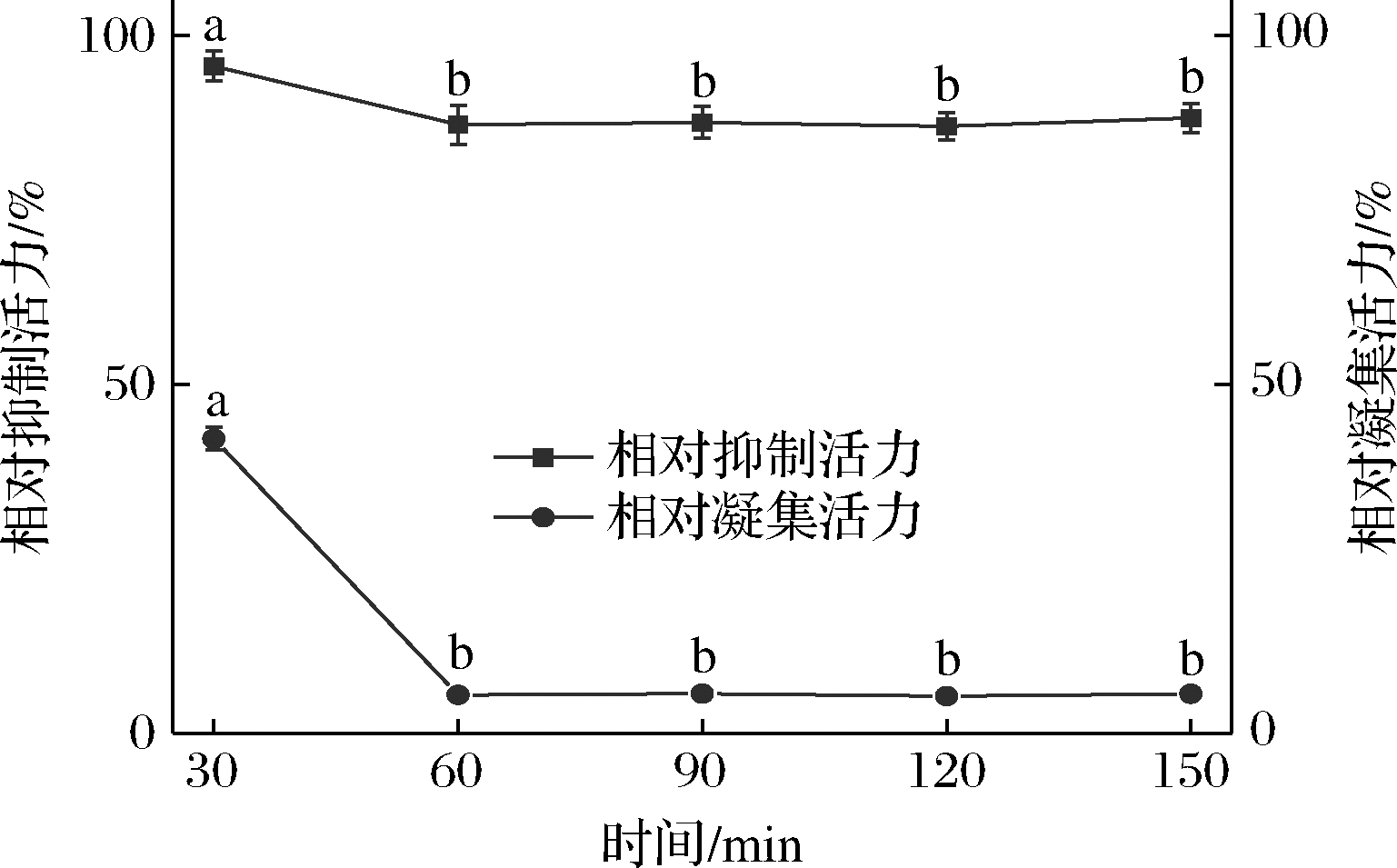
图3 时间对花芸豆提取物α-淀粉酶抑制活力与凝集活力的影响
Fig.3 Effect of treating time on α-amylase inhibitory activity and lectin activity of kidney bean extract
2.2.4 加酶量的影响
在温度50 ℃、时间60 min、pH 3条件下,加酶量对花芸豆提取液α-淀粉酶抑制活力与凝集活力的影响如图4所示。随着加酶量由500 U/g增加到1 000 U/g,花芸豆提取物相对抑制活力与相对凝集活力均显著降低,分别从95.62%和42.18%降低至87.22%和5.31%,随着加酶量的进一步增加,相对抑制活力与相对凝集活力均不再变化,这是因为当底物分子与酶分子百分之百结合的时候,再增加酶的用量也不会对反应造成显著影响[25]。综合考虑,选择加酶量为1 000 U/g。
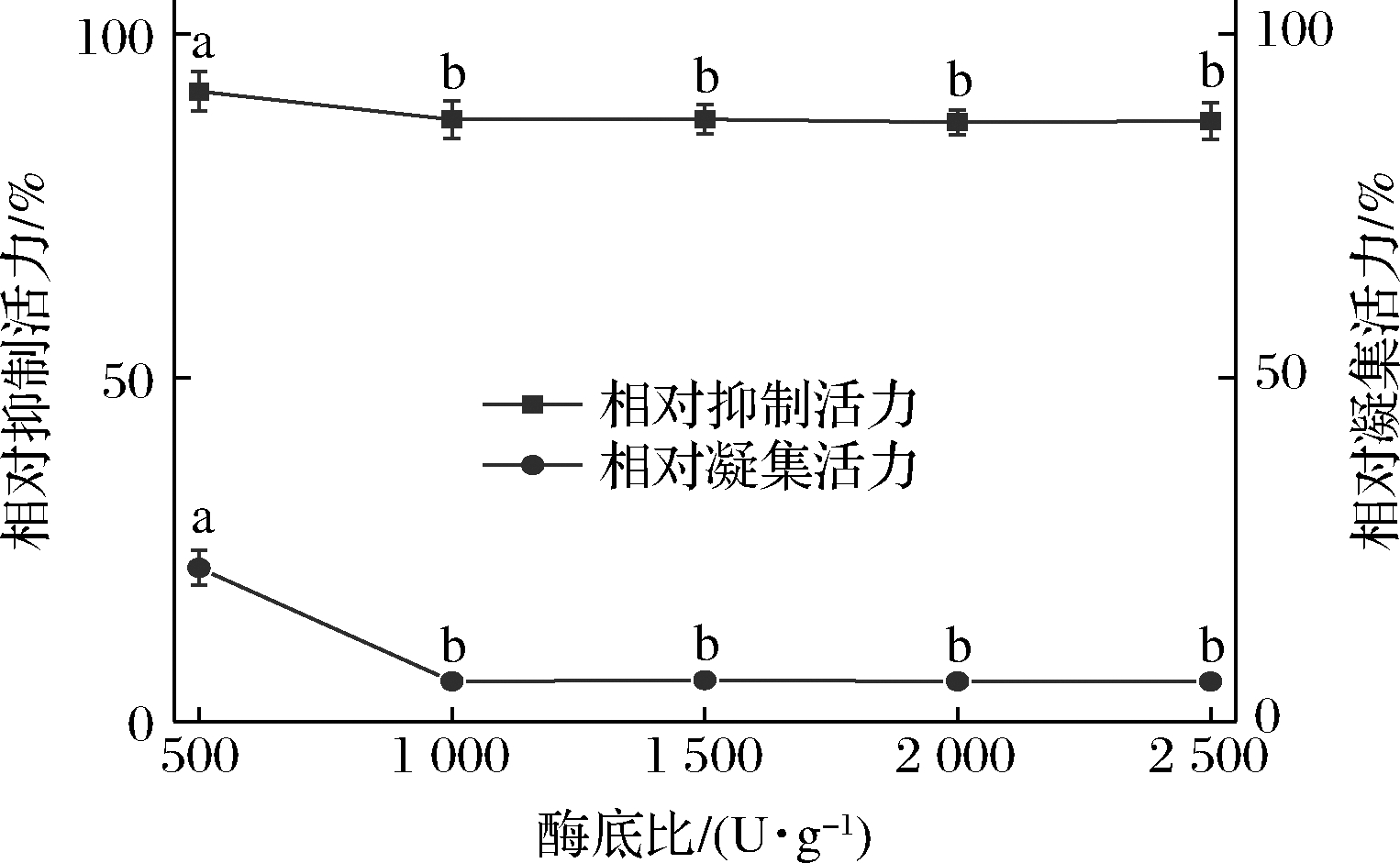
图4 加酶量对花芸豆提取物α-淀粉酶抑制活力与凝集活力的影响
Fig.4 Effect of enzyme level on α-amylase inhibitory activity and lectin activity of kidney bean extract
2.3 正交试验结果
综合单因素试验结果,以相对凝集活力为指标,进行正交试验,结果如表2所示。可以得出去除凝集活力的最佳条件为A1B3C3D2,即pH 2.5、温度70 ℃、时间90 min、加酶量1 000 U/g。
表2 正交试验设计及结果
Table 2 Orthogonal array design arrangement and experimental results
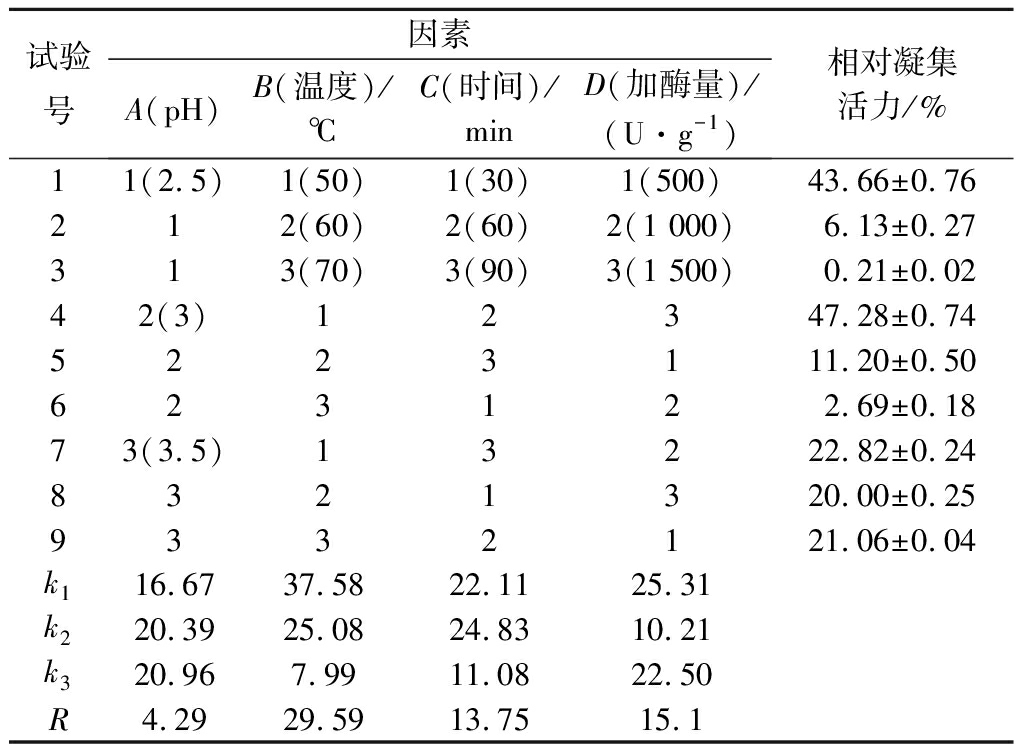
试验号因素A(pH)B(温度)/℃C(时间)/minD(加酶量)/(U·g-1)相对凝集活力/%11(2.5)1(50)1(30)1(500)43.66±0.76212(60)2(60)2(1000)6.13±0.27313(70)3(90)3(1500)0.21±0.0242(3)12347.28±0.745223111.20±0.50623122.69±0.1873(3.5)13222.82±0.248321320.00±0.259332121.06±0.04k116.6737.5822.1125.31k220.3925.0824.8310.21k320.967.9911.0822.50R4.2929.5913.7515.1
进行验证试验,发现此时血凝板中未出现血凝现象(n=0),即相对凝集活力为0%,表明正交试验结果可靠。各影响因素主次顺序为温度>加酶量>时间>pH。凝集素对人体有害,将其去除是花芸豆提取物应用于食品工业的前提,所以选择A1B3C3D2方法,此时相对抑制率为75.38%,相对凝集活力为0%。方差分析结果表明(表3),各因素对粗提物凝集活力影响显著。
表3 方差分析结果
Table 3 Analysis of variance
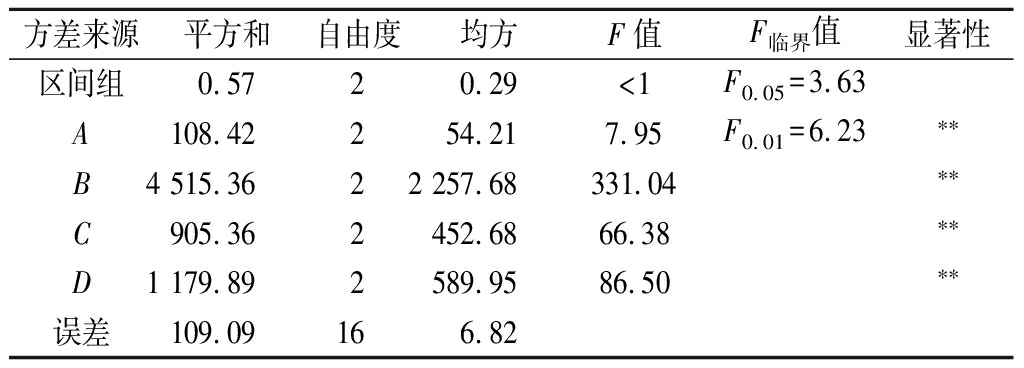
方差来源平方和自由度均方F值F临界值显著性区间组0.5720.29<1F0.05=3.63A108.42254.217.95F0.01=6.23**B4515.3622257.68331.04**C905.362452.6866.38**D1179.892589.9586.50**误差109.09166.82
注:**表示在0.01水平有显著差异
2.4 模拟胃肠道对提取物α-淀粉酶抑制率的影响
无凝集活力花芸豆提取物分别经体外胃、肠环境模拟后,α-淀粉酶抑制率的变化如图5所示,在模拟胃液处理后,抑制率显著降低,从63.15%降低至55.18%,这说明提取物对胃蛋白酶的水解具有一定的抵抗力,仍能保持一定的α-淀粉酶抑制率[26]。模拟肠液处理后,提取物对α-淀粉酶的抑制率变化不显著,与让一峰等[19]的研究结果相符。提取物先后经体外胃环境模拟和体外肠环境模拟后,仍具有53.53%抑制率。总而言之,花芸豆提取物在体外模拟胃、肠环境后仍对α-淀粉酶具有抑制效果,较为稳定。
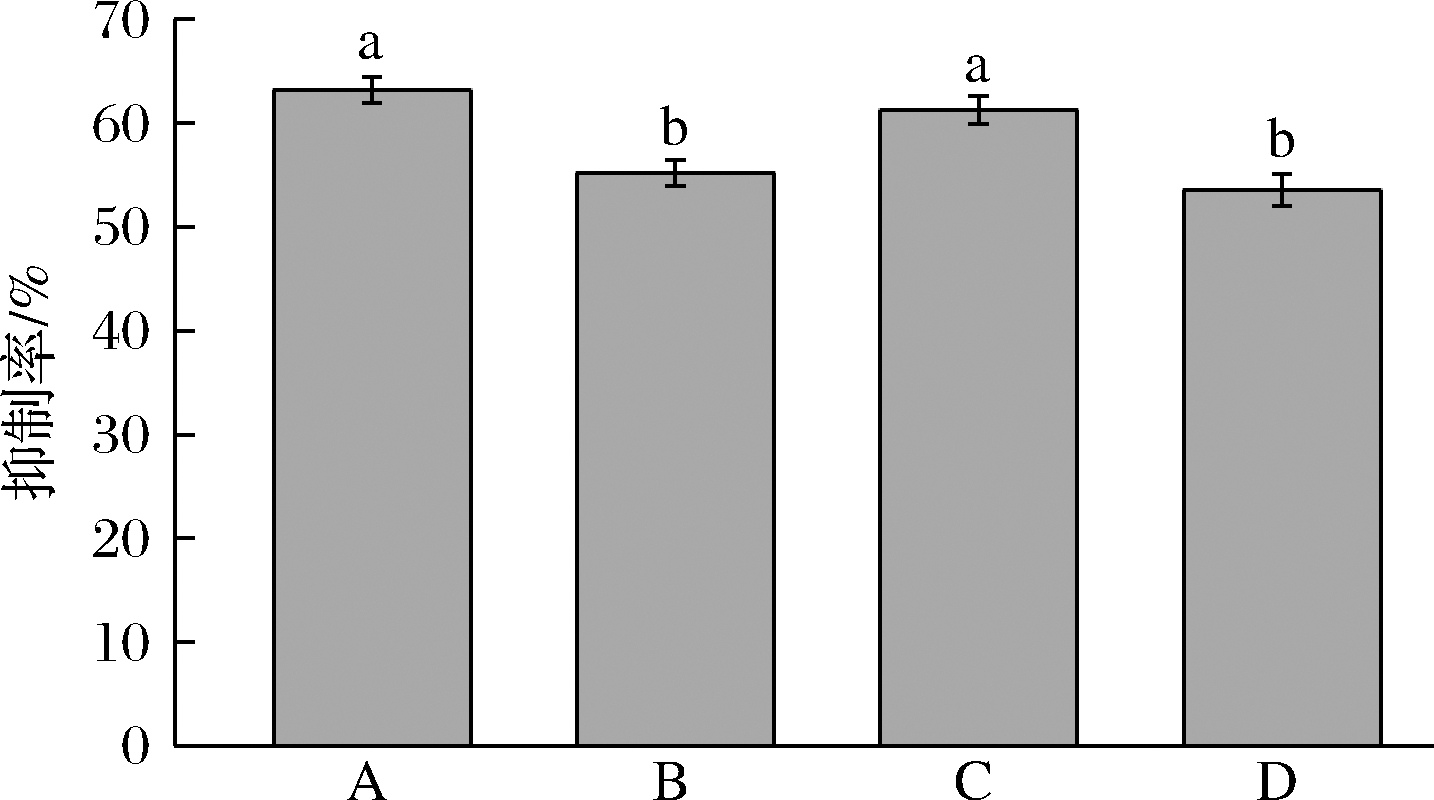
A-未经过模拟肠胃处理;B-模拟胃液处理;C-模拟肠液处理;D-模拟胃肠处理
图5 模拟胃肠处理对提取物α-淀粉酶抑制率的影响
Fig.5 Effect of simulating gastrointestinal treatment on α-amylase inhibitory activity and lectin activity of kidney bean extract
2.5 花芸豆提取物添加量对日常主食eGI的影响
日常主食淀粉水解度如图6所示,淀粉水解度随着水解时间的增加而增加,然后趋于平衡。面包淀粉水解平衡的时间为120 min,米饭、白馒头和玉米馒头则为180 min。添加了1%~3%的花芸豆提取物后,米饭、白馒头和玉米馒头淀粉水解平衡的时间降低至120 min,同时随着花芸豆提取物添加量的增加,淀粉水解度显著降低,在添加3%提取物后,面包、米饭、白馒头与玉米馒头的水解度分别从77.79%、84.58%、84.91%和77.90%降低至30.48%、40.98%、19.08%和15.12%。说明花芸豆提取物能够有效抑制不同淀粉的水解。
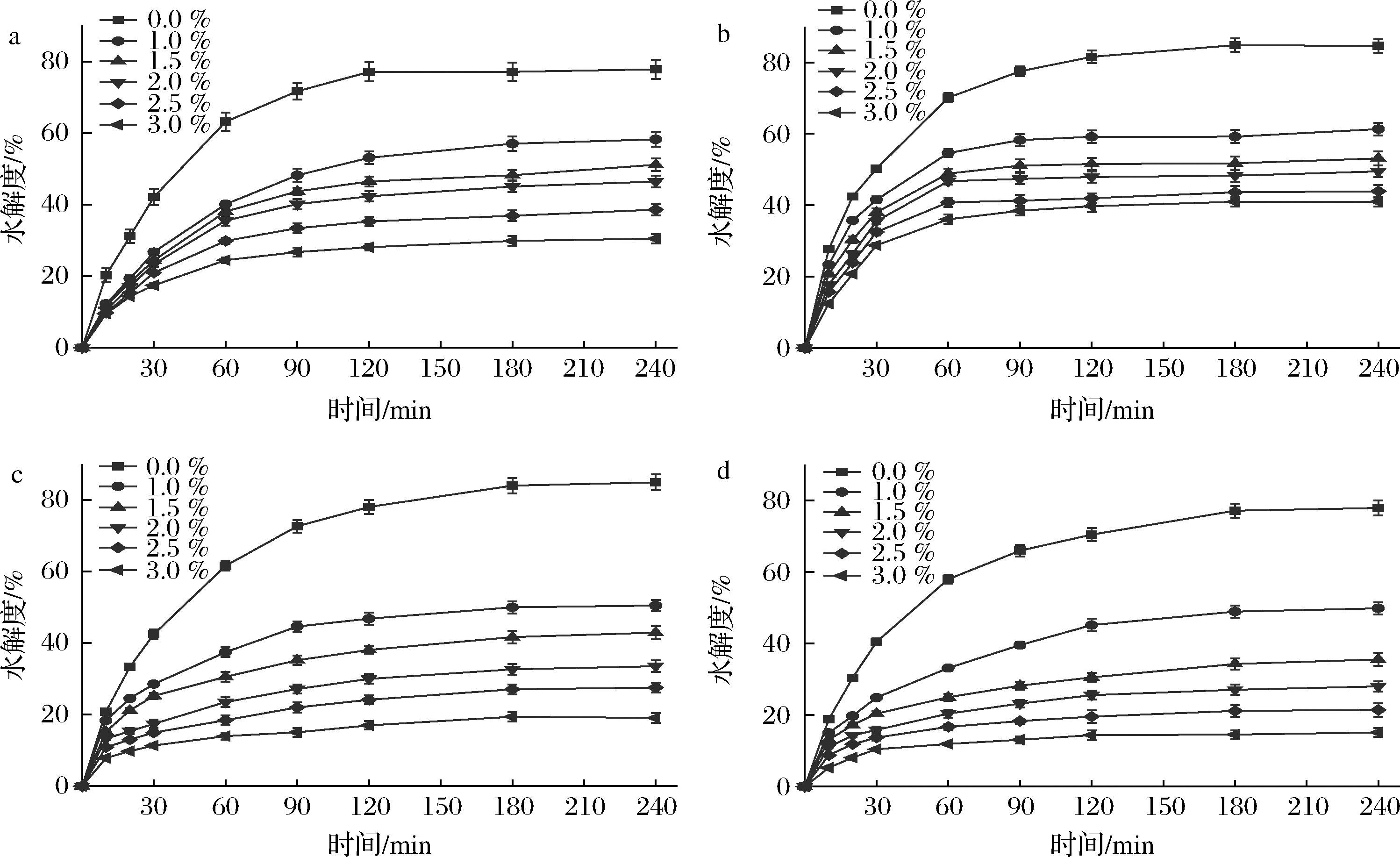
a-面包;b-米饭;c-白馒头;d-玉米馒头
图6 提取物添加量对主食淀粉水解度的影响
Fig.6 Hydrolysis curves of starch in staple foods containing different amount of kidney bean extract
不同提取物添加量对主食eGI的影响如表4所示,面包、米饭、白馒头与玉米馒头的eGI值分别为65.00、71.65、68.17和63.41,其中米饭属于高GI食品,面包、白馒头与玉米馒头属于中GI食品,随着花芸豆提取物的添加,4种主食eGI值都得到显著降低,且随着添加量的增加,eGI值进一步降低,当添加量为3%时,面包、米饭、白馒头与玉米馒头的eGI值分别降低至30.69、39.51、22.30和19.69,属于低GI食品。说明花芸豆提取物可应用于低GI食品中生产中,添加提取物的食品会降低餐后葡萄糖的升高,有益于糖尿病,肥胖症等疾病患者[27]。
表4 不同提取物添加量主食的估计血糖生成指数
Table 4 eGI of staple food containing various amounts of kidney bean extract

提取物添加量/%eGI面包米饭白馒头玉米馒头0.065.00±0.76a71.65±0.99a68.17±0.76a63.41±0.77a1.048.09±0.68b55.68±0.68b45.38±0.51b42.85±0.69b1.543.97±0.35c49.57±0.40c39.51±0.28c33.89±0.46c2.041.05±0.37d46.55±0.37d32.24±0.19d28.81±0.32d2.535.90±0.41e42.29±0.29e27.92±0.24e24.46±0.29e3.030.69±0.39f39.51±0.31f22.30±0.23f19.69±0.24f
注:同一列不同字母表示差异显著(P<0.05)
3 结论
花芸豆粗提物具有较强的α-淀粉酶抑制活力与凝集活力,比较了菠萝蛋白酶、木瓜蛋白酶、酸性蛋白酶、中性蛋白酶与碱性蛋白酶处理对粗提物α-淀粉酶抑制活力与凝集活力的影响,最终选择酸性蛋白酶制备无凝集活力花芸豆提取物。正交试验结果表明,温度70 ℃,pH 2.5,处理时间90 min,加酶量1 000 U/g条件下,花芸豆粗提物的凝集活力被完全去除的同时α-淀粉酶的抑制活力保留75.38%。对花芸豆粗提物凝集活力影响最大的因素是温度。体外模拟胃环境后,花芸豆提取物α-淀粉酶抑制活力显著降低,体外模拟肠环境则无显著影响。花芸豆提取物的添加会显著降低面包、米饭、白馒头与玉米馒头的eGI值,且随着添加量的增加进一步降低。
[1] 户月秀, 高小丽,侯夏乐,等.响应面法优化芸豆蛋白提取工艺[J].食品工业,2015,36(9):47-51.
HU Y X,GAO X L,HOU X L,et al.Optimization of protein extraction from Phaseolus vulgaris by response surface methodology[J].The Food Industry,2015,36(9):47-51.
[2] 梁亚静, 韩飞,梁盈,等.萌发对芸豆酚类物质及抗氧化活性的影响[J].食品工业科技,2015,36(16):142-146.
LIANG Y J,HAN F,LIANG Y,et al.Effect of germination on the content of polyphenols and antioxidation activity of kidney beans(Phaseolus vulgaris L.)[J].Science and Technology of Food Industry,2015,36(16):142-146.
[3] 葛平珍, 余莉,王昭礼,等.芸豆籽粒中胰蛋白酶抑制剂的研究进展[J].食品工业科技,2018,39(8):348-351.
GE P Z,YU L,WANG Z L,et al.Research progress on trypsin inhibitor of kidney beans’ seeds[J].Science and Technology of Food Industry,2018,39(8):348-351.
[4] 韩晶, 郑文彬,王颖,等.黑龙江芸豆主栽品种营养价值的评价[J].食品科技,2016,41(3):99-104.
HAN J,ZHENG W B,WANG Y,et al.Evaluation of protein nutritional value of kidney bean in Heilongjiang province[J].Food Science and Technology,2016,41(3):99-104.
[5] 赵蓉, 李多伟,沈晓东,等.白芸豆中α-淀粉酶抑制剂的研究[J].中成药,2008,30(9):1 355-1 357.
ZHAO R,LI D W,SHEN X D,et al.The research on the α-amylase inhibitor of white kidney bean[J].Chinese Traditional Patent Medicine,2008,30(9):1 355-1 357.
[6] BOWMAN D E.Amylase inhibitor of navy beans[J].Science,1945,102(2 649):358-359.
[7] 杨明琰.白芸豆中α-淀粉酶抑制剂糖蛋白的提取纯化、组成结构及生物活性研究[D].西安:西北大学2008.
YANG M Y.The research of extraction,purification、structure and biological activity of α-amylase inhibitor glycoprotein in white kidney beans[D].Xi’an:Northwest University,2008.
[8] 魏鹏娟, 王鲁峰,徐晓云,等.α-淀粉酶蛋白类抑制剂的研究进展[J].食品科学,2011,32(9):312-318.
WEI P J,WANG L F,XU X Y,et al.Research progresses on proteinaceous α-amylase inhibitors[J].Food Science,2011,32(9):312-318.
[9] 于雪慧.新疆奶花芸豆中α-淀粉酶抑制剂及凝集素的提取、分离、鉴定[D].石河子:石河子大学,2018.
YU X H.Extraction,purification and identification of alpha-amylase inhibitor and lectin from Phaseolus vulgaris[D].Shihezi:Shihezi University,2018.
[10] 让一峰, 赵伟,杨瑞金.低胰蛋白酶抑制剂活力的白芸豆α-淀粉酶抑制剂的工业化制备方法探究[J].食品与发酵工业,2016,42(4):1-5.
RANG Y F,ZHAO W,YANG R J.Industrial preparation of white kidney bean α-amylase inhibitor with low trypsin inhibitor activity[J].Food and Fermentation Industries,2016,42(4):1-5.
[11] 王颖, 李林峰,王欣卉,等.去凝集素芸豆粉理化与功能特性的研究[J].食品工业科技,2016,37(17):64-67;74.
WANG Y,LI L F,WANG X H,et al.Study on physicochemical and functional properties of kidney bean flour by phytohaemagglutinin-free[J].Science and Technology of Food Industry,2016,37(17):64-67;74.
[12] KASERA R,SINGH A B,KUMAR R,et al.Effect of thermal processing and γ-irradiation on allergenicity of legume proteins[J].Food & Chemical Toxicology,2012,50(10):3 456-3 461.
[13] LU Y J,LIU C C,ZHAO M M,et al.Structure and activity changes of phytohemagglutinin from red kidney bean(Phaseolus vulgaris)affected by ultrahigh-pressure treatments[J].Journal of Agricultural and Food Chemistry,2015,63(43):9 513-9 519.
[14] ZHAO J L,HE S D,TANG M M,et al.Low-pH induced structural changes,allergenicity and in vitro digestibility of lectin from black turtle bean(Phaseolus vulgaris L.)[J].Food Chemistry,2019,283:183-190.
[15] 让一峰.白芸豆α-淀粉酶抑制剂的制备及其在低GI方便粥中的应用[D].无锡:江南大学,2016.
RANG Y F.Preparation of white kidney bean α-amylase inhibitor and its application in instant porridge with low GI[D].Wuxi:Jiangnan University,2016.
[16] YANG M Y,ZHANG X Q,MA Y,et al.Purification and partial characterization of a glycoprotein alpha-amylase inhibitor from white kidney bean(Phaseolus vulgaris L.)[J].Journal of Food Biochemistry,2008,32(1):72-84.
[17] HE S D,SHI J,MA Y,et al.Kinetics for the thermal stability of lectin from black turtle bean[J].Journal of Food Engineering,2014,142:132-137.
[18] LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the Folin-phenol reagent[J].The Journal of Biological Chemistry,1951,193(1):265-275.
[19] 让一峰, 赵伟,杨瑞金,等.白芸豆α-淀粉酶抑制剂在加工和消化过程中的活性变化研究[J].食品工业科技,2015,36(17):53-57.
RANG Y F,ZHAO W,YANG R J,et al.Study on activity changes of α-amylase inhibitor from white kidney beans during processing and digestion[J].Science and Technology of Food Industry,2015,36(17):53-57.
[20] FERRER-MAIRAL A,PE ALVA-LAPUENTE C,IGLESIA I,et al.In vitro and in vivo assessment of the glycemic index of bakery products:Influence of the reformulation of ingredients[J].European Journal of Nutrition,2012,51(8):947-954.
ALVA-LAPUENTE C,IGLESIA I,et al.In vitro and in vivo assessment of the glycemic index of bakery products:Influence of the reformulation of ingredients[J].European Journal of Nutrition,2012,51(8):947-954.
[21] GO I I,GARCIA-ALONSO A,SAURA-CALIXTO F.A starch hydrolysis procedure to estimate glycemic index[J].Nutrition Research,1997,17(3):427-437.
I I,GARCIA-ALONSO A,SAURA-CALIXTO F.A starch hydrolysis procedure to estimate glycemic index[J].Nutrition Research,1997,17(3):427-437.
[22] PIECYK M,WOROBIEJ E,WO OSIAK R,et al.Effect of different processes on composition,properties and in vitro starch digestibility of grass pea flour[J].Journal of Food Measurement and Characterization,2019,13(1):848-856.
OSIAK R,et al.Effect of different processes on composition,properties and in vitro starch digestibility of grass pea flour[J].Journal of Food Measurement and Characterization,2019,13(1):848-856.
[23] BISWAS S,KAYASTHA A M.Thermal stability of Phaseolus vulgaris leucoagglutinin:A differential scanning calorimetry study[J].Journal of Biochemistry and Molecular Biology,2002,35(5):472-475.
[24] 訾艳, 王常青,陈晓萌,等.具有α-淀粉酶抑制活性的白芸豆多肽的制备及其热稳定性研究[J].食品科学,2015,36(13):190-195.
ZI Y,WANG C Q,CHEN X M,et al.Preparation and thermal stability of white kidney bean polypeptide with α-amylase inhibitory activity[J].Food Science,2015,36(13):190-195.
[25] 马瑞娟, 林煌华,谢友坪,等.固定化酶制备鳀鱼蒸煮液蛋白肽及其性能表征[J].食品与发酵工业,2020,46(9):122-127.
MA R J,LIN H H,XIE Y P,et al.Preparation and characterization of peptides from anchovy cooking liquid using immobilized protease[J].Food and Fermentation Industries,2020,46(9):122-127.
[26] GIBBS B F,ALLI I.Characterization of a purified α-amylase inhibitor from white kidney beans(Phaseolus vulgaris)[J].Food Research International,1998,31(3):217-225.
[27] UDANI J K,SINGH B B,BARRETT M L,et al.Lowering the glycemic index of white bread using a white bean extract[J].Nutrition Journal,2009,8(1):52.