直链糊精是一种由葡萄糖单元通过α-1,4-糖苷键连接而成的线性多糖[1],与直链淀粉具有相似的结构,其疏水性空腔由亚甲基和糖苷氧基团构成[2],当溶液中存在合适尺寸的客体分子时,不规则卷曲状的直链糊精能够与客体分子形成左手单螺旋结构[3-4],因此可以用来包埋客体分子。目前通常使用环糊精作为包埋壁材,但环糊精空腔大小较为固定、成本较高,难以包埋大尺寸客体分子。而支链淀粉通过酶解脱支、醇沉分级得到一系列聚合度不同的直链糊精形成的螺旋空腔尺寸不固定,且不同链长直链糊精形成的螺旋空腔大小不尽相同[5-6]。近年来,以直链糊精为壁材包埋生物活性物质逐渐受到关注[7-8],但对不同链长直链糊精对客体分子包埋特性的研究甚少。
维生素E是一种脂溶性维生素,作为最主要的抗氧化剂之一[9],具有延缓衰老和消除自由基[10]等功能。然而,维生素E对热和光的不稳定性严重限制了其在各领域的应用[11]。本文选用维生素E为客体,以蜡质玉米淀粉为原料,通过普鲁兰酶脱支,乙醇梯度溶解法分级得到几种不同链长直链糊精,制备直链糊精-维生素E复合物,评价其耐热、耐光稳定性,以期为选择合适链长直链糊精包埋生物活性分子提供指导。
1 材料与方法
1.1 材料与试剂
蜡质玉米淀粉,杭州星普罗淀粉有限公司;普鲁兰酶(1 498 NPUN/g),美国Sigma试剂公司;无水乙醇、维生素E、无水磷酸氢二钠、一水柠檬酸、己烷,国药集团化学试剂有限公司。
1.2 仪器与设备
ME104E电子天平,梅特勒-托利多仪器(上海)有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;ICS—5000+离子色谱仪,美国赛默飞世尔科技公司;Waters 1525EF高效液相色谱仪,美国沃特世公司;TU-1900双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;IS10傅里叶红外光谱仪,美国Nicolet公司;D8-Advance型X-射线衍射仪,德国Bruker公司;TGA2热分析系统,瑞士梅特勒-托利公司;SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司;ZF-1三用紫外分析仪,上海驰唐电子有限公司。
1.3 实验方法
1.3.1 不同链长直链糊精的制备
参考CHANG[12]和HU等[13]的方法并加以优化。用pH 5.0~5.5的磷酸盐缓冲溶液配制10%的蜡质玉米淀粉乳,高压灭菌锅处理40 min,冷却至55 ℃,加入体积为淀粉乳体积2%的普鲁兰酶,保温24 h,沸水浴10 min灭酶,离心(4 500 r/min,8 min)后,将上清液旋转蒸发去除乙醇和大部分水,得到未分级的直链糊精(unfractionated linear dextrin,UNLD),真空冷冻干燥得到粉末;准确称取2 g UNLD,加入100 mL乙醇与水体积比为2∶1的乙醇溶液,60 ℃恒温水浴搅拌4 h,离心(4 500 r/min,20 min)弃掉上清液,收集沉淀;向沉淀中加入乙醇与水体积比1∶1的乙醇溶液,60 ℃恒温水浴搅拌4 h,离心(4 500 r/min,20 min)后将上清液旋转蒸发除去乙醇和大部分水,冻干得到的样品命名为LD1∶1;继续向沉淀中加入乙醇与水体积比1∶5的乙醇溶液,同样的方法制备LD1∶5;沉淀用大量去离子水洗涤,干燥得到的样品命名为LD>1∶5。
1.3.2 直链糊精链长及分子质量测定
取25 mg样品分散于5 mL超纯水中,在恒定磁搅拌的油浴中加热,使其完全糊化,过0.22 μm的滤膜备用。高效阴离子交换色谱系统装备脉冲安培检测器,色谱柱型号为戴安CarboPAC PA200。流动相为150 mmol/L的NaOH溶液,流速为0.4 mL/min,进样量为25 μL。平均聚合度(degree of polymerization,DP)计算公式(1)为:
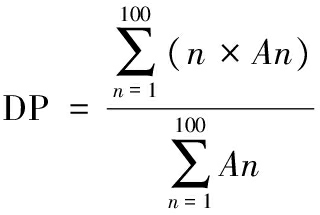
(1)
式中:n,峰序号;A,峰面积,nC·min。
分子质量测定使用带有保护柱的超水凝胶线性色谱柱(300 mm×7.8 mm,2 μm)。采用一系列不同分子质量的葡萄糖标准品(Mw 2 700、9 750、135 030、300 600和2 000 000)作为标准。
1.3.3 不同链长直链糊精-维生素E复合物的制备
取1 g直链糊精分散到100 mL去离子水中,加热糊化后冷却至70 ℃,取0.1 g 维生素E用少量无水乙醇溶解,待直链糊精温度冷却至70 ℃时,逐滴加入维生素E-乙醇溶液,70 ℃下密封避光搅拌2 h以促进两者复合,待复合结束后缓慢冷却至室温,离心(10 000 r/min,10 min)后得到的沉淀用V(无水乙醇)∶V(蒸馏水)=50∶50的混合液洗涤2次后冷冻干燥,即为LD-维生素E复合物。采用同样的方法作空白实验,得对照品的直链糊精。质量比为10∶1的直链糊精与维生素E物理混合即得物理混合物(LD+VE)。
1.3.4 直链糊精对维生素E负载量、包埋率的测定
1.3.4.1 标准曲线的绘制
精密称取161.9 mg 维生素E样品,用己烷溶解定容至100 mL,分别吸取维生素E标准溶液1、2、3、4和5 mL置于25 mL容量瓶中,用己烷定容至刻度,摇匀。以己烷为空白对照,在200~400 nm全波长扫描,确定最大吸收波长。
在最大吸收波长处(285 nm)测量吸光值,得到标准曲线回归方程为:A=0.004 6ρ-0.002 9(R2=0.999 9),A为吸光值,ρ为维生素E含量(μg/mL)。
1.3.4.2 负载量、包埋率的测定
取上述LD-VE分散于己烷中,超声处理15 min,离心(10 000 r/min,10 min)后将沉淀重新分散到己烷中,重复3次,合并上清液,采用紫外分光光度法测定维生素E含量[14]。
负载量计算公式(2)为:
(2)
式中:ω,维生素E负载量,μg/mg;ρ,维生素E含量,μg/mL;V,样品溶液总体积,mL;N,样品稀释倍数;m0,样品质量,mg。
包埋率按公式(3)计算:
(3)
式中:Y,维生素E包埋率,%;m1,LD-VE复合物质量,g;ω,维生素E负载量,μg/mg;m2,加入维生素E的质量,g。
1.3.5 直链糊精-VE复合物结构分析
1.3.5.1 傅里叶变换衰减全反射红外光谱(attenuated total reflection flourier transformed infrared spectroscopy,ATR-FTIR)
取少量样品平铺于样品台上。实验参数如下:扫描波长为4 000~400 cm-1,分辨率为4 cm-1,扫描次数为32次[15]。
1.3.5.2 X-射线衍射(X-ray diffraction,XRD)
扫描时采用NaI晶体闪烁计数器测量,扫描范围3~40°,扫描速度4°/min[16]。采用Jade 5.0软件进行分析。
1.3.6 热分析(thermogravimetric analysis,TGA)
称取4 mg左右的样品置于瓷坩埚中,从30 ℃升温至500 ℃,升温速率为10 ℃/min。测定过程中,样品处于氮气氛围中,氮气流速为20 mL/min。通过对TGA曲线求导得到微商热重分析(differentia thernmal gravity,DTG)曲线。
1.3.7 直链糊精-VE复合物的耐光稳定性分析
将样品置于紫外灯(254 nm)下照射,分别在照射的第0、1、3、5、10、24、36和48 h取样,采用1.3.4的方法测定剩余维生素E的含量。
1.4 数据统计分析
使用Origin 2018软件对数据进行拟合和绘图。使用SPSS 18.0进行方差分析和Duncan显著性分析以确定不同样品之间的显著差异,P<0.05表示在统计学上具有显著性差异。所有实验平行测定3次,数据以平均值±标准差的形式呈现。
2 结果与分析
2.1 直链糊精链长测定
普鲁兰酶是一类淀粉脱支酶,能够专一性切开支链淀粉分支点中的α-1,6糖苷键,形成分子质量分布广的直链糊精UNLD。用乙醇梯度溶解法将UNLD分为3个组分:LD1∶1、LD1∶5和沉淀LD>1∶5。如图1所示,分级后的直链糊精在DP 30~60部分呈现递增趋势。DP结果如表1所示,LD1∶1、LD1∶5和LD>1∶5的DP分别为14.53、16.20和25.25。当加入较高含量的乙醇时,短链溶解,长链沉淀[17]。因此,LD1∶1DP<6,DP 6~12和DP 13~24部分所占比例高于LD1∶5和LD>1∶5。随着乙醇含量的降低,直链糊精长链部分在溶液中的溶解量增加,因此,LD1∶5长链部分(DP 25~36和DP ≥ 37)所占比例高于LD1∶1。沉淀LD>1∶5长链部分比例分别达到21.91%和21.68%,显著高于LD1∶5。

图1 分级前后直链糊精链长分布
Fig.1 Chain length distributions of unfractionated linear dextrin(UNLD)and fractionated linear dextrin(LD)samples
表1 分级前后直链糊精链长分布
Table 1 Chain length of unfractionated linear dextrin(UNLD)and fractionated linear dextrin(LD)samples
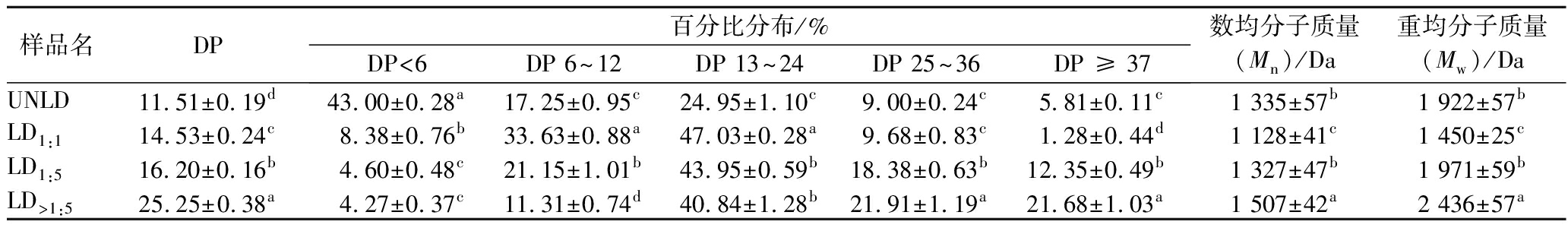
样品名DP百分比分布/%DP<6DP6~12DP13~24DP25~36DP≥37数均分子质量(Mn)/Da重均分子质量(Mw)/DaUNLD11.51±0.19d43.00±0.28a17.25±0.95c24.95±1.10c9.00±0.24c5.81±0.11c1335±57b1922±57bLD1:114.53±0.24c8.38±0.76b33.63±0.88a47.03±0.28a9.68±0.83c1.28±0.44d1128±41c1450±25cLD1:516.20±0.16b4.60±0.48c21.15±1.01b43.95±0.59b18.38±0.63b12.35±0.49b1327±47b1971±59bLD>1:525.25±0.38a4.27±0.37c11.31±0.74d40.84±1.28b21.91±1.19a21.68±1.03a1507±42a2436±57a
注:每一列后面的数字(a~d)代表差异性显著(P<0.05)
LD1∶1、LD1∶5和LD>1∶5的重均分子质量(Mw)分别为1 450、1 971和2 436 Da。不同分子质量的直链糊精在同一乙醇溶液中溶解度不同,即分子质量与溶解度呈负相关。乙醇含量降低导致各组分分子质量增加,其顺序为LD1∶1
2.2 直链糊精对维生素E的负载量和包埋率
不同链长直链糊精对VE负载量和包埋率如图2所示。随着直链糊精链长增加,包合物中维生素含量以及直链糊精对维生素包埋率都呈现递增趋势。当直链糊精的DP由14.53增加至25.25时,直链糊精对维生素E负载量从45.97 μg/mg提高至62.71 μg/mg,维生素E包埋率从39.07%增加至59.57%。因此,可以说明直链糊精的链长对维生素E负载量、包埋率有影响,且链长长的直链糊精对维生素E负载量和包埋率高。
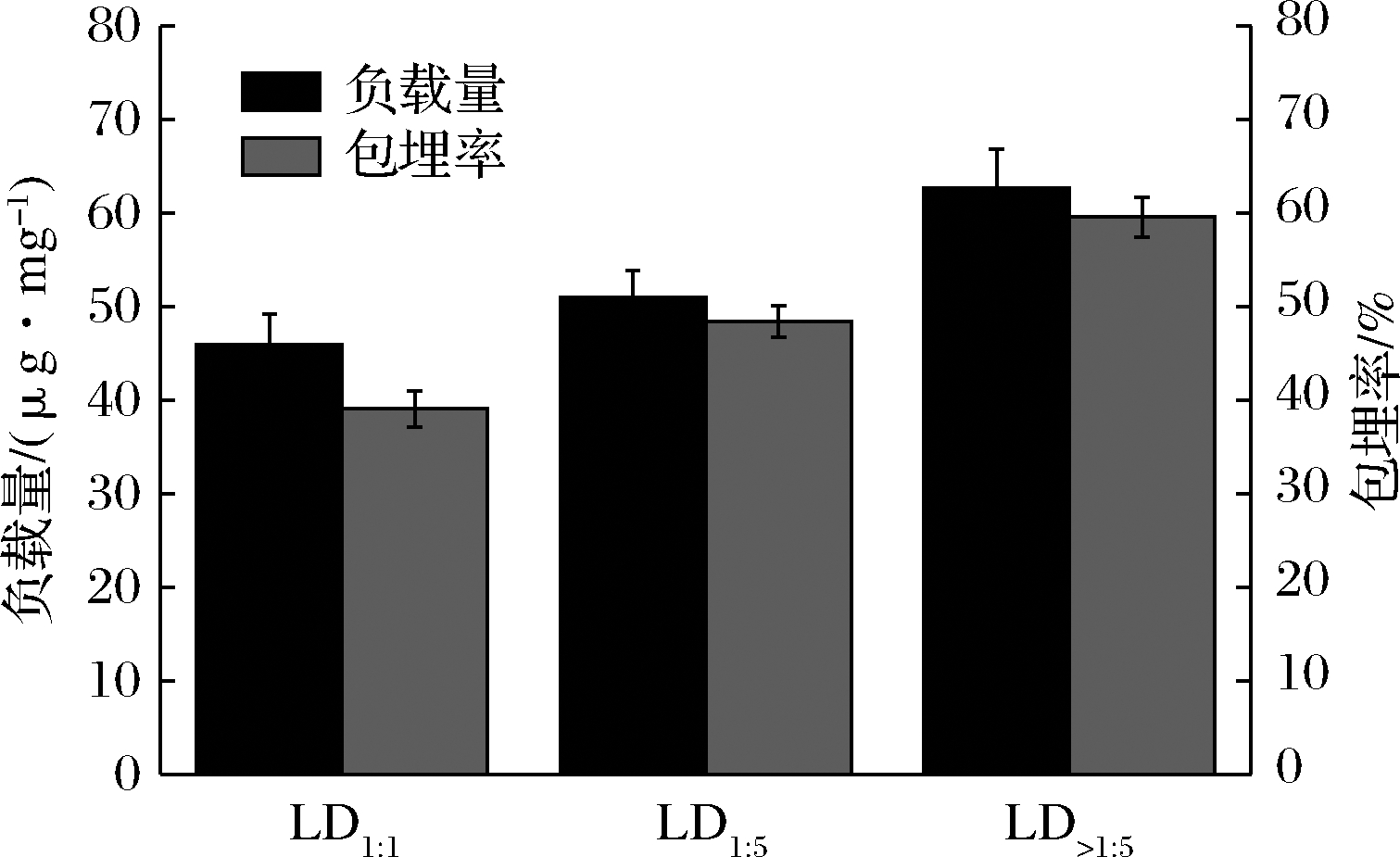
图2 不同链长直链糊精对维生素E的负载量和包埋率
Fig.2 Effect of chain length of LD on vitamin E payload and inclusion rate
2.3 直链糊精-VE复合物的结构分析
2.3.1 FTIR分析
如图3所示,LD1∶1、LD1∶5和LD>1∶5在3 600~2 990 cm-1的宽吸收峰是由于-OH的伸缩振动引起的,而2 925 cm-1的峰与-CH2的碳氢不对称伸缩振动有关[18]。1 016、1 076和1 147 cm-1处的3个强吸收峰分别对应C—C与C—O伸缩振动和C—H弯曲振动。
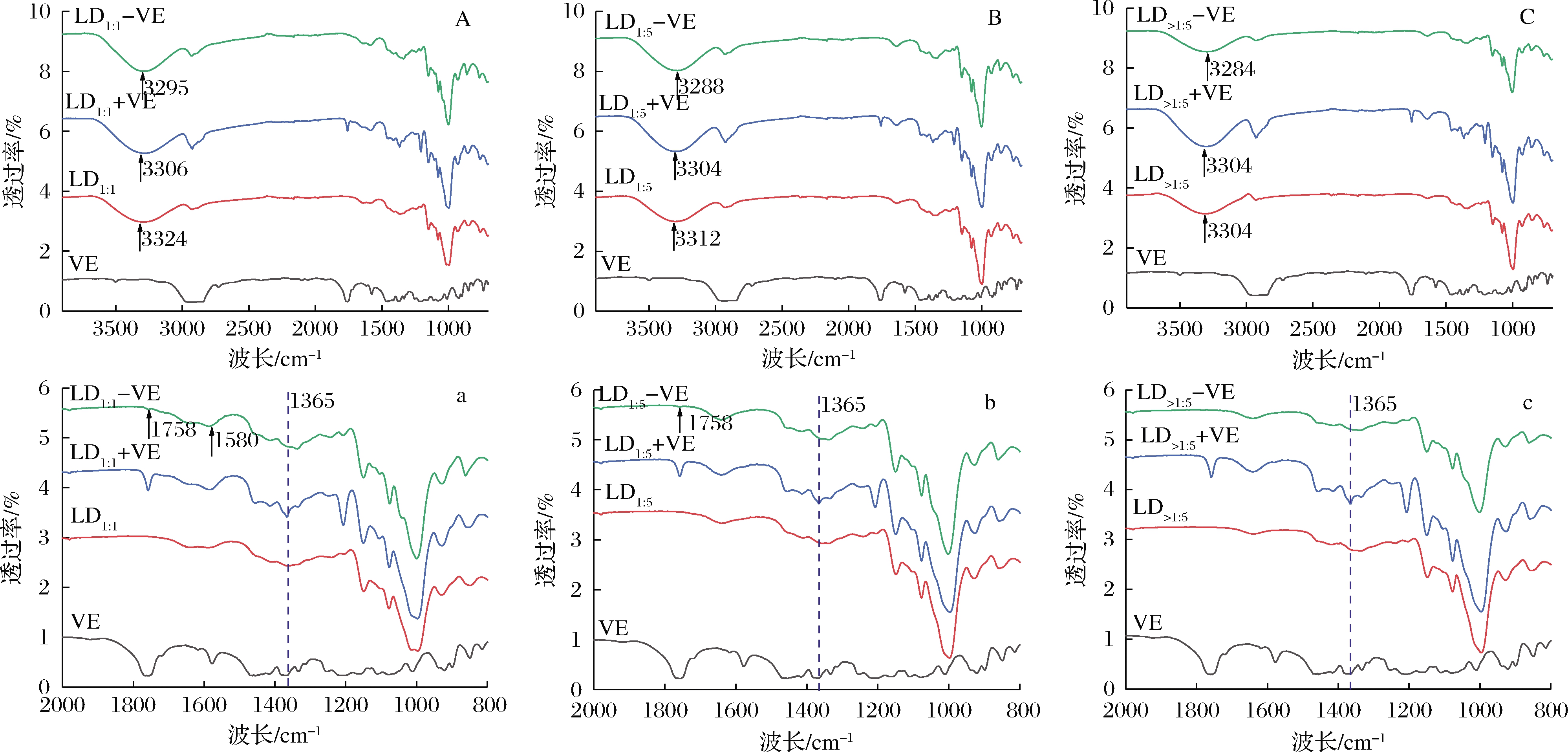
LD-VE-直链糊精与维生素E复合物;LD+VE-直链糊精与维生素E的物理混合物;图中a,b和c分别为A,B和C细节放大图
图3 不同链长直链糊精、维生素E及其复合物的红外图谱
Fig.3 FT-IR of LD with different chain length,vitamin E and its complexes
在维生素E的光谱中,1 365 cm-1处的吸收峰属于苯基骨架[19],在2 840、2 961和1 758 cm-1处观察到特征吸收峰依次对应于维生素E分子中CH2伸缩振动,CH3伸缩振动,C![]() O振动[20]。维生素E和直链糊精物理混合物的红外谱图显示了两者叠加的特征峰,说明物理混合没有改变2种物质的结构,两者没有发生相互作用。而在LD-VE中,1 365 cm-1处属于苯基骨架的特征峰几乎消失,说明芳香环被包裹在直链糊精内部。复合物的羟基伸缩振动波数移向低波数,说明直链糊精与维生素E之间通过氢键作用形成复合物。马云标等[21]也曾经在环糊精与维生素E复合物中发现相同现象。LD1∶1-VE在1 580 cm-1处属于芳香环的峰未被掩盖,说明LD1∶1不能将维生素E全部包裹,LD1∶1-VE和LD1∶5-VE仍能观察到1 758 cm-1处属于维生素E的C
O振动[20]。维生素E和直链糊精物理混合物的红外谱图显示了两者叠加的特征峰,说明物理混合没有改变2种物质的结构,两者没有发生相互作用。而在LD-VE中,1 365 cm-1处属于苯基骨架的特征峰几乎消失,说明芳香环被包裹在直链糊精内部。复合物的羟基伸缩振动波数移向低波数,说明直链糊精与维生素E之间通过氢键作用形成复合物。马云标等[21]也曾经在环糊精与维生素E复合物中发现相同现象。LD1∶1-VE在1 580 cm-1处属于芳香环的峰未被掩盖,说明LD1∶1不能将维生素E全部包裹,LD1∶1-VE和LD1∶5-VE仍能观察到1 758 cm-1处属于维生素E的C![]() O振动峰,而LD>1∶5-VE中1 758 cm-1处属于维生素E的特征峰消失。综上可知,长链直链糊精与VE形成复合物结构更加稳定。
O振动峰,而LD>1∶5-VE中1 758 cm-1处属于维生素E的特征峰消失。综上可知,长链直链糊精与VE形成复合物结构更加稳定。
2.3.2 XRD分析
图4为LD和LD-VE的XRD谱图。LD1∶1、LD1∶5和LD>1∶5在5.6、14、17和22.3°附近出现衍射峰,表明直链糊精为较弱的B-型结构。维生素E的X-射线衍射图谱呈现一个大而宽的晶胞,表明其具有非结晶性、无定形的特性。复合物在5.7、17、19.5和22°等处出现衍射峰,呈现较弱的B-+V-型结构。LD1∶1-VE、LD1∶5-VE和LD>1∶5-VE的相对结晶度分别为26.5%、33.7%和41.9%,说明链长较长的直链糊精与维生素E形成的结晶结构更紧密,与负载量结果一致。
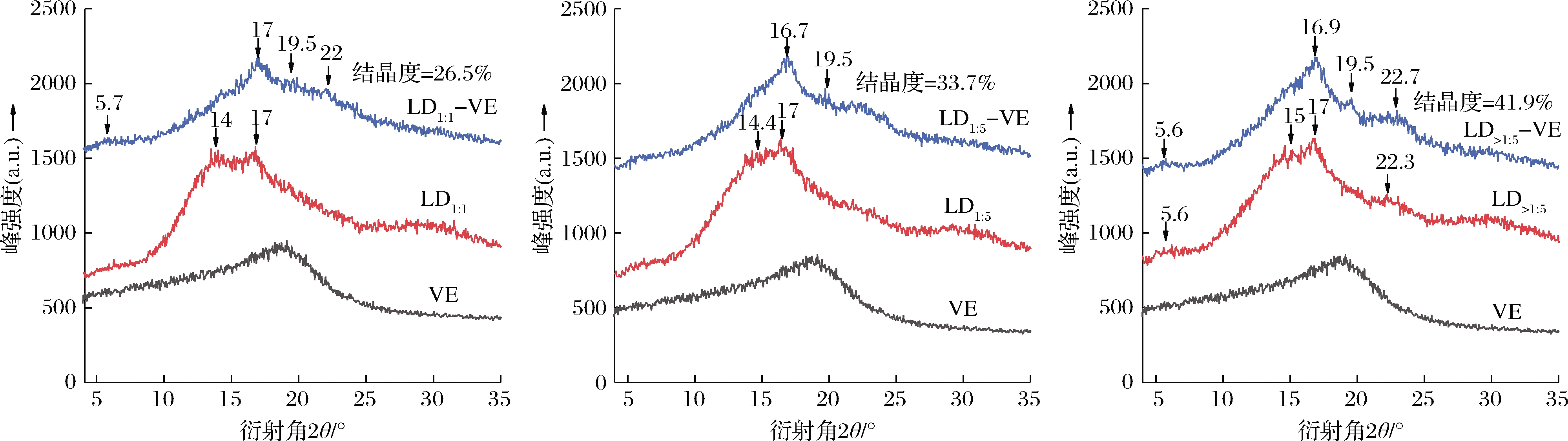
图4 不同链长直链糊精及其与维生素E复合物的XRD图谱
Fig.4 X-ray diffraction patterns of LD with different chain length and its complexes with vitamin E
2.4 直链糊精-VE复合物耐热稳定性分析
采用TGA分析LD-VE耐热稳定性,如图5所示。LD1∶1呈现双裂解峰,峰值温度分别是233和298 ℃,LD1∶1-VE峰值温度分别为249和305 ℃。LD1∶5和LD>1∶5的失重表现为2个阶段,第1阶段是结合水减少造成的失重,第2阶段是直链糊精热降解造成的失重。LD1∶5和LD>1∶5的裂解峰值温度分别为312和318 ℃,复合物在热降解阶段后移形成更高的裂解温度,分别为318和321 ℃。结果表明LD与维生素E复合提高了维生素E耐热稳定性。
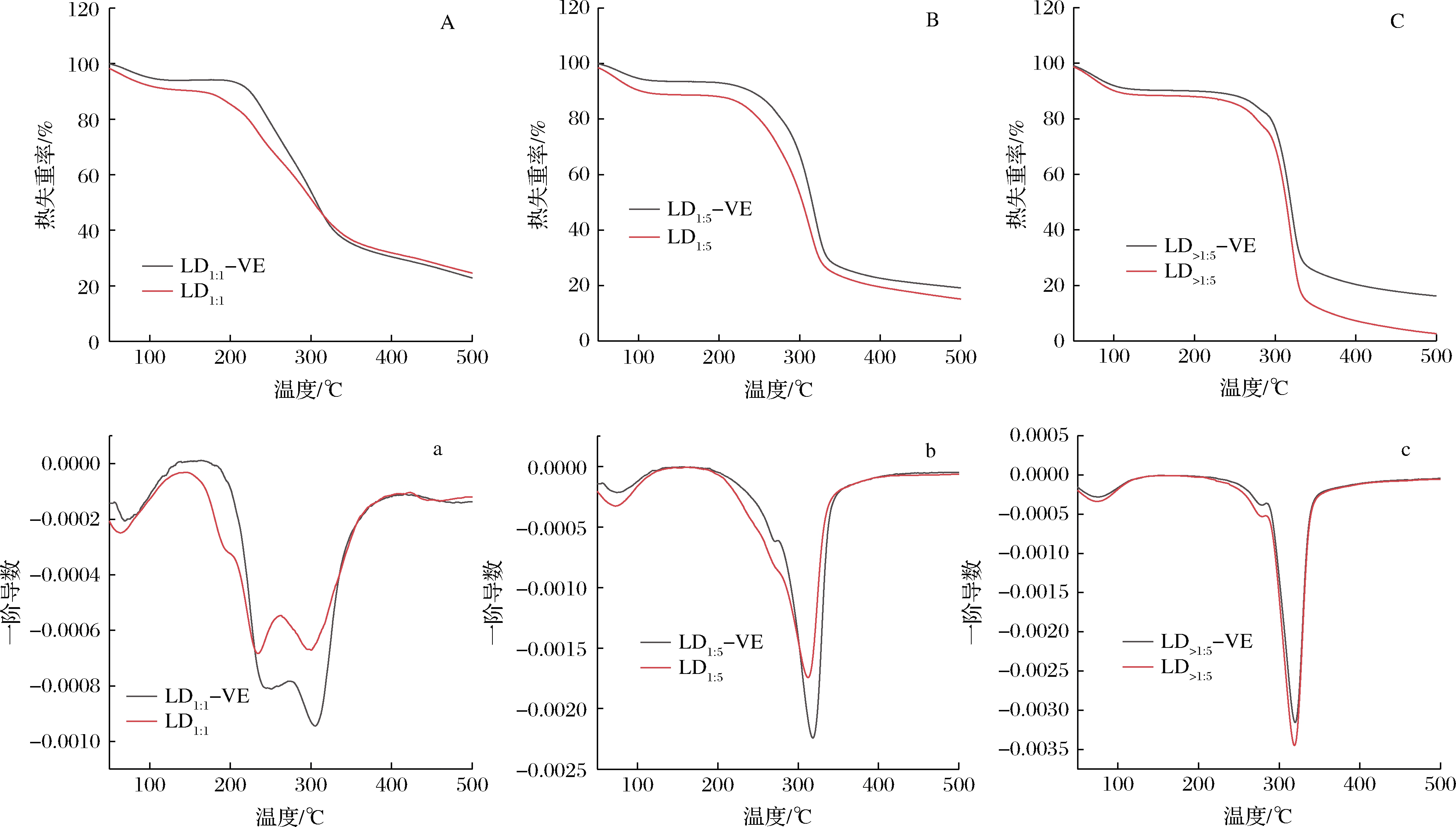
图5 直链糊精与直链糊精-VE复合物的TGA分析
Fig.5 TGA analysis of linear dextrin with different chain length and its complexes with vitamin E
2.5 直链糊精-维生素E复合物耐光稳定性分析
维生素E中存在酚羟基和β-二酮基团,使其对光较敏感[14]。如图6所示,随着照射紫外线的时间的增加,所有样品的维生素E保留率都有所下降,经过48 h的紫外光照射后,游离维生素E的保留率仅为59.52%,而复合后的维生素E保留率分别为78.73%(LD1∶1)、82.01%(LD1∶5)和89.19%(LD>1∶5),说明直链糊精对维生素E起到了保护作用,显著提高了其耐光稳定性。链长长的直链糊精与维生素E之间的相互作用更强,复合物的结构更加紧密,从而具有更强的保护作用。
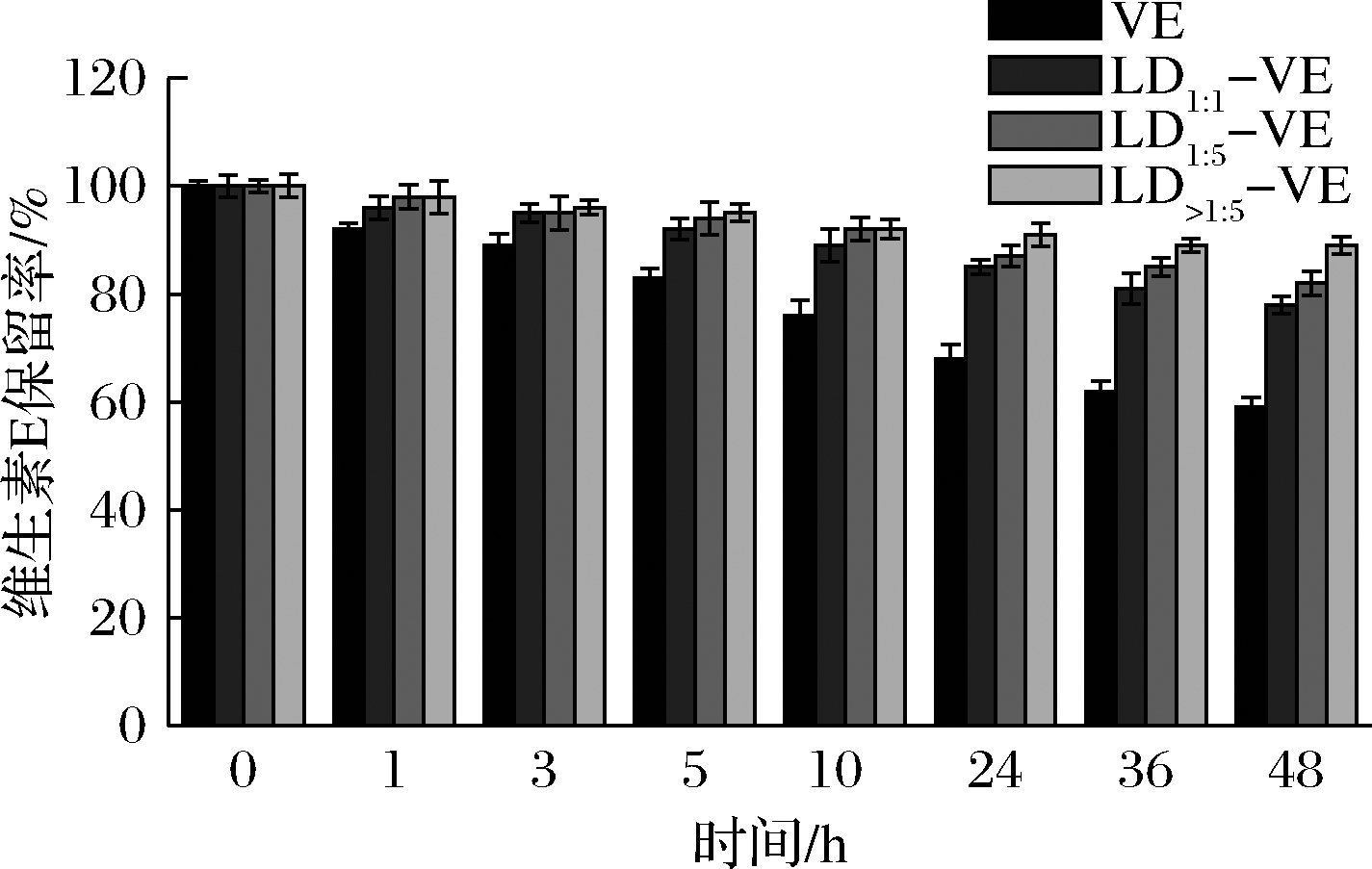
图6 游离VE和不同链长直链糊精-维生素E复合物的光降解曲线
Fig.6 Photochemical degradation of free vitamin E and LD-VE complexes
3 结果与讨论
制备了不同链长直链糊精与维生素E复合物,发现直链糊精对维生素E的负载量和包埋率受直链糊精链长的影响,长链直链糊精对维生素E负载量和包埋率高于短链的直链糊精。直链糊精与维生素E通过氢键作用形成复合物,且链长长的直链糊精与维生素E形成的复合物更稳定。复合物的形成提高了维生素E的耐热、耐光稳定性,长链直链糊精(LD>1∶5)对维生素E的保护效果优于短链(LD1∶1和LD1∶5),为不同链长直链糊精包埋疏水性客体分子提供了指导,有望扩大不同链长直链糊精在包埋领域的应用。
[1] CHUNG H J,LIU Q,LEE L,et al.Relationship between the structure,physicochemical properties and in vitro digestibility of rice starches with different amylose contents[J].Food Hydrocolloids,2011,25(5):968-975.
[2] WANG S X,ZHAN J L,JIN Z Y,et al.Enhanced fluorescence of starch-fluorescence guest complexes enables evaluation of the encapsulation properties of maize starches[J].Food Hydrocolloids,2017,63:286-292.
[3] GELDERS G G,VANDERSTUKKEN T C,GOESAERT H,et al.Amylose-lipid complexation:A new fractionation method[J].Carbohydrate Polymers,2004,56(4):447-458.
[4] OBIRO W C,RAY S S,EMMAMBUX M N.V-amylose structural characteristics,methods of preparation,significance,and potential applications[J].Food Reviews International,2012,28(4):412-438.
[5] HU X T,LIU C M,JIN Z Y,et al.Fractionation of starch hydrolysate into dextrin fractions with low dispersity by gradient alcohol precipitation[J].Separation and Purification Technology,2015,151:201-210.
[6] XU J,ZHAO W X,NING Y W,et al.Can helical spring dextrin be composed of higher eight glucose units per turn[J].Journal of Molecular Structure,2013,1 036:303-309.
[7] 冯涛, 曾小兰,王珂,等.短链葡聚糖-姜黄素纳米乳液的制备及结构表征[J].农业工程学报,2019,35(1):303-309.
FENG T,ZENG X L,WANG K,et al.Preparation and structure characterization of short glucan chain-curcumin nano-emulsion[J].Transactions of the Chinese Society of Agricultural Engineering,2019,35(1):311-317.
[8] WANG P P,QIN X S,YANG Q Y,et al.Comparative structural characterization of spiral dextrin inclusion complexes with vitamin E or soy isoflavone[J].Journal of Agricultural and Food Chemistry,2017,65(39):8 744-8 753.
[9] 宋晓燕, 杨天奎.天然维生素E的功能及应用[J].中国油脂,2000,25(6):45-47.
SONG X Y,YANG T K.Function and application of natural vitamin E[J].China Oils and Fats,2000,25(6):45-47.
[10] HATEGEKIMANA J.对维生素E运输体系的设计及其稳定性和生物利用率的研究[D].无锡:江南大学,2016.
HATEGEKIMANA J.Designing delivery systems of vitamin E to enhance its stability and bioaccessibility[D].Wuxi:Jiangnan University,2016.
[11] 龙吉云.高含量天然维生素E油微胶囊化研究[D].南昌:南昌大学,2011.
LONG J Y.Study on microencapsulation of high content natural Vitamin E[D].Nanchang:Nanchang University,2011.
[12] CHANG R R,XIONG L,LI M,et al.Fractionation of debranched starch with different molecular weights via edible alcohol precipitation[J].Food Hydrocolloids,2018,83:430-437.
[13] HU X T,HUANG Z H,ZENG Z L,et al.Improving resistance of crystallized starch by narrowing molecular weight distribution[J].Food Hydrocolloids,2020,103:105 641.
[14] 王萍萍.基于疏水性生物活性因子新型糊精超分子体系的构筑及其性质研究[D].广州:华南理工大学,2018.
WANG P P.Study on preparation and characterization of a novel dextrin supermolecule system based on hydrophobic bioactive materials[D].Guangzhou:South China University of Technology,2018.
[15] MA R R,TIAN Y Q,CHEN L,et al.Effects of cooling rate on retrograded nucleation of different rice starch-aromatic molecule complexes[J].Food Chemistry,2019,294:179-186.
[16] CHANG R R,TIAN Y Q,LU H,et al.Effects of fractionation and heat-moisture treatment on structural changes and digestibility of debranched waxy maize starch[J].Food Hydrocolloids,2020,101:105 488.
[17] LU H,XIONG L,LI M,et al.Separation and characterization of linear glucans debranched from normal corn,potato and sweet potato starches[J].Food Hydrocolloids,2019,89:196-206.
[18] SUN B H,TIAN Y Q,CHEN L,et al.Linear dextrin as curcumin delivery system:Effect of degree of polymerization on the functional stability of curcumin[J].Food Hydrocolloids,2018,77:911-920.
[19] CELEBIOGLU A,UYAR T.Antioxidant vitamin E/cyclodextrin inclusion complex electrospun nanofibers:Enhanced water-solubility,prolonged shelf-life and photostability of vitamin E[J].Journal of Agricultural and Food Chemistry,2017,65(26):5 404-5 412.
[20] WANG P P,LUO Z G,PENG X C.Encapsulation of vitamin E and soy isoflavone using spiral dextrin:Comparative structural characterization,release kinetics,and antioxidant capacity during simulated gastrointestinal tract[J].Journal of Agricultural and Food Chemistry,2018,66(40):10 598-10 607.
[21] 马云标, 朱科学,周惠明.维生素E微胶囊的理化性质表征[J].中国油脂,2010,35(1):55-59.
MA Y B,ZHU K X,ZHOU H M.Physical and chemical characterization of vitamin E microcapsules[J].China Oils and Fats,2010,35(1):55-59.