瓜尔豆是一年生耐旱的豆科植物,主要用来生产瓜尔胶,广泛应用于食品、石油等工业中[1]。瓜尔豆粕是瓜尔胶生产过程中的副产物,含有33%~45%的蛋白质,且比大豆粕价格便宜,是一种开发潜力很大的植物蛋白资源,但由于抗营养因子的存在限制了其在食品等工业上的应用[2]。豆粕经微生物发酵后,不仅可以去除部分抗营养因子,而且会产生小分子肽类、酚类、黄酮类活性成分,大大地提高其营养价值、活性成分和抗氧化等功能并改善其品质[3-7]。尽管利用农副产品作为发酵基质进行固体发酵的研究很多,所用原料大多为大豆粕等大豆加工的副产品,其他农副产品如瓜尔豆粕等的研究相对较少,未能充分发掘其价值。贝莱斯芽孢杆菌作为潜在的发酵食品发酵剂,能增加发酵食品的营养成分和功能活性[8]。CAO等[9]利用贝莱斯芽孢杆菌SN-1发酵产胞外多糖,可作为天然的抗氧化剂和益生菌应用于食品工业。LIU等[10]利用贝莱斯芽孢杆菌DP-2发酵豆粕,抗营养因子大豆抗原蛋白和β-伴大豆球蛋白分别降低了78%和43%,粗蛋白和可溶性蛋白分别增加了13.45%和12.53%。目前尚未见贝莱斯芽孢杆菌发酵瓜尔豆粕的研究报道。
血栓性疾病严重危害人类健康,发病率和死亡率居各种疾病之首。据统计,目前全世界每年约有1 700万患者死于血栓性疾病,且仍呈高发态势[11]。因此,高效溶栓药物的研制备受关注。目前临床上常用的尿激酶、链激酶和纤溶酶原激活剂等溶栓药物存在副作用大、价格昂贵、半衰期短等缺点。相比之下,微生物源纤溶酶,具有可口服、安全、高效、持久和廉价等优势而备受青睐[12]。
本研究利用从中国传统发酵食品豆豉中筛选的1株高产纤溶酶的贝莱斯芽孢杆菌CAU263对农业副产物进行固体发酵,研究其活性成分、溶栓及抗氧化活性,为瓜尔豆粕的合理利用提供依据。
1 材料与方法
1.1 材料与试剂
瓜尔豆粕,北京瓜尔润科技股份有限公司;凝血酶、胃蛋白酶、胰蛋白酶、牛纤维蛋白原、DPPH、Trolox(6-羟基-2,5,7,8-四甲基色烷-2-羧酸)、水溶性维生素E,美国Sigma-Aldrich公司;胰蛋白胨、酵母提取物、琼脂粉,英国Oxoid公司;其他试剂如无说明均为国产分析纯,北京化工厂。贝莱斯芽孢杆菌(Bacillus velezensis)CAU263为本实验室自行筛选,保藏于中国普通微生物菌种保藏管理中心,保藏号为CGMCC 20318。
1.2 仪器与设备
HZQ-F160全温振荡培养箱,太仓市豪城实验仪器制造有限公司;TYAIB立式压力蒸汽灭菌锅,宁波久兴医疗器械有限公司;LHS-500L恒温恒湿培养箱,上海一恒科学仪器有限公司;GL-20B高速冷冻离心机,上海安亭科学仪器厂;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;TU—1800PC紫外可见分光光度计,北京普析通用仪器设备有限责任公司;DK-S24恒温水浴锅,上海精宏实验设备有限公司;Thermo Multiskan FC酶标仪,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 主要培养基
LB液体培养基(g/L):酵母提取物5、蛋白胨10、NaCl 10,121 ℃灭菌20 min。
LB固体培养基(g/L):酵母提取物5、蛋白胨10、NaCl 10、琼脂20,121 ℃灭菌20 min。
固体发酵培养基:60 g磨碎过20目筛的农业副产物装入1 L三角瓶中,加入60 mL蒸馏水浸润12 h,121 ℃灭菌20 min。
1.3.2 种子液的制备
挑取保存于LB固体培养基上的贝莱斯芽孢杆菌CAU263单菌落接入装液量为10 mL的50 mL三角瓶中,37 ℃摇床培养10 h获得种子液。
1.3.3 固体发酵方法
将种子液稀释1 000倍后按农业副产物质量的5%混匀于120 mL无菌水[m(农业副产物)∶V(水)=1∶2]中,再接至固体发酵培养基中,在37 ℃、70%的恒温恒湿培养箱中发酵48 h。将发酵结束的样品真空冷冻干燥48 h后,磨碎过20目筛,获得冻干粉样品。
对照样品(未发酵):用3 mL无菌水代替种子液,其余步骤同上。
原料样品:原料不经任何处理。
1.3.4 单因素发酵条件优化
以纤溶活性为评价指标,逐级优化,考察固体发酵基质农业副产物种类(瓜尔豆粕、豆饼粉、菜籽粕、黄豆粕、棉籽粕、花生粉饼、稻米粕、油茶籽粕、小麦麸皮、燕麦麸皮、玉米芯和豆壳)、蒸煮时间(25、30、35、40、45 min)、加水量[m(固体基质)∶V(水)=1∶1、1∶2、1∶3、1∶4、1∶5)、接种量(3%、4%、5%、6%、7%,质量分数)、发酵时间(12、24、36、48、60 h)5个因素对纤溶酶产量的影响。
1.3.5 样品提取液的制备
分别取10 g发酵、对照及原料冻干粉样品,加入100 mL水于25 ℃、200 r/min下提取2 h,10 000 r/min离心10 min后,收集上清液待测,水提液样品质量浓度为100 mg/mL。
1.3.6 纤溶活性的测定
纤溶活性测定按照HUY等[13]的纤维蛋白降解法并稍作修改。将0.4 mL 0.72%纤维蛋白原溶液及1.4 mL 50 mmol/L硼砂缓冲液加入离心管中混匀后,放入37 ℃水浴锅中预热5 min。加入0.1 mL 20 U/mL凝血酶,混匀后在37 ℃水浴锅中反应10 min。将样品水提液稀释至合适浓度后,加入0.1 mL样品水提液稀释液于上述试液中,混匀后在37 ℃下反应60 min,每隔20 min振荡1次。反应结束时立刻加入500 μL 0.2 mol/L的三氯乙酸溶液终止反应,然后于10 000 r/min下离心10 min,取上清液在275 nm处测定吸光值。对照处理:先加入500 μL三氯乙酸溶液,后加入0.1 mL样品水提液,其余步骤同上。纤溶活性的定义:在275 nm下,与样品对照相比,样品的吸光值1 min增加0.01所需的酶量相当于1个酶活力单位(FU)。按公式(1)计算:
(1)
式中,X:样品测定液的纤溶活性,FU/mL,根据样品水提液中折合瓜尔豆粕的质量,将结果换算为FU/g DW;Ar:样品测定液的吸光值;Ac:对照的吸光值;60:反应时间为60 min,以1 min计;0.1:反应的样品体积是0.1 mL;N:稀释倍数。
1.3.7 抗凝血活性的测定
按照WEI等[14]和刘梦洁等[15]的测定方法并稍作修改。将纤维蛋白原和凝血酶溶于pH 7.2,50 mmol/L Tris-HCl缓冲液(含0.12 mmol/L NaCl),配制成质量分数为0.1%的纤维蛋白原溶液及4 U/mL的凝血酶溶液。分别吸取140 μL 0.1%纤维蛋白原、样品水提液稀释液加入96孔板中,放置酶标仪中于405 nm处测定吸光值,5 min后加入30 μL 4 U/mL凝血酶,于37 ℃反应10 min后于405 nm处测定吸光值。阳性对照为用40 μL 10 mg/mL的肝素钠代替样品,空白对照为用40 μL Tris-HCl缓冲液代替样品,其余操作同上。样品的抗凝血活性按公式(2)计算,并根据样品质量浓度与抗凝血活性的关系计算出样品抗凝血活性IC50值(表示抗凝血活性抑制率为50%时所需的样品质量浓度)。计算公式如下:
(2)
式中,X:某质量浓度下样品测定液的抗凝血活性百分比;A1:反应10 min后空白对照的吸光度;A2:预热5 min后空白对照的吸光度;A3:反应10 min后样品测定的吸光度;A4:预热5 min后样品待测液的吸光度。
1.3.8 总酚含量的测定
采用福林酚法[16]。将样品水提液稀释10倍后用作待测液(10 mg/mL)。以没食子酸作为标准品制作标准曲线,单位为mg GAE/mL,根据瓜尔豆粕冻干粉质量,将结果换算为mg GAE/g DW(全文均以干重计)。
1.3.9 总异黄酮含量的测定
参照LI等[17]的方法并稍作修改。将样品水提液稀释10倍后用作待测液(10 mg/mL),将100 μL样品待测液和6 μL质量分数为5%的NaNO2溶液加入96孔板中混合均匀后反应6 min,再加入6 μL质量分数为10%的Al(NO3)3溶液反应6 min,然后加入80 μL质量分数为4%的NaOH溶液终止反应,加入8 μL体积分数为50%的乙醇将反应体系补足至200 μL,静置15 min后在510 nm下测定吸光值。以芦丁为标准品制作标准曲线,单位为mg RE/mL,根据瓜尔豆粕冻干粉质量,将结果换算为mg RE/g DW(全文均以干重计)。
1.3.10 多肽含量的测定
采用邻苯二甲醛法[18]。用Gly-Leu二肽作为标准品制作标准曲线,单位为mg/mL,然后根据瓜尔豆粕冻干粉质量,将结果换算为mg/g DW(全文均以干重计)。
1.3.11 还原糖含量的测定
采用二硝基水杨酸法[19]。以葡萄糖制作标准曲线,还原糖含量根据瓜尔豆粕冻干粉质量,结果以mg/g DW表示(全文均以干重计)。
1.3.12 DPPH自由基清除能力的测定
将DPPH自由基溶解于无水乙醇中,配制成0.1 mmol/L DPPH溶液。将40 μL的样品测定液与200 μL的DPPH溶液在96孔板中混合均匀,在暗处避光反应30 min后于517 nm处测定吸光值A1。同时测定40 μL无水乙醇溶液与200 μL DPPH溶液混合后的吸光度A2(阴性对照),及40 μL样品溶液与200 μL无水乙醇溶液混合后的吸光度A3(阳性对照)[20-21]。按公式(3)计算DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
以抗氧化剂维生素E(Trolox, TE)为阳性对照,将样品换算成TE当量来表示抗氧化能力,单位为μmol TE/g DW。
1.4 数据处理
每组实验重复3次,结果表示为![]() 各组数据采用SPSS 19.0软件分析处理。采用Origin 9.2软件做图。
各组数据采用SPSS 19.0软件分析处理。采用Origin 9.2软件做图。
2 结果与分析
2.1 单因素优化贝莱斯芽孢杆菌CAU263固体发酵产纤溶酶
2.1.1 农业副产物种类对贝莱斯芽孢杆菌CAU263固体发酵产纤溶酶的影响
如表1所示,瓜尔豆粕作为固体发酵基质时,产纤溶酶的水平最高,纤溶活性达到117.7 FU/g DW,其次是黄豆粕和豆饼粉,纤溶活性分别达到111.3和110.1 FU/g DW。而以小麦麸皮作为固体发酵基质时,无纤溶活性。因此,选择瓜尔豆粕作为最适固体发酵基质。
表1 不同种类农业副产物对贝莱斯芽孢杆菌CAU263固体发酵产纤溶酶的影响
Table 1 Effects of different agricultural byproducts on fibrinolytic enzyme production through solid-state fermentation by B.velezensis CAU263
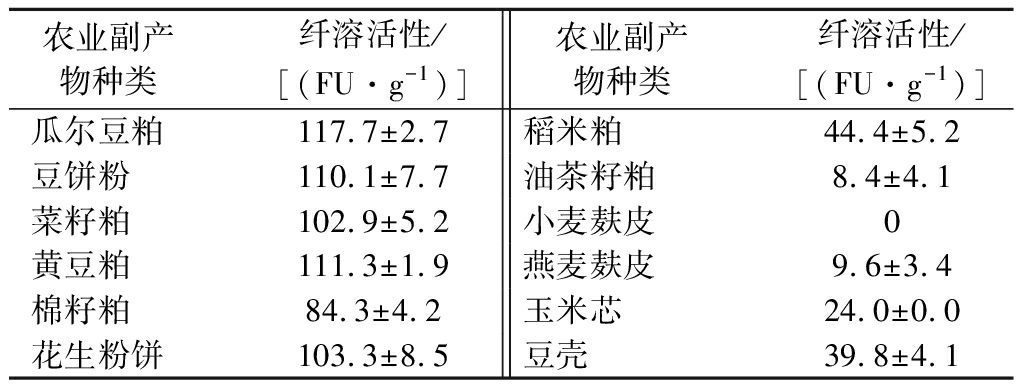
农业副产 物种类 纤溶活性/[(FU·g-1)]农业副产 物种类 纤溶活性/[(FU·g-1)]瓜尔豆粕117.7±2.7稻米粕44.4±5.2豆饼粉110.1±7.7油茶籽粕8.4±4.1菜籽粕102.9±5.2小麦麸皮0黄豆粕111.3±1.9燕麦麸皮9.6±3.4棉籽粕84.3±4.2玉米芯24.0±0.0花生粉饼103.3±8.5豆壳39.8±4.1
近年来,人们对固体发酵产酶的兴趣日益增加,最重要的原因之一是工农业副产物作为微生物生长基质的低成本和适宜性[22]。目前,豆粉、稻米粕、玉米麸皮、葵花籽粕、麦麸等都可以作为有机氮源或碳源来进行固体发酵产酶和提升营养价值[23]。当固体基质为麦麸时比米糠和绿豆皮产纤溶活性更高[24]。PAN等[25]以黄豆粕作为主要发酵基质,最终获得纤溶酶产量达3 787 U/mL。BI等[26]同样以黄豆粕作为发酵基质,经过发酵条件优化纤溶酶产量达到1 347.4 IU/g。瓜尔豆粕能促使贝莱斯芽孢杆菌CAU263分泌大量纤溶酶,可能是由于瓜尔豆粕含有高达50%的蛋白质,还有皂苷、酚类化合物、异黄酮和必需氨基酸组成,含有丰富全面的营养物质[27],可有效促进贝莱斯芽孢杆菌CAU263的生长及代谢。因此选择瓜尔豆粕作为贝莱斯芽孢杆菌CAU263固体发酵产纤溶酶的最适发酵基质。
2.1.2 蒸煮时间对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
不同蒸煮时间对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响如图1所示。蒸煮时间为40 min时,纤溶活性最高,为192.9 FU/g,因此40 min为最适蒸煮时间。
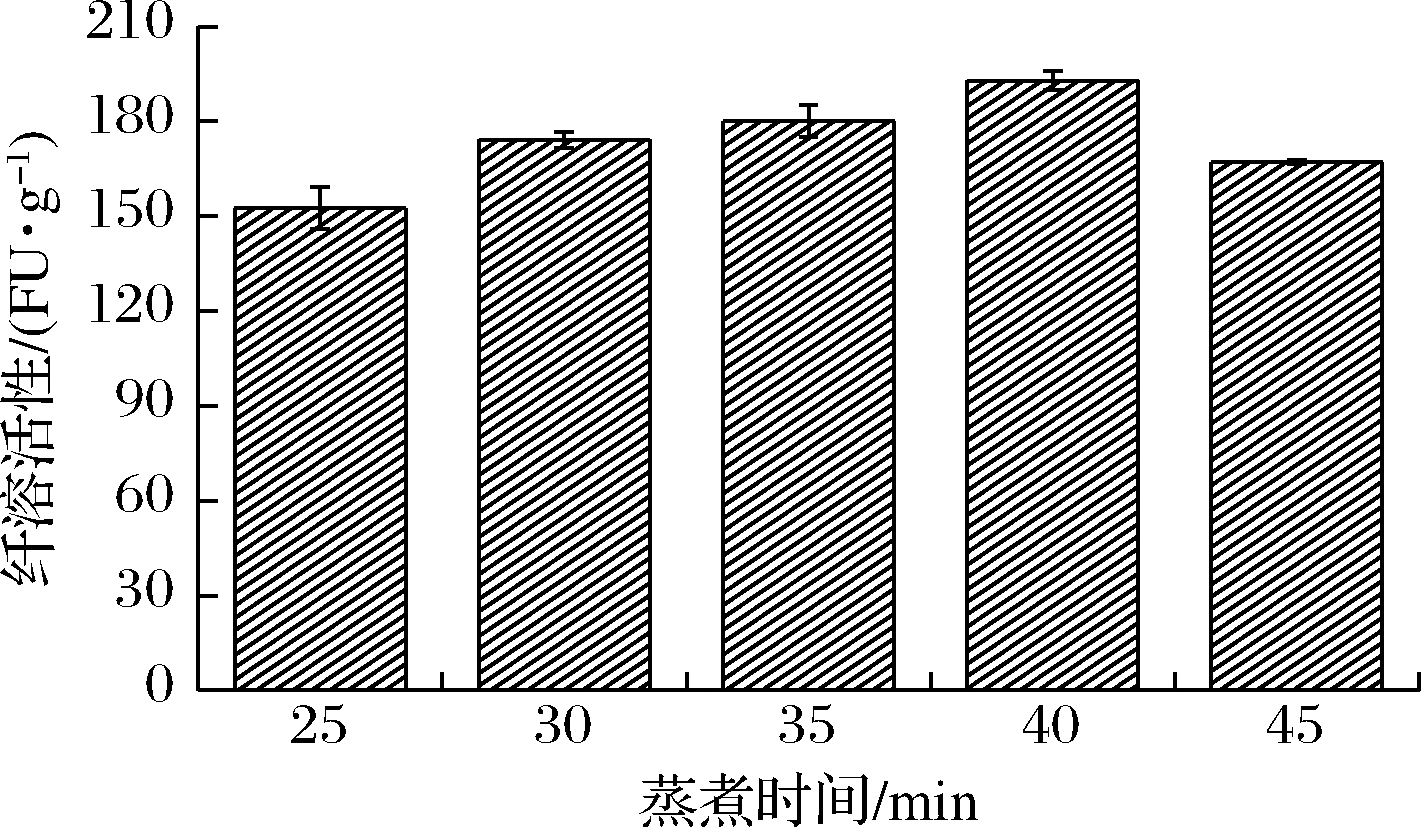
图1 不同蒸煮时间对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
Fig.1 Effects of different cooking time on fibrinolytic enzyme production through solid-state fermentation of guar meal by B.velezensis CAU263
在瓜尔豆粕发酵过程中,不同瓜尔豆粕原料蒸煮时间使得其质构的变化程度不同,从而使蛋白质的变性程度不同。蒸煮不足或过度,发酵过程中会因为蛋白质未变性或过度变性而影响微生物的生长及纤溶酶的产生。而适宜的蒸煮时间会使蛋白质适当变性从而能被微生物更充分的利用,达到促进微生物生长及产酶的目的[28]。
2.1.3 加水量对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
加水量对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响如图2所示。
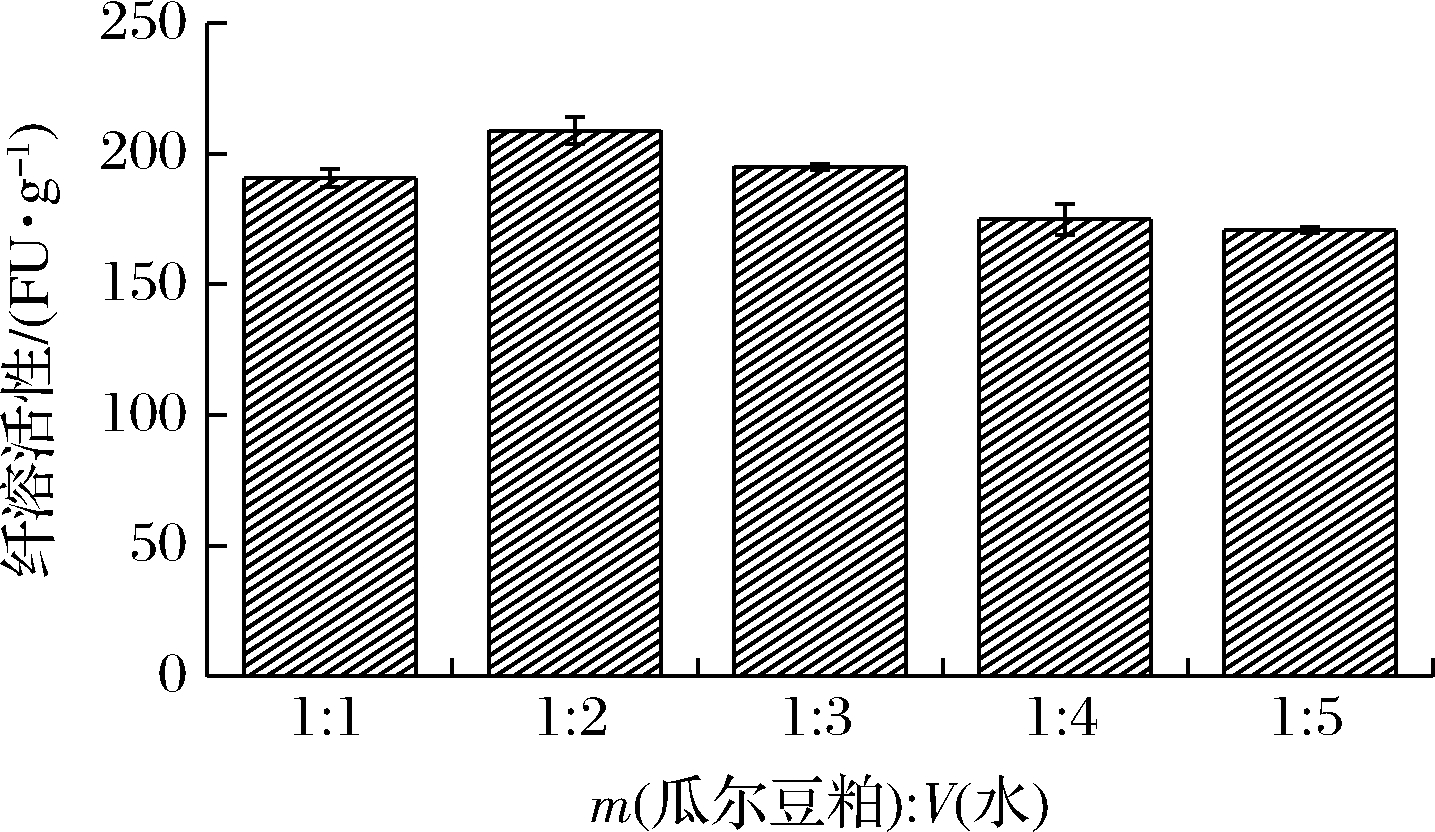
图2 不同加水量对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
Fig.2 Effects of different water addition on fibrinolytic enzyme production through solid-state fermentation of guar meal by B.velezensis CAU263
当m(瓜尔豆粕)∶V(水)=1∶2时,纤溶活性最高,达208.8 FU/g。适当的加水量会增加固体发酵基质中营养物质的溶解性,促进微生物的生长[28]。当水分过多时,将会减少固体发酵基质的孔隙率,降低氧的传递和散热[29]。而水分过低时,固体发酵基质膨胀度低,菌体生长代谢受到抑制,导致纤溶酶产量降低[30]。因此选择m(瓜尔豆粕)∶V(水)=1∶2作为最适加水量。
2.1.4 接种量对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
由图3可知,接种量为5%时发酵瓜尔豆粕的纤溶活性最高,为230.2 FU/g。当接种量过少时,菌体生长慢且利用固体发酵基质不足,从而所产的酶量较少;接种量过多时,培养基中的营养物质不能满足菌体生长需要且容易形成白色菌膜等粘稠物质,不利于微生物的生长代谢,致使产酶量下降[31]。因此选择5%为最适接种量。

图3 不同接种量对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
Fig.3 Effects of different inoculation quantity on fibrinolytic enzyme production through solid-state fermentation of guar meal by B.velezensis CAU263
2.1.5 发酵时间对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
发酵时间对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响结果如图4所示。

图4 不同发酵时间对贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕产纤溶酶的影响
Fig.4 Effects of different fermentation time on fibrinolytic enzyme production through solid-state fermentation of guar meal by B.velezensis CAU263
发酵瓜尔豆粕的纤溶活性在发酵12~48 h时持续增加,发酵48 h时达到最高,为231.6 FU/g。之后随着发酵时间的增加,发酵瓜尔豆粕的纤溶活性逐渐下降。
在发酵前期,随着发酵时间的延长,贝莱斯芽孢杆菌CAU263与瓜尔豆粕表面接触的时间延长,其吸收利用原料中营养物质产酶的时间就越长,发酵效果就越好。而发酵后期,随着发酵时间延长,过量的细菌使培养基中的营养物质不能足量供应,甚至因缺氧等原因而受损或死亡。对纤溶酶的产生造成不利影响[32]。
2.2 贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕活性成分评价
对最适产酶发酵条件下制备的发酵瓜尔豆粕活性成分(总酚、总异黄酮、还原糖和多肽)分析结果如表2所示。瓜尔豆粕原料及对照的总酚含量分别为2.4和1.9 mg GAE/g,发酵后总酚含量增加到9.4 mg GAE/g,比原料及对照分别提高了2.9和3.9倍。瓜尔豆粕原料的总异黄酮含量为11.5 mg RE/g,对照及发酵瓜尔豆粕的总黄酮含量分别为8.2和5.6 mg RE/g,比原料分别下降了28.7%和51.3%。原料、对照和发酵瓜尔豆粕的还原糖含量相近,分别为133.7、124.8和126.8 mg/g。瓜尔豆粕原料及对照的多肽含量相近,分别为22.1和22.6 mg/g,发酵瓜尔豆粕的多肽含量为189.5 mg/g,比原料及对照分别提高了7.6和7.4倍。
表2 贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕活性成分变化
Table 2 Bioactive components of guar meal solid-state fermented by B.velezensis CAU263

样品总酚/(mgGAE·g-1)总异黄酮/(mgRE·g-1)还原糖/(mg·g-1)多肽/(mg·g-1)原料2.4±0.211.5±0.9133.7±0.722.1±0.7对照1.9±0.18.2±0.4124.8±0.922.6±0.7发酵9.4±0.45.6±0.1126.8±0.0189.5±1.2
注:样品的营养成分均以干重计
XU等[33]评估了不同发酵豆制品中的活性成分。结果表明,酚类物质含量显著增加,总异黄酮类物质含量下降。在发酵过程中,微生物所产的蛋白酶会适度水解原料中的大分子蛋白质,从而产生较多的肽类物质,可能含有Tyr和Trp等具有较强抗氧化活性的氨基酸,再者发酵后产生了更多的酚类物质,这些抗氧化肽和酚类化合物可以提高发酵样品的抗氧化能力,帮助保护身体免受自由基的攻击,进一步降低许多慢性疾病的风险,如癌症和心血管疾病[34]。
2.3 贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕的功能活性
对最适产酶发酵条件下制备的发酵瓜尔豆粕功能活性(纤溶活性、抗凝血活性和DPPH自由基清除能力)分析结果如表3所示。从表3可知,瓜尔豆粕原料及对照无纤溶活性和抗凝血活性,发酵瓜尔豆粕的纤溶活性为231.3 FU/g,抗凝血活性IC50为0.28 mg/mL。瓜尔豆粕原料的DPPH自由基清除能力为22.1 μmol TE/g,对照样品的DPPH自由基清除能力为13.1 μmol TE/g,与原料相比下降了41%,可能是受高温高压灭菌处理的影响,损失了部分抗氧化活性物质。发酵后瓜尔豆粕的DPPH自由基清除能力为33.0 μmol TE/g,与原料及对照相比,分别提高了49.1%和152.7%。
表3 贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕的功能活性
Table 3 Functional activities of guar meal solid-state fermented by B.velezensis CAU263
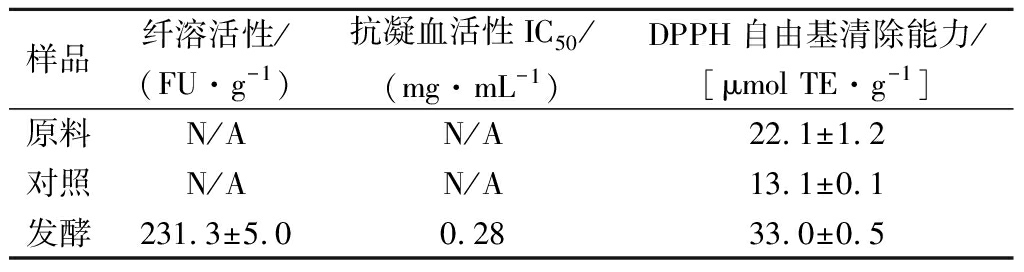
样品纤溶活性/(FU·g-1)抗凝血活性IC50/(mg·mL-1)DPPH自由基清除能力/[μmolTE·g-1]原料N/AN/A22.1±1.2对照N/AN/A13.1±0.1发酵231.3±5.00.2833.0±0.5
注:N/A表示无活性;样品的功能活性均以干重计
目前,国内外学者在提高发酵豆制品的溶栓能力方面做出了很多努力,主要包括高产纤溶酶菌株的筛选及发酵条件的优化。刘梦洁等[15]用枯草芽孢杆菌MJ-1制备了具有较高纳豆激酶活性的黄豆纳豆(90.2 FU/g),其提取物质量浓度在3 mg/mL时的抗凝血活性可达91%。LEE等[35]通过筛选菌株得到1株高产纤溶酶的枯草芽孢杆菌,优化发酵条件后使木豆纳豆的纤溶活性达到53.0 FU/g,经动物实验发现,木豆纳豆的水提物显著改善了自发性高血压大鼠的收缩压和舒张压,具有改善心血管疾病的潜力。FENG等[32]同样采用枯草芽孢杆菌发酵木豆,纤溶活性达53.0 FU/g。吴珊等[36]利用高产纤溶酶的解淀粉芽孢杆菌CAUNDJ118制备发酵豆腐,其纤溶活性达86.1 FU/g,抗凝血活性IC50为0.17 mg/mL。WEI等[14]采用解淀粉芽孢杆菌LSSE-62发酵鹰嘴豆,在最优发酵条件下纤溶活性达39.2 FU/g,且发酵鹰嘴豆的抗凝血活性和抗氧化活性较未发酵均有提升。目前已报道的产纤溶酶的发酵豆制品主要采用枯草芽孢杆菌、解淀粉芽孢杆菌作为发酵剂,纤溶活性大多在20~80 FU/g,溶栓能力高低差异较大,本研究采用贝莱斯芽孢杆菌发酵瓜尔豆粕,不仅菌种新颖,且在纤溶活性上领先于目前报道的同类产品。另外,发酵瓜尔豆粕的抗氧化能力可能来自于含量较高的总酚和多肽类物质,XU等[33]测定了27种豆豉、豆酱、纳豆等发酵豆制品的抗氧化活性发现,不同类型的发酵豆制品的DPPH自由基清除能力不同,其中黄豆酱类的DPPH自由基清除能力在1.9~20.6 μmol TE/g之间,豆豉类在2.7~23.1 μmol TE/g,纳豆类在2.6~4.5 μmol TE/g。本研究的发酵瓜尔豆粕具有较高的DPPH自由基清除能力。
3 结论
本文利用高产纤溶酶的菌株贝莱斯芽孢杆菌CAU263进行固体发酵,采用单因素试验优化得到了产纤溶酶的最适发酵条件,即固体发酵基质为瓜尔豆粕、蒸煮时间40 min、加水量[m(瓜尔豆粕)∶V(水)]=1∶2、接种量5%、发酵时间48 h。在最适发酵条件下对其活性成分、溶栓及抗氧化活性进行分析。其中,发酵瓜尔豆粕的总酚及多肽含量比瓜尔豆粕原料和未发酵瓜尔豆粕显著提高,同时,显著提高了纤溶活性、抗凝血活性及抗氧化活性。结果表明,贝莱斯芽孢杆菌CAU263固体发酵瓜尔豆粕显著提高瓜尔豆粕的营养价值和功能活性。
[1] JANNATHULLA R,DAYAL J S,AMBASANKAR K,et al.Effect of fungal fermentation on the nutrient digestibility of guar meal in Penaeus vannamei[J].Indian Journal of Fisheries,2017,64(3):67-74.
[2] HUSSAIN M,REHMAN A U,KHALID M F.Feeding value of guar meal and the application of enzymes in improving nutritive value for broilers[J].Worlds Poultry Science Journal,2012,68(2):253-268.
[3] ZHAO Y Q,SUN-WATERHOUSE D,ZHAO M M,et al.Effects of solid-state fermentation and proteolytic hydrolysis on defatted soybean meal[J].LWT,2018,97:496-502.
[4] SHAHZAD R,SHEHZAD A,BILAL S,et al.Bacillus amyloliquefaciens RWL-1 as a new potential strain for augmenting biochemical and nutritional composition of fermented soybean[J].Molecules,2020,25(10):2 346.
[5] DAI C H,MA H L,HE R H,et al.Improvement of nutritional value and bioactivity of soybean meal by solid-state fermentation with Bacillus subtilis[J].LWT,2017,86:1-7.
[6] SILVA F D O,MIRANDA T G,JUSTO T,et al.Soybean meal and fermented soybean meal as functional ingredients for the production of low-carb,high-protein,high-fiber and high isoflavones biscuits[J].LWT,2018,90:224-231.
[7] YANG J,WU X B,CHEN H L,et al.A value-added approach to improve the nutritional quality of soybean meal byproduct:Enhancing its antioxidant activity through fermentation by Bacillus amyloliquefaciens SWJS22[J].Food Chemistry,2019,272:396-403.
[8] YAO Z,KIM J A,KIM J H.Characterization of a fibrinolytic enzyme secreted by Bacillus velezensis BS2 isolated from sea squirt jeotgal[J].Journal of Microbiology and Biotechnology,2019,29(3):347-356.
[9] CAO C X,LIU Y M,LI Y,et al.Structural characterization and antioxidant potential of a novel exopolysaccharide produced by Bacillus velezensis SN-1 from spontaneously fermented Da-Jiang[J].Glycoconjugate Journal,2020,37(3):307-317.
[10] LIU Z Y,GUAN X F,ZHONG X X,et al.Bacillus velezensis DP-2 isolated from Douchi and its application in soybean meal fermentation[J].Journal of the Science of Food and Agriculture,2021,101:1 861-1 868.
[11] KOTB E.Activity assessment of microbial fibrinolytic enzymes[J].Applied Microbiology and Biotechnology,2013,97(15):6 647-6 665.
[12] 吴燕,李英波,梁向峰,等.纳豆激酶液态发酵生产的研究进展[J].食品与发酵工业,2017,43(10):256-262.
WU Y,LI Y B,LIANG X F,et al.Research progress of liquid fermentation of nattokinase[J].Food and Fermentation Industries,2017,43(10):256-262.
[13] HUY D N A,HAO P A,HUNG P V.Screening and identification of Bacillus sp.isolated from traditional Vietnamese soybean-fermented products for high fibrinolytic enzyme production[J].International Food Research Journal,2016,23(1):326-331.
[14] WEI X T,LUO M F,XU L,et al.Production of fibrinolytic enzyme from Bacillus amyloliquefaciens by fermentation of chickpeas,with the evaluation of the anticoagulant and antioxidant properties of chickpeas[J].Journal of Agricultural and Food Chemistry,2011,59(8):3 957-3 963.
[15] 刘梦洁, 陈守文,魏雪团.纳豆激酶高产菌的快速筛选及其发酵纳豆特性[J].食品科学,2016,37(21):131-135.
LIU M J,CHEN S W,WEI X T.Rapid isolation of a strain with high nattokinase activity and characterization of as-fermented natto food[J].Food Science,2016,37(21):131-135.
[16] ZHANG Q,ZHANG J Z,SHEN J K,et al.A simple 96-well microplate method for estimation of total polyphenol content in seaweeds[J].Journal of Applied Phycology,2006,18(3-5):445-450.
[17] LI J G,FAN S T,QIU Z H,et al.Total flavonoids content,antioxidant and antimicrobial activities of extracts from Mosla chinensis Maxim.cv.Jiangxiangru[J].LWT-Food Science and Technology,2015,64(2):1 022-1 027.
[18] CHURCH F C,SWAISGOOD H E,PORTER D H,et al.Spectrophotometric assay using ortho-phthaldialdehyde for determination of proteolysis in milk and isolated milk-proteins[J].Journal of Dairy Science,1983,66(6):1 219-1 227.
[19] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[20] SHUKLA S,PARK J,KIM D H,et al.Total phenolic content,antioxidant,tyrosinase and α-glucosidase inhibitory activities of water soluble extracts of noble starter culture Doenjang,a Korean fermented soybean sauce variety[J].Food Control,2016,59:854-861.
[21] ZHANG B,DENG Z Y,RAMDATH D D,et al.Phenolic profiles of 20 Canadian lentil cultivars and their contribution to antioxidant activity and inhibitory effects on α-glucosidase and pancreatic lipase[J].Food Chemistry,2015,172:862-872.
[22] SALIM A ![]() S,
S, EKULJICA N,et al.Production of enzymes by a newly isolated Bacillus sp.TMF-1 in solid state fermentation on agricultural by-products:The evaluation of substrate pretreatment methods[J].Bioresource Technology,2017,228:193-200.
EKULJICA N,et al.Production of enzymes by a newly isolated Bacillus sp.TMF-1 in solid state fermentation on agricultural by-products:The evaluation of substrate pretreatment methods[J].Bioresource Technology,2017,228:193-200.
[23] ZHU Z,ZHANG G Y,LUO Y,et al.Production of lipopeptides by Bacillus amyloliquefaciens XZ-173 in solid state fermentation using soybean flour and rice straw as the substrate[J].Bioresource Technology,2012,112:254-260.
[24] VIJAYARAGHAVAN P,ARASU M V,RAJAN R A,et al.Enhanced production of fibrinolytic enzyme by a new Xanthomonas oryzae IND3 using low-cost culture medium by response surface methodology[J].Saudi Journal of Biological Sciences,2019,26(2):217-224.
[25] PAN S H,CHEN G G,ZENG J J,et al.Fibrinolytic enzyme production from low-cost substrates by marine Bacillus subtilis:Process optimization and kinetic modeling[J].Biochemical Engineering Journal,2019,141:268-277.
[26] BI H,ZHAO H Z,LU F X,et al.Improvement of the nutritional quality and fibrinolytic enzyme activity of soybean meal by fermentation of Bacillus subtilis[J].Journal of Food Processing and Preservation,2015,39(6):1 235-1 242.
[27] NIDHINA N,MUTHUKUMAR S P.Antinutritional factors and functionality of protein-rich fractions of industrial guar meal as affected by heat processing[J].Food Chemistry,2015,173:920-926.
[28] WANG Y,LIU X T,WANG H L,et al.Optimization of processing conditions for solid-state fermented soybean meal and its effects on growth performance and nutrient digestibility of weanling pigs[J].Livestock Science,2014,170:91-99.
[29] GERVAIS P,MOLIN P.The role of water in solid-state fermentation[J].Biochemical Engineering Journal,2003,13(2-3):85-101.
[30] 邢瀚文, 韩玮,施文正,等.固态发酵法制备罗非鱼皮胶原蛋白肽及其抗氧化活性研究[J].食品与发酵工业,2020,46(19):104-110.
XING H W,HAN W,SHI W Z,et al.Tilapia skin collagen peptides prepared by solid-state fermentation and its antioxidant activity[J].Food and Fermentation Industries,2020,46(19):104-110.
[31] 张杰, 杨希娟,党斌,等.蚕豆纳豆发酵工艺优化及其酶学性质[J].食品工业科技,2019,40(6):205-210.
ZHANG J,YANG X J,DANG B,et al.Optimization of fermentation process of natto by broad bean and its enzymatic properties[J].Science and Technology of Food Industry,2019,40(6):205-210.
[32] FENG C,JIN S,LUO M,et al.Optimization of production parameters for preparation of natto-pigeon pea with immobilized Bacillus natto and sensory evaluations of the product[J].Innovative Food Science & Emerging Technologies,2015,31:160-169.
[33] XU L,DU B,XU B J.A systematic,comparative study on the beneficial health components and antioxidant activities of commercially fermented soy products marketed in China[J].Food Chemistry,2015,174:202-213.
[34] 赵谋明, 邹颖,林恋竹,等.纳豆菌液态发酵荞麦产纳豆激酶及其代谢特性分析[J].食品科学,2019,40(4):178-185.
ZHAO M M,ZOU Y,LIN L Z,et al.Nattokinase production and metabolic characteristics during submerged fermentation of buckwheat using Bacillus subtilis natto[J].Food Science,2019,40(4):178-185.
[35] LEE B H,LAI Y S,WU S C.Antioxidation,angiotensin converting enzyme inhibition activity,nattokinase,and antihypertension of Bacillus subtilis(natto)-fermented pigeon pea[J].Journal of Food and Drug Analysis,2015,23(4):750-757.
[36] 吴珊, 闫巧娟,骆珅,等.解淀粉芽孢杆菌发酵豆腐工艺条件优化及营养功能研究[J].中国粮油学报,2020,35(2):134-140.
WU S,YAN Q J,LUO S,et al.Optimization of fermentation conditions for Bacillus amyloliquefaciens fermented tofu production and research on nutritional and functional properties[J].Journal of the Chinese Cereals and Oils Association,2020,35(2):134-140.