蛋白酶广泛应用于食品、养殖等行业,而微生物作为工业酶制剂的主要来源具有生长空间小、速度快、可控性强等诸多优势。研究人员分离出多种高产蛋白酶的微生物资源[1-3]。常用筛选方法包括蛋白酶产生水解圈和蛋白酶活性测定。曹慧等[1]从青藏高原土壤样品中获得枯草芽胞杆菌XC2;陈茏等[4]从南昌大学食堂污水中筛选的解淀粉芽孢杆菌CL-10均具有较高的产蛋白酶活力。由于微生物资源丰富且菌株之间存在特异性,更加广泛地筛选高产蛋白酶菌株并开展其应用研究仍是微生物领域重要的研究方向。
近年来有关螺旋藻发酵的研究多有报道,如乳酸菌和枯草芽胞杆菌混菌发酵螺旋藻可提高多肽和必需游离氨基酸含量分别达16%~19%和6%~19%[5],藏灵菇发酵的螺旋藻酸奶风味成分显著增加,且醇类物质增加,酸类物质减少[6]。螺旋藻发酵产物还具有多种生物活性,乳酸菌单菌发酵螺旋藻得到的发酵产物抗氧化活性有所提高,但因菌株而异[7],混菌发酵螺旋藻提取物对小鼠原发性脾淋巴细胞具有增殖和免疫调节潜力[8],枯草芽胞杆菌单菌发酵螺旋藻渣所得抗菌肽SP-AP-1和Iturin A对金黄色葡萄球菌具有较强的抑制效果[9]。前人开展了大量有关螺旋藻肽的制备研究,以酶解为主[10-13]。与利用纯酶制剂相比,采用发酵法可因微生物的广谱蛋白酶系产生更多的活性多肽,还能够降低生产成本。
筛选更适用于螺旋藻蛋白的高产蛋白酶菌株是制备优质螺旋藻肽的关键。通过从不同发酵时期的螺旋藻泥自然发酵液中分离筛选高产蛋白酶菌,并利用筛选菌株发酵螺旋藻监测发酵过程中菌量和酶活变化,对发酵产物中多肽等生物活性成分进行分析,对其抗氧化活性和血管紧张素I转移酶(angiotensin I converting enzyme,ACE)抑制酶活进行测定,以期为采用微生物发酵制备螺旋藻活性肽提供参考和借鉴。
1 材料与方法
1.1 实验材料
1.1.1 实验藻株及菌种
螺旋藻藻种(Spirulina platensis GY-D18),上海光语生物科技有限公司;解淀粉芽孢杆菌(Bacillus amyloliquefaciens LXZ1)、芽孢杆菌(Bacillus sp.LXZ2)、短小芽胞杆菌(B.pumilus LXZ3)为本次分离高产蛋白酶菌株。
1.1.2 主要试剂
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、马尿酰组氨酰亮氨酸(hippuryl-L-histidyl-L-leucine,HHL)、血管紧张素转换酶(angiotensin-converting enzyme,ACE),Sigma-Aldrich;2,4,6-三吡啶基三嗪、2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、抗坏血酸(Vc),上海阿拉丁生化科技股份有限公司;琼脂粉、邻苯二甲醛,北京索莱宝科技有限公司;蛋白胨、牛肉膏、酵母提取物,北京奥博星生物技术有限公司;NaCl、NaNO3、MgSO4·7H2O、K2SO4、K2S2O4、CaCl2、FeCl3·6H2O、H3BO3、MnCl2·2H2O、Na2MoO4、NaHCO3、葡萄糖等,国药集团化学试剂有限公司,均为分析纯。
1.1.3 主要仪器与设备
JA5003型电子天平,上海舜宇恒平科学仪器有限公司;LDZX-75KB型立式压力蒸汽灭菌器,上海申安医疗器械厂;YT-CJ-2D/B型超净台,北京亚泰科隆仪器技术有限公司;HZQ-X100型微生物培养箱,中国哈尔滨市东明医疗仪器厂;SB25-12 DTD型超声清洗仪,宁波新芝生物技术有限公司;FYY(40~120)01/02型纯水仪,青岛富勒姆科技有限公司;ZX-LGJ-18压盖型真空冷冻干燥机,上海知信实验仪器技术有限公司;756PC型紫外分光光度计,上海舜宇恒平科学仪器有限公司。
1.2 试验方法
1.2.1 培养基配制
ZK培养基:参考文献[7]配制;LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,定容至1 000 mL,115 ℃灭菌20 min。蛋白酶筛选培养基:干酪素8.0 g,Na2HPO4 2.0 g,MgSO4·7H2O 0.5 g,NaCl 5.0 g,牛肉膏3 g,定容至1 000 mL,pH 7.4。固体培养基每升加入20 g 琼脂粉。螺旋藻发酵培养基:葡萄糖20 g,螺旋藻干粉10 g,蒸馏水定容至 1 000 mL,115 ℃灭菌20 min。
1.2.2 菌种分离筛选与鉴定
螺旋藻培养至OD660>2时,离心收获藻泥(呈墨绿色,其中干物质占藻泥质量分数的15.8%,蛋白质占干物质的66.2%),将新鲜藻泥放入发酵桶中并添加质量分数为10%的葡萄糖,置于实验室自然发酵,在发酵的不同阶段(6个月,12个月)取样进行菌种的分离筛选,将自然发酵液在超净工作台中梯度稀释,取100 μL涂布于LB平板。于37 ℃恒温培养24 h后挑取单一菌落,划线法纯化培养3代。采用福林法测定蛋白酶活力(GB/T 23527—2009《蛋白酶制剂》附录B),筛选酶活力较高的菌株进行后续试验。
采用革兰氏染色和过氧化氢酶试验对菌株进行初步判断,后用细菌通用引物(A27F:5′-AGCGGATCACTTCACACAGGACTACGGCTACCTTGT-TACGA-3′,A1495R:3′-GCAGAGTTCTCGGAGTCACGAAGAG-TTTGATCCTGGCTCAG-5′)进行16S rRNA验证。检测和比对工作委托北京擎科新业生物技术有限公司完成。
1.2.3 高产蛋白酶菌株的培养及生长曲线绘制
采用LB固体平板划线法将纯化后的解淀粉芽孢杆菌、芽孢杆菌和短小芽胞杆菌进行同步化处理,划线后置37 ℃培养24 h。分别挑取单菌落至200 mL液体培养基中,每隔8 h取样测定其600 nm下的吸光度值,并绘制生长曲线。
1.2.4 螺旋藻发酵处理
高产蛋白酶菌株种子液制备:取筛选菌种固体板上的单菌落分别接入LB液体培养基,置37 ℃培养箱中培养,24 h后进行浓缩,以107 CFU/mL的接种密度分别接入螺旋藻培养基中,其中混菌发酵按照1∶1∶1比例。发酵72 h后,5 000 r/min离心5 min得到发酵上清液,留取一部分上清液用于测定多肽、总黄酮和总酚含量,另一部分上清液调整pH至8.3后冻干备用,用于活性指标测定。
1.2.5 菌种计数
分别在0、24、48、72 h取样,梯度稀释后取适合的稀释倍数样品溶液进行平板涂布,置于37 ℃培养箱中培养,24 h后计数菌落数量,以每毫升发酵液中的菌落统计(lg CFU/mL)。
1.2.6 发酵产物的活性成分分析
多肽采用邻苯二甲醛法[14],分别取50 μL发酵液样品,加入2 mL反应试剂(含50 mmol/L 硼砂,1% 十二烷基硫酸钠,0.8 mg/mL邻苯二甲醛和200 μL β巯基乙醇),混合均匀后室温静置2 min。以蒸馏水代替样品作为空白,在340 nm处测定吸光度值。以胰蛋白胨作为标准品做标准曲线,样品中多肽含量以mg(tryptone equivalent,TE)/mL表示。
总黄酮采用亚硝酸钠-硝酸铝比色法[15],略有改动。分别取3 mL发酵液样品,加入1 mL 0.5 g/L的亚硝酸钠,充分混匀后静置5 min,加入1 mL 1g/L的三氯化铝,混匀后25 ℃水浴6 min,加入10 mL 1.0 mol/L氢氧化钠溶液,最后补足30%乙醇至25 mL,充分混匀放置15 min。于510 nm测定吸光度值,以芦丁为标准品做标准曲线,样品中总黄酮含量以mg(rutin equivalent,RE)/mL 表示。
总酚采用Folin-Ciocalteu法[16],略有改动。分别取0.1 mL发酵液样品,加入0.9 mL蒸馏水和2 mL Folin-Ciocalteu 试剂(稀释10倍,现用现配),混匀后反应5 min。加入2.0 mL 0.75 g/L碳酸钠溶液,黑暗条件下25 ℃水浴反应30 min。于765 nm 测定吸光度值,以没食子酸为标准品做标准曲线,样品中总多酚含量以mg(galic acid equivalent,GAE)/mL 表示。
1.2.7 发酵产物的抗氧化活性分析
将冻干后的产物配制成0.5 mg/mL的样品溶液,进行DPPH自由基清除能力[15]、ABTS阳离子自由基清除活性[16]、铁离子还原力(FRPA)[17]和总抗氧化活性[15]等抗氧化指标的测定,均以0.1 mg/mL抗坏血酸作为阳性对照。
1.2.8 发酵产物的ACE抑制活性分析
将冻干后的产物配制成0.5 mg/mL的样品溶液,进行ACE抑制活性测定[18],方法略有改动。取50 μL样品溶液与100 μL 5.0 mmol/L HHL溶液混合,37 ℃水浴3 min,加入50 μL 10 μmol/L ACE溶液,置37 ℃水浴锅中水浴30 min,加入200 μL 1.0 mol/L HCl溶液终止反应。加入1.5 mL乙酸乙酯,充分振荡后于3 000 r/min离心10 min,取1.2 mL上清液,于80 ℃烘干。加入2.5 mL蒸馏水后,在228 nm处测定吸光度值,根据公式(1)计算ACE抑制率:
ACE抑制率![]()
(1)
式中:Aa,反应中未加入样品液,反应结束后添加样品液以维持整个反应体系平衡,是ACE和HHL完全反应的参照的测定值;Ab,反应中加入样品液与ACE、HHL共同反应的测定值;Ac,样品在反应前先使ACE失活,再加入样品液,是ACE与HHL反应的空白对照的测定值。
1.2.9 数据分析
各处理均进行3次重复,数据均为平均值±标准差。采用SPSS 16.0对所得数据进行one-way ANOVA统计分析。采用DUCAN多重分析比较方法进行显著性分析(P<0.05)。采用SPSS 16.0多元线性回归进行活性成分与抗氧化指标的相关性分析,根据Pearson’s相关分析结果判断其显著水平。
2 结果与分析
2.1 分离菌株的鉴定及特性分析
微生物是蛋白酶的重要来源,由于微生物无处不在,前人从各种环境及不同的原料中开展高产蛋白酶菌株的分离筛选工作[1-2,4]。本研究从螺旋藻自然发酵培养基中分离筛选高产蛋白酶的菌株,通过酶活力测定选取初测蛋白酶活性较高的3株菌(蛋白酶活力分别为101.3、120.4、176.5 U/mL)作为后续实验菌种。首先对3株菌的形态进行鉴定[19]:LXZ1、LXZ2和LXZ3均为白色不透明菌落,湿润,无光泽,其中LXZ1、LXZ2菌落呈圆形微凸,边缘绒毛状,LXZ3菌落呈圆形较平,边缘较规则。3株菌均为革兰氏阳性菌,过氧化氢酶阳性,其中LXZ1菌体为长杆状,多个连接呈链状(图1-a),LXZ2和LXZ3菌体为短杆状,单个或成对(图1-b、1-c)。通过16S rRNA扩增并在NCBI中进行Blast序列比对,其中LXZ1(登录号MN759438)与B.amyloliquefaciens strain HS10(登录号GU323370)的相似度为99%,将其命名为B.amyloliquefaciens LXZ1;LXZ2(登录号MN759437)与Bacillus sp.B1(2014b)(登录号KF922381)的相似度为100%,将其命名为Bacillus sp.LXZ2;LXZ3(登录号MNMW180955)与B.pumilus JH4(登录号DQ232734)的相似度为100%,将其命名为B.pumilus LXZ3。
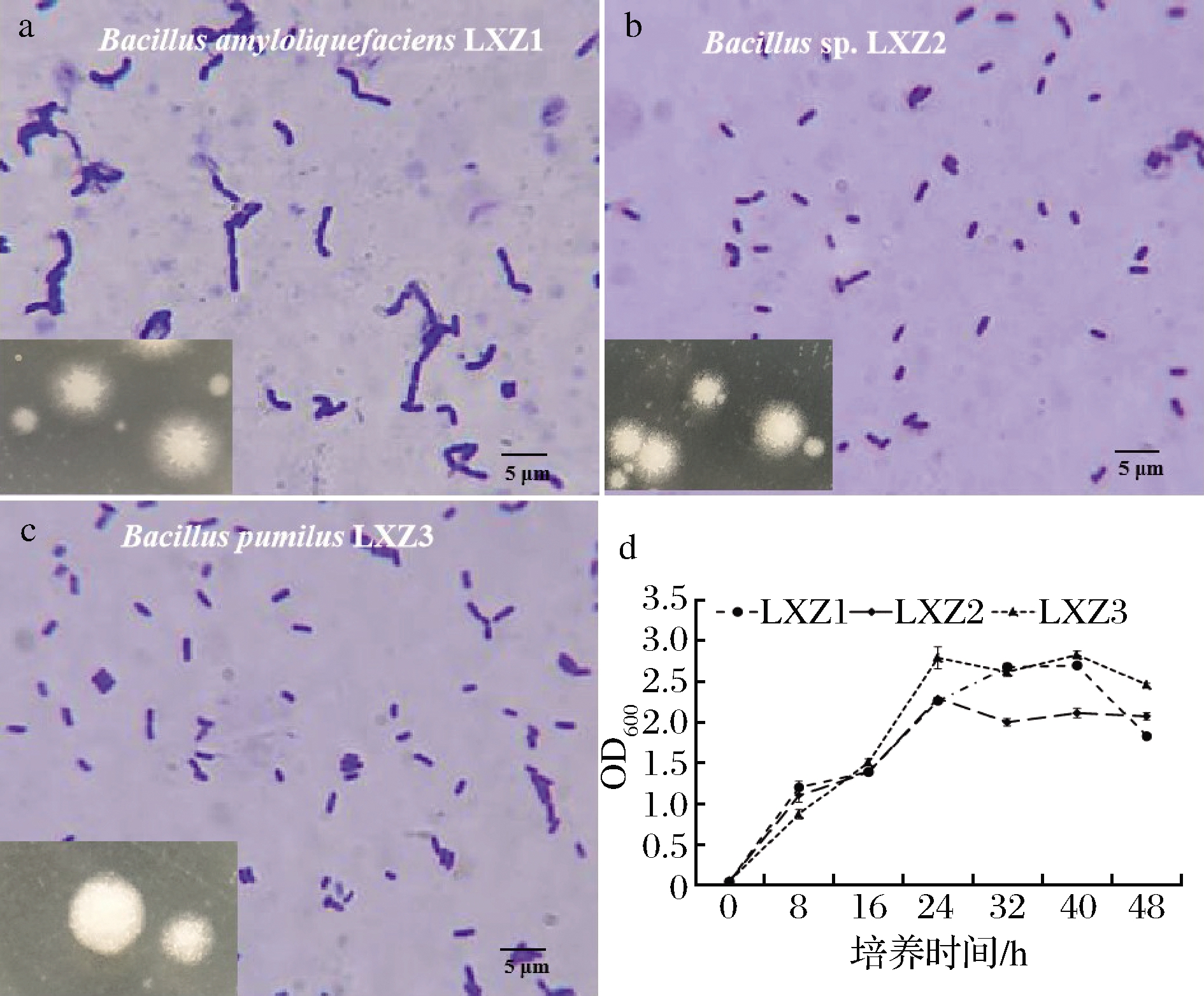
图1 筛选菌种形态特征及生长曲线
Fig.1 Morphological characteristics and growth curve of the selected strains
从生长曲线来看(图1-d),3株菌均在24 h后进入平台期,其中以LXZ3的生物量最大,且在48 h内均能维持较高水平,OD600的吸光度值在2.5~2.8,LXZ2在平台期处于相对较低的状态,OD600的吸光度值在2.0~2.1,LXZ1则处于而者之间,且波动幅度较大。
2.2 螺旋藻发酵过程参数变化
以上述3株菌进行螺旋藻的发酵,对其发酵过程中的菌量和蛋白酶力活进行测定(图2),发现LXZ1和LXZ2在24 h时的菌量显著高于LXZ3(P<0.05),而LXZ3的菌量在48 h居上且持续处于较高的水平,48 h前后3株菌的菌量基本维持在平台期,且前人筛选高产蛋白酶细菌多在24~72 h区间测定酶活力或达到产酶高峰[1-2,4],因此将这3株菌的培养周期设定为72 h。从蛋白酶活力来看,3株菌的蛋白酶活性在24 h内基本相当,48 h后LXZ3的酶活力显著增加。与前人的结果不同的是,至72 h时3株菌的酶活力一直处于上升趋势,说明菌株在平台期仍保持较好持续产酶能力,因此后续还需进一步优化其最佳产酶条件。相对于单菌,混菌的菌量与蛋白酶活均维持在较高的水平,在72 h时菌量和蛋白酶活力均显著高于各单菌(P<0.05)。
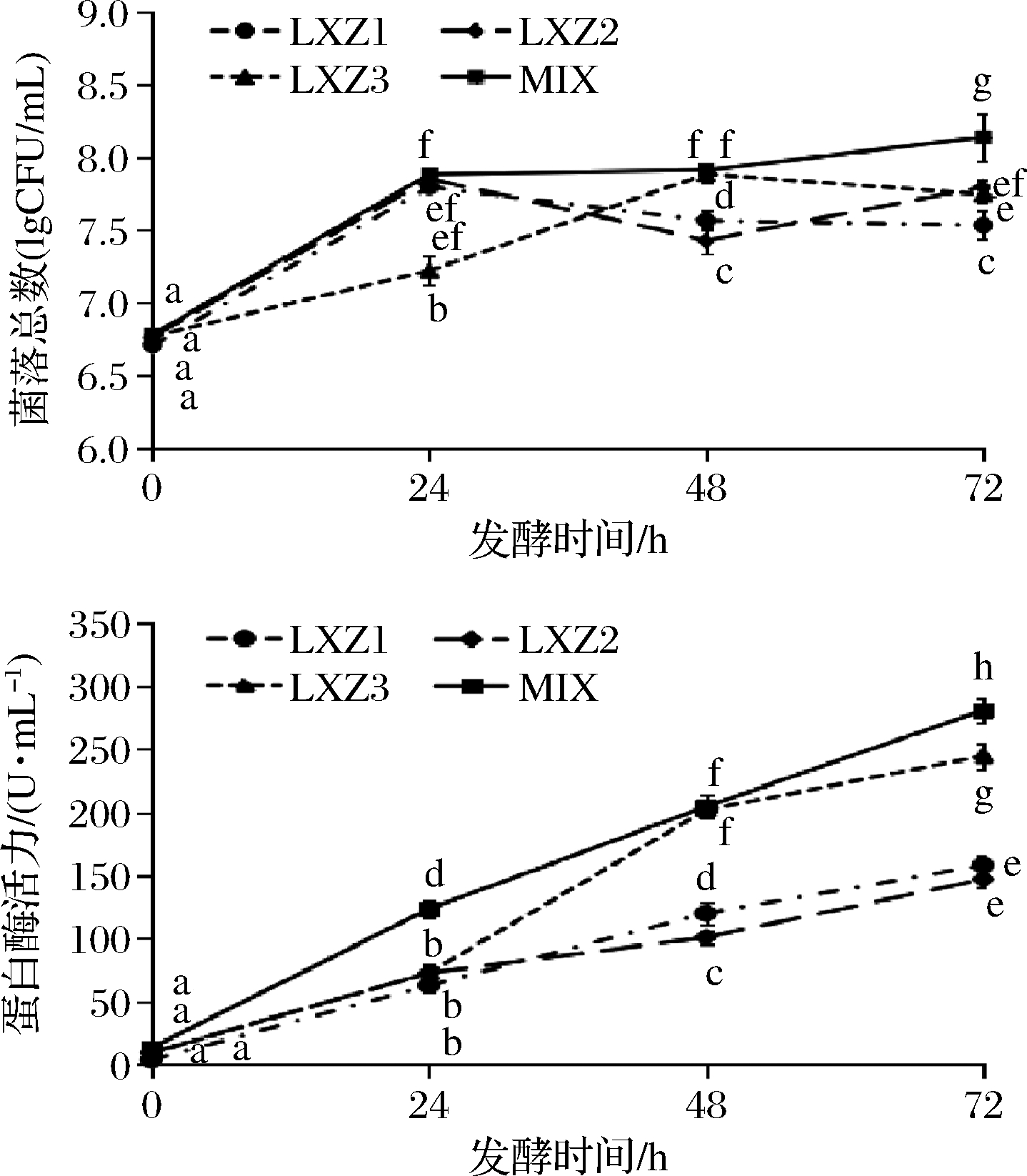
图2 螺旋藻发酵过程中菌量与酶活力的变化
Fig.2 Changes of bacteria amount and enzyme activity during Spirulina fermentation
2.3 发酵产物的活性成分含量
本文采用微生物发酵螺旋藻的目标产物为多肽,而黄酮和多酚也具有较好的抗氧化能力,故对发酵产物中多肽、总黄酮和总酚的含量均进行了测定,由表1可看出,发酵后上清液中的多肽、总黄酮和总酚含量均显著高于未发酵(P<0.05)。就多肽而言,单菌发酵以LXZ3发酵液中的含量最高,比对照提高了209.6%,而混菌发酵显著优于单菌(P<0.05),表现出更好的效果,比对照提高了305.2%;就总黄酮而言,单菌发酵LXZ1和LXZ3的效果与混菌发酵相当,而LXZ2的效果略差,但仍是对照的2.25~2.73倍;就总酚而言,LXZ2的效果优于LXZ1和LXZ3(P<0.05),增幅为138.3%,而以混菌发酵最佳,增幅达164.2%。发酵后总黄酮和总酚增幅较大,然而多肽含量总体较高,为总黄酮的300~500倍,总酚的8~14倍。
表1 不同发酵处理螺旋藻发酵产物中活性成分的含量
Table 1 The content of bioactive ingredients in the fermented products of Spirulina
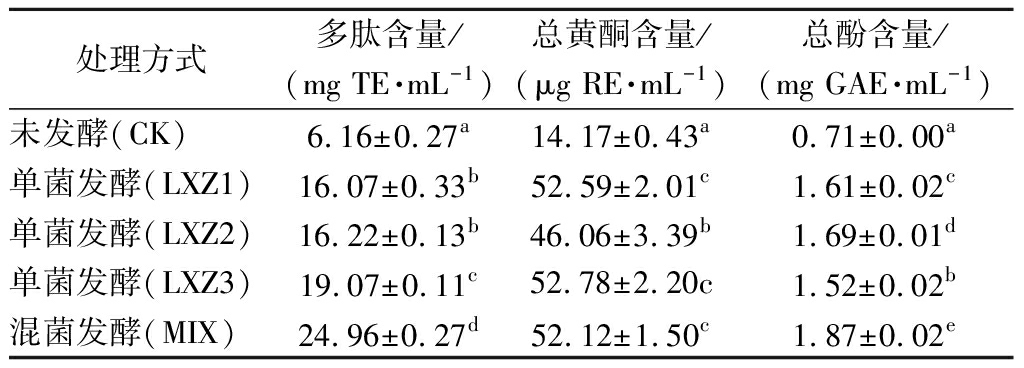
处理方式多肽含量/(mgTE·mL-1)总黄酮含量/(μgRE·mL-1)总酚含量/(mgGAE·mL-1)未发酵(CK)6.16±0.27a14.17±0.43a0.71±0.00a单菌发酵(LXZ1)16.07±0.33b52.59±2.01c1.61±0.02c单菌发酵(LXZ2)16.22±0.13b46.06±3.39b1.69±0.01d单菌发酵(LXZ3)19.07±0.11c52.78±2.20c1.52±0.02b混菌发酵(MIX)24.96±0.27d52.12±1.50c1.87±0.02e
2.4 发酵产物的抗氧化活性分析
ANGELA等[20]通过同时糖化和发酵获得的螺旋藻生物活性肽具有较高的ABTS阳离子清除能力;YU等[21]研究表明,枯草芽孢发酵螺旋藻产物的DPPH自由基清除能力、FRAP值均显著提高。本研究与前人结果一致,螺旋藻发酵产物相比未发酵处理,其DPPH自由基清除能力、ABTS阳离子自由基清除能力、铁离子还原力和总抗氧化能力均显著提高(P<0.05)(图3)。不同单菌发酵产物的抗氧化活性也有显著差异(P<0.05),其中LXZ3发酵产物的DPPH和ABTS阳离子自由基清除能力最强,分别是对照的5.3和2.8倍;LXZ 2发酵产物的FRAP值最高,是对照的3.1倍;LXZ1发酵产物的总抗氧化能力最高,是对照的4.8倍。混菌发酵产物的DPPH和ABTS阳离子自由基清除能力、FRAP值均显著优于单菌(P<0.05)。
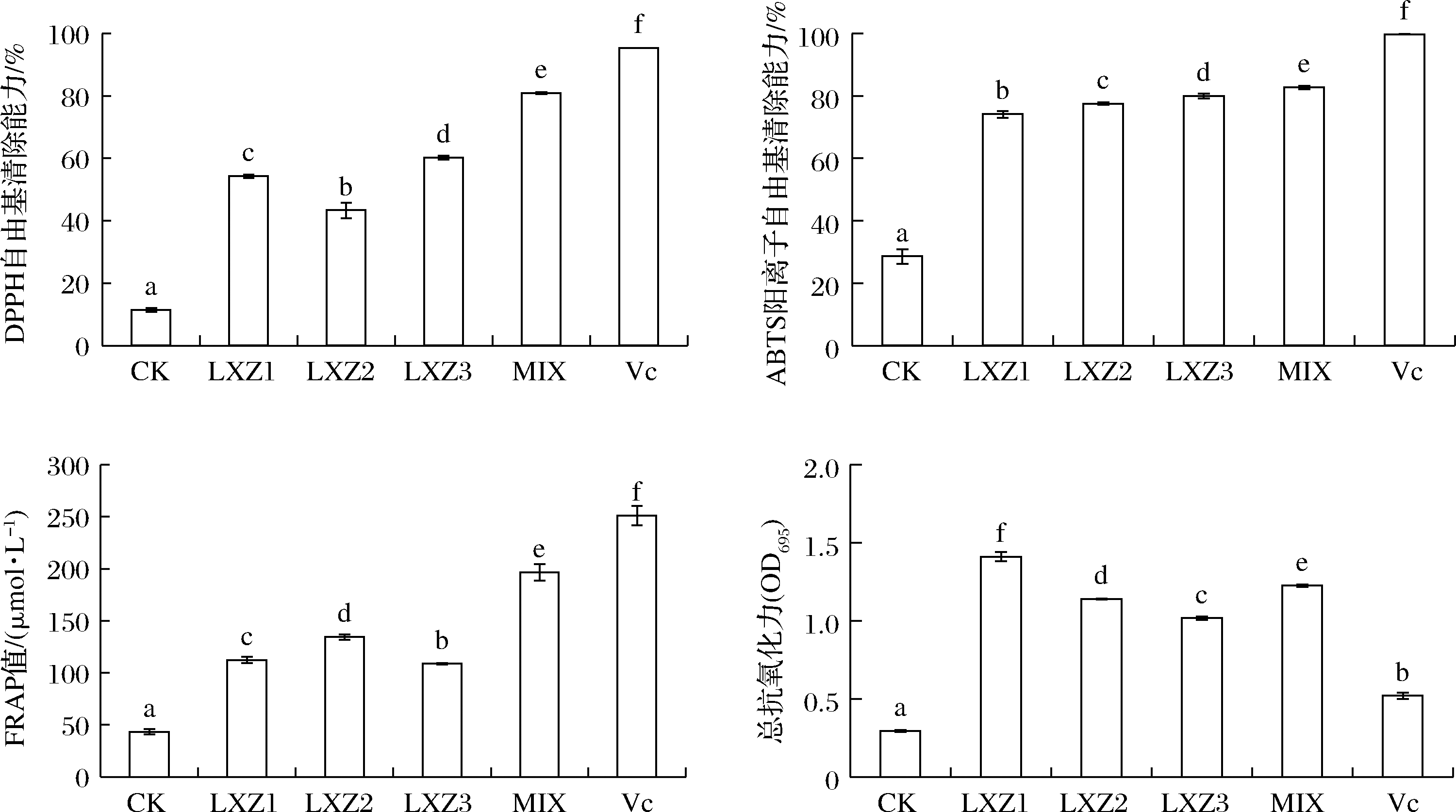
图3 不同发酵处理螺旋藻发酵产物的抗氧化活性
Fig.3 Antioxidant activity of the fermented products of Spirulina
通过相关分析可知(表2),各抗氧化指标的水平与多酚、总黄酮和总酚均有较强的正相关性,说明发酵产物的抗氧化活性是3种活性成分共同作用的结果,本研究筛选的高产蛋白酶菌不仅可提高螺旋藻发酵产物的多肽含量,还能增加黄酮和多酚等其他活性成分的含量,进一步增强发酵产物的抗氧化功效。
表2 螺旋藻发酵产物活性成分与抗氧化指标的相关性分析
Table 2 Correlation coefficients of bioactive ingredients and antioxidant index of the fermented products of Spirulina
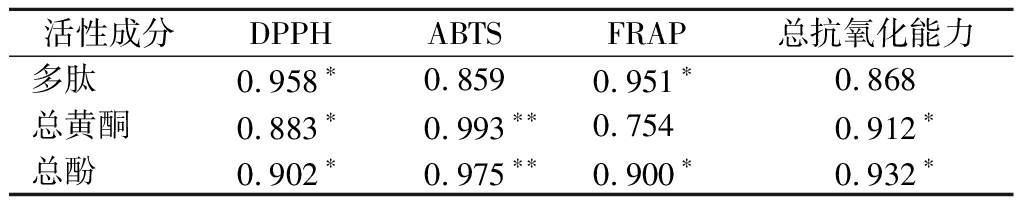
活性成分DPPHABTSFRAP总抗氧化能力多肽0.958*0.8590.951*0.868总黄酮0.883*0.993**0.7540.912*总酚0.902*0.975**0.900*0.932*
注:*表示显著水平P<0.05;**表示显著水平P<0.01
2.5 发酵产物的ACE抑制酶活力分析
ACE是高血压的重要靶点,其活性抑制后可阻止血管紧张素Ⅱ的合成,进而缓解血压升高[22],因此,通过ACE抑制酶活测定可筛选具有降血压功效的成分。对发酵产物进行了ACE抑制酶活力测定,结果表明各发酵处理的ACE抑制酶活力均显著提高(P<0.05),其中LXZ1处理提高了25.5%,LXZ2处理提高了30%,LXZ3发酵处理提高了31%,混菌发酵则提高了39.0%,从而说明螺旋藻发酵产物具有潜在的降血压作用。
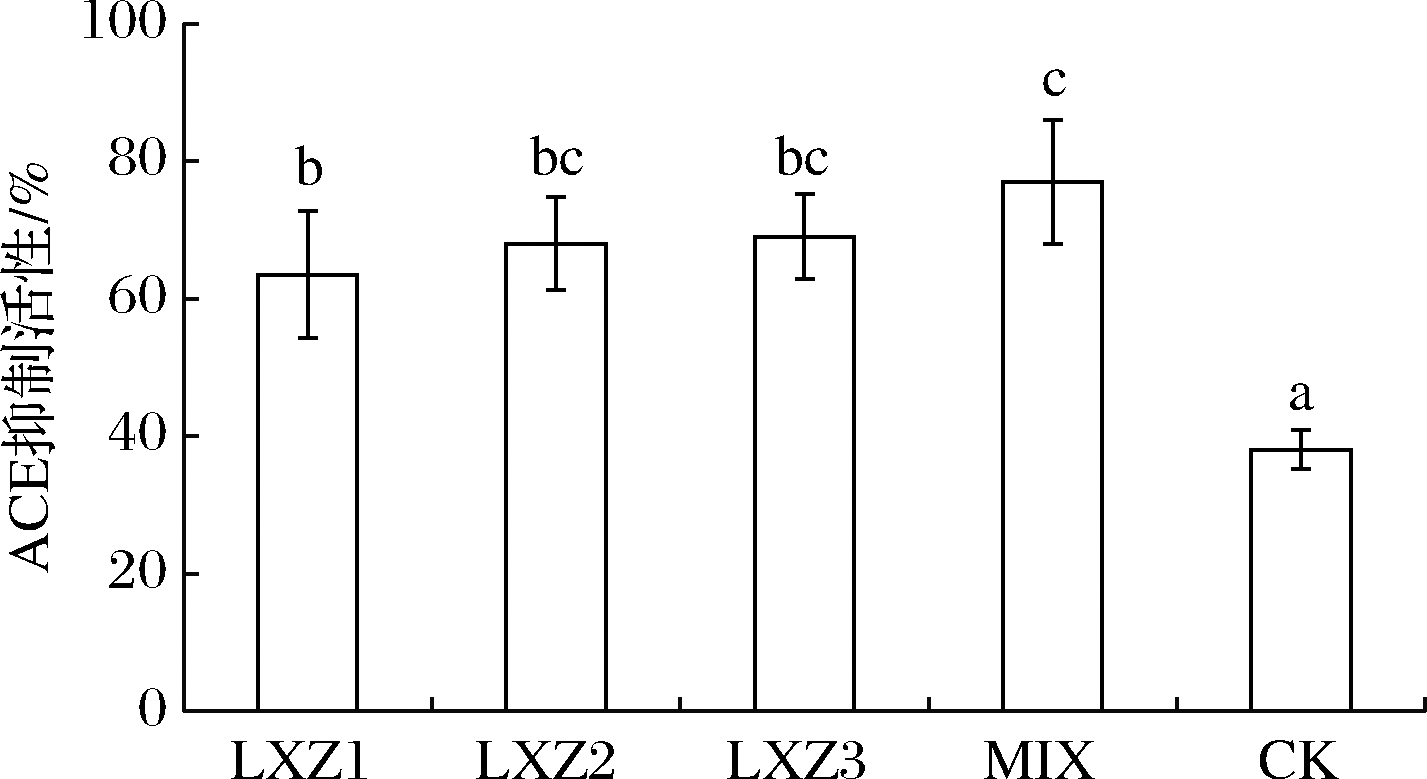
图4 螺旋藻发酵产物的ACE抑制活性
Fig.4 ACE inhibitory activity of the fermented products of Spirulina
3 结论
本研究从螺旋藻自然发酵液中筛选出3株高产蛋白酶的菌株,分别为B.amyloliquefaciens LXZ1、Bacillus sp.LXZ2和B.pumilus LXZ3,其中B.pumilus LXZ3产酶最高,但是最佳产酶条件仍需进一步优化。以单菌或混菌发酵螺旋藻,发酵产物中多肽、总黄酮和总酚含量显著高于未发酵,抗氧化活性和ACE抑制活性也显著提高,且混菌发酵的效果优于单菌发酵,可能是由于多菌之间的协同作用所致,然而关于菌间互作机制还需深入研究。
[1] 曹慧,张腾月,赵龙妹,等.土壤中高产蛋白酶菌株产酶条件及酶学性质[J].微生物学通报,2020,47(7):2 072-2 081.
CAO H,ZHANG T Y,ZHAO L M,et al.Identification and characterization of a high protease-producing strain from soil[J].Microbiology China,2020,47(7):2 072-2 081.
[2] 耿芳,杨绍青,闫巧娟,等.土壤中高产蛋白酶菌株的筛选鉴定及发酵条件优化[J].中国酿造,2018,37(4):66-71.
GENG F,YANG S Q,YAN Q J,et al.Screening,identification and fermentation conditions optimization of a high yield protease strain from soil[J].China Brewing,2018,37(4):66-71.
[3] 邓维琴,陈功,张其圣,等.传统郫县豆瓣酱中高产蛋白酶曲霉的筛选及应用[J].微生物学通报,2019,46(9):2 272-2 281.
DENG W Q,CHEN G,ZHANG Q S,et al.Screening and application of high yield protease fungus from traditional fermented Pixian broad bean paste[J].Microbiology China,2019,46(9):2 272-2 281.
[4] 陈茏,杨俊,马毛毛,等.产蛋白酶菌株的筛选及以菜籽粕为氮源的产酶条件优化[J].食品科学,2021,42(4):115-121.
CHEN L,YANG J,MA M M,et al.Screening of the protease-producing strain and optimization of enzyme-producing conditions using rapeseed meal as a nitrogen source[J].Food Science,2021,42(4):115-121.
[5] BAO J,ZHANG X,ZHENG J H,et al.Mixed fermentation of Spirulina platensis with Lactobacillus plantarum and Bacillus subtilis by random-centroid optimization[J].Food Chemistry,2018,264:64-72.
[6] 颜志秀,陆思宇,孟丽娜,等.藏灵菇发酵螺旋藻酸乳工艺条件优化及其挥发性风味物质[J].食品工业科技,2019,40(9):189-197;201.
YAN Z X,LU S Y,MENG L N,et al.Optimization of process conditions and volatile flavor compounds of Spirulina yoghourt fermented by Tibetan mushroom[J].Science and Technology of Food Industry,2019,40(9):189-197;201.
[7] 于金慧,马德源,刘云鹏,等.乳酸菌发酵对螺旋藻主要功效成分影响的初步研究[J].食品工业科技,2019,40(18):85-90;96.
YU J H,MA D Y,LIU Y P,et al.Preliminary study on effect of Lactobacillus fermentation on the main functional components of Spirulina[J].Science and Technology of Food Industry,2019,40(18):85-90;96.
[8] AN J,FENG Y X,ZHENG J H,et al.The immune-enhancing potential of peptide fractions from fermented Spirulina platensis by mixed probiotics[J].Journal of Food Biochemistry,2020,44(7):13 245.
[9] 付云,赵谋明,卢美杉,等.枯草芽孢杆菌YA215发酵螺旋藻渣产抑菌活性的工艺[J].食品与发酵工业,2020,46(4):146-152.
FU Y,ZHAO M M,LU M S,et al.Optimization of the production of antimicrobial using Spirulina residue by Bacillus subtilis YA215 fermentation[J].Food and Fermentation Industries,2020,46(4):146-152.
[10] ZENG Q H,WANG J J,ZHANG Y H,et al.Recovery and identification bioactive peptides from protein isolate of Spirulina platensis and their in vitro effectiveness against oxidative stress-induced erythrocyte hemolysis[J].Journal of the Science of Food and Agriculture,2020,100(9):3 776-3 782.
[11] VO T S,RYU B,KIM S K.Purification of novel anti-inflammatory peptides from enzymatic hydrolysate of the edible microalgal Spirulina maxima[J].Journal of Functional Foods,2013,5(3):1 336-1 346.
[12] 潘进权,周鲜娇,蒋边,等.复合蛋白酶水解螺旋藻制备多肽的工艺优化[J].中国粮油学报,2019,34(11):87-94.
PAN J Q,ZHOU X J,JIANG B,et al.Optimization on the preparation process of polypeptides from hydrolysis of Spirulina by compound protease[J].Journal of the Chinese Cereals and Oils Association,2019,34(11):87-94.
[13] WANG Z J,ZHANG X W.Isolation and identification of anti-proliferative peptides from Spirulina platensis using three-step hydrolysis[J].Journal of the Science of Food and Agriculture,2017,97(3):918-922.
[14] BAO Z J,CHI Y J.In vitro and in vivo assessment of angiotensin-converting enzyme(ACE)inhibitory activity of fermented soybean milk by Lactobacillus casei strains[J].Current Microbiology,2016,73(2):214-219.
[15] 张禄捷,李荣,姜子涛.茼蒿叶中总黄酮的提取纯化及抗氧化活性分析[J].食品科学,2015,36(24):40-45.
ZHANG L J,LI R,JIANG Z T.Extraction,purification and antioxidant activity of total flavonoids from Chrysanthemum coronarium L.leaves[J].Food Science,2015,36(24):40-45.
[16] BAQUEIRO-PE A I,GUERRERO-BELTR
A I,GUERRERO-BELTR N J
N J  .Physicochemical and antioxidant characterization of Justicia spicigera[J].Food Chemistry,2017,218:305-312.
.Physicochemical and antioxidant characterization of Justicia spicigera[J].Food Chemistry,2017,218:305-312.
[17] WANNENMACHER J,COTTERCHIO C,SCHLUMBERGER M,et al.Technological influence on sensory stability and antioxidant activity of beers measured by ORAC and FRAP[J].Journal of the Science of Food and Agriculture,2019,99(14):6 628-6 637.
[18] LIN L,LYU S,LI B F.Angiotensin-I-converting enzyme(ACE)-inhibitory and antihypertensive properties of squid skin gelatin hydrolysates[J].Food Chemistry,2012,131(1):225-230.
[19] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
DONG X Z,CAI M Y.Manual for identification of common bacterial systems[M].Beijing:Science Press,2001.
[20] ANGELA L A,ALAN R,VITOR F C,et al.Simultaneous saccharification and fermentation of Spirulina sp.and corn starch for the production of bioethanol and obtaining biopeptides with high antioxidant activity[J].Bioresource Technology,2020,301:122 698.
[21] YU J H,MA D Y,QU S J,et al.Effects of different probiotic combinations on the components and bioactivity of Spirulina[J].Journal of Basic Microbiology,2020,60(6):543-557.
[22] ANEKTHANAKUL K,SENACHAK J,HONGSTHONG A,et al.Natural ACE inhibitory peptides discovery from Spirulina(Arthrospira platensis)strain C1[J].Peptides,2019,118:170 107.