蓝圆鲹(Decapterus maruadsi),鲈形目鲹科圆鲹属,是我国重要的海洋经济鱼类之一[1],其产量大、分布广、蛋白质含量高、营养丰富,是一种优质的海洋蛋白资源。目前,蓝圆鲹主要以冰鲜及冷冻产品为主,部分用于生产饲料,其精深加工水平较低,亟需采用现代加工技术提升其高值化利用水平。
生物活性肽是对生物体的生命活动有益或具有特定生理作用的肽类化合物,已被证明具有抗肿瘤、抗衰老、抗氧化、降血脂、降血压、降血糖等多种生物活性[2-7]。生物活性肽具有免疫原性弱、安全性高、易被人体吸收及加工性能好等特点,被广泛应用于化妆品、医药和保健食品等多个领域。黄嘌呤氧化酶(xanthine oxidase,XOD)抑制肽是一种能够在体内或体外抑制XOD活性,从而减少尿酸生成量的生物活性肽。XOD抑制肽可降低尿酸的生成,对治疗高尿酸血症和痛风疾病具有潜在的应用意义。目前,已有研究以脱脂核桃粉[8]、水稻[9]、罗非鱼皮[10]、鲣鱼[11-12]、鲨鱼软骨[13]、金枪鱼[14]等动植物蛋白为原料制备出具有XOD抑制活性的多肽,而对于蓝圆鲹蛋白多肽的XOD抑制活性研究尚未见报道。
XOD(EC 1.17.3.2)是尿酸合成过程中的关键酶。XOD由2个对称的亚基组成,每个亚基包含1个钼蝶呤中心、1个黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)和2个铁-硫中心。在嘌呤代谢的过程中,电子依次通过XOD的钼蝶呤,铁-硫中心和FAD 3个氧化还原中心,催化次黄嘌呤生成黄嘌呤,进而生成尿酸。因此,XOD抑制活性是评价降尿酸效果的重要指标[15]。本研究以蓝圆鲹为原料,采用酶解法制备XOD抑制肽,并对其制备工艺进行了优化。同时基于探究金属离子作为辅基在酶活性中心发挥的作用,对酶解产物的金属离子结合活性进行了测定,并用红外及紫外光谱对其结合位点进行分析。旨在为蓝圆鲹的高值化利用提供新的思路,并为蓝圆鲹XOD抑制肽的开发及其降尿酸活性研究提供重要参考。
1 材料与方法
1.1 材料与试剂
冰鲜蓝圆鲹购于广州华润万家超市,去除头尾、骨和内脏,取鱼肉,洗净沥干,绞成肉糜,于-20 ℃冻藏备用。
胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、复合蛋白酶,酷尔化学科技有限公司;黄嘌呤、XOD,美国Sigma公司;还原型谷胱甘肽(307.3 Da)、氧化型L-谷胱甘肽(612.63 Da)、杆菌肽(1 422.69 Da)、抑肽酶(6 511.44 Da)、细胞色素C(12 400 Da),北京睿博兴科生物技术有限公司;MgCl2、FeCl2·4H2O,上海源叶生物科技有限公司;CuSO4·5H2O,天津市百世化工有限公司。
1.2 仪器与设备
电子天平,德国Sartorius公司;超纯水系统,美国Millipore公司;恒温水浴锅,上海森信实验仪器厂有限公司;高速冷冻离心机,德国Sigma公司;冷冻干燥机,德国Christ公司;凯氏定氮仪,丹麦FOSS公司;水浴恒温振荡器,金坛市精达仪器制造厂;自动电位滴定仪,瑞士Metrohm公司;SUNRISE酶标仪,瑞士TECAN公司;紫外可见分光光度计、红外光谱仪、高效液相色谱仪,日本岛津公司;C18分析柱(4.6 mm×150 mm,2.7 μm)、电感耦合等离子体质谱,美国Agilent 公司;高压高通量微波消解系统,美国CEM公司。
1.3 实验方法
1.3.1 蓝圆鰺XOD抑制肽制备中酶的筛选
以蓝圆鲹鱼肉为原料,以1∶2(g∶mL)的料液比加入去离子水,加酶量0.3%(质量分数),选用胰蛋白酶、木瓜蛋白酶、中性蛋白酶、复合蛋白酶及碱性蛋白酶分别在其各自最适pH和温度条件下酶解,水浴振荡不同时间,酶解结束后,沸水浴灭酶15 min,冷却后于4 ℃、8 000 r/min离心20 min,收集上清液经抽滤、冷冻干燥后即得酶解物,放置在-20 ℃贮藏。5种蛋白酶的酶解条件及添加量见表1。然后取不同酶解条件的冻干肽粉,配制为质量浓度为15 g/L的水溶液,分别进行体外XOD抑制活性测定。
表1 不同蛋白酶的酶解条件及添加量
Table 1 Hydrolysis conditions and dosages of different proteases
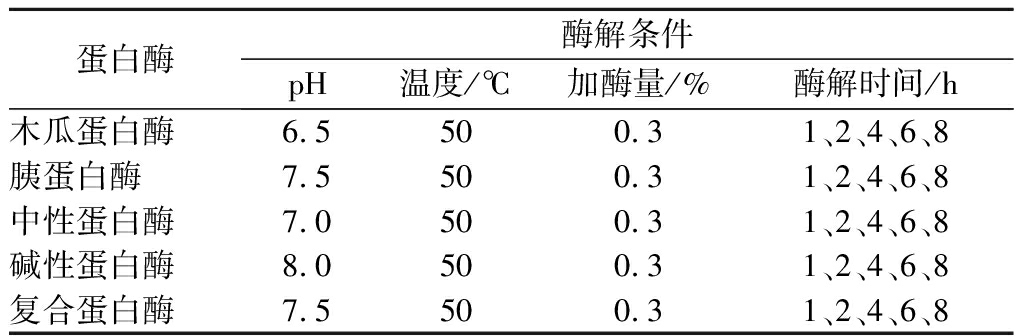
蛋白酶酶解条件pH温度/℃加酶量/%酶解时间/h木瓜蛋白酶6.5500.31、2、4、6、8胰蛋白酶7.5500.31、2、4、6、8中性蛋白酶7.0500.31、2、4、6、8碱性蛋白酶8.0500.31、2、4、6、8复合蛋白酶7.5500.31、2、4、6、8
1.3.2 单因素试验
按照 1.3.1节方法对蓝圆鲹鱼肉进行酶解,以体外XOD抑制活性为主要指标,水解度为辅助指标,分别考察中性蛋白酶的酶解时间(2、3、4、5、6 h)、酶解 pH(6.0、6.5、7.0、7.5)、料液比(1∶1、1∶2、1∶3、1∶4、1∶5)(g∶mL)以及酶添加量(质量分数0.1%、0.2%、0.3%、0.4%、0.5%)对该指标的影响。固定条件:酶解时间6 h、温度50 ℃、pH 7.0、加酶量0.3%(质量分数)、料液比1∶2(g∶mL),酶解时每次改变其中1个因素,其他因素不变。
1.3.3 水解度的测定
采用凯氏定氮法测定蓝圆鲹肉中总氮质量m1(g),电位滴定法测定酶解液中氨态氮质量m2(g),水解度的计算如公式(1)所示:
水解度![]()
(1)
1.3.4 酶解物体外XOD抑制活性测定
参照WU等[16]的方法,并稍作修改。在96酶标仪检测板中分别加入50 μL待测样品(15 g/L)或50 μL磷酸缓冲盐(20 mmol/L,pH 7.5),50 μL 0.05 U/mL的XOD,37 ℃孵育30 min,加入150 μL 0.42 mmol/L黄嘌呤溶液,此时酶促反应被启动,持续记录反应体系在290 nm波长处吸光值,根据酶解物XOD抑制情况适当调整检测时间。每个样品做3个平行,以PBS缓冲液做空白对照,XOD抑制活性的计算如公式(2)所示:
XOD抑制活性![]()
(2)
式中:V0,酶促反应体系的初始反应速率;VS,样品存在时酶促反应体系的初始速率。
1.3.5 正交实验
在单因素实验的基础上,以XOD抑制活性为响应值,设定时间(A)、pH(B)及酶添加量(C)的变化范围及中心点值,采用 L9(34)正交实验进行酶解条件的优化,因素水平设计见表2。
表2 正交试验因素水平设计
Table 2 Factors and levels for orthogonal array design
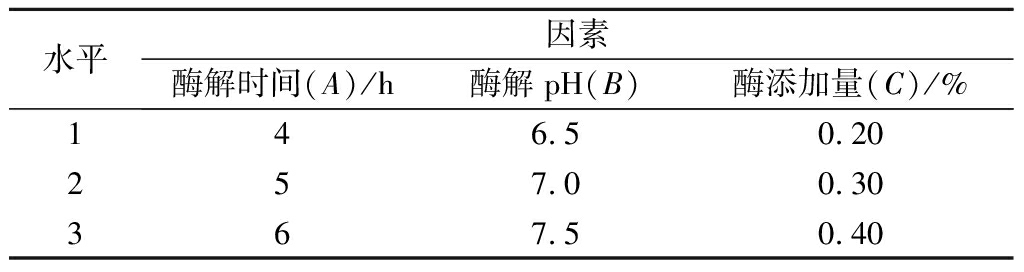
水平因素酶解时间(A)/h酶解pH(B)酶添加量(C)/%146.50.20257.00.30367.50.40
1.3.6 酶解物结合金属离子活性的测定
参考杨伊然等[17]的方法并加以修改,将蓝圆鲹多肽(round scad peptides,RSPs)分别与Fe2+、Mg2+、Cu2+ 3种矿物离子在37 ℃,中性条件下结合40 min。结合后将溶液全部移入透析袋(截留分子质量100 Da),每隔4 h换1次水,共透析24 h。透析结束后记录膨胀后体积v,取5 mL透析后溶液于消化管内,加10 mL浓硝酸进行微波消解。将消解后溶液用超纯水定容至50 mL,用电感耦合等离子体质谱检测金属离子质量浓度c,矿物离子与多肽的结合率计算如公式(3)所示:
结合率![]()
(3)
式中:c,检测出金属离子的质量浓度,mg/L;v,膨胀后体积,mL;n,稀释倍数;m,金属离子总添加量,mg。
1.3.7 蓝圆鲹XOD抑制肽分子质量测定
采用凝胶色谱法测定其分子质量(molecular weight,Mw)分布。取不同酶解时间蓝圆鲹降尿酸活性肽冻干粉,用含有乙腈和水的流动相配制成2 g/L溶液。流动相A:体积分数0.1%三氟乙酸的乙腈;流动相B:体积分数0.1%三氟乙酸的超纯水;洗脱比例20%(A)∶80%(B),色谱柱:TSK-GEL® G2 000SWXL(7.8 mm×300 mm),流速0.5 mL/min,进样体积10 μL,检测波长214 nm,标准肽样品:还原性谷胱甘肽(Mw 307.3)、L-氧化型谷胱甘肽(Mw 612.63)、杆菌肽(Mw 1 422.69)、细胞色素C(Mw 12 400),按一定比例混合后,过0.22 μm微孔滤膜,以相对分子质量的对数(lg Mw)对保留时间(t)作图,得到标准曲线方程:lg Mw=-0.221 2t+6.885 6(R2=0.996 4)。
1.3.8 氨基酸分析
按GB/T 5009.124—2016《食品中氨基酸的测定》中的酸水解法测定18种基本氨基酸。
1.3.9 RSPs与RSPs-Fe2+结合物的紫外光谱扫描
为了研究肽和铁的结合方式,对RSPs和RSPs-Fe2+进行紫外光谱扫描分析。参考SUN等[18]的方法并稍加修改,将冻干肽粉RSPs和RSPs-Fe2+用去离子水配制成0.1 g/L的溶液。在测量样品之前,用去离子水对紫外可见分光光度计进行空白校准,在波长190~400 nm进行紫外光谱扫描。
1.3.10 RSPs及RSPs-Fe2+结合物的红外光谱扫描
采用压片法测定RSPs和RSPs-Fe2+结合物的红外光谱,扫描范围为4 000~400 cm-1。
2 结果与分析
2.1 蛋白酶的筛选
用5种蛋白酶分别对蓝圆鲹鱼肉进行酶解。由图1-a可知,经胰酶酶解6 h的产物水解度最高,达到20.41%,中性蛋白酶次之(15.3%),这可能是由不同蛋白酶的特异性酶切位点和作用方式引起的。蓝圆鲹富含Asp、Lys、Glu、Leu等氨基酸,胰蛋白酶及中性蛋白酶可以特异性识别这些结合位点。不同蛋白酶酶解得到的肽段不同,导致其XOD抑制活性有差异。由图1-b可知,中性蛋白酶在6 h时酶解产物表现出最佳的XOD抑制活性,达62.79%,碱性蛋白酶6 h酶解物次之(60.21%)。6 h后水解度及XOD抑制活性均有所降低。该结果与邹琳[11]的研究结果相一致,其通过5种蛋白酶对鲣鱼蛋白进行酶解,发现中性蛋白酶酶解产物的XOD抑制活性最高,达到了94.99%。此外,赵谋明等[19]研究发现中性蛋白酶为酶解法制备秋刀鱼XOD抑制肽的最佳用酶。因此,选择中性蛋白酶做进一步的制备工艺优化。
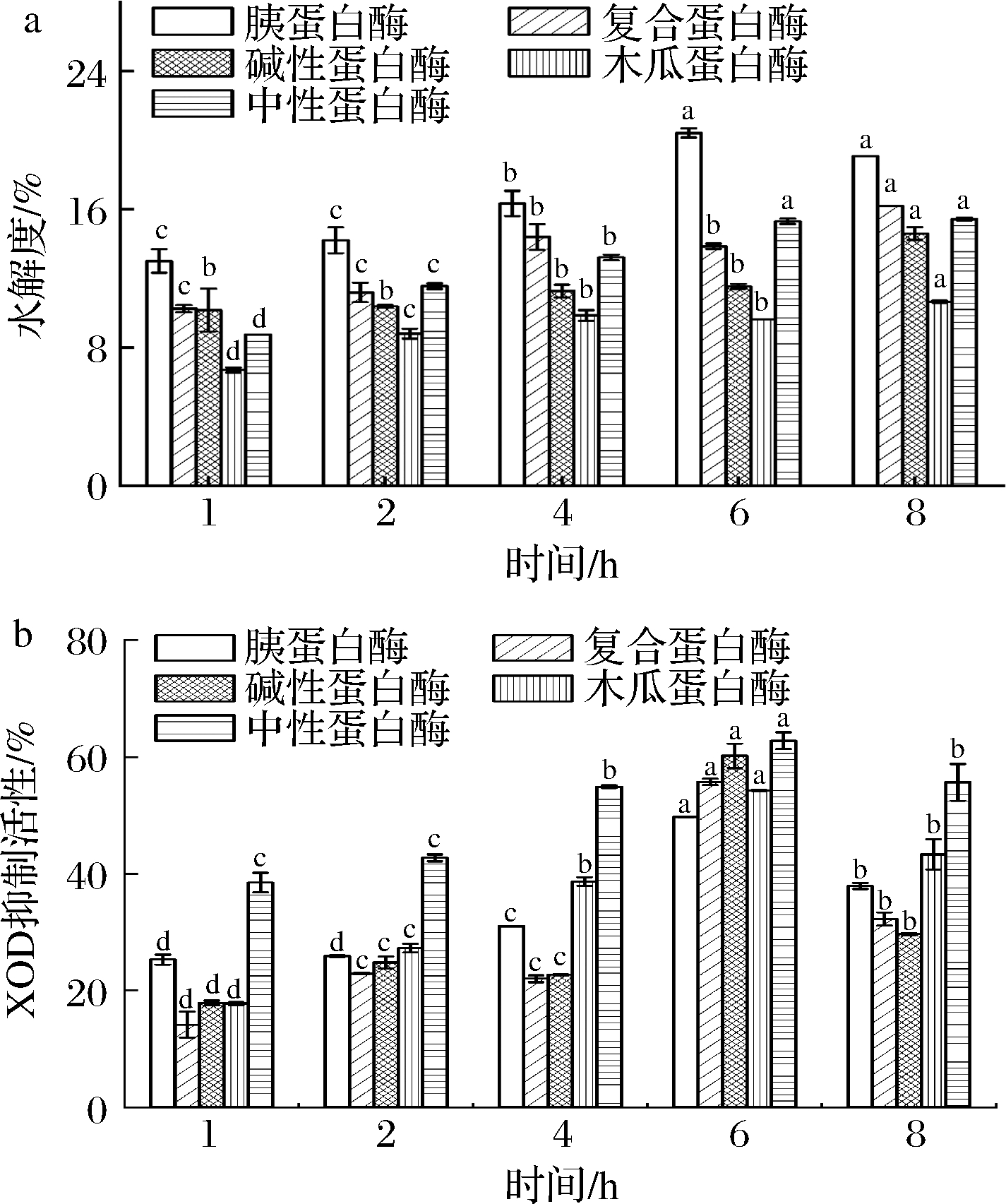
a-水解度;b-XOD抑制活性
图1 不同蛋白酶对水解度、XOD抑制活性的影响
Fig.1 Effect of different proteases on degree of hydrolysis,and XOD inhibition activity
注:不同字母表示存在显著性差异(P<0.05)(下同)
2.2 单因素试验结果分析
pH会改变底物和辅酶的解离程度,也会影响酶活性中心的相关基团,从而影响酶解反应[11,20]。由图2-a可知,pH为6~7.5时,水解度呈现先增大后减小的趋势。当pH 7.0时,水解度达到最大值17.26%,XOD抑制活性达到59.01%。综合考虑水解度及XOD抑制活性,选定pH 6.5~7.5为较好酶解pH条件。由图2-b可知,酶解物的水解度和XOD抑制活性随着酶解时间的增长呈现先增大后减小的趋势。在酶解时间达到6 h时,酶解物的水解度与XOD抑制活性均达到最大值,分别为18.02%、61.82%,随后有所降低。因此,选择5~7 h为蓝圆鲹较佳酶解时间。如图2-c所示,水解度在料液比为1∶2(g∶mL)时达到最大(19.20%),此时的XOD抑制活性也达到最大(61.43%)。因此,选择料液比1∶2(g∶mL)为酶解最适料液比。由图2-d可知,随着加酶量的增加,蓝圆鲹鱼肉蛋白的水解度逐渐增大,在加酶量为0.5%(质量分数)时,水解度达到最大值(19.2%)。XOD抑制活性呈先增大后减小的趋势,当加酶量为0.3%(质量分数),XOD抑制活性达最大值(63.05%)。因此,选择0.2%~0.4%(质量分数)为蓝圆鲹酶解较佳加酶量。

a-pH;b-时间;c-料液比;d-加酶量
图2 pH、时间、料液比、加酶量对XOD抑制活性及水解度的影响
Fig.2 Effect of pH,enzymatic hydrolysis time,liquid-material ratio and enzyme dosage on XOD inhibition activities and the degree of hydrolysis
2.3 正交试验
根据单因素试验结果,按1.3.5的方法进行正交试验。以XOD抑制活性为评价指标,正交试验结果如表3所示。极值R显示,各因素在试验范围内对XOD抑制活性的影响主次顺序为酶添加量(C)>酶解pH(B)>酶解时间(A);方差分析结果表明,所选因素中酶解pH(B)和酶添加量(C)对XOD抑制活性的影响极其显著,因素酶解时间(A)对XOD抑制活性具有显著影响(表4)。得出最佳酶解条件A2B2C2,即酶解时间6 h,酶解pH 7.0,加酶量0.3%(质量分数),此条件下酶解产物的XOD抑制活性达64.03%。
表3 正交实验设计及结果
Table 3 Orthogonal array design and results
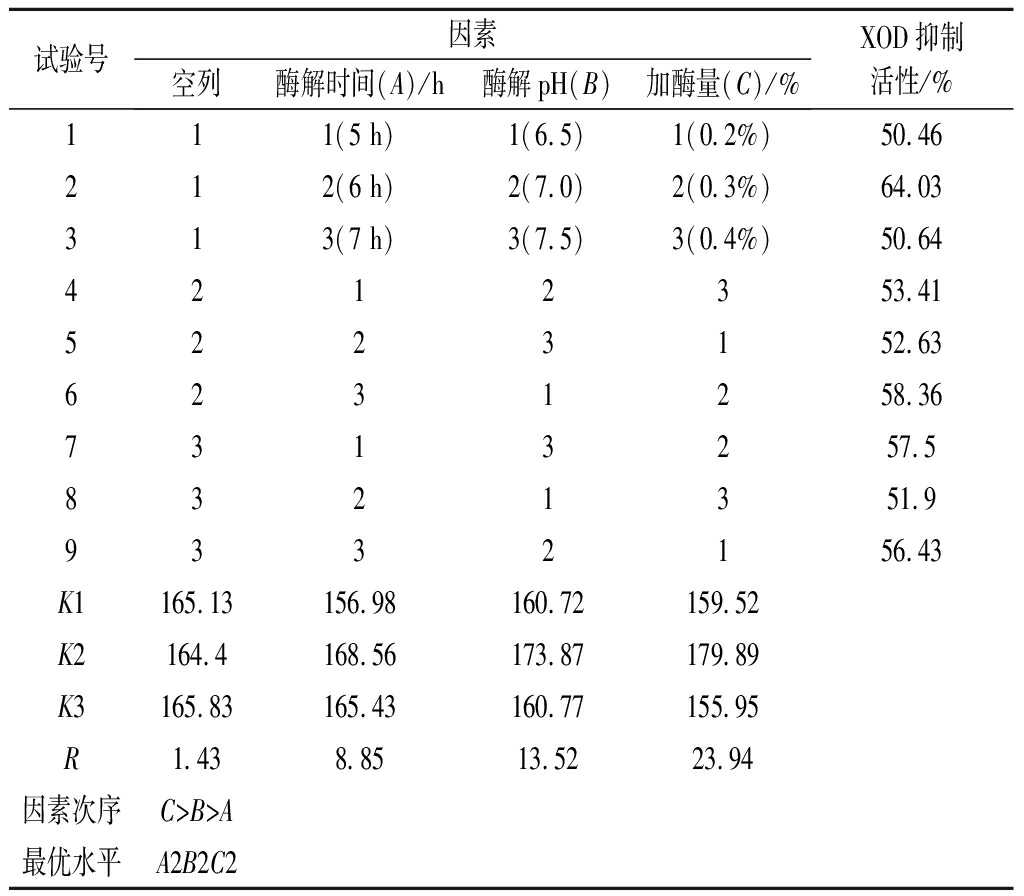
试验号因素空列酶解时间(A)/h酶解pH(B)加酶量(C)/%XOD抑制活性/%111(5h)1(6.5)1(0.2%)50.46212(6h)2(7.0)2(0.3%)64.03313(7h)3(7.5)3(0.4%)50.644212353.415223152.636231258.367313257.58321351.99332156.43K1165.13156.98160.72159.52K2164.4168.56173.87179.89K3165.83165.43160.77155.95R1.438.8513.5223.94因素次序C>B>A最优水平A2B2C2
表4 正交试验方差分析结果
Table 4 Analysis of variance of orthogonal array design
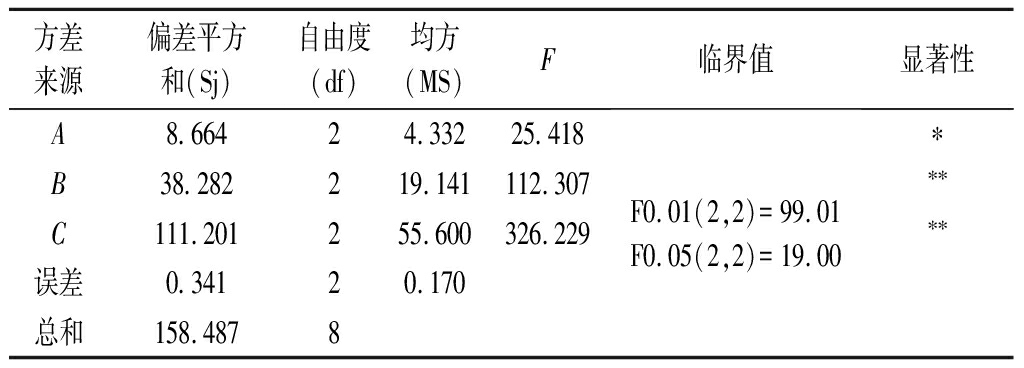
方差来源偏差平方和(Sj)自由度(df)均方(MS)F临界值显著性ABC误差总和8.66438.282111.2010.341158.487222284.33219.14155.6000.17025.418112.307326.229F0.01(2,2)=99.01F0.05(2,2)=19.00*****
注:**-差异极显著(P<0.01),*-差异显著(P<0.05)
2.4 蓝圆鲹酶解物与不同金属离子的结合活性
由于金属离子常作为辅基在酶活性中心发挥作用,为此对酶解物的金属离子结合活性进行了测定。由图3可知,对比不同酶解时间蓝圆鲹酶解物的Fe2+、Mg2+和Cu2+结合能力,发现Fe2+结合能力最高,约为相同条件下Mg2+和Cu2+结合活性的3倍。其中6 h酶解产物RSPs的Fe2+结合率达到了61.56%,明显高于Mg2+结合率(13.99%)和Cu2+结合率(17.12%)。该结果表明RSPs具有较强的Fe2+结合能力。结合正交试验结果,推测RSPs的较高XOD抑制活性可能与酶活性中心的铁元素存在一定关联。王婷婷[21]研究发现蓝圆鲹鱼肉经中性蛋白酶和胰蛋白酶复配酶解5 h,表现出最高的Fe2+结合率(72.91%)。
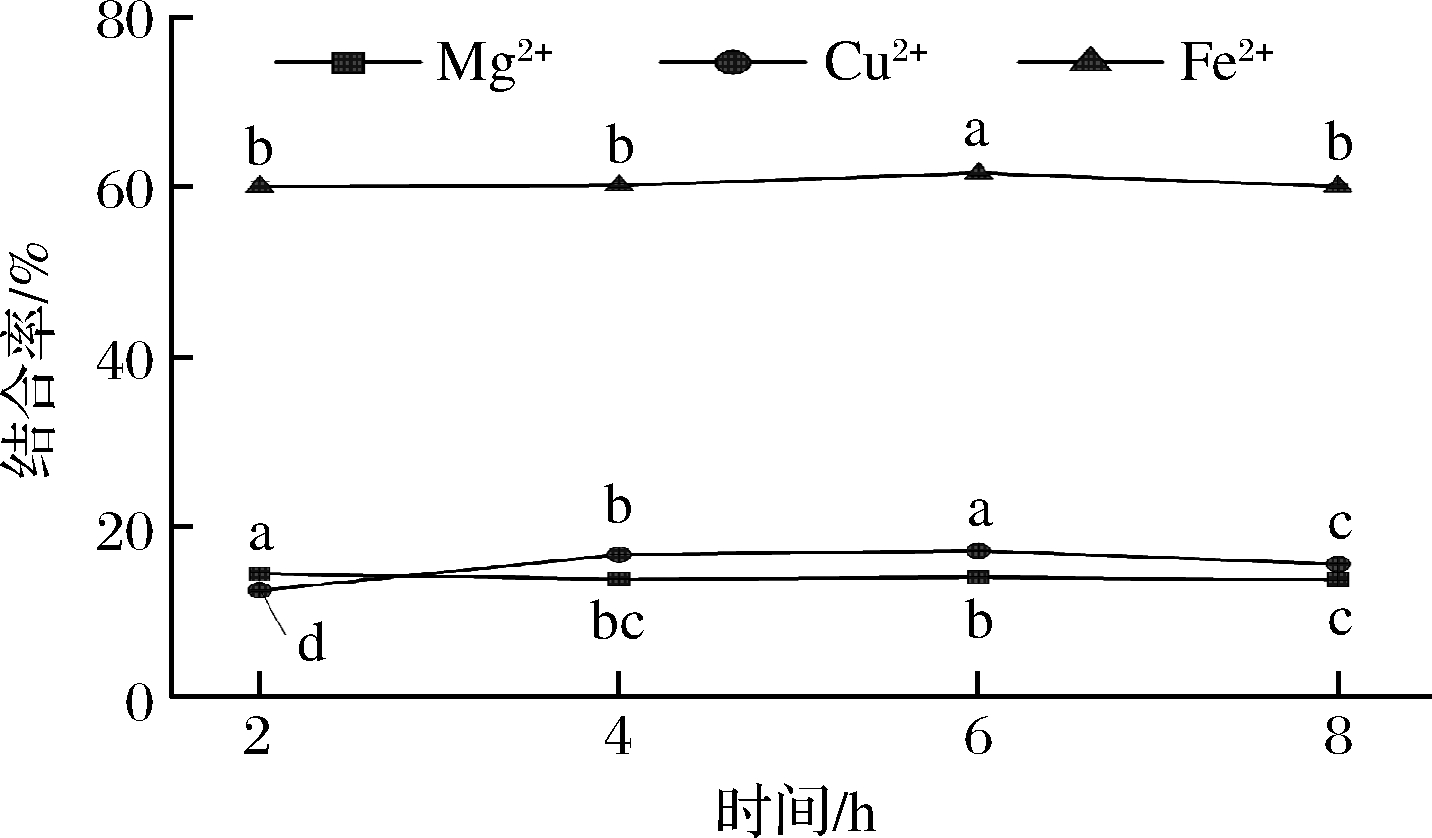
图3 酶解时间对蓝圆鲹蛋白酶解物金属离子结合率的影响
Fig.3 Effect of enzymolysis time on the chelating rate of round scad peptides
2.5 RSPs的分子质量分布
利用高效液相色谱法测定RSPs分子质量分布情况。图4-a为RSPs的高效体积排阻色谱(high perfomance size exclusion chromatography,HPSEC)图谱,其分子质量分布情况如图4-b所示,随着酶解时间的延长,蓝圆鲹酶解物中Mw>3 000 Da的多肽组分逐渐减少,Mw<1 000 Da的多肽组分逐渐增多。其中,6 h酶解产物RSPs中Mw>3 000 Da的组分仅占0.58%,Mw<1 000 Da的组分高达92.35%,由此说明,小分子肽(<1 000 Da)可能具有更强的XOD抑制活性。何伟炜[22]研究发现多肽组分的XOD抑制活性与其中Mw<1 000 Da 的多肽含量正相关。LI等[23]从核桃粉中鉴定出2个Mw<1 000 Da的肽段WPPKN(640.8 Da)、ADIYTE(710.7 Da),均表现较高的XOD抑制活性。MUROTA等[13]从鲨鱼软骨中鉴定出Mw686.64 Da的五肽,其XOD抑制活性高于其粗酶解物。同时,在一定范围内,肽的分子质量分布与其金属离子结合活性有关。VATTEM等[24]用蛋清蛋白制备的铁结合肽的Mw<1 000 Da。TORRES-FUENTES等[25]发现Mw<500 Da的鹰嘴豆蛋白衍生的水解产物亚组分比>500 Da的亚组分具有更高的Fe2+结合活性。
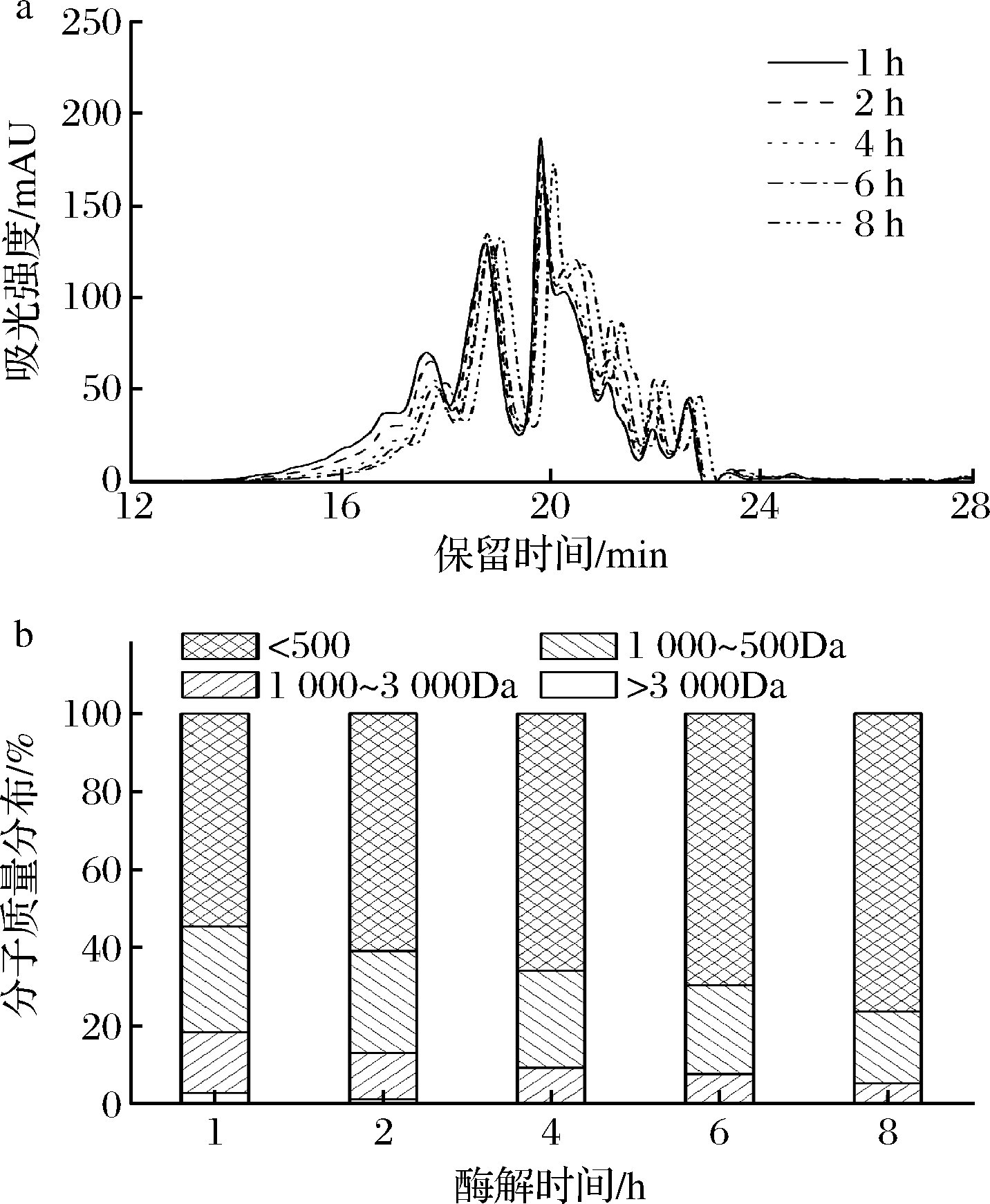
a-分子质量HPSEC图谱;b-分子质量分布
图4 蓝圆鲹蛋白酶解物分子质量分布
Fig.4 Molecular weight distribution of round scad peptides
2.6 RSPs氨基酸含量分析
为了研究氨基酸组成与RSPs的XOD抑制活性及Fe2+结合活性的关系,对蓝圆鲹鱼肉及RSPs的氨基酸进行对比分析。由表5可知,RSPs中疏水性氨基酸(Ala、Val、Leu、Ile、Met、Trp和Phe)含量较高,达31.64%。何伟炜[22]研究发现,存在疏水性氨基酸的多肽更容易通过疏水相互作用进入XOD的活性中心,从而发挥抑制作用。李宇娟[12]研究发现,疏水性氨基酸残基之间的疏水相互作用更有利于多肽和XOD的结合。同时,氨基酸组成也会影响多肽的金属离子结合活性[26]。有研究表明,金属离子更容易与富氧或富氮基团结合,如磷酸基的氧和Asp和Glu的羧基等富氧基团,以及His的咪唑基、Arg、Asn中的富氮基团[27]。由表5中氨基酸分析结果可知,RSPs中Glu、Asp、Arg、His含量在总氨基酸含量中占比较大,有利于发挥更好的Fe2+结合活性。SUN等[18]从海参卵子水解物中分离出Fe2+结合活性肽,其Asp、Arg及His的含量与Fe2+结合活性呈正相关。TORRES-FUENTES等[25]研究发现,鹰嘴豆蛋白中多肽与铁的结合活性与多肽中His有关。CAETANO-SILVA等[28]从乳清蛋白肽的序列中发现了高含量的Asp和Glu残基,这2个残基是主要的铁结合位点。综上说明,RSPs的氨基酸组成有利于其发挥良好的XOD抑制活性及Fe2+结合活性。
表5 蓝圆鲹鱼肉与RSPs中的氨基酸组成分析
Table 5 Amino acids compositions of round scad muscle and RSPs
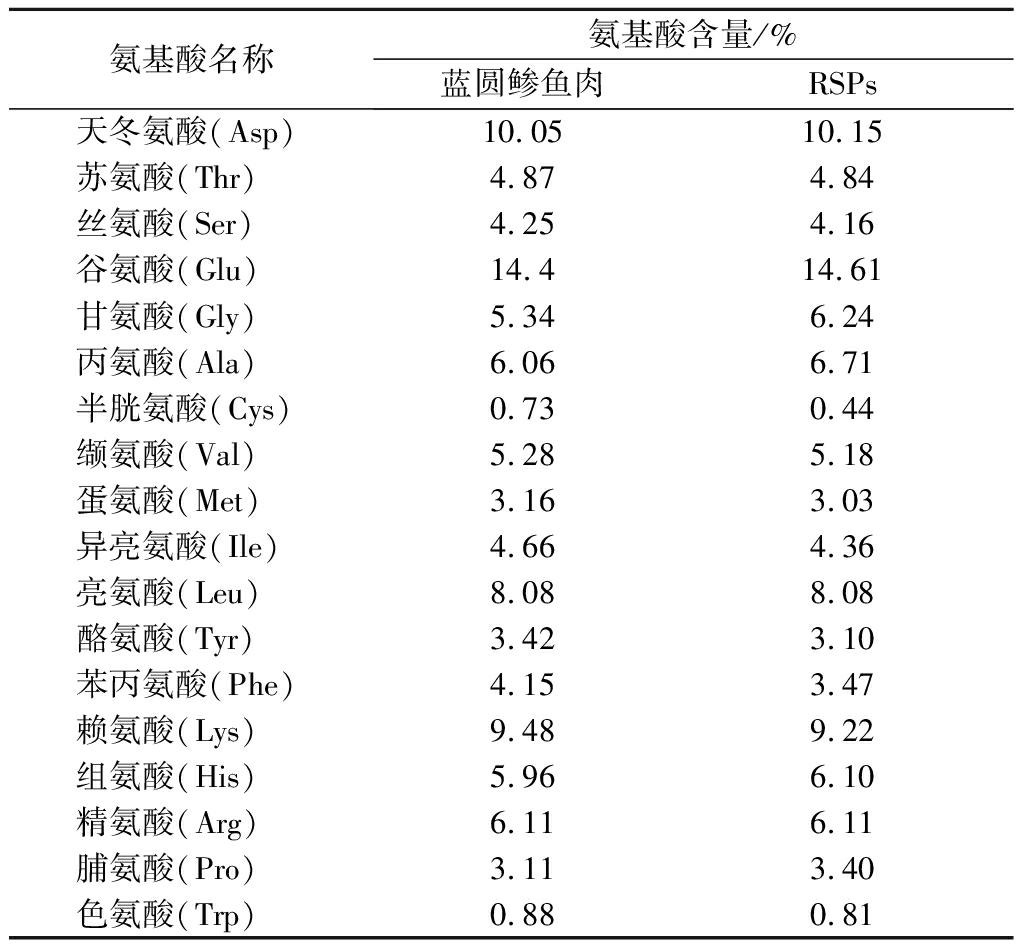
氨基酸名称氨基酸含量/%蓝圆鲹鱼肉RSPs天冬氨酸(Asp)10.0510.15苏氨酸(Thr)4.874.84丝氨酸(Ser)4.254.16谷氨酸(Glu)14.414.61甘氨酸(Gly)5.346.24丙氨酸(Ala)6.066.71半胱氨酸(Cys)0.730.44缬氨酸(Val)5.285.18蛋氨酸(Met)3.163.03异亮氨酸(Ile)4.664.36亮氨酸(Leu)8.088.08酪氨酸(Tyr)3.423.10苯丙氨酸(Phe)4.153.47赖氨酸(Lys)9.489.22组氨酸(His)5.966.10精氨酸(Arg)6.116.11脯氨酸(Pro)3.113.40色氨酸(Trp)0.880.81
2.7 RSPs及RSPs-Fe2+结合物的紫外光谱分析
多肽在紫外光210 nm附近有其最强特征吸收峰,多肽在与金属离子形成结合物的过程中,结合物中的配合体内部电子的跃迁与游离配位体内部电子的跃迁时的能量不同,从而导致其紫外吸收峰的移动或消失,或出现新的吸收峰[18]。由图5可知,RSPs和RSPs-Fe2+的紫外吸收光谱具有明显的变化,RSPs与Fe2+结合后,紫外最大吸收峰从190 nm红移到193 nm,且吸收强度增加。该结果与纪晓雯等[29]的研究结果相似。
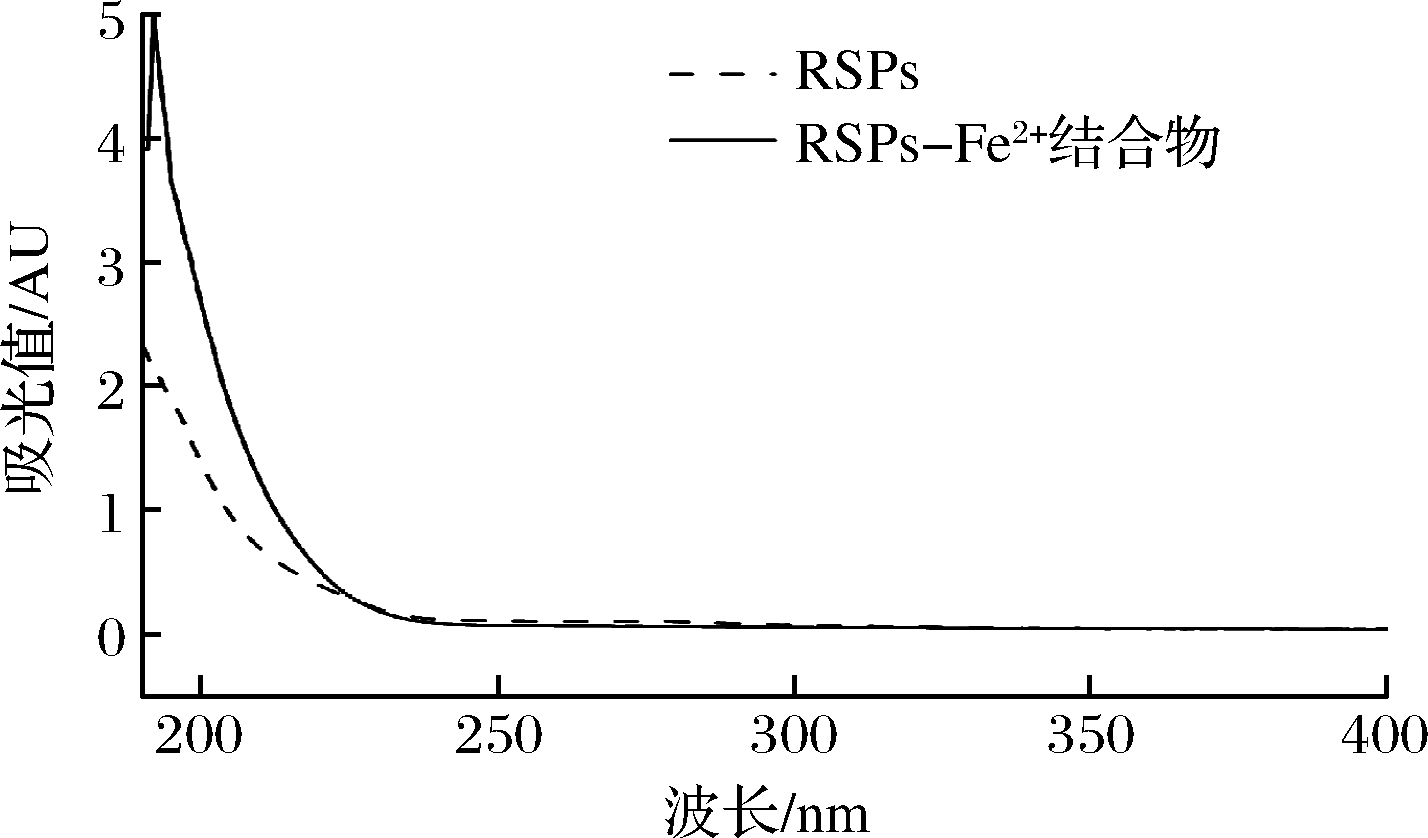
图5 RSPs及RSPs-Fe2+结合物紫外吸收光谱图
Fig.5 UV spectrum of RSPs and RSPs-Fe2+ complex
2.8 RSPs及RSPs-Fe2+结合物的红外光谱分析
红外光谱中氨基和羧基吸收峰的变化可以反映金属离子与有机基团之间的配位反应[30]。如图6所示,在RSPs的红外光谱中,3 394.72 cm-1是由N—H伸缩振动引起的,1 647.21 cm-1属于RSPs的酰胺Ⅰ带的特征峰,1 587.42 cm-1属于酰胺Ⅱ带的特征峰。此外,1 402.25和1 083.99 cm-1分别是—COOH吸收峰和C![]() O吸收峰[31]。在加入Fe2+后,N—H键的吸收峰由3 394.72 cm-1向低波段位移至3 331.07 cm-1,酰胺Ⅰ键特征吸收峰由1 647.21 cm-1位移至1 660.71 cm-1,酰胺Ⅱ键特征吸收峰由1 587.42 cm-1移至1 539.20 cm-1。以上结果表明RSPs的氨基的N原子参与Fe2+的结合。另外,—COOH特征峰和C
O吸收峰[31]。在加入Fe2+后,N—H键的吸收峰由3 394.72 cm-1向低波段位移至3 331.07 cm-1,酰胺Ⅰ键特征吸收峰由1 647.21 cm-1位移至1 660.71 cm-1,酰胺Ⅱ键特征吸收峰由1 587.42 cm-1移至1 539.20 cm-1。以上结果表明RSPs的氨基的N原子参与Fe2+的结合。另外,—COOH特征峰和C![]() O特征峰分别由1 402.25和1 083.99 cm-1移动至1 396.46和1 043.49 cm-1,说明羧基的O原子与Fe2+发生结合反应。综上所述,推测RSPs的酰胺键,氨基的N原子与羧基的O原子可能与Fe2+发生了结合。SUN等[18]通过红外光谱发现海参卵子肽的Fe2+结合位点主要对应于羧基O原子和氨基N原子。WU等[32]发现鳕鱼皮明胶蛋白肽可以通过肽主链的氨基端和羧基端、肽键以及精氨酸侧链的氨基和亚胺与Fe2+结合。
O特征峰分别由1 402.25和1 083.99 cm-1移动至1 396.46和1 043.49 cm-1,说明羧基的O原子与Fe2+发生结合反应。综上所述,推测RSPs的酰胺键,氨基的N原子与羧基的O原子可能与Fe2+发生了结合。SUN等[18]通过红外光谱发现海参卵子肽的Fe2+结合位点主要对应于羧基O原子和氨基N原子。WU等[32]发现鳕鱼皮明胶蛋白肽可以通过肽主链的氨基端和羧基端、肽键以及精氨酸侧链的氨基和亚胺与Fe2+结合。
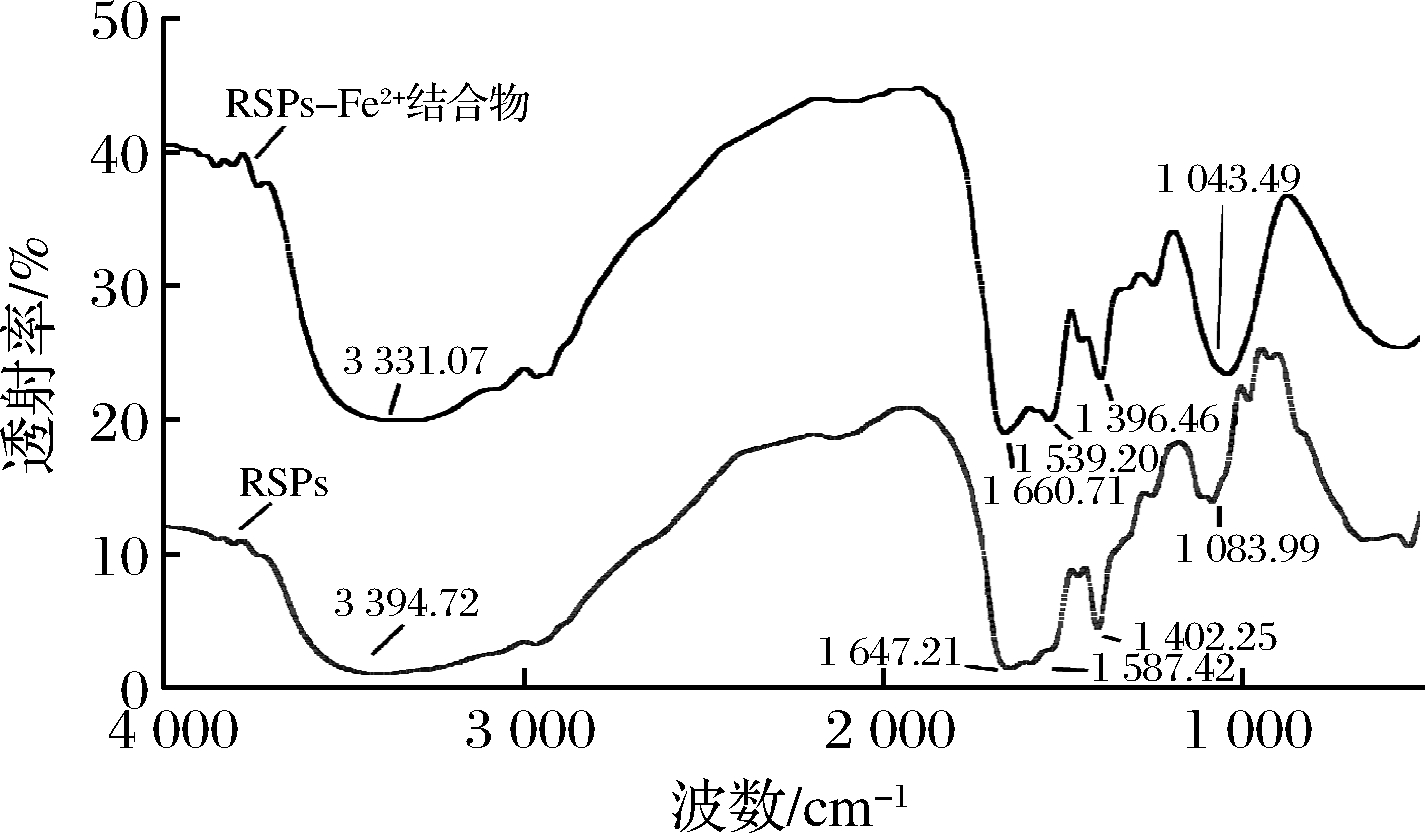
图6 RSPs及RSPs-Fe2+结合物红外吸收光谱图
Fig.6 FTIR spectra of RSPs and RSPs-Fe2+ complexes
3 结论
本文以蓝圆鲹为原料,选用5种蛋白酶对其进行水解,以酶解产物的XOD抑制活性为评价指标,筛选出中性蛋白酶为制备蓝圆鲹XOD抑制肽的最适酶类,并探明其最佳酶解条件为:加酶量0.3%(质量分数)、料液比1∶2(g∶mL)、pH 7.0、酶解温度50 ℃、酶解时间6 h。在此条件下获得的多肽RSPs的XOD抑制活性达64.03%,且表现出较高的Fe2+结合活性(61.56%)。通过分子质量分析,具有较高XOD抑制活性的RSPs的分子质量较小,其Mw<1 000 Da的组分高达92.35%,且RSPs中与XOD抑制活性有关的疏水性氨基酸以及与金属离子结合活性相关的氨基酸含量较高。此外,对RSPs和RSPs-Fe2+结合物进行紫外光谱和红外光谱扫描分析,结果表明RSPs与Fe2+的结合位点可能是RSPs的酰胺键、氨基的N原子与羧基的O原子。本研究可为蓝圆鲹黄嘌呤氧化酶抑制肽的制备及开发提供参考。
[1] 王爽.蓝圆鲹脱脂蛋白抗氧化肽的制备及其分离纯化、抗氧化活性研究[D].广州:华南农业大学,2018.
WANG S.Preparation,purification and antioxidant activity of Decapterus maruadsi peptide antioxidant peptide[D].Guangzhou:South China Agricultural University,2018.
[2] GONG F,CHEN M F,CHEN J L,et al.Boiled abalone byproduct peptide exhibits anti-tumor activity in HT1080 cells and HUVECs by suppressing the metastasis and angiogenesis in vitro[J].Journal of Agricultural and Food Chemistry,2019,67(32):8 855-8 867.
[3] 谢丽平.具有抗氧化、抗衰老活性的多肽筛选、分离纯化及结构鉴定[D].广州:华南理工大学,2019.
XIE L P,Screening,separation and purification,structure identification of peptides with antioxidant and anti-aging effects[D].Guangzhou:South China University of Technology,2019.
[4] 李瑞杰, 胡晓,李来好,等.罗非鱼皮酶解物钙离子结合能力及其结合物的抗氧化活性[J].南方水产科学,2019,15(6):106-111.
LI R J,HU X,LI L H,et al.Calcium ion binding ability of tilapia skin hydrolysate and its antioxidant activity[J].South China Fisheries Science,2019,15(6):106-111.
[5] 朱晓连, 陈华,蔡冰娜,等.具有结合胆酸盐作用卵形鲳鲹蛋白酶解物的制备和分子量分布研究[J].南方水产科学,2017,13(2):101-108.
ZHU X L,CHEN H,CAI B N,et al.Production of bile acid salts binding hydrolysate from Trachinotus ovatus and its molecular weight distribution[J].South China Fisheries Science,2017,13(2):101-108.
[6] 李雯晖, 张健,应欣,等.大豆低聚肽对自发性高血压大鼠血压及血浆血管紧张素的影响[J].食品科学,2019,40(11):152-158.
LI W H,ZHANG J,YING X,et al.Effect of soybean oligopeptides on blood pressure and plasma angiotensin in spontaneously hypertensive rats[J].Food Science,2019,40(11):152-158.
[7] 延海莹, 刘盟梦,乔乐克,等.扇贝裙边活性肽的制备及其降血糖活性研究[J].食品工业,2018,39(3):117-121.
YAN H Y,LIU M M,QIAO L K,et al.Study on scallop skirt active peptide and glucose tolerance activity[J].The Food Industry,2018,39(3):117-121.
[8] 黎青勇.核桃源降尿酸肽靶向抑制黄嘌呤氧化酶活性的构效机制研究[D].广州:华南理工大学,2018.
LI Q Y.Study on the structure-activity mechanism of targeting inhibition of xanthine oxidase by uric acid-lowering peptides derived from walnut[D].Guangzhou:South China University of Technology,2018.
[9] LIU N X,WANG Y,YANG M F,et al.New rice-derived short peptide potently alleviated hyperuricemia induced by potassium oxonate in rats[J].Journal of Agricultural and Food Chemistry.2019,67(1):220-228.
[10] 盛周煌.罗非鱼皮胶原蛋白降尿酸活性肽的研究[D].广州:华南理工大学,2018.
SHENG Z H.Study on uric acid-reducing peptide of tilapia skin collagen[D].Guangzhou:South China University of Technology,2018.
[11] 邹琳.鲣鱼黄嘌呤氧化酶抑制肽的酶解制备及功能活性评价[D].杭州:浙江大学,2019.
ZOU L.Enzymatic preparation and functional evaluation of xanthine oxidase inhibitory peptides from skipjack tuna[D].Hangzhou:Zhejiang University,2019.
[12] 李宇娟.鲣鱼降尿酸肽的制备分离、结构表征及功效机制研究[D].广州:华南理工大学,2019.
LI Y J.Preparation,isolation,structural characterization,and the effect mechanism of uric acid-lowering peptides derived from bonito[D].Guangzhou:South China University of Technology,2019.
[13] MUROTA I,TAGUCHI S,SATO N,et al.Identification of antihyperuricemic peptides in the proteolytic digest of shark cartilage water extract using in vivo activity-guided fractionation[J].Journal of Agricultural & Food Chemistry,2014,62(11):2 392-2 397.
[14] HE W W,SU G W,SUN D X,et al.In vivo anti-hyperuricemic and xanthine oxidase inhibitory properties of tuna protein hydrolysates and its isolated fractions[J].Food Chemistry,2019,272:453-461.
[15] 王成华, 邢新会.黄嘌呤氧化酶的研究进展及其发展前景[J].广西科学,2017,24(1):15-24.
WANG C H,XING X H.Research progress and prospects of xanthine oxidase[J].Guangxi Sciences,2017,24(1):15-24.
[16] WU X H,RUAN J L,ZHANG J,et al.Pallidifloside D,a saponin glycoside constituent from Smilax riparia,resist to hyperuricemia based on URAT1 and GLUT9 in hyperuricemic mice[J].Journal of Ethnopharmacology,2014,157(157):201-205.
[17] 杨伊然, 胡晓,杨贤庆,等.蓝圆鲹蛋白酶解物的螯合矿物离子活性研究[J].食品科学,2017,38(3):88-93.
YANG Y R,HU X,YANG X Q,et al.Mineral ion chelating activity of enzymatic protein hydrolysates from Decapterus maruadsi muscle[J].Food Science,2017,38(3):88-93.
[18] SUN N,CUI P B,JIN Z Q,et al.Contributions of molecular size,charge distribution,and specific amino acids to the iron-binding capacity of sea cucumber(Stichopus japonicus)ovum hydrolysates[J].Food Chemistry,2017,230:627-636.
[19] 赵谋明, 徐巨才,刘洋,等.秋刀鱼制备黄嘌呤氧化酶抑制肽的工艺优化[J].农业工程学报,2015,31(14):291-297.
ZHAO M M,XU J C,LIU Y,et al.Technology optimization on preparation of XOD inhibition peptide from saury[J].Transactions of the Chinese Society of Agricultural Engineering,2015,31(14):291-297.
[20] 田旭静, 段鹏慧,范三红,等.响应面法优化酶解藜麦糠蛋白制备抗氧化肽工艺[J].食品科学,2018,39(10):158-164.
TIAN X J,DUAN P H,FAN S H,et al.Response surface methodology for optimization of hydrolysis conditions for preparing antioxidant peptides from quinoa bran protein[J].Food Science,2018,39(10):158-164.
[21] 王婷婷.蓝圆鲹蛋白酶解物的制备及其抗氧化活性研究[D].上海:上海海洋大学,2015.
WANG T T.Study on preparation of pound scad(Decapterus maruadsi)protein hydrolysates and its antioxidant activity[D].Shanghai:Shanghai Ocean University,2015.
[22] 何伟炜.金枪鱼黄嘌呤氧化酶抑制肽的分离鉴定及其作用机制初探[D].广州:华南理工大学,2019.
HE W W.Study on identification and mechanism of xanthine oxidase inhibitory peptides from tuna protein[D].Guangzhou:South China University of Technology,2019.
[23] LI Q Y,KANG X Y,SHI C C,et al.Moderation of hyperuricemia in rats via consuming walnut protein hydrolysates diet and identification of new antihyperuricemic peptides[J].Food and Function,2018,9(1):107-116.
[24] VATTEM D A,MAHONEY R R.Production of dialysable iron by in vitro digestion of chicken muscle protein fractions:The size of the dialysable iron[J].Journal of the Science of Food and Agriculture,2005,85(9):1 537-1 542.
[25] TORRES-FUENTES C,ALAIZ M,VIOQUE J.Iron-chelating activity of chickpea protein hydrolysate peptides[J].Food Chemistry,2012,134(3):1 585-1 588.
[26] CARRASCO-CASTILLA J,HERN NDEZ-
NDEZ- LVAREZ A J,JIMÉN-EZ-MART
LVAREZ A J,JIMÉN-EZ-MART NEZ C,et al.Antioxidant and metal chelating activities of Phaseolus vulgaris L.var.Jamapa protein isolates,phaseolin and lectin hydrolysates[J].Food Chemistry,2012,131(4):1 157-1 164.
NEZ C,et al.Antioxidant and metal chelating activities of Phaseolus vulgaris L.var.Jamapa protein isolates,phaseolin and lectin hydrolysates[J].Food Chemistry,2012,131(4):1 157-1 164.
[27] ZACHARIOU M,HEARN M T W.Application of immobilized metal ion chelate complexes as pseudocation exchange adsorbents for protein separation.[J].Biochemistry,1996,35(1):202-211.
[28] CAETANO-SILVA M E,BERTOLDO-PACHECO M T,PAES-LEME A F,et al.Iron-binding peptides from whey protein hydrolysates:Evaluation,isolation and sequencing by LC-MS/MS[J].Food Research International,2015,71:132-139.
[29] 纪晓雯, 王志耕,阚文翰,等.酪蛋白铁螯合肽的分离纯化及结构解析[J].食品科学,2018,39(6):63-68.
JI X W,WANG Z G,KAN W H,et al.Isolation,purification and structural analysis of iron-binding peptides from casein hydrolysate[J].Food Science,2018,39(6):63-68.
[30] MIZUGUCHI M,FUJISAWA R,NARA M,et al.Fourier-transform infrared spectroscopic study of Ca2+-binding to osteocalcin[J].Calcified Tissue International,2001,69(6):337-342.
[31] YUAN B,ZHAO C,CHENG C,et al.A peptide-Fe(II)complex from Grifola frondosa protein hydrolysates and its immunomodulatory activity[J].Food Bioscience,2019,32:100 459.
[32] WU W F,LI B F,HOU H,et al.Identification of iron-chelating peptides from pacific cod skin gelatin and the possible binding mode[J].Journal of Functional Foods,2017,35:418-427.