长期的高钠盐饮食是心血管疾病的主要诱发因素之一,而减少钠盐摄入可有效降低罹患心血管疾病的风险[1]。目前,常使用的食盐替代物(如KCl、CaCl2或MgCl2)会导致食品的感官品质下降,例如风味降低、金属异味增加[2]。因此,如何在减少钠盐的同时又不牺牲食品的味道成为亟需解决的问题。
食源性肽是以食源性蛋白为原料,经过酶解、分离后的蛋白水解产物,具有良好的营养价值、生理活性以及呈味特性[3]。日本科学家TADA首次在酪蛋白水解物的N-端类似物合成过程中发现,Orn-β-Ala·HCl和Orn-Tau·HCl具有与NaCl类似的咸味[4]。不同食品蛋白质来源的短肽,特别是鱼精蛋白[5]、酪蛋白[5]和大黄鱼蛋白[6]来源的肽具有一定的咸味增强作用。但是咸味肽的提取与合成费用十分昂贵,因此不适合实际应用。多肽与还原糖在加热的条件下会发生美拉德反应,其反应产物的滋味显著提升,主要关键呈味物质为分子质量1 k~5 kDa的美拉德肽。食源性多肽与还原糖的美拉德反应后,少量的美拉德肽可使食物更加美味,同时对人体的咸味受体TRPV1t产生增强作用[7-9]。最新研究表明,大豆蛋白[10]、猪血浆蛋白[11]和火鸡肉蛋白[12]来源的美拉德反应产物均有显著的咸味增强效果。
罗非鱼在加工过程中,会产生大量的副产物(如鱼皮、鱼骨、鱼鳞等),约占鱼体重的40%~60%。罗非鱼鱼皮富含胶原,是一种良好的蛋白质资源。此外,由于胶原中含有大量的甘氨酸,因此酶解产生的胶原肽不具有苦味。通过蛋白酶水解结合美拉德反应修饰,有望将罗非鱼鱼皮转化为高附加值的咸味增强肽,同时延伸罗非鱼加工产业链。本研究以罗非鱼鱼皮胶原为原料,通过蛋白酶水解结合美拉德反应修饰制备咸味增强肽,探究不同还原糖种类对所形成的美拉德反应产物的理化性质以及增咸作用的影响,为制备咸味增强肽提供理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼鱼皮胶原(蛋白质含量85.2%),上海鑫汐生物科技有限公司;食品级D-核糖、D-木糖、葡萄糖、氨基葡萄糖(纯度均>99%),深圳一诺食品配料有限公司;食品级蛋白酶A,日本天野酶制品株式会社;食品级NaCl(纯度≥99.1%),重庆市北碚区永辉超市;邻苯二甲醛(o-phthalaldehyde,OPA)(纯度98%)、N-乙酰基-L-半胱氨酸(纯度99%)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),北京索莱宝科技有限公司;L-亮氨酸(纯度99%),瑞士阿达玛斯试剂有限公司;葡萄糖含量检测试剂盒,南京建成生物工程研究所;其他所用试剂均为分析纯。
1.2 主要仪器
F-380荧光分光光度计,天津港东科技发展股份有限公司;UV-6100紫外分光光度计,上海元析仪器有限公司;电热恒温水浴锅,上海齐欣科学仪器有限公司;PB-10 pH计,Sartorius赛多利斯;UltraScan PRO全自动多功能色差仪,美国HunterLab。
1.3 实验方法
1.3.1 美拉德反应产物的制备
参考FU等[11]的方法。加水调整底物蛋白质质量浓度至50 g/L,调节pH至7.0、温度50 ℃,加入蛋白酶A进行水解(水解过程中不调整pH,以避免引入过多的Na+)。反应5 h后,沸水浴灭酶15 min。冷却至室温,离心除去沉淀后,获得胶原肽。按蛋白质与还原糖质量比5∶1,添加不同还原糖(木糖、核糖、氨基葡萄糖和葡萄糖)于胶原肽中,调节pH至7.0,沸水浴反应3 h(经过前期实验优化,反应3 h后的美拉德反应产物具有最高的咸味增强率,同时反应3 h后还原糖已经全部消耗),立即冷却,冷冻干燥后用于后续分析。选择未糖基化的胶原肽作为对照组。
1.3.2 pH和色泽变化的测定
利用pH计测定不同美拉德反应产物的pH值。
采用色差仪来测定美拉德反应产物的L*(亮度值)、a*(红度值)、b*(黄度值),以超纯水作为空白组,总色差(ΔE)按公式(1)计算:
(1)
1.3.3 游离氨基含量测定
采用OPA法测定美拉德反应产物中游离氨基含量[13]。OPA试剂由10 mL 50 mmol/L的OPA,10 mL 50 mmol/L的N-乙酰基-L-半胱氨酸,5 mL 200 mg/mL的SDS和75 mL 100 mmol/L硼酸盐缓冲液(pH 9.5)组成。OPA测定由10 μL样品(或标准品)与1.2 mL OPA试剂混合,室温反应10 min,通过紫外可见分光光度计测定其在340 nm波长处的吸光值。使用亮氨酸标准溶液绘制标准曲线,吸光值转换为亮氨酸质量浓度当量(μg/mL),按公式(2)计算:
y=0.000 4x+0.051 3(R2=0.999 2)
(2)
式中:x,亮氨酸质量浓度,μg/mL;y,吸光值(A)。
1.3.4 光谱法分析美拉德反应产物
1.3.4.1 紫外光谱分析
采用紫外光谱法分析美拉德反应的程度。美拉德反应产物用超纯水稀释至5 g/L,利用紫外分光光度计在波长为200~500 nm范围内进行紫外光谱扫描。
1.3.4.2 荧光光谱分析
采用荧光光谱法分析美拉德反应的程度。美拉德反应产物用超纯水稀释至5 g/L,借助荧光分光光度计在激发波长为347 nm,发射波长为370~600 nm范围内进行荧光光谱扫描。
1.3.5 分子排阻色谱分析美拉德反应产物
采用Ultimate 3000高效液相色谱系统分析美拉德反应产物的分子质量分布[14]。色谱柱为Phenomenex BioSepTM SEC-S2000。洗脱液为乙腈/水/三氟乙酸。进样体积10 μL,流速0.5 mL/min,检测波长214 nm。采用Chromeleon软件分析色谱数据,美拉德肽的分子质量分布采用标准样品与洗脱体积拟合方程计算。采用以下标准Trp(204 Da),GLV(287 Da),SGNIGFPGPK(1 114 Da)、胰岛素(5 700 Da)和肌红蛋白(17 600 Da),获得分子质量校准曲线,按公式(3)计算:
lg MW=-0.608 6t+6.938 1
(3)
式中:MW,分子质量,Da;t,洗脱时间,min。
1.3.6 美拉德产物的增咸特性评估
1.3.6.1 咸味强度标准曲线
根据文献[15],建立9人感官评价小组,感官评价员均具有2年以上的食品感官评价经验,对不同还原糖美拉德反应产物的增咸作用进行评价。首先,小组成员对3位数随机编码的5种不同浓度NaCl溶液(0.017、0.051、0.085、0.119、0.153 mol/L)进行咸味强度评分(0=无,14=极强),进而建立评价标准尺度。根据每位小组成员对各浓度NaCl溶液进行评分,得出各浓度溶液咸味强度平均值,绘制NaCl溶液浓度与咸味强度的标准曲线。
1.3.6.2 咸味强度评价
配制不同还原糖美拉德反应产物(10 g/L)溶液,加入一定量NaCl,使NaCl终浓度为0.051 mol/L。选择0.051 mol/L的NaCl溶液为对照,通过感官评价分析不同还原糖美拉德反应产物的咸味增强率。样品采用3位数随机编码,取15 mL置于黑色品饮杯中,随机顺序呈送给各评价员,评价其咸味强度,根据标准曲线方程计算其咸味增强率,按公式(4)计算:
咸味增强率![]()
(4)
式中:x1,0.051 mol/L NaCl溶液咸味强度(5.44);x2,样品咸味强度。
1.3.7 数据处理
每组试验重复3次,结果以平均值±标准差来表示。采用SPSS 22.0对实验数据进行单因素方差分析和Pearson相关性分析,并用Duncan法进行事后多重比较(P<0.05代表有显著性差异,P>0.05代表无显著性差异)。
2 结果与分析
2.1 美拉德反应产物的pH和色泽变化
美拉德反应过程中会发生一系列的化学反应,引起反应产物pH和色泽的变化[16]。不同还原糖美拉德反应产物的pH呈不同程度的下降,分别下降至6.23(核糖)、6.35(氨基葡萄糖)、6.69(木糖)和6.95(葡萄糖)。由于美拉德反应过程中会产生一些酸性物质(乙酸等),同时美拉德反应会消耗胶原肽的氨基,进而导致反应体系的pH下降。
美拉德反应高级阶段会生成类黑精等褐色物质,引起反应产物色泽的变化。不同还原糖与胶原肽的美拉德反应产物的色差值如表1所示。与对照组相比,核糖美拉德反应产物a*值和L*值变化显著。不同还原糖美拉德反应产物的b*值呈现上升的趋势,表明美拉德反应产物具有明显的黄色特征。此外,不同还原糖美拉德反应产物的总色差(ΔE*)变化趋势为核糖(14.19)>氨基葡萄糖(5.40)>木糖(3.65)>葡萄糖(0.31),这与pH值变化趋势一致,其中核糖导致美拉德产物的褐变最强烈,主要由于核糖作为五碳糖,比六碳糖具有更高的反应活性[17]。
表1 不同还原糖与胶原肽的美拉德反应产物的色差值
Table 1 Color changes of Maillard reaction products from different reducing sugars and collagen peptides
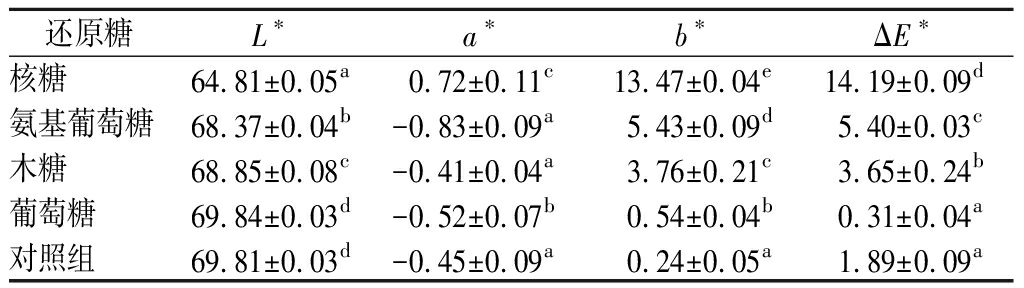
还原糖L*a*b*ΔE*核糖64.81±0.05a0.72±0.11c13.47±0.04e14.19±0.09d氨基葡萄糖68.37±0.04b-0.83±0.09a5.43±0.09d5.40±0.03c木糖68.85±0.08c-0.41±0.04a3.76±0.21c3.65±0.24b葡萄糖69.84±0.03d-0.52±0.07b0.54±0.04b0.31±0.04a对照组69.81±0.03d-0.45±0.09a0.24±0.05a1.89±0.09a
4种还原糖对应的胶原肽美拉德反应产物如图1所示,该结果与总色差结果一致,即核糖颜色最深,而葡萄糖颜色最浅。

图1 四种还原糖与胶原肽的美拉德反应产物的照片
Fig.1 The photo of Maillard reaction products from four reducing sugars and collagen peptides
2.2 游离氨基含量变化
在美拉德反应过程中,肽的游离氨基与体系中还原糖的羰基发生反应,造成氨基的损失[17]。游离氨基含量的减少,可间接地反应出美拉德反应的程度。图2结果表明,与对照组相比,除氨基葡萄糖,其他还原糖美拉德反应产物的游离氨基浓度显著下降(P<0.05),该结果与JIANG等[18]的结果一致,即美拉德反应后,其反应产物的游离氨基含量下降。氨基葡萄糖与胶原肽的美拉德反应产物游离氨基浓度显著高于对照组(P<0.05),主要是由于其自身含有氨基,造成其反应产物样品浓度高于胶原肽对照组。
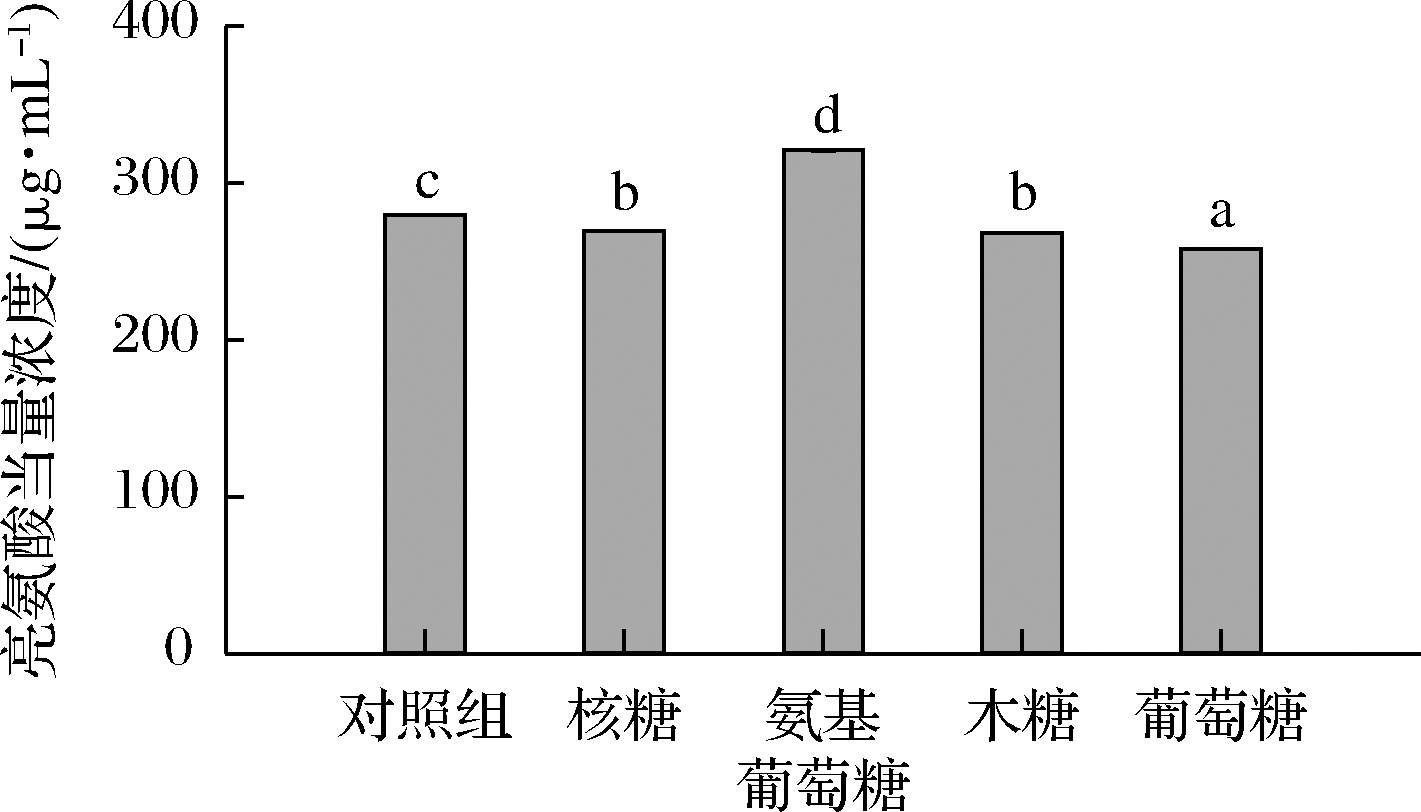
图2 不同还原糖与胶原肽的美拉德反应产物的游离氨基含量
Fig.2 Free amino content of Maillard reaction products from collagen peptides reacted with different reducing sugars
注:不同小写字母表示具有显著性差异(P<0.05)(下同)
在本研究中,其他3种还原糖导致游离氨基下降的顺序为核糖>木糖>葡萄糖。
2.3 紫外、荧光光谱分析
紫外扫描光谱法可用于监测美拉德反应的进程[19]。320 nm处的吸光值可用于衡量美拉德反应中间产物的形成,而420 nm处的吸光值常用于衡量美拉德反应终末产物(类黑精等)的形成[12]。在本研究中,不同还原糖美拉德反应产物的紫外扫描光谱如图3所示。与对照组相比,美拉德反应产物在280~420 nm具有更高的吸光值,其大小顺序为核糖>氨基葡萄糖>木糖>葡萄糖。核糖和氨基葡萄糖在320和420 nm处具有更高的吸光值,说明他们在美拉德反应过程中产生了更多的中间产物和终末产物,该结果与pH和色泽分析结果高度相关。在相同反应条件下,五碳糖的反应速率大于六碳糖,进而形成了更多的美拉德反应中间产物和终末产物[20]。核糖作为一种五碳糖,具有极强的反应速率。因此,本研究中核糖美拉德反应产物具有较高的反应程度。
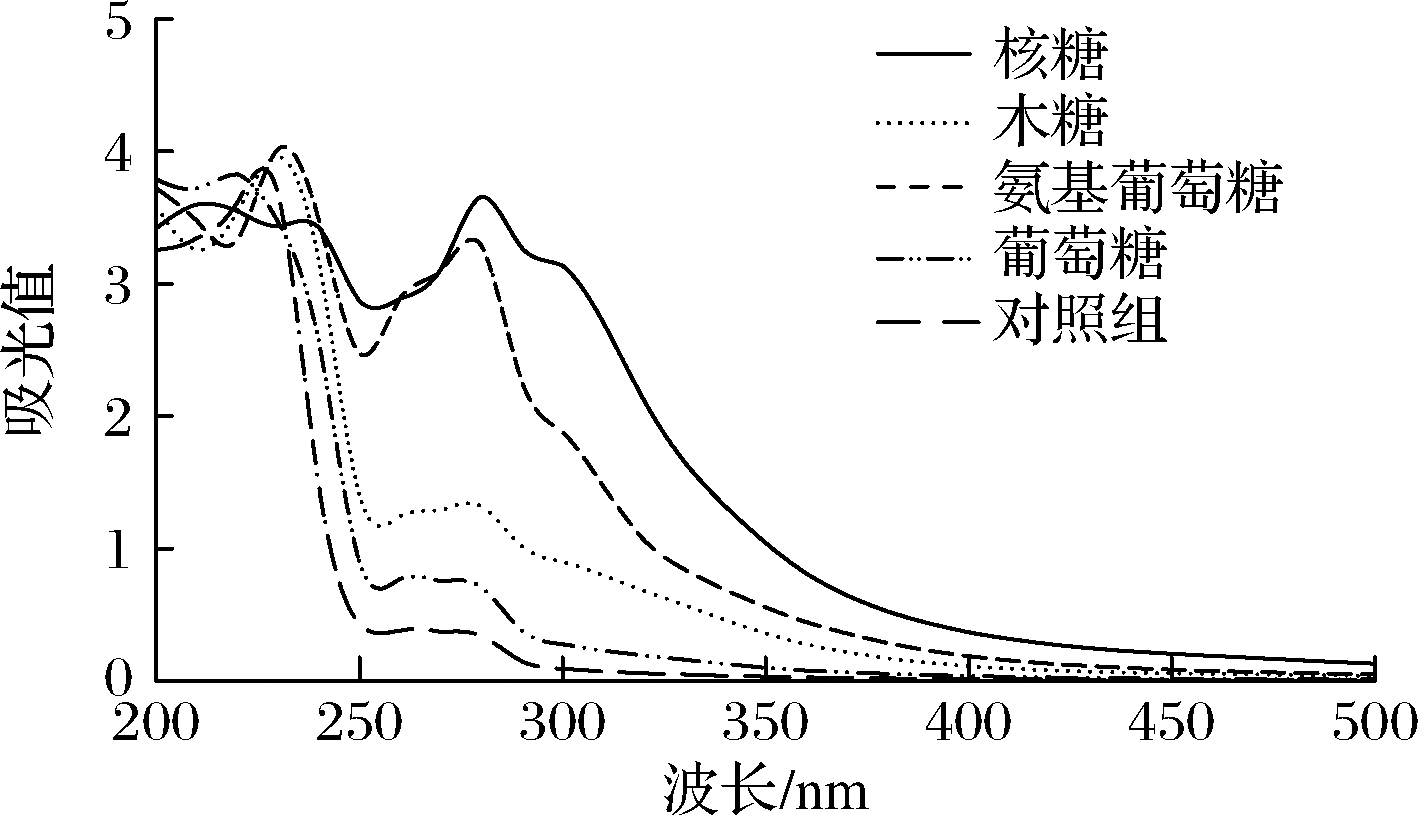
图3 不同还原糖与胶原肽的美拉德产物紫外吸收光谱图
Fig.3 UV absorption spectra of Maillard reaction products from collagen peptides reacted with different reducing sugars
荧光扫描光谱法可用于评估美拉德反应产生的小分子荧光产物[12,21]。不同还原糖美拉德反应产物的荧光扫描光谱图见图4。总体而言,与对照组相比,各个反应产物在400~550 nm具有更高的荧光强度(最大荧光强度λ=430 nm),说明形成了具有荧光吸收的美拉德反应产物。不同还原糖的美拉德反应产物荧光强度大小顺序为氨基葡萄糖>木糖>核糖>葡萄糖。其中,氨基葡萄糖美拉德反应产物具有更多的荧光物质(与紫外扫描光谱结果类似),主要是由于形成的美拉德反应中间产物具有荧光特性,可以作为褐色类黑精等物质前体,所以美拉德体系中荧光强度与紫外光吸收强度表现出不同趋势[22]。
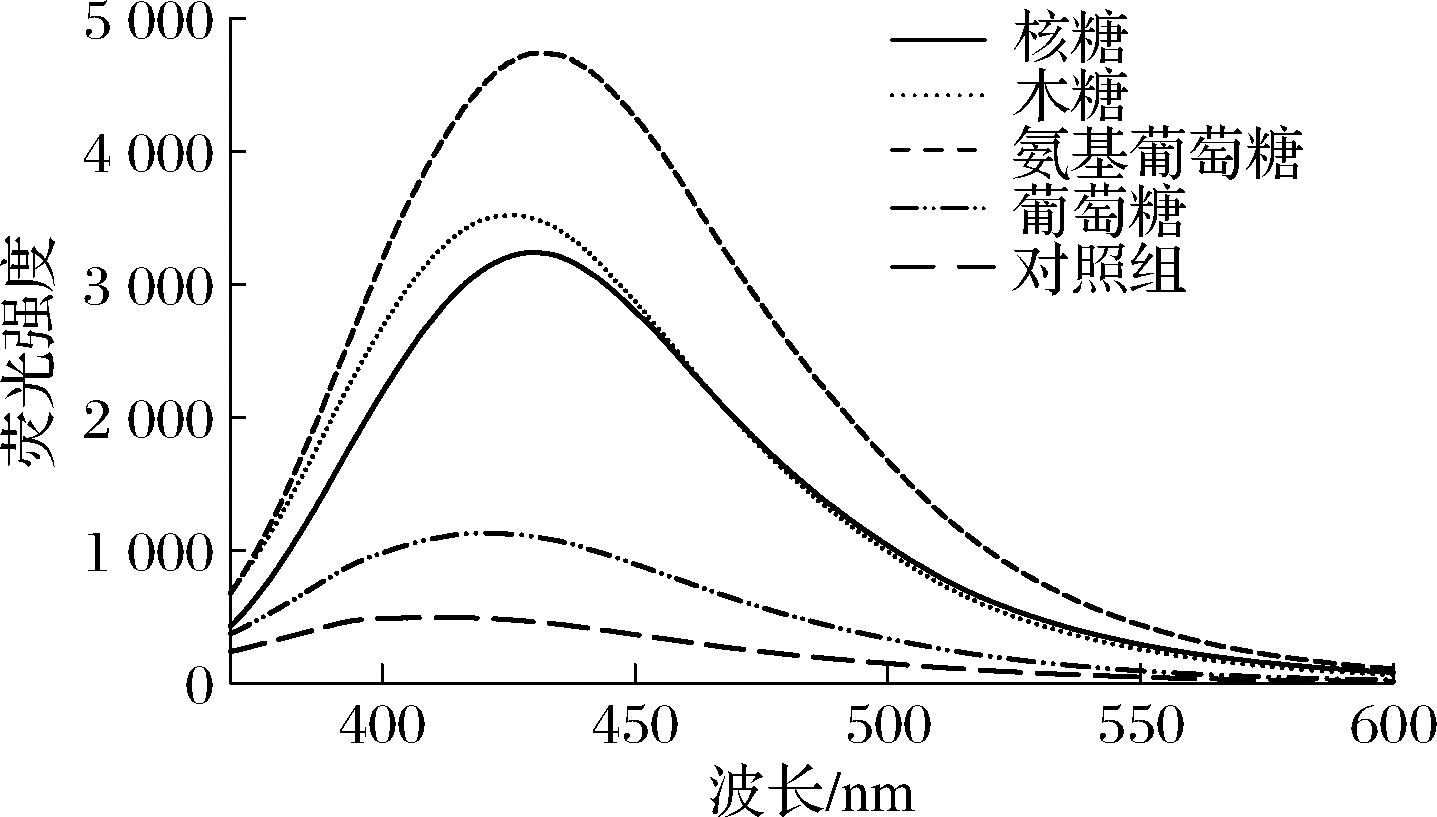
图4 不同还原糖与胶原肽的美拉德产物荧光光谱图
Fig.4 Fluorescence spectra of Maillard reaction products from collagen peptides reacted with different reducing sugars
2.4 分子质量分布
采用分子排阻色谱分析美拉德反应产物的分子质量分布,结果如图5所示。与对照组相比,不同还原糖美拉德反应产物的分子质量分布变化不显著,其中分子质量<1 kDa肽组分略有下降,主要归因于低分子质量的小肽具有较高反应活性,参与美拉德反应后比例降低[11]。1 k~5 kDa的美拉德肽组分比例增加不显著(P>0.05),可能是由于交联反应以及分子质量>5 kDa的肽组分降解导致。还原糖美拉德反应产物的分子质量变化不显著,主要是由于各实验组中热降解和交联同时发生,达到了一个动态平衡状态[22-25]。值得一提的是,分子质量为1 k~5 kDa的美拉德肽可以作为风味增强物质,有助于增加食物的咸味强度[9]。FU等[11,14]研究表明,猪肌肉蛋白水解物与氨基葡萄糖的美拉德反应产物的分子质量分布比例与水解物之间无显著差异。美拉德反应产物具有更高比例的1 k~5 kDa肽组分,是否能提高其咸味增强特性,需要进行感官实验来进一步验证。
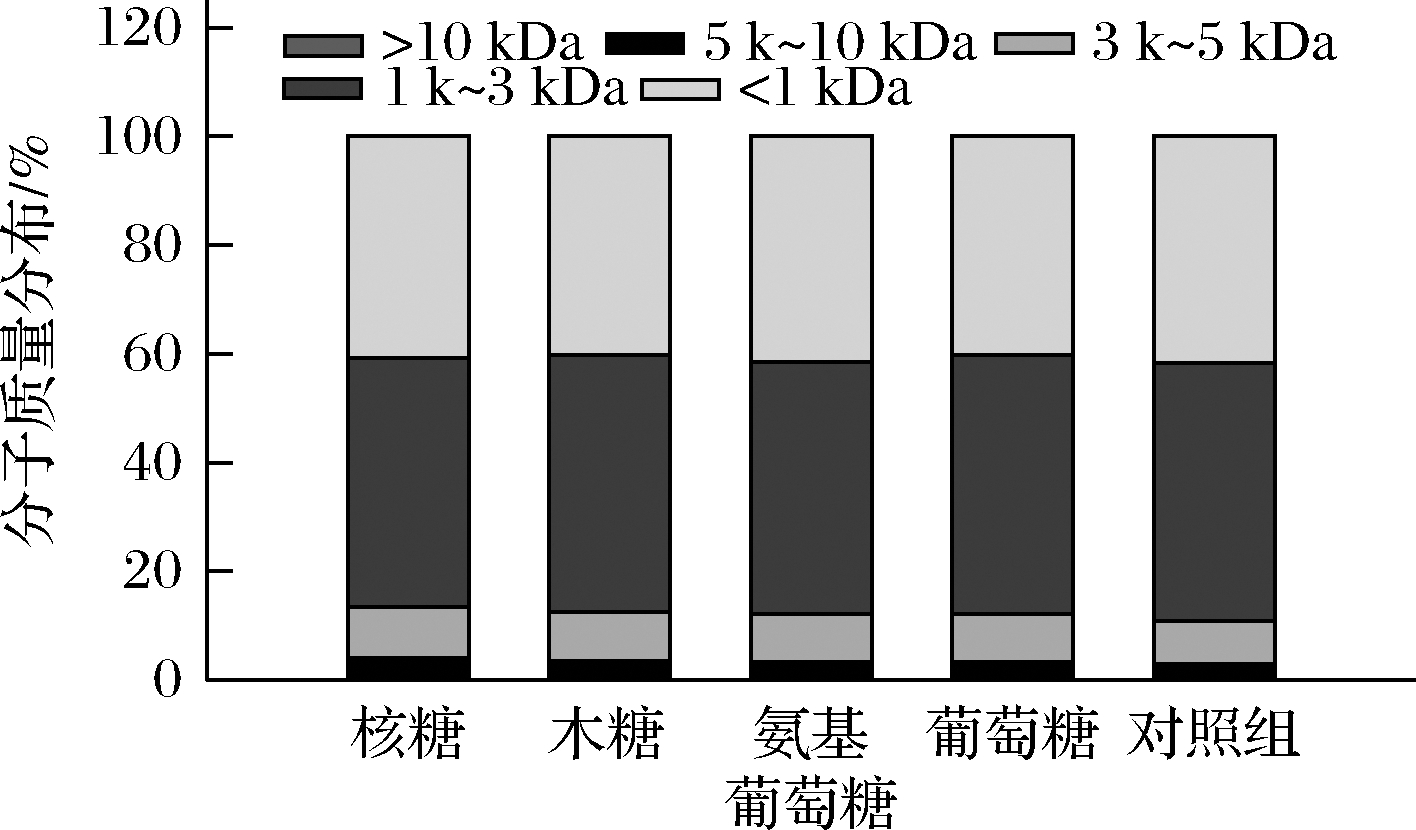
图5 不同还原糖与胶原肽的美拉德产物的分子质量分布
Fig.5 Molecular weight distribution of Maillard reaction products from collagen peptides reacted with different reducing sugars
2.5 咸味增强作用评价
根据不同NaCl溶液浓度与咸味强度绘制标准曲线为y=75.49x+1.716 7,R2=0.980 4。将4种还原糖美拉德反应产物加入NaCl溶液后(终质量浓度为10 mg/mL),其咸味强度评价结果见表2。总体而言,4种还原糖美拉德反应的产物呈现出不同的增咸效果。木糖、核糖及氨基葡萄糖经过美拉德反应后均具有一定咸味增强作用,然而不同还原糖间差异不显著(P>0.05)。与NaCl对照溶液(51 mmol/L)相比,木糖、核糖和氨基葡萄糖美拉德反应产物的咸味增强率分别为8.64%、6.25%和18.01%,其中氨基葡萄糖增咸效果显著(P<0.05),可能是由于氨基葡萄糖具有较高的反应速率。
表2 不同还原糖与胶原肽的美拉德反应产物的咸味增强率
Table 2 Salt taste-enhancing rate of Maillard reaction products from different reducing sugars and collagen peptides

还原糖木糖核糖氨基葡萄糖葡萄糖对照组咸味强度5.91±1.87ab5.78±1.86ab6.42±1.25a5.24±1.17ab4.61±1.78b咸味增强率/%8.646.2518.01-3.68-15.26
注:不同字母代表不同样品咸味强度具有显著性差异(P<0.05)
在前期实验中,以葡萄糖为例,测定美拉德反应3 h后葡萄糖的消耗量超过91.5%。该结果表明,在温度100 ℃、胶原肽与葡萄糖添加质量比例为5∶1、反应时间3 h,绝大部分葡萄糖被消耗。在相同的美拉德反应条件下,4种还原糖的反应活性为核糖>氨基葡萄糖>木糖>葡萄糖,考虑到其他3种还原糖比葡萄糖具有更强的反应活性,因此在美拉德反应过程中完全消耗。此外,本研究美拉德反应中蛋白质与还原糖质量比为5∶1,因此体系中糖含量较低,加之它们的甜度值也较低(核糖没有甜味),即使有剩余,对反应产物的咸味影响很小。
本实验结果与之前研究结果一致,即不同还原糖美拉德反应产物对人咸味受体TRPV1t产生不同增强作用,增咸趋势为氨基葡萄糖>木糖>葡萄糖[7]。课题组前期研究表明,猪血浆蛋白水解物与氨基葡萄糖的美拉德反应产物能够起到一定的增咸作用,其主要原因是反应产物中含有咸味增强作用的美拉德肽(1 k~5 kDa),但是其确切的增咸分子机制尚未阐明。王欣等[26]发现双酶酶解哈氏仿对虾蛋白可将其酶解产物的感官咸味强度从10 mmol/L NaCl 提高至55 mmol/L NaCl。陈瑞霞等[27]研究发现,淘汰蛋鸡蛋白酶解物可将50 mmol/L NaCl 溶液的咸味强度提升26.2%。本研究中氨基葡萄糖美拉德反应产物有望作为咸味增强物质在食品领域应用,然而其确切的增咸构效关系有待进一步研究。
3 结论
探究核糖、木糖、葡萄糖和氨基葡萄糖对鱼皮胶原肽美拉德反应产物的理化性质和咸味增强作用的影响,发现4种还原糖得到的美拉德反应产物具有不同的理化特性及增咸作用,其中氨基葡萄糖美拉德反应产物的增咸效果显著。4种还原糖美拉德反应产物pH和游离氨基含量呈下降趋势,核糖和氨基葡萄糖胶原肽美拉德反应产物总色差变化显著。氨基葡萄糖-胶原肽美拉德反应产物形成了大量的中间产物和终末产物。美拉德反应产物中1 k~5 kDa肽组分比例增加,主要是形成具有咸味增强作用的美拉德肽。不同美拉德反应产物具有不同的咸味增强作用,其趋势为氨基葡萄糖>木糖>核糖>葡萄糖,其中氨基葡萄糖美拉德反应产物的咸味增强作用最佳,能够将51 mmol/L的NaCl溶液的咸味感知强度提高18%。然而,美拉德反应产物的构效关系以及确切的增咸机制有待进一步研究。
[1] DINICOLANTONIO J J,O’KEEFE J H.Salt and hypertension:What do we know?[J].Current Opinion in Cardiology,2018,33(4):377-381.
[2] INGUGLIA E S,ZHANG Z H,TIWARI B K,et al.Salt reduction strategies in processed meat products-a review[J].Trends in Food Science & Technology,2017,59:70-78.
[3] FU Y,ZHANG Y,SOLADOYE O P,et al.Maillard reaction products derived from food protein-derived peptides:Insights into flavor and bioactivity[J].Critical Reviews in Food Science and Nutrition,2019,60(20):3 429-3 442.
[4] TADA M,SHINODA I,OKAI H.L-Ornithyltaurine,a new salty peptide[J].Journal of Agricultural and Food Chemistry,1984,32(5):992-996.
[5] SCHINDLER A,DUNKEL A,ST HLER F,et al.Discovery of salt taste enhancing arginyl dipeptides in protein digests and fermented fish sauces by means of a sensomics approach[J].Journal of Agricultural and Food Chemistry,2011,59(23):12 578-12 588.
HLER F,et al.Discovery of salt taste enhancing arginyl dipeptides in protein digests and fermented fish sauces by means of a sensomics approach[J].Journal of Agricultural and Food Chemistry,2011,59(23):12 578-12 588.
[6] 李微,苏国万,孙为正.酶解大黄鱼制备咸味增强肽的研究[J].现代食品科技,2019,35(6):184-190.
LI W,SU G W,SUN W Z.Study on characteristics of salt-enhanced peptides prepared by enzymatic hydrolysis of Larimichthys crocea[J].Modern Food Science and Technology,2019,35(6):184-190.
[7] KATSUMATA T,NAKAKUKI H,TOKUNAGA C,et al.Effect of Maillard reacted peptides on human salt taste and the amiloride-insensitive salt taste receptor(TRPV1t)[J].Chemical Senses,2008,33(7):665-680.
[8] CHATTERTON D E W,AAGAARD S,HANSEN T H,et al.Bioactive proteins in bovine colostrum and effects of heating,drying and irradiation[J].Food & Function,2020,11(3):2 309-2 327.
[9] OGASAWARA M,KATSUMATA T,EGI M.Taste properties of Maillard-reaction products prepared from 1 000 to 5 000 Da peptide[J].Food Chemistry,2006,99(3):600-604.
[10] ZHANG Z Y,ELFALLEH W,HE S D,et al.Heating and cysteine effect on physicochemical and flavor properties of soybean peptide Maillard reaction products[J].International Journal of Biological Macromolecules,2018,120:2 137-2 146.
[11] FU Y,LIU J,ZHANG W,et al.Exopeptidase treatment combined with Maillard reaction modification of protein hydrolysates derived from porcine muscle and plasma:Structure-taste relationship[J].Food Chemistry,2020,306:125 613.
[12] HONG P K,NDAGIJIMANA M,BETTI M.Glucosamine-induced glycation of hydrolysed meat proteins in the presence or absence of transglutaminase:chemical modifications and taste-enhancing activity[J].Food Chemistry,2016,197:1 143-1 152.
[13] FU Y,LIU J,HANSEN E T,et al.Structural characteristics of low bitter and high umami protein hydrolysates prepared from bovine muscle and porcine plasma[J].Food Chemistry,2018,257:163-171.
[14] FU Y,BAK K H,LIU J,et al.Protein hydrolysates of porcine hemoglobin and blood:Peptide characteristics in relation to taste attributes and formation of volatile compounds[J].Food Research International,2019,121:28-38.
[15] HONG LE BAO T,CHAISERI S,LORJAROENPHON Y.Potential of Szechuan pepper as a saltiness enhancer[J].International Journal of Food Properties,2018,21(1):533-545.
[16] WEI C K,NI Z J,THAKUR K,et al.Color and flavor of flaxseed protein hydrolysates Maillard reaction products:Effect of cysteine,initial pH,and thermal treatment[J].International Journal of Food Properties,2019,22(1):84-99.
[17] HEMMLER D,ROULLIER-GALL C,MARSHALL J W,et al.Insights into the chemistry of non-enzymatic browning reactions in different ribose-amino acid model systems[J].Scientific Reports,2018,8(1):16 879.
[18] JIANG Z,WANG L,WU W,et al.Biological activities and physicochemical properties of Maillard reaction products in sugar-bovine casein peptide model systems[J].Food Chemistry,2013,141(4):3 837-3 845.
[19] OGUTU B,KIM Y J,KIM D W,et al.Optimization of Maillard reaction between glucosamine and other precursors by measuring browning with a spectrophotometer[J].Preventive Nutrition and Food Science,2017,22(3):211-215.
[20] DELAROQUE D,INISAN C,BERGER C,et al.Kinetic study on the Maillard reaction.Consideration of sugar reactivity[J].Food Chemistry,2008,111(4):1 032-1 042.
[21] MATIACEVICH S B,PILAR BUERA M.A critical evaluation of fluorescence as a potential marker for the Maillard reaction[J].Food Chemistry,2006,95(3):423-430.
[22] HRYNETS Y,NDAGIJIMANA M,BETTI M.Studies on the Formation of Maillard and caramelization products from glucosamine incubated at 37 ℃[J].Journal of Agricultural and Food Chemistry,2015,63(27):6 249-6 261.
[23] SONG C L,ZHAO X H.Structure and property modification of an oligochitosan-glycosylated and crosslinked soybean protein generated by microbial transglutaminase[J].Food Chemistry,2014,163:114-119.
[24] LAN X H,LIU P,XIA S Q,et al.Temperature effect on the non-volatile compounds of Maillard reaction products derived from xylose-soybean peptide system:Further insights into thermal degradation and cross-linking[J].Food Chemistry,2010,120(4):967-972.
[25] SU G W,CUI C,REN J Y,et al.Effect of xylose on the molecular and particle size distribution of peanut hydrolysate in Maillard reaction system[J].Journal of the Science of Food and Agriculture,2011,91(13):2 457-2 462.
[26] 王欣, 安灿,陈美龄,等.酶水解哈氏仿对虾蛋白提高咸味的研究[J].中国调味品,2017,42(5):12-16.
WANG X,AN C,CHEN M L,et al.Enzymatic hydrolysis of Parapenaeopsis hardwickii(Miers)protein for enhancing saltiness[J].China Condiment,2017,42(5):12-16.
[27] 陈瑞霞,孙思远,相悦,等.以淘汰蛋鸡为原料利用蛋白酶解技术制备咸味增强肽[J].食品与发酵工业,2020,46(1):166-171.
CHEN R X,SUN S Y,XIANG Y,et al.Optimization of enzymatic hydrolysis for rejected hen protein for salt-enhanced peptides preparation[J].Food and Fermentation Industries,2020,46(1):166-171.