发酵香肠是指碎肉和丁状脂肪同盐、糖、香辛料及其他辅料等混合灌入肠衣后,经微生物发酵及干燥成熟后形成的一种发酵肠类制品[1],按加工过程中脱水程度和水分含量可分为半干发酵香肠和干发酵香肠。其中半干发酵香肠的最终pH值为4.8~5.3,水分含量在50%以上,且需要冷藏。在发酵香肠生产过程中往往需要添加亚硝酸盐,以促进发色、抑菌及改善肉制品品质等[2],同时还起到有效的抗氧化作用。亚硝酸盐自身毒性较强,且能在腌制过程中与肉制品中的胺类物质发生反应,产生具有潜在致癌性的亚硝胺类物质[3]。为了提高食品的安全性,国内外的研究学者都在致力于寻找一种天然无毒的亚硝酸盐替代品[4-5]。
玫瑰中的营养物质丰富,含300多种化学成分,其中花色素和黄酮类化合物含量较丰富[6]。玫瑰花色素有良好的着色效果,尤其是酸性环境下,稳定性更好,可经受一般食品的加工条件[7],同时玫瑰花色素还有清除亚硝酸盐的作用[8];冯作山等[9]研究发现从玫瑰花渣中提取的总黄酮含量高达3.34%,黄酮类物质在抗氧化、抑菌、抗肿瘤、抗炎等方面有显著的功效[10]。玫瑰含有大量鞣酸,苦涩味较重,目前在肉制品领域上运用较少,本实验采用糖渍浸提法提取玫瑰有效成分,并通过响应面法优化提取工艺,利用玫瑰红色素的着色及黄酮类抗氧化等作用,与亚硝酸钠复配后添加于肉制品中,旨在改善发酵肉制品色泽并降低其亚硝酸盐残留量,提高发酵肉制品的安全性。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉、猪背膘、味精、食盐、蔗糖、葡萄糖、白胡椒粉、五香粉、豆蔻粉、姜粉,当地青义镇家多乐超市;新鲜墨红玫瑰花,云南红河;SBM-52菌株(肉葡萄球菌+木糖葡萄球菌+乳酸片球菌+戊糖片球菌),意大利SACCO公司。
芦丁标准品,成都曼思特生物科技有限公司;硝酸铝、氢氧化钠、亚铁氰化钾、乙酸锌、碘化钾、四硼酸钠、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠,成都科龙试剂厂;柠檬酸(食品级),河南万邦实业有限公司;复合磷酸盐(食品级),徐州恒世食品有限公司。
1.2 仪器与设备
DJQQLS128-C强力台式绞切两用机,如东垣悦食品机械厂;NH 300色差仪(光源为D65),深圳市三恩时科技有限公司;DHG—9053A电热鼓风干燥箱,上海一恒科学仪器有限公司;UV 1000单光束紫外可见光分光光度计,上海天美科学仪器有限公司;HH-S数显恒温水浴锅,浙江金坛市正基仪器有限公司;MJ-L500原汁机,松下电器。
1.3 实验方法
1.3.1 玫瑰液制备与优化
1.3.1.1 工艺流程及要点
工艺流程:原料清洗→晾干→浸提→压榨→过滤→玫瑰汁
取新鲜玫瑰花瓣,洗净晾干后剪碎,与水和蔗糖按试验设计混合,混匀后加入一定质量分数的柠檬酸,因玫瑰花色苷的热稳定性差,当温度超过70 ℃时,花色苷易分解,故本试验的提取温度固定为60 ℃,待浸提结束后用原汁机榨汁,过滤后即得玫瑰液。
1.3.1.2 单因素试验设计
以总黄酮含量、色度值和感官评分为评价指标,探究液花比、糖花比、柠檬酸添加量和提取时间对玫瑰液的品质影响,以初步确定最佳工艺条件的范围。各因素的设置水平如表1所示。
表1 单因素试验中各因素水平表
Table 1 Levels of independent variables in single factor experiments
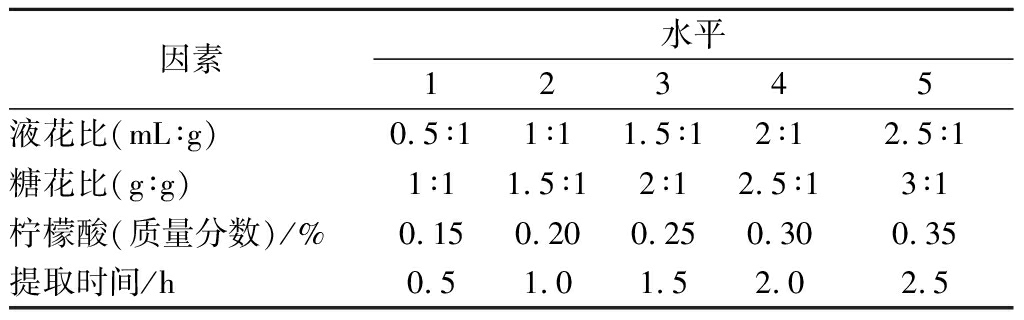
因素水平12345液花比(mL∶g)0.5∶11∶11.5∶12∶12.5∶1糖花比(g∶g)1∶11.5∶12∶12.5∶13∶1柠檬酸(质量分数)/%0.150.200.250.300.35提取时间/h0.51.01.52.02.5
1.3.1.3 Box-Benhnken优化试验设计
结合单因素试验结果,选出指标较好的水平,同时将总黄酮、色度值、感官评分通过几何加权法进行量纲统一归一化,并依据各指标重要性得到综合指标Y,并以此为响应值,用响应面软件对数据进行多项回归拟合及模型进行方差分析,探究其最佳提取工艺。
1.3.2 发酵香肠的制作
1.3.2.1 基础配方
新鲜猪后腿肉和猪背膘(肥瘦肉质量比2∶8),其他成分均以肉的质量计,食盐2%、蔗糖1%、葡萄糖0.8%、复合磷酸盐0.2%、豆蔻粉0.06%、料酒2%、味精0.1%、姜粉0.1%、五香粉0.1%、白胡椒粉0.1%(均为质量分数),亚硝酸钠及玫瑰液根据实验设计添加,水分添加量控制在原料肉质量的20%以内。
1.3.2.2 工艺流程及操作要点
工艺流程:原料肉处理→绞碎→腌制→菌液制备→接种→灌肠→发酵→烟熏→干燥→成品检验
选择新鲜猪后腿肉和猪背膘,将猪背膘切成薄片于-18 ℃下预冻,将瘦肉切成块后和预冻好的背膘一同搅碎;加入各种调味料和辅料并搅匀,于4 ℃腌制24 h;将5 g脱脂奶粉和0.75 g葡萄糖溶于50 mL水中,加入1.0 g SBM-52菌粉,混匀后于常温下活化2 h;对腌制后的原料接种发酵剂,确保活菌数在107 CFU/g以上;将原料灌入肠衣中,用牙签排除香肠内的气体,每隔15~20 cm打一线结,最后放入温水中洗去表面的油污杂质;在温度为30 ℃,湿度为80%的条件下发酵,当pH值下降至5.1左右时停止发酵;用烟熏炉40 ℃熏制45 min,随后于65 ℃干燥150 min;将成品真空包装并冷藏24 h后测定其亚硝酸盐残留、色差值,蒸煮30 min后做感官评价。
1.3.3 亚硝酸盐及玫瑰液对发酵香肠品质的影响
肉类制品若要抑制肉毒梭菌毒素的产生,在腌制时亚硝酸盐的使用量必须在40 mg/kg以上[11],考虑到安全性,本试验考察亚硝酸钠添加量40~100 mg/kg的基础上,玫瑰液的最佳替代效果。具体试验组的编号及分组情况见表2。
表2 发酵香肠配方及分组情况
Table 2 Recipe and grouping of fermented sausages
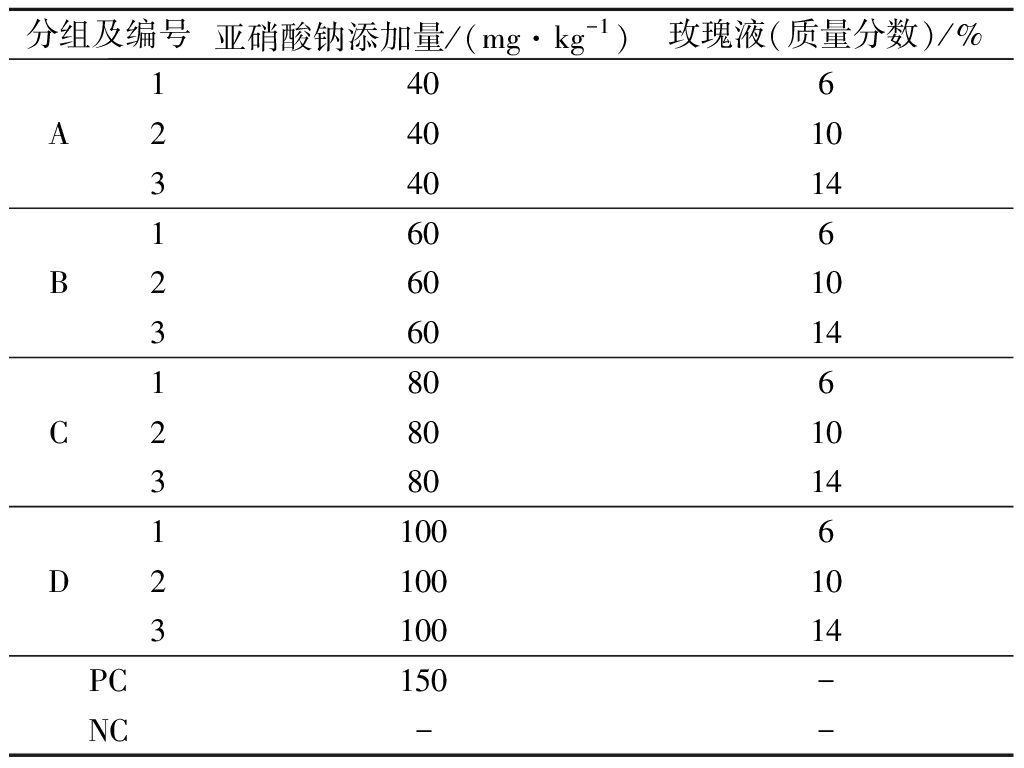
分组及编号亚硝酸钠添加量/(mg·kg-1)玫瑰液(质量分数)/%A14062401034014B16062601036014C18062801038014D11006210010310014PC150-NC--
注:“-”表示不添加
1.3.4 指标测定
1.3.4.1 总黄酮测定
准确量取玫瑰液1.0 mL用蒸馏水定容至50 mL,取4.0 mL用于测定总黄酮,采用改进的硝酸铝-亚硝酸钠显色法[12]进行测定。
1.3.4.2 色度值测定
将样品稀释适宜倍数后离心取上清液于可见光波长范围内进行光谱特征分析,确定其最大吸收波长为520 nm。取待测样品1 mL,定容至25 mL后用分光光度计于波长520 nm处测吸光度,以此作为色度值。
1.3.4.3 玫瑰液感官评价
感官评价由8名食品专业研究生组成,评分标准参考张冰晶等[13]的方法并稍作修改,如表3所示。
表3 玫瑰液感官评分标准
Table 3 Criteria for sensory evaluation of rose extract
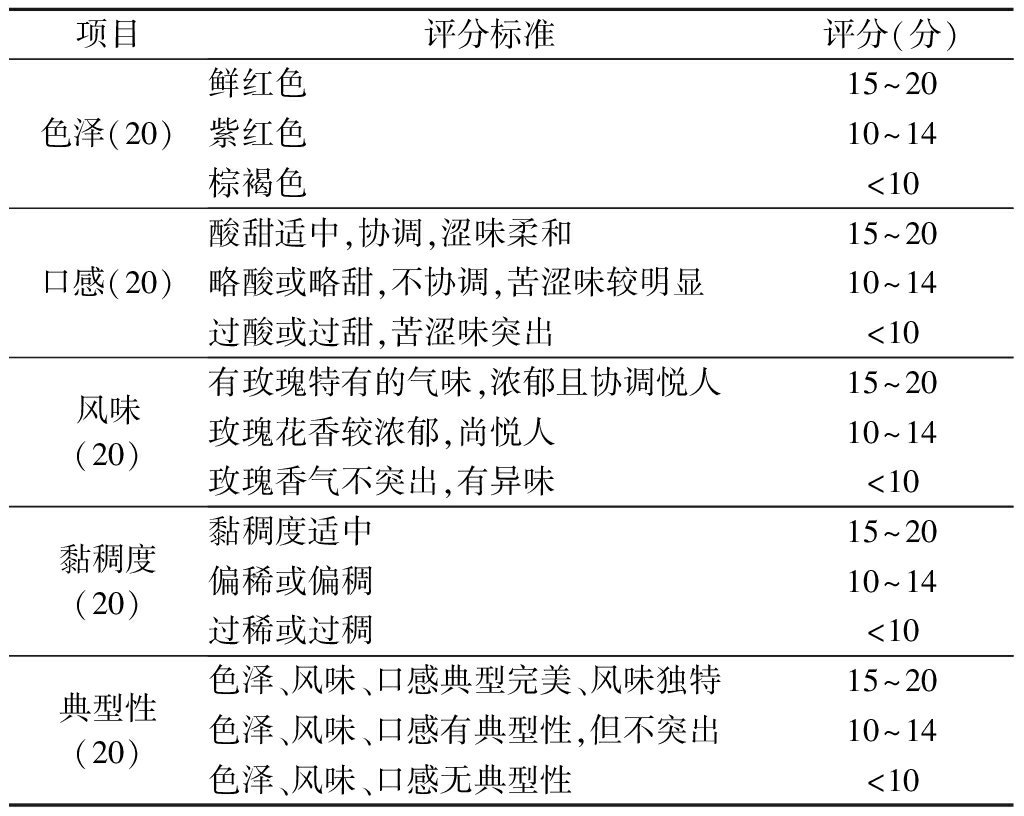
项目评分标准评分(分)色泽(20)鲜红色15~20紫红色10~14棕褐色<10口感(20)酸甜适中,协调,涩味柔和15~20略酸或略甜,不协调,苦涩味较明显10~14过酸或过甜,苦涩味突出<10风味(20)有玫瑰特有的气味,浓郁且协调悦人15~20玫瑰花香较浓郁,尚悦人10~14玫瑰香气不突出,有异味<10黏稠度(20)黏稠度适中15~20偏稀或偏稠10~14过稀或过稠<10典型性(20)色泽、风味、口感典型完美、风味独特15~20色泽、风味、口感有典型性,但不突出10~14色泽、风味、口感无典型性<10
1.3.4.4 综合指标的计算
加权评分的计算方法参照文献[14],几何加权法统一量纲的计算如公式(1)所示:
(1)
式中:Ui为统一量纲值;fimin为测定最小值;fimax为测定最大值。
权重分配解释:玫瑰红色素和总黄酮对试验设计同等重要,故相应的色度值及总黄酮含量的权重系数各分配0.3,蔗糖和柠檬酸添加会使提取液的感官特性发生显著变化,故感官评分的权重系数为0.4。加权后综合指标的计算如公式(2)所示:
综合指标Y=0.3×U1+0.3×U2+0.4×U3
(2)
式中:U1为统一量纲后的总黄酮量纲值;U2为统一量纲后的A520值;U3为统一量纲后的感官评分量纲值。
1.3.4.5 亚硝酸钠的测定
参考国家标准GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》中的分光光度法。
1.3.4.6 色差的测定
色差仪校正后,将香肠切成2 cm厚的切片,用保鲜膜覆盖其表面,用镜口紧贴切面(镜口直径8 mm),测定其亮度值(L*)和红度值(a*),每个样品重复测定6次,取其平均值。
1.3.4.7 发酵香肠感官评价
参考黄金枝等[15]的方法并略作修改。由8位食品专业研究生的组成评定小组,采用盲评计分方式及排序法对香肠的感官指标进行评价。分别从外观、组织状态和口感3个方面进行评定,计分标准:10分制,其中各评定项目中极好为10.0~8.1分,较好为8.0~6.1分,一般为6.0~4.1分,较差为4.0~2.1分,极差为2.0~0分,总分为30分。
1.4 数据处理
使用Excel 2016处理数据,采用Design-Expert 8.0.6软件进行响应面试验设计与分析,用SPSS Statistics 20软件进行显著性分析,同时使用Origin 2018软件作图。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 液花比对玫瑰液品质的影响
由图1可知,当液花比在0.5∶1~1∶1(mL∶g)时,总黄酮含量呈上升趋势,分析原因是由于玫瑰花总黄酮含量丰富,相对溶剂较少,玫瑰花中的总黄酮不能完全溶出,未达到提取的饱和点;当液花比高于1∶1(mL∶g)后,总黄酮含量逐渐降低,可能因为溶剂的增加导致细胞中的其他杂质溶出,同时溶剂也有稀释作用,使得提取的总黄酮含量较低;提取液的色度值变化趋势与总黄酮类似,花色素易溶于水,适当的溶剂有利于花色素的提取,当液花比高于1∶1(mL∶g)时,溶剂增多反而会稀释提取液的花色苷的浓度,并且花色苷分子之间的作用力也会受到削弱,稳定性较差。从感官上来看,当液花比在1∶1(mL∶g)左右时,感官评分较高,过度的稀释会导致整体的风味及口感不理想。综合各指标可确定液花比在0.5∶1~1.5∶1(mL∶g)范围内最佳。

图1 液花比对提取液品质的影响
Fig.1 The effect of water to flowers ratio on the quality of rose extract
2.1.2 糖花比对玫瑰液品质的影响
由图2可知,随着蔗糖添加量的增加,总黄酮的含量直线下降,这是因为蔗糖可以提高渗透压,在高渗透压作用下玫瑰鲜花的汁液和包括黄酮类化合物在内的其他营养成分逐渐溶出,加糖量越多,出汁率越高,加之糖的浓度提高使得提取液总黄酮的相对含量降低,而色度值的变化与总黄酮的变化趋势相反,蔗糖有良好的护色作用,可提高花色素的热稳定性,蔗糖的浓度越大,增强稳定性的效果越明显[16],且蔗糖还具有一定的辅色作用,在提取的过程中随着糖浓度的升高,其渗透压让花色素加速溶出并与糖形成较稳定的结合[17]。当糖花比高于2∶1(g∶g)时,色度值的增长趋势较缓慢,可能由于花色素类物质提取接近饱和。从感官上来讲,当糖花比为2∶1(g∶g)时,蔗糖能有效掩盖住玫瑰厚重的苦涩味,且甜度适宜,当糖分增加时,使得提取液发黏发稠,同时口味甜腻。综合各指标结果,可确定糖花比在1.5∶1~2.5∶1(g∶g)最佳。
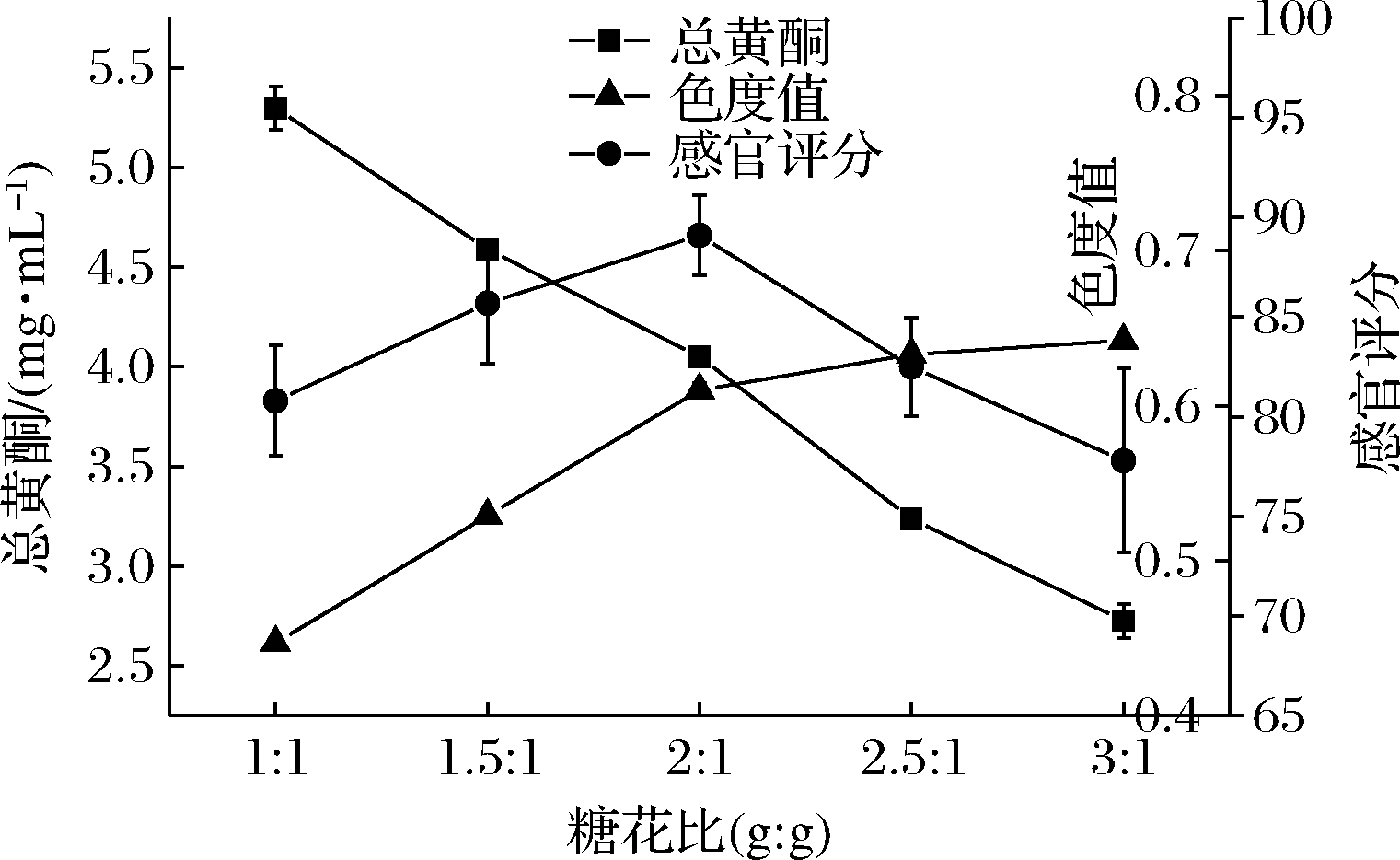
图2 糖花比对提取液品质的影响
Fig.2 The effect of sugar to flowers ratio on the quality of rose extract
2.1.3 柠檬酸对玫瑰液品质的影响
由图3可知,柠檬酸对总黄酮含量的影响不显著,这与陆庆[18]的研究结果相似。色度值与柠檬酸添加量呈正相关,这是因为花色苷在酸性条件下稳定,通过柠檬酸处理玫瑰花可降低细胞液内pH值,增加花色苷在酸性溶液中的溶解度,并使其维持鲜红色的花色烊阳离子结构[19]。然而柠檬酸的添加显著影响提取液的感官特性,从感官结果中可看出,当柠檬酸质量分数在0.30%左右时,感官评分较高,此时提取液酸甜适中,颜色鲜艳。综合各指标结果,可以确定柠檬酸质量分数在0.25%~0.35%最佳。

图3 柠檬酸添加量对提取液品质的影响
Fig.3 The effect of citric acid addition on the quality of rose extract
2.1.4 提取时间对玫瑰液品质的影响
由图4可知,经过1.5 h提取后总黄酮含量达到峰值,随后随时间推移而趋于平缓,是因为在提取的起初阶段,提取液和原料这2个体系间存在浓度差,当提取1.5 h后,这2个体系达到相对平衡的状态,原料中的总黄酮不易溶出,含量趋于稳定。不仅如此,时间的推移还会使其他水溶性的物质溶解,干扰总黄酮的提取。从色度值的变化趋势可以看出提取液中的花色苷的含量在0.5~1.0 h稳定增加,随后较为平缓,最后表现下降趋势,这是由于玫瑰花色苷的热稳定性较差,花色苷的结构易破坏而降解,故提取时间不宜过长。从感官结果来看,在提取1.5 h左右时,提取液的品质较好,色泽及风味较佳。综合各指标结果,可以确定提取时间在1.0~2.0 h最佳。
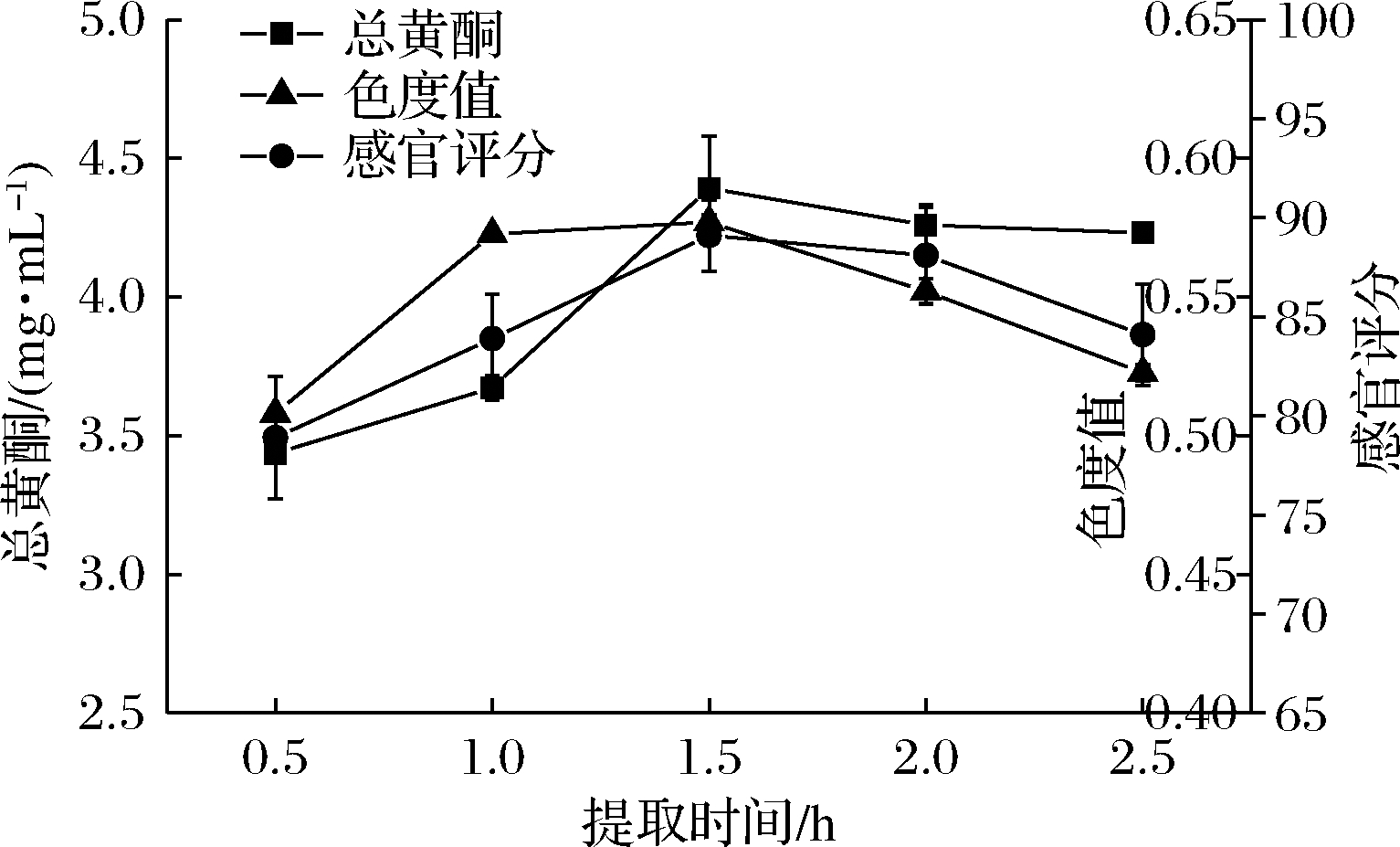
图4 提取时间对提取液品质的影响
Fig.4 The effect of extraction time on the quality of rose extract
2.2 响应面优化提取工艺条件
2.2.1 响应面分析因素水平的选择
根据单因素试验的结果,以液花比(A)、糖花比(B)、柠檬酸(C)及提取时间(D)为自变量,采用4因素3水平的响应面分析方法,试验的因素及水平设计见表4。
表4 响应面因素水平及编码
Table 4 Factors and levels used in response surface design

因素水平-101A液花比(g∶mL)0.5∶11∶11.5∶1B糖花比(g∶g)1.5∶12∶12.5∶1C柠檬酸(质量分数)/%0.250.300.35D提取时间/h1.01.52.0
2.2.2 响应面试验设计与结果
试验设计及结果见表5,将表5中的试验数据进行多元回归分析,可得到回归方程预测模型:Y=0.6-0.094A-0.14B-0.025C+0.027D+0.092AB+0.019AC-0.005AD+0.012BC-0.029BD-0.015CD-0.17A2-0.078B2-0.10C2-0.064D2
表5 响应面试验设计方案及结果
Table 5 Experimental design and results for response surface analysis

试验号ABCD总黄酮/(mg·mL-1)色度值感官评分综合指标110-103.010.45682.200.24120-1014.070.72884.400.6413-10-103.920.62780.400.4594-10103.890.70274.200.3795-11003.350.53776.400.226601013.070.53783.000.325700-1-13.780.50084.400.431800003.460.53492.200.57690-1-103.920.63285.400.5691000113.580.64079.600.402111-1003.180.51381.800.299120-10-14.030.57384.800.5301310013.070.53582.400.3111411002.640.45482.000.1811500-113.620.59285.800.5051600003.520.56892.600.61817001-13.520.52583.200.38718-100-14.020.59078.200.4001910102.950.50280.800.236200-1103.810.67681.800.5092101-103.010.45284.400.2852200003.440.56092.200.5922300003.490.55693.000.6132400003.370.56991.800.58025-10013.980.72877.400.47826-1-1004.710.84179.400.7112701102.950.54281.200.27428010-13.420.45983.600.33229100-13.180.43382.400.253
运用Design-Expert软件对模型进行方差分析,以此来验证回归模型及各个参数的显著度,结果如表6所示,模型的P值为0.000 1<0.01,表明该模型方程极显著,模型失拟项的P值为0.375 8>0.05,表明本试验不存在其他显著影响因素,模型的决定系数R2为98.9%,这说明该模型与实际试验拟合度较高,98.9%的响应值变化可有效通过此模型进行解释。为了验证模型预测结果与实际情况是否相近,利用软件分析得到最优工艺条件,考虑实际生产可操作性,将最佳工艺条件略作修改,修改后的参数为:液花比0.7∶1(mL∶g)、糖花比1.5∶1(g∶g)、柠檬酸质量分数为0.3%、提取时间为1.75 h,在此条件下重复3次试验,所得的综合指标平均结果为0.716,与预测理论值相近,其相对误差约为1.68%,偏差不大,说明此结果可靠,该模型能较好预测响应值的变化趋势。
表6 响应面试验结果方差分析表
Table 6 Analysis of variance for the experimental results of response surface design

方差来源平方和自由度均方F值P值显著性模型0.611140.04489.956<0.0001**A液花比0.10710.107220.066<0.0001**B糖花比0.22310.223459.650<0.0001**C柠檬酸7.651×10-317.651×10-315.7670.0014**D提取时间9.020×10-319.020×10-318.5890.0007**AB0.03410.03469.393<0.0001**AC1.406×10-311.406×10-32.8980.1108AD1.000×10-411.000×10-40.2060.6568BC6.003×10-416.003×10-41.2370.2848BD3.481×10-313.481×10-37.1740.0180*CD8.703×10-418.703×10-41.7930.2018A20.17910.179369.763<0.0001**B20.03910.03980.946<0.0001**C20.06910.069143.035<0.0001**D20.02610.02654.227<0.0001**残差6.793×10-3144.850×10-4失拟项5.349×10-3105.350×10-41.4810.3758纯误差1.445×10-343.610×10-4总和0.61828R2=98.9%R2Adj=97.8%CV=5.18%
注:“*”表示差异显著,P<0.05;“**”表示差异极显著,P<0.01
2.3 不同添加量的玫瑰液和亚硝酸盐对发酵香肠亚硝酸盐残留的影响
由图5可知,PC组的亚硝残留最高,接近20 mg/kg,是由于初始添加量最高所致;其余添加玫瑰试验组的亚硝残留呈现梯度增长的趋势,是由于相邻组间初始亚硝酸盐添加量相差20 mg/kg所致,然而当亚硝酸盐添加量一致时,A、B、C组内亚硝残留均出现随玫瑰提取液的增加而增加,这可能是因为玫瑰中本身存在一定量的硝酸盐,在发酵过程中可以在硝酸盐还原菌的作用下转化为亚硝酸盐[20],导致不同玫瑰液添加量中的亚硝酸盐残留出现差异,D组亚硝酸盐残留相对较高,均在10 mg/kg左右,尽管所有试验组的残留量均在国家标准范围内(<30 mg/kg),但产品的安全性随亚硝残留量的增加而降低,考虑安全性因素,将A、B、C试验组作为考察范围。
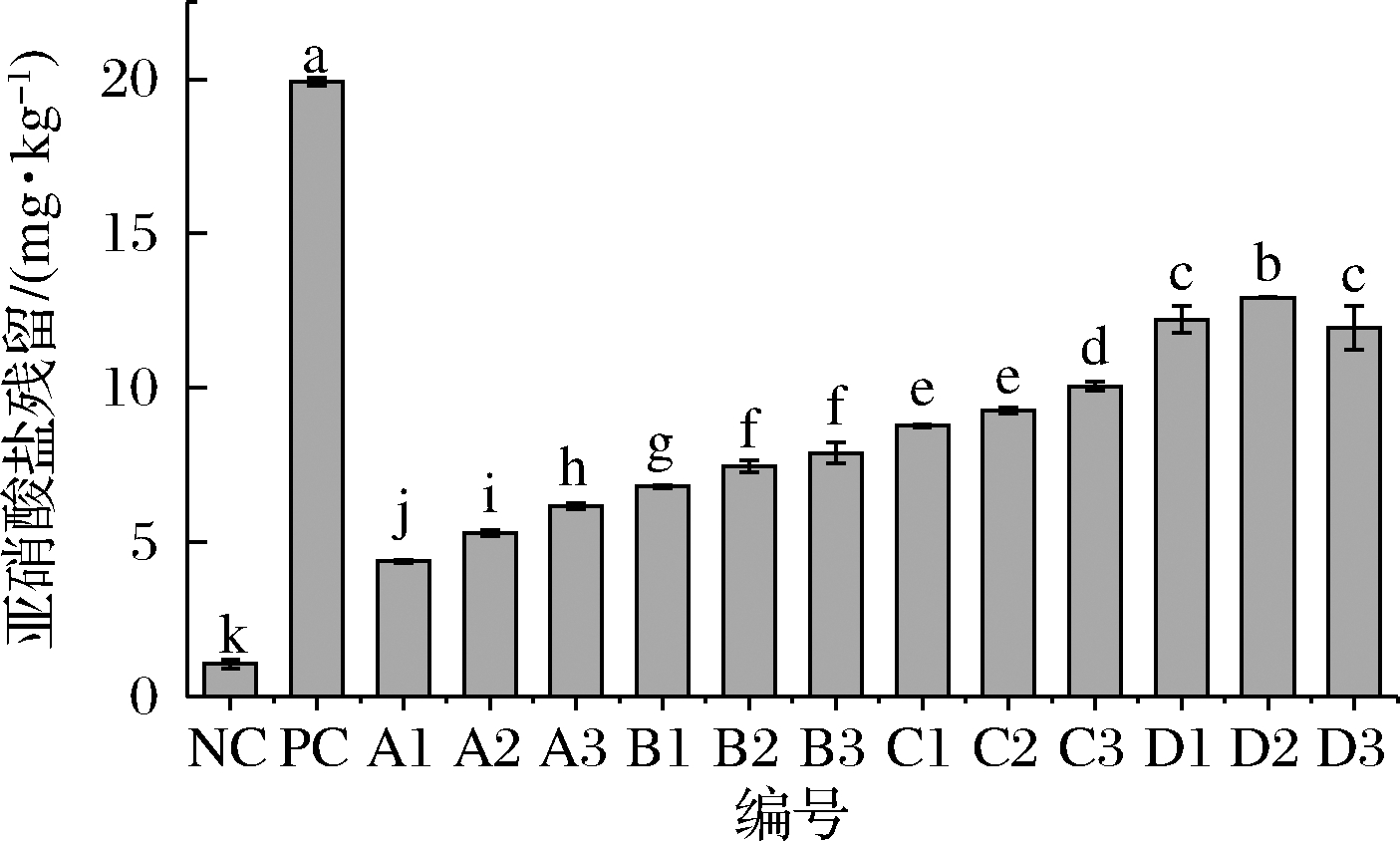
图5 各试验组亚硝酸盐残留的结果
Fig.5 Results of nitrite residue in each test group
2.4 不同添加量的玫瑰液和亚硝酸盐对发酵香肠色差的影响
对腌肉制品来说,色泽中最重要也最直观的参数是a*值。从表7可见a*值最低的是NC组,因未添加亚硝酸钠使香肠的切面泛白。a*值最高的是C2、C3及D1组,其a*值显著高于PC组(P<0.05),这是由于玫瑰液中的玫瑰红色素在起作用,花色素在酸性环境下较稳定,使得发酵香肠的a*值显著提升;随着玫瑰液添加量的增加,使得L*值显著降低(P<0.05),可能由于玫瑰液中含有较多的酚类物质,这些多酚类物质容易被多酚氧化酶氧化成相应的醌类,从而降低香肠的L*值[21],当亮度值低于57时香肠切面颜色暗淡,感官较差,不纳入选择范围内。综合a*值和L*值结果,C2和D1组的在色泽方面较理想。
表7 不同添加量的玫瑰液和亚硝酸钠对发酵香肠色差的影响
Table 7 Influences of different levels of rose juice and nitrite on color parameter values of fermented sausages
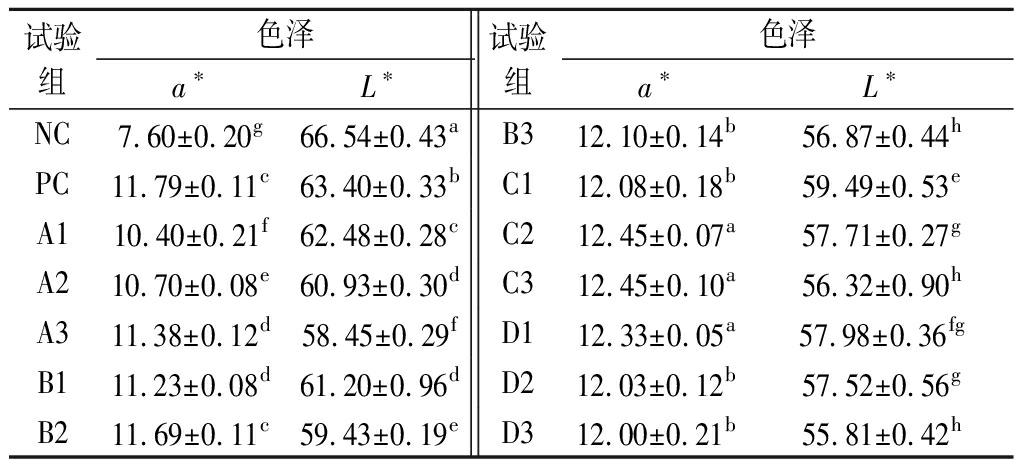
试验组色泽a*L*试验组色泽a*L*NC7.60±0.20g66.54±0.43aB312.10±0.14b56.87±0.44hPC11.79±0.11c63.40±0.33bC112.08±0.18b59.49±0.53eA110.40±0.21f62.48±0.28cC212.45±0.07a57.71±0.27gA210.70±0.08e60.93±0.30dC312.45±0.10a56.32±0.90hA311.38±0.12d58.45±0.29fD112.33±0.05a57.98±0.36fgB111.23±0.08d61.20±0.96dD212.03±0.12b57.52±0.56gB211.69±0.11c59.43±0.19eD312.00±0.21b55.81±0.42h
注:不同上标字母表示差异显著(P<0.05)
2.5 感官评价
由图6可知,与PC组相比,玫瑰的添加使得发酵香肠的品质得到极大地提升,玫瑰液中的果胶有一定的凝胶特性,在改善色泽的同时一定程度上有助于提高香肠的弹性,改善硬度、口感,且赋予发酵香肠独特的风味及营养价值。从图6可直观反映出C2、C3、及D2组的感官评分较高,且远高于其他试验组及对照组。
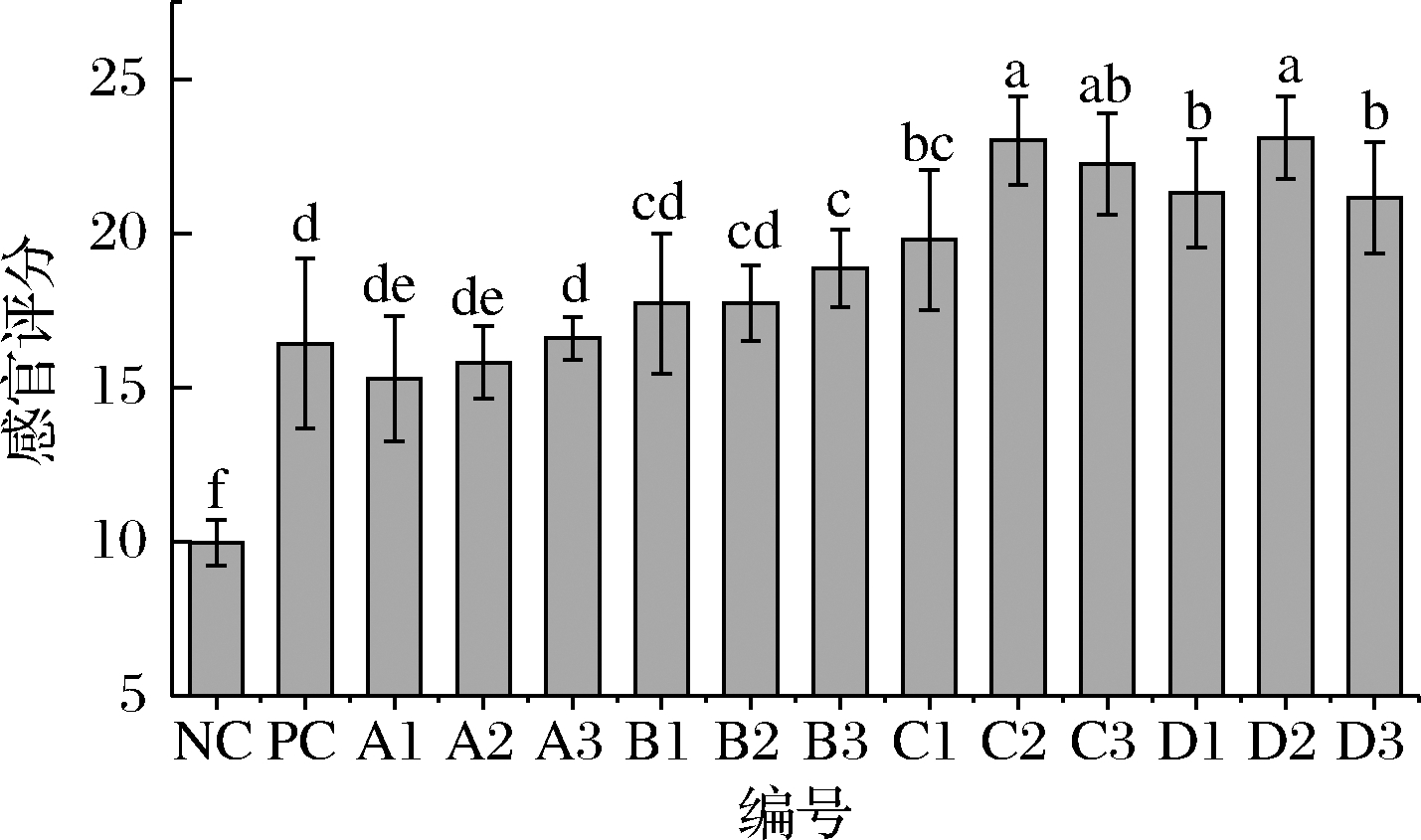
图6 发酵香肠的感官评定
Fig.6 Sensory evaluation of fermented sausages
通过观察亚硝酸盐残留、色差值及感官评定结果可知,C2试验组符合各项指标要求,因此我们可以确定C2试验组为部分替代亚硝的最佳组合,即80 mg/kg亚硝酸钠+10%(质量分数)玫瑰液。
3 结论
玫瑰含有丰富的花青素和抗氧化物质,在半干发酵香肠生产过程中使用可减少亚硝酸盐的添加量。采用响应面法对提取工艺进行优化,当液花比0.7∶1(mL∶g)、糖花比1.5∶1(g∶g)、柠檬酸质量分数为0.3%、提取时间为1.75 h时,玫瑰液综合品质指标较高。将优化后的玫瑰液与亚硝酸钠复配添加到发酵香肠中,通过考察玫瑰液对发酵香肠亚硝酸盐残留量、色差(L*值和a*值)及感官品质的影响,并确定了80 mg/kg 亚硝酸盐和10%(质量分数)玫瑰液的组合就能使发酵香肠达到一个很好的色泽,且各方面品质特性均远优于单独添加150 mg/kg的发酵香肠。表明玫瑰替代发酵肉制品中亚硝酸盐的应用效果较好且前景广阔。
[1] 龙强, 聂乾忠,刘成国.发酵香肠研究进展及展望[J].食品科学,2017,38(13):291-298.
LONG Q,NIE Q Z,LIU C G.Fermented sausage:Recent progress and prospects[J].Food Science,2017,38(13):291-298.
[2] HAMMAD H H M,MEIHU M,ELGASIM A E,et al.Nitroso-hemoglobin-ginger conjugates effects on bacterial growth and color stability in a minced beef model[J].International Journal of Food Microbiology,2020,331.DOI:10.1016/j.ijfoodmicro.2020.108731.
[3] MICHAUD D S,HOLICK C N,BATCHELOR T T,et al.Prospective study of meat intake and dietary nitrates,nitrites,and nitrosamines and risk of adult glioma[J].American Journal of Clinical Nutrition,2009,90(3):570-577.
[4] NAMRYE L,CHEONGSIK K,GEONSEONG Y,et al.Effect of nitrite substitution of sausage with addition of purple sweet potato powder and purple sweet potato pigment[J].Journal of the Korean Society of Food Science and Nutrition,2015,44(6):896-903.
[5] 朱培培, 唐宏刚,肖朝耿,等.甜菜粉与亚硝酸钠复合对中式香肠品质的影响[J].食品工业科技,2017,38(1):269-272;327.
ZHU P P,TANG H G,XIAO C G,et al.Effects of beet powder combined with sodium nitrite on the quality of Chinese sausage[J].Science and Technology of Food Industry,2017,38(1):269-272;327.
[6] 郑淑彦, 王伟,董金金,等.食用玫瑰营养保健功能及产品开发研究进展[J].食品研究与开发,2016,37(23):206-211.
ZHEN S Y,WANG W,DONG J J,et al.Research progress on nutrition health function and product development of edible rose[J].Food Research and Development,2016,37(23):206-211.
[7] SHIKOV V,KAMMERER D R,MIHALEV K,et al.Heat stability of strawberry anthocyanins in model solutions containing natural copigments extracted from rose(Rosa damascena Mill.)petals[J].Journal of Agricultural and Food Chemistry,2008,56(18):8 521-8 526.
[8] 高春燕, 刘颖,李文鹏.玫瑰花色素微波辅助提取及其对亚硝酸盐清除作用的研究[J].食品工业科技,2008,29(4):207-209.
GAO C Y,LIU Y,LI W P.Study on extraction of rose pigment by microwave and its scavenging capability to nitrite[J].Science and Technology of Food Industry,2008,29(4):207-209.
[9] 冯作山, 谢琼,余永婷,等.玫瑰花渣中抗氧化成分提取工艺研究[J].食品工业科技,2007,28(8):143-145.
FENG Z S,XIE Q,YU Y T,et al.Study on extraction technology of antioxidant components from rose residue[J].Science and Technology of Food Industry,2007,28(8):143-145.
[10] 孙迪,付本宁,张志国.玫瑰花生物活性物质的研究进展[J].食品工业,2016,37(7):243-245.
SUN D,FU B N,ZHANG Z G.Research progress of roses bioactive substances[J].Food Industry,2016,37(7):243-245.
[11] 刘万臣,刘爱萍,赵榕,等.肉制品加工及贮存过程中亚硝酸盐含量的变化与安全性分析[J].食品科学,2010,31(1):113-116.
LIU W C,LIU A P,ZHAO R,et al.Change and safety assessment of nitrite in meat products during processing and storage[J].Food Science,2010,31(1):113-116.
[12] DEWANTO V,WU X Z,ADOM K K,et al.Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J].Journal of Agricultural and Food Chemistry,2002,50(10):3 010-3 014.
[13] 张冰晶, 蒋玉梅,米兰,等.发酵型苦水玫瑰花酱的制作工艺参数优化[J].中国酿造,2014,33(6):147-152.
ZHANG B J,JIANG Y M,MI L,et al.Brewing technology of rosa rugosa jam[J].China Brewing,2014,33(6):147-152.
[14] 李美娟, 陈国宏,陈衍泰.综合评价中指标标准化方法研究[J].中国管理科学,2004,12(增刊1):45-48.
LI M J,CHEN G H,CHEN Y T.Research on index standardization method in comprehensive evaluation[J].Chinese Journal of Management Science,2004,12(Sup.1):45-48.
[15] 黄金枝, 杨荣玲,刘学铭,等.发酵广式香肠菌种配比优化研究[J].食品科技,2014,39(11):143-146.
HUANG J Z,YANG R L,LIU X M,et al.Optimize of strain ratio on cantonese fermented sausage[J].Food Science and Technology,2014,39(11):143-146.
[16] 王慧英.玫瑰红色素的理化性质、生物活性及提取应用研究进展[J].食品与机械,2018,34(11):174-177.
WANG H Y.Research advances on property,extractionand application of redpigment from rose[J].Food & Machinery,2018,34(11):174-177.
[17] 郑华, 张弘,张忠和.天然动植物色素的特性及其提取技术概况[J].林业科学研究,2003,16(5):628-635.
ZHEN H,ZHANG H,ZHANG Z H.Characteristics and extraction technology of natural pigments from animals and plants[J].Forest Research,2003,16(5):628-635.
[18] 陆庆.桃花黄酮提取纯化、稳定性与抗氧化性研究及其结构鉴定[D].南昌:江西农业大学,2015.
LU Q.Extraction,purification,stability,antioxidation and structural identification of flavonoids from prunus persica flos[D].Nanchang:Jiangxi Agricultural University,2015.
[19] 张志国, 姜闪.食用玫瑰花褪色原因及控制措施研究进展[J].食品科学,2017,38(9):322-328.
ZHANG Z G,JIANG S.Causes and control measures of the fading of edible roses[J].Food Science,2017,38(9):322-328.
[20] ELS V,MARIANA U,STEFAAN D S,et al.Dog rose(Rosa canina L.)as a functional ingredient in porcine frankfurters without added sodium ascorbate and sodium nitrite[J].Meat Science,2012,92(4):451-457.
[21] LARA M S,GUTIERREZ J I,TIM N M,et al.Evaluation of two natural extracts(Rosmarinus officinalis L.and Melissa officinalis L.)as antioxidants in cooked pork patties packed in MAP[J].Meat Science,2011,88(3):481-488.
N M,et al.Evaluation of two natural extracts(Rosmarinus officinalis L.and Melissa officinalis L.)as antioxidants in cooked pork patties packed in MAP[J].Meat Science,2011,88(3):481-488.