大米是人类消费蛋白质的重要来源,并且作为人类膳食蛋白质来源的需求将随着世界人口的增加而显著增加。大米中蛋白相对含量约为8%~10%,根据溶解度的不同可分为白蛋白、球蛋白、醇溶蛋白和谷蛋白[1-2]。其中谷蛋白是水稻籽粒中主要的蛋白质贮存物,也是主要的可溶性蛋白,富含易被人体消化吸收的赖氨酸,位于胚乳细胞内的蛋白质体II中,约占大米总蛋白干质量的80%左右[3-4]。然而过高的可溶性蛋白的吸收可能会导致蛋白质代谢紊乱,尤其是对于糖尿病、肾脏病的患者来说,不宜食用可溶性蛋白含量超过4%的大米,同时过高的谷蛋白含量还会影响以大米为原料的发酵产品的质量[5-6]。因此低谷蛋白大米可以为人们带来潜在的健康益处,但目前关于低谷蛋白大米经胃消化后对肠道菌群结构和代谢的影响还鲜有研究。
人体肠道中居住着高度多样化的微生物群落,主要由细菌组成,是人体最庞大、最复杂的微生态系统[7-8]。肠道除了吸收营养、排出废物之外,其中的细菌还能产生短链脂肪酸(short chain fatty acids,SCFAs)和支链脂肪酸(branched chain fatty acids,BCFAs)等有益或有害的物质,从而影响人体健康[11-12]。肠道菌群作为人体代谢的重要参与者,不仅能够为人体代谢提供有益或有害的物质、酶和能量,而且可以通过从粪便中检测菌群的DNA信息,帮助了解肠道功能及代谢性或免疫性疾病隐患,为医疗诊断提供多方面的探析数据[13]。因此,研究低谷蛋白大米对肠道菌群的益生效果具有重要意义。
应用体内消化模型研究食品药品在人体内的消化过程往往存在着成本高、实验周期长、可靠性差等缺点,因此使用体外消化模型反应器来模拟人体肠道已逐渐成为一种趋势。体外消化模型分为静态模型和动态模型,但静态模型不能模拟体内发生剪切、混合等物理过程,且不会吸收消化过程中的代谢产物,而动态模型正好弥补了静态模型的不足,不仅能够对胃肠道中物理过程进行模拟,而且可以对不同消化时间下发生的其他变化进行观测[14-15]。基于张文龙[16]设计的动态模型改进而成的仿生大肠反应器,是一种利用可编程逻辑控制的反应器,相比于其他动态模型,具有可视化好、结构高度仿生、准确性高等特点。
本研究以淀粉、低谷蛋白大米和普通大米为碳源,通过在仿生大肠反应器中发酵健康志愿者的粪便菌群,探究低谷蛋白大米对健康人群肠道菌群结构和代谢的影响。
1 材料和方法
1.1 实验材料
1.1.1 主要实验材料
低谷蛋白大米,北京中国农科院作物科学研究所;普通大米,营口禾丰源米业有限公司;淀粉、耐高温α-淀粉酶、胃蛋白酶、胰酶、L-半胱氨酸盐酸盐、胆汁盐,Sigma-Aldrich公司;TIANamp粪便基因组DNA提取试剂盒,天根生化科技有限公司。
1.1.2 主要仪器与设备
厌氧培养箱(HYQX-II),上海跃进医疗器械有限公司;紫外分光光度计(TU-1810),北京普析通用仪器有限公司;气相色谱仪(7890A),安捷伦科技有限公司;生物传感分析仪(SBA-40E),山东省科学院生物研究所。
1.1.3 仿生大肠反应器结构
仿生大肠反应器结构如图1所示,由3个连续的玻璃反应容器构成,两侧为具有硅胶仿生大肠的直形容器,一侧设有氮气通气口,一侧设有透析口和排料口,中间为不设有硅胶仿生大肠的拱形容器,其上设有肠液流加口、碱液流加口、加样口、补料口和排气口。通过在反应瓶内套设具有真实大肠纹路的硅胶管,模拟人体大肠;通过玻璃瓶与硅胶仿生大肠之间的37 ℃恒温循环水,模拟人体真实的内环境温度;通过玻璃瓶和硅胶仿生大肠之间循环水的压力实现对仿生大肠的挤压,模拟大肠的蠕动;通过控制电磁阀的开启和闭合时间与顺序控制大肠蠕动的频次,模拟在食物在大肠的蠕动频率;通过发酵液在中空纤维滤膜的过滤吸收,来模拟人体肠道对营养物质和代谢产物的吸收。

1-PLC;2-触控屏;3-恒温水浴锅;4-废液瓶;5-中空纤维滤膜;6-补碱瓶;7-补料瓶;8-肠液流加瓶;9-蠕动泵;10-尾气收集装置;11-接种口;12-内层软管;13-反应容器;14-pH电极;15-电磁阀;16-取样口
图1 仿生大肠反应器示意图
Fig.1 Schematic diagram of bionic large intestinal reactor
1.2 实验方法
1.2.1 肠道菌群培养体系
选取3名3个月内未接受抗生素治疗的健康志愿者的粪便,制成粪便菌悬液接种于仿生大肠反应器内。反应器的装液量为230 mL,接种量为10%(体积分数),pH设定为5.8,每天向反应器中通10 min氮气,以维持反应器的厌氧环境,每隔12 h无菌取样10 mL,并立即补充新鲜的发酵培养基,并以1 mL/min的速率进行透析,维持1 h。肠道菌群接种物的生长培养基每1 L包含6.0 g淀粉、1.0 g阿拉伯半乳糖、2.0 g果胶、1.0 g木聚糖、3.0 g酵母提取物、1.0 g胰蛋白胨、2.0 g酪蛋白、0.5 g L-半胱氨酸、1 g KCl、4.5 g NaCl、0.5 g K2HPO4、0.5 g KH2PO4、0.15 g CaCl2·6H2O、0.01 g MgSO4·7H2O、0.005 g FeSO4·7H2O、0.025 g氯化血红素、1 mL吐温-80、0.4 g胆汁盐、1.0 mL维生素混合液。每1 L维生素混合液包含1.0 mg甲萘醌、2.0 mg D-生物素、0.5 mg维生素B-12、10 mg泛酸、5.0 mg烟酰胺、5.0 mg对氨基苯甲酸、4 mg硫胺素[19]。其余2组将淀粉换成等量的经唾液、胃肠液消化过后的低谷蛋白大米和普通大米。
1.2.2 SCFAs和BCFAs分析
参考王如月等[20]的方法,使用乙醚从样品中提取SCFAs和BCFAs,并用安捷伦7820 A气相色谱仪测定。使用HP-INNOWAX(19091 N-133)30 m毛细管柱分离SCFAs和BCFAs,内径250 μm,膜厚0.25 μm。色谱升温程序:初始温度60 ℃保持1 min,以20 ℃/min升至190 ℃,保持7.5 min;进样口温度:220 ℃;氢火焰离子化检测器(FID)温度:250 ℃;进样体积:5 μL,分流比20∶1;载气:高纯氮气(纯度>99.999%),流速:1.5 mL/min;尾吹气:高纯氮气(纯度>99.999%),流速:30 mL/min;氢气流速:40 mL/min;空气流速:400 mL/min。
1.2.3 氨的测定
使用靛酚蓝-分光光度法[21]测定发酵液中的氨含量。向400 mL水中加入5 g苯酚和2.0 mL质量分数为1.25%的亚硝基铁氰化钠溶液,定容至500 mL配制溶液A;向400 mL水中加入2.5 g NaOH、3.5 mL NaClO和2.0 g柠檬酸三钠,定容至500 mL配制溶液B,取100 μL发酵液样品,分别加入5 mL溶液A和溶液B,充分混合后放入37 ℃恒温水浴锅中水浴显色20 min,取出后冷却至室温,并在637 nm下测量其吸光度。
1.2.4 乳酸的测定
使用生物传感仪测定发酵液中的乳酸含量。
1.2.5 微生物分析
1.2.5.1 平板计数
采用选择培养基[22-23]对双歧杆菌、乳酸杆菌、拟杆菌、粪大肠杆菌和总厌氧菌进行计数,本实验所用的培养基条件及生长条件如表1所示。
表1 分析微生物群使用的选择培养基和培养条件
Table 1 Analyzed microbial groups together with the selective media used and the incubation conditions

菌群培养基培养条件粪大肠杆菌McConkeyagar35℃/24h/厌氧乳酸杆菌LAMVABagar37℃/72h/厌氧拟杆菌BEAagar35℃/24h/厌氧双歧杆菌BSMagar37℃/48h/厌氧总厌氧菌BHIagar37℃/72h/厌氧
1.2.5.2 DNA提取
分别提取淀粉组、大米组和低谷蛋白大米组发酵72 h后的基因组DNA。采用TIANamp粪便基因组DNA提取试剂盒提取DNA,并将提取的基因组DNA贮存在-40 ℃冰箱。
1.2.5.3 16S rDNA扩增子测序方法
16S rDNA扩增子测序技术是一种研究环境样品中各种微生物分子的组成和结构问题的重要方法和手段[24]。将提取的DNA稀释至1 ng/μL,以稀释后的基因组DNA为模板,使用带Barcode的特异引物对16S V3-V4区域进行PCR扩增。然后对得到的PCR产物进行纯化,最后通过TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库使用Qubit和Q-PCR定量,文库合格后,使用NovaSeq 6000进行上机测序。根据所扩增的16S区域特点,构建小片段文库,基于Illumina NovaSeq 测序平台对该文库进行双末端测序。经过Reads拼接过滤,以97%的一致性将序列聚类成为可操作分类单元(operational taxonomic units,OTUs),进行物种注释及丰度分析。
2 结果与分析
2.1 SCFAs和乳酸
结肠健康对维持整体健康状态和降低疾病风险方面有重要作用。SCFAs是肠道菌群在发酵过程中的重要代谢产物,乳酸被认为是肠道微生物学的中间代谢物。乳酸和SCFAs可使结肠pH值降低至5~6,这对于抵抗病原体的定植具有重要作用[24]。由图2可知,与淀粉组和普通大米组相比,低谷蛋白大米组的总SCFAs浓度显著升高(P<0.05),其中乙酸浓度达到49.70 mmol/L,比淀粉组和普通大米组提高33.60%和18.42%;丙酸浓度达到26.68 mmol/L,比淀粉组提高47.32%;丁酸浓度达到28.47 mmol/L,比淀粉组和普通大米组提高67.18%和41.78%,总SCFAs的浓度达到104.85 mmol/L,比淀粉组和普糖大米组提高44.94%和25.33%。相比于淀粉组,低谷蛋白大米组的乳酸浓度也显著升高,乳酸浓度达到18.19 mmol/L,比淀粉组提高60.55%。综上所述,以低谷蛋白大米为碳源,对健康人群肠道菌群代谢产生SCFAs和乳酸具有显著的促进作用。

图2 肠道菌群以不同碳源发酵72 h后SCFAs和乳酸含量
Fig.2 SCFAs and lactic acid content of intestinal flora fermentated with different carbon sources for 72 h
注:同一组中标注的不同字母表示显著性差异(P<0.05)(下同)
2.2 BCFAs和氨
大多数微生物喜欢发酵碳水化合物,当有足够数量的可发酵的碳水化合物存在时,蛋白质(或蛋白质中的氨基酸)被用于构建到微生物的生物量中,而不是用于蛋白水解发酵。当不存在碳水化合物时,或当碳水化合物不易发酵时(如纤维素),微生物群转向蛋白质发酵,产生腐败的、有毒的代谢物,如BCFAs和氨[25]。当体系中SCFAs和氨的含量减少时,蛋白质被更多地应用于构建微生物的生物量中,这对于增加微生物种群丰度具有重要意义。由图3可知,相比于普通大米组,低谷蛋白大米组异丁酸、异戊酸、总BCFAs和氨浓度均显著降低,其中,异丁酸的浓度为0.14 mmol/L,比普通大米组降低85.71%;异戊酸的浓度为0.15 mmol/L,比普通大米组降低73.33%,总BCFAs的浓度为0.29 mmol/L,比淀粉组降低79.31%;氨的浓度为2.60 mmol/L,比普通大米组降低16.15%。与淀粉组相比,普通大米组的BCFAs和氨含量均有显著增长,低谷蛋白大米组BCFAs和氨的含量则没有显著增长,推测是因为普通大米中可溶性的谷蛋白含量高,使微生物群转向蛋白质发酵,而低谷蛋白大米中,谷蛋白含量少,更多的以发酵碳水化合物为主。以上代谢数据表明,使用低谷蛋白大米为碳源,可以减少腐败代谢物质的产生,对促进健康人群身体健康有积极作用。

图3 肠道菌群以不同碳源发酵72 h后BCFAs和氨的含量
Fig.3 BCFAs and ammonia content of intestinal flora fermented with different carbon sources for 72 h
2.3 微生物分析
2.3.1 平板计数
采用平板计数法对部分肠道有益菌和有害菌的计数结果如图4所示。低谷蛋白大米组的肠道有益菌的菌群浓度相较于淀粉组和普通大米组均有所增长,其中以双歧杆菌和拟杆菌的增长最为显著,浓度为8.27和8.92 lg CFU/mL,比淀粉组浓度提高0.67和0.85 lg CFU/mL,比普通大米组浓度提高0.41和0.23 lg CFU/mL;而肠道有害菌粪大肠杆菌浓度相较于淀粉组也显著降低,浓度为7.39 lg CFU/mL,比淀粉组和普通大米组浓度降低0.41 lg CFU/mL。由平板计数结果可知,使用低谷蛋白大米为碳源,能显著增加健康人群肠道有益菌的浓度,降低肠道有害菌浓度。

图4 肠道菌群以不同碳源发酵72 h后的菌群浓度
Fig.4 The concentration of intestinal flora after 72 h fermentation with different carbon sources
2.3.2 菌群组成
由图5可知,在门水平上,体外发酵不同碳源后的优势菌群均为拟杆菌门(Bacterioidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和梭杆菌门(Fusobacteria),占菌群总数的95%以上。体外发酵健康人粪便菌群72 h后,相比于淀粉组,普通大米组和低谷蛋白大米组的拟杆菌门和厚壁菌门增多,变形菌门和梭杆菌门减少,以低谷蛋白大米组的变化尤为明显。厚壁菌门和拟杆菌门存在一种相互促进的共生关系,共同促进宿主吸收和储存能量[26];变形菌门和梭杆菌门中多数细菌对人体具有致病性,变形菌门是典型的肠道菌群失调标志物,其中低谷蛋白大米组的变形菌门菌群数量明显减少,推测可能是因为短链脂肪酸和乳酸产量升高,降低了肠道pH,从而抑制了肠道有害菌的生长[24],由此可知,低谷蛋白大米可以改善健康人群的肠道菌群生态平衡。结果表明,低谷蛋白大米能改善健康人群门水平上肠道菌群的结构,促进肠道菌群的生态平衡。

图5 不同碳源发酵72 h后的肠道菌群在门水平上的影响
Fig.5 Effects of different carbon sources of fecal flora at phylum level after 72 h fermentation
为了研究低谷蛋白大米对肠道菌群在属水平上的影响,根据所有样本在属水平的物种注释及丰度信息绘制成热图。由图6可知,在属水平上,不同碳源发酵72 h后,各组粪便菌群的组成差异较大。相比于淀粉组,普通大米组的梭菌嗜胆菌属(Bilophila)、狄氏副拟杆菌属(Parabacteroides)、黄杆菌属(Flavonifracto)的相对丰度显著增多,嗜血杆菌属能引起原发性化脓性感染及严重的继发感染,狄氏副拟杆菌属可以产生有益的代谢终产物,如乙酸、琥珀酸等,而黄杆菌属多为条件致病菌。低谷蛋白大米组的梭菌属(Fusobacterium)、柠檬酸杆菌属(Citrobacter)、克雷伯氏菌属(Klebsiella)的相对丰度显著减少,梭杆菌属、柠檬酸杆菌属和克雷伯氏菌属中的多数细菌具有致病性;芽孢杆菌属(Bacillus)、柔嫩梭菌属(Faecalibacterium)、罗姆布茨菌属(Romboutsia)、巨型球菌属(Megasphaera)的相对丰度显著增多,其中,芽孢杆菌属可以拮抗肠道内的有害菌,柔嫩梭菌属是主要的产丁酸菌属,罗姆布茨菌属对维持宿主健康状态有重要作用,巨型球菌属参与人体乳酸和果糖的发酵。这也与BONDER等[27]关于低谷蛋白谷物可以减少梭杆菌属等有害菌丰度研究结果相似。同时,以低谷蛋白大米为碳源发酵肠道菌群,部分有益菌属增多,这部分菌通常是一些产SCFAs和乳酸的细菌,也从侧面解释了以低谷蛋白大米为碳源,SCFAs和乳酸的含量会较淀粉组和普通大米组有显著提高的原因。综合上述结果,低谷蛋白大米能改善健康人群属水平上的肠道菌群结构。

图6 不同碳源发酵72 h后的肠道菌群在属水平上的物种丰度聚类图
Fig.6 Species abundance clustering map of intestinal flora at the genus level after 72 h fermentation with different carbon sources
将样本中的OTUs数目按相对丰度由大到小排序得到对应的排序编号,再以OTUs的排序编号为横坐标,OTUs中的相对丰度为纵坐标,绘制得到等级聚类曲线,它可直观地反映样本中物种的丰富度和均匀度。由图8可知,使用低谷蛋白大米组的曲线在横轴的跨度最大,且垂直方向,曲线也最为最为平缓,而曲线在横轴上的跨度越大,物种的丰富度越高,垂直方向上曲线越平缓,物种分布越均匀。以上结果表明,低谷蛋白大米可以有效增加健康人群肠道菌群的丰富度和均匀度。推测是由于低谷蛋白大米中谷蛋白含量低,而其余大米大白如醇溶性蛋白比例升高,谷蛋白主要由赖氨酸组成,而醇溶性蛋白组要由脯氨酸和酰胺组成,因此氨基酸的比例也更加均衡,且由BCFAs和氨含量下降可知,肠道菌群多以发酵碳水化合物为主,蛋白质被更多的应用于构建微生物的细胞量中,这些均有助于促进菌群多样性。
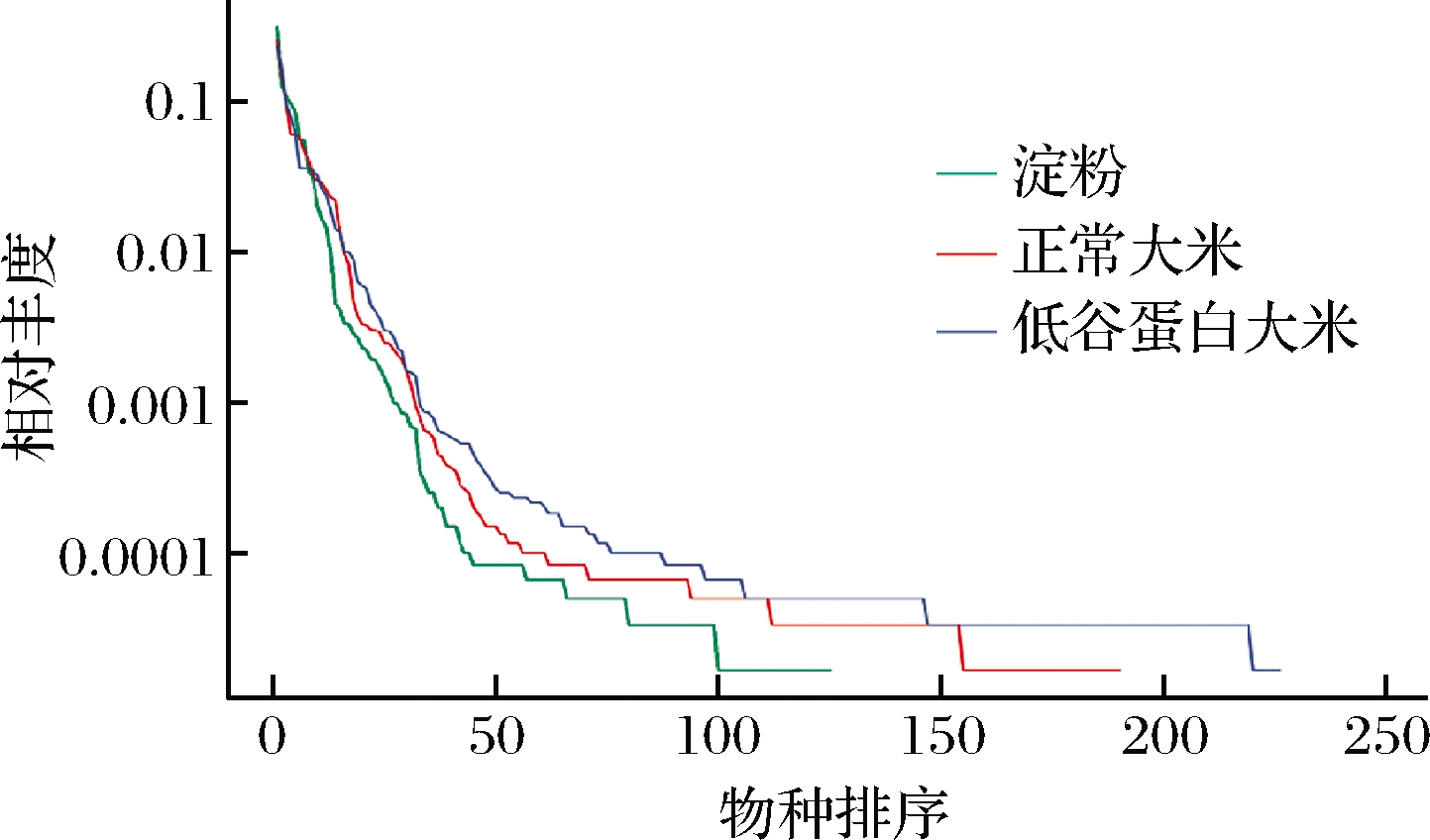
图7 不同碳源发酵72 h后的肠道菌群等级聚类曲线
Fig.7 Rank abundance curve of intestinal flora after 72 h fermentation with different carbon sources
3 结论
本研究以淀粉、低谷蛋白大米和普通大米为碳源在仿生大肠反应器中对健康人群的粪便微生物进行发酵,探究低谷蛋白大米对肠道菌群结构及其代谢产物的影响。通过对在仿生大肠反应器中发酵72 h后的SCFAs、BCFAs、乳酸和氨含量进行测定,及对发酵72 h后肠道菌群的部分菌群进行选择性培养可知,相较于淀粉和普通大米,低谷蛋白大米对SCFAs和乳酸的生成具有促进作用,并对一些不好的代谢产物,如BCFAs和氨的生成具有一定程度的抑制作用,还可以增加一些肠道有益菌的菌群数量,如双歧杆菌和拟杆菌等,降低有害菌的浓度,如粪大肠杆菌。由16S rDNA测序可知,低谷蛋白大米能显著提高肠道菌群的相对丰度,尤其是一些肠道有益菌的相对丰度,如拟杆菌门和厚壁菌门,降低肠道有害菌的丰度,如变形菌门和梭杆菌门。综合以上结论,低谷蛋白大米对健康人群肠道菌群的结构和代谢均有正向影响。
[1] 陈旭,陈选,杨炯,等.低谷蛋白大米对Beagle犬血糖生成指数的影响[J].食品科学,2020,41(17):126-132.
CHEN X,CHEN X,YANG J,et al.Glycemic index of low gluten rice in beagle dogs[J].Food Science,2020,41(17):126-132.
[2] ALRUFAYE Z T A U,ALSHEIKH W M S,GHALEB I K.Detection of Lgc1 gene low glutelin content in rice cultivars iraq using Iindel markers[J].Journal of Global Pharma Technology,2018,10(8):193-196.
[3] JI Y L,JONG H L,JUN H C.Analysis of eating quality in recombinant inbred lines and selection of elite line with low glutelin content in rice[J].Korean Journal of Breeding Science,2012,44(2):136-141.
[4] GUO D S,LING X T,ZHOU X G,et al.Evaluation of the quality of a high-resistant starch and low-glutelin rice(Oryza sativa L.)generated through CRISPR/Cas9-mediated targeted mutagenesis[J].Journal of Agricultural and Food Chemistry,2020,68(36):9 733-9 742.
[5] LI G H,CHEN Y L,DING Y F.et al.Charactering protein fraction concentrations as infl uenced by nitrogen application in low-glutelin rice cultivars[J].Journal of Integrative Agriculture,2016,15(3):537-544.
[6] WANG L H,LIU S J,JI S L,et al.Fine mapping and marker-assisted selection(MAS)of a low glutelin content gene in rice[J].Cell Research,2005,15(8):622-630
[7] WANG H,WEI C X,MIN L,et al.Good or bad:Gut bacteria in human health and diseases[J].Biotechnology and Biotechnological Equipment,2018,32(5):1 075-1 080.
[8] ANN M O,FERGUS S,The gut microbiota in transplant patients[J].EMBO Reports,2006,7(7):688-693.
[9] FUKUI H,XU X,MIWA H,Role of gut microbiota-gut hormone axis in the pathophysiology of functional gastrointestinal disorders[J].Journal of Neurogastroenterology and Motility,2018,24(3):367-386.
[10] MAKKI K,DEEHAN E C,WALTER J,et al.The impact of dietary fiber on gut microbiota in host health and disease[J].Cell Host Microbe,2018,23(6):705-715.
[11] BARCZYNSKA R,LITWIN M,SLIZEWSKA K,et al.Bacterial microbiota and fatty acids in the faeces of overweight and obese children[J].Polish Journal of Microbiology,2018,67(3):339-345.
[12] EAMONN M M Q,Gut bacteria in health and disease[J].Gastroenterology and Hepatology,2013,9(9):560-569
[13] QIN J,LI Y,CAI Z,et al.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature,2012,490(7 418):55-60.
[14] URIOT O,GALIA W,AWUSSI A A,et al.Use of the dynamic gastro-intestinal model TIM to explore the survival of the yogurt bacterium Streptococcus thermophilus and the metabolic activities induced in the simulated human gut[J].Food Microbiol,2016,53:18-29.
[15] 支梓鉴, 俞邱豪,程焕,等.肠道微生物体外发酵模型研究进展及其在食品中的应用[J].食品工业科技,2016,37(14):353-358.
ZHI X J,YU Q H,CHEN H,et al.Advances in in vitro fermentation model of gut microbiota and its applications in food[J].Food and Beverage Industry,2016,37(14):353-358.
[16] 张文龙, 詹晓北,陈荦,等.模拟胃肠道反应器的参数建立与冷模实验研究[J].化工学报,2019,70(5):1 879-1 886.
ZHANG W L,ZHAN X B,CHEN L,et al.Parameter estimation and cold model experiments of gastrointestinal simulation reactor[J].CIESC Journal,2019,70(5):1 879-1 886.
[17] SHANAHAN F,The host-microbe interface within the gut[J].Best Pract Res Clin Gastroenterol,2002,16(6):915-931.
[18] LI M,YUE H,WANG Y,et al.Intestinal microbes derived butyrate is related to the immunomodulatory activities of dendrobium officinale polysaccharide[J].International Journal of Biological Macromolecules,2020,149:717-723.
[19] MINEKUS M,SMEETS-PEETERS M,BERNALIER A,et al.A computer-controlled system to simulate conditions of the large intestine with peristaltic mixing,water absorption and absorption of fermentation products[J].Applied Microbiology and Biotechnology,1999,53(1):108-114.
[20] 王如月, 余讯,徐静静,等.燕麦β-葡聚糖及其寡糖对肠道菌群结构和代谢的影响[J].食品与发酵工业,2020,46(11):85-91;97.
WANG R Y,YU X,XU J J,et al.Effects of oat β-glucan and oligosaccharides on composition and metabolism of intestinal microorganisms[J].Food and Fermentation Industries,2020,46(11):85-91;97.
[21] 梁剑光,朱玲,徐正军.靛酚蓝-分光光度法测定发酵液中氨态氦含量研究[J].食品与发酵工业,2006,32(9):134-137.
LIANG J G,ZHU L,XU Z J.Study on the determination of ![]() content in microbial fermentation liquor by indophenol blue spectrophotometric method[J].Food and Fermentation Industries,2006,32(9):134-137.
content in microbial fermentation liquor by indophenol blue spectrophotometric method[J].Food and Fermentation Industries,2006,32(9):134-137.
[22] CHAIKHAM P,RATTANASENA P,et al.Combined effects of low-fat ice cream supplemented with probiotics on colon microfloral communities and their metabolites during fermentation in a human gut reactor[J].Food Bioscience,2017,17:35-41.
[23] 霍冬雪,张家超,白娜,等.适用于分离人肠道中双歧杆菌的选择性培养基[J].微生物学报,2014,(4):433-441.
HUO D X,ZHANG J C,BAI N,et al.Selective medium to isolate human Bifidobacterium[J].Acta Microbiologica Sinica,2014,(4):433-441.
[24] CHEN C,HUANG Q,FU X,et al.In vitro fermentation of mulberry fruit polysaccharides by human fecal inocula and impact on microbiota[J].Food Function,2016,7(4):637-643.
[25] MAATHUIS A,HOFFMAN A,EVANS A,et al.The effect of the undigested fraction of maize products on the activity and composition of the microbiota determined in a dynamic in vitro model of the human proximal large intestine[J].Journal of the American College of Nutrition,2009.28(6):657-666.
[26] WALSH C J,GUINANE C M,O’TOOLE P W,et al.Beneficial modulation of the gut microbiota[J].FEBS Letters,2014.588(22):4 120-4 130.
[27] BONDER M J,TIGCHELAAR E F,CAI X,et al.The influence of a short-term gluten-free diet on the human gut microbiome[J].Genome Medicine,2016,8(1):1 756-1 766.