腊肉主要是以畜肉为原料,经过腌制、烘干(风干)等加工工艺制成的肉制品,从广义上讲也属于低酸发酵肉制品(pH≥5.5)[1],具有风味浓郁、耐贮藏、方便食用等特点,深受消费者喜爱。但目前腊肉生产过程中仍面临一些问题:生产工艺落后、周期长、成本较高;自然发酵过程中易受杂菌的污染,从而导致产品的质量不稳定且不可控[2-3]。因此,使腊肉加工实现工业化已成为必然趋势。近几年,企业采用快速腌制和高温烘烤的工艺,大幅度缩短了生产周期、并使卫生状况得以改善,但因成熟期较短,且采用高温烘干的方式,加速了脂肪的氧化,并缺失了微生物发酵对产品风味的贡献,致使最终产品与传统工艺生产的腊肉相比,仍存在一定的差距[4]。
传统发酵腊肉通常会有来自原料以及生产环境中存在的微生物,而细菌是参与发酵的主要微生物,因此,了解腊肉中细菌微生物群落结构组成是调控和提升产品品质的关键。目前关于腊肉中微生物的报道较多,但多数研究对以传统培养法为基础的微生物学手段进行分析,该方法的缺陷是不能全面、准确地反映样品的微生物信息[5]。高通量测序技术是目前研究微生物多样性中应用最广泛的测序技术,不仅能够快速地分析复杂微生物群落多样性,还能检测到低存在率以及不可培养的微生物[6],目前该技术已经被广泛应用于酸奶[7]、泡菜[8]、白酒[9]、醋[10]等生物群落结构研究。
本研究以来源于湖北、云南、重庆、贵州、河南的传统发酵腊肉为研究对象,采用 Illumina MiSeq高通量测序平台对细菌的16S rDNA V3-V4区进行测序,更全面地呈现腊肉的细菌群落结构和多样性;同时结合电子鼻分析,探究细菌群落结构与腊肉风味品质的关系,以期为传统腊肉的生产研究提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
2019年3月在湖北(HB)、云南(YN)、重庆(CQ)、贵州(GZ)、河南(HN)5个地区分别购买当地农家自制腊肉,样品均为2019年1月左右制作,使用采样袋在常温下运回实验室,保存在-40 ℃备用,采用信息见表1。
表1 采样信息
Table 1 Information of samples

样品来源经度/(°)纬度/(°)平均温度/℃原料肉加工工艺HB113.4129.583~13当地五花肉原料肉选择→修整→腌制→烟熏→成品GZ109.1227.436~13当地后腿肉原料肉选择→修整→腌制→烟熏→成品HN114.0732.123~11当地五花肉原料肉选择→修整→腌制→晾晒→成品YN100.5625.476~19当地五花肉原料肉选择→修整→腌制→烟熏→成品CQ108.9930.739~15当地五花肉原料肉选择→修整→腌制→烟熏→成品
DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒,北京天根生物科技有限公司;Taq酶、引物等,上海生工生物工程有限公司。
1.2 仪器与设备
SW-CJ-2FD无菌操作台,美国Airtech公司;TGradient梯度PCR仪,德国Biometra公司;EC3-310凝胶成像系统,美国UVP公司;DYY-12电泳仪,北京市六一仪器厂;DHP—9272低温培养箱,上海一恒科技有限公司;Easy MIX拍击式均质仪,梅里埃诊断产品(上海)有限公司;PEN3电子鼻,德国AIR-SENSE公司。
1.3 仪器与设备
1.3.1 样品处理
在无菌条件下,将样品剪碎,混匀后称取25 g样品装入无菌的均质袋中,加入 225 g 无菌生理盐水,拍击式均质器拍打2 min提取细菌,均质液采用4层无菌纱布过滤,收集滤液,滤液装入无菌的离心管中,在4 ℃、2 000 r/min下离心5 min,取离心后的上清液放入另外的无菌离心管中,在4 ℃、9 500 r/min下离心10 min,弃去上清液,即为菌体沉淀。每个样品做3次平行处理。
1.3.2 DNA提取和PCR扩增
按照细菌DNA 试剂盒使用说明书提取细菌DNA。用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3-V4可变区进行PCR扩增;扩增程序:95 ℃预变性3 min,27个循环(95 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系:20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。
1.3.3 文库构建和上机测序
使用2%琼脂糖凝胶对PCR产物进行回收,利用AxyPrep DNA凝胶提取试剂盒进行纯化,Tris-HCl进行洗脱,2%琼脂糖进行电泳检测。利用QuantiFluorTM-ST微型荧光剂检测定量。根据 Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库。利用Illumina公司的MiSeq PE300平台进行测序(上海美吉生物医药科技有限公司)。
1.4 电子鼻测定
参考文献[11]和[12]的方法,略有改动。将腊肉绞碎,称取15 g肉样放入250 mL的锥形瓶中,用3层保鲜膜密封,40 ℃恒温水浴锅中加热5 min后立即测定。参数设置:顶空进样,清洗时间60 s,传感器归零时间5 s,样品准备时间5 s,数据采集时间80 s。
1.5 数据处理
每个样品做3 次重复试验,实验数据采用SPSS 16.0 软件进行数据处理。测序序列使用UPARSE软件(version 7.1 http://drive5.com/uparse/),根据97%的相似度对序列进行操作分类单元(operational taxonomic unit,OTU)聚类;使用UCHIME 软件剔除嵌合体。利用RDPclassifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123)。利用生物云平台(www.i-sanger.com)、R语言作图工具等绘制稀释曲线和堆积柱状图等。利用Origin 2017绘制挥发性物质信号强度和相关性热图。
2 结果与分析
2.1 不同来源腊肉样品测序深度和OTU分析
采用Illumina MiSeq高通量测序获得了5个来源腊肉样品的原始序列数据,15个样本经Trimmomatic及FLASH软件优化后,共得到了636 675条有效序列。稀释曲线是根据序列条数和测序深度与其所聚类得到OTU数(97%相似性)进行绘制得到。由图1-a可知,在样品量大于30 000时,样品的稀释曲线逐渐趋于平坦,说明各样品测序数量较为充分合理,符合后续的生物信息学分析要求。OTU数可以反映样品中细菌的丰度,对样品进行OTU聚类分析,共获得的OTU数量为258个,涵盖了7门、10纲、33目、56科、83属。不同来源样品中OTU数目存在差异,其中HB样品中包含的OTU数目最多(238个),特有的OTU数目也最多(165个),说明所含有的细菌种类及特有的细菌种类均最多;CQ和YN样品的OTU数较为接近,分别为62和57,特有的OTU数目分别为5和4;GZ样品中包含的OTU数目最少(28个),无特有的OTU种类。除HB样品外,其他4个样品特有的OTU数所占比例均<10.81%,说明虽然腊肉来源不同,但大多数样品的细菌多样性特异性较小,相似性较高。
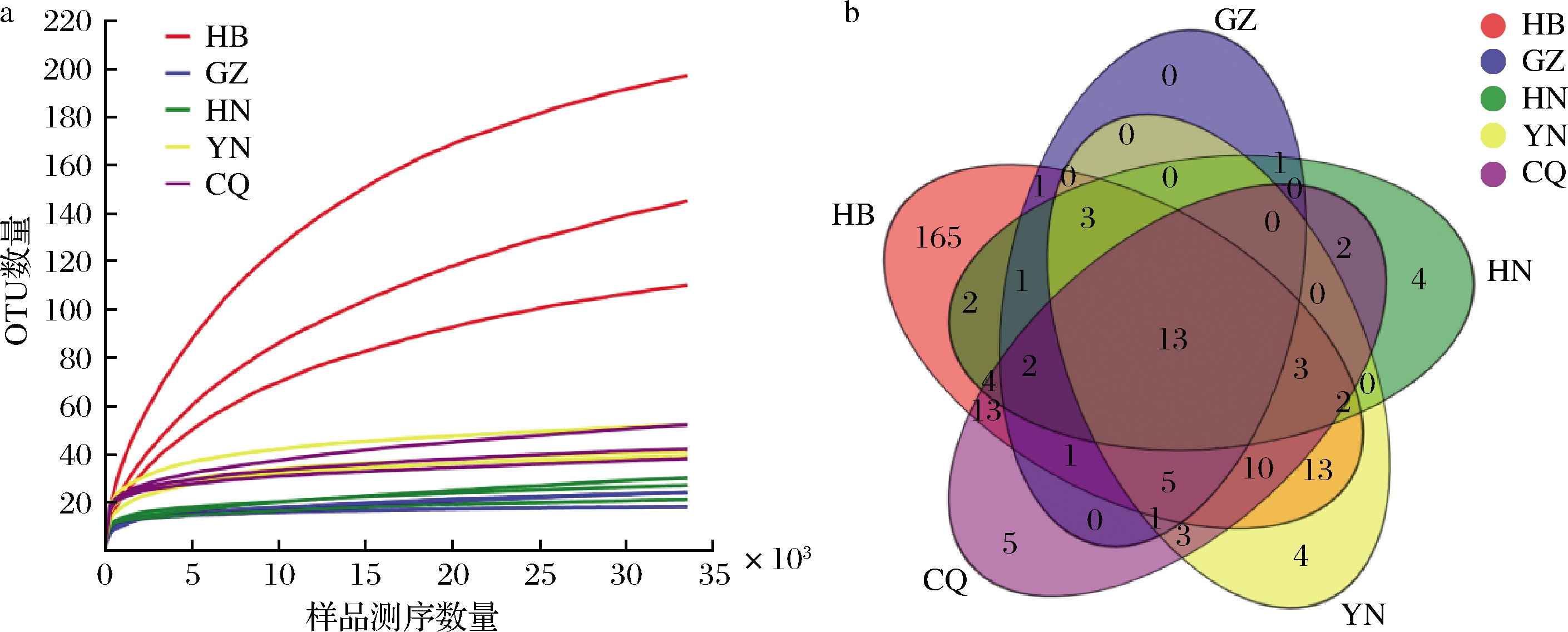
a-稀释曲线;b-Venn图
图1 稀释曲线和Venn图
Fig.1 Rarefaction curves and Venn diagrams
2.2 不同来源腊肉样品的Alpha多样性分析
根据97%相似性水平下的OTU信息,采用Alpha多样性指标中的Shannon、ACE、Chao1及Coverage指数对样品中细菌的多样性和丰富度进行评估。由表2可知,各样品的Coverage指数均达到了0.99以上,说明样品文库中序列基本上都被测出,即样本测序结果可以反应样品真实情况,测序结果合理。HB样品的ACE、Chao1指数均最高,说明该样本中物种丰富度最高;CQ样品中Shannon指数最高,ACE、Chao1指数仅次于HB样品,说明其微生物多样性最高,物种丰富度也较高;GZ样品中ACE、Chao1及Shannon指数均为最低,说明样品中的细菌丰富度和多样性都最低,这与OTU分析结果一致(图1)。
表2 Alpha多样性指数
Table 2 Alpha diversity index
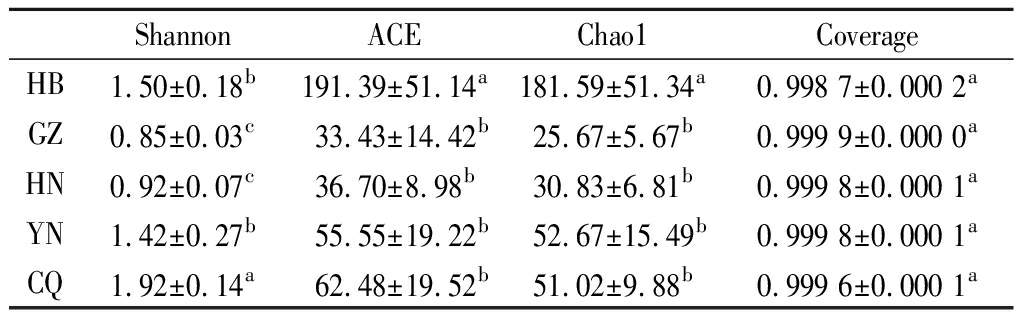
ShannonACEChao1CoverageHB1.50±0.18b191.39±51.14a181.59±51.34a0.9987±0.0002aGZ0.85±0.03c33.43±14.42b25.67±5.67b0.9999±0.0000aHN0.92±0.07c36.70±8.98b30.83±6.81b0.9998±0.0001aYN1.42±0.27b55.55±19.22b52.67±15.49b0.9998±0.0001aCQ1.92±0.14a62.48±19.52b51.02±9.88b0.9996±0.0001a
2.3 不同来源腊肉样品中的细菌群落组成分析
2.3.1 基于门分类水平的分析
5个来源传统发酵腊肉样本序列经RDP classifier软件进行分类分析,在门水平上,共检测到7个细菌门,其样本群落组成如图2所示。不同来源样品中共有的细菌门有3个,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),其中Proteobacteria和Firmicutes为绝对优势菌门,两者的相对丰度达到98%以上。这与多数研究一致,在风干肉[11]、发酵香肠[13]、腐乳[14]等多种传统发酵产品中,均发现Proteobacteria和Firmicutes为优势菌门。HB、GZ、HN、CQ样品中的第1优势细菌门为Firmicutes,相对丰度分别高达59.59%、88.28%、80.64%、85.98%;第2优势细菌门Proteobacteria,相对丰度分别为39.40%、11.70%、19.29%、13.87%。而YN样品中的第1优势细菌门为Proteobacteria,相对丰度为64.66%;第2优势细菌门为Firmicutes,相对丰度为35.05%。Actinobacteria在各样品中相对丰度较少,比例为0.01%~0.13%。
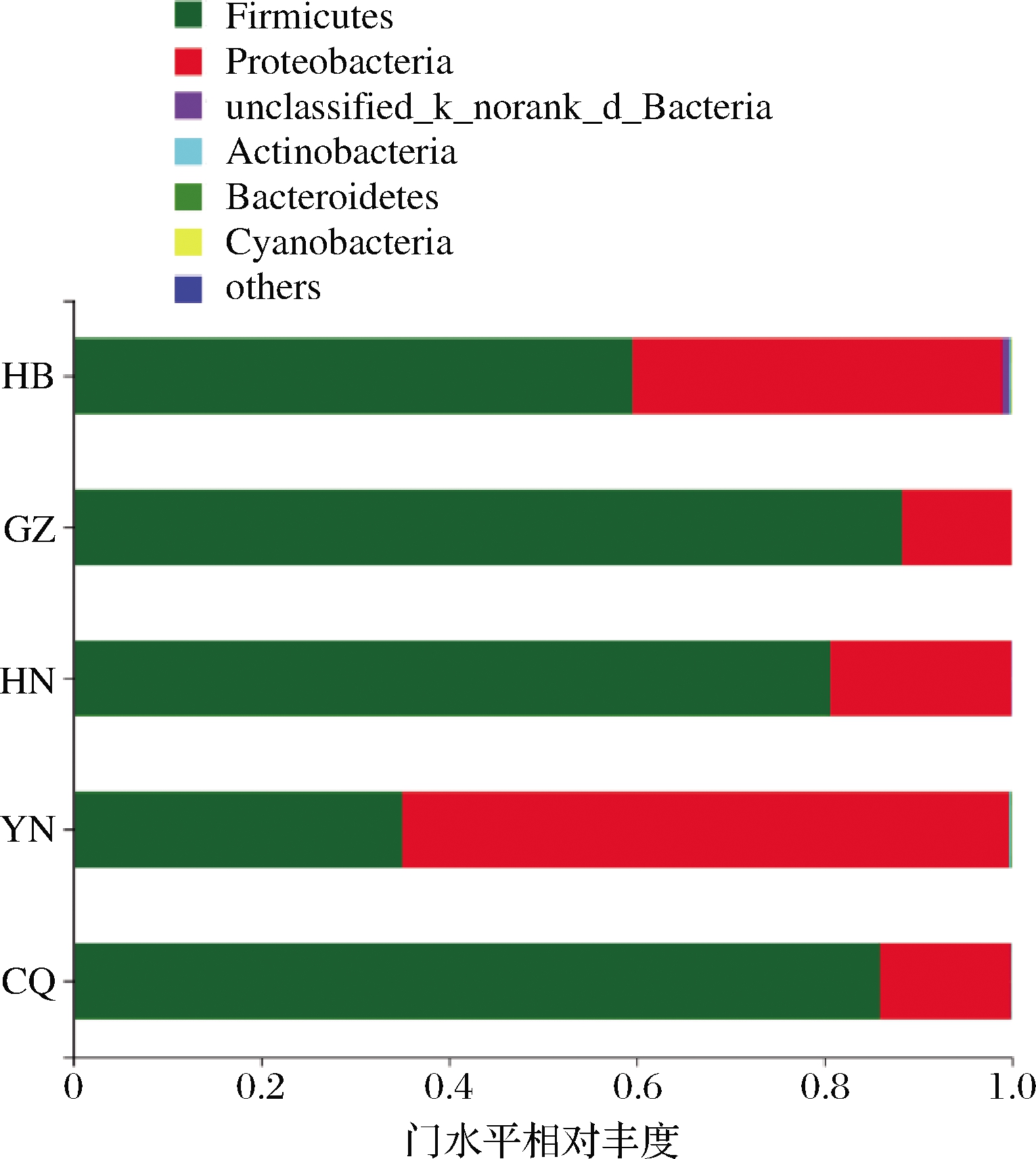
图2 门水平物种分布柱状图
Fig.2 Phylum distribution statistics
此外,除GZ样品外,其他样品均含有unclassified_k_norank_d_Bacteria。HB和CQ样品还包含极少量的拟杆菌门(Bacteroidetes)和蓝菌门(Cyanobacteria),相对丰度分别为0.07%、0.01%和0.08%、0.02%。
2.3.2 基于属分类水平的分析
5个来源传统发酵腊肉中共鉴定出83个细菌属,图3显示了主要优势菌属(前15位)的分布情况。前15个属中,HB和CQ样品所包含的属种类最多,均为14个属,YN样品包含13个属,HN样品包含11个属,GZ样品中包含的属种类最少,为10个属,这与Alpha多样性分析结果一致(表2)。5个来源样品中共有的属包括葡萄球菌属(Staphylococcus)、嗜冷杆菌属(Psychrobacter)、乳杆菌属(Lactobacillus)、环丝菌(Brochothrix)、魏斯氏菌属(Weissella)、气球菌属(Aerococcus)、肉食杆菌属(Carnobacterium)和未识别的芽孢杆菌(unclassified_c_Bacilli)。以相对丰度>10% 统计,CQ样品中的优势菌属为Lactobacillus(32.43%)、Staphylococcus(31.93%)、Weissella(14.07%)、Psychrobacter(13.37%);YN样品中的优势菌属为Psychrobacter(63.80%)、Brochothrix(20.76%);HN、GZ、HB样品中的优势细菌属均为Staphylococcus 和Psychrobacter,所占比例分别为79.72%、86.30%、48.71% 和15.69%、11.70%、38.05%。除YN样品外,Staphylococcus 和Psychrobacter均为样品中的优势细菌属。GZ和HN样品中Staphylococcus和Psychrobacter所占的比例分别高达98.00%和95.41%,其他菌属所占比例较低且菌种多样性较差,这与样品多样性分析一致(表2)。样品中还检测到乳球菌属(Lactococcus)、明串珠菌属(Leuconostoc)等,Lactococcus和Leuconostoc在YN样品中相对丰度最高,分别为3.41%和3.58%,在其他样品中的相对丰度均<2%。此外,在HN样品中检测出Cobetia;在CQ、HB样品中检测出Aerococcus;在超过3个地区样品中检测出unclassified_c_Bacilli、Carnobacterium和Acinetobacter,柱状图中未显示的并不代表该样品中无此菌属,可能是因为所占比例较小(<0.5%),归类为others。
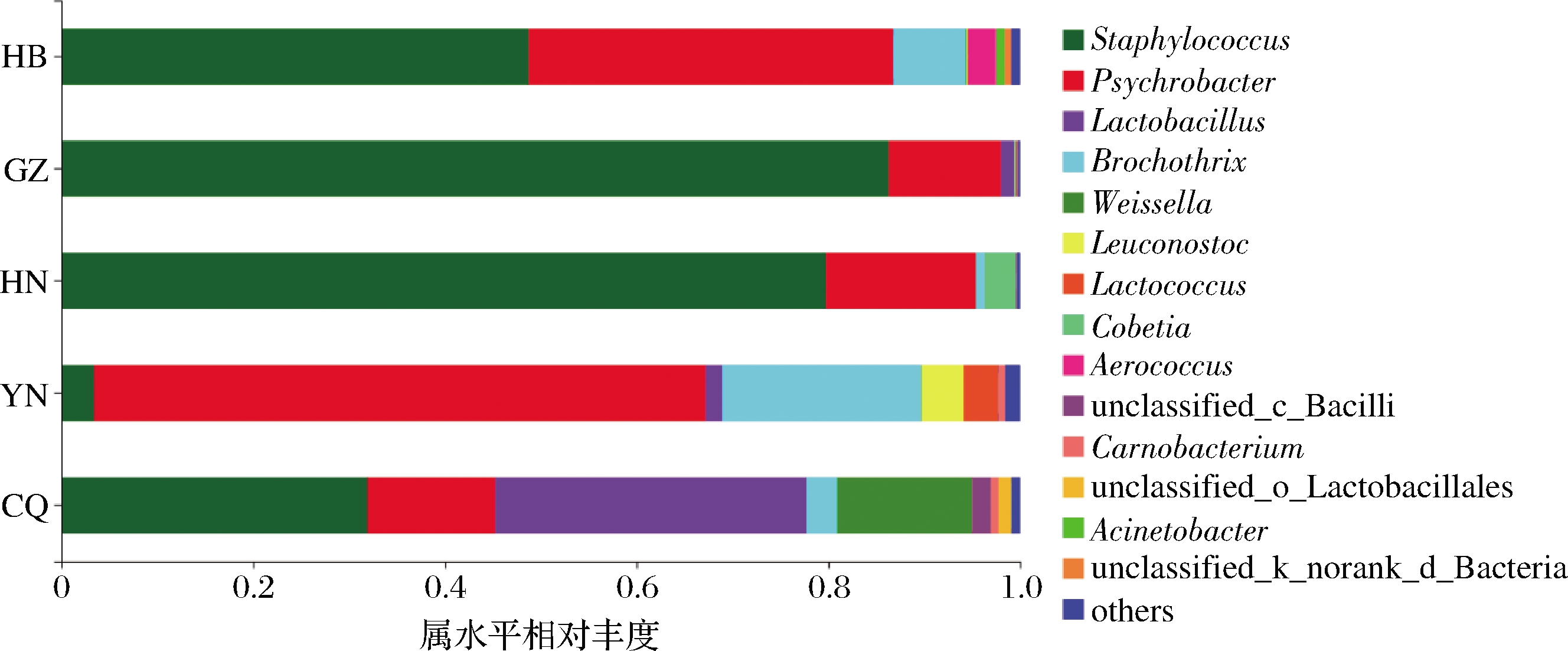
图3 属水平物种分布柱状图
Fig.3 Genus distribution statistics
乳酸菌和凝固酶阴性葡萄球菌(coagulase-negative Staphylococcus,CNS)被认为是发酵肉制品成熟过程中的2种主要微生物,对产品品质特性有至关重要的影响[15-16]。葡萄球菌中的木糖葡萄球菌(Staphylococcus xylosus)和肉葡萄球菌(Staphylococcus carnosus)等具有较强的蛋白酶和脂肪酶活性,有利于产生多肽、游离氨基酸和游离脂肪酸,对发酵肉制品的质地和风味起关键作用[17],并有研究表明,S.xylosus和S.carnosus具有硝酸盐还原酶活性,可以有效促进发酵肉制品的发色作用。清酒乳杆菌(Lactobacillus sakei)、植物乳杆菌(Lactobacillus plantarum)、戊糖片球菌(Pediococcus pentosus)等一般都具有较好的产酸能力,能抑制部分有害微生物的生长,甚至具有抗氧化、降低胆固醇等功能性作用[18]。Weissella作为乳酸菌的一种,也具有提高发酵产品质量、缩短发酵周期等重要作用[19]。
作为参与肉制品发酵的菌种,乳酸菌被认为是安全的,但对于其他菌种,对产品品质和安全性的影响有待进一步研究。Psychrobacter在各样品中均为优势菌属,相对丰度为11.70%~63.80%。相关研究报道,Psychrobacter属于低温冷藏食品中的优势腐败菌[20-22],能够引起产品产生轻微腥味和发霉的气味[23-24]。在多种发酵肉制品[25]中也检测出Psychrobacter,若发酵完成的产品在冷藏过程中蛋白质和脂肪继续被分解,会严重影响产品的品质。Brochothrix均存在于5个来源样品中,相对丰度为0.06%~20.76%,该菌能够在好氧和厌氧条件下生长,被认为是使肉类产生异味和肉类腐败的因素之一[26-27]。除HB样品外,在其他4个地区样品中均检测到Carnobacterium,相对丰度为0.02%~0.82%,有研究表明Carnobacterium是低温冷藏小龙虾中的优势腐败菌,同时,也有报道称Carnobacterium参与不饱和脂肪酸的代谢,从而促进了酸价、过氧化值上升。在YN、CQ、HB这3个地区样品中检测到Acinetobacter,该菌种在发酵产品中较为常见,虽然在腊肉细菌群落中相对丰度较小(HB样品中相对含量为0.83%、CQ和YN样品中均为0.01%),但会使产品产生异味和腐败,并且作为条件性致病菌,应注意其潜在危险性。在YN、GZ、CQ 3个地区样品中检测到unclassified_c_Bacilli,相对丰度为0.03%~1.93%,该类菌会产芽孢且耐高温,部分芽孢杆菌可能还会产生毒素,危害人体健康。CQ、HB样品中检测到Aerococcus,相对丰度分别为0.02%和2.87%,该菌属于革兰氏阳性球菌,对食盐和胆盐有一定的耐受性,但目前有研究报道一些疾病的产生与Aerococcus属中的一些菌有关[28-29],应注意该菌种在发酵肉制品中的潜在危害。多数地区传统发酵肉制品在生产过程中对原料肉不做杀菌处理,卫生质量主要依靠原料肉自身和周边的环境条件,容易被致病菌或腐败菌污染。因此,发酵肉制品因被致病菌或腐败菌污染而引起的风险应该被广泛关注。虽然不同来源传统发酵腊肉的原料、加工工艺和环境条件等不尽相同,但Psychrobacter、Brochothrix、Carnobacterium、Aerococcus、Bacilli 和Acinetobacter在多个地区产品中出现,对产品品质和产品安全性存在潜在威胁。关于产品的安全性,可以通过使用发酵剂代替自然发酵,规范加工生产工艺,保证产品的品质和安全性。
2.4 不同来源腊肉样品中细菌群落比较
主坐标分析(principal coordinate analysis,PCoA)是结合聚类分析与主成分分析的方法,用较少的主坐标对分类单元进行有效地排序,样本组成越相似反映在PCoA图中的距离越近[11]。如图4-a所示,主成分1和主成分2分别解释了不同来源腊肉样品中细菌群落 62.68%和 23.28%的信息,2个主成分所占比例之和超过85%,表明这2个成分能较好地代表样品中的细菌群落信息。同一来源的样品在主坐标分析图中比较聚集,说明样品测序结果重复性较好。在主成分1水平上,YN、HB样品与GZ、HN、CQ样品能较好地区分;GZ和HN样品距离最近,甚至出现交叉重叠现象,差异不大,这与Heatmap中聚类结果一致(图4-b),说明GZ和HN来源的样品中细菌群落较为相似。YN样品与HN、GZ样品在图4-a中距离较远,说明细菌群落差异较大。不同来源腊肉的原料、加工工艺和环境条件等都可能导致样品中细菌群落的差异,从而导致样品风味等品质的差异性。
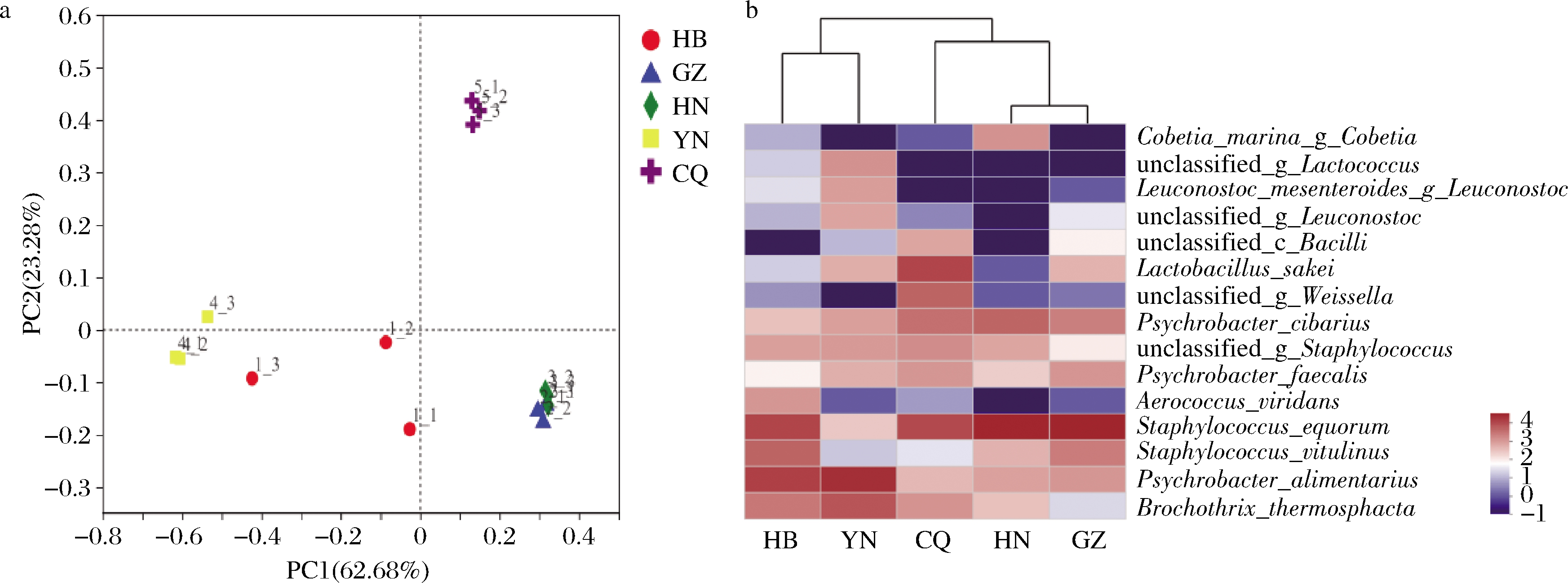
图4 细菌群落主坐标分析图(a)和属水平Heatmap(b)
Fig.4 Principal coordinate analysis of bacterial communities(a)and the Heatmap at genus level(b)
2.5 不同来源腊肉样品中的菌群结构与产品风味
使用电子鼻技术对不同来源传统发酵腊肉的风味品质进行了评价。由图5可知,电子鼻10个传感器对腊肉样品中的风味物质均有很好的响应。不同地区样品对电子鼻传感器的响应值存在显著性差异(P<0.05),说明不同样品的风味存在一定差异。W5S和W1W传感器的响应值相对最高,W1S和W2S的响应值次之,W1C和W3C的响应值最低。GZ和HN样品的传感器响应值有50%不存在显著性差异(P>0.05),而YN与GZ样品和YN与HN样品的传感器响应值分别有70%和90%存在显著性差异(P<0.05)。这可能与GZ和HN样品的群落相似性较高,而YN样品与GZ、HN样品相似性较低有关(图4)。

图5 不同来源腊肉中挥发性物质信号强度
Fig.5 Signal strength of volatile substances in meat from different sources
注:W1C-对芳烃化合物灵敏;W5S-对氮氧化合物灵敏;W3C-对氨气、芳香类物质灵敏;W6S-对氢化物灵敏;W5C-对烷烃、芳香类物质灵敏;W1S-对烷类灵敏;W1W-对硫化物、萜类物质灵敏;W2S-对醇类灵敏;W2W-对有机硫化物灵敏;W3S-对烷烃、酯类灵敏
对平均相对含量>1.00%的优势细菌属与风味品质评价指标之间的相关性进行分析,结果如图6所示,Psychrobacter和Brochothrix菌株均与W5S、W1W、W2W显著正相关(P<0.05),而W1W和W2W代表传感器对硫化物较为敏感,W5S代表对氮氧化合物较为敏感。孙娜等[30]的研究中表明,一些硫化物呈现的气味描述为腐臭味和恶臭味等不良风味,这与之前的研究和前文中推测相符,说明Psychrobacter和Brochothrix可能会对产品品质产生负面的影响。挥发性物质与细菌菌群结构关系复杂,某一种挥发性成分可能与多种细菌菌群均存在一定的相关性,可能是多种微生物协同作用的结果。如W1W和W2W还与Staphylococcus存在显著的负相关关系(P<0.05),这可能是因为葡萄球菌属中部分菌株具有硝酸盐还原和抗氧化能力,可以阻止不饱和脂肪酸的氧化和其他不良风味的形成。另外,Staphylococcus与W1C、W3C、W5C有较高的正相关关系,而W1C、W3C、W5C主要对芳香类物质敏感,说明葡萄球菌对风味物质形成发挥着重要作用。周慧敏等[4]研究发现添加木糖葡萄球菌和肉葡萄球菌可以有效促进氨基酸代谢类风味物质的产生,同时可以降低脂质氧化类物质的形成速率。BECK等[31]研究中表明木糖葡萄球菌和肉葡萄球菌能够转换氨基酸和游离脂肪酸,从而协调风味的形成。Lactobacillus和Weissella与W1S、W2S和W3S均有正相关关系,而W1S、W2S和W3S代表的传感器主要对烷类、醇类和酯类敏感。这与孙娜等[30]的研究结果相似,均表明乳杆菌等乳酸菌与醇类、酯类具有较高的相关性。这可能是因为乳酸菌对发酵肉制品风味的贡献主要是通过分解代谢碳水化合物、氨基酸等产生有机酸[32-33],且异型发酵的乳酸菌对碳水化合物的代谢和脂质氧化可产生并不断积累醇类物质,是形成酯类及其他香味成分的重要物质基础[34]。原料肉中的肌原纤维和肌浆蛋白会经过内源酶或乳酸菌胞外酶的作用降解生成呈味氨基酸或寡肽,氨基酸进一步通过转氨反应、氧化脱氨、脱羧反应以及降解反应形成其他物质,其中醛类物质进一步发生氧化还原反应形成酸类、醇类、酯类[35]。这都会直接或间接引起乳酸菌与醇类、酯类等的相关性。
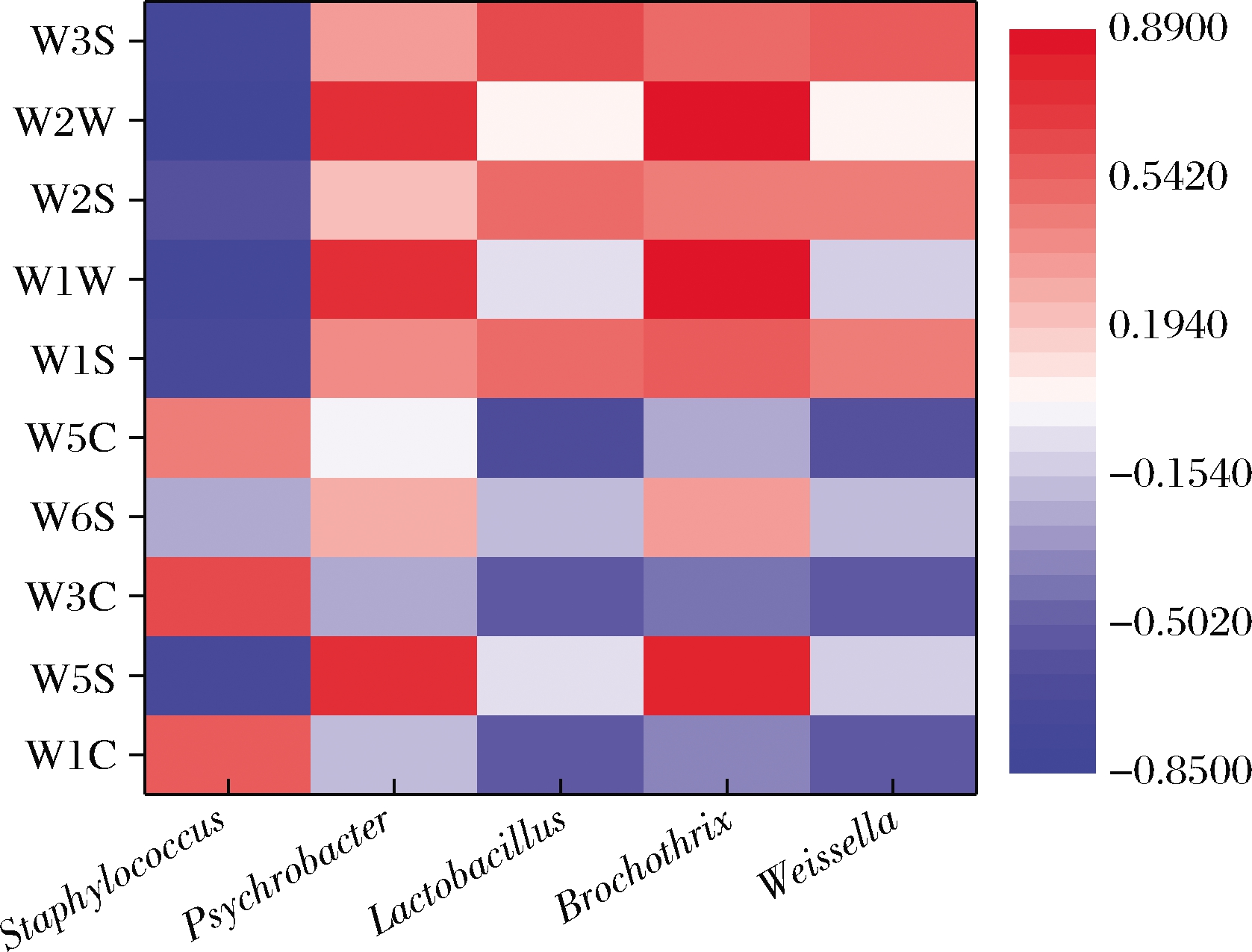
图6 优势细菌属与风味指标相关性
Fig.6 Correlations of dominant bacterial genus and flavor indicators
3 结论
本研究采用高通量测序技术对不同来源的传统发酵腊肉中细菌多样性进行了解析,同时结合电子鼻技术对风味品质进行评价。结果显示不同来源腊肉样品在细菌组成方面存在较高的相似性。厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为绝对优势细菌门;葡萄球菌属(Staphylococcus)、嗜冷杆菌属(Psychrobacter)、乳杆菌属(Lactobacillus)、环丝菌属(Brochothrix)和魏斯氏菌属(Weissella)为优势细菌属。葡萄球菌属(Staphylococcus)可能会促进产品中芳香类物质的产生且抑制不良风味;乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)可能影响腊肉中醇类、酯类和烷类挥发性风味物质;嗜冷杆菌属(Psychrobacter)和环丝菌属(Brochothrix)可能会导致产品品质变差,同时引起不良风味的产生;在非优势细菌属中,肉食杆菌属(Carnobacterium)、气球菌属(Aerococcus)、芽孢杆菌属(Bacilli)和不动杆菌属(Acinetobacter)也有对产品品质造成不良影响的风险。本研究结果为深入了解传统自然发酵腊肉的微生物群落与产品品质的关系、开发专用细菌发酵剂提供数据支撑和参考依据。
[1] 国家卫生和计划生育委员会.GB 2730—2015 腌腊肉制品[S].北京:中国标准出版社,2015.
National Health and Family Planning Commission.GB 2730—2015 Pickled bacon products[S].Beijing:China Standards Press,2015.
[2] 赵改名, 李珊珊,崔文明,等.云南自然发酵火腿中乳酸菌的分离鉴定及发酵特性研究[J].食品与发酵工业,2020,46(1):56-61.
ZHAO G M,LI S S,CUI W M,et al.Isolation,identification and fermentation properties of lactic acid bacteria from naturally fermented ham in Yunnan[J].Food and Fermentation Industries,2020,46(1):56-61.
[3] 李珊珊, 祝超智,崔文明,等.发酵肉制品中微生物发酵剂分离筛选及应用研究进展[J].肉类研究,2019,33(7):61-66.
LI S S,ZHU C Z,CUI W M,et al.Recent progress in separation,screening and application of starter cultures for fermented meat products[J].Meat Research,2019,33(7):61-66.
[4] 周慧敏, 张顺亮,赵冰,等.木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学,2018,39(22):32-38.
ZHOU H M,ZHANG S L,ZHAO B,et al.Effect of starter culture mixture of Staphylococcus xylosus and S.carnosus on the quality of dry-cured meat[J].Food Science,2018,39(22):32-38.
[5] COCOLIN L,ALESSANDRIA V,DOLCI P,et al.Culture independent methods to assess the diversity and dynamics of microbiota during food fermentation[J].International Journal of Food Microbiology,2013,167(1):29-43.
[6] LI X F,LI C,YE H,et al.Changes in the microbial communities in vacuum-packaged smoked bacon during storage[J].Food Microbiology,2019,77:26-37.
[7] VELIKOVA P,PETROV K,LOZANOV V,et al.Microbial diversity and health-promoting properties of the traditional Bulgarian yogurt[J].Biotechnology & Biotechnological Equipment,2018,32(5):1 205-1 217.
[8] WANG Z X,SHAO Y Y.Effects of microbial diversity on nitrite concentration in pao cai,a naturally fermented cabbage product from China[J].Food Microbiology,2018,72:185-192.
[9] LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].International Journal of Food Microbiology,2011,146(1):31-37.
[10] WU L H,LU Z M,ZHANG X J,et al.Metagenomics reveals flavour metabolic network of cereal vinegar microbiota[J].Food Microbiology,2017,62:23-31.
[11] 孟子晴, 赵改名,祝超智,等.基于电子鼻与模糊数学建立熏牛肉品质评价法[J].食品与发酵工业,2020,46(18):219-225.
MENG Z Q,ZHAO G M,ZHU C Z,et al.Quality evaluation method of smoked beef based on electronic nose,and fuzzy mathematics sensory evaluation method[J].Food and Fermentation Industries,2020,46(18):219-225.
[12] 孟舒雨, 李苗云,赵改名,等.基于灰色关联度法的狮子头风味电子鼻分析与感官评分相关性[J].肉类研究,2019,33(4):24-28.
MENG S Y,LI M Y,ZHAO G M,et al.Correlation between electronic nose analysis of and sensory evaluation of flavor in lion’s head meatballs based on grey correlation analysis[J].Meat Research,2019,33(4):24-28.
[13] JU REZ-CASTEL
REZ-CASTEL N C, GARC
N C, GARC A-CANO I, ESCOBAR-ZEPEDA A,et al.Evaluation of the bacterial diversity of Spanish-type chorizo during the ripening process using high-throughput sequencing and physicochemical characterization[J].Meat Science,2019,150:7-13.
A-CANO I, ESCOBAR-ZEPEDA A,et al.Evaluation of the bacterial diversity of Spanish-type chorizo during the ripening process using high-throughput sequencing and physicochemical characterization[J].Meat Science,2019,150:7-13.
[14] XU D D,WANG P,ZHANG X,et al.High-throughput sequencing approach to characterize dynamic changes of the fungal and bacterial communities during the production of sufu,a traditional Chinese fermented soybean food[J].Food Microbiology,2020,86:103 340
[15] ARO J M,NYAM-OSOR P,TSUJI K,et al.The effect of starter cultures on proteolytic changes and amino acid content in fermented sausages[J].Food Chemistry,2010,119(1):279-285.
[16] TABANELLI G,COLORETTI F,CHIAVARI C,et al.Effects of starter cultures and fermentation climate on the properties of two types of typical Italian dry fermented sausages produced under industrial conditions[J].Food Control,2012,26(2):416-426.
[17] BENITO M J,RODR GUEZ M,C
GUEZ M,C RDOBA M G,et al.Effect of the fungal protease EPg222 on proteolysis and texture in the dry fermented sausage ‘salchichón’[J].Journal of the Science of Food & Agriculture,2005,85(2):273-280.
RDOBA M G,et al.Effect of the fungal protease EPg222 on proteolysis and texture in the dry fermented sausage ‘salchichón’[J].Journal of the Science of Food & Agriculture,2005,85(2):273-280.
[18] LRENE F,VALENTINA A,PAOLA D,et al.Sausage fermentation and starter cultures in the era of molecular biology methods[J].International Journal of Food Microbiology,2018,279:26-32.
[19] AMMOR M S,MAYO B.Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production:An update[J].Meat Science,2007,76(1):138-146.
[20] PARLAPANI F F,FERROCINO I,MICHAILIDOU S,et al.Microbiota and volatilome profile of fresh and chill-stored deepwater rose shrimp(Parapenaeus longirostris)[J].Food Research International,2020,132:109 057.
[21] ZHANG D,PALMER J,TEH K H,et al.16S rDNA high-throughput sequencing and MALDI-TOF MS are complementary when studying psychrotrophic bacterial diversity of raw cows’ milk[J].International Dairy Journal,2019,97:86-91.
[22] CHEN H B,WANG M Y,YANG C F,et al.Bacterial spoilage profiles in the gills of Pacific oysters(Crassostrea gigas)and eastern oysters(C.virginica)during refrigerated storage[J].Food Microbiology,2019,82:209-217.
[23] BROEKAERT K,HEYNDRICKX M,HERMAN L,et al.Molecular identification of the microbiota of peeled and unpeeled brown shrimp(Crangon crangon)during storage on ice and at 7.5 ℃[J].Food Microbiology,2013,36(2):123-134.
[24] PRAPAIWONG N,WALLACE R K,ARIAS C R.Bacterial loads and microbial composition in high pressure treated oysters during storage[J].International Journal of Food Microbiology,2009,131(2/3):145-150.
[25] WANG X H,ZHANG Y L,REN H Y,et al.Comparison of bacterial diversity profiles and microbial safety assessment of salami,Chinese dry-cured sausage and Chinese smoked-cured sausage by high-throughput sequencing[J].LWT-Food Science & Technology,2018,90:108-115.
[26] NOWAK A,PIOTROWSKA M.Biochemical activities of Brochothrix thermosphacta[J].Meat Science,2012,90(2):410-413.
[27] CASABURI A,DE FILIPPIS F,VILLANI F,et al.Activities of strains of Brochothrix thermosphacta in vitro and in meat[J].Food Research International,2014,62:366-374.
[28] RAYJI P,BROWN N.A case of recurrent Aerococcus urinae infective endocarditis with associated cerebral embolic phenomena[J].Access Microbiology,2020,2(2).DOI:10.1099/acmi.fis2019.po0053.
[29] MAKYANA B S,PIWOZ S N,PIWOZ J A,et al.Clinical significance of Aerococcus-related infections:An emerging threat[J].Journal of the Pediatric Infectious Diseases Society,2019,8(6):579.
[30] 孙娜,张雅婷,于寒松,等.发酵型青腐乳菌群结构与风味物质分析及相关性[J].食品科学,2020,41(22):177-183.
SUN N,ZHANG Y T,YU H S,et al.Analysis and correlation on microflora and flavor components of stinky tofu[J].Food Science,2020,41(22):177-183.
[31] BECK H C,HANSEN A M,LAURITSEN F R.Catabolism of leucine to branched-chain fatty acids in Staphylococcus xylosus[J].Journal of Applied Microbiology,2010,96(5):1 185-1 193.
[32] LEROY F,VERLUYTEN J,DE VUYST L.Functional meat starter cultures for improved sausage fermentation[J].International Journal of Food Microbiology,2006,106(3):270-285.
[33] CHEN Q,LIU Q,SUN Q X,et al.Flavour formation from hydrolysis of pork sarcoplasmic protein extract by a unique LAB culture isolated from Harbin dry sausage[J].Meat Science,2015,100:110-117.
[34] MONTANARI C,BARGOSSI E,GARDINI A,et al.Correlation between volatile profiles of Italian fermented sausages and their size and starter culture[J].Food Chemistry,2016,192:736-744.
[35] ZAGOREC M,CHAMPOMIER-VERGÉS M C.Lactobacillus sakei:A starter for sausage fermentation,a protective culture for meat products[J].Microorganisms,2017,5(56):1-13.