噻节因(dimethipin)是一种植物生长调节剂,可促进植物成熟,使玉米、苗木、橡胶树和葡萄落叶,并能降低收获后水稻和向日葵种子的含水量。噻节因具有中等毒性,长期使用可能对生态和食品安全产生较大风险。美国环保局将噻节因列为可能的人类致癌物,目前欧盟禁止噻节因在农作物上使用,国际食品法典委员会、美国、日本等国家或组织制定了食品中噻节因的最大残留限量。我国食品安全国家标准(GB 2763—2019)中也制定了油料和油脂、马铃薯、哺乳动物肉类及内脏(海洋哺乳动物除外)、禽肉类、禽类内脏、蛋类、生乳中噻节因的最大残留限量值,但该标准中哺乳动物肉类及内脏(海洋哺乳动物除外)、禽肉类、禽类内脏、蛋类、生乳中噻节因的测定是参照蜂蜜(GB/T 20771—2008)的方法。
目前,国内外关于食品中噻节因的检测方法主要有气相色谱法[1]、液相色谱法[1-2]、气质联用法[1,3-11]、液质联用法[12-14]。气相色谱法和气质联用法前处理较繁琐、耗时较长;液相色谱法灵敏度低;液质联用法前处理相对简便且具有高特异性和高灵敏度,但现有文献方法大多针对果蔬类样品,对动物源性食品中噻节因检测的研究较少。本文以动物源性食品为研究对象,采用内标法定量,建立了高效液相色谱-串联质谱法测定动物源性食品中噻节因残留的分析方法,并研究了离子源、色谱柱、流动相、提取溶剂、净化方式、固相萃取柱等因素对噻节因的离子化程度、提取效率及净化效果的影响。
1 实验部分
1.1 仪器、试剂与材料
Vanquish-TSQ Quantis高效液相色谱-串联质谱仪,美国Thermo公司;MV5多通道氮吹浓缩仪、DHS-220双模式自动均质仪,北京莱伯泰科有限公司;Allegra 64R高速冷冻离心机,美国Beckman Coulter公司;GM200刀式研磨仪,德国Retsch公司;Venusil MP C18(2)色谱柱(150 mm×2.1 mm,3 μm),天津博纳艾杰尔科技有限公司;C18固相萃取柱(2 g,12 mL),北京中检维康技术有限公司。
噻节因(纯度99.0%)、4-羟基苯甲酸异丁酯(纯度99.0%),德国Dr.Ehrenstorfer公司;乙腈、正己烷、甲酸、乙酸,均为HPLC级,上海安谱公司;MgSO4、NaCl,均为分析纯,国药集团有限公司。
称取适量噻节因和4-羟基苯甲酸异丁酯标准品,分别用乙腈配制成1.0 mg/mL的标准储备液(噻节因可加少量丙酮溶解再用乙腈定容),于0~4 ℃冰箱中储存。根据需要将噻节因标准储备液用乙腈稀释成适当浓度的标准工作液,将4-羟基苯甲酸异丁酯内标储备液用乙腈稀释成100 ng/mL的内标工作液,于0~4 ℃冷藏储存,备用。
1.2 实验方法
1.2.1 样品制备
猪、牛、羊、鸡等畜禽类样品取可食肌肉组织、内脏约200 g,切碎后经组织捣碎机捣碎均匀,装入洁净容器内,密封,于-20 ℃以下冷冻保存;蛋类取10枚,去壳后经组织捣碎机充分混匀,装入洁净容器内,密封,于-20 ℃以下冷冻保存;生乳样品取约200 g充分混匀,装入洁净容器内,密封,于-20 ℃以下冷冻保存。
1.2.2 样品前处理
称取5 g(精确至0.01 g)制备均匀的样品,置于50 mL具塞离心管中,加入5 mL水(生乳不用加水),准确加入50 μL内标工作溶液(100 ng/mL),混匀静置20 min;加入25 mL体积分数1%的乙酸乙腈溶液,15 000 r/min均质2 min,加入1~2 g NaCl、2~3 g MgSO4,快速混匀2 min,7 000 r/min离心5 min,取15 mL提取液,用2×10 mL乙腈饱和的正己烷脱脂2次,准确移取其中10 mL提取液于40 ℃氮吹浓缩至约1 mL,待进一步净化。
用10 mL乙腈活化C18固相萃取柱,上样,用10 mL乙腈洗脱,接收提取液和洗脱液,于40 ℃氮吹浓缩至近干,用1.0 mL乙腈-水溶液[V(乙腈)∶V(水)=3∶2]溶解残渣,过0.22 μm有机滤膜后供高效液相色谱-串联质谱仪测定。
1.2.3 色谱和质谱条件
色谱柱Venusil MP C18(2)柱(150 mm×2.1 mm,3 μm);柱温40 ℃;流速0.4 mL/min;流动相A为水,流动相B为乙腈。梯度洗脱程序:0~1.00 min,10%B~60%B;1.00~3.50 min,60%B~95%B;3.50~4.00 min,95%B;4.00~4.01 min,95%B~10%B;4.01~5.00 min,10%B。进样体积10 μL。
离子源:大气压化学电离源(atmospheric pressure chemical ionization source,APCI);扫描模式:负离子扫描;扫描方式:多反应监测;离子传输管温度310 ℃;蒸发温度325 ℃;鞘气流量8.4 L/min;辅助气流量2.42 L/min;放电电流:5 μA;其他质谱条件见表1。
表1 噻节因和4-羟基苯甲酸异丁酯的质谱参数
Table 1 MS parameters of the dimethipin and isobutyl 4-hydroxybenzoate

分析物监测离子对(m/z)碰撞能/eV透镜补偿电压/V噻节因209>91*23103209>161161034-羟基苯甲酸异丁酯193>92*1056
注:*定量离子
2 结果与讨论
2.1 质谱条件的选择
液质联用法检测噻节因常用的离子源有电喷雾离子源(electron spray ionization, ESI)[13-14]和APCI源[12]。本方法配制10 mg/L的噻节因标准溶液和1 mg/L的4-羟基苯甲酸异丁酯内标溶液,注入ESI源和APCI源,并分别在正离子和负离子模式下进行一级质谱图全扫描,确定母离子,然后对准母离子进行子离子扫描,不同模式下二级离子碎片质谱图见图1。结果表明,噻节因在APCI源中的离子化效果要优于ESI源,且负离子模式下的响应明显高于正离子模式,与杨涛等[12]的研究结果一致。因此,选择APCI源负离子模式对噻节因和4-羟基苯甲酸异丁酯进行离子化,并在多反应监测模式下优化各种质谱参数,得到最佳质谱条件,噻节因和4-羟基苯甲酸异丁酯的质谱参数见表1。
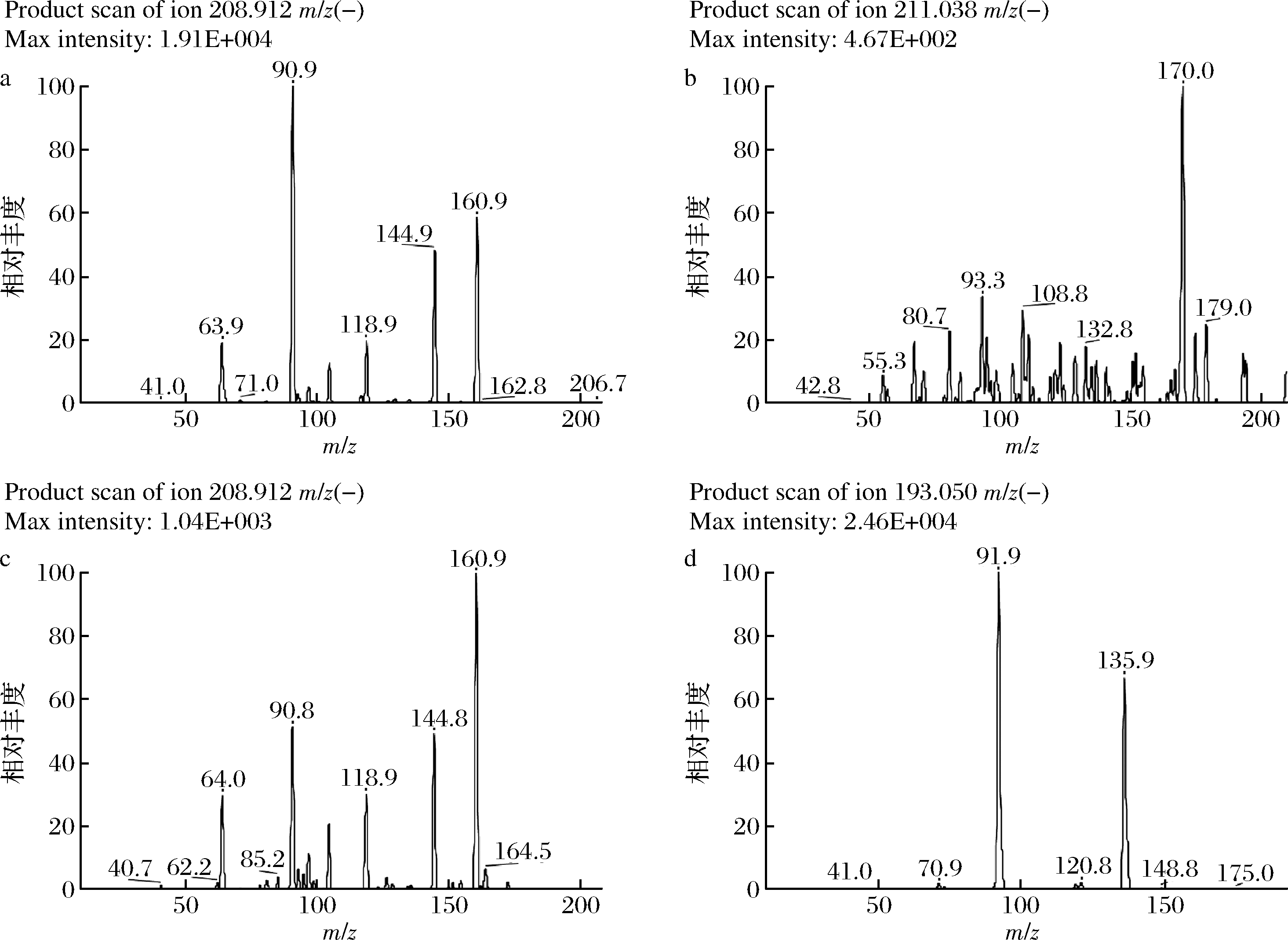
a-噻节因:APCI-;b-噻节因:APCI+;c-噻节因:ESI-;d-4-羟基苯甲酸异丁酯:APCI-
图1 噻节因和4-羟基苯甲酸异丁酯的二级离子碎片质谱图
Fig.1 Secondary ion fragment mass spectra of dimethipin and isobutyl 4-hydroxybenzoate
2.2 色谱条件的选择
色谱柱的选择对样品的分离十分重要,通常不同类型的填料对同一样品有不同的保留效果。本文重点比较了Venusil MP C18(2)柱(150 mm×2.1 mm,3 μm)和Venusil HILIC柱(150 mm×2.1 mm,3 μm)对目标化合物的保留情况,并采用同浓度的标准溶液考察了分别以乙腈-水、乙腈-0.1%甲酸水溶液和乙腈-10 mmol/L乙酸铵水溶液作流动相时,对目标化合物离子化程度的影响(图2)。结果表明,采用MP C18(2)柱,以乙腈-水作为流动相时,噻节因的响应明显高于其他2种流动相;采用HILIC柱,以乙腈-10 mmol/L乙酸铵水溶液作为流动相时,噻节因的响应明显高于其他2种流动相。这2种色谱柱最佳流动相条件下噻节因的响应相差不大,但是MP C18(2)柱对噻节因的保留效果要优于HILIC柱,且流动相中不需要添加铵盐。因此,选择Venusil MP C18(2)柱作为噻节因的分离色谱柱,并以乙腈-水作为流动相进行梯度洗脱。

a-色谱柱:MP C18(2),流动相:乙腈-水;b-色谱柱:MP C18(2),流动相:乙腈-0.1%甲酸水溶液;c-色谱柱:MP C18(2),流动相:乙腈-10 mmol乙酸铵水溶液;d-色谱柱:HILIC,流动相:乙腈-水;e-色谱柱:HILIC,流动相:乙腈-0.1%甲酸水溶液;f-色谱柱:HILIC,流动相:乙腈-10 mmol乙酸铵水溶液
图2 不同色谱条件下噻节因标准溶液色谱图
Fig.2 Chromatograms of dimethipin standard solution under different chromatographic conditions
2.3 提取和净化条件的优化
噻节因常用的提取溶剂有乙腈[13-14]、体积分数1%的乙酸乙腈溶液[3-4,7]、丙酮[12]等。李南等[7]比较了正己烷、丙酮、纯乙腈和1%的乙酸乙腈溶液对坚果中农药的提取效果,最终得出1%的乙酸乙腈溶液效果最佳;张煜卓等[10]比较了乙腈、丙酮、乙酸乙酯、二氯甲烷对南果梨中农药的提取效果,最终得出乙腈效果最佳;杨涛等[12]比较了乙腈、甲醇、丙酮、水和丙酮-水等体积混合对果蔬中噻节因的提取效果,最终得出丙酮效果最佳。对于动物源性食品,由于脂肪含量高,丙酮提取液浓缩后呈黏稠状液体,不利于后期净化;乙腈和1%的乙酸乙腈溶液作为提取溶剂,方法回收率均可达80%以上,当用正己烷对提取液进行脱脂处理后,发现提取液明显变得澄清,且不会影响噻节因的回收率;采用含1%的乙酸乙腈溶液作为提取溶剂,可以进一步沉淀动物源性样品中的蛋白质,使上机待测液较纯乙腈作为提取溶剂时更澄清。因此,实验选择体积分数1%的乙酸乙腈溶液作为提取溶剂,并用正己烷对提取液进行脱脂处理。
噻节因净化常用的固相萃取柱有NH2柱、GCB+NH2柱、C18柱、PSA柱、弗罗里硅土柱、中性氧化铝柱等,研究发现,NH2柱(500 mg/3 mL)、GCB+NH2柱(500 mg/500 mg/6 mL)、中性氧化铝柱(500 mg/3 mL)均会吸附内标4-羟基苯甲酸异丁酯。进一步比较了C18柱(500 mg/3 mL)、PSA柱(500 mg/3 mL)、弗罗里硅土柱(500 mg/3 mL)对提取液的净化效果,结果显示,对于肝脏类样品,PSA柱、弗罗里硅土柱可以吸附提取液中大部分极性色素,但是洗脱液浓缩复溶过膜后呈黄色浑浊状,表明这2种固相萃取柱对其他杂质的净化效果不明显,与李南等[7]的研究结果相近。而提取液经C18柱净化、浓缩、复溶过膜后溶液较为澄清透明,当C18固相萃取柱规格提高至2 g/12 mL时,复溶液过膜后明显变得澄清透明。因此,实验最终选择C18固相萃取柱(2 g/12 mL)进行净化。
2.4 方法学评价
2.4.1 基质效应
基质效应是影响结果准确性的一个重要因素,在质谱方法开发和确证过程中需要对基质效应做出评价。为了考察本方法在去除基质效应方面的效果,按照MATUSZEWSKI等[15]的方法对其进行基质效应评估。实验选择猪肉、牛肝、鸡蛋、牛奶4种阴性样品,按照1.2节进行前处理,获得的基质提取液分别配制质量浓度为100 μg/L基质标准溶液(含内标2 μg/L)。此外,用乙腈-水溶液[V(乙腈)∶V(水)=3∶2]配制同样质量浓度的标准溶液,按照公式(1)计算方法的基质效应。
基质效应![]()
(1)
研究表明,当用外标法计算时,这4种基质的基质效应值为92.5%~97.1%;当用内标法计算时,这4种基质的基质效应值为94.3%~98.7%,说明采用该方法测定动物源性食品中噻节因残留量时无需配制基质标准曲线,主要是APCI对基质效应的敏感程度要低于ESI,与文献[13-14]中方法相比,对鸡肉、鸡蛋中噻节因残留的研究基质干扰更小。
2.4.2 线性范围和定量限
配制质量浓度为1、2、5、10、50、100、200、500 μg/L的系列标准溶液(含内标2 μg/L),对噻节因和内标4-羟基苯甲酸异丁酯定量离子的峰面积之比(y)与噻节因的质量浓度(x,μg/L)进行线性回归,绘制标准曲线,其线性方程为y=0.077 87 x-0.024 62,相关系数(R2)为0.999 3。研究表明,噻节因在1~500 μg/L范围内线性关系良好,且满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》附录F中对于确证方法相关系数≥0.99的要求。
在阴性样品中添加噻节因,按照1.2节进行前处理上机测定,以10倍信噪比(S/N)为定量限,得到噻节因的方法定量限为1.0 μg/kg,完全满足各国限量标准要求,且同现有方法相比具有更高的灵敏度[3,12-14]。
2.4.3 准确度和精密度
通过对阴性样品进行加标回收,考察方法的准确度和精密度。按照1.2节提取和净化步骤,在猪肉、猪肝、牛肉、牛肝、羊肉、羊肝、鸡肉、鸡胗、鸡蛋和牛奶10种基质样品中添加定量的噻节因标准溶液进行加标回收试验,加标量分别为1.0、10.0和100.0 μg/kg,每个加标水平做6个平行,试验结果见表2。
表2 不同基质中噻节因的加标回收率和精密度(n=6)
Table 2 Spiked recoveries and precisions of dimethipin in the different matrices(n=6)
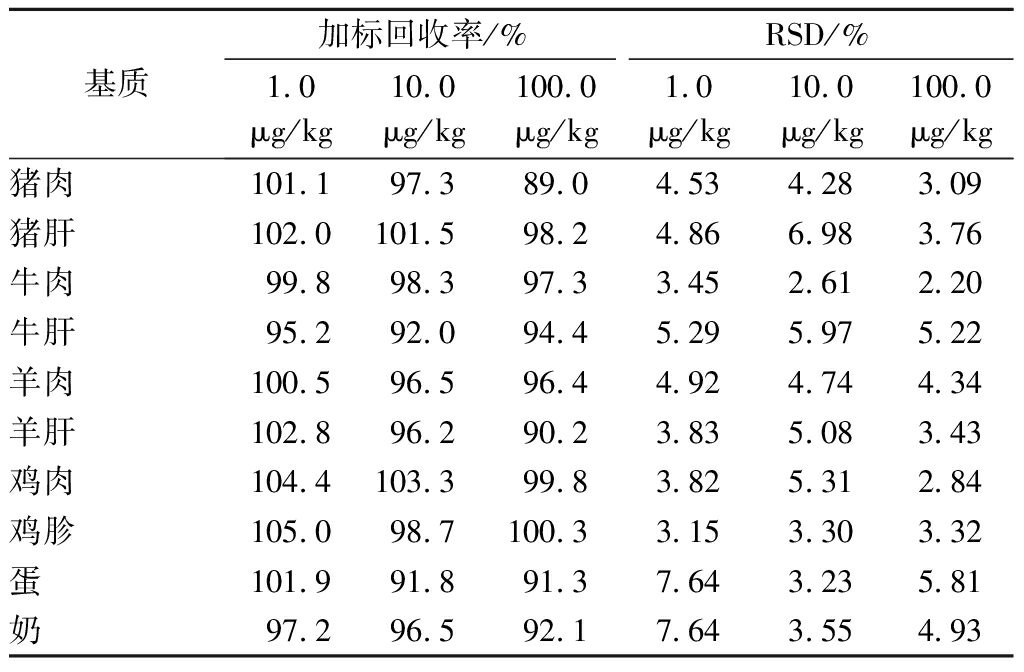
基质加标回收率/%RSD/%1.0μg/kg10.0μg/kg100.0μg/kg1.0μg/kg10.0μg/kg100.0μg/kg猪肉101.197.389.04.534.283.09猪肝102.0101.598.24.866.983.76牛肉99.898.397.33.452.612.20牛肝95.292.094.45.295.975.22羊肉100.596.596.44.924.744.34羊肝102.896.290.23.835.083.43鸡肉104.4103.399.83.825.312.84鸡胗105.098.7100.33.153.303.32蛋101.991.891.37.643.235.81奶97.296.592.17.643.554.93
结果显示,在3个加标水平下,猪肉、猪肝、牛肉、牛肝、羊肉、羊肝、鸡肉、鸡胗、鸡蛋和牛奶中噻节因的平均回收率为89.0%~105.0%,相对标准偏差为2.20%~7.64%。说明方法的准确度高,通用性好,且方法的回收率优于现有研究[3,12-14],完全满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》附录F中检测方法确认回收率和精密度要求。
2.5 实际样品的测定
运用本文建立的方法,对市售的畜禽肉及肝脏类、蛋类、牛奶共40份样品进行噻节因的残留检测,所有样品均为阴性。
3 结论
本文建立了高效液相色谱-串联质谱测定动物源性食品中噻节因残留的分析方法,方法操作简单,基质干扰小,定性准确,灵敏度高,线性关系、准确度和精密度均满足方法学指标,方法定量限完全满足各国限量标准要求,可为动物源性食品中噻节因的残留检测提供技术手段。
[1] POTTER T L,MARTI L,BELFLOWER S,et al.Multiresidue analysis of cotton defoliant,herbicide,and insecticide residues in water by solid-phase extraction and GC-NPD,GC-MS,and HPLC-diode array detection[J].Journal of Agricultural and Food Chemistry,2000,48(9):4 103-4 108.
[2] 孙武勇, 魏东伟,刘海芳,等.高效液相色谱法测定棉花中3种脱叶剂的残留量[J].理化检验(化学分册),2014,50(1):112-113.
SUN W Y,WEI D W,LIU H F,et al.Determination of three defoliant residues in cotton by high performance liquid chromatography[J].Physical Testing and Chemical Analysis(Part B:Chemical Analysis),2014,50(1):112-113.
[3] KIM Y J,CHOI Y H,SHIN B W,et al.Comparison between the liquid-liquid partition method and modified QuEChERS method for the analysis of pesticide residues in beef fat[J].Korean Journal of Veterinary Service,2011,34(4):429-439.
[4] 李凯, 刘永强,张金玲,等.DPX-Q萃取吸管结合气相色谱/串联质谱法同时检测水果蔬菜中102种农药残留[J].分析试验室,2015,34(2):236-242.
LI K,LIU Y Q,ZHANG J L,et al.Application of DPX-Q tips for analysis of 102 pesticide residues in fruits and vegetables by GC-MS[J].Chinese Journal of Analysis Laboratory,2015,34(2):236-242.
[5] 吴卫东, 洪小柳,孙娅楠,等.GC-MS/MS快速检测香港《食物内除害剂残余规例》中的101种除害剂残留量[J].环境化学,2016,35(10):2 215-2 220.
WU W D,HONG X L,SUN Y N,et al.Rapid determination of 101 pesticide residues of HongKong regulation by GC-MS/MS[J].Environmental Chemistry,2016,35(10):2 215-2 220.
[6] 张权, 沙比拉·吐拉江,周贻兵,等.不同种类固相萃取柱测定韭菜中58种农药残留量的净化效果比较[J].食品工业科技,2019,40(20):243-250;261.
ZHANG Q,SHABILA T L J,ZHOU Y B,et al.Comparison of purfication effect of different types of SPE column on the dertermination of 58 pesticide residues in chives[J].Science and Technology of Food Industry,2019,40(20):243-250;261.
[7] 李南, 石志红,庞国芳,等.坚果中185种农药残留的气相色谱-串联质谱法测定[J].分析测试学报,2011,30(5):513-521.
LI N,SHI Z H,PANG G F,et al.Determination of 185 pesticide residues in nuts by gas chromatography tandem mass spectrometry[J].Journal of Instrumental Analysis,2011,30(5):513-521.
[8] 史晓梅, 章晴,杨永坛,等.凝胶渗透色谱净化结合气相色谱-三重四极杆质谱法测定植物油中多农药残留量[J].中国粮油学报,2017,32(10):156-162.
SHI X M,ZHANG Q,YANG Y T,et al.Determination of multi-pesticides residues in vegetable oil by gel permeation chromatography purifying method combined with gas chromatography tandem mass spectrometry[J].Journal of the Chinese Cereals and Oils Association,2017,32(10):156-162.
[9] 黄宗兰, 陈沙,朱作为,等.气相色谱-三重四级杆串联质谱法同时测定西红柿中47种农药残留[J].食品安全质量检测学报,2018,9(5):1 142-1 148.
HUANG Z L,CHEN S,ZHU Z W,et al.Simultaneous determination of 47 pesticide residues in tomato by gas chromatography-triple quadrupole mass spectrometry[J].Journal of Food Safety and Quality,2018,9(5):1 142-1 148.
[10] 张煜卓, 于湛,李硕,等.应用QuEChERS技术与气相色谱-串联质谱法同时检测南果梨中16种农药残留[J].现代预防医学,2019,46(2):327-331.
ZHANG Y Z,YU Z,LI S,et al.Simultaneous determination of 16 pesticide residues in Nanguo pear by QuEChERS combined with gas chromatography-tandem mass spectrometry[J].Modern Preventive Medicine,2019,46(2):327-331.
[11] 马驰远, 段吴燕,罗秋红,等.GC-MS/MS法与HPLC-MS/MS法相结合检测果蔬中农药多残留[J].江西化工,2019(1):119-128.
MA C Y,DUAN W Y,LUO Q H,et al.Determination of pesticide residues in fruits and vegetables by GC-MS/MS combined with HPLC-MS/MS[J].Jiangxi Chemical Industry,2019(1):119-128.
[12] 杨涛, 王静静,鹿毅.HPLC-APCI-MS/MS检测果蔬中噻节因残留的方法研究[J].广州化工,2013,41(8):126-128.
YANG T,WANG J J,LU Y.Study on the method of detection dimethipin residues in fruits and vegetables by HPLC-APCI-MS/MS[J].Guangzhou Chemical Industry,2013,41(8):126-128.
[13] 田海, 冯玉洁,张艳玲,等.超高效液相色谱串联质谱法测定鸡肉中噻节因残留[J].现代农药,2017,16(4):39-41.
TIAN H,FENG Y J,ZHANG Y L,et al.Determination of dimethipin residues in chicken by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Modern Agrochemicals,2017,16(4):39-41.
[14] 田海, 冯玉洁,郇志博,等.超高效液相色谱串联质谱法测定鸡蛋中噻节因残留[J].中国科技成果,2019,20(5):32-34.
TIAN H,FENG Y J,XUN Z B,et al.Determination of dimethipin residues in egg by ultra-high performance liquid chromatography-tandem mass spectrometry[J].China Science and Technology Achievements,2019,20(5):32-34.
[15] MATUSZEWSKI B K,CONSTANZER M L,CHAVEZ-ENG C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Analytical Chemistry,2003,75(13):3 019-3 030.