炎症性肠病是一种多因素的肠道炎症性疾病,其发病因素主要包括遗传、环境因素、肠黏膜屏障完整性和功能异常、免疫调节以及肠道微生态异常等[1]。为了研究炎症性肠病的发病机制和评价其治疗效果,葡聚糖硫酸钠盐(dextran sulfate sodium,DSS)诱导的小鼠结肠炎模型被广泛应用[2]。益生菌是一类可用于缓解人体各种慢性疾病,如慢性先天性炎症、高脂血症、糖尿病、肥胖,结肠炎等[3-4]的微生物。有证据表明,口服活性益生菌可作为预防和缓解结肠炎的有效途径,其主要机制为抑制炎症、改善肠屏障功能障碍、提高免疫调节活性及调节肠道微生态平衡等[5-6]。动物模型研究表明补充活性鼠李糖乳杆菌可以改善DSS诱导的实验性小鼠结肠炎[7]。但值得注意的是在某些群体中使用活菌出现感染的安全问题,例如新生儿[8-9]和易受感染的患者[10]。因此,寻找解决这一问题的有效途径引起了学者的广泛关注。
最近,有研究报道热灭活的益生菌也能对宿主产生有益的影响,例如热灭活的发酵乳杆菌CECT5716和短乳杆菌SBC8803对小鼠结肠炎均具有改善作用[11-12]。此外,多项体外和体内研究表明热灭活的鼠李糖乳杆菌GG也具有改善结肠炎的功能作用[13-15]。与活性益生菌相比,热灭活益生菌更利于工业生产和消费者使用;同时具有产品保质期延长和便于储存运输等优点,因此热灭活益生菌具有良好的应用前景。鼠李糖乳杆菌HN001(Lactobacillus rhamnosus HN001)是1株存在于人体肠道中的不产生芽孢的厌氧性革兰氏阳性菌,它是全球研究最多的第3代益生菌之一。然而,热灭活的鼠李糖乳杆菌HN001(HK-HN001)对炎症性肠病的作用影响尚不清楚。本研究以DSS诱导的小鼠结肠炎为研究模型,探讨HK-HN001对结肠炎的保护作用,为研发活性益生菌代替产品提供科学依据。
1 材料与方法
1.1 试验材料
活性鼠李糖乳杆菌HN001冻干粉,美国杜邦公司;DSS,大连美伦生物科技有限公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)测试盒、谷胱甘肽(glutathione,GSH)测试盒、丙二醛(malondialdehyde,MDA)测试盒、髓过氧化物酶(myeloperoxidase,MPO)测试盒,南京建成生物工程研究所;白细胞介素1β(interleukin-1β,IL-1β)测试盒、白细胞介素6(interleukin-6,IL-6)测试盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)测试盒,美国BD Biosciences公司;脂多糖(lipopolysaccharide,LPS)、二胺氧化酶(diamine oxidase,DAO)测试盒,美国BioVision公司;RNAiso Plus总RNA提取试剂盒、PrimeScriptTM RT反转录试剂盒及SYBR Premix Ex荧光定量试剂盒,日本TaKaRa公司;多聚甲醛固定液、苏木精和伊红染料、石蜡及切片等,武汉赛维尔生物技术有限公司;DEPC水,北京索莱宝科技有限公司;氯仿、异丙醇、乙醇、二甲苯,国药集团;本文所使用的基因引物,上海Generay公司。
1.2 仪器及设备
SpectraMax M4多功能酶标仪,美国Molcular Devices公司;EG1150自动石蜡包埋切片机,德国Leica公司;ND2000核酸定量仪、Forma900超低温冰箱,美国Thermo-Fisher 公司;S1000型PCR仪、CFX96实时荧光定量PCR仪,美国Bio-Rad公司;3-18KS高速冷冻离心机,美国Simga公司;Scientz-48高通量组织匀浆仪,宁波新芝公司;多量程单道可调移液器,法国Gilson公司;MH-2800a多功能恒温器,天津奥特赛恩斯公司;双人单面净化工作台,苏州净化公司;MLS-3780高压灭菌锅,日本SANYO公司。
1.3 实验动物
雄性C57BL/6小鼠(8周龄),体质量(20±2)g,购自上海斯莱克实验动物有限责任公司。所有小鼠饲养在(22±2)℃和相对湿度60%~80%的SPF级环境。所有动物实验均按照中华人民共和国科学技术部《实验室动物饲养与使用规范》进行,该研究遵循的程序符合江苏科技大学实验动物伦理委员会所制订的伦理学标准,批准文号20200302。
1.4 试验方法
1.4.1 灭活菌粉的制备
准确称取10 g活性鼠李糖乳杆菌HN001冻干粉装入10 mL无菌离心管中,利用高压灭菌锅于121 ℃、0.12 MPa下热杀菌处理10 min,并用平板菌落计数法检测灭活效果,获得HK-HN001粉末。随后利用纯水配制质量浓度2 g/L的HK-HN001水溶液,分装低温保存备用。
1.4.2 实验动物处理
将24只小鼠随机分为3组(每组8只),分别为对照组、模型组和HK-HN001保护组。其中对照组小鼠正常饮水;模型组小鼠饮用20 g/L的DSS水溶液构建结肠炎模型;HK-HN001保护组小鼠饮用20 g/L的DSS水溶液的同时通过移液器饲喂100 μL(相当于200 mg/kg 体质量)上述HK-HN001水溶液每日1次;各组处理均连续进行3周,实验过程中每日记录动物体质量1次。实验结束后首先利用水合氯醛溶液麻醉小鼠,通过眼球取血法收集血清样本,随后利用CO2麻醉法处死小鼠。解剖采集小鼠结肠组织,测量结肠长度后分别低温保存用于后续分析。
1.4.3 疾病活动指数分析
通过每日监测实验动物体质量、直肠出血情况和粪便形态进行疾病活动指数(disease activity index,DAI)评分,具体分值如表1所示。
表1 疾病活动指数(DAI)评分表
Table 1 Disease activity index evaluation score

症状分数01234体重减轻率/%无1~55~1010~15>15大便黏稠度/腹泻正常大便大便松弛轻度腹泻中度腹泻水样腹泻出血无略有血色轻微出血中度出血大出血
1.4.4 结肠组织氧化逆境程度分析
结肠匀浆的制备:按照每0.1 g结肠组织与1 mL冰冷的组织匀浆液(150 mmol/L PBS,pH 7.2,1 mmol/L EDTA·Na2)的比例利用高通量组织匀浆仪对结肠组织充分匀浆,4 ℃、15 000 g/min离心15 min以除去细胞碎片和细胞核。取上清液并保存于-80 ℃待用。根据相关试剂盒操作说明书,检测上清液中T-SOD和MPO的活力,以及使用相应试剂盒测定GSH和MDA的含量,其中以牛血清白蛋白为标准,用Bradford法测定蛋白水平。
1.4.5 结肠组织切片制作及病理观察
生物样本经组织固定液固定72 h后进行常规梯度脱水,随后将结肠组织利用自动石蜡包埋机进行浸蜡和包埋,随后修整蜡块后利用切片机将石蜡块切成4 μm厚的切片,然后根据标准方法进行苏木精和伊红染色,最后在光学显微镜下进行结肠病理观察并拍照分析(20×)。
1.4.6 结肠组织炎症因子表达分析
使用ELISA试剂盒按照试剂盒说明书分别检测结肠匀浆液中IL-1β、IL-6和TNF-α的浓度。利用多功能酶标仪在450 nm波长处读取标准品及各检测样本的吸光度,测得的数据运用ELISACalc软件进行计算处理,单位为pg/g组织蛋白。
1.4.7 结肠组织肠道通透性分析
利用实验动物血浆中LPS浓度和DAO的活力作为指标评价肠道通透性。利用适量的血清样本,严格按照相关的试剂盒说明书操作,利用多功能酶标仪读取吸光度从而测定血清中LPS和DAO的含量,单位分别为ng/mL和U/mL。
1.4.8 结肠组织总RNA的提取与实时定量PCR检测
称取50 mg的结肠组织加入1.0 mL RNAiso Plus提取液,使用高通量匀浆仪将样品充分研磨后,将得到的样品组织匀浆4 ℃、15 000 r/min离心15 min,收集上清液并加入500 μL氯仿进行提取。将提取液4 ℃、12 000 r/min离心15 min,再次收集上清液,并用等体积的异丙醇于-20 ℃条件下助沉30 min;随后在4 ℃、12 000 r/min的条件下离心10 min,弃去上清液;随后利用体积分数75%乙醇对沉淀进行清洗,再于4 ℃、12 000 r/min条件下离心10 min,使用200 μL的DEPC水溶解沉淀获得总RNA提取。利用核酸定量仪检测总RNA浓度,使用DEPC水将原液稀释至50 ng/μL后,按照逆转录试剂盒说明书在超净台中于冰水浴条件下配制逆转录反应液,然后在PCR仪内按逆转录程序,即37 ℃、15 min和85 ℃、5 s进行逆转录,以获得cDNA样品。随后按照实时定量试剂盒说明书在超净台中于冰浴条件下配制反应液,然后在实时定量PCR仪中按优化的扩增条件进行实时定量检测。使用的引物序列如下:ZO-1(正向:5′-ACCACCAACCCGAGAAG-3′,反向:5′-CAGGAGTCATGGACGCAC-3′);Occludin(正向:5′-TTGAAAGTCCACCTCCTT-3′,反向:5′-CCGGATAAAAA-GAGTACG-3′);Claudin-1(正向:5′-GGCCTGATAGC-GAGCAC-3′,反向:5′-GTGACGCACTCCATCCAGA-3′);E-cadherin(正向:5′-CAGGTCTCCTCATGGCTT-3′,反向:5′-CTTCCGAAAAGA-AGGCTG-3′);β-actin(正向:5′-GCTGAGAGGGAA-ATCGTGCGTt-3′,反向:5′-ACCGCTCGTTGCCAATAG-TGA-3′)。
1.4.9 统计分析
所有数据的差异分析使用One-way ANOVA。根据Bartlett’s检验差异是否具有显著性而选择Dunnett’s或Tukey’s进行各组间的多重比较检验。数据表示方法为平均值±标准误差(mean ± SEM),当P<0.05时,组间存在显著差异。所有数据处理及分析软件使用GraphPad(Prism,USA)。
2 结果与分析
2.1 HK-HN001对结肠炎小鼠病理的影响
DSS诱导的小鼠结肠炎模型其主要病理特征为小鼠出现明显体质量减轻、腹泻或粪便疏松和可见的血便以及结肠长度缩短及损伤。由图1-a所示,模型组的DAI评分逐渐增加,在试验观察期结束时达到最大值,而HK-HN001保护组与模型组相比较,DAI评分从第10天开始显著降低直到实验观察期结束。这一结果说明补充HK-HN001显著改善了由DSS诱导引起的小鼠的体质量减轻、腹泻和血便。通过解剖测量各组小鼠结肠长度发现,模型组小鼠结肠长度显著降低(P<0.001),而HK-HN001保护组显著改善了DSS诱导的小鼠结肠缩短(P<0.01)(图1-b)。此外,病理分析结果显示,DSS处理后的小鼠结肠组织出现黏膜肠腺消失、炎性细胞浸润、上皮细胞肿胀和细胞质疏松以及黏膜下层结缔组织增生等情况。而HK-HN001补充显著改善这些病理特征(图1-c)。

a-DAI评分;b-结肠长度;c-结肠病理切片
图1 HK-HN001对DSS诱导的结肠炎小鼠病理的影响
Fig.1 Effects of HK-HN001 on DSS-induced histologic changes of colitis in mice
注:*P<0.05 **P<0.01和***P<0.001表示对照组与模型组比较;#P<0.01和##P<0.01表示模型组与HK-HN001组比较(下同)
2.2 HK-HN001对结肠炎小鼠氧化逆境的影响
结肠组织的氧化逆境是DSS诱导的小鼠结肠炎中的特征性分子变化,其中MPO是炎症、组织损伤和中性粒细胞浸润的重要生物标志物,主要反映炎症和氧化应激水平。有研究表明急性结肠炎往往伴随着氧化应激的增加,而降低结肠组织中的氧化应激是减轻结肠炎的潜在干预措施之一[16]。如图2所示,DSS显著诱导了小鼠结肠组织的氧化逆境,具体表现为结肠组织中T-SOD的活力降低、GSH含量显著降低,同时伴随着MPO活力和MDA含量的显著升高。然而,与模型组相比,HK-HN001保护组结肠组织中的T-SOD活力(P<0.05)和GSH含量(P<0.01)显著增加,而MPO活力(P<0.01)和MDA含量(P<0.01)显著减低。这些研究结果表明,HK-HN001的补充可以改善DSS诱导的小鼠结肠氧化应激。

a-T-SOD(U/mg组织蛋白)、GSH(nmol/mg组织蛋白);b-MPO(U/mg组织蛋白)、MDA(nmol/mg组织蛋白)
图2 HK-HN001对DSS诱导的结肠炎小鼠氧化逆境的影响
Fig.2 Effects of HK-HN001 on DSS-induced oxidative stress of colitis in mice
2.3 HK-HN001对结肠炎小鼠炎症反应的影响
氧化应激可以刺激多种促炎细胞因子的产生,最终导致结肠炎症。IL-1β、IL-6和TNF-α是结肠组织释放的主要促炎细胞因子,可能在结肠炎的发生发展中起重要作用,因此本文通过ELISA测量结肠组织中促炎细胞因子IL-1β、IL-6和TNF-α的水平来判断HK-HN001对结肠炎小鼠炎症反应的影响。结果表明,DSS处理后结肠组织中促炎细胞因子IL-1β、IL-6和TNF-α的水平均显著增加(P<0.001),然而补充HK-HN001的实验组显著降低了小鼠结肠组织中促炎细胞因子IL-1β(P<0.01)、IL-6(P<0.01)和TNF-α(P<0.001)的水平(图3)。这些结果提示,降低结肠的氧化应激、调节结肠组织的促炎细胞因子表达和黏膜免疫可能是HK-HN001改善DSS小鼠结肠炎的潜在机制之一。
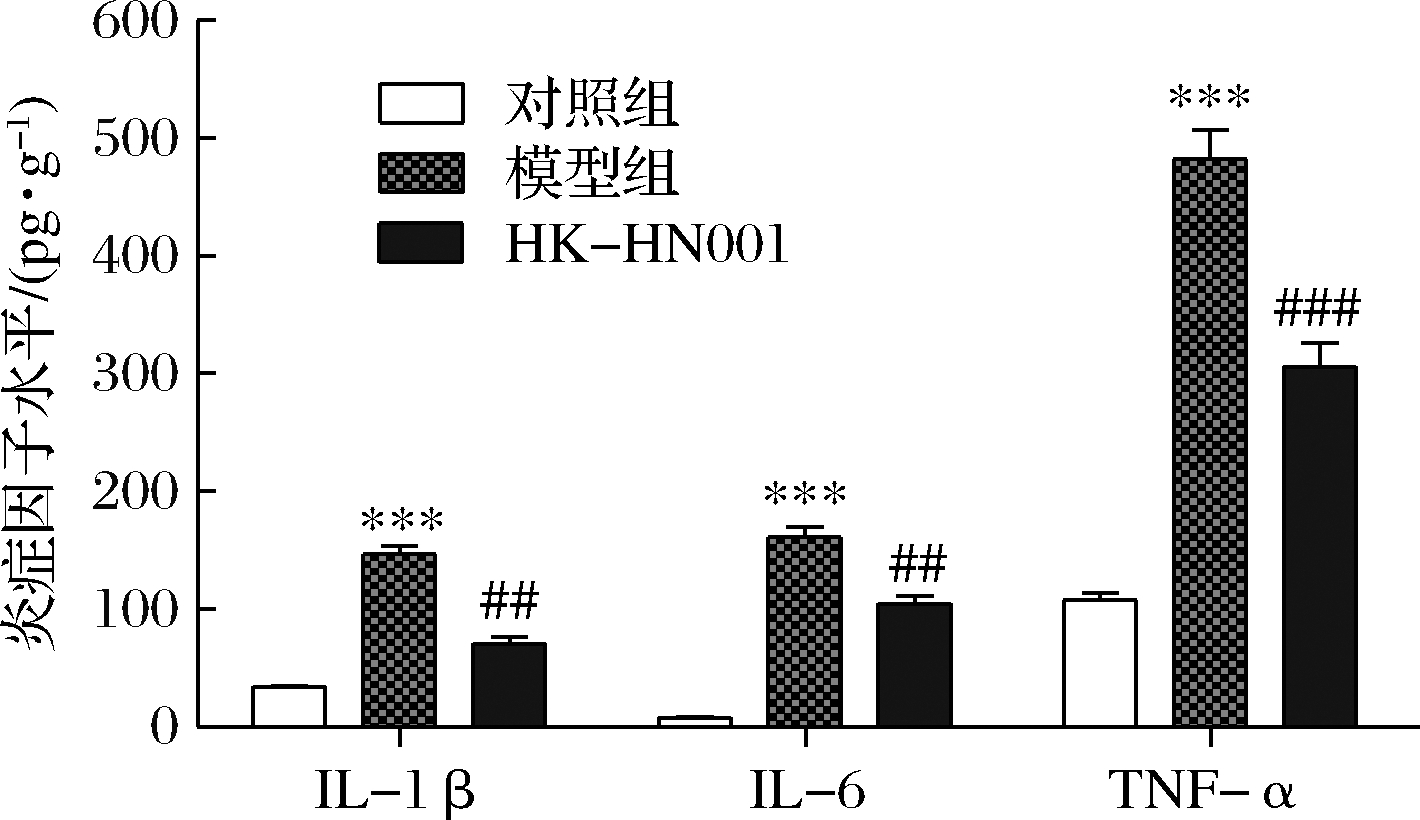
图3 HK-HN001对DSS诱导的结肠炎小鼠炎症反应的影响
Fig.3 Effects of HK-HN001 on DSS-induced inflammatory response of colitis in mice
2.4 HK-HN001对结肠炎小鼠结肠通透性的影响
结肠细胞可以表达紧密连接蛋白,主要包括ZO-1、Occludin、Claudin-1和E-cadherin等,它们形成天然的肠屏障,通过固有层阻止毒素和微生物抗原的外泄。研究表明,紧密连接蛋白表达的降低可以加速实验性结肠炎的发生发展[17]。血清LPS水平和DAO活力已被广泛用于评价肠道机械屏障的完整性和受损伤程度,肠屏障功能受损时血液中LPS水平显著增加。如图4所示,与对照组相比,模型组小鼠血清中LPS含量显著增加(P<0.01),同时DAO的活力显著降低(P<0.01),而HK-HN001保护组小鼠血清中LPS含量显著低于模型组(P<0.01),且血清中DAO的活力相对于模型组显著升高(P<0.05)。此外,利用实时定量PCR进一步分析了各组小鼠结肠组织中关键紧密连接蛋白的转录表达水平。结果显示,与对照组相比,模型组小鼠结肠组织中ZO-1(P<0.01)、Occludin(P<0.01)、Claudin-1(P<0.01)和E-cadherin(P<0.05)的转录表达水平均显著被抑制。而在HK-HN001保护组中,HK-HN001补充显著增强小鼠结肠组织中ZO-1(P<0.05)、Claudin-1(P<0.05)和E-cadherin(P<0.05)转录表达水平(图4-c)。这些结果表明HK-HN001补充可改善结肠炎小鼠的结肠通透性、降低血液中LPS水平,同时通过调节肠道紧密连接蛋白基因的表达促进肠屏障功能。
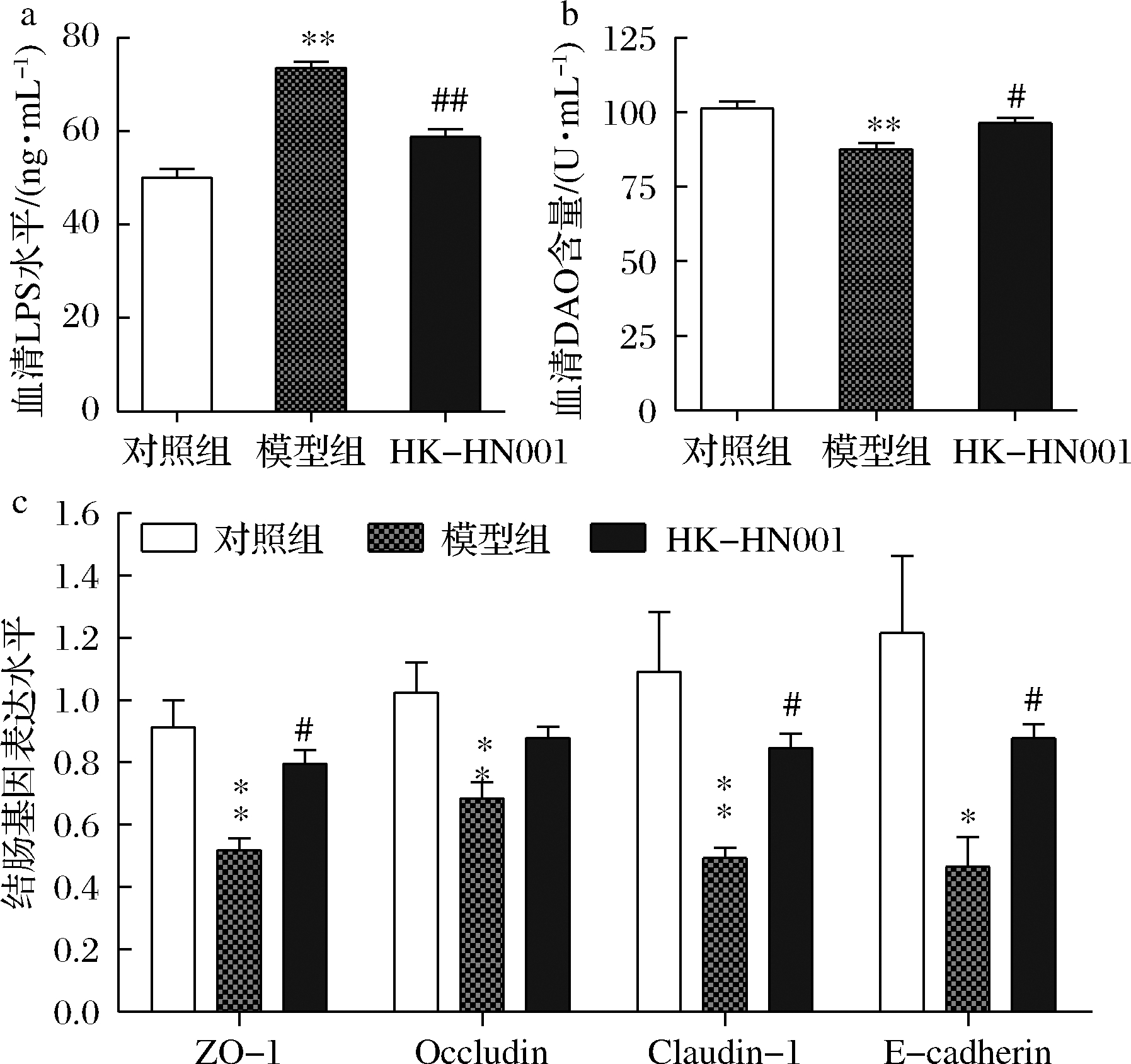
a-血清LPS水平;b-血清DAO含量;c-结肠紧密连接蛋白基因表达水平
图4 HK-HN001对DSS诱导的结肠炎小鼠肠道通透性的影响
Fig.4 Effects of HK-HN001 on DSS-induced intestinal permeability of colitis in mice
3 讨论与结论
最近研究指出热灭活益生菌对宿主产生有益影响,这很可能是由于肠道细胞能够识别特定的细菌成分由黏液相关淋巴组织介导免疫反应,这些成分包括具有免疫刺激活性的DNA、细胞壁成分(如肽聚糖或脂磷壁酸)以及胞内和胞外多糖产物[18]。同时越来越多的证据表明,活性的和热灭活的益生菌均可保护结肠炎实验动物的上皮屏障[19-20]。例如,热灭活鼠李糖乳杆菌OLL2838已经被证明可以保护结肠炎小鼠的黏膜屏障通透性缺陷[7]。利用大肠杆菌C1845感染的Caco-2/TC7细胞单层模型,热灭活的嗜酸乳杆菌LB及其培养基抵消了大肠杆菌C1845诱导的细胞间隙通透性的增加[21]。肠细胞可以表达紧密连接蛋白,包括ZO-1、Claudins和Occladin,它们形成天然的肠道屏障,通过固有层阻止毒素和微生物抗原[17]。研究表明实验性结肠炎的发生伴随着紧密连接蛋白表达的降低[22]。在本研究中DSS增加通透性(血清LPS)同时下调紧密连接蛋白的表达,而HK-HN001显著减轻DSS诱导的小鼠结肠屏障功能异常,这些结果说明,HK-HN001可以通过调节紧密连接蛋白的表达促进肠屏障功能的改善。本研究未做等量的活菌功效对比研究,但热灭活菌有其特殊的应用范围,例如可加入热饮或加热便当中食用,因此虽有不足但本研究仍具有积极的意义和应用价值。总之,HK-HN001对DSS诱导的小鼠结肠炎模型具有保护作用,能恢复结肠炎导致的结肠长度的减少并缓解结肠炎相关症状,同时减轻DSS诱导的结肠炎小鼠组织的病理学改变。此外,HK-HN001对DSS诱导的结肠氧化损伤具有保护作用,同时能够降低结肠炎小鼠炎症细胞因子的含量;HK-HN001还能够改善结肠炎小鼠结肠的通透性并修复结肠屏障功能紊乱。综上所述,HK-HN001对DSS诱导的小鼠结肠炎具有保护作用,研究结果为热灭活益生菌食品开发及营养应用提供了理论支持。
[1] JEONG S Y,IM Y N,YOUM J Y,et al.L-glutamine attenuates DSS-induced colitis via induction of MAPK phosphatase-1[J].Nutrients,2018,10(3):288.
[2] EICHELE D D,KHARBANDA K K.Dextran sodium sulfate colitis murine model:An indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis[J].World Journal of Gastroenterology,2017,23(33):6 016-6 029.
[3] NOVIK G,SAVICH V.Beneficial microbiota.probiotics and pharmaceutical products in functional nutrition and medicine[J].Microbes and Infection,2020,22(1):8-18
[4] ISLAM S U.Clinical uses of probiotics[J].Medicine(Baltimore),2016,95(5):e2 658.
[5] ABRAHAM B P,QUIGLEY E M M.Probiotics in inflammatory bowel disease[J].Gastroenterology Clinics of North America,2017,46(4):769-782.
[6] GANJI-ARJENAKI M,RAFIEIAN-KOPAEI M.Probiotics are a good choice in remission of inflammatory bowel diseases:A meta analysis and systematic review[J].Journal of Cellular Physiology,2018,233(3):2 091-2 103.
[7] MIYAUCHI E,MORITA H,TANABE S.Lactobacillus rhamnosus alleviates intestinal barrier dysfunction in part by increasing expression of zonula occludens-1 and myosin light-chain kinase in vivo[J].Journal of Dairy Science,2009,92(6):2 400-2 408.
[8] BOYLE R J,ROBINS-BROWNE R M,TANG M L K.Probiotic use in clinical practice:What are the risks?[J]The American Journal of Clinical Nutrition,2006,83(6):1 256-1 264.
[9] OHISHI A,TAKAHASHI S,ITO Y,et al.Bifidobacterium septicemia associated with postoperative probiotic therapy in a neonate with omphalocele[J].The Journal of Pediatrics,2010,156(4):679-681.
[10] GOLDENBERG J Z,MA S S Y,SAXTON J D,et al.Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children[J].The Cochrane Database of Systematic Reviews,2013(5):CD006095.
[11] RODR GUEZ-NOGALES A,ALGIERI F,VEZZA T,et al.The viability of Lactobacillus fermentum CECT5716 is not essential to exert intestinal anti-inflammatory properties[J].Food & Function,2015,6(4):1 176-1 184.
GUEZ-NOGALES A,ALGIERI F,VEZZA T,et al.The viability of Lactobacillus fermentum CECT5716 is not essential to exert intestinal anti-inflammatory properties[J].Food & Function,2015,6(4):1 176-1 184.
[12] UENO N,FUJIYA M,SEGAWA S,et al.Heat-killed body of Lactobacillus brevis SBC8803 ameliorates intestinal injury in a murine model of colitis by enhancing the intestinal barrier function[J].Inflammatory Bowel Diseases,2011,17(11):2 235-2 250.
[13] FANG S B,SHIH H Y,HUANG C H,et al.Live and heat-killed Lactobacillus rhamnosus GG upregulate gene expression of pro-inflammatory cytokines in 5-fluorouracil-pretreated Caco-2 cells[J].Supportive Care in Cancer,2014,22(6):1 647-1 654.
[14] LI N,RUSSELL W,DOUGLAS-ESCOBAR M,et al.Live and heat-killed Lactobacillus rhamnosus GG:Effects on proinflammatory and anti-inflammatory cytokines/chemokines in gastrostomy-fed infant rats[J].Pediatric Research,2009,66(2):203-207.
[15] ZHANG L Y,LI N,CAICEDO R,et al.Alive and dead Lactobacillus rhamnosus GG decrease tumor necrosis factor-alpha-induced interleukin-8 production in Caco-2 cells[J].The Journal of Nutrition,2005,135(7):1 752-1 756.
[16] VEZZA T,RODR GUEZ-NOGALES A,ALGIERI F,et al.Flavonoids in inflammatory bowel disease:A review[J].Nutrients,2016,8(4):211.
GUEZ-NOGALES A,ALGIERI F,et al.Flavonoids in inflammatory bowel disease:A review[J].Nutrients,2016,8(4):211.
[17] LANDY J,RONDE E,ENGLISH N,et al.Tight junctions in inflammatory bowel diseases and inflammatory bowel disease associated colorectal cancer[J].World Journal of Gastroenterology,2016,22(11):3 117-3 126.
[18] ADAMS C A.The probiotic paradox:Live and dead cells are biological response modifiers[J].Nutrition Research Reviews,2010,23(1):37-46.
[19] SHEN Z H,ZHU C X,QUAN Y S,et al.Relationship between intestinal microbiota and ulcerative colitis:Mechanisms and clinical application of probiotics and fecal microbiota transplantation[J].World Journal of Gastroenterology,2018,24(1):5-14.
[20] PIQUÉ N,BERLANGA M,MI ANA-GALBIS D.Health benefits of heat-killed(tyndallized)probiotics:An overview[J].International Journal of Molecular Sciences,2019,20(10):2 534.
ANA-GALBIS D.Health benefits of heat-killed(tyndallized)probiotics:An overview[J].International Journal of Molecular Sciences,2019,20(10):2 534.
[21] LIEVINLE MOAL V,SARRAZIN-DAVILA L E,SERVIN A L.An experimental study and a randomized,double-blind,placebo-controlled clinical trial to evaluate the antisecretory activity of Lactobacillus acidophilus strain LB against nonrotavirus diarrhea[J].Pediatrics,2007,120(4):e795-803.
[22] ZHU L G,HAN J,LI L,et al.Claudin family participates in the pathogenesis of inflammatory bowel diseases and colitis-associated colorectal cancer[J].Frontiers in Immunology,2019,10:1 441.