微生物产生的胞外多糖(extracellular polysaccharides,EPS)是其在生长代谢过程中分泌到细胞壁外的黏液多糖或夹膜多糖[1]。自然界中产生胞外多糖的微生物很多,传统的发酵食品(如酸奶、泡菜、酸面团等)中含有大量产胞外多糖的乳酸菌[2]。传统发酵食品来源的微生物胞外多糖被公认为是安全的,特别是乳酸菌产生的胞外多糖,可以直接作为发酵剂或添加物应用于发酵食品中[3]。研究发现,产胞外多糖的乳酸菌能够改善乳制品的质构、黏度和风味,使其发酵乳质构细腻黏稠、结构稳定、口感润滑[4]。乳酸菌胞外多糖还具有提高免疫力、降胆固醇、抗病毒、抗氧化、抗肿瘤等多种生理活性[5]。乳酸菌胞外多糖的免疫调节功能是研究最为广泛的,也是被普遍认同的,其作用机制主要是通过增强细胞介导的免疫反应(如促进T/B淋巴细胞增殖、激活NK细胞活性、增强单核细胞吞噬能力等)来加强机体的免疫防护作用,从而提高免疫力[6]。
乳酸菌被认为是绿色安全的益生菌,因此产胞外多糖的乳酸菌可以直接应用到发酵生产中[7]。同时,乳酸菌胞外多糖还可作为益生元促进肠道内其他益生菌的生长,改善肠道微生态环境,促进机体健康[8]。鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG,LGG)是研究最多的益生菌之一。研究发现,LGG能够在胃肠道内存活并定植[9],具有产胞外多糖的特性[10],同时也可促进有益菌在肠道定植,并激活肠道免疫反应,提高机体免疫力[11]。
本研究从传统发酵食品中分离乳酸菌,以LGG菌株为对照,进行产胞外多糖乳酸菌的筛选,并对高产胞外多糖乳酸菌特性进行研究,同时探索了乳酸菌和其胞外多糖的免疫活性,及在发酵乳中的应用。以期为开发具有一定生理活性的产胞外多糖的乳酸菌功能性发酵剂提供理论依据。
1 材料和方法
1.1 材料与试剂
雄性SPF级昆明小鼠,浙江省中医药大学动物实验中心。人结直肠腺癌细胞HT-29,中国科学院上海生命科学研究院细胞资源中心。鼠李糖乳杆菌GG分离自市售产品康萃乐益生菌粉,杭州娃哈哈集团菌种保藏中心。
MRS培养基,英国Oxoid生物试剂有限公司;细菌/细胞总DNA提取试剂盒,北京天根生化科技有限公司。
1.2 实验仪器
DU800紫外分光光度计,美国Beckman公司;Multiskan Sky酶标仪,赛默飞世尔科技(中国)有限公司;OLYMPUS BX61光学显微镜,日本Olympus株式会社;DV2T黏度计,美国BROOKFIELD公司;AFL-W15A乳品发酵监控仪,法国AMS Alliance iCinac公司;905 Titrando电位滴定仪,瑞士Metrohm公司。
1.3 实验方法
1.3.1 菌株分离纯化与鉴定
1.3.1.1 菌株分离纯化
称取1 mL(或1 g)样品(采集西藏、新疆、贵州、青海和四川的泡菜、酸奶等)加入9 mL无菌生理盐水中,充分混匀,10倍梯度稀释,取适当稀释梯度稀释液0.1 mL,涂布于固体MRS培养基上,于37 ℃厌氧培养48 h。根据菌落形态特征挑选典型单个菌落,划线分离2~3次,获得纯菌株,编号,于杭州娃哈哈集团菌种保藏中心保藏。
1.3.1.2 16S rDNA鉴定
用细菌基因组DNA提取试剂盒提取菌株DNA,用引物27-F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492-R(5′-GGTTACCTTGTTACGACTT-3′)进行16S rDNA片段扩增,扩增产物送苏州金唯智生物科技有限公司测序,测序结果通过NCBI-BLAST数据库比对[12]。根据菌株16S rRNA序列,通过MEGA5软件,采用最大似然法构建系统发育进化树。
1.3.2 产胞外多糖乳酸菌的筛选和胞外多糖的提取纯化
1.3.2.1 胞外多糖乳酸菌的筛选
将分离纯化得到的菌株,在固体MRS培养基上划线,于30和37 ℃厌氧培养24 h。用无菌牙签挑取单菌落,比较菌落拉丝的长度。
1.3.2.2 胞外多糖提取和纯化
菌株种子液接种于MRS液体培养基中,在30和37 ℃恒温培养箱中培养24 h,收集菌液。菌液煮沸10 min后,冷却,7 000 r/min,4 ℃离心20 min收集上清液,加入质量分数为80%的三氯乙酸溶液至质量分数为4%,4 ℃静置过夜。7 000 r/min,4 ℃离心20 min收集上清液,加入2.5倍体积的体积分数为95%冰乙醇4 ℃过夜,7 000 r/min,4 ℃离心20 min收集沉淀。沉淀用蒸馏水溶解,装入透析袋(截留分子质量14 kDa)中透析48 h,每8 h换一次蒸馏水,透析液冷冻干燥96 h[6,13]。LGG菌株为对照菌。
1.3.2.3 胞外多糖检测
采用苯酚-硫酸法[14]测总糖含量,3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法测定还原糖含量,用总糖含量减去还原糖含量,差值即为胞外多糖含量。
1.3.3 菌株生物学特性研究
1.3.3.1 生长和产酸曲线
菌株种子液接种于MRS液体培养基中,在37 ℃下培养24 h,每隔2 h取样1次,测定在600 nm波长的光密度(OD)值和pH值,绘制生长曲线和产酸曲线。
1.3.3.2 耐受性实验
菌株活化后,取对数生长末期菌液,4 000 r/min离心10 min,弃上清液,获得菌泥。分别进行如下操作:①加入等体积pH 2.5的MRS培养基,充分混匀,37 ℃培养4 h,用平板计数法测定0、1、2和4 h后活菌数。②加入等体积质量分数为0.3%胆盐的MRS培养基,充分混匀,37 ℃培养8 h,用平板计数法测定0、4和8 h后活菌数[15]。LGG菌株为对照菌。按公式(1)计算菌株存活率:
(1)
式中:S为菌株存活率,%;N1为菌株培养后活菌数对数值,CFU/mL;N0为菌株培养0 h活菌数对数值,CFU/mL。
1.3.3.3 菌株的黏附特性
建立HT-29细胞培养体系,以1×106细胞/孔的密度接种于已放置细胞爬片的12孔细胞培养板中,37 ℃ 5% CO2培养箱中培养2 d。菌株活化后,取对数生长末期菌液,4 000 r/min离心10 min,弃上清液,获得菌泥,重悬于含质量分数为10%胎牛血清的DMEM完全培养基中,取2×108 CFU/mL的菌液1 mL接种于上述12孔细胞培养板中,37 ℃ 5% CO2培养箱中孵育2 h。孵育结束后,吸去培养液,PBS溶液洗涤2次,甲醇固定8 min。取出细胞爬片静置20 min,经革兰氏染色后,用中性树脂封片[16]。于光学显微镜下进行观察,每个片子随机选取10个视野计数。LGG菌株为对照菌。
1.3.4 菌株及其胞外多糖免疫活性
1.3.4.1 菌株免疫活性
昆明小鼠饲养温度为(21±2)℃,湿度为 40%~70%,12 h光照交替,自由摄入小鼠维持饲料和饮水。昆明小鼠脱颈椎处死,无菌取小鼠脾脏,经200目金属筛网过滤后,加入ACK细胞裂解液(5倍于细胞体积)裂解5 min,加入无菌Hank’s液(9倍体积于裂解液)终止裂解,1 000 r/min,4 ℃离心5 min。沉淀重悬于5 mL 含质量分数为10%胎牛血清的RPMI-1 640培养基[17-18]。用台盼蓝染色,血细胞计数板计数,调整细胞浓度为5×106 cells/mL。菌株活化后,菌液浓度调整至2×108 CFU/mL。
将细胞悬液加入96孔细胞培养板,分为调零组、空白对照组、诱导剂组(10 μg/mL Con A或LPS)和菌处理组(10 μg/mL Con A或LPS+菌悬液),37 ℃ 5% CO2培养箱中培养72 h。培养结束后,每孔加入20 μL 2.5 g/L MTT溶液,37 ℃显色4 h后,加入100 μL DMSO,用酶标仪于490 nm下测定吸光值[19]。LGG菌株为对照菌。
1.3.4.2 菌株胞外多糖免疫活性
将昆明小鼠脾淋巴细胞细胞悬液(5×106 cells/mL)加入96孔细胞培养板,分为调零组、空白对照组、诱导剂组(10 μg/mL Con A或LPS)和胞外多糖处理组(10 μg/mL Con A或LPS+不同质量浓度胞外多糖,质量浓度为0.001、0.005、0.01、0.025、0.050和0.100 g/L),37 ℃ 5% CO2培养箱中培养72 h。培养结束后,进行MTT实验。
1.3.5 发酵乳中的应用
称取脱脂乳100 g,45~50 ℃的纯水900 g,50 ℃温水溶解,剪切30 min,50 ℃水化30 min,均质,95 ℃杀菌10 min,降温备用。菌株以1×106 CFU/mL接种于上述脱脂乳中,37 ℃发酵12 h,4 ℃后熟8~12 h。观察凝乳状态,用打蛋器破乳后,检测其拉丝长度、产酸曲线、黏度、酸度,并对其发酵风味进行评估。
2 统计分析
每个实验设置3次重复,数据分析用SPSS 17.0软件,作图用Graph Pad Prism 6.01版本软件,显著性分析用Duncan’s多重比较检验法进行,测定指标均表示为“平均值±标准差”,显著水平设置为0.05和0.01。
3 结果与分析
3.1 产胞外多糖菌株筛选与胞外多糖含量测定
36个样品共计分离得到224株乳酸菌。经菌落拉丝初筛,获得4株有明显单菌落拉丝的菌株,编号为WHH483、WHH589、WHH647和WHH997。其中WHH589拉丝长度最长,依次是WHH483、WHH647和WHH997。提取胞外多糖后,产量最高的菌株为WHH589(图1),达0.58 g/L,显著高于对照菌LGG和其他3株乳酸菌,胞外多糖产量是LGG(0.28 g/L)的2.07倍。
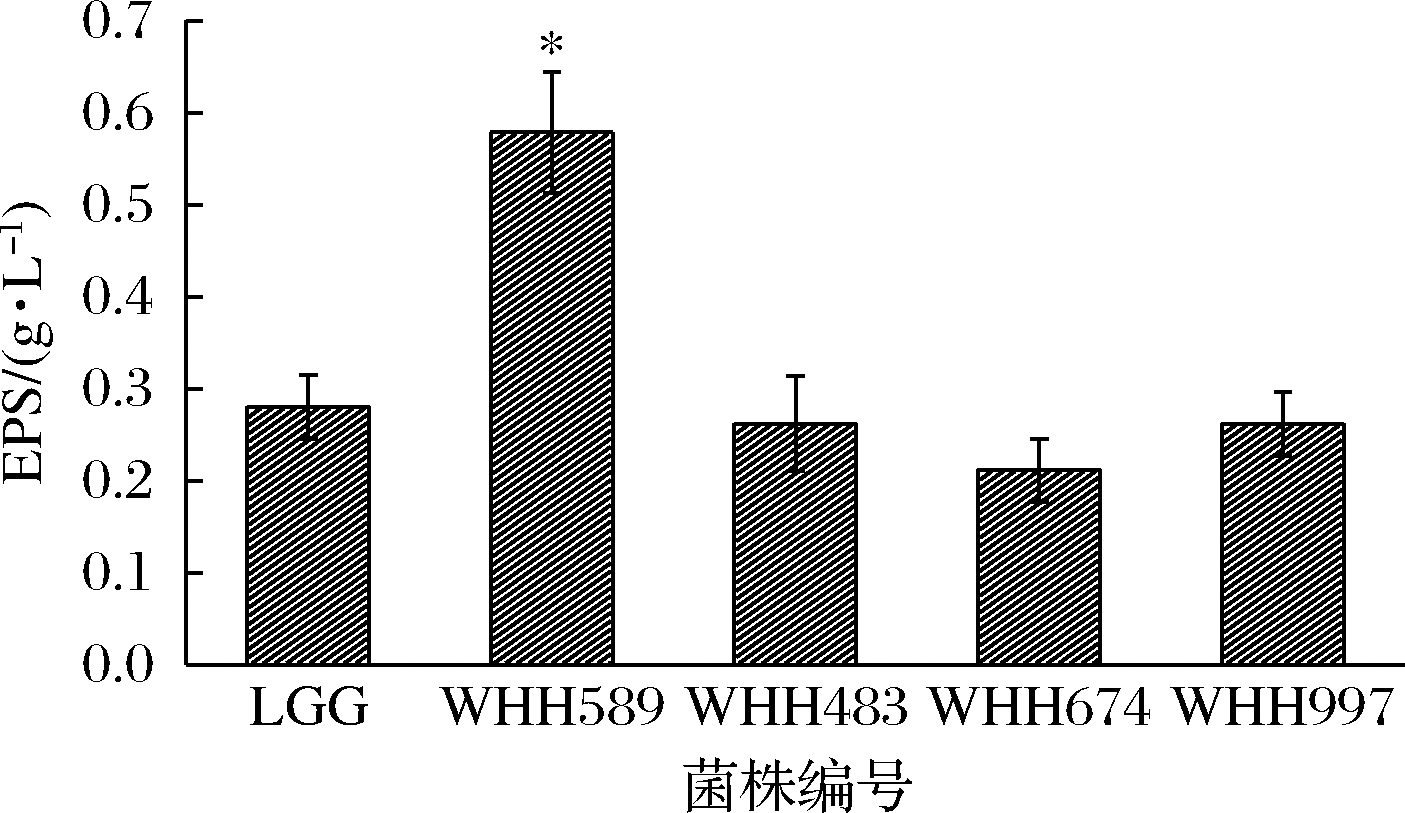
图1 胞外多糖产量
Fig.1 Production of extracellular polysaccharide
注:与对照组相比,*:P<0.05;**:P<0.01(下同)
3.2 WHH589菌株鉴定与保藏
WHH589分离自四川泡菜样品,WHH589的16S rRNA基因序列测序结果于NCBI的GenBank数据库进行同源性比对分析,并构建系统发育进化树。结果显示WHH589为植物乳杆菌(Lactobacillus plantarum),命名为植物乳杆菌WHH589(图2)。植物乳杆菌WHH589于2018年5月25日在中国微生物菌种保藏管理委员会普通微生物菌种保藏中心保藏,微生物保藏编号为CGMCC No.15811。

图2 植物乳杆菌WHH589 16S rRNA序列系统发育树
Fig.2 Phylogenetic tree based on 16S rRNA gene sequences for L.plantarum WHH589
3.3 植物乳杆菌WHH589基础特性
3.3.1 植物乳杆菌WHH589生长和产酸曲线
生长曲线和产酸速率是反应乳酸菌活力的重要特征。由图3可知,植物乳杆菌WHH589显示出较好的生长和产酸能力。植物乳杆菌WHH589在经过0~2 h的迟缓期后,从2 h开始快速生长,进入对数生长期,14 h结束对数期后进入稳定期;植物乳杆菌WHH589在接种后10 h产酸趋于平稳,pH达3.80~4.00。
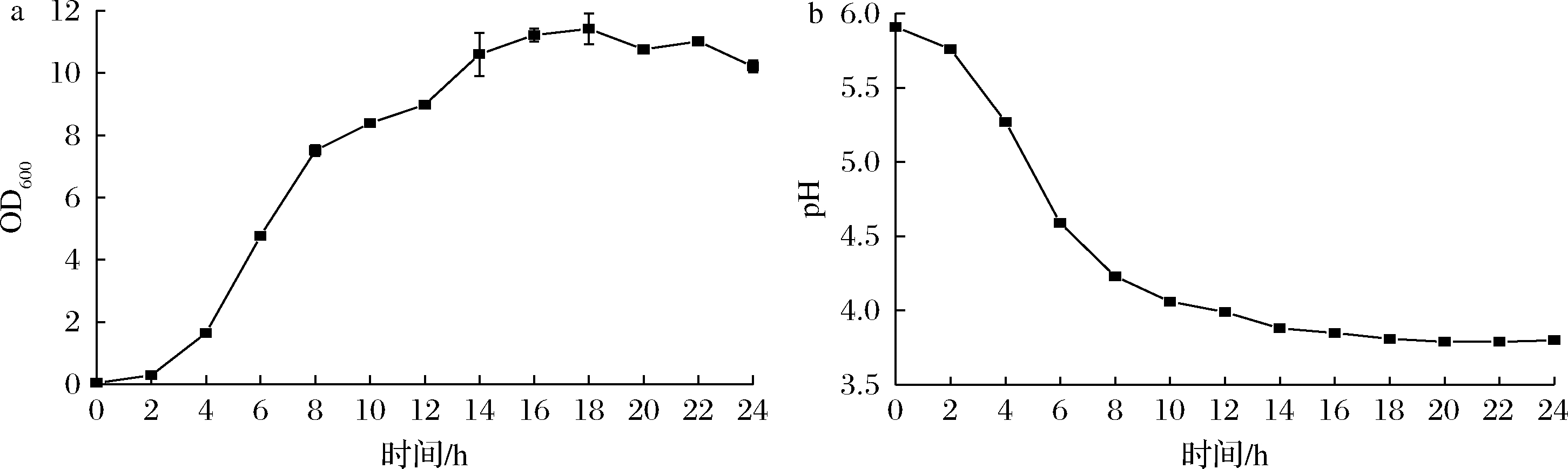
a-生长曲线;b-产酸曲线
图3 植物乳杆菌WHH589的生长曲线和产酸曲线
Fig.3 Growth and acid production curve of L.plantarum WHH589
3.3.2 植物乳杆菌WHH589耐受性
胃肠道环境极其复杂和严苛,乳酸菌能否顺利通过胃肠道,并保持活性,对发挥其益生功能至关重要。由表1可知,植物乳杆菌WHH589具有良好的耐酸和耐胆盐的特性。在酸环境下孵育4 h后,存活率高达97.77%,达到5.91×108 CFU/mL,优于对照菌LGG,其存活率仅为92.22%。在胆盐环境下孵育8 h后,存活率高达94.81%,虽然低于对照菌LGG,但也达到4.71×107 CFU/mL,表现出较好的胆盐耐受性。
表1 植物乳杆菌WHH589的耐受性
Table 1 Tolerance of L.plantarum WHH589
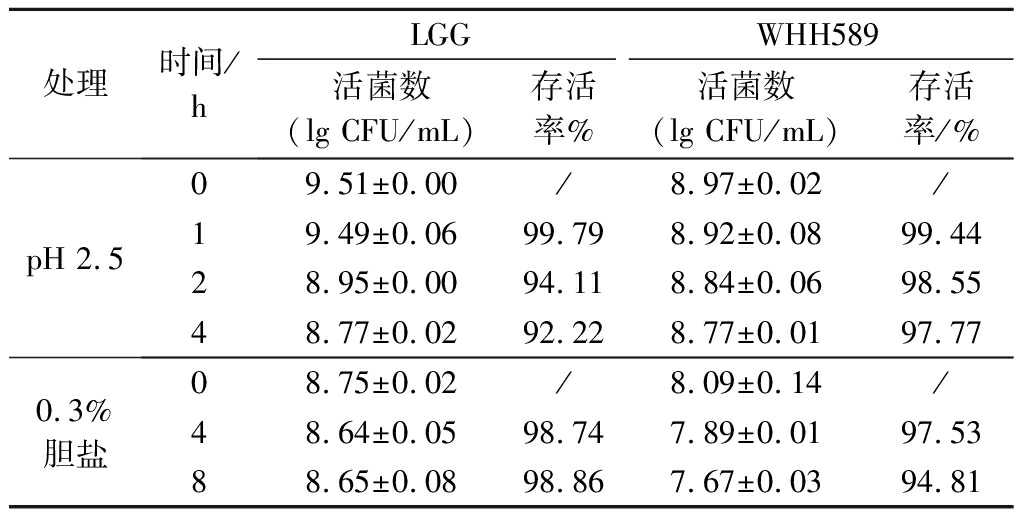
处理时间/hLGGWHH589活菌数(lgCFU/mL)存活率%活菌数(lgCFU/mL)存活率/%pH2.509.51±0.00/8.97±0.02/19.49±0.0699.798.92±0.0899.4428.95±0.0094.118.84±0.0698.5548.77±0.0292.228.77±0.0197.770.3%胆盐08.75±0.02/8.09±0.14/48.64±0.0598.747.89±0.0197.5388.65±0.0898.867.67±0.0394.81
3.3.3 植物乳杆菌WHH589黏附性
乳酸菌黏附性是评价其能否在肠道定植,发挥益生功能的重要标准。由图4可知,植物乳杆菌WHH589具有良好的黏附特性。黏附率为(1.96±0.15)菌数/细胞,与对照菌LGG相当,LGG黏附率为(1.75±0.30)菌数/细胞。
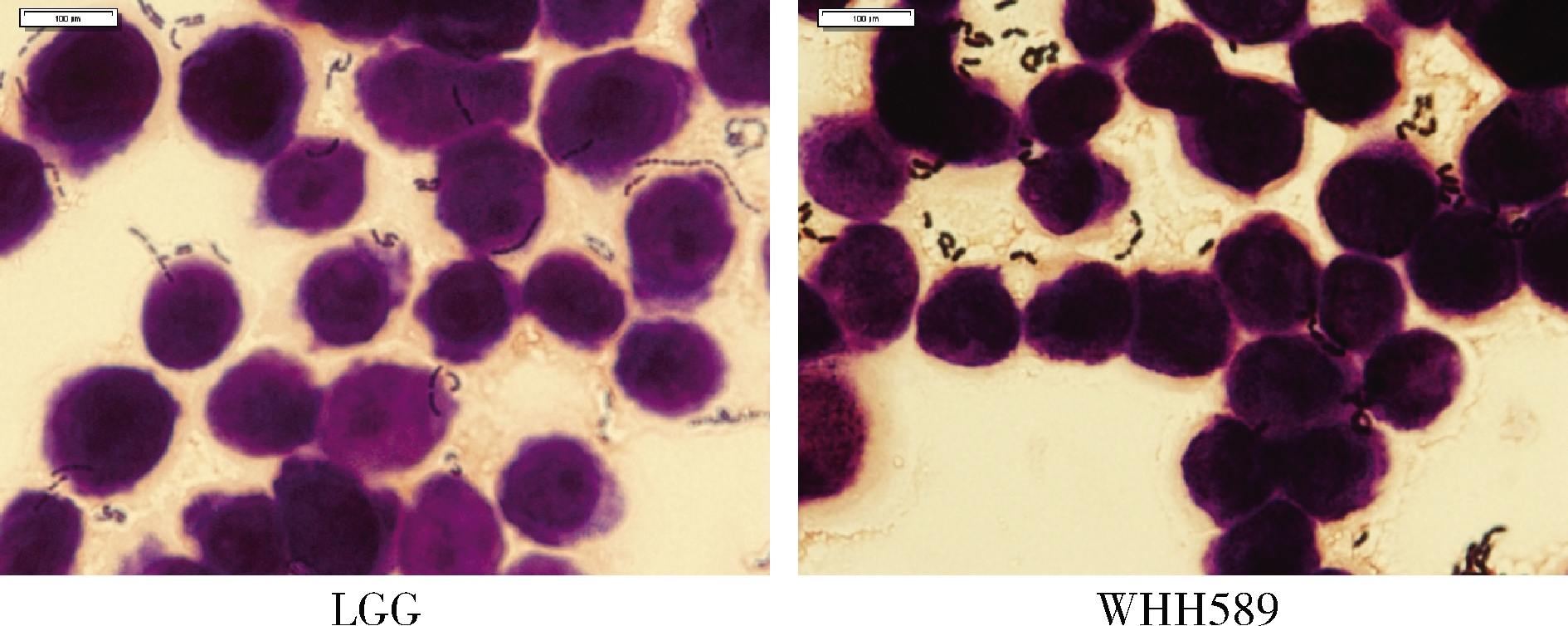
图4 植物乳杆菌WHH589的黏附性
Fig.4 Adhesion of L.plantarum WHH589
3.4 植物乳杆菌WHH589及其胞外多糖免疫活性
3.4.1 植物乳杆菌WHH589免疫活性
由图5可知,植物乳杆菌WHH589能够显著促进脾脏中T、B淋巴细胞的增殖,具有免疫调节活性,且优于LGG菌株。在没有诱导剂的条件下,促脾淋巴细胞增殖提高79.79%,与LGG相当;在LPS诱导的条件下,促脾淋巴细胞增殖提高110.36%,是LGG的1.20倍;在Con A诱导的条件下,促脾淋巴细胞增殖提高127.55%,是LGG的1.13倍。
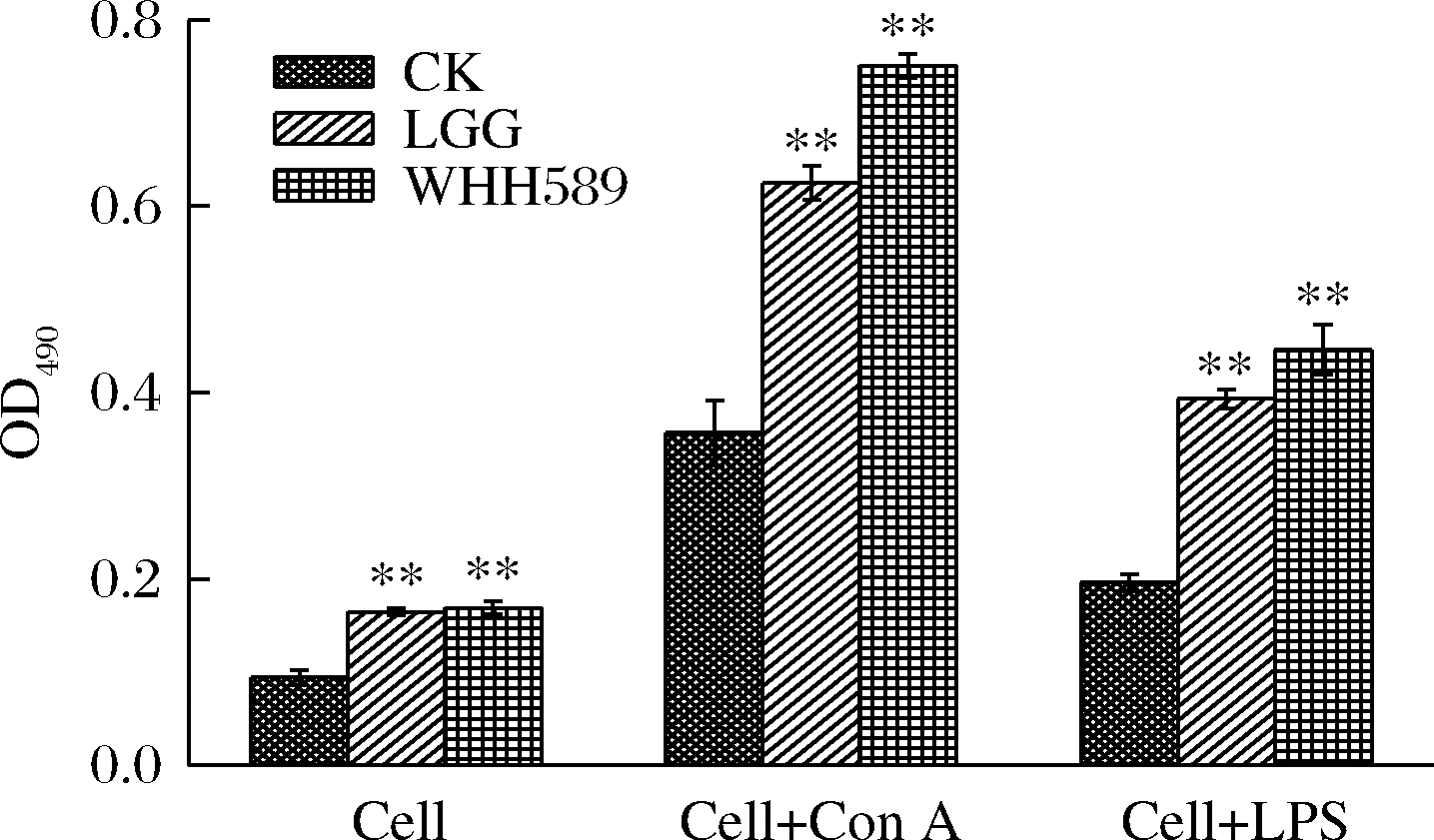
图5 植物乳杆菌WHH589的促脾淋巴细胞增殖
Fig.5 The results of splenic lymphocyte proliferation
3.4.2 植物乳杆菌WHH589胞外多糖免疫活性
由表2可知,植物乳杆菌WHH589分泌的胞外多糖能够显著促进脾淋巴细胞增殖。在没有诱导剂的条件下可提高93.27%~164.42%;在LPS诱导的条件下可提高80.15%~125.95%;在Con A诱导的条件下可提高81.58%~149.12%。说明植物乳杆菌WHH589分泌的胞外多糖不同浓度作用效果不同,但都能够显著促进脾脏中T、B淋巴细胞的增殖,具有免疫调节活性,质量浓度在1~100 μg/mL都有显著效果,且10~25 μg/mL效果最佳。
表2 植物乳杆菌WHH589的胞外多糖促脾淋巴细胞增殖结果
Table 2 The proliferation of splenic lymphocyte promoted by the extracellular polysaccharides of L. plantarum WHH589
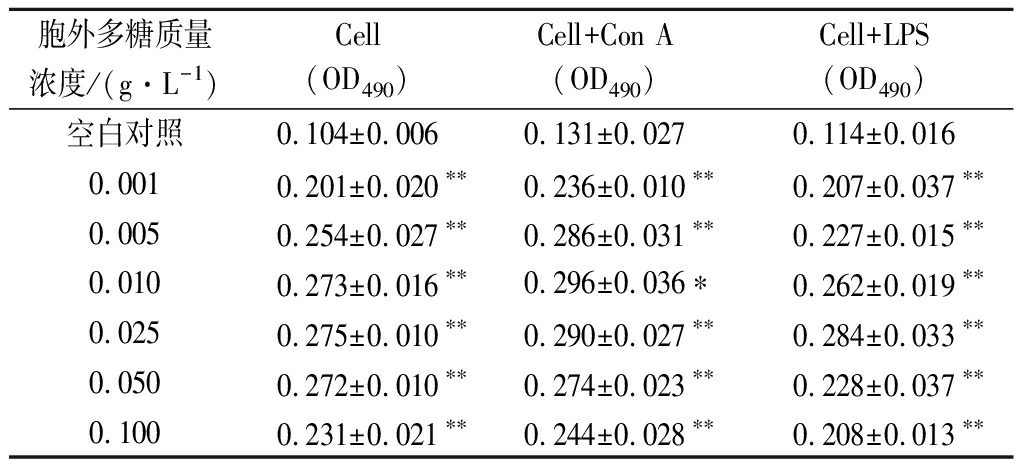
胞外多糖质量浓度/(g·L-1)Cell(OD490)Cell+ConA(OD490)Cell+LPS(OD490)空白对照0.104±0.0060.131±0.0270.114±0.0160.0010.201±0.020**0.236±0.010**0.207±0.037**0.0050.254±0.027**0.286±0.031**0.227±0.015**0.0100.273±0.016**0.296±0.036*0.262±0.019**0.0250.275±0.010**0.290±0.027**0.284±0.033**0.0500.272±0.010**0.274±0.023**0.228±0.037**0.1000.231±0.021**0.244±0.028**0.208±0.013**
3.5 植物乳杆菌WHH589在发酵乳中的应用
由表3和图6可知,植物乳杆菌WHH589发酵乳凝乳状态紧实,表面光滑,无乳清析出,破乳后丝滑黏稠,拉丝长度(25.57±0.57)cm,活菌数达4.97×108 CFU/g,感官和风味良好,奶香明显,口感细腻丝滑。植物乳杆菌WHH589可以作为发酵剂应用于发酵乳制品中。
表3 发酵乳特性
Table 3 Characteristics of fermented milk
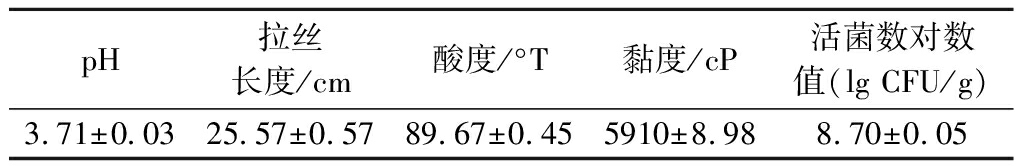
pH拉丝长度/cm酸度/°T黏度/cP活菌数对数值(lgCFU/g)3.71±0.0325.57±0.5789.67±0.455910±8.988.70±0.05
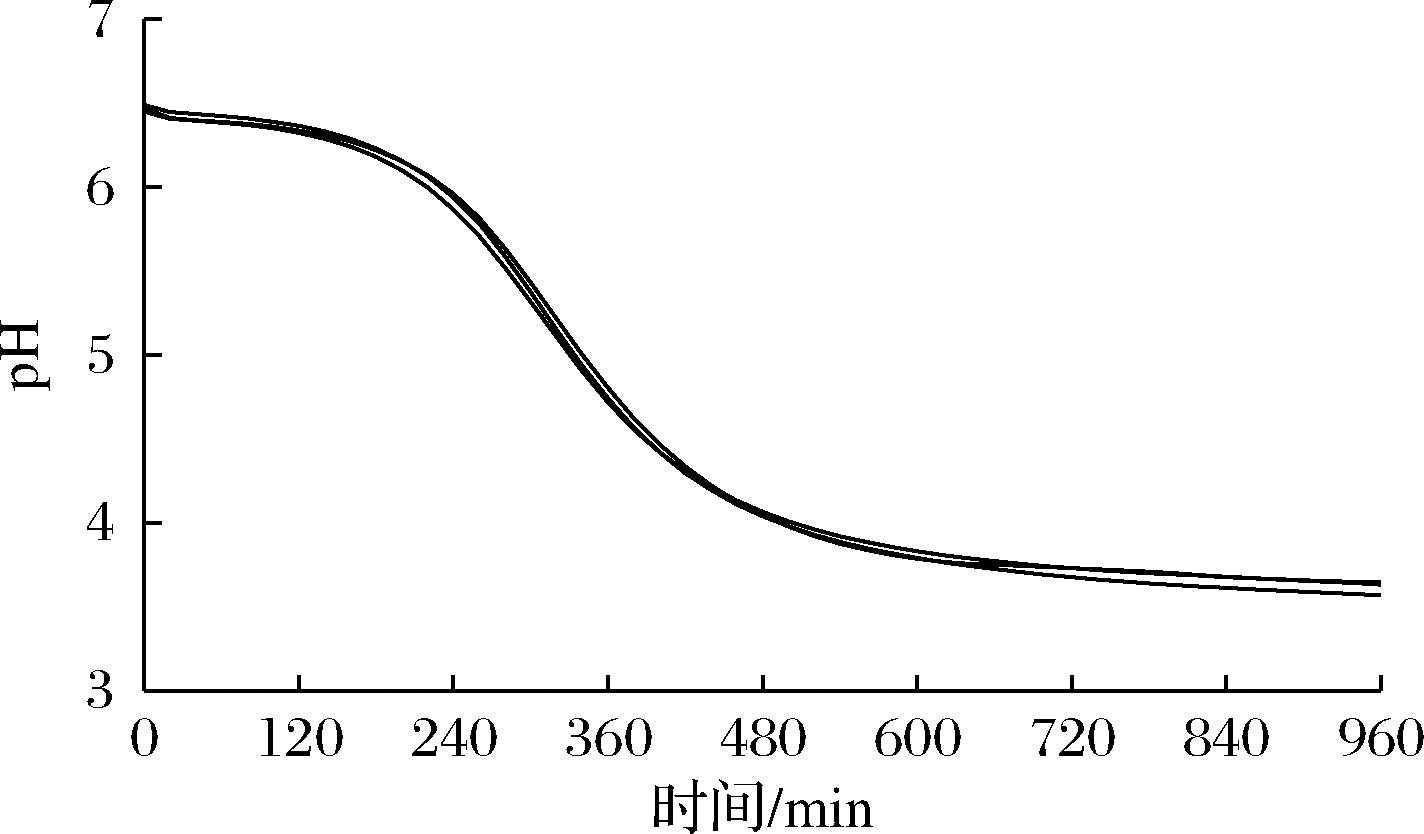
图6 发酵产酸速率曲线
Fig.6 The production rate of acid by fermentation
4 讨论
胞外多糖产量除受到菌株本身遗传特性的影响外,培养基组成、培养时间、培养温度、pH等也是影响胞外多糖产量的重要因素[20]。同时,胞外多糖的提取、纯化方法也很关键,如提取的方法(甲醇、乙醇、异丙醇和丙酮)、除蛋白的方法(Sevage法、三氟三氯乙烷法和三氯乙酸法)、除去杂质的方法(透析法、离子交换树脂法和凝胶过滤法),对获得高纯度的胞外多糖十分重要[21]。研究发现,LGG是1株产胞外多糖的乳酸菌,不同文献报道其胞外多糖产量不同,CLAS等研究发现LGG菌株在牛奶中培养胞外多糖产量为0.08 g/L[11],张娟等[22]研究了不同培养条件和提取方法对LGG菌株胞外多糖产量的影响,发现其产量在0.025~0.296 g/L,这与菌株的培养条件、胞外多糖的提取方法有关。本研究以LGG菌株为对照菌,在同一条件下,与筛选到4株产胞外多糖的乳酸菌进行比较,经过除蛋白、醇沉和透析获得胞外多糖,发现其中一株植物乳杆菌WHH589胞外多糖产量显著高于LGG菌株(P<0.01),达到0.58 g/L,LGG胞外多糖产量为0.28 g/L,其他3株乳酸菌胞外多糖产量与LGG相当,说明植物乳杆菌WHH589是一株高产胞外多糖的乳酸菌。
人胃内的pH值空腹到餐后范围在1~4.5变化,食物在胃内停留在3 h左右;胆盐浓度在0.03%~0.3%,但也会随着饮食的变化而改变,食物在小肠内停留在4 h左右[23]。乳酸菌能否在胃肠道低pH、高胆盐浓度的环境下存活,并黏附于肠道上皮细胞,对其在肠道内定植和功能发挥至关重要。本研究分析了植物乳杆菌WHH589菌株在pH 2.5和0.3%胆盐条件下的存活情况,以及在HT-29细胞表面的黏附性,发现植物乳杆菌WHH589菌株在pH 2.5条件下可存活4 h以上,存活率高达97.77%;在0.3%胆盐环境下可存活8 h以上,存活率高达94.81%;在HT-29细胞表面的黏附率为(1.96±0.15)菌数/细胞,表现出良好的耐受性和黏附特性。
脾脏是T/B淋巴细胞定居的主要场所,也是初次免疫应答产生抗体的主要器官。T淋巴细胞和B淋巴细胞是两类重要的免疫激活细胞,T淋巴细胞主要参与细胞免疫,而B淋巴细胞则是产生抗体。Con A作为T淋巴细胞的有丝分裂原,仅对T淋巴细胞的增殖起促进作用,对B淋巴细胞不起作用;反之LPS仅能诱导B淋巴细胞增殖[6]。当有病原体入侵时,T、B淋巴细胞被激活,参与免疫应答,清除病原体,保护机体健康。KIM等[24]研究发现LGG能够促进小鼠脾淋巴细胞增值,具有免疫调节功能。胞外多糖具有免疫活性,一方面它能够通过激活非特异性免疫中巨噬细胞和NK细胞活性,提高机体分泌免疫分子的能力;另一方面又能通过激活T淋巴细胞和B淋巴细胞活性,作用于特异性免疫系统,增强机体免疫力[25]。本研究分析了植物乳杆菌WHH589菌株对小鼠脾淋巴细胞增殖效果,以LGG菌株为阳性对照,发现菌浓度在1×107 CFU/mL时,植物乳杆菌WHH589能显著促进T淋巴细胞和B淋巴细胞增殖(P<0.01),与LGG相当。同时,植物乳杆菌WHH589胞外多糖质量浓度在1~100 μg/mL时,也能显著促进T淋巴细胞和B淋巴细胞增殖(P<0.01),提高机体免疫力。
乳酸菌胞外多糖可作为增稠剂、稳定剂和保鲜剂等应用于食品领域。产胞外多糖的乳酸菌作为发酵剂可以改善乳制品的质地、稳定性和口感,同时乳酸菌胞外多糖能够解决发酵乳凝胶易破裂和易脱水收缩等问题,使得发酵乳结构更加稳定,延长保质期[26]。本研究对植物乳杆菌WHH589在发酵乳中的应用进行探究,发现植物乳杆菌WHH589发酵乳质构黏稠,拉丝明显,长度达25.57 cm,口感细腻丝滑,活菌数达4.97×108 CFU/g,同时植物乳杆菌WHH589及其胞外多糖又具有免疫活性,可以作为功能性发酵剂用于发酵食品中,提高产品附加属性。
5 结论
综上所述,本研究从四川泡菜样品中分离得到1株植物乳杆菌,命名为WHH589,微生物保藏编号为CGMCC No.15 811。研究发现植物乳杆菌WHH589具有良好的耐受性和黏附性,能够产生大量胞外多糖,菌株及其胞外多糖能够显著促进脾淋巴细胞增值,且发酵特性优良,可作为功能性发酵剂应用于发酵乳中。
[1] 卢承蓉, 叶美芝,上官文丹,等.高产胞外多糖乳酸菌的诱变育种及其益生特性[J].食品与发酵工业,2020,46(12):14-20.
LU C R,YE M Z,SHANGGUAN W D,et al.Mutation breeding for high-yield exopoiysaccharide lactic acid bacteria and evaluation of its probiotic properties[J].Food and Fermentation Industries,2020,46(12):14-20.
[2] ANGELIN J,KAVITHA M.Exopolysaccharides from probiotic bacteria and their health potential[J].International Journal of Biological Macromolecules,2020,162:853-865.
[3] ZANNINI E,WATERS D M,COFFEY A,et al.Production,properties,and industrial food application of lactic acid bacteria-derived exopolysaccharides[J].Applied Microbiology and Biotechnology,2016,100(3):1 121-1 135.
[4] LYNCH K M,ZANNINI E,COFFEY A,et al.Lactic acid bacteria exopolysaccharides in foods and beverages:Isolation,properties,characterization and health benefits[J].Annual Review of Food Science and Technology,2018,9:155-176.
[5] RAHBAR SAADAT Y,YARI KHOSROUSHAHI A,POURGHASSEM GARGARI B.A comprehensive review of anticancer,immunomodulatory and health beneficial effects of the lactic acid bacteria exopolysaccharides[J].Carbohydrate Polymers,2019,217:79-89.
[6] 邵丽.产胞外多糖乳杆菌的筛选及其多糖的分离、结构和生物活性研究[D].无锡:江南大学,2015.
SHAO L,Screening of exopolysaccharide-producing lactobacilli and separation,structure and bioactivities of exopolysaccharide[D].Wuxi:Jiangnan University,2015.
[7] WU M H,PAN T M,WU Y J,et al.Exopolysaccharide activities from probiotic bifidobacterium:Immunomodulatory effects(on J774A.1 macrophages)and antimicrobial properties[J].International Journal of Food Microbiology,2010,144(1):104-110.
[8] SANDERS M E,MERENSTEIN D J,REID G,et al.Probiotics and prebiotics in intestinal health and disease:From biology to the clinic[J].Nature Reviews,Gastroenterology & Hepatology,2019,16(10):605-616.
[9] GOLDIN B R,GORBACH S L,SAXELIN M,et al.Survival of Lactobacillus species(strain GG)in human gastrointestinal tract[J].Digestive Diseases and Sciences,1992,37(1),37:121-128.
[10] LANDERSJÖ C,YANG Z N,HUTTUNEN E,et al.Structural studies of the exopolysaccharide produced by Lactobacillus rhamnosus strain GG(ATCC 53103)[J].Biomacromolecules,2002,3(4):880-884.
[11] LUDWIG I S,BROERE F,MANURUNG S,et al.Lactobacillus rhamnosus GG-derived soluble mediators modulate adaptive immune cells[J].Frontiers in Immunology,2018,9:1 546.
[12] CHEN S,CHEN L,CHEN L E,et al.Potential probiotic characterization of Lactobacillus reuteri from traditional Chinese highland barley wine and application for room-temperature-storage drinkable yogurt[J].American Dairy Science Association,2018,101:5 780-5 788.
[13] 张文平, 赵英杰,罗晟,等.高产胞外多糖植物乳杆菌筛选及其发酵工艺优化[J].食品与发酵工业,2019,45(21):38-45.
ZHANG W P,ZHAO Y J,LUO S,et al.Screening of Lactobacillus plantarum with higher yield of exopolysaccharides andoptimization of fermentation conditions[J].Food and Fermentation Industries,2019,45(21):38-45.
[14] 邝嘉华, 黄燕燕,胡金双,等.解淀粉芽孢杆菌 DMBA-K4 高产胞外多糖的发酵条件优化及其抗氧化活性研究[J].食品与发酵工业,2020,46(22):28-35.
KUANG J H,HUANG Y Y,HU J S,et al.Optimization of fermentation conditions and anti-oxidation of exopolysaccharide produced by Bacillus amyloliquefaciens DMBA-K4[J].Food and Fermentation Industries,2020,46(22):28-35.
[15] 刘之园, 贾俊霞,姜昊蔚,等.耐酸耐胆盐益生菌的筛选及其益生特性研究[J].中国酿造,2020,39(11):103-108.
LIU Z Y,JIA J X,JIANG H W,et al.Screening of probiotics resistant to acid and bile salt and their probiotic properties[J].China Brewing,2020,39(11):103-108.
[16] TUO Y F,ZHANG W Q,ZHANG L W,et al.Study of probiotic potential of four wild Lactobacillus rhamnosus strains[J].Anaerobe,2013,21:22-27.
[17] PATURI G.Probiotic characteristics of Lactobacillus acidophilus and Lactobacillus paracasei and their effects on immune response and gene expression in mice[D].Australia:University of Western Sydney,2007.
[18] MAJDALAWIEH A F,HMAIDAN R,CARR R I.Nigella sativa modulates splenocyte proliferation,Th1/Th2 cytokine profile,macrophage function and NK anti-tumoractivity[J].Journal of Ethnopharmacology,2010,131(2):268-275.
[19] WEN L J,HOU X L,WANG G H,et al.Immunization with recombinant Lactobacillus casei strains producing K99,K88 fimbrial protein protects mice against enterotoxigenic Escherichia coli[J].Vaccine,2012,30(22):3 339-3 349.
[20] PINTADO A E,FERREIRA J A,PINTADO M E,et al.Efficiency of purification methods on the recovery of exopolysaccharides from fermentation media[J].Carbohydr Polymers,2020,231:115 703.
[21] 陈晓红.乳酸菌胞外多糖的生物合成及其组成和体外抑瘤活性研究[D].南京:南京农业大学,2003.
Study on the biosynthesis,formation and antitumor activity in vitro of exopolysaccharide produced by lactic acid bacteria[D].Nanjing:Nanjing Agricultural University,2003.
[22] 张娟, 刘丽,高侃,等.鼠李糖乳酸杆菌Lactobacillus rhamnosus GG胞外多糖合成与提取优化研究[J].饲料工业,2014,35(13):30-34.
ZHANG J,LIU L,GAO K,et al.Optimization of conditions in synthesis and extraction of exopolysaccharide of Lactobacillus rhamnosus GG[J].Feed Industry,2014,35(13):30-34.
[23] 李倩.降胆固醇益生菌的筛选及副干酪乳杆菌Jlus66对非酒精性脂肪肝的功效[D].长春:吉林大学,2018.
LI Q.Screening of cholesterol-lowering probiotics and the efficacy of Lactobacillus paracasei Jlus66 on non-alcoholic fatty liver[D].Changchun:Jilin University,2018.
[24] KIM B J,JUNG H W,LEE K P,et al.Novel Lactobacillus plantarum and composition comprising the same:America,US201202-08260A1[P].20120816[20201118].
[25] 梁增澜, 李超,王艳萍.乳酸菌胞外多糖免疫活性的研究进展[J].食品与发酵工业,2018,44(2):266-272.
LIANG Z L,LI C,WANG Y P.Research progressing of immune regulatory activity of exopolysaccharides synthesized by lactic acid bacterium[J].Food and Fermentation Industries,2018,44(2):266-272.
[26] 李彬.产胞外多糖菌株的筛选及胞外多糖性质和结构分析[D].南京:南京理工大学,2016.
LI B.Screening of exopolysaccharide-producing strains and properties and structure analysis of the exopolysaccharides[D].Nanjing:Nanjing University of Science and Technology,2016.