由于臭氧层的破坏,更多的紫外线(ultraviolet light,UV)穿过臭氧层辐射到地球表面,患皮肤疾病的患者逐年增多,严重危害人民群众的身心健康。辐射到地面的UV,按照其波长可以分为3种、UVA(320~420 nm)、UVB(275~320 nm)和UVC(200~275 nm),其中UVB能穿过表皮层,直达表皮层与真皮层交界面,是导致皮肤光老化发生的主要原因[2]。皮肤光老化是一种由过多UV不断辐射积累造成的皮肤早衰现象[1],不仅损害容貌美观,而且与许多疾病的发生有着密切联系。如何预防和治疗皮肤光老化已成为皮肤和化妆品研究领域的热点。
过多的UVB辐射皮肤不仅会对细胞里的生物大分子(蛋白质和DNA)造成损伤,而且还会减低细胞内抗氧化酶的活性,导致细胞内活性氧(reactive oxygen species,ROS)的含量升高。过量的ROS通过MAPK信号通路促进基质金属蛋白酶(matrix metalloproteinase,MMPs)的表达,加速细胞外基质(extracellular matrix,ECM)中胶原纤维的降解,从而导致皮肤胶原蛋白流失,加速皱纹的形成[4-5]。胶原蛋白前体对于胶原蛋白的形成起着至关重要的作用,因此抑制ROS的活性和抑制胶原蛋白的降解为预防和治疗光老化提供了新的策略。
香港牡蛎(Crassostrea hongkongensis),是分布于我国南部沿海的一种重要的养殖贝类[6]。据明代李时珍所著《本草纲目》记载:“牡蛎肉,炙食甚美,令人细肌肤,美颜色”[7]。前期研究发现,牡蛎具有抗氧化、抗炎、降血压、解酒护肝和抗肿瘤等功效[6]。虽有研究报道牡蛎水解产物能抑制UVB辐射后小鼠皮肤黑色素和皱纹的形成,然而关于牡蛎蛋白酶解产物抗UVB诱导的皮肤光老的研究报道相对较少。
本研究首先采用碱沉酸提的方法提取牡蛎分离蛋白,再用中性蛋白酶进行酶解获得牡蛎蛋白酶解产物(oyster protein enzymatic hydrolysate,OPEH),逐级通过分子筛获得4个超滤组分。通过对比OPEH和这4个超滤组分的体外总抗氧化能力,在UVB辐射诱导的HaCaT光老化细胞模型上,评价OPEH及其超滤组分的抗皮肤光老化的活性。
1 材料与方法
1.1 材料与试剂
香港牡蛎,广东省湛江市水产品批发市场;维生素C(PHR1008),美国Sigma公司;DMEM基础培养基(C11995500BT)、胎牛血清(10100147),Gibco 生物公司;0.25%的胰酶(J170025), Hyclone生物公司;中性蛋白酶(30万U/g),庞博生物工程有限公司;CCK-8试剂盒,日本同仁化学公司;活性氧检测试剂盒(S0033S),碧云天生物技术有限公司;I型胶原蛋白前体测定试剂盒(E-EL-H0181c),Elabscience生物技术有限公司;人永生化角层细胞,苏州北纳创联生物技术有限公司,细胞培养在含10%胎牛血清的DMEM培养基中,放置在5% CO2, 37 ℃的恒温恒湿细胞培养箱培养。
1.2 仪器与设备
UVB紫外灯管(9 W),飞利浦照明有限公司;Varioskan Flash全自动酶标仪,美国Thermo公司;FD-551大型立式冷冻干燥机,东京理化器械公司;DM2000 LED荧光倒置显微镜,德国Leica公司。
1.3 实验方法
1.3.1 OPEH和各超滤组分的制备
牡蛎蛋白提取工艺参照郑慧娜等[9]的实验方案,采用碱提酸沉的方法(碱提pH=12,酸沉pH=4.8)从新鲜牡蛎全肉中提取牡蛎蛋白,制成冻干粉。采用中性蛋白酶酶解牡蛎蛋白(物料比为1∶3,加酶量为6 000 U/g蛋白质,50 ℃,3 h)。灭活中性蛋白酶后(90 ℃,10 min),离心取上清液(1×104 r/min,20 min)获得OPEH。然后将上清液逐级通过8 k、5 k、3 kDa分子筛超滤膜,共截留出<3 kDa(OPEH-1)、3 k~5 kDa(OPEH-2)、5 k~8 kDa(OPEH-3)和>8 kDa(OPEH-4)4个超滤组分。
1.3.2 OPEH及各超滤组分体外总抗氧化能力测定
OPEH及各超滤组分的总抗氧化能力测定采用的是ABTS法,具体操作步骤参照产品说明书。
1.3.3 UVB辐射和HaCaT细胞活力的测定及细胞形态观察
HaCaT细胞在T25细胞培养瓶中长到70%~80%时,用0.25%的胰酶消化细胞,制成细胞悬液。向96孔板种植细胞(1×104个/孔)。待细胞完全贴壁后,吸干培养基,用PBS溶液将细胞清洗3遍,并在底部留少许液体。将96孔板置于由8根并排排列的UVB紫外灯管(9 W,发射光谱在285~350 nm之间,峰值在310~315 nm,灯管距离孔板16 cm)所组成的辐射仪下。参考XIAO等[10]实验方案,以35 mJ/cm2的辐射强度照射细胞,随后向细胞加入100 μL 混有待测样品的DMEM基础培养基。24 h后,测定CCK-8试剂盒细胞活力。并在倒置显微镜下拍照记录HaCaT细胞的形态。
1.3.4 细胞外I型胶原蛋白前体表达的测定
采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒测定I型胶原蛋白前体在HaCaT 细胞外含量。首先在24孔板接种HaCaT细胞(1×105个/孔),如1.3.3节所示进行紫外辐射和给药处理。24 h后,收集培养基,离心(2 500 r/min,4 ℃,20 min),收取上清液,参照ELISA试剂说明书进行浓度测定。
1.3.5 细胞内ROS表达的测定
用活性氧检测试剂盒检测HaCaT 细胞内ROS的生成。在24孔板或者96孔荧光酶标板接种HaCaT细胞(分别为1×105个/孔,1×104个/孔),如1.3.3节所示进行紫外辐射和给药处理。12 h后,吸出培养基,加入新鲜无血清含10 μmol/L DCFH-DA培养液,37 ℃避光孵育20 min。随后,用PBS溶液冲洗细胞3次。在荧光倒置显微镜下拍照记录24孔板中DCF的荧光信息强度,或者在荧光酶标仪上检测96孔荧光酶标板中DCF荧光的强弱。
1.4 数据处理
实验结果以平均值±标准差的形式表示。采用 SPSS 17.0统计软件进行单因素方差分析、结合LSD法进行组间对比,P<0.05,为有显著性差异,P<0.01,为有极显著性差异。
2 结果与分析
2.1 OPEH及各超滤组分体外总抗氧化能力比较
采用ABTS法测定OPEH及各超滤组分体外总的抗氧化能力[14]。由表1可知,OPEH-1、OPEH-2以及OPEH均表现出较好的ABTS阳离子自由基清除能力,其ABTS阳离子自由基半清除质量浓度分别为156.083、273.505和243.133 μg/mL。其中OPEH-1的ABTS阳离子自由基半清除质量浓度最低,说明OPEH-1具有最好的体外总的抗氧化能力。
表1 OPEH及各超滤组分ABTS阳离子自由基抑制质量浓度的比较
Table 1 The ABTS+ radical half scavenging concentration of each components
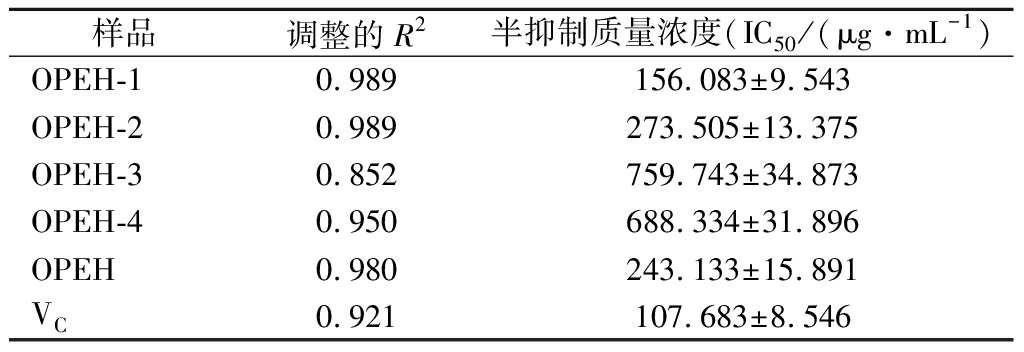
样品调整的R2半抑制质量浓度(IC50/(μg·mL-1)OPEH-10.989156.083±9.543OPEH-20.989273.505±13.375OPEH-30.852759.743±34.873OPEH-40.950688.334±31.896OPEH0.980243.133±15.891VC0.921107.683±8.546
前期的研究表明UVB辐射皮肤后,会抑制皮肤组织中的抗氧化酶体系,加速抗氧化物质的降解,造成体内大量的氧化自由基的积累[11-12]。据报道富含疏水性氨基酸的多肽有很强的抗氧化活性[15]。本课题前期研究表明OPEH-1富含多种疏水氨基酸,占到所有游离氨基酸的41.81%[7],另外通过LC/MS/MS质谱分析结果发现OPEH-1主要是由一系列分子质量小于2 kDa(占总成分的95.6%)的小分子肽组成。而来自于深海鱼类的海洋胶原蛋白肽以及从罗非鱼明胶和鳕鱼皮中提取的小分子肽,被报道具有抗皮肤光老化的活性[15]。因此我们推测具有较好体外抗氧化能力的OPEH-1具有潜在的抗皮肤光老化活性。
2.2 OPEH及各超滤组分细胞对HaCaT 细胞活力的影响
角质形成细胞是皮肤组织表皮层的主要细胞类型,在皮肤防御方面起着关键作用。在其不断的细胞分化和更新过程中,细胞的形态大小和排列有规律地发生变化,最后形成富含角蛋白的角质层细胞[10],其过度地衰老和凋亡也是皮肤光老化的一个典型的病理特征[15]。由图1可知,与对照组相比较,35 mJ/cm2辐射强度的UVB辐射人角层HaCaT 细胞后,细胞活力显著地下降(P<0.01),细胞活力仅为对照组的61%左右。前期研究表明,当细胞活力在 60%左右的时候,细胞不至于因UVB 辐射而受损过重,同时细胞中与抗光老化相关的蛋白会有所表达,可认为在此辐射剂量下光老化的细胞模型造模成功[10]。对UVB辐射后的HaCaT 细胞加入不同质量浓度的牡蛎蛋白酶解产物及其各超滤组分处理细胞24 h 后,OPEH-1、OPEH-2、OPEH均能对UVB辐照后光老化HaCaT细胞的细胞活力具有保护作用,并且呈现出较好的剂量依赖性。OPEH-1在质量浓度>50 μg/mL 后就能显著地提升UVB辐照后HaCaT细胞的活力。OPEH-2、OPEH在质量浓度>100 μg/mL 后也能显著地能提升UVB辐照后HaCaT细胞的活力(P<0.05)。从CCK-8的实验结果可知,在UVB损伤的HaCaT光老化细胞模型上,OPEH-1表现出最好的抗光老化活性。
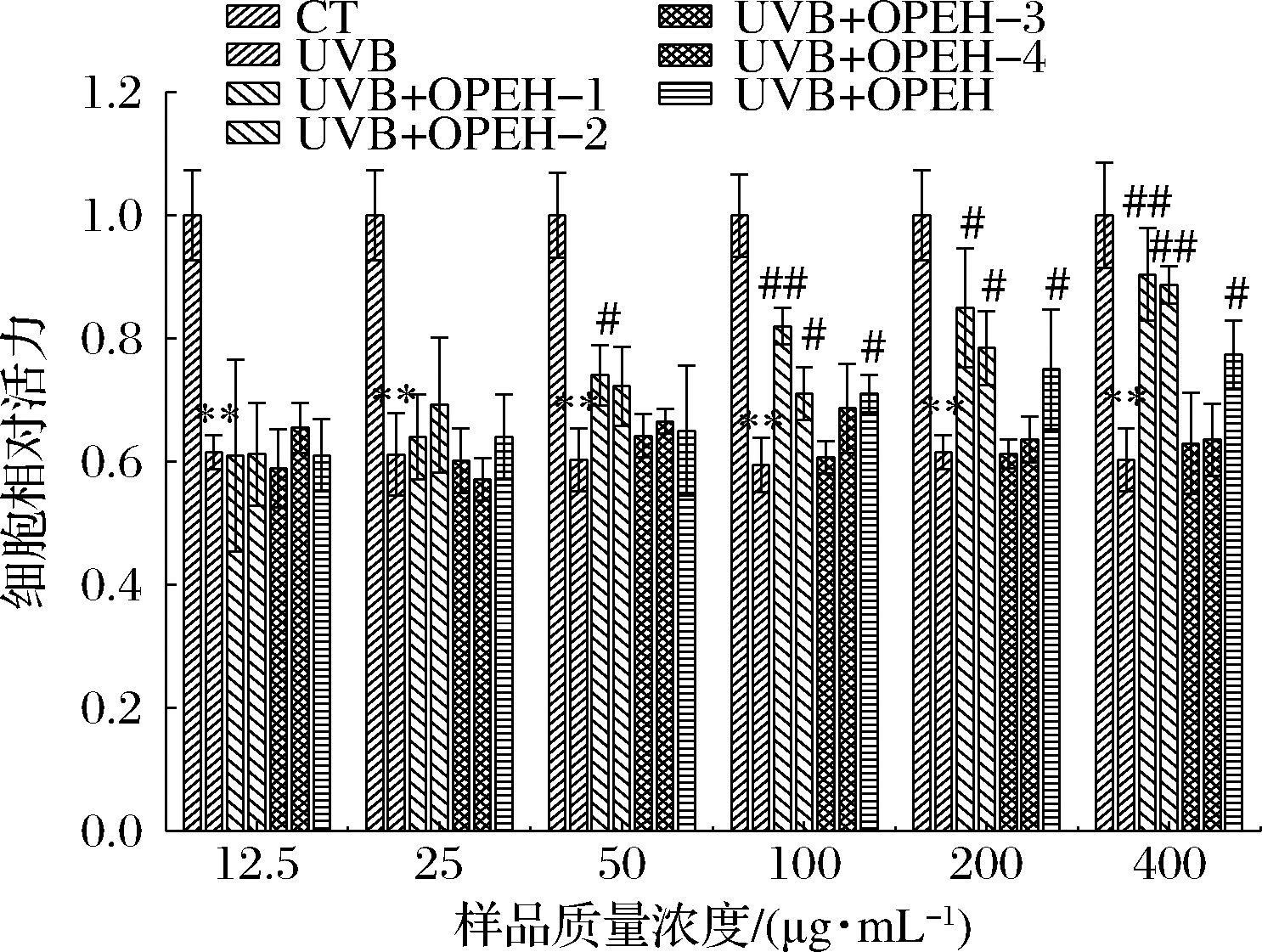
图1 牡蛎蛋白酶解产物及各超滤组分对UVB辐射后的HaCaT细胞活力的影响
Fig.1 The effects of OPEH and its ultrafiltration fractions on the cell viability of UVB-irradiated HaCaT cells
注:** P<0.01 UVB vs CT;## P<0.01,# P<0.05,UVB+给药组 vs UVB;其中CT是空白对照组,UVB是模型组,下同
2.3 OPEH及各超滤组分对UVB诱导的HaCaT细胞形态的影响
前期研究表明,当HaCaT细胞受到不良刺激时候,伴随细胞活力的下降,细胞的形态也会相应发生改变[1]。如图2所示,正常的 HaCaT细胞排列紧密,细胞形态一致,呈椭圆形且边界清晰,细胞透光性较好。在模型组中,UVB 辐射HaCaT细胞后出现细胞间隙变大,细胞皱缩,形态呈现不规则的改变,细胞边缘变得模糊,并伴随有细胞碎片的产生。对UVB辐射后的HaCaT 细胞加100 μg/mL的OPEH及各超滤组分处理细胞24 h 后,与细胞活力测试结果一致,在质量浓度为100 μg/mL 的给药下,OPEH-1、OPEH-2、OPEH均对UVB辐射后HaCaT细胞形态的改变有略微改善作用。与细胞活力测定结果一致,OPEH-1对UVB辐射造成的HaCaT细胞形态改变具有最好的改善作用,虽然略有细胞碎片发生,细胞形态基本恢复到空白对照组的水平,与5 μg/mL的阳性对照药物维生素C的效果相当。

a-CT;b-UVB;c-UVB+OPEH-1;d-UVB+OPEH-2;e-UVB+OPEH-3;f-UVB+OPEH-4;g-UVB+OPEH h-UVB+VC
图2 OPEH及各超滤组分对UVB辐射后的HaCaT细胞形态的影响
Fig.2 The effects of OPEH and its ultrafiltration fractions on the cell morphology of UVB-irradiated HaCaT cells
注:OPEH-1、OPEH-2、OPEH-3、OPEH-4和OPEH的质量浓度为100 μg/mL,而VC的质量浓度为5 μg/mL,下同
2.4 OPEH及各超滤组分对UVB诱导的HaCaT细胞外I型胶原蛋白前体产生的影响
胶原蛋白是一种小分子蛋白质,丝状的胶原蛋白纤维能使皮肤保持结实而有弹性[16]。皮肤光老化会导致人体胶原蛋白含量会逐渐流失,使得真皮层的弹性与保水度降低,表皮形成松垮的皱纹。胶原蛋白前体对于胶原蛋白的形成起到至关重要的作用。如图3所示,ELISA结果显示,UVB辐射后,HaCaT细胞分泌到细胞外的I型胶原蛋白前体水平显著地下降(P<0.01)。OPEH及各超滤组分中,只有OPEH-1能显著地提高I型胶原蛋白前体的分泌(P<0.01)。
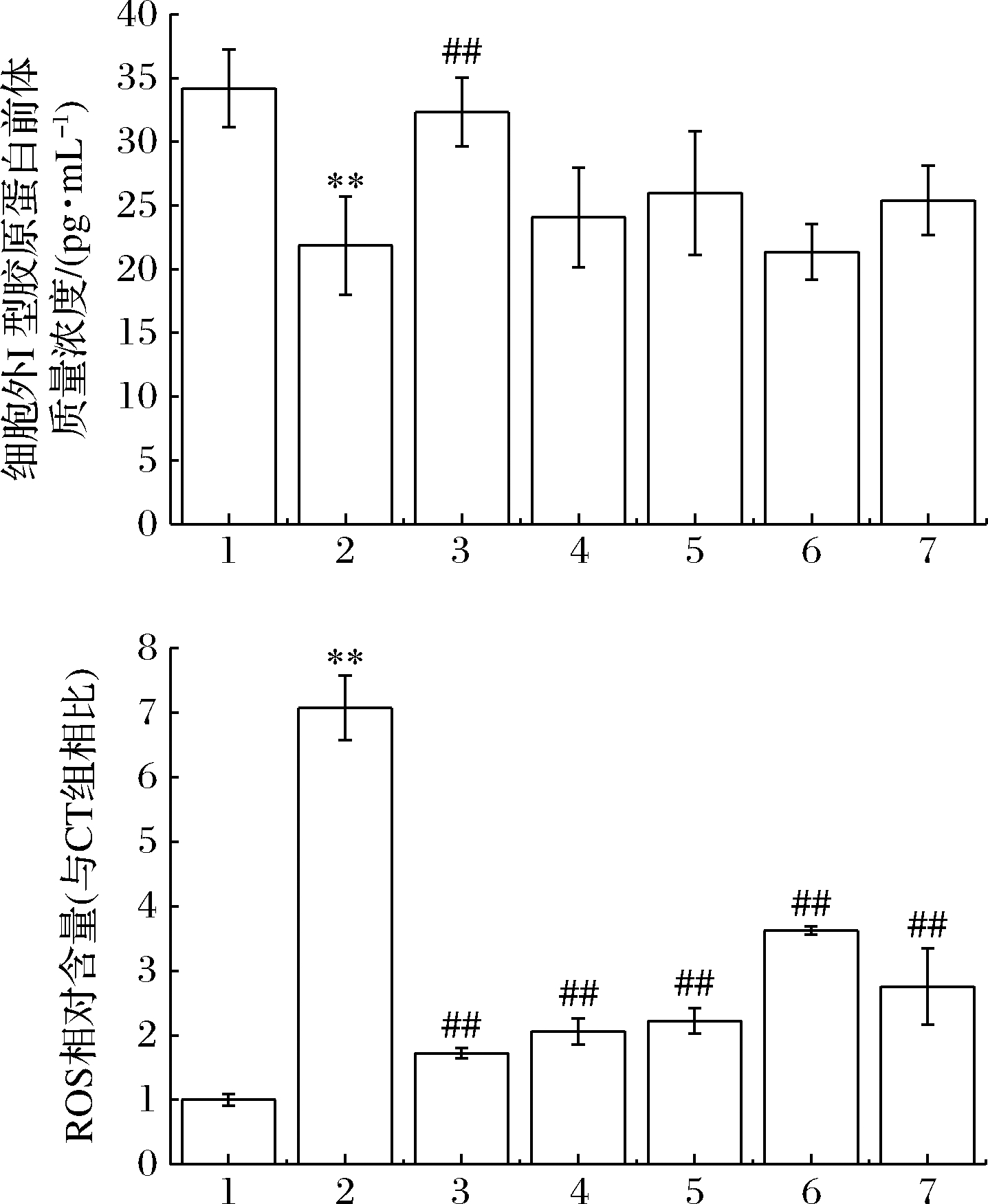
图3 OPEH及各超滤组分对UVB辐射后的HaCaT细胞外I型胶原蛋白前体及细胞内ROS产生的影响
Fig.3 The effects of OPEH and its ultrafiltration fractions on the production of extracellular pro-collagen I and intracellular ROS in UVB-irradiated HaCaT cells
2.5 OPEH及各超滤组分对UVB辐射诱导的HaCaT细胞内ROS产生的影响
有报道称半胱氨酸、维生素C及罗非鱼胶原肽能有效地清除细胞内的 ROS,从而对UV诱导的细胞氧化应激和凋亡起到保护作用[17-18]。从图4-b 可知,UVB辐射后,导致HaCaT细胞内ROS大量产生(P<0.01),OPEH以及各超滤组分和阳性对照药物维生素C均能极显著地抑制ROS的产生(P<0.01)。从图4同样可见,CT组使用DCFH-DA荧光探针孵育细胞20 min后,细胞内仅出现微弱的绿色荧光。模型组经UVB辐射HaCaT细胞后,细胞内大量的ROS产生,经荧光探针染色后,细胞内可见大量的绿色荧光。OPEH及各组分、阳性对照药物维生素C均能减弱了细胞内绿色荧光的强度,抑制ROS的产生。我们可以看出OPEH-1、OPEH-2、OPEH抑制细胞内ROS的效果与阳性对照药物维生素C的效果相当。

a-CT;b-UVB;c-UVB+OPEH-1;d-UVB+OPEH-2;e-UVB+OPEH-3;f-UVB+OPEH-4;g-UVB+OPEH;h-UVB+VC
图4 OPEH及各超滤组分对UVB辐射后的HaCaT细胞内ROS水平的影响
Fig.4 The effects of OPEH and its ultrafiltration fractions on the ROS production of UVB-irradiated HaCaT cells
3 结论与讨论
本研究通过中性蛋白酶酶解香港牡蛎蛋白制备OPEH,逐级通过8 k、5 k、3 kDa 分子筛超滤后,共截留出4个超滤组分。研究表明,OPEH-1(<3kDa)具有最佳的体外抗氧化能力。同时在UVB诱导的HaCaT光老化细胞模型上,OPEH-1能显著地提高UVB损伤后的HaCaT细胞的细胞活力,保护HaCaT细胞形态的改变。进一步的研究表明,OPEH-1的抗皮肤光老化活性可能与抑制细胞内ROS的产生,以及促进细胞外I型胶原蛋白前体产生有关。本研究也提示小分子质量的牡蛎蛋白酶解产物可用于抗皮肤光老化保健食品和化妆品的开发和利用。在本研究的基础上,后续研究还需要在动物模型上验证对该超滤组分的抗皮肤光老化的活性,以及通过进一步的分离,纯化,鉴定具体的抗皮肤光老化活性成分。
[1] 何丽,林雪霏,陈慧,等.皮肤光老化治疗研究进展[J].中国麻风皮肤病杂志,2020,36(11):687-689.
HE L,LIN X F,CHEN H,et al.Update of the treatments for skin photoaging[J].China Journal of Leprosy and Skin Diseases,2020,36(11):687-689.
[2] PARK E K,LEE H J,LEE H,et al.The anti-wrinkle mechanism of melatonin in UVB treated HaCaT keratinocytes and hairless mice via inhibition of ROS and sonic hedgehog mediated inflammatory proteins[J].International Journal of Molecular Sciences,2018,19(7).DOI:10.3390/1ims19071995.
[3] KONG S Z,SHI X G,FENG X X,et al.Inhibitory effect of hydroxysafflor yellow on mouse skin photoaging induced by ultraviolet irradiation[J].Rejuvenation Research,2013,16:404-413.
[4] HAN J H,BANG J S,CHOI Y J,et al Oral administration of oyster(Crassostrea gigas)hydrolysates protects against wrinkle formation by regulating the MAPK pathway in UVB-irradiated hairless mice[J].Photochemistry Photobiology Science,2019,18(6),1 436-1 446.
[5] PILLAI S,ORESAJO C,HAYWARD J.Ultraviolet radiation and skin aging:Roles of reactive oxygen species,inflammation and protease activation,and strategies for prevention of inflammation-induced matrix degradation-a review[J].International Journal of Cosmetics Science,2005,27(1):17-34.
[6] 林海生.牡蛎蛋白肽的酶法制备及其改善小鼠学习记忆功能的研究[D].湛江:广东海洋大学,2013.
LIN H S.Preparation of peptides from oyster protein by enzymatic approach and their improving effects on the learning and memorizing ability of mice[D].Zhanjiang:Guangdong Ocean University,2013.
[7] PENG Z L,CHEN B B,ZHENG Q S,et al.Ameliorative effects of peptides from the oyster(Crassostrea hongkongensis)protein hydrolysates against UVB-induced skin photodamage in mice[J].Marine Drugs,2020,18(6).DOI:10.3390/md18060288
[8] HAN J H,BANG J S,CHOI Y J,et al.Anti-melanogenic effects of oyster hydrolysate in UVB-irradiated C57BL/6 J mice and B16F10 melanoma cells via downregulation of cAMP signaling pathway[J].Journal of Ethnopharmacology,2019,229:137-144.
[9] 郑惠娜,张晶晶,周春霞,等.pH调节法提取牡蛎蛋白及氨基酸、蛋白组成分析[J].中国食品学报,2014,14(7):230-235.
ZHENG H N,ZHANG J J,ZHOU C X,et al.Extraction of oyster protein by alkali solution acid precipitation and its amino acid and protein composition analysis[J].Chinese Journal of Food,2014,14(7):230-235.
[10] XIAO Z B,LIANG P,CHEN J L,et al.A peptide YGDEY from tilapia gelatin hydrolysates inhibits UVB-mediated skin photoaging by regulating MMP-1 and MMP-9 expression in HaCaT cells[J].Photochemistry and Photobiology,2019,95(6):1 424-1 432.
[11] CHEN T J,HOU H,FAN Y,et al.Protective effect of gelatin peptides from pacific cod skin against photoaging by inhibiting the expression of MMPs via MAPK signaling pathway[J].Journal of Photochemistry and Photobiology B-Biology,2016,165:34-41.
[12] CALCABRINI C,DE BELLIS R,MANCINI U,et al.Protective effect of Juglans Regia L.walnut extract against oxidative DNA damage[J].Plant Foods for Human Nutrition,2017,72(2):192-197.
[13] ZHUANG Y L,SUN L P,XUE Z,et al.Investigation of gelatin polypeptides of jellyfish(Rhopilema esculentum)for their antioxidant activity in vitro[J].Food Technology & Biotechnology,2010,48(2):222-228.
[14] ZHANG H T,ZHANG Z J,MO W C,et al.Shielding of the geomagnetic field reduces hydrogen peroxide production in human neuroblastoma cell and inhibits the activity of CuZn superoxide dismutase[J].Protein Cell,2017,8(7):527-537.
[15] KIM S-K,WIJESEKARA I.Development and biological activities of marine-derived bioactive peptides:A review[J].Journal of Functional Foods,2010,2:1-9.
[16] SOLIMAN Y S,HASHIM P W,FARBERG A S,et al.The role of diet in preventing photoaging and treating common skin conditions[J].Cutis,2019,103(3):153-153.
[17] KOSTYUK V,POTAPOVICH A,ALBUHAYDAR A R,et al.Natural substances for prevention of skin photoaging:Screening systems in the development of sunscreen and rejuvenation cosmetics[J].Rejuvenation Research,2018,21(2):91-101.
[18] AVOLA R,GRAZIANO ACE,PANNUZZO G,et al.Hydroxytyrosol from olive fruits prevents blue-light-induced damage in human keratinocytes and fibroblasts[J].Journal of Cellular Physiology,2019,234(6):9 065-9 076.