黄曲霉毒素(aflatoxin,AFT)是一类致毒性超强的真菌毒素,主要是由黄曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus paraciticus)产生[1]。目前已经发现了20多种黄曲霉毒素,根据其结构的不同可以大致分为2类:AFB和AFG[2]。其中黄曲霉毒素B1(Alfatoxin B1,AFB1)分布最广泛,毒性也最强。畜禽食用含有AFB1的饲料会引起肝脏损伤、免疫力下降甚至死亡;人长期食用被AFB1污染的农产品会引起呕吐、发育迟缓并诱发肝癌[3]。肝脏既是代谢AFB1的主要场所,同时也是AFB1损伤的主要器官,其损伤过程是由CYP450酶系、线粒体、免疫系统和自由基等机制介导的复杂转化过程[4]。鉴于AFB1的毒性,如何避免AFB1感染和进行AFB1脱毒,对于食品安全至关重要。
黄曲霉毒素降解的方法一般有物理法[5-6]、化学法[7-8]和生物降解法。物理法和化学法会使原料中营养成分流失,还可能产生新的有害物质[9]。生物降解法主要是利用微生物产生的次级代谢产物或酶将有毒基团分解,具有专一性强、效率高等优点[10]。细菌和真菌中都存在着可以降解AFB1的微生物[11],可降解AFB1的细菌主要有浑浊红球菌(Rhodococcus opacus)[12-13]、橙红色粘球菌(Myxococcus fulvus)[9]、食醚红球菌(Rhodococcus aetherivorans)[14]、枯草芽胞杆菌(Bacillus subtills)[15]、施氏假单胞菌(Pseudomonas stutzeri)[16-17]等,真菌主要有寄生曲霉(Aspergillus parasiticus)、白腐菌(Trametes versicolor)和假蜜环菌(Armillariella tabescens)等[10]。但是关于微生物降解AFB1的相关酶的报道却不多。研究表明,在降解AFB1中起作用的酶包括乳过氧化氢酶[18]、漆酶[3]和黄曲霉毒素氧化酶[19]等。但是目前仍缺乏能够实际应用的微生物酶,有关黄曲霉解毒酶的开发工作仍需要进一步加强。多铜氧化酶具有来源广泛、易于获取、底物谱广泛、对环境非常友好等优点[20-21]。因此,多铜氧化酶在工业上有着广泛的应用前景,是一类开发潜力较强的霉菌毒素脱毒剂[22-23]。
本文从乳酸片球菌(Pediococcus acidilactici 7_4)基因组中筛选到一种多酮氧化酶,通过基因工程的手段重组到大肠杆菌中进行诱导表达,得到重组的大肠杆菌。将重组大肠杆菌的多铜氧化酶纯化,研究其对AFB1的降解能力以及酶学性质,进一步探究重组多铜氧化酶的降解潜力,为后续深入研究提供基础。
1 材料与方法
1.1 试剂
AFB1标准品,上海佰晔生物科技中心;乙酰丁香酮(acetosyringone,AS)、丁香醛(syringaldehyde,SA)、阿魏酸(ferulic acid,FA)、1-羟基苯并三唑(1-hydroxybenzotriazole,HBT)、酚红(phenol red,PhR)、2,2′,6,6′-四甲基呱啶氧化物(2,2′,6,6′-tetramethyl-piperidine-N-oxyl,TEMPO)、2,2′-联氨-双-(3-乙基-苯并噻唑啉-6-磺酸)二氨盐(2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS),生工生物工程(上海),色谱级乙腈、色谱级甲醇,上海阿拉丁试剂有限公司
1.2 AFB1的检测
向反应后的样品中加入5 mL V(乙腈)∶V(水)=84∶16的混合液,再加入1 mL正己烷,用旋涡振荡器充分混匀,静置60 min,取下层溶液经0.22 μm聚偏氟乙烯滤膜过滤后进样。使用高效液相色谱-光化学反应器-荧光检测器(high performance liquid chromatography-Photoelectric reactor-Fluorescence detector,HPLC-PHR-FLD)的方法对AFB1进行检测。色谱条件:色谱柱为X-BridgeTM C18(4.6 mm×250 mm,5 μm),进样量20 μL,流动相为V(甲醇)∶V(水)∶V(乙腈)=35∶55∶10,流速1 mL/min,柱温30oC,荧光激发光波长360 nm,发射光波长440 nm[24]。
1.3 酶活力测定
将1 min 转化1 pmol AFB1 所需的酶量定义为1个酶活力单位(U)。酶降解AFBl的活性采用U/mg的形式表示。
1.4 试验方法
1.4.1 基因克隆及载体构建
P.acidilactici 7_4基因组信息已公布在NCBI上(NZ_ACXB00000000),其基因组中多酮氧化酶D2EK17编码的基因NZ_GG730086.1由安徽通用系统生物有限公司合成,基因两端添加EcoR I和Xho I酶切位点,将载体和基因片段分别用EcoR I和Xho I酶切,T4连接酶连接后转入DH5α感受态细胞,冰浴30 min,在42 ℃水浴锅热激90 s,冰浴2 min后加入500 μL LB液体培养基37 ℃,200 r/min培养1 h。培养物离心后涂布在含有50 μL/mL的卡那霉素 LB 平板,培养16 h左右后挑选单菌落,经酶切和测序验证无误后,将构建好的pET-28a(+)-CueO转入到BL21(DE3)感受态细胞中。
1.4.2 重组CueO表达与纯化
将含有pET-28a(+)-CueO转入到BL21(DE3)的单菌落加入含有0.1 mg/mL卡那霉素的LB液体培养基中,37 ℃,170 r/min摇床培养24 h。活化的菌液以1%的接种量培养至OD600为0.6左右,加异丙基硫代半乳糖苷(Isopropyl β-D-1-thiogalactopyranoside,IPTG)使其浓度为0.5 mmol/L,同时加入250 mmol/L的无菌硫酸铜溶液,使其终浓度为0.25 mmol/L,16 ℃,150 r/min,培养18~20 h。菌液4 ℃,4 000 r/min,离心10 min,收集菌体。100 mL菌体用25 mL(50 mmol/L,pH 7.2)磷酸缓冲液(phosphate buffer solution,PBS)重悬菌体,冰水浴超声破碎15 min,4 ℃,10 000 r/min离心10 min,收集上清液。上清液通过镍柱结合后,用30 mmol/L的咪唑洗脱杂蛋白,最后用300 mmol/L咪唑洗脱目的蛋白。使用购自生工生物工程公司的C500090脱盐柱进行脱盐,具体方法参照说明书。纯化脱盐后的蛋白用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel-electrophoresis,SDS-PAGE)鉴定分子质量和纯度。
1.4.3 酶学性质分析
1.4.3.1 不同介体对重组CueO降解AFB1的影响
反应在一个20 mL无菌玻璃瓶中进行,反应体系为1 mL,包括:20 μL 5 μg/mL的AFB1标准液,380 μL 纯化后的酶液(含纯酶193.04 μg,下同),浓度为100 mmol/L的不同介体100 μL,生理盐水500 μL。反应体系在37 ℃下避光静置反应12 h。每个处理3个重复,以不加入酶的反应体系作为对照。反应结束后用1.2小节的萃取回收方法处理,使用HPLC-PHR-FLD测定AFB1含量。
1.4.3.2 重组CueO降解AFB1的最适温度和热稳定性
最适温度:反应在一个20 mL无菌玻璃瓶进行,反应体系为1 mL,包括:20 μL 5 μg/mL的AFB1标准液,380 μL 纯化后的酶液,100 μL 100 mmol/L的SA溶液100 μL,500 μL 生理盐水。反应体系在4、30、37、50、60、70、80 ℃下避光静置反应12 h,每个处理3个重复,以不加入酶的反应体系作为对照。反应结束后用1.2小节的萃取回收方法处理,使用HPLC-PHR-FLD测定AFB1含量。
热稳定性:将酶液分别放置在不同温度(4、30、37、50、60、70、80 ℃)下处理2 h,12 000 r/min,离心5 min,取上清液。反应在一个20 mL无菌玻璃瓶中进行,反应体系为1 mL,包括:20 μL 5 μg/mL的AFB1标准液,380 μL 处理后的酶液,100 μL 100 mmol/L的SA溶液,生理盐水500 μL。反应体系在37oC下避光静置反应12 h。每个处理3个重复,以不加入酶的反应体系作为对照。反应结束后用1.2小节的萃取回收方法处理,使用HPLC-PHR-FLD测定AFB1含量。
1.4.3.3 重组CueO降解AFB1的最适pH
反应在一个20 mL无菌玻璃瓶中进行,反应体系为1 mL,包括:20 μL 5 μg/mL的AFB1标准液,380 μL 纯化后的酶液,100 μL 100 mmol/L的SA溶液,500 μL 缓冲液(pH值为4.0~10.0)。反应体系在37 ℃下避光静置反应12 h,每个处理3个重复,以不加入酶的反应体系作为对照。反应结束后用1.2小节的萃取回收方法处理,用HPLC-PHR-FLD测定AFB1含量。
1.5 Km与Vmax的测定
选用不同质量浓度的AFB1(50、100、200、400、800、1 000、2 000 ng/mL)作为底物,在最适温度与最适pH条件下反应24 h,通过公式(1)[25]计算出反应速率[pmol/(min·mg)],使用米氏方程获得Km和Vmax值[26]。
反应速率![]()
(1)
1.6 降解产物的毒性分析
降解产物毒性分析实验设置3个处理,分别是未反应的AFB1、CueO降解后的AFB1以及SA介体对照(含有SA和AFB1)。反应在一个250 mL无菌锥形瓶中进行,反应体系为50 mL,包括:500 μL 1 mg/mL的AFB1标准液,44.5 mL 纯化后的酶液,5 mL 100 mmol/L的SA溶液。反应体系在37 ℃下避光静置反应12 h。未反应的AFB1处理组和SA介体对照组中用pH 7.0的磷酸缓冲液代替酶液,反应结束后用旋转蒸发仪浓缩样品,DMSO回收AFB1用于下一步实验,每个处理做3个重复。
取处于生长对数期的LO2肝细胞,消化后用1640培养液吹匀成单细胞悬液。细胞计数后,以5×104 cell/mL的密度种进96孔板中,每孔加入100 μL。5% CO2,37 ℃隔夜贴壁陪养后,加入100 μL降解产物处理液。继续培养48 h后每孔加入20 μL 5 mg/mL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT),继续培养4 h。吸掉上清液后每孔加入200 μL DMSO,置摇床振匀后,测量各孔在570 nm处的吸光值[27]。
2 结果与讨论
2.1 序列分析
CueO的开放阅读框由1 434个碱基构成,对应477个氨基酸残基。通过SWISS-MODEL(https://swissmodel.expasy.org/)同源建模法预测蛋白质结构,根据可信度(GMQE)选择合适的模板。其中可信度最高的模板是2yxw.1(GMQE为0.61)。3zx1.1的GMQE为0.53,6iqx.1的GMQE为0.58。根据模板可推测,CueO氨基酸序列含有细菌多铜氧化酶的保守序列HXHG,HXH,HXXHXH和HCHXLXHEDXXM(红色下划线部分),符合多铜氧化酶序列特征。

图1 CueO氨基酸序列多序列比对结果
Fig.1 Multiple sequence alignment results of CueO amino acid sequence
2.2 蛋白表达纯化
CueO蛋白的理论分子质量为54.36 kD,pI为5.42。经过SDS-PAGE检测(图2),重组蛋白可以在上清液中表达。使用30 mmol/L咪唑洗脱杂蛋白,300 mmol/L咪唑洗脱目的蛋白,纯化的纯度较好。重组蛋白分子质量大小约60 kDa左右,比CueO理论分子量稍大,原因是pET-28a(+)载体上N端序列和CueO融合表达,加上这部分氨基酸残基的分子质量和电泳结果一致。以上结果说明CueO可以在大肠杆菌中实现可溶性表达。

1-Ni-NTA纯化后的CueO;2-IPTG诱导后E.coli BL21(DE)3,pET28(a)-CueO可溶蛋白;3-IPTG诱导后E.coli BL21(DE)3,pET28(a)-CueO不可溶蛋白;4-IPTG诱导后E.coli BL21(DE)3,pET28(a)-CueO全细胞;5-Marker;6-E.coli BL21(DE)3,pET28(a)-CueO未诱导
图2 CueO样品的SDS-PAGE结果
Fig.2 SDS-PAGE results of CueO samples
2.3 重组CueO对AFB1的降解性质
2.3.1 不同介体对重组CueO降解AFB1的影响
常见介体主要分为2大类,即天然介体(natural mediators)和合成介体(synthetic mediators)[7]。实验比较了7种不同介体对重组CueO酶降解AFB1活性的影响。AS、SA、FA属于天然介体;ABTS、HBT、PhR和TEMPO为合成介体。由图3可知,介体本身对AFB1会有一些降解作用,但不同的介体催化AFB1的反应能力不同,其中SA最强。当加入重组CueO酶时,“CueO-介体”催化AFB1降解的能力均显著提高,SA作为介体时,相对降解率最高,达到96.89%。
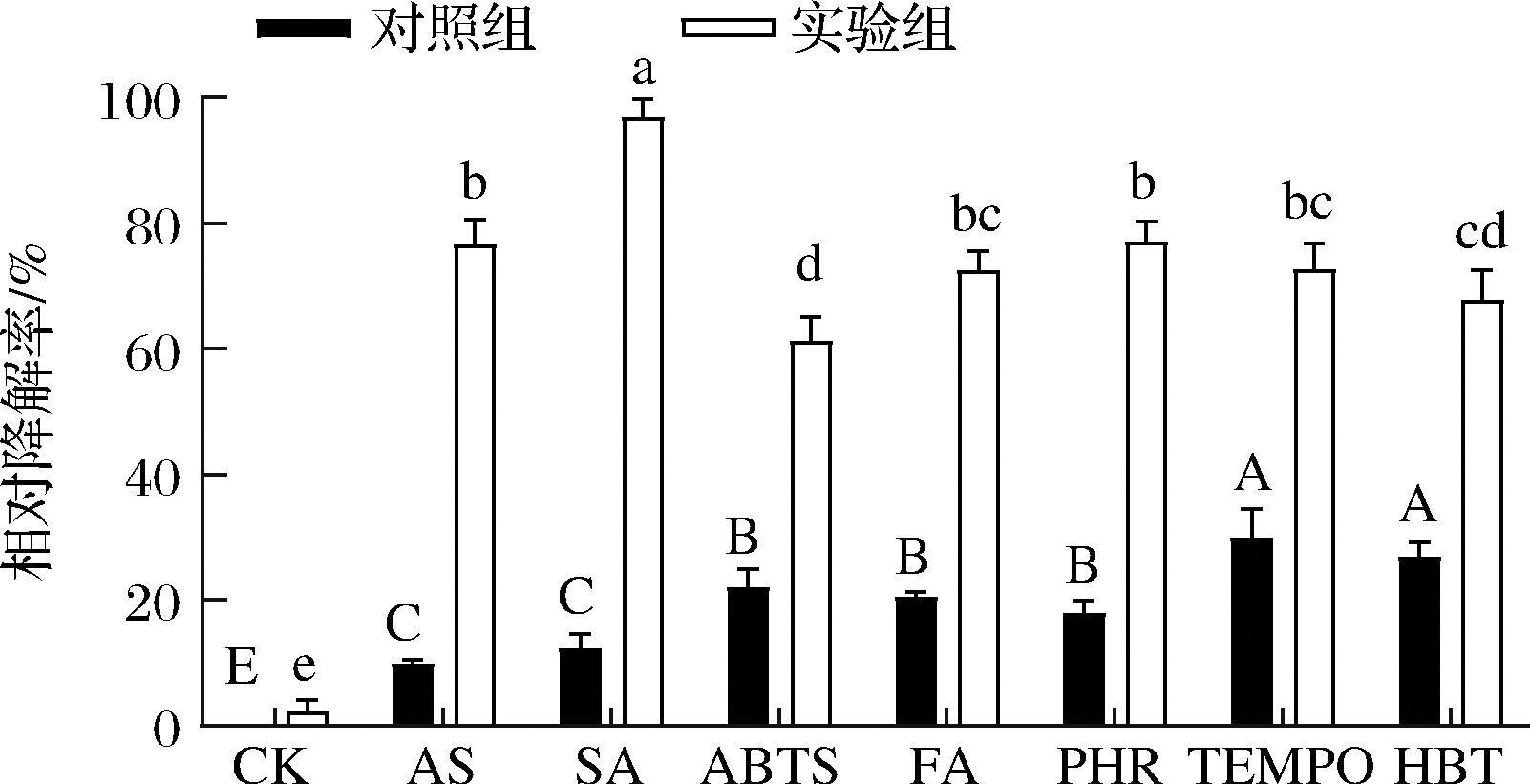
图3 不同介体对AFB1降解率的影响
Fig.3 Effect of different mediator on degradation rate of AFB1
注:不同字母表示差异显著(P<0.05),下同
AS次之,相对降解率达到76.52%,HBT和ABTS效果较差。因此CueO最佳的反应介体是SA。
漆酶催化氧化还原反应,对底物具有一定选择性,只有氧化还原势能低于漆酶的物质,且能够进入活性中心的物质才能直接被漆酶氧化[28]。而高于漆酶氧化还原势能的底物,需要有介体参与才能被氧化[29]。由于漆酶CueO不能和AFB1直接反应,漆酶-介体-底物的反应是否能够进行,取决于介体是否能够进入到活性中心以及介体的氧化还原势能。CueO-SA具有较强的AFB1降解能力可能和上述原因相关。
2.3.2 重组CueO降解AFB1的最适温度和热稳定性
不同温度条件下,重组CueO降解AFB1的结果如图4所示。重组CueO在37 ℃下相对降解率最高,随着温度的升高呈现先升高再降低的趋势。从4 ℃到37 ℃,温度越高,AFB1相对降解率越高,降解效果越好。当温度超过37 ℃时,降解率开始急剧下降。由此可见重组CueO降解AFB1的最适反应温度为37 ℃。
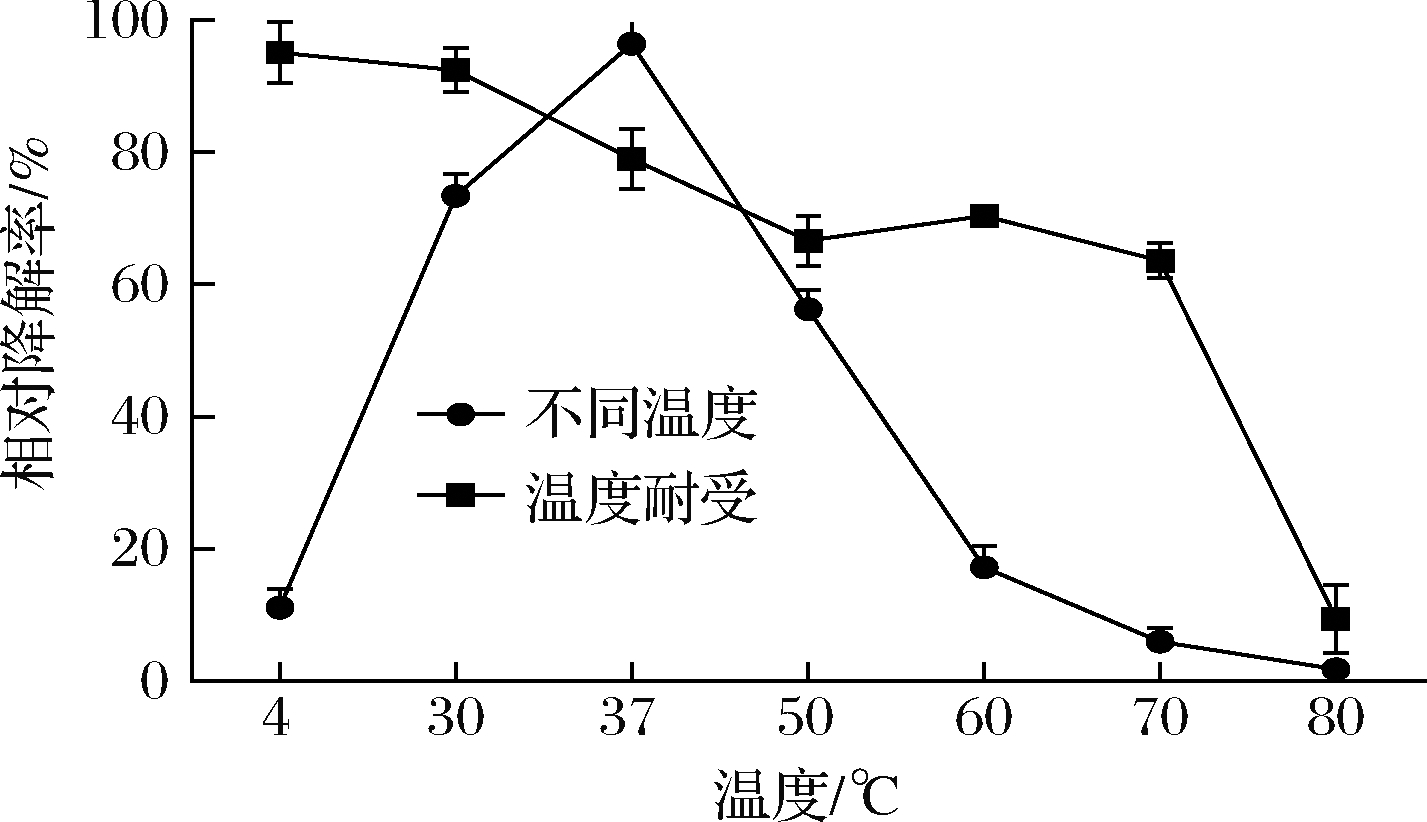
图4 温度对AFB1降解率的影响
Fig.4 Effect of temperature on degradation rate of AFB1
该重组CueO酶在4 ℃处理后,相对降解率最高。50 ℃处理后,酶对AFB1的相对降解率下降了26.89%;在80 ℃时,酶失去活性。因此该酶在低于70 ℃时,具有一定的热稳定性。
2.3.3 重组CueO降解AFB1的最适pH
在不同pH缓冲液处理下,降解AFB1结果如图5所示。重组CueO在pH 4.0~6.0,随着pH值的升高,AFB1的降解率呈现下降趋势。当pH为7.0时,重组CueO降解AFB1效果最好。pH值超过7.0之后,随着pH值的升高,AFB1降解率反而降低。因此,重组CueO降解AFB1的最适pH为7.0。
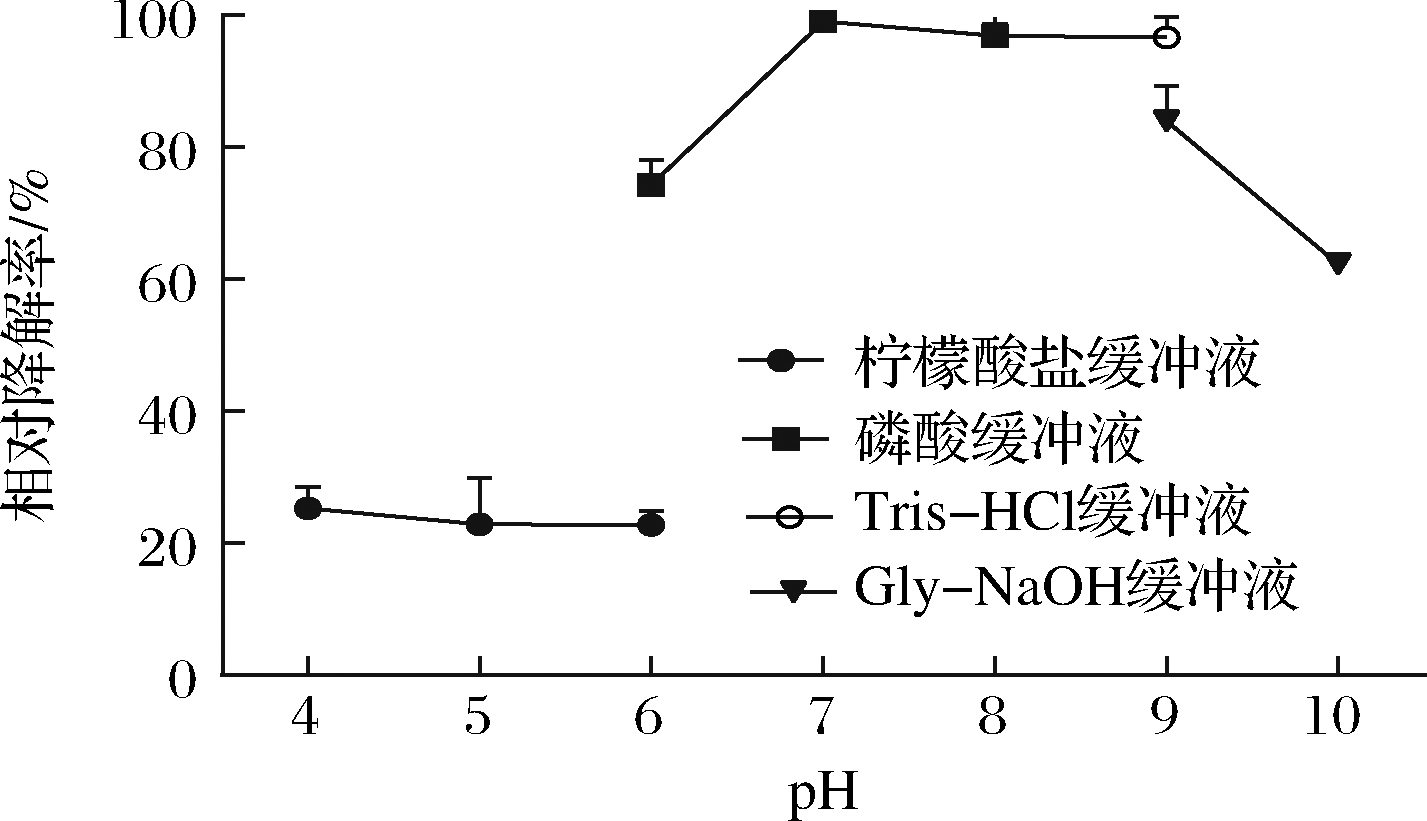
图5 不同pH条件对AFB1降解率的影响
Fig.5 Effect of different pH conditions on degradation rate of AFB1
在上述优化的条件下,以SA为介体检测了重组酶CueO降解AFB1的能力,结果如图6所示,AFB1的出峰时间在11.45 min左右,随着反应时间的延长峰面积不断减少,12 h后对100 ng/mL AFB1的降解率可达64.8%。
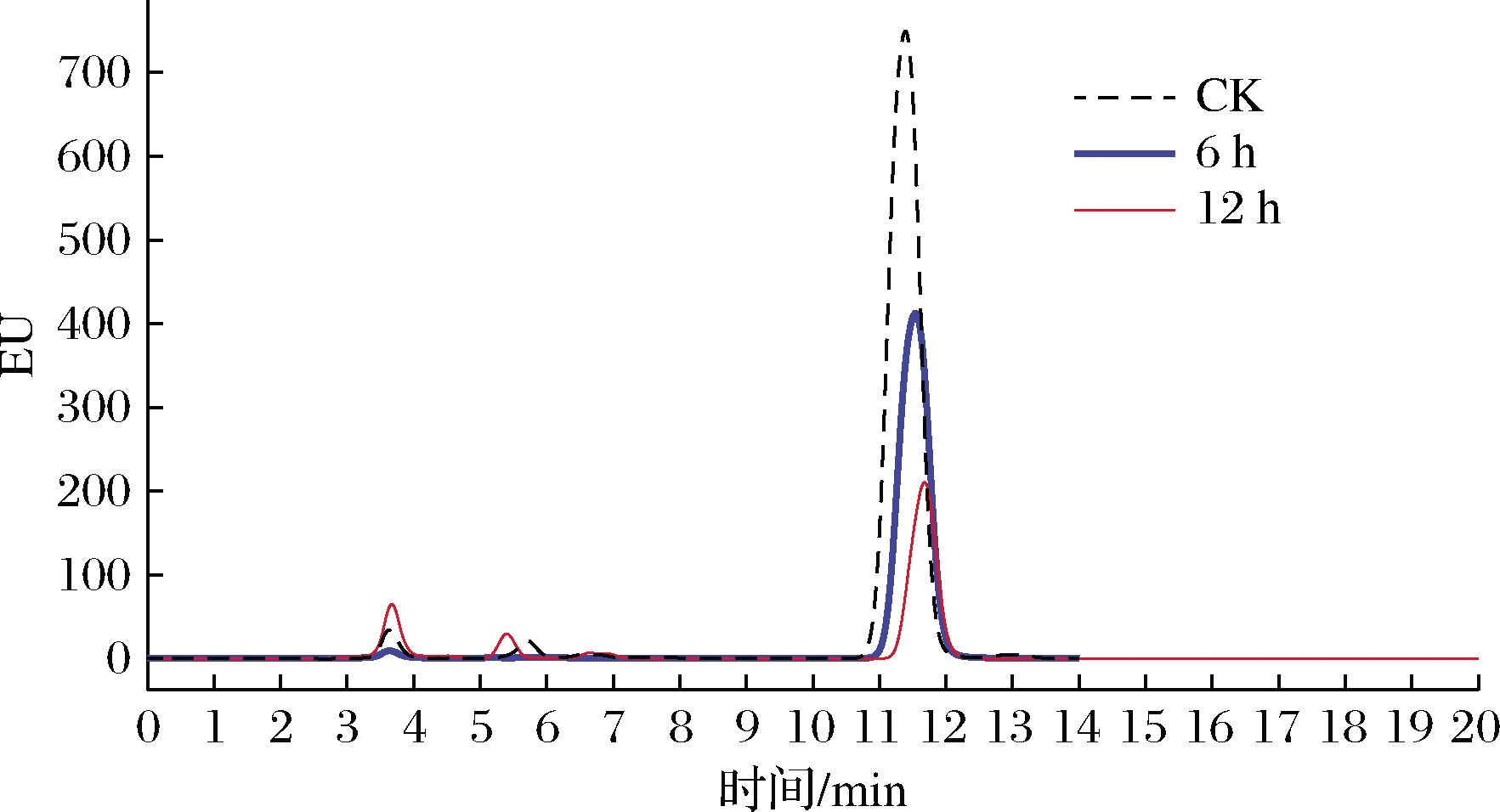
图6 重组CueO酶降解AFB1的HPLC结果
Fig.6 HPLC results of recombinant expressed CueO to degrade AFB1
2.3.4 底物浓度对重组CueO降解AFB1酶活力的影响
比较了从0~0.006 4 μmol/L浓度下重组CueO降解AFB1的酶活变化。在起始阶段,随着底物浓度的增加,重组CueO的酶活力不断增加,但到0.003 2 μmol/L(1 000 ng/mL)时酶活力达到最大值,为7.895 U/mg,之后再增加底物浓度,其降解AFB1活性不再增加。
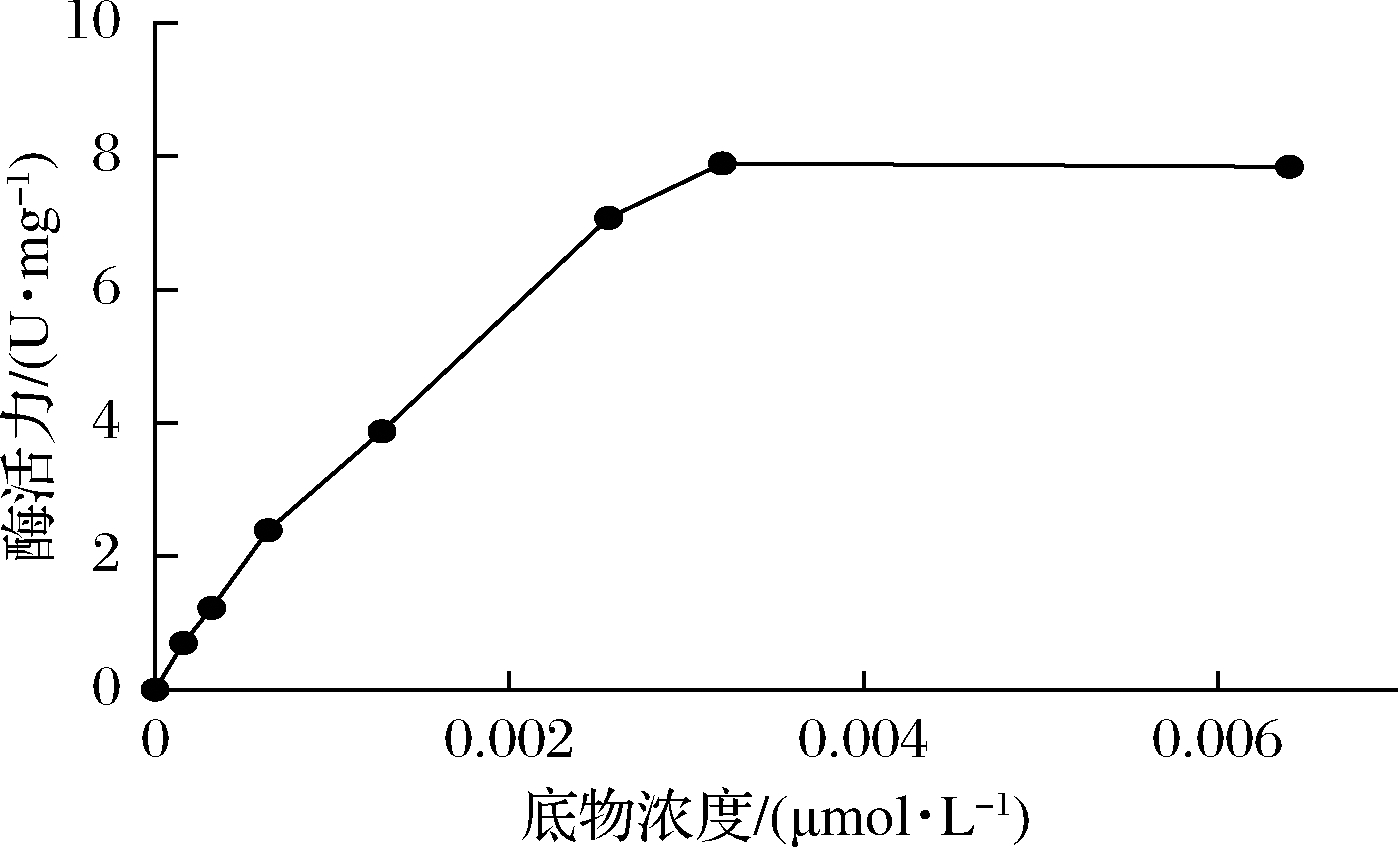
图7 底物浓度对重组CueO降解AFB1酶活的影响
Fig.7 Effect of substrate concentration on the enzyme activity of recombinant CueO to degrade AFB1
2.4 Km与Vmax的测定
利用GraphPad Prism5.0计算重组CueO的Km与Vmax,通过Michaelis-Menten做图,计算出Km=1.99×10-3 μmol,Vmax=11.31 pmol/(min·mg)。
2.5 降解产物的毒性分析
通过MTT实验,得到了不同质量浓度AFB1对人肝细胞LO2存活率的影响,0~0.5 μg/mL AFB1对肝细胞LO2存活率影响不大。当AFB1质量浓度达到10 μg/mL时,细胞存活率下降到51.29%。因此实验选用10 μg/mL作为AFB1的处理质量浓度。
将未处理的AFB1、回收的降解产物以及SA对照(含有介体和AFB1)加入到肝细胞中混合培养,以比较三者的细胞毒性差异,结果如图8所示。与未降解的AFB1相比,CueO脱毒产物对细胞毒性明显降低,细胞存活率上升了24.86%;同时,未降解的AFB1组与SA对照组对肝细胞的毒性影响差异不显著。这些结果说明了重组酶CueO不仅可以有效的降解AFB1,而且降解产物对细胞的毒性明显减少。
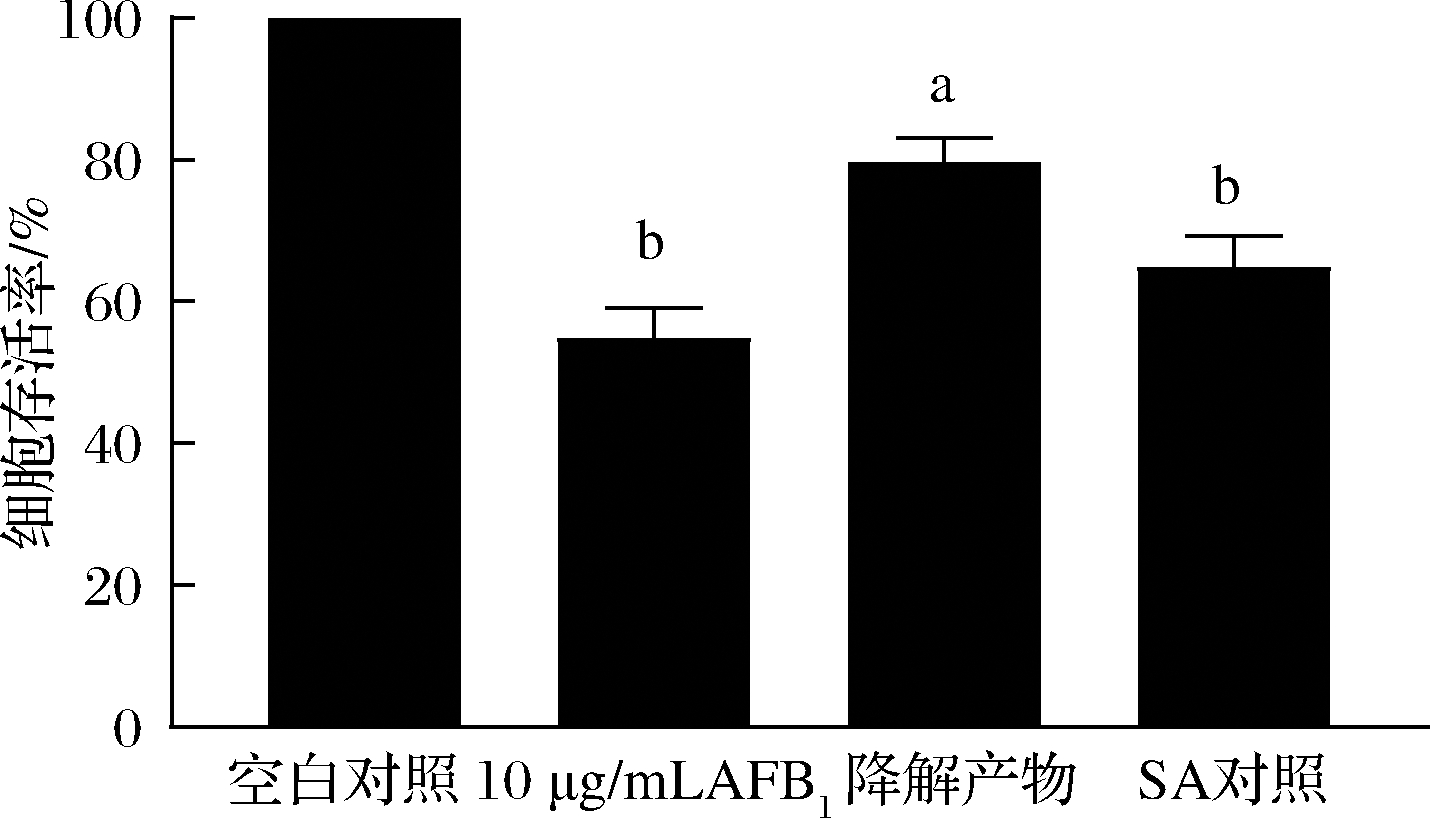
图8 降解产物对肝细胞LO2存活率的影响
Fig.8 Effect of degradation products on the survival rate of liver cell LO2
3 结论
本文首次研究了乳酸菌多酮氧化酶对AFB1的降解效果,发现Pediococcus acidilactici 7_4中多铜氧化酶CueO基因可在大肠杆菌中成功表达出可溶性蛋白,纯化获得的重组多铜氧化酶CueO对AFB1有降解作用。重组CueO最佳介体为SA,最适温度为37 ℃,最适pH为7.0。通过Michaelis-Menten法计算得Km=1.99×10-3 μmol,Vmax=11.31 pmol/(min·mg),表明其对AFB1的亲和力较强。细胞毒性实验表明,重组CueO可以有效降解AFB1,并且降解产物对细胞毒性降低,具有进一步的研究和开发价值。
[1] 唐璎, 孟宪刚,邓展瑞,等.西北酸菜中吸附黄曲霉毒素B1乳酸菌株的筛选鉴定及稳定性研究[J].食品与发酵工业,2020,46(15):60-65.
TANG Y,MENG X G,DENG Z R,et al.Screening and stability of an aflatoxin B1-adsorbing lactic acid bacterium isolated from pickled vegetable in northwest China[J].Food and Fermentation Industries,2020,46(15):60-65.
[2] TAYLOR M C,JACKSON C J,TATTERSALL D B,et al.Identification and characterization of two families of F420 H2-dependent reductases from Mycobacteria that catalyse aflatoxin degradation[J].Molecular Microbiology,2010,78(3):561-575.
[3] 张初署, 孙杰,毕洁,等.食用菌SJ-1漆酶酶学性质及降解黄曲霉毒素B1的研究[J].核农学报,2017,31(7):1 317-1 322.
ZHANG C S,SUN J,BI J,et al.The study of enzymatic properties of edible fungi laccase SJ-1 and the degradation of aflatoxins B1 by the edible fungi laccase[J].Journal of Nuclear Agricultural Sciences,2017,31(7):1 317-1 322.
[4] 庞惠萍, 丁泽,苏娜,等.黄曲霉毒素B1致肝脏损伤的机制[J].动物医学进展,2019,40(12):110-113.
PANG H P,DING Z,SU N,et al.Mechanism of liver injury caused by aflatoxin B1[J].Progress in Veterinary Medicine,2019,40(12):110-113.
[5] AKIKAZU S,YOICHI T,TATSUYA M,et al.Degradation and detoxification of aflatoxin B1 using nitrogen gas plasma generated by a static induction thyristor as a pulsed power supply[J].Food Control,2017,73(73):619-626.
[6] WANG S Q,HUANG G Q,LI Y P,et al.Degradation of aflatoxin B1 by low-temperature radio frequency plasma and degradation product elucidation[J].European Food Research and Technology,2015,241(1):103-113.
[7] ERNANDES R ![]() R D F,NILDA F F S,et al.Efficacy of ozone as a fungicidal and detoxifying agent of aflatoxins in peanuts[J].Journal of the Science of Food and Agriculture,2012,92(4):899-905.
R D F,NILDA F F S,et al.Efficacy of ozone as a fungicidal and detoxifying agent of aflatoxins in peanuts[J].Journal of the Science of Food and Agriculture,2012,92(4):899-905.
[8] 罗小虎, 王韧,王莉,等.臭氧降解玉米中黄曲霉毒素B1效果及降解动力学研究[J].食品科学,2015,36(15):45-49.
LUO X H,WANG R,WANG L,et al.Efficiency and kinetics of ozone degradation of aflatoxin B1 in corn[J].Food Science,2015,36(15):45-49.
[9] 严家俊, 庄艺协,吴风霞,等.细菌降解黄曲霉毒素B1的研究进展[J].中国酿造,2018,37(3):10-13.
YAN J J,ZHUANG Y X,WU F X,et al.Advances in the study of bacterial degradation of aflatoxin B1[J].China Brewing,2018,37(3):10-13.
[10] 黄巍, 殷海成,王乐.生物法降解黄曲霉毒素B1的机理研究进展[J].中国饲料,2019(1):7-11;15.
HUANG W,YIN H C,WANG L.Research progress on mechanism of biodegradation of aflatoxin B1[J].China Feed,2019(1):7-11;15.
[11] CIEGLER A,LILLEHOJ E B,PETERSON R E,et al.Microbial detoxification of aflatoxin[J].Applied Microbiology,1966,14(6):934 934.
[12] 阴佳璐, 唐语谦,任杰,等.浑浊红球菌PD630对黄曲霉毒素B1的生物降解特性研究[J].中国食品添加剂,2020,31(2):39-46.
YIN J L,TANG Y Q,REN J,et al.Biodegradation of aflatoxin B1 by Rhodococcus opacus PD630[J].China Food Additives,2020,31(2):39-46.
[13] RISA A,KRIFATON C,KUKOLYA,et al.Aflatoxin B1 and zearalenone-detoxifying profile of Rhodococcus type strains[J].Current Microbiology,2018,75(7):907-917.
[14] 王雪妍,陈晓飞,周伏忠,等.一株具有黄曲霉毒素B1降解功能的食醚红球菌的分离鉴定[J].河南科学,2017,35(7):1 070-1 074.
WANG X Y,CHEN X F,ZHOU F Z,et al.Isolation and Identification of a Rhodococcus aetherivorans strain degrading aflatoxin B1[J].Henan Science,2017,35(7):1 070-1 074.
[15] 马芳芬, 殷海成.枯草芽孢杆菌及其杆菌霉素D对黄曲霉毒素作用机制的研究进展[J].粮食与饲料工业,2016(4):48-50;54.
MA F F,YIN H C.Research progress on the inhibition mechanism of Bacillus subtilis and bacillomycin D against aflatoxin[J].Cereal and Feed Industry,2016(4):48-50;54.
[16] 李文明, 杨文华,李海星,等.施氏假单胞菌F4对黄曲霉毒素B1的酶解作用及其降解产物的初步分析[J].食品与发酵工业,2013,39(2):11-16.
LI W M,YANG W H,LI H X,et al.Enzymolysis of aflatoxin B1 by Pseudomonas stutzeri F4 and analysis of the degrading products[J].Food and Fermentation Industries,2013,39(2):11-16.
[17] 杨文华, 李海星,刘晓华,等.黄曲霉毒素B1降解酶的分离纯化及其酶学特性[J].食品科学,2014,35(19):164-168.
YANG W H,LI H X,LIU X H,et al.Purification and characteristics of an aflatoxin B1-degrading enzyme from Pseudomonas stutzeri F4[J].Food Science,2014,35(19):164-168.
[18] 毛文凌, 杨升,王士林,等.假单胞菌593多铜氧化酶CopA的漆酶活性研究[J].湖北大学学报(自然科学版),2019,41(5):483-488;493.
MAO W L,YANG S,WANG S L,et al.Characterization of the multicopper oxidase CopA on laccase activity from Pseudomonas sp.593[J].Journal of Hubei University(Natural Science),2019,41(5):483-488;493.
[19] 温思霞, 管敏,周涛,等.假蜜环菌黄曲霉毒素氧化酶的基因克隆、表达、纯化及酶学性质分析(英文)[J].微生物学报,2011,51(9):1 212-1 221.
WEN S X,GUAN M,ZHOU T,et al.Cloning,expression,purification and characterization of an aflatoxin-converting enzyme from Armillaria tabescens[J].Acta Microbiologica Sinica,2011,51(9):1 212-1 221.
[20] JONES S M,SOLOMON E I.Electron transfer and reaction mechanism of laccases[J].Cellular and Molecular Life Sciences,2015,72(5):869-883.
[21] 廖海君, 李蕊伽,陶敏,等.杂优-2平菇漆酶的分离纯化及酶学性质[J].食品科学,2016,37(19):147-153.
LIAO H J,LI R J,TAO M,et al.Isolation,purification and characterization of laccase from Pleurotus ostreatus heterosis-2[J].Food Science,2016,37(19):147-153.
[22] 刘宁, 贾慧,申珅,等.真菌漆酶:多样的生物学功能及复杂的天然底物[J].农业生物技术学报,2020,28(2):333-341.
LIU N,JIA H,SHEN S,et al.Fungal laccase:Multi-biofunction and ccomplicated natural substrates[J].Journal of Agricultural Biotechnology,2020,28(2):333-341.
[23] CALLEJ N S,SENDRA R,FERRER S,et al.Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine[J].Applied Microbiology and Biotechnology,2014,98(1):185-198.
N S,SENDRA R,FERRER S,et al.Identification of a novel enzymatic activity from lactic acid bacteria able to degrade biogenic amines in wine[J].Applied Microbiology and Biotechnology,2014,98(1):185-198.
[24] 高志杰.HPLC法同时测定食品中的4种黄曲霉毒素[J].中国卫生检验杂志,2007,17(10):1 803-1 804.
GAO Z J.Determination of four aflatoxin in food by HPLC at the time[J].Chinese Journal of Health Laboratory Technology,2007(10):1 803-1 804.
[25] CAO H,LIU D L,MO X M,et al.A fungal enzyme with the ability of aflatoxin B1 conversion:purification and ESI-MS/MS identification[J].Microbiological Research,2011,166(6):475-483.
[26] LOI M,FANELLI F,CIMMARUSTI M T,et al.In vitro single and combined mycotoxins degradation by Ery4 laccase from Pleurotus eryngii and redox mediators[J].Food Control,2018,90:401-406.
[27] LE C Q,OYUGI M,JOSEPH E,et al.Effects of isoleucine 135 side chain length on the cofactor donor-acceptor distance within F420H2:NADP+ oxidoreductase:A kinetic analysis[J].Biochemistry and Biophysics Reports,2017,9:114-120.
[28] MOROZOVA O V,SHUMAKOVICH G P,SHLEEV S V,et al.Laccase-mediator systems and their applications:A review[J].Applied Biochemistry and Microbiology,2007,43(5):523-535.
[29] CA ASA A I,CAMARERO S.Laccases and their natural mediators:Biotechnological tools for sustainable eco-friendly processes[J].Biotechnology Advances,2010,28(6):694-705.
ASA A I,CAMARERO S.Laccases and their natural mediators:Biotechnological tools for sustainable eco-friendly processes[J].Biotechnology Advances,2010,28(6):694-705.