人体在生长过程中会产生自由基,过量积累将会引发衰老、癌症、糖尿病、心脑血管疾病等一系列慢性疾病[1-4]。因此,清除自由基对维持人体健康至关重要。随着科技的进步和经济的发展,人们对于人工合成的抗氧化剂持有怀疑态度[5],天然抗氧化剂的研究引起了人们的极大兴趣[6]。生物活性肽能够以多种方式发挥其抗炎、抗氧化等特性,包括清除自由基、抑制活性氧的产生以及抑制促炎细胞因子的释放等[7-9]。自然界中存在的胶原蛋白及其衍生肽具有强氧化性、强生物相容性和对人体无刺激等特点[10]。已报道多种来源的多肽具有抗氧化功能,如罗非鱼皮多肽[11]、低值海洋鱼低聚肽[12]、大豆多肽[13]等。
牦牛主要生活在青藏高原等高海拔地区,是一种罕见的可抗低温且耐受力超强的物种[14]。极端的生活环境使牦牛肉产品在蛋白质、脂肪和氨基酸等含量上优于普通牛肉产品。牦牛骨是牦牛肉类加工的副产品,富含矿物质和蛋白质等营养物质[15]。但在牦牛肉加工的过程中,产生的大量副产物牦牛骨被丢弃,没有得到进一步的利用。牦牛骨富含胶原蛋白,其水解物已被证实具有抗氧化[16-17]、抗高血压[18]、促成骨细胞增殖[19]等潜在的生物活性。然而,酶解牦牛骨胶原蛋白制备抗氧化肽时,使用的蛋白酶以碱性蛋白酶为主,这与人体消化系统中的蛋白酶(胃蛋白酶、胰蛋白酶)在酶解位点上有明显差异,所形成的多肽也会显著不同,且在胃肠消化过程中消化酶和极端pH条件可能会影响蛋白或肽的结构及活性[20]。因此,考察胃肠消化对牦牛骨胶原蛋白肽抗氧化活性的影响对于牦牛骨合理开发利用具有重要作用。
本文选用一种酶解法制备的牦牛骨胶原蛋白肽,通过测定体外模拟胃肠消化前后分子质量分布、氨基酸组成,结合·OH清除能力、Fe2+螯合能力、ABTS阳离子自由基清除能力等抗氧化性特征的分析,综合评价胃肠消化对于牦牛骨胶原蛋白肽抗氧化能力的影响。本研究可为牦牛骨胶原蛋白肽作为功能性食品的开发提供理论依据和基础。
1 材料与方法
1.1 材料与试剂
牦牛骨胶原蛋白粉,安徽国肽生物科技有限公司;食品级碱性蛋白酶、中性蛋白酶、风味蛋白酶,诺维信;胃蛋白酶、胰液、17种氨基酸标准品,美国Sigma公司;牛胆盐,国药沪试;本实验所用其他药剂均为国产分析纯。
1.2 仪器与设备
磁力搅拌器,国华仪器有限公司;实验室pH计,上海雷磁公司;UV-1200型紫外可见分光光度计,上海美谱达仪器有限公司;酶标仪,南京科麟得仪器有限公司;UltiMate3000高效液相色谱系统,美国Thermo Fisher Scientific公司;L-8900型全自动氨基酸分析仪,日本日立公司;电热恒温水槽,上海精宏实验设备有限公司;SHZ-D(Ⅲ)循环水式多用真空泵,上海秋佐科学仪器有限公司;高速离心机,安徽中科中佳科学仪器有限公司;电子分析天平,奥豪斯仪器有限公司。
1.3 实验方法
1.3.1 牦牛骨胶原蛋白肽的制备流程
将食品级碱性蛋白酶、中性蛋白酶和风味酶以2∶2∶0.5的质量比例混合,加入牦牛骨胶原粉溶液中进行水解。酶/底物(牦牛骨胶原蛋白粉)质量比为3∶1 000。水解温度(55±0.5)℃,水解4 h,95 ℃加热20 min终止酶反应,水解结束。冷却至室温,10 000×g离心15 min。收集上清液,旋转蒸发浓缩。浓缩后冷冻干燥,-20 ℃保存待进一步分析[21]。
1.3.2 体外模拟胃肠消化
根据产品推荐使用量,配制30 g/L牦牛骨胶原蛋白肽溶液。使用1 mol/L 盐酸调节溶液pH至2.0,以酶底质量比1∶50加入胃蛋白酶。37 ℃水浴摇床,在100 r/min下反应1 h。之后,样品使用1 mol/L NaOH溶液调节pH至5.0使胃蛋白酶失活。加入适量胰液[m(胰液)∶m(底物)=1∶25]和牛胆盐[m(牛胆盐)∶m(底物)=1∶35]。搅拌均匀后,用1 mol/L NaOH溶液调节pH至7.0~8.0,容器上方充氮气,盖紧瓶塞后放入37 ℃水浴摇床中,在100 r/min下反应2 h。沸水加热10 min使酶失活。放入-80 ℃冷冻4 h后放入真空冷冻干燥仪中进行冷冻干燥[22]。
1.3.3 水解度的测定
利用甲醛法[23]测定其水解度,取水解液8 mL,加超纯水60 mL。使用NaOH溶液调pH为8.2,加甲醛10 mL,用0.025 mol/L NaOH溶液调pH为9.2,所用NaOH的体积为V1。取8 mL同浓度未酶解的蛋白溶液,按上述方法做空白实验,记录NaOH的消耗量V0。再用凯氏定氮法测牦牛骨胶原蛋白肽中的氮含量,按公式(1)计算样品的水解度:
水解度![]()
(1)
式中:V1,水解液消耗的NaOH体积,mL;V0,空白消化液消耗的NaOH体积,mL;V,总酶解液体积,mL;c,滴定时所用NaOH浓度,mol/L;14.01,氮的摩尔质量,g/mol;m,样品质量,g。
1.3.4 分子质量分布的测定
采用Waters液相色谱系统测定牦牛骨胶原蛋白肽体外模拟消化前后的分子质量分布。
色谱条件:色谱柱TSK gel G2000 SWXL 色谱柱;柱温40 ℃;流动相V(0.1%三氟乙酸)∶V(乙腈)=45∶55;等梯度洗脱流速0.5 mL/min;进样体积10 μL;波长214 nm。
标品校准:Gly-Sar(146 Da);Gly-Gly-Tyr-Arg(451 Da);Bacitracin(1 422 Da);Aprotinin(6 511 Da);Cytochrome C(12 327 Da)。建立保留时间(X)和分子质量对数(Y)之间的标准曲线。
1.3.5 水解氨基酸含量分析
采用液相色谱法测定样品氨基酸的组成。取水解管编号,称取模拟消化前后样品100.0 mg左右,精确到小数点后1位,并详细记录称样质量。样品中加入 8 mL 6 mol/L的HCl溶液(先加入 4 mL摇匀润湿,再加入其余HCl溶液),充氮气3 min,调流速,使溶液呈微沸状态,拧紧水解管盖。放入已设定为 120 ℃的烘箱中,水解 22 h。将水解管样品全部转移至具塞试管,加4.8 mL 10 mol/L的NaOH 溶液中和,用蒸馏水定容至 25 mL。双层滤纸过滤,取1 mL澄清滤液于 1.5 mL离心管内,编号,15 345×g离心30 min。取 400 μL上清液于液相样品瓶,利用OPA柱前衍生反相高效液相色谱-紫外检测法测定氨基酸[24]。
分析条件:色谱柱Agilent Hypersil ODS柱(5 μm,4.0 mm×250 mm);流动相A:V(27.6 mmol/L醋酸钠)∶V(三乙胺)∶V(四氢呋喃)=500∶0.11∶2.5;流动相B:V(80.9 mmol/L醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2;流速1 mL/min;洗脱流程:0 min 8%B,17min 50%B,20.1 min 100%B,24.0 min 0%B;柱温40 ℃;紫外器检测波长338 nm,脯氨酸以波长262 nm检测。
1.3.6 抗氧化能力测定
1.3.6.1 ·OH清除能力的测定
用超纯水将样品配制为0.5、1.0、5.0、10.0、30.0 g/L 的样品溶液,取1 mL样品加入300 μL 8 mmol/L FeSO4溶液、250 μL 20 mmol/L H2O2溶液、1 mL 3 mmol/L水杨酸(乙醇溶液),混匀,37 ℃水浴20 min,以6 820×g离心1 min,上清液于波长510 nm处测吸光值A1。蒸馏水取代样品所测吸光值为A0,甲醇取代H2O2所测的吸光值为A2,·OH清除能力根据公式(2)进行计算[25]:
·OH清除能力![]()
(2)
1.3.6.2 Fe2+离子螯合能力
200 μL质量浓度为0.5、1.0、5.0、10.0、30.0 g/L的样品溶液加入2.5 μL 2 mmol/L FeCl2溶液、5 μL 5 mmol/L菲咯嗪反应10 min,测其562 nm波长处吸光度A1,200 μL的纯净水代替样品作为空白组吸光度为A0,2.5 μL的纯净水代替FeCl2作为对照组,其吸光度为A2,根据公式(3)计算Fe2+的螯合能力[26]。
Fe2+螯合能力![]()
(3)
1.3.6.3 ABTS阳离子自由基清除能力
采用KETNAWA 等[27]的方法并稍作修改。用超纯水将样品配制为0.5、1.0、5.0、10.0、30.0 g/L 的样品溶液。取 38.4 mg ABTS 和 6.623 mg K2S2O8混合,蒸馏水定容至 10 mL 配成ABTS母液。20 ℃避光反应12~16 h,用 pH 7.4的PBS稀释ABTS母液,调734 nm处吸光值为(0.7 ± 0.2)左右。分别取50 μL样品溶液与150 μL ABTS母液混合,室温避光反应 6 min,于734 nm 波长处测吸光值Ai。以50 μL 蒸馏水代替样品的反应体系为控制组其吸光值为Ac,以 150 μL PBS代替ABTS母液的反应体系为样品空白组其吸光值为Aj,以50 μL蒸馏水和150 μL PBS分别代替样品和ABTS母液的反应体系为空白组其吸光值Ab。按公式(4)计算ABTS阳离子自由基清除能力:
ABTS阳离子自由基清除能力/%=
(4)
1.4 数据统计与分析
所有实验均重复3次,采用 SPSS 25.0 软件进行统计分析,使用独立样本T检测进行显著性分析,数据均采用平均值±标准偏差表示,P<0.05表示显著差异,P<0.01表示极显著差异,并用Origin 8.0作图。
2 结果与分析
2.1 分子质量分布变化
模拟胃肠消化过程中分子质量分布变化如图1所示。在模拟胃液消化的过程中,分子质量500~1 000 Da的组分变化不明显,其他分子质量组分都发生明显变化。其中,分子质量>1 000 Da的组分显著降低,降幅超过50%,<500 Da的组分显著升高。以上结果说明,>1 000 Da的组分在胃肠道酶的作用下可被降解成分子质量更小的多肽及游离氨基酸。而<1 000 Da 的组分,特别是分子质量介于180~1 000 Da的部分能够抵抗胃肠液的消化。牦牛骨胶原蛋白肽体外模拟胃肠道消化过程中水解度为1.36%,虽然>1 000 Da的组分有明显降低,但其含量所占比例较低,因此水解度较低。由以上结果可知,牦牛骨胶原蛋白肽可以有效抵抗胃肠液的消解作用。
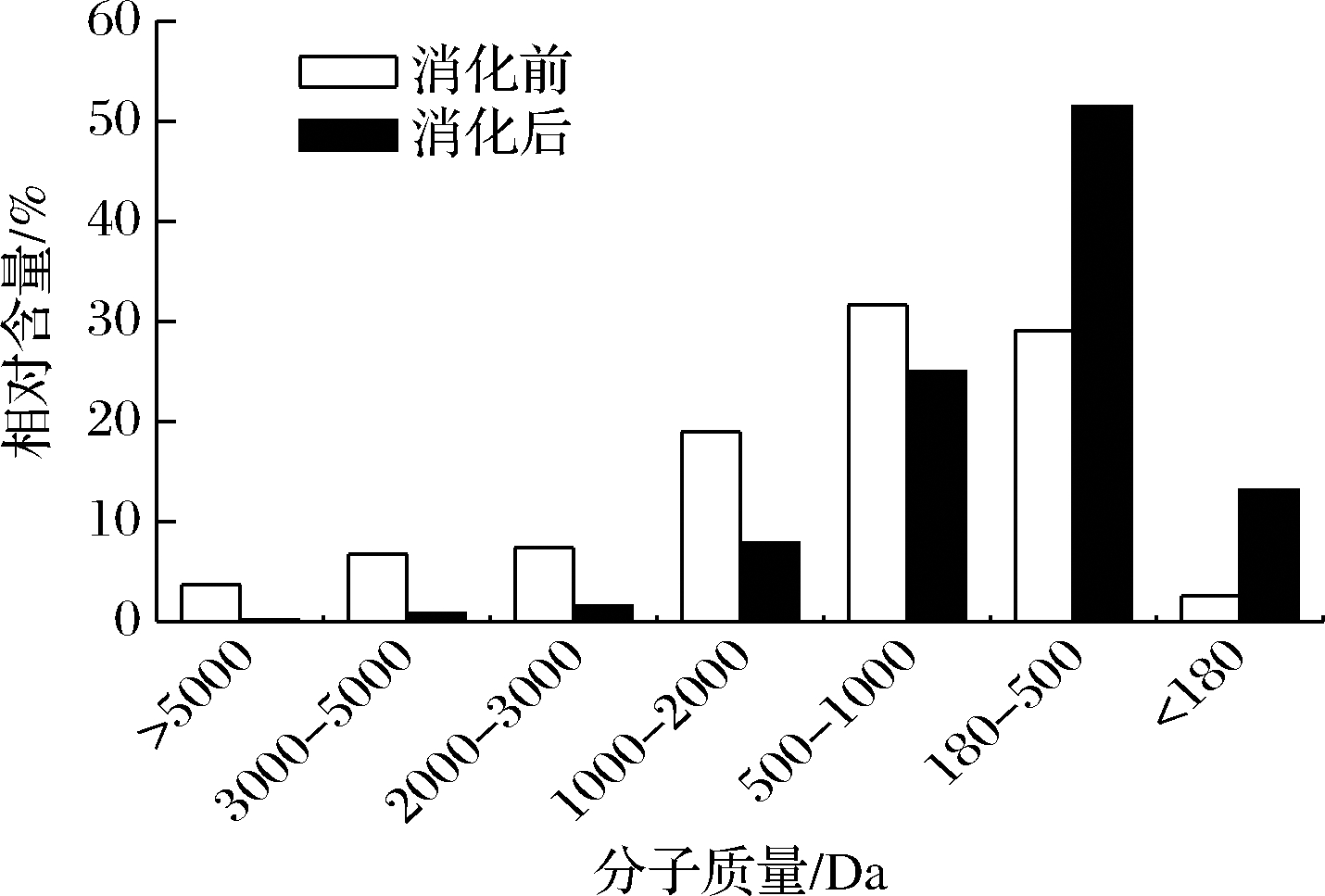
图1 消化前后分子质量分布变化
Fig.1 Changes in relative molecular weight distribution before and after digestion
2.2 体外模拟胃肠消化后样品氨基酸组成的变化
模拟胃肠消化期间释放的游离氨基酸和多肽,可以提供关于蛋白质水解产物抗氧化活性的信息[28],体外模拟胃肠消化前后样品氨基酸组成的变化如表1所示。
表1 体外模拟胃肠消化前后氨基酸组成的变化
Table 1 Changes of amino acid composition before and after simulated gastrointestinal digestion in vitro
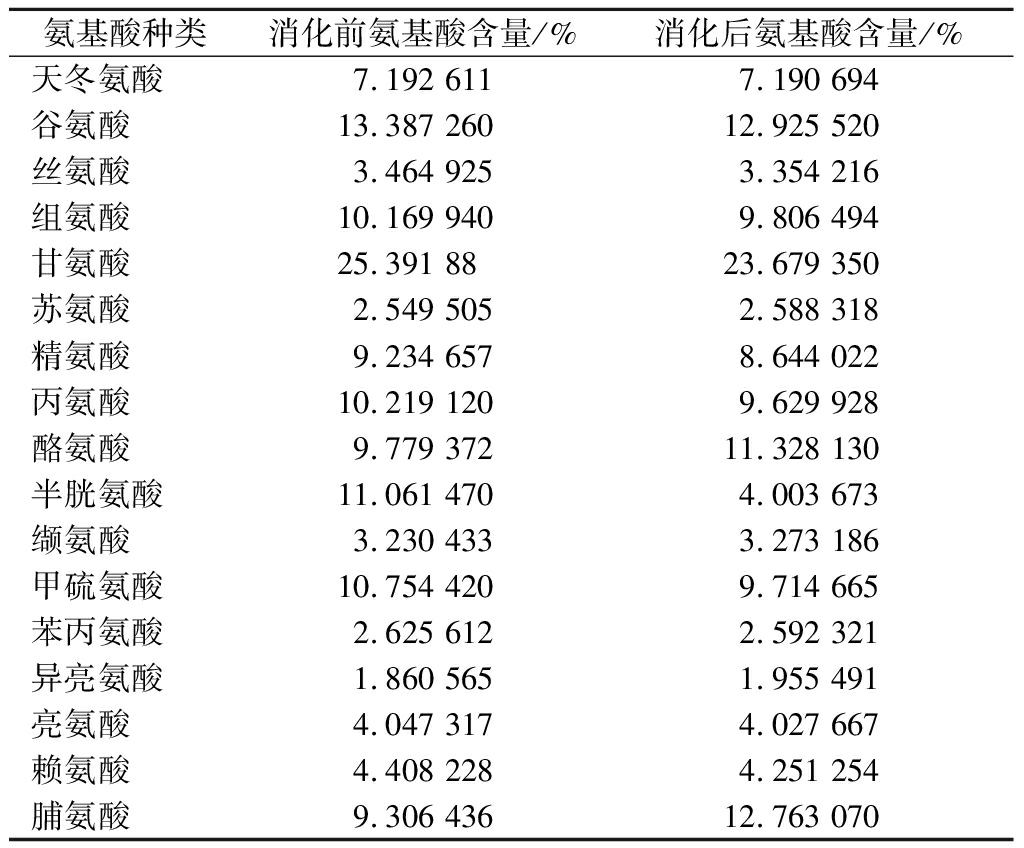
氨基酸种类消化前氨基酸含量/%消化后氨基酸含量/%天冬氨酸7.1926117.190694谷氨酸13.38726012.925520丝氨酸3.4649253.354216组氨酸10.1699409.806494甘氨酸25.3918823.679350苏氨酸2.5495052.588318精氨酸9.2346578.644022丙氨酸10.2191209.629928酪氨酸9.77937211.328130半胱氨酸11.0614704.003673缬氨酸3.2304333.273186甲硫氨酸10.7544209.714665苯丙氨酸2.6256122.592321异亮氨酸1.8605651.955491亮氨酸4.0473174.027667赖氨酸4.4082284.251254脯氨酸9.30643612.763070
疏水性氨基酸对多肽的抗氧化性起决定性作用。消化前苯丙氨酸、亮氨酸、异亮氨酸、缬氨酸、酪氨酸、甲硫氨酸等疏水性氨基酸占总量的32.30%,消化后占总量的32.90%,消化前后疏水氨基酸含量无明显差异。极性氨基酸和非极性氨基酸可通过协同作用来增强牦牛骨胶原蛋白肽抗氧化的能力,且每个单位极性氨基酸的抗氧能力是非极性氨基酸的1.2倍,每个单位芳香族氨基酸的抗氧化能力是脂肪族氨基酸的2倍[29]。消化前极性氨基酸与非极性氨基酸分别占氨基酸总量的44.39%和35.47%,消化后分别占42.82%和35.47%;消化前芳香族氨基酸与脂肪氨基酸分别占氨基酸总量的31.88%和54.11%,消化后分别占36.59%和51.92%。消化前后与抗氧化有关的氨基酸含量均无明显变化,表明胃肠消化对牦牛骨胶原蛋白肽的抗氧化活性可能影响较小,适合营养品和保健品等方面的应用。
2.3 模拟胃肠消化后产物的抗氧化活性测定结果
2.3.1 ·OH清除能力的测定
·OH清除能力结果如图2所示。消化前后牦牛骨胶原蛋白肽的·OH清除能力都随样品浓度增加而增强,且消化前后的·OH清除能力无明显差异。表明牦牛骨胶原蛋白肽中含有抗氧化活性的片段,且胃肠消化对其·OH清除能力活性影响不明显。

图2 模拟消化前后·OH清除能力的对比
Fig.2 Comparison of ·OH scavenging ability before and after digestion
2.3.2 Fe2+螯合能力
Fe2+螯合能力结果如图3所示。Fe2+螯合能力是物质抗氧化能力的重要指标,Fe2+被螯合可防止其被氧化为Fe3+。当样品浓度增加时,消化后样品的Fe2+螯合能力比消化前增长快,并在30 g/L时已达到92.8%。食物中具有明显抗氧化性的肽段分子质量为0.5 k~1.8 kDa[30]。牦牛骨胶原蛋白肽在体外模拟胃肠消化后大部分以二肽至十肽的结构存在,可有效增强抗氧化速率。因此消化后的Fe2+螯合能力和消化前相比有所提高。
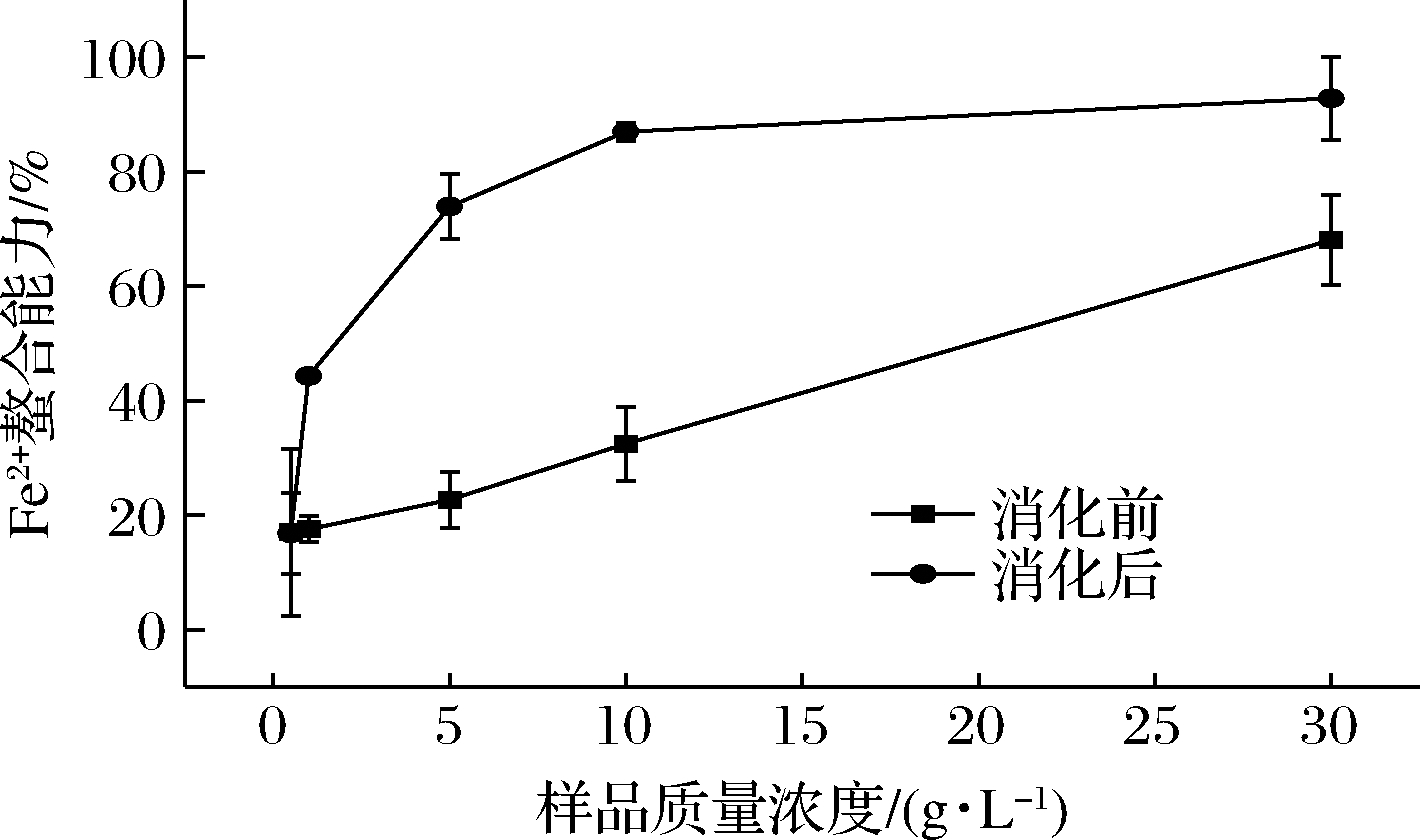
图3 模拟消化前后Fe2+螯合力的对比
Fig.3 Comparison of Fe2+ chelating force before and after digestion
2.3.3 ABTS阳离子自由基清除能力
ABTS阳离子自由基清除能力的测定可应用于亲脂性和亲水性化合物,并且已经广泛用作抗氧化活性测定。ABTS阳离子自由基清除能力结果如图4所示,在样品浓度增加时,体外模拟胃肠消化后样品的ABTS阳离子自由基清除能力增加速度更快,且在质量浓度为30 g/L时,消化前后牦牛骨胶原蛋白肽的ABTS阳离子自由基清除能力趋近100%,可能是因为经过胃蛋白酶和胰蛋白酶消化后,多肽链上的部分氨基酸被酶解下来,从而提高了抗氧化能力。

图4 模拟消化前后ABTS阳离子自由基清除能力的对比
Fig.4 Comparison of ABTS+ scavenging power before and after digestion
·OH清除能力、Fe2+螯合能力和ABTS阳离子自由基清除能力可作为评价牦牛骨胶原蛋白肽抗氧化性的重要指标。由以上结果可知,消化后除·OH清除能力无明显差异外,其他抗氧化性均有提高。胶原蛋白肽模拟胃肠消化过程中需要引入酸碱进行pH的调节以模拟胃肠道环境。但是这个过程会引入大量离子,经冻干后进入样品,这些离子的引入可能会对后续抗氧化活性的测定造成影响,实验设计过程中以及后续结果分析时应充分考虑离子对抗氧化活性的影响。本实验过程中,采用了HCl与NaOH溶液进行调节,引入的离子为Cl-和Na+,推测可能对抗氧化活性影响不明显。综上所述,严苛的胃肠消化环境不能破坏牦牛骨胶原蛋白中的抗氧化性功能肽。另外,由于分子质量变小,更有利于牦牛骨胶原蛋白肽穿过小肠壁被人体所吸收,因此消化后的牦牛骨胶原蛋白肽更能充分发挥其生物效应。
3 结论
该牦牛骨胶原蛋白肽经体外模拟胃肠消化后,抗氧化活性并未降低。消化后除·OH清除能力无明显变化外,其他抗氧化性均有提高。此现象可能是因为分子质量>1 000 Da的多肽大部分被模拟胃肠液中蛋白酶水解为小分子肽及游离氨基酸;这些游离氨基酸及小分子肽能够增强抗氧化活性及速率。除此之外,小分子多肽更容易被小肠吸收,更有利于牦牛骨胶原蛋白肽在体内发挥其抗氧化活性。因此该牦牛骨胶原蛋白肽产品适合应用于抗氧化保健品及营养品的开发。
[1] MAULIK S K,KUMAR S.Oxidative stress and cardiac hypertrophy:A review[J].Toxicology Mechanisms and Methods,2012,22(5):359-366.
[2] DALLE-DONNE I,ROSSI R,COLOMBO R,et al.Biomarkers of oxidative damage in human disease[J].Clinical Chemistry,2006,52(4):601-623.
[3] DALLE-DONNE I,GIUSTARINI D,COLOMBO R,et al.Protein carbonylation in human diseases[J].Trends in Molecular Medicine,2003,9(4):169-176.
[4] HARMAN D.Aging:A theory based on free radical and radiation chemistry[J].Journal of Gerontology,1956,11(3):298-300.
[5] 张雅楠, 梁鹏,谢静仪,等.天然食品抗氧化剂的研究进展[J].中国食物与营养,2019,25(1):67-71.
ZHANG Y N,LIANG P,XIE J Y,et al.Research advancements of natural food antioxidants[J].Food and Nutrition in China,2019,25(1):67-71.
[6] JIRATANAN T,LIU R H.Antioxidant activity of processed table beets(Beta vulgaris var.Conditiva)and green beans(Phaseolus vulgaris L.)[J].Journal of Agricultural and Food Chemistry,2004,52(9):2 659-2 670.
[7] SHI Y N,KOVACS-NOLAN J,JIANG B,et al.Peptides derived from eggshell membrane improve antioxidant enzyme activity and glutathione synthesis against oxidative damage in caco-2 cells[J].Journal of Functional Foods,2014,11:571-580.
[8] LIN S Y,WANG J,ZHAO P,et al.Optimized antioxidant peptides fractions preparation and secondary structure analysis by MIR[J].International Journal of Biological Macromolecules,2013,59:151-157.
[9] GU L J,ZHAO M M,LI W Z,et al.Chemical and cellular antioxidant activity of two novel peptides designed based on glutathione structure[J].Food and Chemical Toxicology,2012,50(11):4 085-4 091.
[10] YOUNG D,FAN M Z,MINE Y.Egg yolk peptides up-regulate glutathione synthesis and antioxidant enzyme activities in a porcine model of intestinal oxidative stress[J].Journal of Agricultural and Food Chemistry,2010,58(13):7 624-7 633.
[11] 李东东.罗非鱼皮多肽抗皮肤光老化作用研究[D].湛江:广东海洋大学,2018.
LI D D.Study on anti-skin photoaging effect of tilapia skin collagen polypeptide[D].Zhanjiang:Guangdong Ocean University,2018.
[12] 丁树慧.低值鱼低聚肽的酶法制备及抗氧化、抗疲劳活性研究[D].长春:吉林农业大学,2018.
DING S H.Studies on the enzymatic preparation of low value fish oligopeptides and its antioxidant and anti-fatigue activities[D].Changchun:Jilin Agricultural University,2018.
[13] 肖聪丽, 李理,陈敏.大豆多肽的分离纯化及其体外降血脂功能研究[J].中国酿造,2020,39(7):30-35.
XIAO C L,LI L,CHEN M,et al.Separation and purification of soybean peptides and its hypolipidemic function in vitro[J].China Brewing,2020,39(7):30-35.
[14] 倪蕴琪, 唐静仪,刘怀高,等.牦牛骨资源综合利用的研究现状与展望[J].农产品加工,2020(22):87-92.
NI Y Q,TANG J Y,LIU H G,et al.A summary review and advance of comprehensive utilization of yak bone resources[J].Farm Products Processing,2020(22):87-92.
[15] S NCHEZ-PAT
NCHEZ-PAT N F,CUEVA C,MONAGAS M,et al.In vitro fermentation of a red wine extract by human gut microbiota:changes in microbial groups and formation of phenolic metabolites[J].Journal of Agricultural and Food Chemistry,2012,60(9):2 136-2 147.
N F,CUEVA C,MONAGAS M,et al.In vitro fermentation of a red wine extract by human gut microbiota:changes in microbial groups and formation of phenolic metabolites[J].Journal of Agricultural and Food Chemistry,2012,60(9):2 136-2 147.
[16] 姜海洋, 张周莉,孙敏,等.牦牛骨抗氧化肽的分离纯化及鉴定[J].基因组学与应用生物学,2019,38(8):3 479-3 485.
JIANG H Y,ZHANG Z L,SUN M,et al.Isolation,purification and identification antioxidant peptides from yak bone[J].Genomics and Applied Biology,2019,38(8):3 479-3 485.
[17] SUN X H,WANG K,GAO S,et al.Purification and characterization of antioxidant peptides from yak(Bos grunniens)bone hydrolysates and evaluation of cellular antioxidant activity[J].Journal of Food Science and Technology,2020(3):1-14.
[18] 于小栋.牦牛骨胶原蛋白肽的制备及其功能特性研究[D].西宁:青海师范大学,2019.
YU X D.Preparation and functional properties of yak bone collagen peptide[D].Xining:Qinghai Normal University,2019.
[19] 叶孟亮, 张春晖,等.牦牛骨胶原蛋白促成骨活性肽分离纯化及结构鉴定∥中国食品科学技术学会.中国食品科学技术学会第十六届年会论文集[C].2019:55-56.
YE M L,ZHANG C H,et al.Isolation,purification and structure identification of active bone peptide facilitated by yak collagen∥Chinese Institute of Food Science and Technology[C],2019:55-56.
[20] 芦鑫, 胡东彬,贾聪,等.体外模拟消化芝麻蛋白产生多肽的抗氧化性分析[J].中国油脂,2020,45(5):63-66;81.
LU X,HU D B,JIA C,et al.Antioxidant analysis of peptides produced by in vitro simulated digestion of sesame protein[J].China Oils and Fats,2020,45(5):63-66;81.
[21] GAO S,HONG H,ZHANG C Y,et al.Immunomodulatory effects of collagen hydrolysates from yak(Bos grunniens)bone on cyclophosphamide-induced immunosuppression in BALB/c mice[J].Journal of Functional Foods,2019,60:103 240.
[22] PUCHALSKA P,CONCEPCION GARCIA M,LUISA MARINA M.Identification of native angiotensin-I converting enzyme inhibitory peptides in commercial soybean based infant formulas using HPLC-Q-ToF-MS[J].Food Chemistry,2014,157:62-69.
[23] 王海萍.高固形物浓度大豆分离蛋白酶解特性的研究[D].广州:华南理工大学,2016.
WANG H P.The effect of high solid concentration on characteristics of enzymatic hydrolysis of soy protein isolates[D].Guangzhou:South China University of Technology,2016.
[24] YANG B,YANG H,LI J,et al.Amino acid composition,molecular weight distribution and antioxidant activity of protein hydrolysates of soy sauce lees[J].Food Chemistry,2011,124(2):551-555.
[25] 卢素珍.鱼鳞明胶抗氧化肽的制备及其抗氧化作用研究[D].南昌:南昌大学,2019.
LU S Z.Preparation of fish scale gelatin antioxidant peptides and its antioxidant activity study[D].Nanchang:Nanchang University,2019.
[26] CHUNG Y C,CHANG C T,CHAO W W,et al.Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J].Journal Agricultural and Food Chemistry,2002,50(8):2 454-2 458.
[27] KETNAWA S,LICEAGA A M.Effect of microwave treatments on antioxidant activity and antigenicity of fish frame protein hydrolysates[J].Food and Bioprocess Technology,2017,10(3):582-591.
[28] FARVIN K H S,ANDERSEN L L,OTTE J,et al.Antioxidant activity of cod(Gadus morhua)protein hydrolysates:Fractionation and characterisation of peptide fractions[J].Food Chemistry,2016,204:409-419.
[29] 葛晓鸣, 顾伟,徐永健.海马水解蛋白的氨基酸组成与抗氧化能力的关系[J].核农学报,2019,33(2):322-329.
GE X M,GU W,XU Y J.Relationship between amino acid composition and antioxidant capacity of hydrolyzed protein from Hippocampus kuda bleeker[J].Journal of Nuclear Agricultural Sciences,2019,33(2):322-329.
[30] KIM S K,WIJESEKARA I.Marine-derived peptides:Development and health prospects marine proteins and peptides[M].Chichester:John Wiley & Sons Ltd,2013.