法兰克福香肠和博洛尼亚香肠等乳化类肉制品因质地细腻、汁液丰富、口味独特等优点深受世界各地消费者的喜爱,在这种乳化性肉制品中,脂肪球或油滴被包裹并嵌入了蛋白质基质中从而形成了不均匀的复合结构[1-3]。尽管有肌浆蛋白和基质蛋白的存在,肌原纤维蛋白(myofibrillar protein,MP)作为肌肉蛋白中含量最高的组分,在包裹脂肪微粒和小油滴的乳液界面蛋白膜的形成及热诱导蛋白凝胶网络形成过程中起着重要作用,因而在很大程度上决定了乳化肉制品的质构、风味等性质[4-5]。
乳化类肉制品的脂肪含量可高达20%~30%,在加工和贮存过程中,由于脂肪和蛋白质的共存,脂肪氧化和蛋白氧化很可能是相互关联的。已有研究表明,脂质过氧化氢、脂质自由基及其衍生的活性醛类物质均可诱导蛋白氧化,且蛋白本身也极易发生氧化反应,进而对蛋白的结构和功能特性造成影响[15-17]。然而关于氧化脂质对MP乳化性能影响的研究非常有限,脂肪酶催化的不饱和脂肪酸氧化可以产生氧化脂质,前期的研究揭示了亚油酸诱导的氧化修饰对猪MP的理化性质和胶凝性能的影响,本研究的目的是评价亚油酸氧化对MP乳化性能的影响。
1 材料与方法
1.1 实验材料
猪外脊肉(Longissimus lumborum)、金龙鱼大豆油,当地超市(陕西西安)购买;大豆脂肪氧合酶、水溶性维生素E(trolox),美国Sigma-Aldrich公司;亚油酸(>95%),上海阿拉丁化学有限公司;其他试剂至少为分析纯。
1.2 仪器与设备
HR/T20MM立式高速冷冻离心机,湖南赫西仪器装备有限公司;高剪切分散乳化机,上海弗鲁克(FLUKO)科技发展有限公司;Mastersizer 2000激光粒度分析仪,英国Malvern Instruments有限公司;Haake-Mars 60 流变仪、DXR2显微共聚焦拉曼光谱仪,德国Thermo Fisher Scientific公司;安东帕LitesizerTM 500纳米粒度及Zeta电位分析仪,奥地利Anton Paar公司;DM2500M显微镜,德国Leica公司。
1.3 MP的提取及样品制备
1.3.1 MP 的提取及氧化处理
MP的提取参照PARK等[17]的方法进行,使用双缩脲法以牛血清白蛋白(bovine serum albumin,BSA)作为标准测定蛋白质量浓度,将所得MP置于碎冰浴4 ℃保存并在48 h内使用。用含0.4 mol/L NaCl的25 mmol/L的磷酸盐缓冲液(pH 6.2)将MP稀释至45 mg/mL,将MP溶液分散于脂肪氧化体系(含0.5~10.0 mmol/L亚油酸,3 750 U/mL脂肪氧合酶)使MP质量浓度达到30 mg/mL并于4 ℃反应12 h。通过添加终浓度为1 mmol/L的trolox来终止氧化反应,未添加氧化体系的MP溶液为空白对照。
1.3.2 MP 乳液的制备
采用25 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl,pH 6.2)将氧化处理后的蛋白溶液分别稀释至1、10、30 mg/mL。向稀释后的MP溶液中加入20%(体积分数)纯大豆油,混合液使用高剪切分散乳化机在13 000 r/min下乳化2.5 min,从而得到新鲜的MP乳液。除去测定蛋白乳液流变性能(30 mg/mL)以及蛋白乳化活性、乳化稳定性(1 mg/mL)外,其余蛋白乳化性能测定如粒度等均使用质量浓度为10 mg/mL的蛋白。
1.4 乳化活性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)的测定
根据KEVIN等[18]提出的比浊法并略做改动测定MP乳液的EAI和ESI。按1.3.2乳液的制备方法制得新鲜乳液,立即从距离瓶底0.5 cm处取100 μL乳液置于试管中,而后加入5 mL 1 mg/mL SDS溶液,混匀后使用紫外分光光度计测定其在500 nm处的吸光度,10 min后再次于相同部位取样重复测定,以1 mg/mL SDS溶液在500 nm处的吸光度作为空白对照。EAI和ESI的计算如公式(1)、公式(2)所示:
(1)
(2)
式中:A0,A10分别为蛋白乳液在0、10 min时于 500 nm处的吸光值;φ为油相体积分数;ρ为乳化前蛋白质溶液中肌原纤维蛋白质量浓度,g/mL;N为稀释倍数。
1.5 MP乳液的粒度测定
采用静态光散射法对蛋白乳液样品的平均粒径进行了分析。测量时以蒸馏水作为分散介质,分散剂折射率为1.330,乳液的粒径分布结果由平均粒径(d3,2和d4,3)表示,重复测定3次取其平均值。
1.6 MP乳液的Zeta电位测定
制得的新鲜蛋白乳液用25 mmol/L磷酸盐缓冲液(含0.4 mol/L NaCl,pH 6.2)按体积比1∶100进行稀释。取1 mL稀释后的乳液置于微量样品池中,平衡时间设定60 s,测试温度为25 ℃,多次测定取其平均值。
1.7 MP乳液的界面蛋白含量测定
参照CHANYONGVORAKUL等[19]所描述的方法略做修改测定界面吸附蛋白含量。新鲜乳状液在11 000×g下离心35 min,将乳脂和乳清相分离,使用滤膜过滤乳清相。以BSA作为标准蛋白来计算乳清相蛋白的质量浓度。界面吸附蛋白含量计算如公式(3)所示:
界面吸附蛋白含量![]()
(3)
式中:ρ0 和 ρ1分别代表初始蛋白乳状液以及乳清相中的蛋白浓度。
1.8 MP乳液的流变学特性
采用Haake-Mars 60流变仪在25 ℃下对MP乳液的流变特性进行了表征。平行板(直径35 mm)间距设定为1 mm,在0.1~300 s-1的剪切速率范围内,测定乳液的稳态剪切流变特性,并对乳液的剪切速率和表观黏度之间的关系进行表征。通过频率扫描测定乳液的动态黏弹特性:频率范围为0.1~10 Hz,应变为0.5%(处于线性黏弹区间),记录储能模量(G′)和损耗模量(G″)。
1.9 MP乳液的微观结构表征
使用莱卡DM2500M光学显微镜观察MP乳液的微观结构,取适量新鲜乳液样品制备玻片标本,在室温下于40×物镜下进行观察。MP乳液样品的图像用显微镜上附带的相机进行记录和分析。
1.10 MP乳液的疏水相互作用和氢键作用表征
新鲜的蛋白乳液使用DXR2显微共聚焦拉曼光谱仪和DXR 785 nm激光光源进行光谱测定。高功率(35 mW)激光通过显微镜10×/0.25 BD定向聚焦于MP乳液,光谱的获取条件设定为:收集曝光时间30 s;孔径50 μm;光斑直径为3.1 μm;分辨率4.7~8.7 cm-1。数据由OMNIC软件收集后使用LabSpec对所得光谱进行平滑、基线校正并使用1 003 cm-1处的苯丙氨酸带进行归一化处理,记录760 cm-1处的归一化强度和830、850 cm-1的相对强度比。
1.11 数据分析
本研究中所有实验均重复2~3次,数据使用Statistix 9.0分析软件通用线性模型进行方差分析,采用LSD全配对多重比较方法进行显著性分析,差异具有统计学意义(P<0.05)。使用Sigma Plot 12.5软件进行绘图。
2 结果与讨论
2.1 氧化MP乳液的EAI和ESI分析
脂肪氧化体系中亚油酸浓度对MP乳液EAI和ESI的影响如图1所示。与未氧化MP样品相比,当亚油酸浓度低于1.0 mmol/L时,氧化MP乳液的EAI和ESI值随亚油酸浓度的增加而增大,而亚油酸浓度的进一步增加(3.0~10.0 mmol/L)则会导致样品EAI和ESI值的显著降低(P<0.05)。低浓度氧化亚油酸诱导MP构象发生变化,蛋白质结构部分解折叠从而暴露出更多的疏水基团,因此MP在形成乳液过程中能更好地吸附在水油界面上,从而有效提升了MP乳液的EAI和ESI[20]。过度氧化情况下蛋白共价交联形成不溶性的蛋白聚集体,蛋白分子柔韧性降低、蛋白分子间的静电相互作用以及乳状液界面—水相互作用减弱,乳液体系难以形成稳定的界面膜,蛋白与脂肪间的交联能力降低,导致乳状液分层加快,乳化活性和乳化稳定性不断降低[21]。在羟自由基氧化体系中,李艳青等[21]研究发现随着H2O2浓度的增加,鲤鱼MP的EAI和ESI不断降低;在脂肪氧化体系中,王丹丹等[22]研究发现,适量添加氧化亚油酸(<4.5 mmol/L)时,核桃分离蛋白样品的EAI和ESI有明显改善,而过量添加时EAI值显著下降、ESI变化则不明显。猜测实验结果的不一致性与氧化剂种类以及蛋白种类的差异等因素有关。
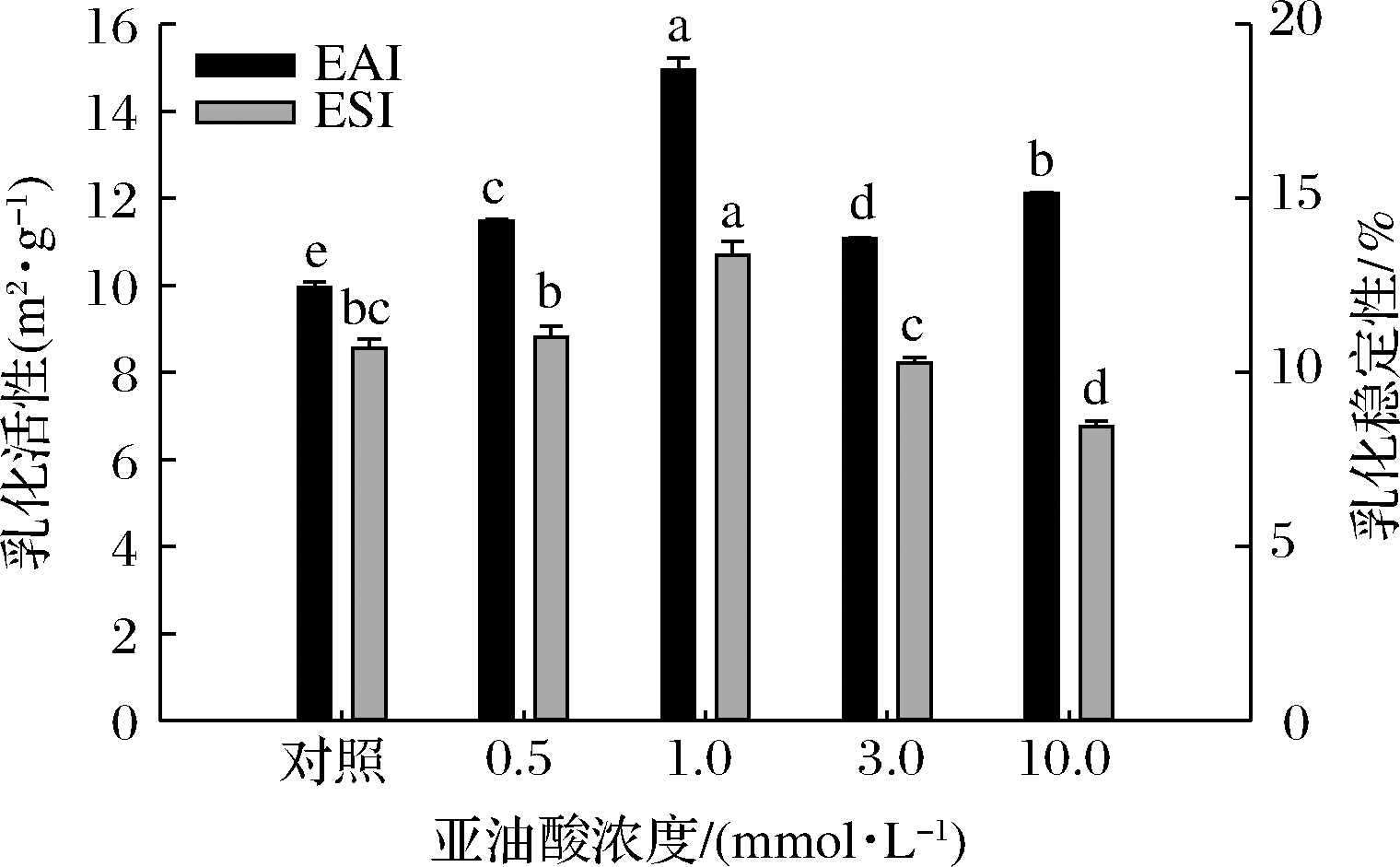
图1 亚油酸添加量对MP乳液EAI及ESI的影响
Fig.1 Effects of linoleic acid content on emulsifying activity and emulsifying stability of myofibrillar protein emulsion
2.2 氧化MP乳液的粒度分析
MP乳液的粒径变化如图2所示,乳液的平均粒径通常用来反映蛋白质的乳化能力,包括液滴的形成与稳定过程。相关研究表明乳液的EAI、ESI与乳液的平均粒径d3,2和d4,3有关:一定程度上乳液平均粒径越小,样品乳化性能越好[23]。未氧化MP样品的d3,2和d4,3值分别为29.14和48.32 μm,亚油酸浓度为1.0 mmol/L时,乳液的d3,2和d4,3分别下降为27.01和45.86 μm,而后随着亚油酸浓度从1.0 mmol/L增加到3.0 mmol/L,MP乳液的平均粒径(d3,2和d4,3)显著增大(P<0.05),这也与MP样品EAI和ESI的实验结果基本一致。类似研究表明轻度氧化降低了乳液的平均粒径(d3,2和d4,3),而严重氧化增大了过氧化氢自由基生成体系的平均粒径[24]。有趣的是本实验中亚油酸浓度为10.0 mmol/L时,氧化MP乳液的平均粒径反而低于亚油酸浓度为3.0 mmol/L时的MP样品,叶凤凌等[25]在研究2,2′-盐酸脒基丙烷(2,2′-azobis(2-amidinopropane)dihydrochloride,AAPH)热解产生的烷过氧自由基浓度对兔肉MP粒径影响时得到类似结果,可能是AAPH浓度过高(10.0 mmol/L)导致MP被过度氧化、肽键断裂从而降低了MP样品的粒径。
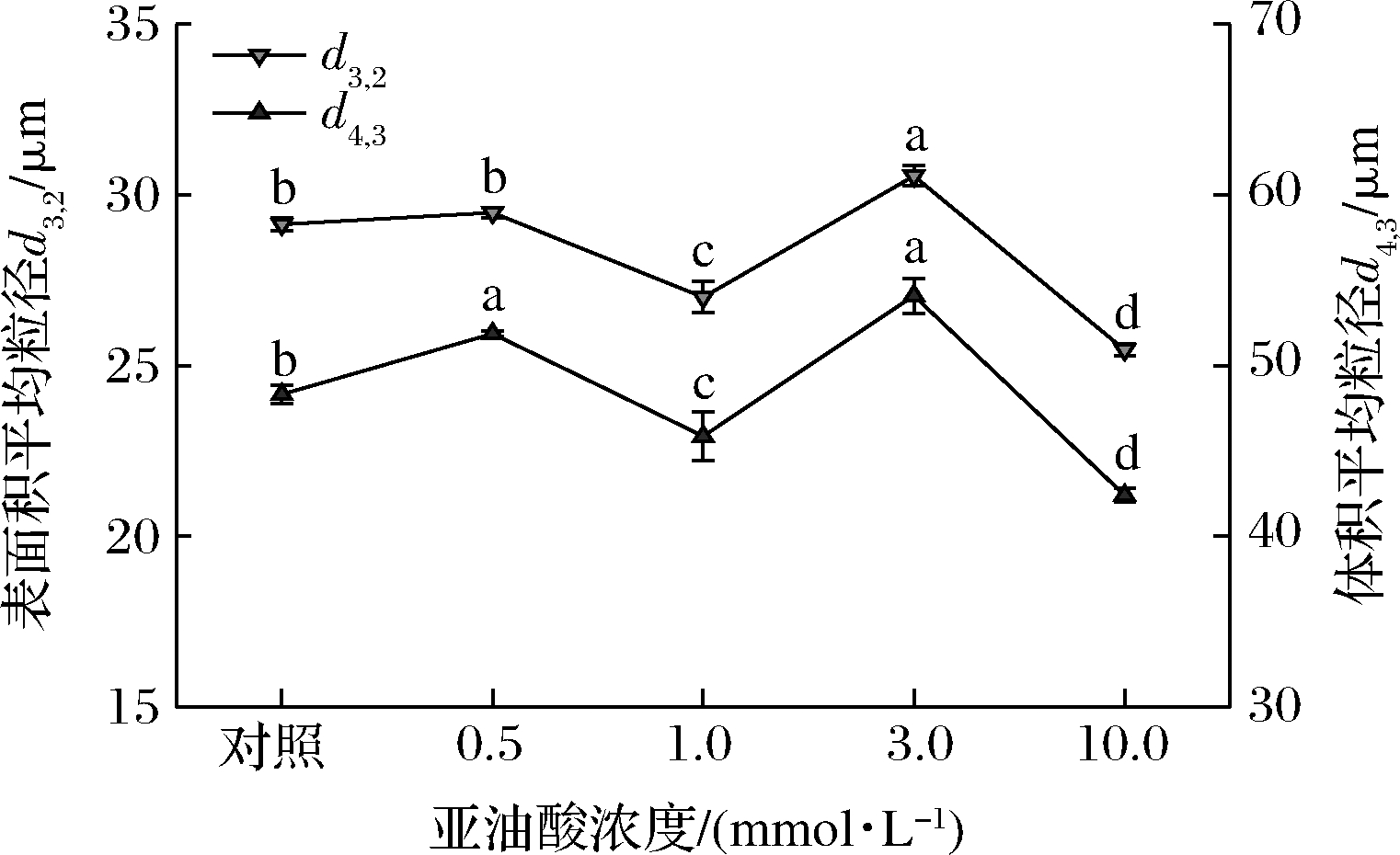
图2 亚油酸添加量对MP乳液平均粒径的影响
Fig.2 Effects of linoleic acid content on mean particle size of myofibrillar protein emulsion
2.3 氧化MP乳液的Zeta电位分析
乳液的Zeta电位是反映乳液体系潜在稳定性的重要指标,相关研究表明乳液的絮凝、沉淀主要与界面层上的静电作用力有关,乳液液滴间的静电作用力越强则乳液体系的稳定性越好[26]。Zeta电位的变化主要由氧化诱导的氨基酸侧链的修饰和蛋白质结构的变化引起[24]。如图3所示,所有MP乳液样品的Zeta电位均为负值,推测是因为MP乳液的pH值(pH 6.2)高于其等电点(pH 5.3)。与MP乳液EAI、ESI结果相似,当亚油酸浓度低于1.0 mmol/L时,随着亚油酸浓度的增加,Zeta电位的绝对值显著增大(P<0.05),当亚油酸浓度继续增加时(3.0~10.0 mmol/L),Zeta电位的绝对值呈现下降趋势。与未氧化MP乳液相比,亚油酸浓度为10.0 mmol/L时,Zeta电位绝对值下降了27.8%。这一结果表明在轻度氧化条件下,蛋白结构适度展开暴露出更多电荷的结合位点,从而增强了乳液间的静电排斥力,起到稳定乳液、减少液滴聚集的作用[27-28],而过度氧化则相反。
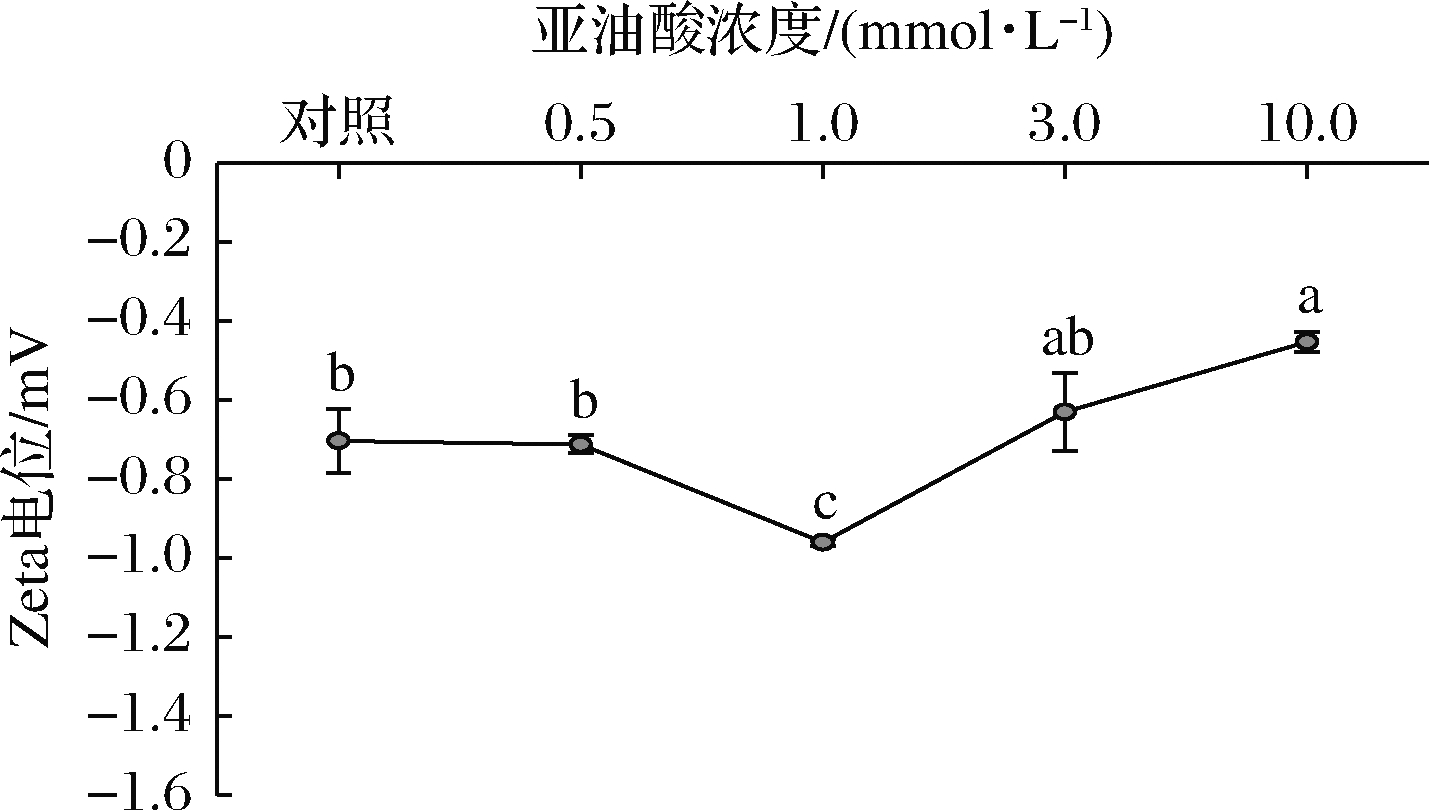
图3 亚油酸添加量对MP乳液Zeta电位的影响
Fig.3 Effects of linoleic acid content on Zeta potential of myofibrillar protein emulsion
2.4 氧化MP乳液的界面吸附蛋白含量
乳液的界面吸附蛋白含量可以作为评价乳液稳定性的一个重要指标。如图4所示,与未氧化MP样品相比,界面吸附蛋白含量随着亚油酸浓度的增加呈现先增大后减小的变化趋势,并在亚油酸浓度为1.0 mmol/L时达到最大值,这一结果与ZHOU等[29]的研究结果相似。轻度氧化导致蛋白质结构部分展开,促进蛋白质疏水基团的暴露、蛋白柔性增加,同时由于蛋白质分子间相互作用力的改变,使得更多的蛋白质吸附在乳状液表面,引起乳液的平均粒径减小(图2)、蛋白质间的静电斥力增强(图3)。而过度氧化情况下,蛋白与蛋白之间形成过量的强共价键,使得蛋白难以附着到乳液界面或易于从乳液界面脱离,界面蛋白吸附量减少、乳液稳定性降低[30]。
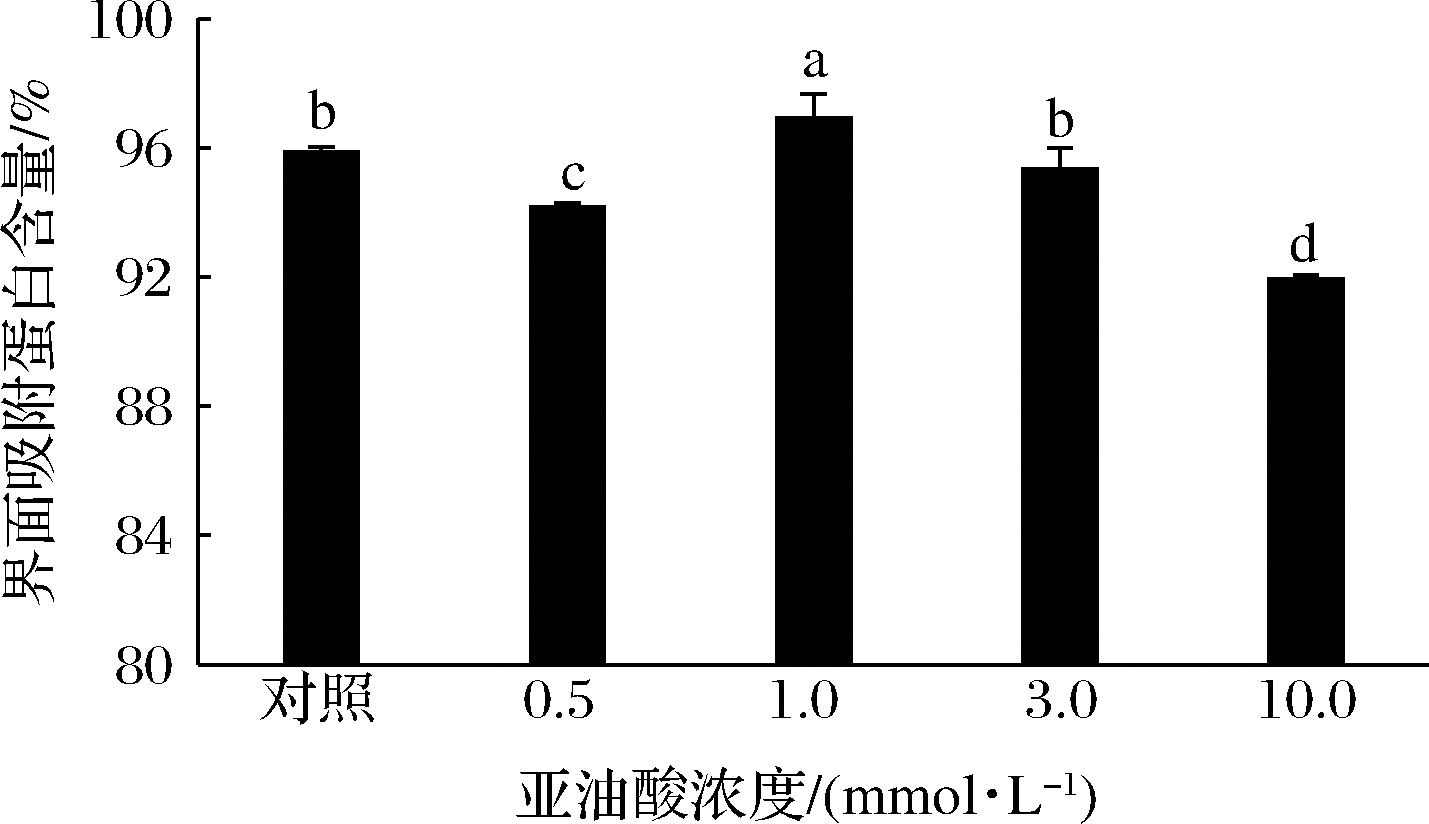
图4 亚油酸添加量对MP乳液界面蛋白吸附含量的影响
Fig.4 Effects of linoleic acid content on interfacial adsorbed protein percentage of myofibrillar protein emulsion
2.5 氧化MP乳液的流变学特性
乳液的流变学性能也与乳液体系稳定性息息相关,乳液的表观黏度随剪切速率的变化关系如图5-a所示,所有的乳液均表现出明显的剪切稀化的非牛顿流体特性,乳状液的表观黏度随着剪切速率从0~300 s-1的增加而逐步减小。结合相关文献可知这一结果主要是由脂肪球的絮凝作用引起[31]。值得注意的是,在任何剪切速率下未被氧化MP乳液均表现出较低的表观黏度,而氧化MP乳液的表观黏度随亚油酸浓度的增加而增加(0.5~1.0 mmol/L),随着亚油酸浓度的进一步增加(1.0~10.0 mmol/L)而降低。较大的乳状液表观黏度可以减缓乳化液液滴的迁移和碰撞,减少液滴聚集,从而提高乳液体系稳定性,这一结果与上述乳液的乳化稳定性和Zeta电位的结果是一致的(图1、图3)。
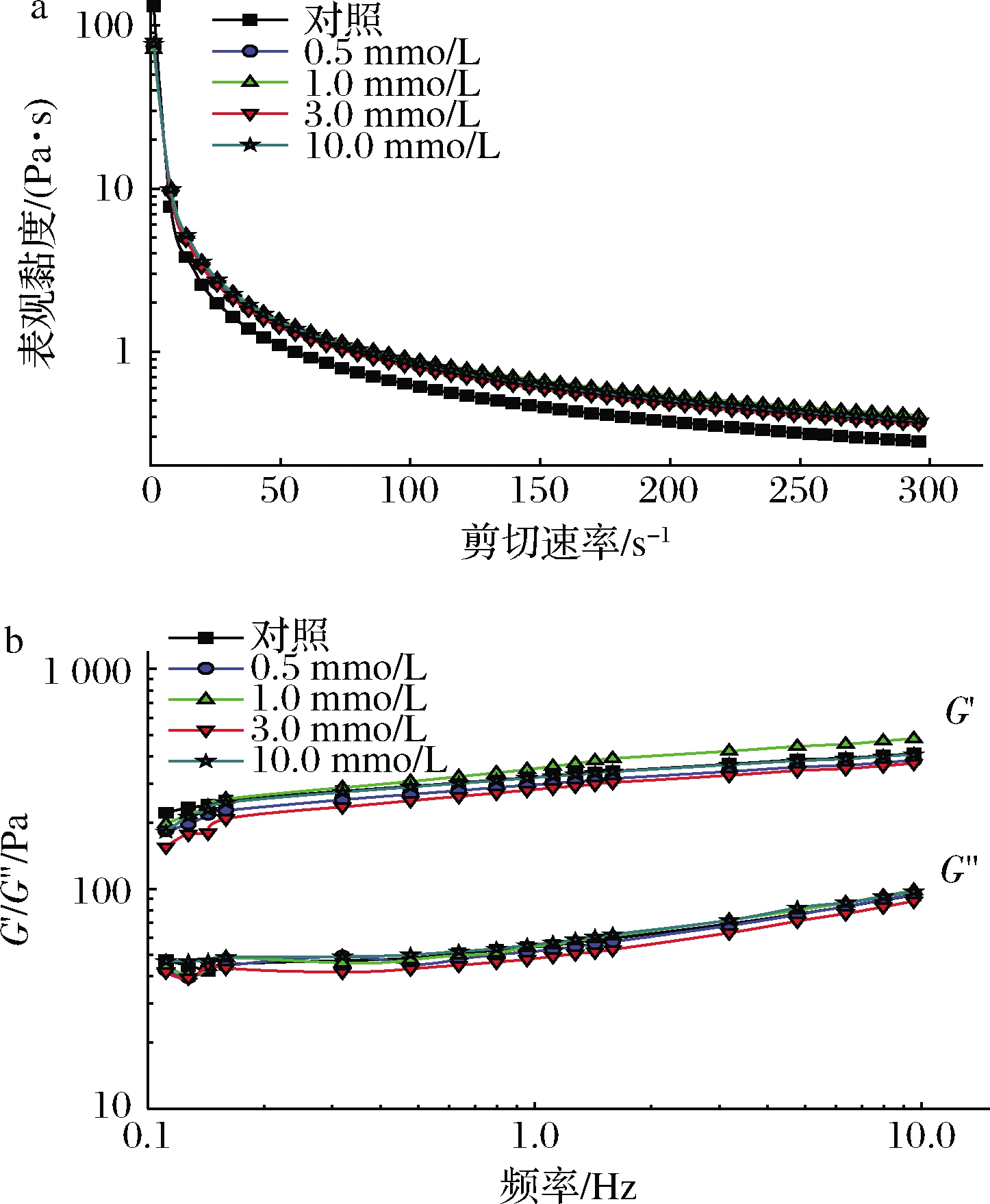
图5 亚油酸添加量对MP乳液流变性能的影响
Fig.5 Effects of linoleic acid content on rheological properties of myofibrillar protein emulsion
MP乳液的G′和G″随频率的变化曲线如图5-b所示,在测试的线性黏弹范围内,所有样品乳液的G′值都高于G″值,说明其内部存在弱凝胶状结构,从而保证了乳液的稳定性[32]。随着振荡频率的增加,不同乳液的G′和G″都在逐渐增加,这一点在其他凝胶状乳液中已有报道[31,33]。其中G′值的增加最有可能是由液滴与蛋白质间的相互作用引起[34]。亚油酸浓度为1.0 mmol/L乳液的G′和G″值在所有乳液中最高,说明轻度氧化增强了脂肪和蛋白质之间的一些非共价相互作用,从而增强了乳液的弹性性能和稳定性。
2.6 MP乳液的微观结构
如图6所示,未氧化MP和不同氧化程度MP样品制备的乳状液微观结构存在明显差异。结合图2乳状液的粒径变化发现,与未氧化MP乳液相比,随着亚油酸浓度的增加(0.5~10.0 mmol/L),乳状液颗粒呈现先减小后增大的变化趋势(图6-a~图6-e),亚油酸浓度为1.0 mmol/L时,MP乳液的微观结构发生显著变化:乳化液的颗粒明显变小,同时分布也更加的均匀,结合以上EAI、ESI、粒径、Zeta电位等乳化性质的结果,可以认为蛋白质氧化程度影响了乳液中蛋白质和脂滴的吸附和分布。王丹丹等[22]研究发现蛋白质氧化会影响蛋白的表面疏水性及其微观结构,从而导致蛋白表面活性、蛋白质分子的柔韧性和电荷的变化,而上述变化最终影响了蛋白质的乳化性能。

a-对照;b-0.5 mmol/L亚油酸;c-1.0 mmol/L亚油酸;d-3.0 mmol/L亚油酸;e-10.0 mmol/L亚油酸
图6 亚油酸添加量对MP乳液微观结构的影响
Fig.6 Effects of linoleic acid content on microscopic structure of myofibrillar protein emulsion
2.7 MP乳液的疏水相互作用及氢键作用
乳液的色氨酸残基(I760/I1003)和酪氨酸双重态(I850/I830)的拉曼强度如表1所示,MP乳液接近760 cm-1处的归一化强度提供了关于蛋白质乳液疏水相互作用的信息[35]。结果表明,与未氧化MP样品相比,亚油酸浓度增加到1.0 mmol/L时,样品的归一化强度(I760/I1003)显著增加(P<0.05),而随亚油酸浓度的进一步增加(3.0~10.0 mmol/L),I760/I1003值未见明显变化(P>0.05)。先前研究表明,拉曼条带归一化强度(I760/I1003)的增加意味着埋藏的色氨酸残基暴露在极性溶液中,从而增强了乳液的疏水相互作用[36]。
表1 亚油酸添加量对MP乳液的疏水相互作用及氢键作用的影响
Table 1 Effects of linoleic acid content on hydrophobic interaction and hydrogen bonding of myofibrillar protein emulsion

亚油酸浓度/(mmol·L-1)I760I850/I830对照0.45±0.09b1.38±0.01a0.50.53±0.06ab1.37±0.02ab1.01.05±0.34a1.41±0.00a3.01.03±0.59a1.40±0.07a10.00.96±0.07ab1.29±0.05b
注:同列上角标不同字母表示差异显著(P<0.05)
酪氨酸双重态的比值(I850/I830)可以监测MP乳液的酪氨酸残基微环境的变化[37]。结果表明,与未氧化MP样品相比,随着亚油酸浓度从0.5 mmol/L增加到1.0 mmol/L,酪氨酸双重态比值(I850/I830)无明显变化(P>0.05),而当亚油酸浓度由1.0 mmol/L增大到10.0 mmol/L时,酪氨酸双重态比值显著降低(P<0.05)。酪氨酸双重态比值(I850/I830)为1.29~1.41,说明酪氨酸残基(—OH)主要暴露在水环境中与水形成中、弱氢键。色氨酸残基(I760/I1003)和酪氨酸双重态比值(I850/I830)的结果表明,轻度氧化增强了MP乳液的疏水相互作用和氢键作用,这可能是轻度氧化条件下乳液体系黏弹性及稳定性提高的内在原因。
3 结论
不同氧化程度对猪肌原纤维蛋白乳化性能的影响具有显著差异。适度氧化导致乳液平均粒径下降(d3,2和d4,3)、Zeta电位绝对值增加、表观黏度增强、G′和G″以及AP%增加,在一定程度上提高了MP的EAI和ESI;但过度氧化则会严重破坏MP的乳化性能。因此,在肉制品加工和原料肉贮存过程中要合理控制氧化程度,以提高原料肉的加工性能、改善肉制品的品质。
[1] 郭延娜.加工条件和冻结对猪肉肌原纤维蛋白乳化特性的影响研究[D].南京:南京农业大学,2009.
GUO Y N.Effects of processing conditions and frozen on emulsifying properties of pork myofibrillar proteins[D].Nanjing:Nanjing Agricultural University,2009.
[2] BARBUT S.Importance of fat emulsification and protein matrix characteristics in meat batter stability[J].Journal of Muscle Foods,1995,6(2):161-177.
[3] WU M G,XIONG Y L,CHEN J.Rheology and microstructure of myofibrillar protein-plant lipid composite gels:Effect of emulsion droplet size and membrane type[J].Journal of Food Engineering,2011,106(4):318-324.
[4] ASGHAR A,SAMEJIMA K,YASUI T,et al.Functionality of muscle proteins in gelation mechanisms of structured meat products[J].Critical Reviews in Food Science and Nutrition,1985,22(1):27-106.
[5] XIONG Y L.Protein oxidation and impIications for muscIe food quaIity[C].In Antioxidants in Muscle Foods:Nutritional Strategies to Improve Quality.New York:Wiley and Sons,2000:85-90.
[6] SUN X D,HOLLEY R A.Factors influencing gel formation by myofibrillar proteins in muscle foods[J].Comprehensive Reviews in Food Science and Food Safety,2011,10(1):33-51.
[7] ESTÉVEZ M,XIONG Y L.Intake of oxidized proteins and amino acids and causative oxidative stress and disease:Recent scientific evidences and hypotheses[J].Journal of Food Science,2019,84(3):387-396.
[8] ZHANG W G,XIAO S,AHN D U.Protein oxidation:Basic principles and implications for meat quality[J].Critical Reviews in Food Science and Nutrition,2013,53(11):1 191-1 201.
[9] 曹云刚, 马文慧,艾娜丝,等.氧化强度对肌原纤维蛋白结构及凝胶性能的影响[J].食品科学,2019,40(20):21-27.
CAO Y G,MA W H,AI N S,et al.Effects of different oxidation intensities on the structure and gel properties of myofibrillar protein[J].Food Science,2019,40(20):21-27.
[10] ESTÉVEZ M.Protein carbonyls in meat systems:A review[J].Meat Science,2011,89(3):259-279.
[11] 曹云刚.植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D].无锡:江南大学,2016.
CAO Y G.Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins:Mechanism and application[D].Wuxi:Jiangnan University,2016.
[12] WANG Z M,HE Z F,EMARA A M,et al.Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J].Food Chemistry,2019,288:405-412.
[13] ZHAO J,CHEN J,ZHU H N,et al.Mass spectrometric evidence of malonaldehyde and 4-hydroxynonenal adductions to radical-scavenging soy peptides[J].Journal of Agricultural and Food Chemistry,2012,60(38):9 727-9 736.
[14] PARK D,XIONG Y L,ALDERTON A L,et al.Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J].Journal of Agricultural and Food Chemistry,2006,54(12):4 445-4 451.
[15] ZHOU F B,ZHAO M M,CUI C,et al.Influence of linoleic acid-induced oxidative modifications on physicochemical changes and in vitro digestibility of porcine myofibrillar proteins[J].LWT-Food Science and Technology,2015,61(2):414-421.
[16] 杨玉玲,周磊,游远,等.氧化对肌原纤维蛋白热诱导凝胶质构特性及保水性的影响[J].中国农业科学,2018,51(18):3 570-3 581.
YANG Y L,ZHOU L,YOU Y,et al.The effects of oxidation on textural properties and water holding capacity of heat-induced myofibrillar protein gel[J].Scientia Agricultura Sinica,2018,51(18):3 570-3 581.
[17] PARK D,XIONG Y L.Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J].Food Chemistry,2007,103(2):607-616.
[18] PEARCE K N,KINSELLA J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[19] CHANYONGVORAKUL Y,MATSUMURA Y,SAWA A,et al.Polymerization of β-lactoglobulin and bovine serum albumin at oil-water interfaces in emulsions by transglutaminase[J].Food Hydrocolloids,1997,11(4):449-455.
[20] 周麟依,孙玉凤,吴非.丙二醛氧化对米糠蛋白结构及功能性质的影响[J].食品科学,2019,40(12):98-107.
ZHOU L Y,SUN Y F,WU F.Effects of oxidation by malondialdehyde on the structure and function of rice bran protein[J].Food Science,2019,40(12):98-107.
[21] 李艳青,孔保华,夏秀芳,等.羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J].食品科学,2012,33(9):31-35.
LI Y Q,KONG B H,XIA X F,et al.Effect of hydroxyl radical oxidation on emulsifying and gel properties of common carp(Cyprinus carpio)myofibrillar protein[J].Food Science,2012,33(9):31-35.
[22] 王丹丹, 毛晓英,孙领鸽,等.氢过氧化物氧化对核桃蛋白结构和乳化特性的影响[J].中国食品学报,2019,19(12):60-68.
WANG D D,MAO X Y,SUN L G,et al.Effects of oxidation by hydrogen peroxide on the structure and emulsifing properties of walnut protein[J].Journal of Chinese Institute of Food Science and Technology,2019,19(12):60-68.
[23] POON S,CLARKE A E,SCHULTZ C J.Effect of denaturants on the emulsifying activity of proteins[J].Journal of Agricultural and Food Chemistry,2001,49(1):281-286.
[24] CHEN N N,ZHAO M M,SUN W Z,et al.Effect of oxidation on the emulsifying properties of soy protein isolate[J].Food Research International,2013,52(1):26-32.
[25] 叶凤凌, 池玉闽,周敏之,等.氧化对兔肉肌原纤维蛋白结构、乳化性和凝胶性的影响研究[J].食品工业科技,2020,41(24):22-30.
YE F L,CHI Y M,ZHOU M Z,et al.Effect of oxidation on the structure,emulsification and gelability of rabbit meat myofibrillar protein[J].Science and Technology of Food Industry,2020,41(24):22-30.
[26] 陈振家, 郝利平.pH值和离子强度对大豆分离蛋白功能特性的影响[J].农产品加工(学刊),2008(4):8-12.
CHEN Z J,HAO L P.The effect of pH value and ionic strength on the functional properties of soybean protein isolate[J].Academic Periodical of Farm Products Processing,2008(4):8-12.
[27] KIM H J,DECKER E A,MCCLEMENTS D J.Role of postadsorption conformation changes of β-lactoglobulin on its ability to stabilize oil droplets against flocculation during heating at neutral pH[J].Langmuir,2002,18(20):7 577-7 583.
[28] ZHAO Q,SELOMULYA C,WANG S Q,et al.Enhancing the oxidative stability of food emulsions with rice dreg protein hydrolysate[J].Food Research International,2012,48(2):876-884.
[29] ZHOU F B,SUN W Z,ZHAO M M.Controlled formation of emulsion gels stabilized by salted myofibrillar protein under malondialdehyde(MDA)-induced oxidative stress[J].Journal of Agricultural and Food Chemistry,2015,63(14):3 766-3 777.
[30] 周非白.氧化修饰对猪肉肌原纤维蛋白结构与功能特性的调控研究[D].广州:华南理工大学,2016.
ZHOU F B,Oxidative modification on porcine myofibrillar protein in relation to structural changes and functional properties[D].Guangzhou:South China University of Technology,2016.
[31] DIAO X Q,GUAN H N,ZHAO X X,et al.Properties and oxidative stability of emulsions prepared with myofibrillar protein and lard diacylglycerols[J].Meat Science,2016,115:16-23.
[32] TURAN D,ALTAY F,GÜVEN E Ç.The influence of thermal processing on emulsion properties of defatted hazelnut flour[J].Food Chemistry,2015,167:100-106.
[33] TANG C H,LIU F.Cold,gel-like soy protein emulsions by microfluidization:Emulsion characteristics,rheological and microstructural properties,and gelling mechanism[J].Food Hydrocolloids,2013,30(1):61-72.
[34] LI C,FU X,LUO F X,et al.Effects of maltose on stability and rheological properties of orange oil-in-water emulsion formed by OSA modified starch[J].Food Hydrocolloids,2013,32(1):79-86.
[35] SUN Y Y,LUO H L,CAO J X,et al.Structural characteristics of Sheldrake meat and secondary structure of myofibrillar protein:Effects of oxidation[J].International Journal of Food Properties,2017,20(2):1 553-1 566.
[36] LI-CHAN E C Y.The applications of Raman spectroscopy in food science[J].Trends in Food Science & Technology,1996,7(11):361-370.
[37] ZHUANG X B,HAN M Y,BAI Y,et al.Insight into the mechanism of myofibrillar protein gel improved by insoluble dietary fiber[J].Food Hydrocolloids,2018,74:219-226.