乳果糖(lactulose)是由D-半乳糖基和D-果糖基通过β-1,4糖苷键连接成的二糖,作为一种功能性低聚糖它无法被人体吸收,但可被肠道微生物利用,对便秘和肝性脑病患者具有较好的疗效[1-3],对滥用抗生素导致的肠道菌群失调调节作用显著[4],在动物饲料中添加乳果糖可以防止镰刀菌毒素引发的疾病[5],还可添加到奶酪中作为益生元产品来生产功能性芝士[6]或改善酸奶的口感[7]。因此,乳果糖在医药、食品、饲料等领域都具有广泛用途,经济价值巨大。
当前乳果糖的工业化生产方法为化学催化法,即乳糖在碱性加热环境下会部分自发异构为乳果糖[8],但该方法仅有不到25%的转化率。加入硼酸或偏铝酸盐可与乳果糖形成络合物使反应平衡向乳果糖生成方向移动,反应结束后调节pH至中性或酸性可解离出络合物,可将转化率提升到75%以上[9]。然而去除铝或硼元素需要大量特种树脂,工艺成本高昂导致产业化后利润率低。因此化学法虽有周期短、工艺简单等优点,却存在污染大和提纯成本高的缺点,限制了应用。酶法制备工艺无污染,下游分离方法成熟,有望取代化学法成为未来生产乳果糖的主要方式。目前可用的2类酶分别为β-半乳糖苷酶和纤维二糖差向异构酶(cellobiose 2-epimerase,CE酶),前者产量较低,例在200 g/L底物条件下产量仅为22.6 g/L[10],原因在于该酶具备水解乳果糖的副反应特性。GUERRERO等[11]研究了影响β-半乳糖苷酶转糖苷和水解的因素,采用分批补料的方式提高了乳果糖产量,但乳果糖最终产率仍不超过45%。与之相比,CE酶仅需单一底物乳糖且转化率高,来源多为嗜热微生物,热稳定性较好[12]。近年来针对CE酶的研究已成为热点,例如沈秋云[13]通过对Caldicellulosiruptor saccharolyticus来源的CE酶(CSCE)进行定向进化,使其对乳果糖的产率大幅提高;CHEN等[14]也通过半理性设计改造提高了该酶的异构活性和热稳定性。由于嗜热酶在高温下热稳定性好,因此纯化仅需一步热处理;本身又耐贮存、高温催化过程不易染菌,因此嗜热型CE酶制备乳果糖的技术更具备应用前景。
在已报道的CE酶中,CSCE纯酶酶活力可达30 U/mg。然而,该酶同时还会产生15%的副产物依匹乳糖(epilactose),远高于中国药典所允许的副产物比例[15];依匹乳糖的分离难度也很大,因此该工艺存在此瓶颈问题。本文对嗜热型CE酶进行了挖掘,考虑到嗜热微生物中含有这类酶的概率更大,在基因库中检索发现,超嗜热微生物网团菌属Dictyoglomus sp.菌株NZ13-RE01编码有CE酶基因,将该基因(简称NZ13-CE)在大肠杆菌BL21(DE3)中实现了活性表达。纯酶性质研究表明,其催化温度较高,所产依匹乳糖含量相对较低,这表明该酶可能是适合于乳果糖规模化生产的候选酶。
1 实验材料
1.1 实验用试剂
DNA胶回收试剂盒、质粒小提试剂盒,南京诺唯赞生物科技公司;PCR引物、目的基因DNA片段,安徽通用生物公司;DNA marker、蛋白质标准品marker,Takara(大连)公司;乳果糖标准品,北京百灵威科技有限公司,其他试剂均为国产分析纯级别。
1.2 培养基
LB(种子)培养基:10 g/L蛋白胨、5 g/L酵母粉、10 g/L NaCl,NaOH溶液调节pH值为7.0。
发酵培养基:20 g/L甘油、15 g/L酵母粉、12 g/L胰蛋白胨、2.1 g/L一水合柠檬酸、0.3 g/L柠檬酸铁铵、2.5 g/L(NH4)2SO4、0.5 g/L MgSO4·7H2O、9.8 g/L K2HPO4·3H2O、15.1 g/L Na2HPO4·12H2O、3 g/L KH2PO4,NaOH溶液调节pH值为7.0。
补料培养基:500 g/L甘油、10 g/L MgSO4·7H2O。
1.3 菌株与载体
E.coli DH5α和E.coli BL21(DE3),南京诺唯赞生物技术公司,表达质粒载体pET-28a由本实验室保藏。
2 实验方法
2.1 重组质粒pET-28a-nz13的构建及转化E.coli BL21(DE3)
NCBI数据库查询得到NZ13-CE酶的编码基因序列,根据大肠杆菌密码子偏好性进行优化后,由安徽通用生物公司合成并连接到表达载体pET-28a;将适量重组质粒加入到E.coli BL21(DE3)感受态中,经热激冰浴后涂布于含25 μg/mL卡纳霉素的LB平板中,37 ℃静置培养12 h,挑取转化子进行PCR以及DNA测序验证。
2.2 重组大肠杆菌的诱导表达及电泳鉴定
挑取出发菌株单菌落,接入含25 μg/mL卡那霉素、装有50 mL液体LB培养基的250 mL摇瓶中,37 ℃和220 r/min培养条件下培养至OD600值达到0.6~0.8,降温到25 ℃加入0.5 mmol/L的IPTG进行诱导表达24 h。离心收集菌体,超声破碎后4 ℃、12 000 r/min离心所得上清液即为粗酶液,吸取适量粗酶液进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析重组酶的表达情况。
2.3 重组酶的纯化
使用缓冲液(50 mmol/L PBS缓冲、pH 7.4)对镍亲和柱进行预平衡,将粗酶液以2 mL/min的速度上样平衡后的镍亲和柱,分别使用45和300 mmol/L的咪唑缓冲液进行蛋白洗杂和洗脱,将洗脱液于透析袋中4 ℃透析8 h、重复3次得到不含咪唑的纯酶溶液,加入50%(体积分数)纯甘油于-20 ℃冷冻保存。
2.4 纤维二糖差向异构酶酶活测定方法
酶活力单位(U)的定义:以乳糖为催化底物每分钟生成1 μmoL乳果糖所需的纤维二糖差向异构酶的酶量。
酶活力测定方法:取1 mL发酵液离心获得菌体,用生理盐水洗涤2次,再用1 mL 50 g/L乳糖溶液重悬菌体,置于80 ℃水浴反应20 min,反应结束后加入盐酸终止反应,进一步分析生成乳果糖的浓度。
检测方法:采用GB 1886.176—2016《食品安全国家标准 食品添加剂 异构化乳糖液》中的HPLC高效液相色谱法以及显色法来测定乳果糖的浓度。
显色法:将样品稀释到适当浓度,取100 μL样品加入280 μL 70%的浓硫酸,置于46 ℃水浴中5 min,加入20 μL显色剂,持续水浴50 min,测定518 nm的吸光值[16]。
2.5 NZ13-RE01 CE酶的酶学性质分析
最适反应pH测定:测定pH为7~9条件下NZ13-CE酶的活性变化(50 mmol/L Tris-HCl缓冲液),最高活性设定为100%,计算在不同pH条件下的相对酶活力。最适反应温度:测定反应温度在40~90 ℃范围内重组酶的酶活力,将测得最高酶活力设为100%,计算在其他温度条件下的相对酶活力。活性半衰期:重组酶在最适反应温度下保温0~240 min,结束后迅速加入盐酸终止反应,测定残余酶活力(Ut),以热处理前的酶活力为初始酶活力(U0),计算该酶在最适反应温度下的活性半衰期[17]。反应动力学参数测定:测定在不同底物浓度[S]下,NZ13-CE酶的催化速率v,并根据底物浓度[S]和催化速率v的双倒数作图,求得Km,Vmax,kcat等动力学参数的数值。
2.6 通过大肠杆菌高密度发酵表达重组酶
以筛选出的相对高酶活克隆作为出发菌株E.coli BL21(DE3)pET-28a-NZ13-CE,在7.5 L发酵罐中尝试高密度发酵和目的酶表达。前期设定培养温度为37 ℃来快速生长菌体,参考裴绪泽和吴彬等[18-19]对高密度发酵大肠杆菌产酶的优化策略,将溶解氧控制在20%~30%水平,通气量5 L/min,发酵液pH 7.0,前期控制比生长速率为0.2 h-1,诱导后比生长速率控制为0.1 h-1。OD600达到40~50时降温至25 ℃,加入IPTG开始诱导,继续发酵至OD600不再上升时停止补料并结束发酵。发酵过程中控制发酵液中的卡那霉素终质量浓度为25 μg/mL,IPTG终浓度为 0.5 mmol/L,总发酵时间不超过30 h。
3 实验结果
3.1 NZ13-CE酶的一级序列分析
将NZ13-CE酶的一级序列与已发表的几种产乳果糖CE酶进行比较,包括C.saccharolyticus(CSCE)、Dictyoglomus turgidum(DTCE)、Caldicellulosiruptor obsidiansis(COCE)等来源。结果表明该酶和DTCE、COCE、CSCE的一致性分别为54.2%、51.5%和51.0%。这表明在已报道能产乳果糖的CE酶中,NZ13-CE的序列一致性相对较低,是比较新的酶家族成员。在保守残基方面,CE酶家族的催化残基H245和H373也存在于NZ13-CE(图1)。

图1 NZ13-CE酶和已报道其他CE酶的一级序列比对
Fig.1 Amino acid sequence alignment of NZ13-CE and other reported CE enzymes
3.2 表达载体pET-28a-NZ13CE的转化与验证
将构建好的pET-28a-NZ13CE质粒表达载体转化表达宿主E.coli BL21(DE3)并进行菌落PCR验证,由图2-a可知PCR产物条带约为1.2 kbp,与NZ13-CE编码基因的片段大小一致,表明该表达质粒成功构建。
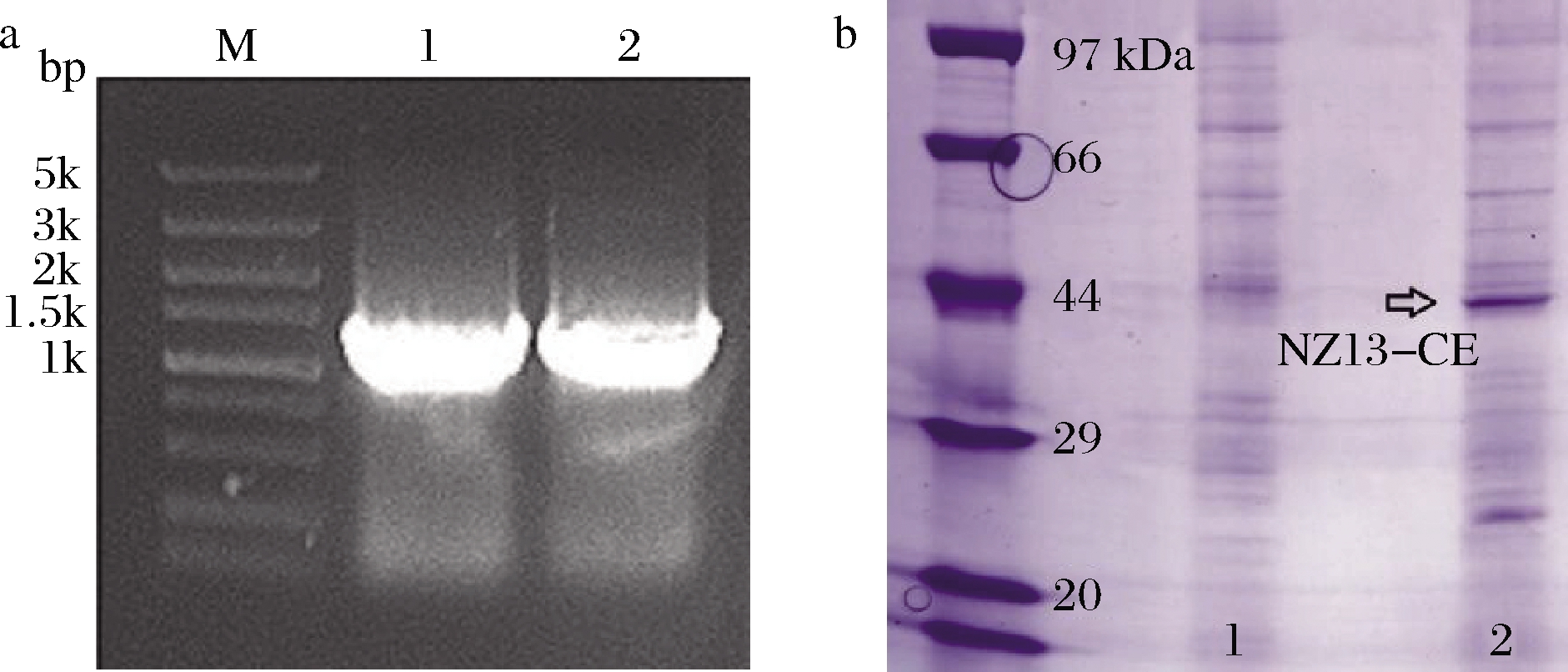
图2 转化克隆的PCR和SDS-PAGE电泳验证
Fig.2 PCR and SDS-PAGE analysis of obtained clones
将重组菌进行摇瓶发酵与诱导表达,结束后离心取菌泥重悬于PBS缓冲液,超声破碎30 min进行SDS-PAGE凝胶电泳,由图2-b可知在44 kDa附近有明显的蛋白表达条带,证明E.coli BL21(DE3)pET-28a-NZ13-CE表达宿主构建成功。
3.3 不同阳性克隆表达NZ13-CE基因的酶活力差别验证
为研究不同阳性克隆表达酶活力的水平差异,用LB液体培养基对随机挑取的10个阳性克隆进行摇瓶培养和酶表达。结果如图3所示,表明不同克隆的酶活力差别较小,其中酶活力最高的#8号克隆为0.53 U/mL,最低的#7号克隆为0.46 U/mL,是前者的87%。该结果表明大肠杆菌BL21(DE3)菌株对NZ13-CE酶的表达稳定性较好,选择#8号克隆进行后续实验。
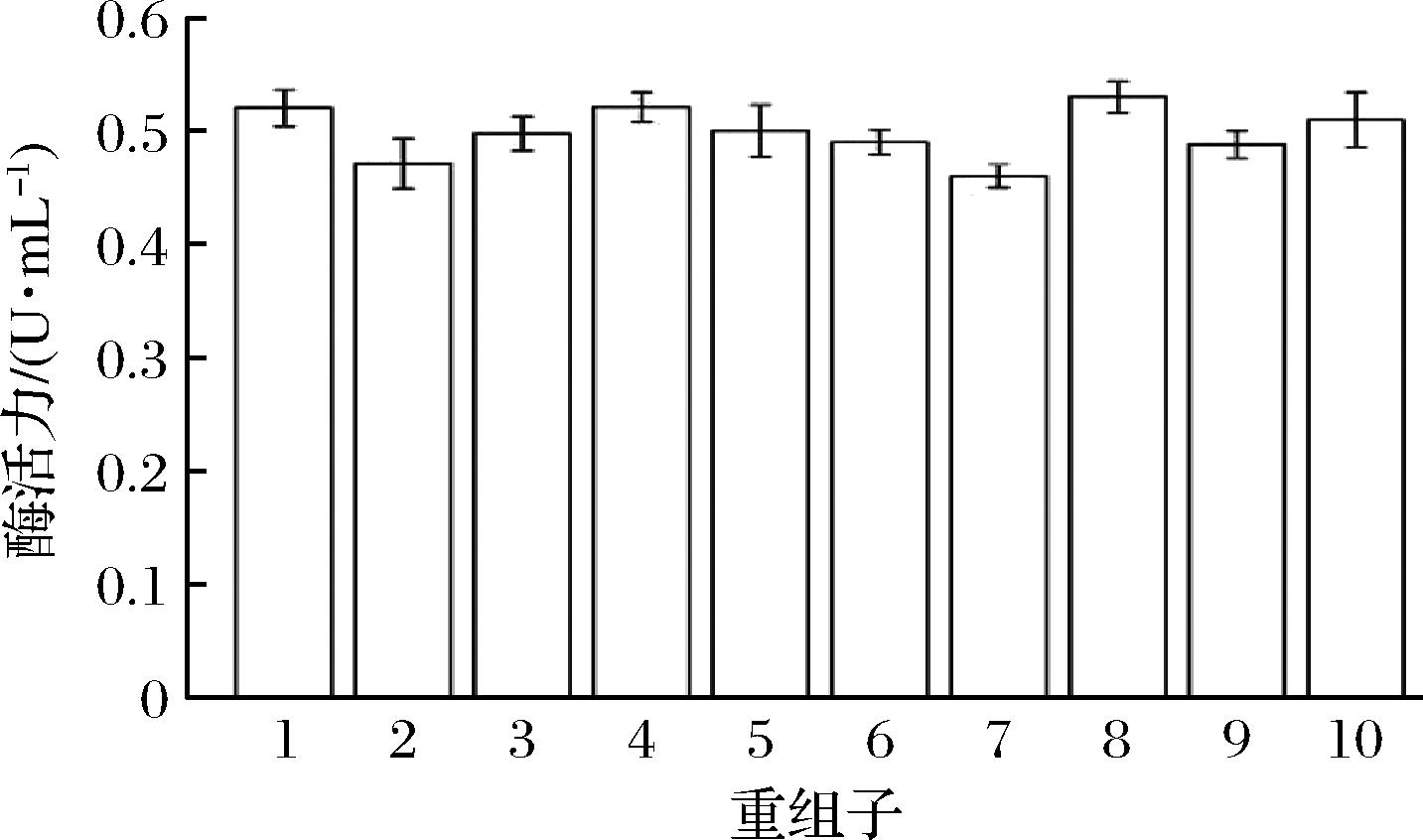
图3 平板挑取不同重组克隆的表达酶活力比较
Fig.3 Comparison of enzyme activities of different clones from one agar plate
3.4 重组纤维二糖差向异构酶的纯化
由于克隆所选择的pET-28a载体插入位点为Nde I和Xho I,使得重组酶N-端带有his-tag组氨酸标签,进而可利用镍亲和柱对其进行高效的蛋白纯化,在纯化过程中收集各步骤所得样品进行SDS-PAGE电泳。由图4可知,泳道1为咪唑洗脱步骤收集的重组酶,从条带可以看出此时酶浓度和纯度均很高;泳道2为洗杂液洗出的较高浓度杂蛋白,表明杂蛋白得到了有效去除;泳道3为上样后的穿透液;泳道4为上样的细胞破碎离心上清液。洗脱所得目的蛋白在5 kDa分子质量的透析袋内透析3次去除咪唑,再添加甘油至终浓度50%(体积分数)于-20 ℃保存。
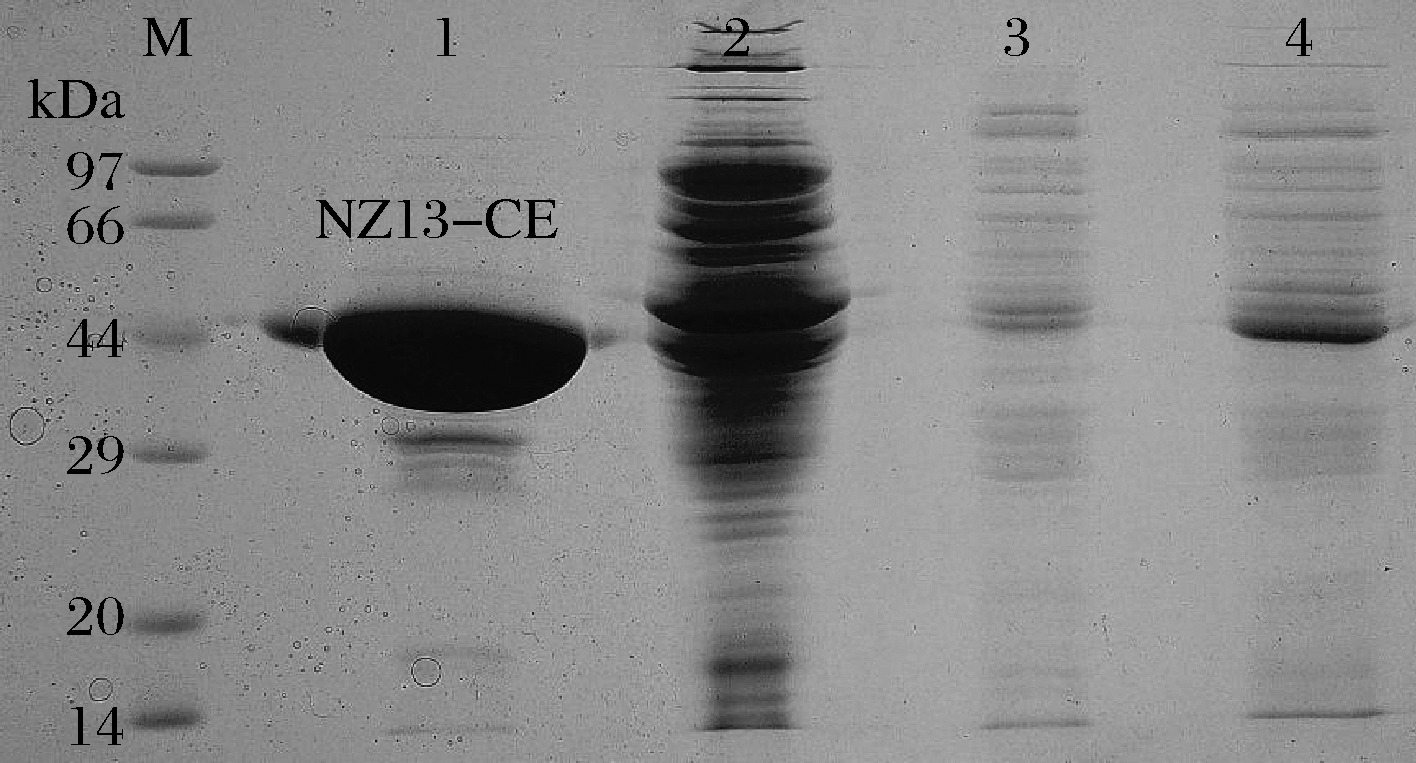
泳道M-蛋白质分子质量标准品;泳道1-洗脱液;泳道2-洗杂液;泳道3-穿透液;泳道4-破碎离心上清液
图4 NZ13-CE重组酶各纯化步骤的SDS-PAGE电泳图
Fig.4 SDS-PAGE analysis of different purification steps of the NZ13-CE enzyme
3.5 重组NZ13-CE酶的全酶分子质量测定
参考已发表文献,使用凝胶排阻色谱法[20]测定NZ13-CE重组酶的分子质量,根据280 nm紫外吸收值监测蛋白质含量变化。由图4可知,重组酶出峰体积为77.65 mL,根据测定不同标准蛋白样品出峰时间得到的标准曲线方程为:Y=-0.041 3X+7.864 9,其中X代表出峰体积(mL),Y代表蛋白质总分子质量(Da)的log值。将数据带入计算得到NZ13-CE酶的分子质量为45.5 kDa,接近理论分子质量46.5 kDa,可知NZ13-CE酶为单亚基酶,这与文献报道结果一致[12]。

a-重组酶的凝胶排阻色谱法出峰图谱;b-凝胶排阻色谱法标准曲线以及重组酶分子质量计算
图5 凝胶排阻色谱法测定重组酶NZ13-CE的全酶分子质量
Fig.5 Determination of relative molecular mass of recombinant enzyme by high performance gel exclusion chromatography
3.6 重组NZ13-CE酶的酶学性质
重组酶在不同温度下的相对酶活如图6-a所示,结果表明其最适反应温度为80 ℃,在70~85 ℃仍能保持80%以上的相对酶活力,当温度超过85 ℃后,酶活力急剧下降。重组NZ13-CE酶在不同pH条件下的酶活力如图6-b所示,可见该酶对于极端pH的耐受力很弱。当pH值为8.0时(缓冲液为Tris-HCl),其酶活力达到最高;随着pH的增加,酶活力急剧降低,仅在pH值为7.5~8.0才能使得该酶保持80%以上的活性。这与已报道的其他CE酶较为相似,其原因可能是CE酶催化残基为组氨酸,仅在中性条件下可同时作为质子供(受)体,因此在其他pH条件下活性变差。由于80 ℃是NZ13-CE酶的最适反应温度,因此继续研究80 ℃下的活力半衰期。由图7-a可知,ln(Ut/U0)数值和保温时间t可拟合成线性关系,线性方程为ln(Ut/U0)=-0.003 84t+0.003 91,当Ut/U0为0.5时,计算得到半衰期t1/2为181.5 min。由于异构酶均存在可逆反应平衡的特征,因此纤维二糖差向异构酶同样存在反应平衡限制。使用过量酶与底物反应足够长的时间即可得到对乳糖至乳果糖的最高转化率。由图7-b可知,重组酶对这一反应的最高转化率为52.5%(质量分数)。进一步通过HPLC分析了反应产物中各组分的比例,由峰面积比较(图8)可知,副产物依匹乳糖含量为总糖含量的9.2%;该数值低于已报道的CE酶,表明NZ13-CE酶形成依匹乳糖的能力较弱,有利于减少最终产品中依匹乳糖的含量。

a-NZ13-CE重组酶的最适反应温度;b-NZ13-CE重组酶的最适反应pH
图6 NZ13-CE重组酶的最适反应温度和pH
Fig.6 Optimal reaction temperature and pH of recombinant NZ13-CE
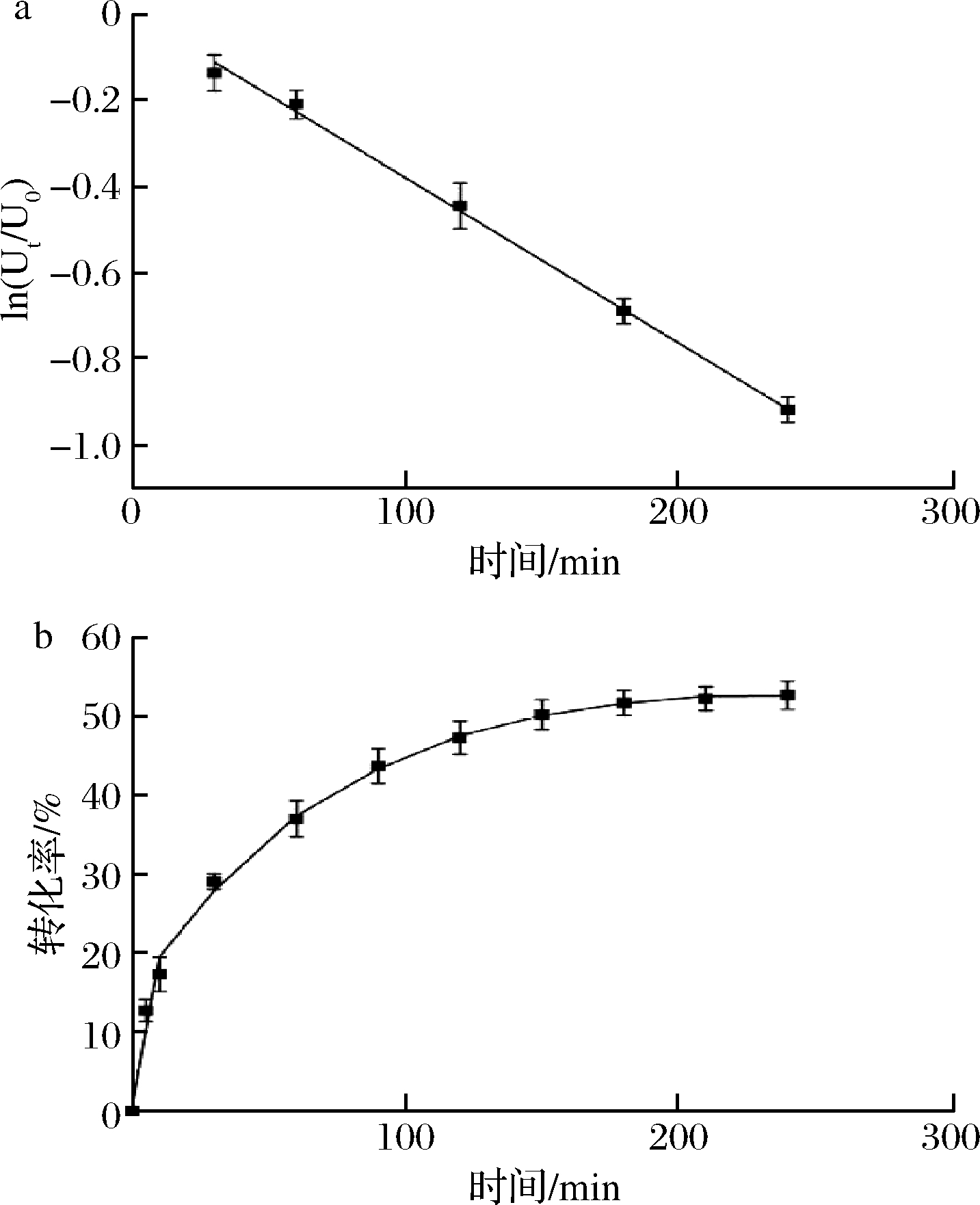
a-NZ13-CE重组酶在80 0.565 ℃下的活性半衰期;b-NZ13-CE重组酶的底物转化曲线
图7 NZ13-CE重组酶的活力半衰期以及转化率曲线
Fig.7 Activity half-life time and the conversion yield curve of recombinant NZ13-CE

图8 酶催化产物的HPLC图谱分析
Fig.8 HPLC analysis of the reaction products by NZ13-CE enzyme
最后测定了NZ13-CE酶的反应动力学参数,双倒数法求得方程Y=1 021.93X+1.77(R2=0.99),其中Y为1/v,X为1/[S];结果表明其Km值为577.4 mmol/L,kcat值为12 150 min-1,Vmax值为0.565 mmol/(L·s)。以上数据与已报道的CE酶相比具有优势,例如转换数kcat值仅低于C.obsidiansis(14 004 min-1)和D.thermophilum来源(26 484 min-1)[12];而其催化效率kcat/Km值为21.0 L/(min·mmol),远高于C.saccharolyticus来源(CSCE),后者仅为4.2 L/(min·mmol)[15]。
3.7 E.coli BL21(DE3)-NZ13菌株的高密度发酵与基因表达
将E.coli BL21(DE3)作为NZ13-CE酶高密度发酵用菌株,总发酵周期为27 h,具体过程:37 ℃培养5 h,在重组大肠杆菌进入对数生长期后降温至25 ℃开始诱导,添加IPTG至终浓度为0.5 mmol/L,加入IPTG后重组酶开始表达;同时进行流加补料,菌浓度逐渐上升并测得了酶活力不断提高。为模拟实际工业化生产中更加严苛的客观条件,对7.5 L罐发酵实验中的搅拌转速和通气量进行限制,分别为最高800 r/min和5 L/min。发现在第5 h,诱导时溶氧仅有3%左右,低溶氧限制了菌体的快速生长,因此需要更长的发酵周期。OD600在27 h时停止上升达到81(DCW = 27.6 g/L),此时结束发酵并测得发酵液酶活力为4.30 U/mL。
4 讨论
大肠杆菌是遗传背景最为清晰的工程菌株之一,且生长速度快、蛋白表达能力强、易于高密度培养。尽管会产生内毒素,但现有技术已完全可以通过下游分离来去除[21]。本研究中将网团菌属Dictyoglomus sp.NZ13-RE01来源的纤维二糖差向异构酶在大肠杆菌BL21(DE3)中表达,摇瓶酶活力为0.53 U/mL发酵液;该酶催化乳糖获得乳果糖的最高转化率为52.5%,而副产物依匹乳糖比例仅为9.2%。经过27 h的高密度发酵,成功将发酵液酶活力提升到4.30 U/mL;反应动力学研究表明NZ13-CE酶具有相对较高的kcat值和kcat/Km值。尽管该酶活力仍有待提高,但未来可对NZ13-CE酶进行蛋白质工程改造,从而将其单酶活力进一步提升,实现乳果糖的生物法制备。
5 结论
本研究首次将网团菌属Dictyoglomus sp.NZ13-RE01菌株来源的CE酶编码基因转化大肠杆菌BL21(DE3)进行表达,结果表明NZ13-CE重组酶的最适反应温度为80 ℃、最适反应pH为8.0,重组酶分子质量为45.5 kDa,在80 ℃下的活性半衰期为181.5 min,催化底物乳糖的最高转化率为52.5%,重组菌株通过高密度发酵发酵液酶活可达4.3 U/mL,是摇瓶水平的8.1倍。
[1] NOOSHKAM M,BABAZADEH A,JOOYANDEH H.Lactulose:Properties,techno-functional food applications,and food grade delivery system[J].Trends in Food Science & Technology,2018,80:23-34.
[2] ACHARYA C,BAJAJ J S.Current management of hepatic encephalopathy[J].The American Journal of Gastroenterology,2018,113(11):1 600-1 612.
[3] BAJAJ J S,IDILMAN R,MABUDIAN L,et al.Diet affects gut microbiota and modulates hospitalization risk differentially in an international cirrhosis cohort[J].Hepatology,2018,68(1):234-247.
[4] BAJAJ J S,KAKIYAMA G,SAVIDGE T,et al.Antibiotic-associated disruption of microbiota composition and function in cirrhosis is restored by fecal transplant[J].Hepatology,2018,68(4):1 549-1 558.
[5] ZHENG W J,JI X,ZHANG Q,et al.Hydrogen-rich water and lactulose protect against growth suppression and oxidative stress in female piglets fed Fusarium toxins contaminated diets[J].Toxins,2018,10(6):E228.
[6] SPERANZA B,CAMPANIELLO D,MONACIS N,et al.Functional cream cheese supplemented with Bifidobacterium animalis subsp.lactis DSM 10140 and Lactobacillus reuteri DSM 20016 and prebiotics[J].Food Microbiology,2018,72:16-22.
[7] HEYDARI S,AMIRI-RIGI A,EHSANI M R,et al.Rheological behaviour,sensory properties and syneresis of probiotic yoghurt supplemented with various prebiotics[J].International Journal of Dairy Technology,2017,71:175-184.
[8] AIDER M,DE HALLEUX D.Isomerization of lactose and lactulose production:Review[J].Trends in Food Science & Technology,2007,18(7):356-364.
[9] WANG M M,GASMALLA M A A,TESSEMA H A,et al.Lactulose production from efficient isomerization of lactose catalyzed by recyclable sodium aluminate[J].Food Chemistry,2017,233:151-158.
[10] DE ALBUQUERQUE T L,GOMES S D,D’ALMEIDA A P,et al.Immobilization of β-galactosidase in glutaraldehyde-chitosan and its application to the synthesis of lactulose using cheese whey as feedstock[J].Process Biochemistry,2018,73:65-73.
[11] GUERRERO C,VERA C,ILLANES A.Fed-batch operation for the synthesis of lactulose with β-galactosidase of Aspergillus oryzae[J].Bioresource Technology,2017,237:126-134.
[12] CHEN Q M,XIAO Y Q,ZHANG W L,et al.Current research on cellobiose 2-epimerase:Enzymatic properties,mechanistic insights,and potential applications in the dairy industry[J].Trends in Food Science & Technology,2018,82:167-176.
[13] 沈秋云.乳果糖制备用酶的构建及应用研究[D].无锡:江南大学,2015.
SHEN Q Y.The construction and application of lactulose-producing enzymes[D].Wuxi:Jiangnan University,2015.
[14] CHEN Q M,XIAO Y Q,SHAKHNOVICH E I,et al.Semi-rational design and molecular dynamics simulations study of the thermostability enhancement of cellobiose 2-epimerases[J].International Journal of Biological Macromolecules,2020,154:1 356-1 365.
[15] KIM Y S,OH D K.Lactulose production from lactose as a single substrate by a thermostable cellobiose 2-epimerase from Caldicellulosiruptor saccharolyticus[J].Bioresource Technology,2012,104:668-672.
[16] SHEN Q Y,ZHANG Y Z,YANG R J,et al.Enhancement of isomerization activity and lactulose production of cellobiose 2-epimerase from Caldicellulosiruptor saccharolyticus[J].Food Chemistry,2016,207:60-67.
[17] 江贤君, 包建波.β-半乳糖苷酶固定化研究[J].武汉轻工大学学报,2016,35(3):35-38;44.
JIANG X J,BAO J B.Study of immobilized β-galactosidase[J].Journal of Wuhan Polytechnic University,2016,35(3):35-38;44.
[18] 裴绪泽, 李益民,杜聪,等.重组大肠杆菌的高密度培养及在丙谷二肽生产中的应用[J].食品与发酵工业,2020,46(13):30-35.
PEI X Z,LI Y M,DU C,et al.High-cell-density cultivation of the recombinant E.coli and its application in the production of Ala-Gln[J].Food and Fermentation Industries,2020,46(13):30-35.
[19] 吴彬, 裴智鹏,成骋,等.利用指数流加补料高密度发酵产β-呋喃果糖苷酶重组大肠杆菌[J].微生物学通报,2017,44(4):766-773.
WU B,PEI Z P,CHENG C,et al.High density fermentation for β-fructofuranosidase production by recombinant Escherichia coli BL21(DE3)using exponential fed-batch culture strategy[J].Microbiology China,2017,44(4):766-773.
[20] 杨中华, 张立娜,张锦,等.中空纤维离心超滤-高效凝胶排阻色谱法测定青霉素V钾中蛋白杂质[J].分析科学学报,2018,34(2):209-213.
YANG Z H,ZHANG L N,ZHANG J,et al.Hollow fiber centrifugal ultrafiltration-high performance gel exclusion chromatography for the determination of protein impurities in phenoxymethylpenicillin potassium[J].Journal of Analytical Science,2018,34(2):209-213.
[21] SCHNEIER M,RAZDAN S,MILLER A M,et al.Current technologies to endotoxin detection and removal for biopharmaceutical purification[J].Biotechnology and Bioengineering,2020,117(8):2 588-2 609.