中国白酒是一种在固态条件下以谷物为原料、酒曲为糖化发酵剂,采用边糖化边发酵的双边发酵工艺生产的蒸馏酒[1]。由于我国现代的固态发酵技术起步较晚,所以对白酒双边发酵过程的研究较少,就糖化来说,国内大部分白酒研究只是聚焦于对大曲和酒醅中的酶活力和糖化产物的提取和测定上,未对双边发酵过程提出较为精确的控制要求和方法[2-4]。
我国传统白酒一直沿用窖池固态发酵法,糖化发酵过程受到粮食原料的糊化程度、发酵温度、酸和酒精等多方面的影响[5]。谷物原粮的糊化是微生物能够有效利用的关键步骤,蒸煮工艺条件的确定和优化对于后续的糖化过程具有重大影响[6];确定原料糊化率、温度、酸和酒精等各种因素对糖化速率的影响,确定对白酒发酵的控制方法,对制曲生产和酿酒生产具有极大的理论和实践意义,对于醋、酱油等固态发酵也有一定的借鉴意义[7-9]。本文探究了糊化率、温度、酸和酒精等因素对糖化速率的影响和控制方法,不同酒醅初始糖化酶活力和最终的酵母产酒差异,为精确控制白酒糖化过程提供参考依据和思路。
1 材料与方法
1.1 材料与试剂
粮食原料、糠壳,江苏泰州梅兰春酒厂有限公司;糖化酶,江苏锐阳生物科技有限公司;酿酒酵母(Saccharomyces cerevisiae),安琪酵母股份有限公司;氨苄青霉素钠,生工生物工程(上海)股份有限公司;盐酸、可溶性淀粉、磷酸氢二钠、柠檬酸、3,5-二硝基水杨酸、酵母膏、葡萄糖等试剂(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
SHP-250 生化培养箱,上海精宏实验设备有限公司;UVmini-1240 紫外分光光度计,日本岛津公司;PB2002-N 电子天平,Mettler Toledo 公司;Freezone 6 plus真空冷冻干燥机,美国Labconco公司;Quanta 200 扫描电子显微镜,Fei公司。
1.3 实验方法
1.3.1 葡萄糖标准曲线绘制
葡萄糖标准曲线绘制参考文献[10]。通过数据分析,得到回归方程y=0.549 2x-0.033 7(R2=0.999 4,x为葡萄糖质量浓度;y为吸光度值)。
1.3.2 还原糖测定
称取待测样品10 g,加入100 mL去离子水,于室温下搅拌30 min,用滤纸过滤得到待测液,用DNS法对待测液进行还原糖测定[11-12]。
1.3.3 不同条件对糖化速率的影响
研究糊化率、温度、酸和酒精对粮食糖化速率的影响,主要通过加塞玻璃瓶模拟窖池粮食糖化发酵固态条件从而进行实验。采用糊化率55%蒸煮工艺得到的原料,发酵温度30 ℃,酶用量120 U/g,乳酸含量0.04 mL/g,酒精含量0 mL/g。在其他条件不变下,分别改变:原料糊化率(50%、55%、60%),温度(20、30、40、50、60 ℃),乳酸增量(0、0.02、0.04、0.06 mL/g),酒精(0、0.05、0.1、0.15、0.2 mL/g)。糖化发酵4 h,测定还原糖量,计算糖化速率。上述条件覆盖正常白酒发酵的酒醅的温度、酸度和酒精含量范围。
1.3.4 粮食原料蒸煮工艺
传统酿酒原料堆积入窖前的蒸煮工艺依次是热水润粮,润粮一段时间后拌糠壳以增加粮食的疏松度和透气性,之后蒸粮,最后进行拌曲拌醅入池发酵[13]。根据粮食蒸煮的影响因素,选取了润粮水量(50%、70%、90%)、润粮时间(120、150、180 min)、蒸粮时间(30、40、50 min)以及润粮水温(60、80、100 ℃)4个因素进行4因素3水平正交试验,同时结合糊化率进行判别。糊化率测定方法参考冯兴垚[14]方法确定。
1.3.5 实验室模拟糖化发酵实验
本实验主要探究的是糖化速率对酵母发酵白酒的影响,为了降低无关因素的影响,在发酵前只添加糖化酶和酿酒酵母。具体操作:以加塞玻璃瓶模拟窖池,将经过蒸煮的原料每100 g拌入10 mL不同浓度糖化酶得到不同的初始酶活力原料(15、30、60、120、180 U/g)和10 mL活化酵母液(2×107 CFU/mL),进行发酵实验。
1.3.6 扫描电子显微镜微观分析
采用扫描电子显微镜对粮食碎粒糖化面进行微观分析,选取原始高粱碎粒、润粮后高粱颗粒、蒸煮后高粱碎粒和发酵一段时间高粱碎粒。将样品放置-70 ℃冰箱进行冷冻处理24 h,取适量入50 mL离心管中用真空冷冻干燥机进行干燥处理,最后取样品进行扫描电子显微镜拍照,进行微观结构观察分析[15-17]。
2 结果与分析
2.1 不同因素对糖化速率的影响
2.1.1 糊化率对糖化速率的影响
由图1可以看出,糊化率不同,粮食原料的糖化速率不同,并且糖化速率随着糊化率上升而逐渐上升。原因可能是随着糊化率的增加,糖化酶底物随之增加,在酶充足的条件下,糖化速率也随之增加[18]。在实际生产中,可以通过控制粮食原料的蒸煮工艺进而改变白酒原料的糊化程度,来控制原料的糖化速率。
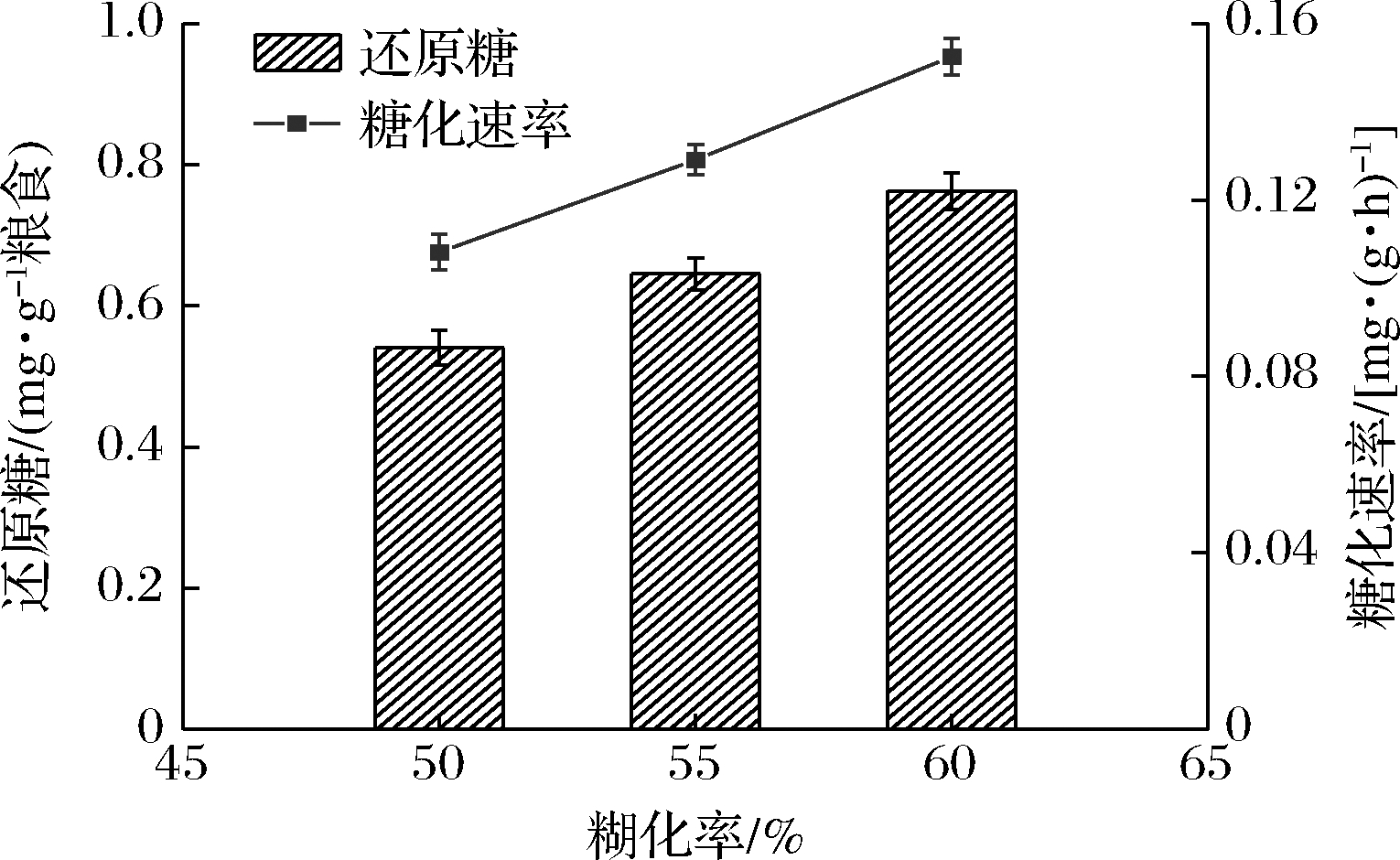
图1 糊化率对糖化速率的影响
Fig.1 The effect of gelatinization rate on saccharification rate
2.1.2 粮食蒸煮工艺的优化
通过正交试验,探究了润粮用水量、润粮时间、润粮温度和蒸粮时间对粮食糊化率的影响,其结果如表1所示。最佳工艺参数为:润粮水量90%、润粮时间180 min、蒸粮时间40 min、润粮温度60 ℃。在此条件下糊化率最高,可达61.63%,相同工艺重复验证实验糊化率达60.78%,误差较小。在几种影响因素中,蒸粮时间对粮食原料糊化影响最大,极差为6.263。但在实际生产中,蒸煮工艺还需要结合感官评价,不能一味只顾糊化率,导致发酵原料过于发黏。
表1 粮食蒸煮工艺正交试验结果与分析
Table 1 Orthogonal experimental results and analysis of sorghum cooking process
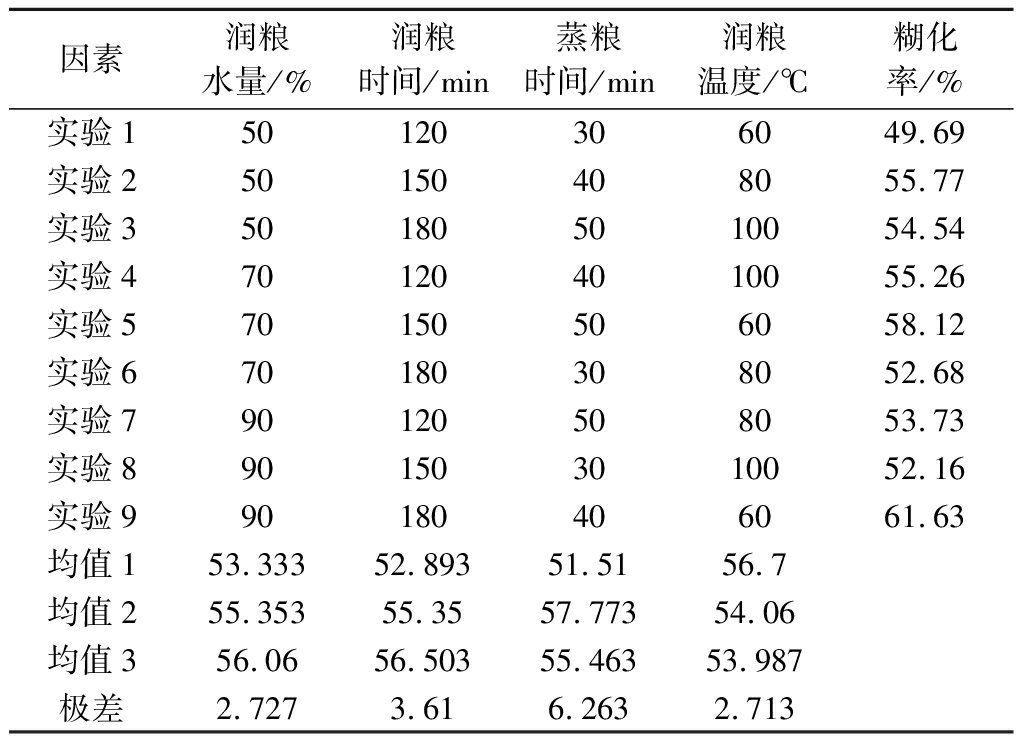
因素润粮水量/%润粮时间/min蒸粮时间/min润粮温度/℃糊化率/%实验150120306049.69实验250150408055.77实验3501805010054.54实验4701204010055.26实验570150506058.12实验670180308052.68实验790120508053.73实验8901503010052.16实验990180406061.63均值153.33352.89351.5156.7均值255.35355.3557.77354.06均值356.0656.50355.46353.987极差2.7273.616.2632.713
2.1.3 温度对糖化速率的影响
由图2可以看出,在20~50 ℃,酶反应速率随着温度上升而逐渐上升,50 ℃以后,酶反应速率急剧下降。原因可能有2个方面,一方面前期随着温度的升高,反应物能量加剧,有效碰撞增加,酶促反应速率增加,粮食糖化速率加快;另一方面,糖化酶作为一种蛋白质,温度的升高会引起酶蛋白质的变性,导致酶促反应速率下降[19]。结合日常发酵和酶学特性判断,当保持糖化反应温度为40~50 ℃时,粮食糖化速率最快,在具体生产中可以结合温控设备对酒醅发酵进行温度实时监测并采取适宜手段进行控温发酵。

图2 温度对糖化速率的影响
Fig.2 The effect of temperature on saccharification rate
2.1.4 乳酸对糖化速率的影响
由图3-a可以看出,在润粮时加一定量乳酸,在一定范围内可以促进原料的糊化,这是因为酸的增加有利于淀粉降解为小分子[20],但随着酸的增加,促进原料糊化效果降低,同时还会导致原料发黏,不利于后续的发酵。由图3-b得知,在蒸煮后添加不同含量的乳酸,糖化速率随着乳酸含量上升而逐渐下降。原因可能是随着乳酸含量的增加,酶活性部位基团的解离状态不利于酶与底物的结合,酶活力相应降低,同时添加乳酸会使pH降低,对酶的构象产生影响,从而使酶变性失活[21]。
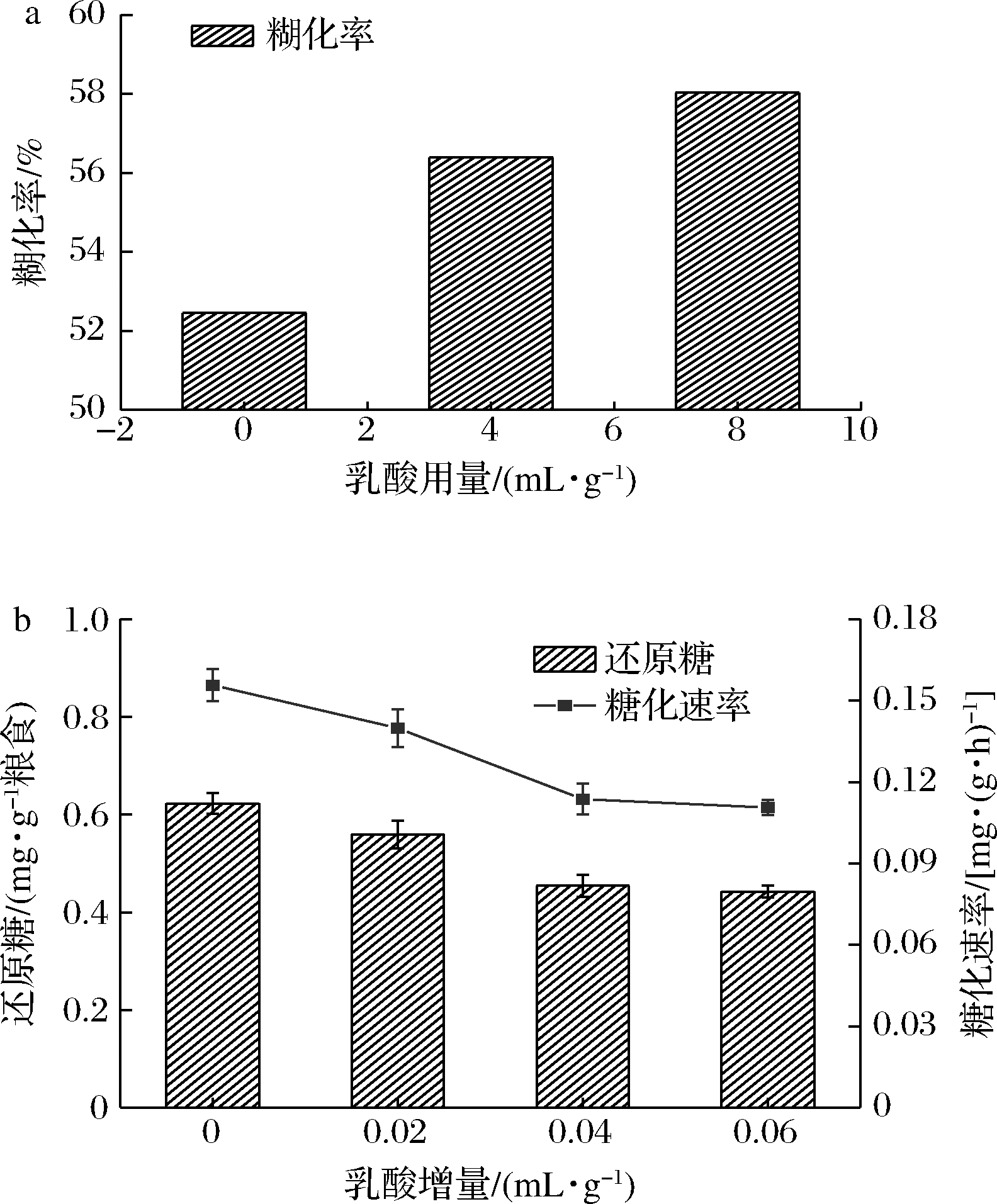
a-乳酸对糊化率的影响;b-乳酸对糖化速率的影响
图3 乳酸含量对糖化的影响
Fig.3 The effect of lactic acid content on saccharification
2.1.5 酒精对糖化速率的影响
由图4可以看出,糖化速率随着酒精含量上升而缓慢下降,当酒精含量达到一定含量,随着酒精含量上升,糖化速率变化趋于平缓,从整体趋势来看,酒精对糖化速率影响不大。原因可能是酒精不参与糖化反应,所以对糖化反应速率影响较小,但同时另一方面酒精的存在会对酶的构象产生影响,从而使酶变性失活。
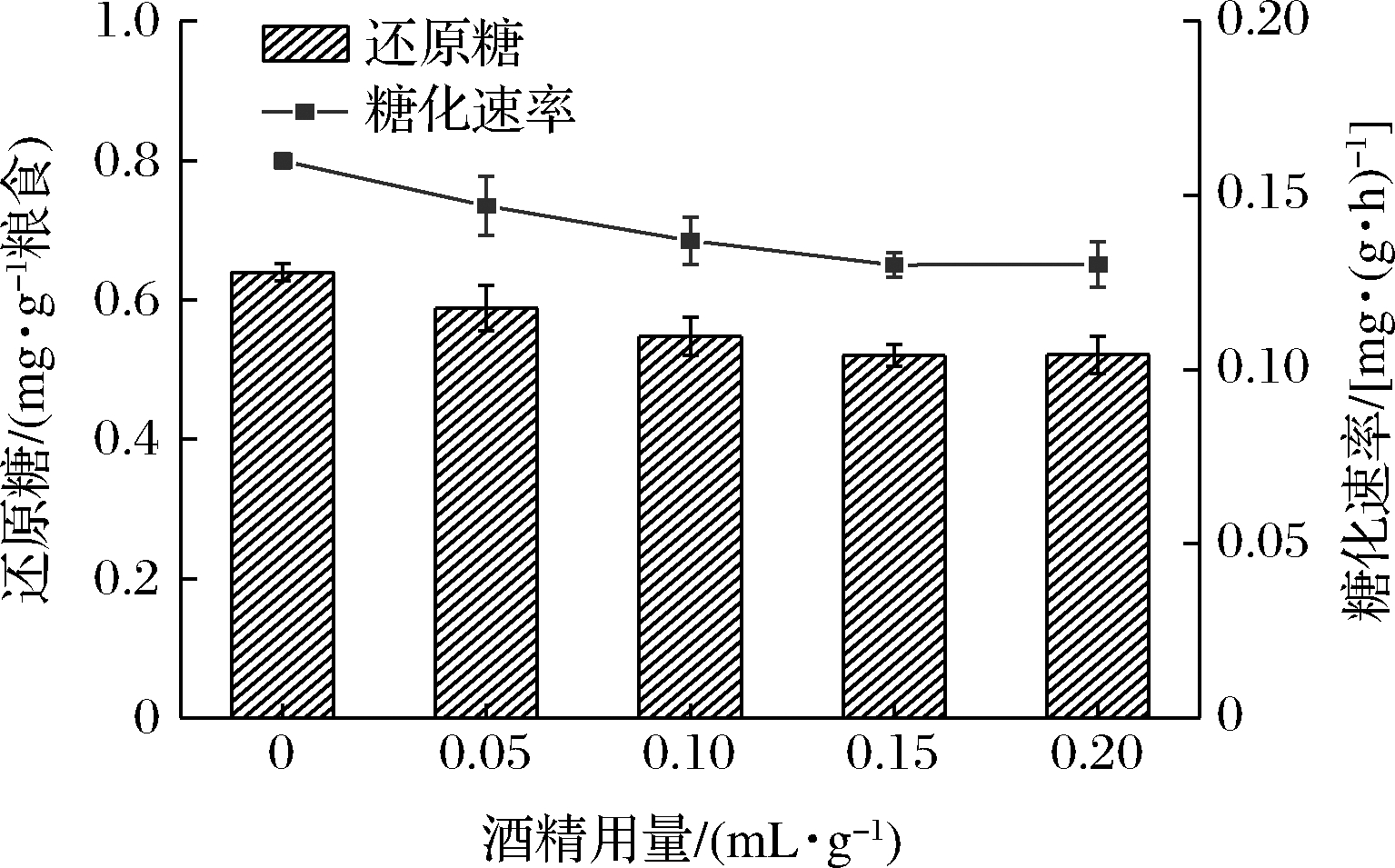
图4 酒精对糖化速率的影响
Fig.4 The effect of alcohol on saccharification rate
2.2 模拟糖化发酵实验
在糖化速率影响因素研究过程中,发现温度、酸等因素主要是通过影响酶活力,进而影响糖化速率。在此基础上,根据控制初始酶活力,结合酒精度测定,对粮食原料进行发酵实验,结果如图5所示。
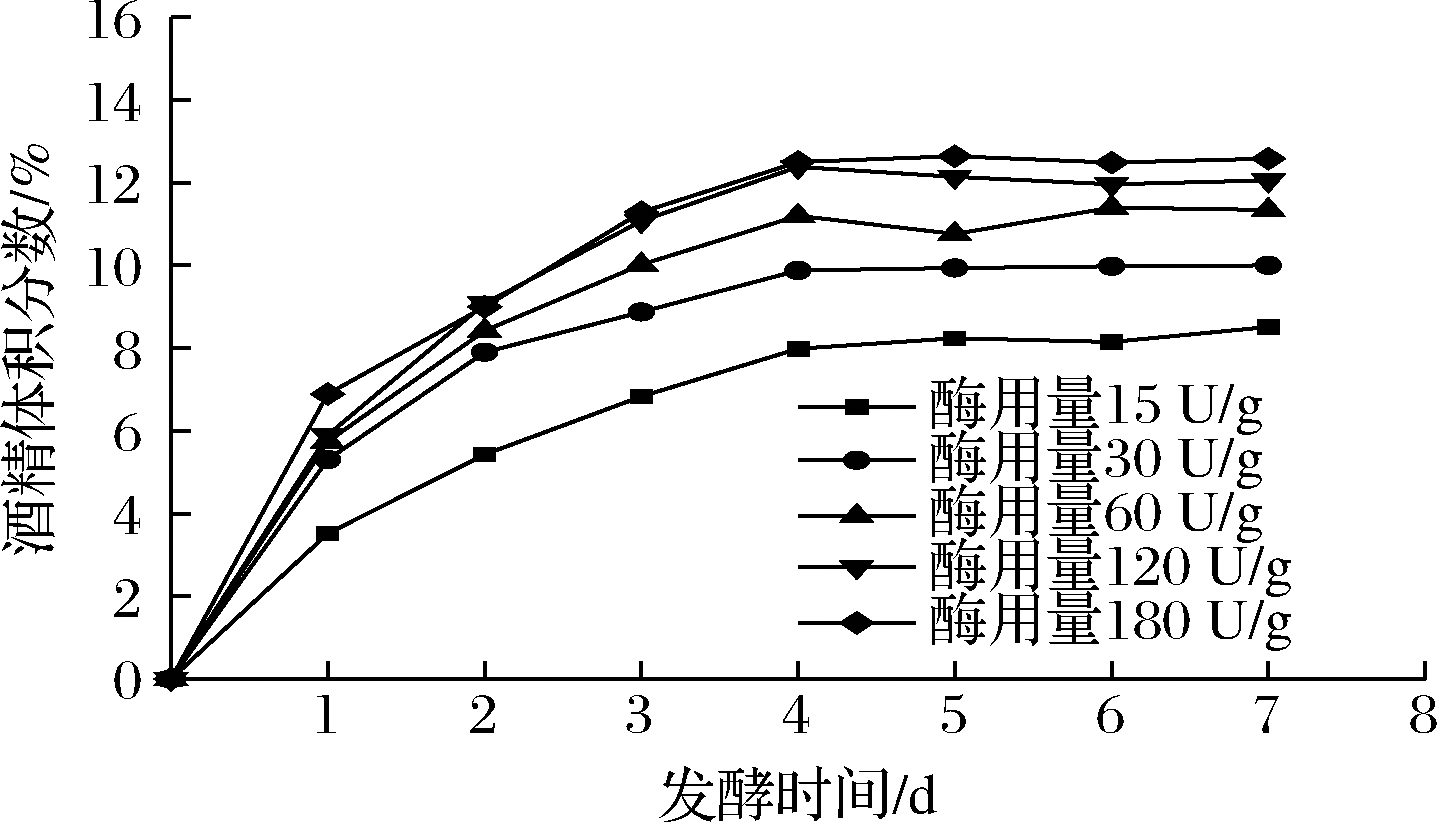
图5 初始酶活力对发酵产酒精的影响
Fig.5 Effect of initial enzyme activity on alcohol production during fermentation
由图5可以看出,发酵原料初始酶活力高于120 U/g,即发酵原料的初始酶活力相对较高情况下,最后酒精产量变化不大;当发酵原料初始酶活力低于120 U/g,即发酵原料的初始酶活力相对较低的情况下,初始酶活力与酒精的最终产量存在显著相关。分析原因可能是因为发酵前期底物充足,在发酵原料的初始酶活力较低阶段,这时的糖化速率主要取决于初始酶活力,进而造成后续的发酵产酒差异;到了后期,因为酵母大量死亡和发酵底物的减少,导致最终产酒存在差异。同时由图5中可以看出,在发酵前期,酒精快速生成,酒精逐渐积累,随着时间的延长,在发酵4 d之后,酒精含量不再显著增长,结合图6分析可知,这是因为在发酵过程中,酵母数量在4 d左右急剧减少所致,这与高大禹等[22]的白酒发酵酵母数量研究结果相符,还可能的原因是随着糊精等糖化酶底物逐渐减少造成了糖化发酵基本停滞。
由图6-a可以看出,随着发酵的进行,粮食原料的淀粉含量逐渐降低,与产酒精趋势基本相符。由图6-b可得还原糖含量呈现先减少,后增加的趋势,初始酶活力越高,该趋势越显著,结合图6-c和图6-d分析发现,这是因为在发酵过程中酵母数量逐渐降低,而酶活力基本不变,进而导致初始酶活力的情况还原糖会呈现先减少后增加的变化趋势。在实际生产中,可以通过控制大曲的产糖化酶菌株的比例、拌曲发酵时的用曲比例以及改变堆积时间来控制入窖前酒醅的初始糖化酶活力,进而达到控制白酒发酵的目的。
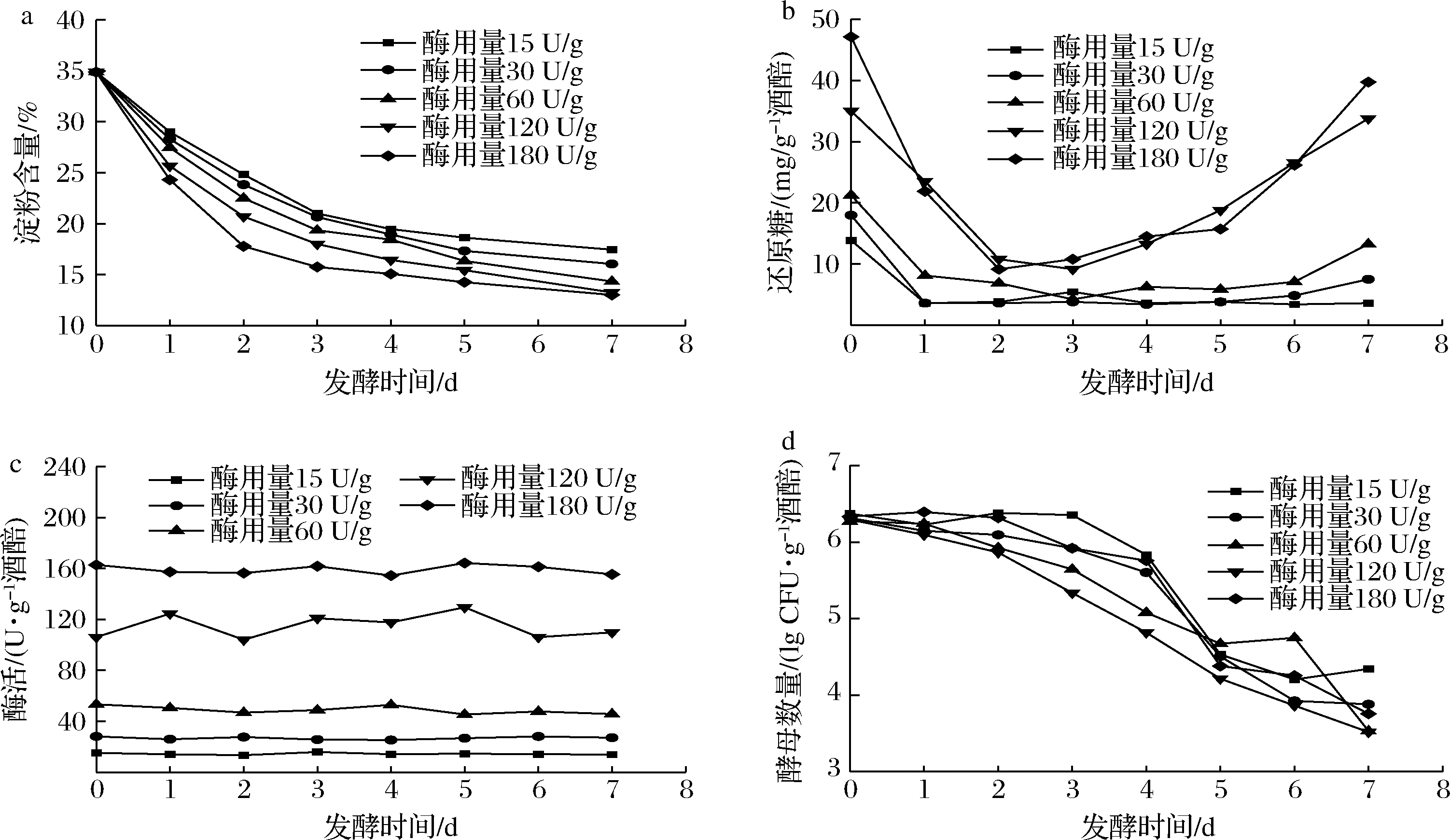
a-淀粉;b-还原糖;c-糖化酶活力;d-酵母数量
图6 酒醅发酵生化指标变化
Fig.6 Changes in biochemical indexes of fermented grains during fermentation
2.3 高粱的微观结构观察
由图7所示,在不同条件下高粱碎粒淀粉的微观结构显著不同。如图7-a所示,润粮前高粱淀粉颗粒立体结构比较完整,呈现椭圆粒状,表面比较光滑。如图7-b所示,经过一段时间润粮,淀粉颗粒吸水膨大,从图7-b-3与图7-a-3对比来看,图7-b-3所示的淀粉颗粒相对更大,立体结构呈圆球状,淀粉颗粒表面也相对光滑。在经历蒸煮过程中,膨大的淀粉颗粒因为物理作用糊化破开,原本结构被破坏,形成不规则的蜂窝状立体结构如图7-c-2所示,此时一些淀粉变成容易被糖化酶利用的糊精等物质。经过糖化酶的分解作用,容易被分解的物质被分解,形成如图7-d-2所示的网状结构,在图7-d-3可以看到上面由一些明显可见的椭球形颗粒,根据查阅资料发现酵母菌的常规大小为1~10 μm[23],根据结构和大小合理推测网状结构上的椭球形小颗粒为发酵前添加的酵母菌。

a-未处理高粱;b-润粮后高粱;c-蒸煮后高粱;d-发酵后高粱
图7 不同时刻高粱颗粒表面微观结构图
Fig.7 Surface microstructure of sorghum grains at different times
注:1,2,3分别对应放大倍数20X,600X,2 400X
3 结论与讨论
控制原料的蒸煮工艺可以间接控制白酒后续的糖化发酵。通过正交试验,在优化后的工艺参数下糊化率可达61%,在影响白酒原料蒸煮工艺的条件中,蒸煮时间对糊化率影响最大。实际生产中蒸煮工艺要结合感官评价,不能一味追求糊化率的提高而造成粮食原料蒸煮过后过于发黏。
此外通过对糖化速率的影响因素研究发现,温度、酸等因素主要是通过影响酶活力对糖化速率产生影响。本实验研究的糖化酶适宜温度为40~50 ℃,酸对糖化的影响有两方面,一方面适量的酸能够促进原料糊化,另一方面酸会导致糖化酶活力降低影响糖化速率。当发酵原料初始酶活力低于120 U/g,发酵原料的初始酶活力与酒精的最后产量存在显著相关。在实际生产中,可以通过控温发酵和选育耐酸性菌株来提高糖化速率和发酵出酒率,还可以通过控制大曲中的产糖化酶菌株的比例、拌曲发酵时的用曲比例以及改变酒醅堆积时间来控制入窖前酒醅的初始糖化酶活力,进而达到控制白酒双边发酵的目的。
[1] JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food ence & Technology,2017,63:18-28.
[2] 范文来, 徐岩,刁亚琴.浓香型大曲水解酶系及测定方法的研究[J].酿酒,2002,29(5):25-31.
FAN W L,XU Y,DIAO Y Q.Study on the Hydrolyzing Enzymes and its determination method from Daqu for Chinese strong flavour liquor making[J].Liquor Making,2002,29(5):25-31.
[3] 李竹赟, 王莉,骆雨龙.气相色谱法测定酒醅中的乙醇[J].酿酒科技,2004,3:85-86.
LI Z Y,WANG L,LUO Y L.Determination of ethanol content in fermented grains by gas chromatography[J].Liquor-Making Science & Technology,2004,3:85-86.
[4] YI Z,FANG Y,HE K,et al.Directly mining a fungal thermostable α-amylase from Chinese Nong-flavor liquor starter[J].Microbial Cell Factories,2018,17(1):30.
[5] 付勋, 刘兴平,敖宗华,等.浓香型白酒典型糟醅及其发酵影响因素研究进展[J].北京工商大学学报,2011,29(6):54-57.
FU X,LIU X P,AO Z H,et al.Research progress in typical fermented grains of Chinese strong aromatic spirits and its influencing factors[J].Journal of Beijing Technology and Business University,2011,29(6):54-57.
[6] 祝贺, 杨涛,杨玉蓉,等.正交试验优化酿酒高粱振荡蒸煮工艺[J].中国酿造,2019.
ZHU H,YANG T,YANG Y R,et al.Optimization of oscillating cooking process of brewing sorghum by orthogonal tests[J].China Brewing,2019.
[7] 刘晶晶.大曲酶系和代谢物组分析及其中产复合酶菌株的应用研究[D].北京:中国农业大学,2018.
LIU J J.Analysis of enzymes and metabolomics in Daqu,and application of compound enzyme-producing Bacillus from Daqu[D].Beijing:China Agricultural University,2018.
[8] 冯锋.传统食醋大曲固态发酵过程中微生物多样性及其主要优势微生物产酶的研究[D].广州:华南理工大学,2016.
FENG F.Research on microbiota dynamics in traditional solid-state fermentation process and enzyme production of the prominent strains in Chinese vinegar Daqu[D].Guangzhou:South China University of Technology,2016.
[9] ARORA S,RANI R,GHOSH S.Bioreactors in solid state fermentation technology:Design,applications and engineering aspects[J].Journal of Biotechnology,2018,269:16-34.
[10] 白玲, 霍群.基础生物化学实验[M].上海:复旦大学出版社,2008.
BAI L,HUO Q.Basic biochemistry experiments[M].Shanghai:Fudan University Press,2008.
[11] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
SHEN Y F.Liquor Production Technology Book[M].Beijing:China Light Industry Press,1998.
[12] 李环, 陆佳平,王登进.DNS法测定山楂片中还原糖含量的研究[J].食品工业科技,2013,34(18):75-77.
LI H,LU J P,WANG D J.Study on determination of reducing sugar from Haw Flakes with DNS colorimetry method[J].Science and Technology of Food Industry,2013,34(18):75-77.
[13] 陆寿鹏.白酒工艺学[M].北京:中国轻工业出版社,1994.
LU S P.Liquor Technology[M].Beijing:China Light Industry Press,1994
[14] 冯兴垚, 杨文斌,罗惠波,等.3种酿酒粮食蒸煮工艺的优化[J].食品科技,2017(11):187-194.
FENG X Y,YANG W B,LUO H B,et al.Optimization of three kinds of wine-making sorghum stewing process[J].Food Science and Technology,2017(11):187-194.
[15] 田晓红,谭斌,谭洪卓,等.20种高粱淀粉特性[J].食品科学,2010,31(15):13-20.
TIAN X H,TAN B,TAN H Z,et al.Properties of sorghum starches from twenty varieties in China[J].Food Science,2010,31(15):13-20.
[16] JACKOWIAK H,PACKA D,WIWART M,et al.Scanning electron microscopy of Fusarium damaged kernels of spring wheat[J].International Journal of Food Microbiology,2005,98(2):113-123.
[17] 杨琳, 马青原,刘洪海,等.尾巨桉木材冷冻干燥特性[J].森林与环境学报,2018,38(3):P.277-283.
YANG L,MA Q Y,LIU H H,et al.Freeze-drying properties of Eucalyptus urophylla×E.grandis wood[J].Journal of Forest and Environment,2018,38(3):P.277-283.
[18] 钟昔阳, 杨积东,汤玉清,等.α-淀粉酶酶解小麦面粉动力学模型研究[J].食品科学,2012,33(7):96-100.
ZHONG X Y,YANG J D,TANG Y Q,et al.Kinetic modeling of enzymatic hydrolysis of wheat flour with α-amylase[J].Food Science,2012,33(7):96-100.
[19] 郑宝东.食品酶学[M].南京:东南大学出版社,2006:88.
ZHENG B D.Food Enzymology[M].Nanjing:Southeast University Press,2006:88.
[20] 滕健.微波法抗性麦芽糊精的制备及其性质和应用的研究[D].无锡:江南大学,2009.
TENG J.Study on preparation,properties and application of microwave-resistant maltodextrin[D].Wuxi:Jiangnan University,2009.
[21] 蔡丽华, 马美湖.4种常用蛋白酶对牛骨蛋白的酶解动力学研究[J].食品科学,2010,31(5):150-154.
CAI L H,MA M H.Effects of temperature and pH on kinetic parameters of enzymatic hydrolysis of bovine bone protein[J].Food Science,2010,31(5):150-154.
[22] 高大禹, 李一关,崔凤娇,等.高蛋白水解率对芝麻香型白酒发酵过程及原酒品质的影响[J].食品与发酵工业,2019,45(6):8-15.
GAO D Y,LI Y G,CUI F J,et al.Effects of high proteolytic rate on sesame-flavor liquor fermentation process and liquor quality[J].Food and Fermentation Industries,2019,45(6):8-15.
[23] 诸葛健, 李华钟.微生物学[M].北京:科学出版社,2009.
ZHU G J,LI H Z.Microbiology[M].Beijing:Science Press,2009.