白酒中的酯类物质是提供香气的主要风味物质,约占白酒风味物质的75%~95%[1]。酯类含量过高时,酒体会产生臭味;酯类含量过低时则会使酒体品质降低,味道淡。只有适宜的酯含量才能协调白酒风味[2-5]。白酒中的酯类物质包括中链脂肪酸乙酯和乙酸酯,乙酸酯又包括乙酸乙酯、乙酸异戊酯等[6]。乙酸乙酯的香气类似苹果香、香蕉香,和己酸乙酯、乳酸乙酯以及丁酸乙酯并称为四大酯[7],是清香型和米香型白酒的主体香气,是清香型白酒中含量最高的酯类物质,在浓香型、酱香型和米香型等白酒中也起着不可替代的作用[8],乙酸乙酯也是唯一一种被国家白酒标准明确规定的风味物质[9]。乙酸异戊酯的香气类似苹果香[10],是决定白酒香气和品格的关键成分,由于乙酸异戊酯的香味阈值极低,仅为0.23 mg/L[11],因此乙酸异戊酯的含量过高会破坏白酒香气平衡,控制乙酸异戊酯含量对提升白酒的品质有重要意义。白酒发酵过程中,乙酸酯主要由酿酒酵母中的醇乙酰基转移酶以及其他酯合成酶生物催化合成的。由此可见,酿酒酵母是乙酸酯合成的关键影响因素,对白酒发酵中风味物质的合成有很大的影响。因此,选育具有优良产香性状的酿酒酵母菌株对白酒酿造行业具有重要的应用意义[12]。
研究表明,ATF1编码的醇乙酰基转移酶可以催化酿酒酵母中乙酸乙酯和乙酸异戊酯的生成[13]。VERSTREPEN等[14]发现啤酒酵母中ATF1的缺失导致乙酸乙酯和乙酸异戊酯的质量浓度分别降低了40%和16%,而过表达ATF1会使得乙酸乙酯和乙酸异戊酯的的质量浓度显著上调,分别提高了30.9倍和183倍。LILLY等[15]研究发现,葡萄酒酵母中ATF1基因过表达可提升乙酸乙酯的质量浓度3~10倍和乙酸异戊酯的质量浓度4~12倍。相反的,IAH1基因编码的乙酸异戊酯水解酶可以催化酿酒酵母中乙酸酯的水解。FUKUDA等[16]发现,IAH1过表达可以提升乙酸异戊酯水解活性2倍多。LILLY等[17]发现IAH1基因的过表达会导致乙酸乙酯、乙酸己酯和乙酸苯乙酯等酯类的质量浓度显著下降。综上所述,IAH1基因编码的乙酸异戊酯水解酶与醇乙酰基转移酶共同调控着乙酸乙酯和乙酸异戊酯的平衡[13,18]。
实验室前期在AY12的单倍体a45菌株基础上敲除了BAT2同时过表达了ATF1,构建了低产高级醇高产乙酸酯菌株a45-AWT[19],其以玉米浓醪为原料模拟白酒发酵产生的乙酸异戊酯的质量浓度过高,不符合高品质白酒的要求。因此,本文通过调节IAH1基因的表达量,改善风味物质比例,以获得高产乙酸乙酯、适量高产乙酸异戊酯、低产高级醇的酿酒酵母菌株,便于工业运用。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒、菌株及培养基
研究所用的菌株和质粒见表1。
表1 本实验研究所用的菌株和质粒
Table 1 Strains and plasmids used in this work
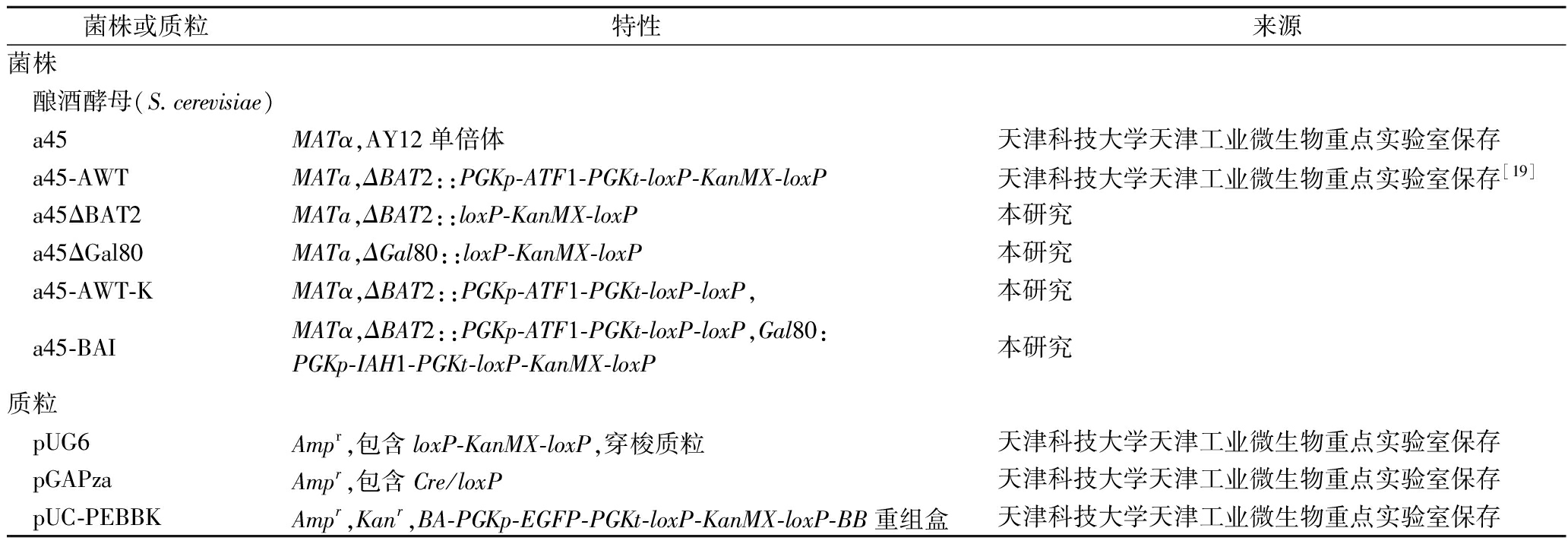
菌株或质粒特性来源菌株 酿酒酵母(S.cerevisi-ae) a45MATα,AY12单倍体天津科技大学天津工业微生物重点实验室保存 a45-AWTMATa,ΔBAT2::PGKp-ATF1-PGKt-loxP-KanMX-loxP天津科技大学天津工业微生物重点实验室保存[19] a45ΔBAT2MATa,ΔBAT2::loxP-KanMX-loxP本研究 a45ΔGal80MATa,ΔGal80::loxP-KanMX-loxP本研究 a45-AWT-KMATα,ΔBAT2::PGKp-ATF1-PGKt-loxP-loxP,本研究 a45-BAIMATα,ΔBAT2::PGKp-ATF1-PGKt-loxP-loxP,Gal80:PGKp-IAH1-PGKt-loxP-KanMX-loxP本研究质粒 pUG6Ampr,包含loxP-KanMX-loxP,穿梭质粒天津科技大学天津工业微生物重点实验室保存 pGAPzaAmpr,包含Cre/loxP天津科技大学天津工业微生物重点实验室保存 pUC-PEBBKAmpr,Kanr,BA-PGKp-EGFP-PGKt-loxP-KanMX-loxP-BB重组盒天津科技大学天津工业微生物重点实验室保存
YEPD培养基:葡萄糖2 g,蛋白胨2 g,酵母浸粉1 g,加水定容至100 mL,115 ℃灭菌20 min。G418抗性YEPD培养基配制时每100 mL加入30 mg G418,Zeocin抗性YEPD培养基配制时每100 mL培养基加入50 mg Zeocin。固体培养基需额外添加2%琼脂粉。
LB培养基:氯化钠1 g,蛋白胨1 g,酵母浸粉0.5 g,121 ℃灭菌 20 min。LB(Ampr)培养基每100 mL添加10 mg氨苄青霉素。固体培养基需额外添加2%琼脂粉。
营养盐:无水硫酸镁15 g,磷酸二氢钾7.5 g,尿素8.1 g,加蒸馏水定容至100 mL,4 ℃保存。
1.1.2 主要试剂
DL5 000 DNA Marker、rTaq DNA聚合酶、dNTP、Yeast RNAiso Kit酵母Total RNA提取试剂盒,宝生物中国大连公司;酵母浸粉(生化试剂),天津泰进科技有限公司;葡萄糖(分析纯)、氯化钠(分析纯),天津索罗门生物科技有限公司;胰蛋白胨,天津市英博生化试剂有限公司;琼脂糖、PEG3350,北京索莱宝公司;G418,BBI公司;甘油,鼎国昌盛公司;醋酸锂,天津市化学试剂一厂。
1.1.3 主要仪器
YXQ-LS-30SII高压蒸汽灭菌锅,山东新华医疗器械厂;全自动凝胶成像仪,美国SYNGENE公司;GL20A型高速冷冻离心机,中科院生物物理所技术服务公司;PCT-200型PCR基因扩增仪,美国BIO-RAD公司;DYY-4c型电泳仪,北京市六一仪器厂;7890A气相色谱仪,美国安捷伦科技公司;StepOnePlus荧光定量PCR仪,美国ABI公司;全自动生长曲线分析仪,芬兰BIOSCREEN公司。
1.2 实验方法
1.2.1 菌株的构建
1.2.1.1 引物的设计与合成
本研究中用到的引物如表2所示。根据NCBI网站上查阅的S.cerevisiae S288C的基因序列,利用Primer 5.0软件设计PCR反应引物。
表2 研究中的主要引物
Table 2 The main primers in this study

引物引物序列(5'→3')用于a45-BAI菌株构建GA-FGTGCTCGAAGATGCTTTCAGAGGA-RCAGTTTTGGATAGATCAGTTAGAGACGGGAGTGGAAAGAACGPGKp-FCGTTCTTTCCACTCCCGTCTCTAACTGATCTATCCAAAACTGPAKp-RATAACAGAAACTTCTCGTAATCCATGTTTTATATTTGTTGTAAAAAGTAGATIAH1-FATCTACTTTTTACAACAAATATAAAACATGGATTACGAGAAGTTTCTGTTATIAH1-RAGAAAAGAAAAAAATTGATCTATCGTCAAGACATTATGTTAGATCCATCATPGKt-KanMX-FTGATGGATCTAACATAATGTCTTGACGATAGATCAATTTTTTTCTTTTCTCTPGKt-KanMX-RCAAGCACAGGGCAAGATGCTTGCATAGGCCACTAGTGGATCTGGB-FCAGATCCACTAGTGGCCTATGCAAGCATCTTGCCCTGTGCTTGGB-RAAATATGACCCCCAATATGAGAAAT用于a45ΔGal80菌株构建G-KANA-FGTTTCCCGTTCTTTCCACTCCCGTCCAGCTGAAGCTTCGTACGG-KANA-RGGGCCAAGCACAGGGCAAGATGCTTGCAT-AGGCCACTAGTGGATCTGATATCACCTAATAACTTCGTATAGCGal80-GA-FCGCTCCTTTCCAAACATCTTCGAACGal80-GA-RGATTTTTCTCATCGATTTCATTCATGTTTTATATTTGTTGTAAAAAGTAGGal80-GB-FGCTATACGAAGTTATTAGGTGATATCAGATCCACTAGTGGCCTATGCAAGCATCTTGCCCTGTGCGal80-GB-RTCATTTTGCAAATGCACCGC用于a45ΔBAT2菌株构建BU-FCGCTATTATTTCCACCATTTTTTGCABU-RCCTGCAGCGTACGAAGCTTCAGCTGATCGTTCTTAAAACTCGTGGAGAB-KAN-FGCATCTCCACGAGTTTTAAGAACGATCAGCTGAAGCTTCGTACGCB-KAN-RTACTTTACGTAGCAATAGCGATACTGCATAGGCCACTAGTGGATBD-FATCAGATCCACTAGTGGCCTATGCAGTATCGCTATTGCTACGTAAAGTABD-RCTGTTTGAAGATCGGTCGGTT用于a45-AWT菌株剔除KanMX抗性基因验证KanMX-FCAGCTGAAGCTTCGTACGCTGCAGGKanMX-RGCATAGGCCACTAGTGGATCTGATATCAZecio-FCCCACACACCATAGCTTCAZecio-RAGCTTGCAAATTAAAGCCTT用于a45-BAI菌株构建验证YZ-IAH1-1-FATAAAAGCAGCCAACCCCYZ-IAH1-1-RCTCTCTGCCCCTCTGTGGYZ-IAH1-2-FTCGTCACACAACAAGGTCYZ-IAH1-2-RCGTCAAGACTGTCAAGGAGGYZ-IAH1-3-FCCTTCATTACAGAAACGGCYZ-IAH1-3-RGGGAATGTTTTTATGATGGGA用于ΔGal80菌株构建验证Gal80-1-FATACCTGCACAAGCAATTTGGal80-1-RAGCCGTAATTTTTGCTTCGGal80-2-FCTTCATTACAGAAACGGCTTGal80-2-RAATGCCCACAGACTAAGTTC用于ΔBAT2菌株构建验证BAT2-1-FACATCTCATCTACTTCAAGAGACTBAT2-1-RGATCTCTAGACCTAATAACTTCGTBAT2-2-FCTTCGTATAATGTATGCTATACGAABAT2-2-RTAGGCCTAAAGCCATCTGATAG用于荧光定量PCRqATF1-FGCCGCTCACAACTACCAGATqATF1-RACAATGTACCTCCGCGTCTTqUBC6-FGGACCTGCGGATACTCCTTACqUBC6-RTAATCGTGTGTTGGGCTTGAqIAH1-FCAAAGAGGGTTCAAAGGGTACACqIAH1-RCATCAAAGATACCATTTGACGAATATTATC
1.2.1.2 突变株的构建
a45-AWT菌株剔除抗性基因KanMX。在a45-AWT菌株基础上进行过表达IAH1基因需要KanMX基因再次作为筛选标记,需要将a45-AWT菌株KanMX基因删除。利用醋酸锂转化法[20]将含有Cre重组酶的质粒pGAPza导入菌株a45-AWT,涂布于含有Zeocin抗性的YEPD平板上,在30 ℃下避光培养2 d;挑取转化子于半乳糖培养基中,在30 ℃ 180 r/min条件下培养6 h,稀释10-4后涂布于YEPD平板,在30 ℃培养箱中培养2 d;挑取转化子,点接于YEPD平板和含有G418抗性的YEPD平板,在30 ℃培养箱中培养2 d;挑取在YEPD平板中正常生长且在含有G418抗性的YEPD平板不生长的菌落,提取转化子基因组,作为模板,PCR扩增验证pGAPZa质粒导入成功且KanMX被剔除。将验证正确的转化子传代培养,10代后进行纯化,验证转化子pGAPZa质粒丢失,且KanMX被剔除。
a45-BAI菌株构建,以亲本菌株AY12的单倍体a45的基因组为模板,GA-F/GA-R、GB-F/GB-R和IAH1-F/IAH1-R为引物,PCR扩增得到上同源臂GA、下同源臂GB以及IAH1片段;以质粒pUC-PABBK为模版,PGKp-F/PGKp-R和PGKt-KanMX-F/PGKt-KanMX-R为引物,PCR扩增得到PGKp和PGKt-KanMX片段,并将片段用PCR纯化回收试剂盒进行纯化回收,测序验证。用醋酸锂转化法将纯化回收后的片段导入菌株a45-AWT-K,通过含有G418抗性的YEPD平板筛选转化子,用酵母基因组DNA提取试剂盒提取转化子的基因组进行PCR验证。
a45ΔGal80菌株构建,为了证明Gal80位点对菌株a45的生长性能和发酵性能无影响,构建a45ΔGal80菌株。以AY12的单倍体a45基因组为模板,Gal80-GA-F/Gal80-GA-R和Gal80-GB-F/Gal80-GB-R为引物,扩增片段上同源臂GA和下同源臂GB,以质粒PUG6为模板,G-KANA-F/G-KANA-R为引物,扩增片段loxp-KanMX-loxp。将片段用PCR纯化回收试剂盒进行纯化,测序验证。用醋酸锂转化法将纯化回收后的片段导入菌株a45,通过含有G418抗性的YEPD平板筛选转化子,用酵母基因组DNA提取试剂盒提取转化子的基因组进行 PCR验证。
a45ΔBAT2菌株构建。为了明确BAT2和ATF1对乙酸酯和高级醇的不同作用,构建a45ΔBAT2菌株。采用与构建a45ΔGal80菌株同样的方法构建a45ΔBAT2。
1.2.2 玉米浓醪模拟白酒发酵实验
1.2.2.1 一级二级种子液制备
(1)玉米水解液的制备
称取玉米醪1 kg,向其中3 L加入60~70 ℃的自来水,静置20 min,进行玉米醪的糊化,使玉米醪充分膨胀,然后加入600 μL的液化酶(α-淀粉酶2×104 U/mL),85~90 ℃液化1.5 h,20 min搅拌1次,液化结束后,迅速冷却降温至60 ℃,加入2 mL糖化酶(10×104 U/mL)糖化20 h,每隔一段时间进行搅拌。待糖化结束后,将糖化液用3层滤布过滤,得到渗出液即为玉米水解液,在105 ℃下高压灭菌20 min,室温保存使用。
(2)种子培养基的制备
一级种子培养基:8°Bix玉米水解液,0.5%的酵母浸粉。
二级种子培养基:12°Bix玉米水解液,0.5%的酵母浸粉。
1.2.2.2 玉米浓醪发酵培养基[21-23]制备
(1)称取60 g玉米醪置于250 mL三角瓶,加入135 mL 60~70 ℃热水并搅拌均匀,放置20 min。
(2)向其中加入30 μL的液化酶(α-淀粉酶 2×104 U/mL)并搅拌均匀,90 ℃水浴90 min,液化。
(3)迅速冷却至60 ℃,加入90 μL糖化酶(10×104 U/mL)并搅拌均匀,60 ℃水浴20 min,糖化。
(4)迅速冷却至40 ℃,加入1.2 mL酸性蛋白酶(2×104 U/mL)并搅拌均匀,40 ℃水浴20 min。
(5)迅速冷却至30 ℃,加入1 mL营养盐溶液。
挑取一环斜面菌株接入装有5 mL一级种子培养基的试管中,30 ℃静置培养24 h;将上述菌液转移至装有54 mL二级种子培养基的150 mL三角瓶中,30 ℃静置培养16 h至对数期后期;以10%接种量接入至玉米浓醪发酵培养基中,30 ℃静置发酵,每隔12 h称重;发酵至每12 h失重小于1 g,结束后测定发酵时间、CO2累积排放质量、酒精度(体积分数)、剩余还原糖质量浓度和蒸馏后的酒样高级醇及乙酸酯质量浓度。
1.2.2.3 CO2排放质量的测定
酵母在发酵过程中逐渐将葡萄糖转化成乙醇和CO2,CO2排放质量的变化间接表示了发酵反应的速度和进程,玉米浓醪三角瓶的重量变化等于CO2排放质量[24]。
1.2.2.4 酒精度(体积分数)的测定
将100 mL水和100 mL发酵液加入至1 L锥形瓶,摇晃均匀后放置于电炉上,将瓶口与冷凝管连接,开启冷凝水,蒸馏发酵液。收集馏出液100 mL,测定温度和酒精度,利用酒精校正表校正得到该酒样在20 ℃时的酒精度(体积分数)[24]。
1.2.2.5 剩余还原糖质量浓度的测定
发酵液中剩余还原糖的质量浓度采用斐林试剂法[25]检测。
1.2.2.6 高级醇及乙酸酯质量浓度的测定
本实验采用气相色谱仪对酒样中的高级醇及乙酸酯质量浓度进行测定[26]。
色谱条件:检测器,FID;色谱柱,Agilent 1909 N-213(30 m×320 μm,0.5 μm);载气,氮气;载气流速2 mL/min;进样口温度200 ℃;检测器温度200 ℃;进样量1 μL;柱温50 ℃维持8 min,5 ℃/min升至120 ℃,维持5 min。
1.2.3 mRNA水平测定
采用实时荧光定量PCR(real-time PCR)法[27],以UBC6基因为内参基因,检测基因ATF1和IAH1的表达水平变化。
1.2.4 生长曲线的测定
为了检测酿酒酵母的生长情况,采用全自动生长曲线测定仪30 ℃下测量OD600值[28]。
2 结果与讨论
2.1 菌株的构建
2.1.1 a45-AWT菌株剔除KanMX基因
在a45-AWT菌株基础上进行基因编辑需要KanMX基因再次作为筛选标记,需要剔除KanMX基因,将该突变株命名为a45-AWT-K(图1-a)。利用验证引物KanMX-F/KanMX-R验证,其片段长度为1 613 bp。为保证重组菌株的遗传稳定性,通过传代丢失pGAPZa质粒,利用验证引物Zecio-F/Zecio-R验证,其片段长度为1 200 bp,电泳结果说明第10代突变株pGAPZa质粒成功丢失(图1-b)。
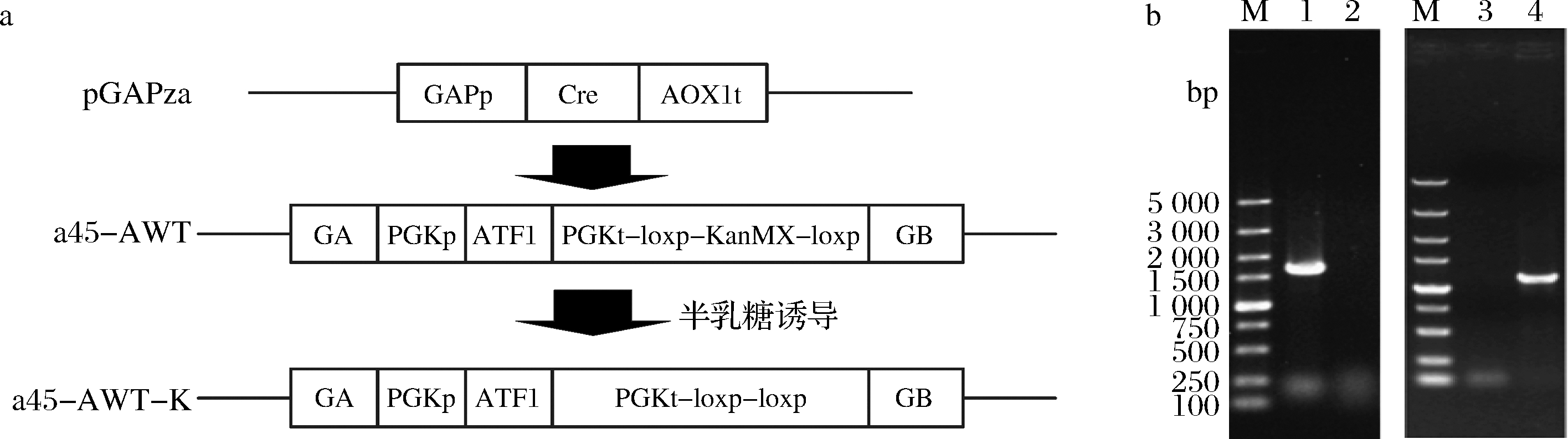
a-菌株a45-AWT剔除KanMX的过程;b-菌株a45-AWT剔除KanMX的PCR验证结果M-DL5 000 DNA marker;泳道 1-以KanMX-F/KanMX-R为引物,a45-AWT的基因组为模板PCR扩增的结果(1 613 bp);泳道2-以KanMX-F/KanMX-R为引物,a45-AWT-K的基因组为模板PCR扩增的结果;泳道3-以Zecio-F/Zecio-R为引物,a45-AWT-K的第10代基因组为模板PCR扩增的结果(1 200 bp);泳道 4-以Zecio-F/Zecio-R为引物,a45-AWT-K的第乙代的基因组为模板,PCR扩增的结果
图1 菌株a45-AWT的KanMX基因的剔除验证
Fig.1 The KanMX gene deletion of recombinant strain a45-AWT
2.1.2 a45-BAI菌株构建和验证
用醋酸锂转化法将构建a45-BAI菌株所需的片段纯化回收后的片段导入菌株a45-AWT-K(图2-a)。提取阴性对照AY12的单倍体a45基因组及G418抗性平板上长出来的转化子的基因组,利用验证引物YZ-IAH1-1-F/YZ-IAH1-1-R、YZ-IAH1-2-F/YZ-IAH1-2-R和YZ-IAH1-3-F/YZ-IAH1-3-R对构建的转化子进行定点验证,其片段长度分别为2 145、1 564和2 129 bp,且阴性对照无条带,验证条带与预期一致(图2-b)。
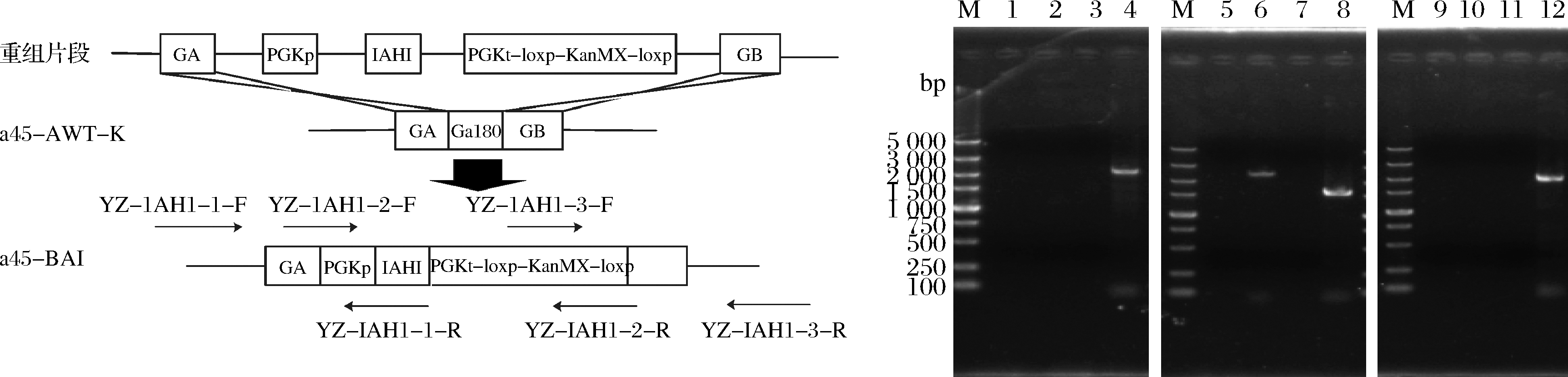
a-菌株 a45-BAI的构建过程;b-菌株 a45-BAI的PCR验证结果M-DL5000 DNA marker;泳道1-以YZ-IAH1-1-F/YZ-IAH1-1-R为引物,a45的基因组为模板扩增得到的产物;泳道 2-以YZ-IAH1-1-F/YZ-IAH1-1-R为引物,a45-AWT的基因组为模板扩增得到的产物;泳道3-以YZ-IAH1-1-F/YZ-IAH1-1-R为引物,a45-AWT-K的基因组为模板扩增得到的产物;泳道4-以YZ-IAH1-1-F/YZ-IAH1-1-R为引物,a45-BAI的基因组为模板扩增得到的产物(2 145 bp);泳道5-以YZ-IAH1-2-F/YZ-IAH1-2-R为引物,a45的基因组为模板扩增得到的产物;泳道 6-以YZ-IAH1-2-F/YZ-IAH1-2-R为引物,a45-AWT的基因组为模板扩增得到的产物(2 425 bp);泳道7-以YZ-IAH1-2-F/YZ-IAH1-2-R为引物,a45-AWT-K的基因组为模板扩增得到的产物;泳道8-以YZ-IAH1-2-F/YZ-IAH1-2-R为引物,a45-BAI的基因组为模板扩增得到的产物(1 564 bp);泳道9-以YZ-IAH1-3-F/YZ-IAH1-3-R为引物,a45的基因组为模板扩增得到的产物;泳道10-以YZ-IAH1-3-F/YZ-IAH1-3-R为引物,a45-AWT的基因组为模板扩增得到的产物;泳道11-以YZ-IAH1-3-F/YZ-IAH1-3-R为引物,a45-AWT-K的基因组为模板扩增得到的产物;泳道12-以YZ-IAH1-3-F/YZ-IAH1-3-R为引物,a45-BAI的基因组为模板扩增得到的产物(2 129 bp)
图2 菌株a45-BAI的构建
Fig.2 Construction process of strain a45-BAI
2.1.3 a45ΔGal80菌株和a45ΔBAT2菌株的构建及验证
用醋酸锂转化法将构建a45ΔGal80菌株所需的片段导入菌株a45(图3-a)。提取阴性对照AY12的单倍体a45基因组及G418平板上的转化子基因组,利用验证引物GA-K-F/GA-K-R和GK-B-F/GK-B-R对构建的转化子进行定点验证,其片段长度分别为1 260和1 309 bp,且阴性对照无条带,验证条带与预期一致(图3-b)。用同样的方法构建a45ΔBAT2菌株并验证。
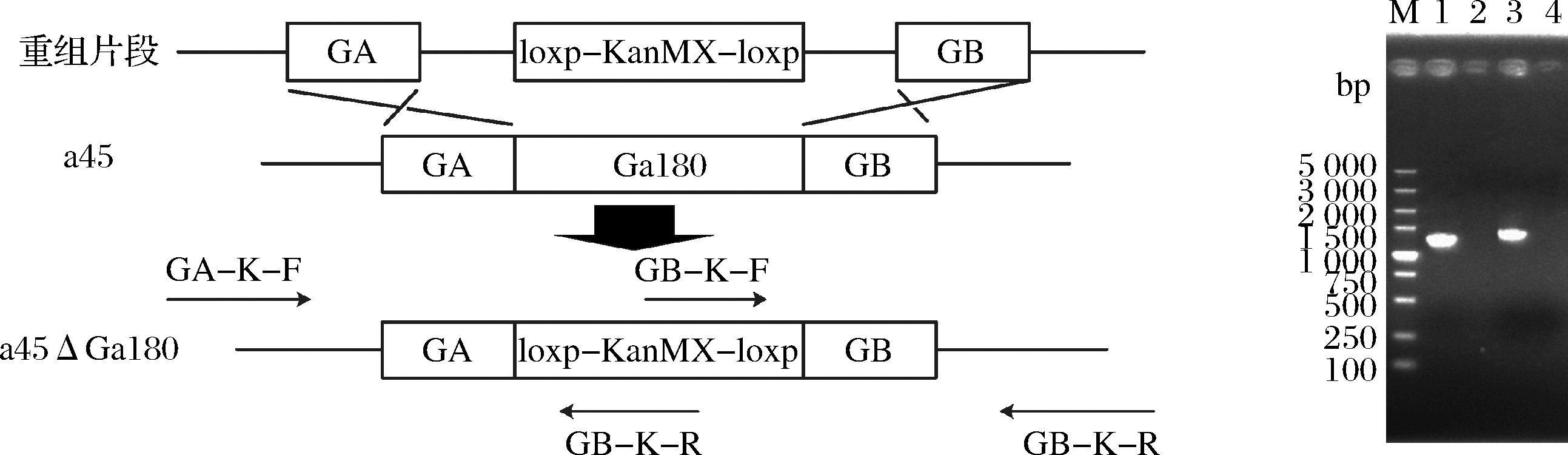
a-菌株a45ΔGal80的构建过程;b-菌株a45ΔGal80的PCR验证结果M-DL5000 DNA marker;泳道1-以 GA-K-F/GA-K-R 为引物,a45ΔGal80的基因组为模板扩增到的产物(1260 bp);泳道2-以GA-K-F/GA-K-R为引物,a45的基因组为模板扩增得到的产物;泳道3-以GK-B-F/GK-B-R为引物,a45ΔGal80的基因组为模板扩增得到的产物(1 309 bp);泳道4-以GK-B-F/GK-B-R为引物,a45的基因组为模板扩增得到的产物
图3 菌株a45ΔGal80的构建
Fig.3 Construction process of strain a45ΔGal80
2.2 突变株与亲本菌株的发酵实验
2.2.1 模拟白酒发酵的基本发酵性能
模拟白酒发酵条件检测重组菌株的发酵性能以及风味物质,分别对发酵液中的CO2排放质量、剩余还原糖的质量浓度和酒精度(体积分数)进行测定。如表3所示,a45ΔBAT2、a45-AWT和a45-BAI菌株发酵产生的CO2排放的质量、剩余还原糖的质量浓度和酒精度(体积分数)与a45没有显著性差异。
表3 突变菌株和亲本菌株的基本发酵性能
Table 3 Basic fermentation performances of mutants and parental strain
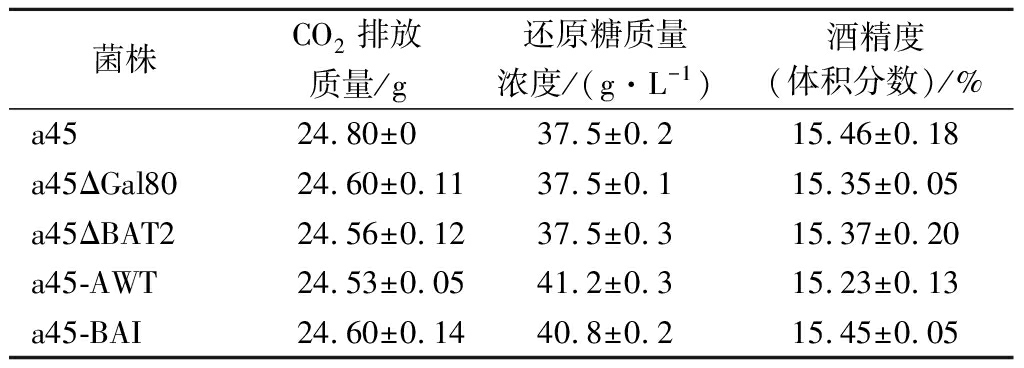
菌株CO2排放质量/g还原糖质量浓度/(g·L-1)酒精度(体积分数)/%a4524.80±037.5±0.215.46±0.18a45ΔGal8024.60±0.1137.5±0.115.35±0.05a45ΔBAT224.56±0.1237.5±0.315.37±0.20a45-AWT24.53±0.0541.2±0.315.23±0.13a45-BAI24.60±0.1440.8±0.215.45±0.05
2.2.2 模拟白酒发酵生成的主要风味物质
用GC检测蒸馏的酒样中主要乙酸酯和高级醇的质量浓度。如图4所示,突变株a45-AWT发酵生成的乙酸乙酯和乙酸异戊酯的质量浓度分别为835.27和63.68 mg/L,比a45分别高29.14和10.26倍,正丙醇、异丁醇和异戊醇的质量浓度分别为57.59、17.23和154.43 mg/L,分别比a45降低了17.2%、31.1%和54.5%。突变株a45-BAI的乙酸乙酯和乙酸异戊酯的质量浓度分别为267.88和10.73 mg/L,分别比a45高867%和89.4%,分别比a45-AWT降低67.9%和83.2%。正丙醇、异丁醇、异戊醇的质量浓度分别为69.58、24.99和339.59 mg/L,分别较原始菌株a45降低了22.8%、49.4%和12.5%,分别比a45-AWT升高了20.8%、45.0%和120%。突变株a45-BAI的高级醇的质量浓度为501.18 mg/L,较原始菌株a45降低了14.8%,比a45-AWT升高了70.5%。
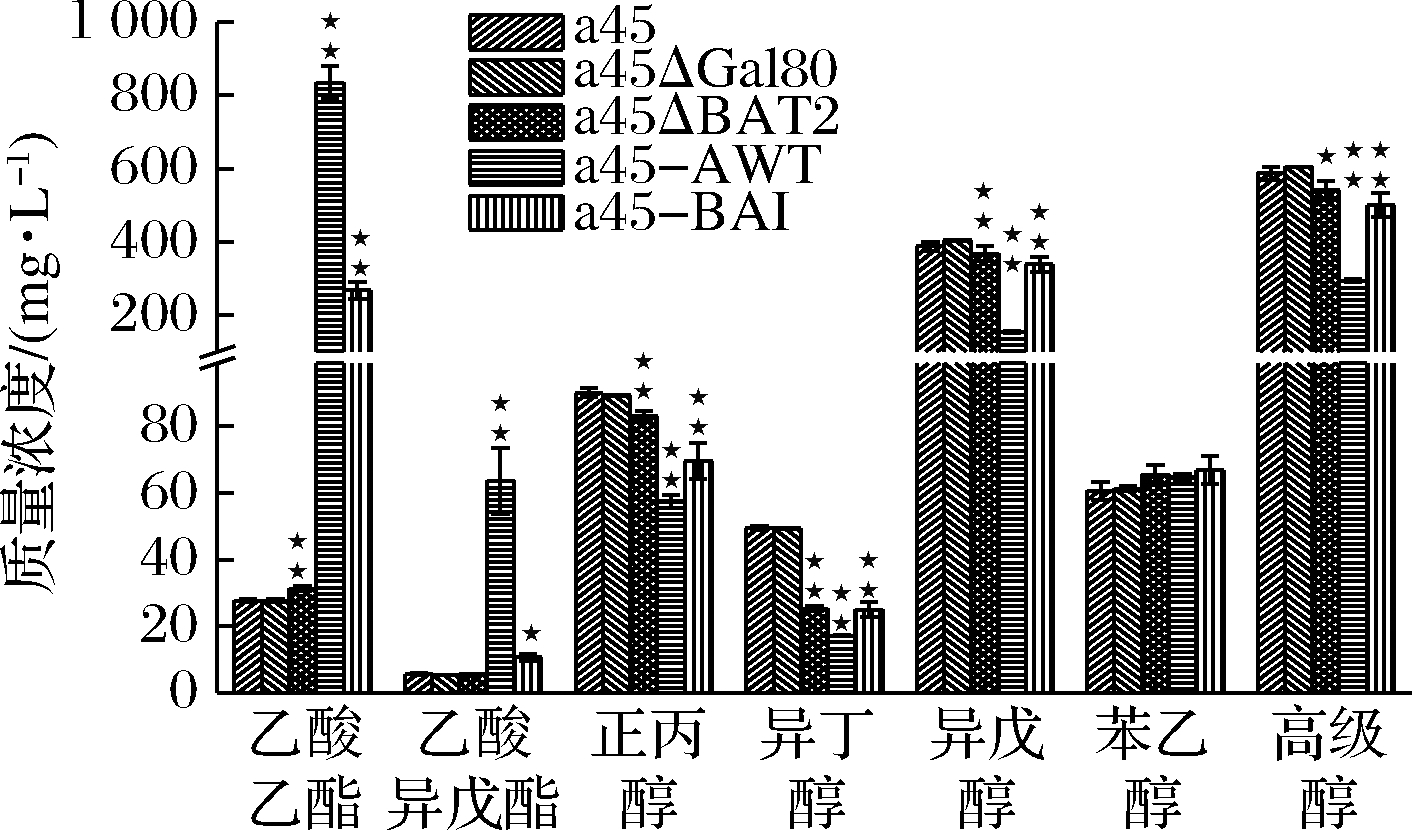
图4 突变菌株和亲本菌株的乙酸酯和高级醇生成量
Fig.4 Concentrations of ethyl acetate and higher alcohols produced by mutants and the parental strain
注:★★ P<0.01,★ P<0.05,n=3
出发菌株a45发酵产生的乙酸乙酯和乙酸异戊酯的质量浓度比是4.9,敲除BAT2时乙酸乙酯和乙酸异戊酯之间的质量浓度比为5.63,提高了14.8%。菌株a45-AWT的乙酸乙酯和乙酸异戊酯之间的质量浓度比为13.36,比a45提高了1.37倍。菌株a45-BAI的乙酸乙酯和乙酸异戊酯的质量浓度比为25.02,比出发菌株高4.1倍,比a45-AWT提高了87.3%。
出发菌株a45发酵产生的高级醇与乙酸酯之间的质量浓度比为17.64,敲除BAT2时高级醇与乙酸酯之间的质量浓度比为14.68,升高了78.7%。菌株a45-AWT的高级醇与乙酸酯之间的质量浓度比为1.80,比a45降低了97.8%。菌株a45-BAI的高级醇与乙酸酯之间的质量浓度比为32.80,比a45降低了89.8%,比a45-AWT提高了4.48倍。
表4 突变菌株和亲本菌株的发酵结果
Table 4 Fermentation performances of mutants and parental strain
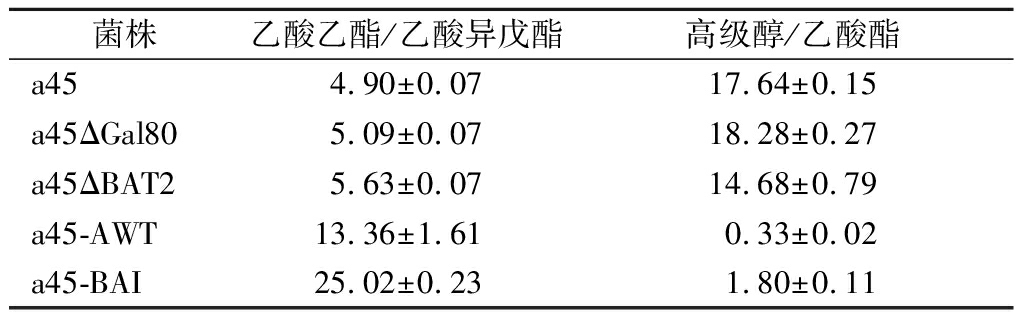
菌株乙酸乙酯/乙酸异戊酯高级醇/乙酸酯a454.90±0.0717.64±0.15a45ΔGal805.09±0.0718.28±0.27a45ΔBAT25.63±0.0714.68±0.79a45-AWT13.36±1.610.33±0.02a45-BAI25.02±0.231.80±0.11
2.3 ATF1及IAH1基因相对表达量的检测
检测了重组菌株a45-AWT和a45-BAI中ATF1基因及IAH1基因的转录水平。如图5所示,在敲除BAT2且过表达ATF1时,ATF1的相对表达水平提高了43.66倍,IAH1的相对表达水平无显著性差异。在敲除BAT2并且过表达ATF1和IAH1时,IAH1的相对表达水平提高了45.5倍,ATF1的相对表达水平提高了34.84倍,表明IAH1和ATF1基因的过表达提高了其转录水平,乙酸乙酯和乙酸异戊酯的适量增长是ATF1和IAH1的共同调控作用。
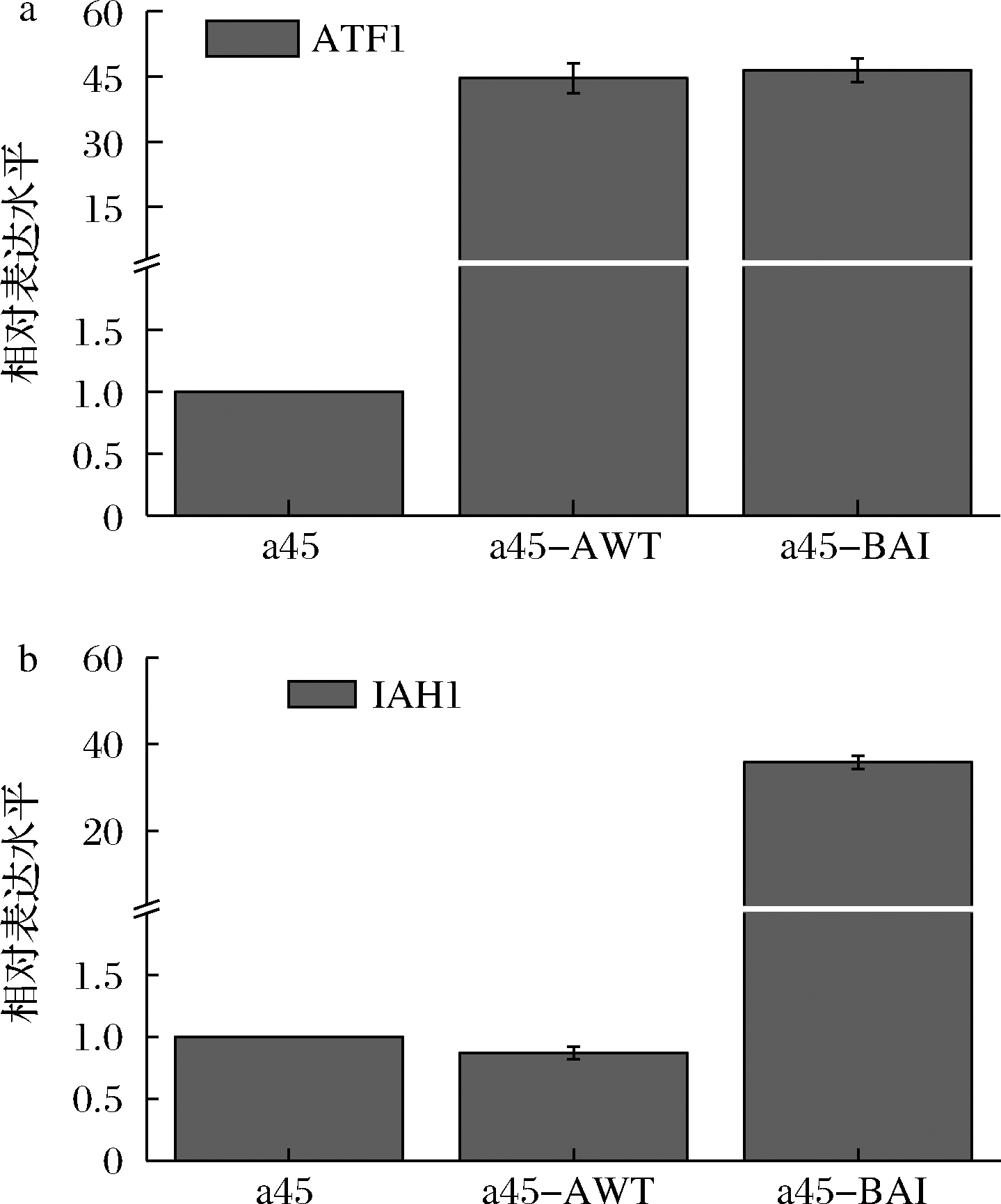
a-重组菌株的ATF1相对表达量;b-重组菌株的IAH1相对表达量
图5 菌株的ATF1、IAH1相对表达量
Fig.5 Relative expression levels of ATF1 and IAH1 genes in strains
2.4 突变株与亲本菌株生长性能的比较
为了检测其生长性能,考察了亲本菌株和突变菌株在30 ℃培养条件下的生长情况。如图6所示,与原始菌株a45相比,突变株和出发菌整体生长趋势基本一致,稳定期菌体密度相似,表明重组菌株的生长性能没有显著影响。

图6 菌株的生长曲线
Fig.6 Growth curve of strains
3 结论
乙酸乙酯和乙酸异戊酯是白酒中调节风味的关键微量成分,适量提高白酒中乙酸乙酯和乙酸异戊酯含量可以协调白酒的味道。IAH1最初被发现时,其编码的酶被证明具有水解乙酸异戊酯的功能,随着研究深入,学者发现其对别的乙酸酯也有着水解作用,敲除IAH1基因显著升高了乙酸乙酯、乙酸异戊酯和乙酸异丁酯的产量[29],本实验前期的研究也表明敲除IAH1基因显著上调了乙酸乙酯和乙酸异戊酯的产量[30],这与我们的研究相一致。从结果来看,其对乙酸异戊酯作用的倾向大于乙酸乙酯,过表达IAH1基因乙酸乙酯的质量分数显著降低了67.9%,乙酸异戊酯的质量分数显著降低了83.2%,这印证了学者对其酶学性质的研究,底物酶对乙酸异戊酯的活性高于乙酸乙酯[31]。学者已经对IAH1编码的酶进行结晶解析,后续对其理性设计,有望实现对某些酯的特异性改造,在白酒发酵中会有更强的应用[10]。
本实验室前期以工业酿酒酵母菌株AY12的单倍体a45为出发菌株,敲除BAT2同时过表达ATF1,构建了1株低产高级醇高产乙酸酯菌株a45-AWT,但其乙酸异戊酯含量过高,因此本研究以a45-AWT为亲本菌株,在Gal80位点上过表达IAH1基因,成功构建了a45-BAI菌株。a45-BAI菌株的乙酸异戊酯的质量分数比a45-AWT降低了83.2%,虽然乙酸乙酯的质量分数也降低了67.9%,但仍然比野生菌株a45提高了8.67倍,高级醇的质量分数比野生菌株a45降低了14.8%。a45-BAI菌株与野生型菌株的生长性能没有显著差别,且具有高产乙酸乙酯、适量产乙酸异戊酯、低产高级醇的特点,可显著改善白酒产品的风味和品质。
[1] 范光森, 吴秋华,刘朋肖,等.脂肪酶在白酒酯类化合物合成中的作用研究进展[J].中国食品学报,2021,21(1):351-360.
FAN G S,WU Q H,LIU P X,et al.Research progress on the role of lipase in the synthesis of esters in Baijiu[J].Journal of Chinese Institute of Food Science and Technology,2020(12):1-8.
[2] ZHU M X,FAN W L,XU Y,et al.1,1-Diethoxymethane and methanethiol as age markers in Chinese roasted-sesame-like aroma and flavour type liquor[J].European Food Research & Technology,2016,242(11):1 985-1 992.
[3] ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J].Letters in Applied Microbiology,2013,57(1):11-18.
[4] JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science & Technology,2017,63:18-28.
[5] 孙丽萍, 樊金梁,王德良.啤酒生产过程中酯类的形成以及影响因素[J].酿酒,2002,29(4):58-59.
SUN L P,FAN J L,WANG D L.The formation and influencing factors of esters in beer production[J].Liquor Making,2002,29(4):58-59.
[6] 张翠英, 崔丹瑶,李维,等.高产乙酸酯酿酒酵母菌种的选育与提高白酒酯香物质含量的研究[J].酿酒科技,2018(7):92-97.
ZHANG C Y,CUI D Y,LI W,et al.Breeding of S.cerevisiae strains with high-yield of acetate[J].Liquor-Making Science & Technology,2018(7):92-97.
[7] 肖冬光, 赵树欣,陈叶福.白酒生产技术[M].北京:化学工业出版社,2011.
XIAO D G,ZHAO S X,CHEN Y F,et al.Baijiu production technology[M].Beijing:Chemical Industry Press,2011.
[8] MA Y H,QIAO H,WANG W,et al.Variations in physicochemical properties of Chinese Fenjiu during storage and high-gravity technology of liquor aging[J].International Journal of Food Properties,2014,17(4):923-936.
[9] 王旭亮, 王异静,王德良,等.清香型白酒优质产酯酵母菌筛选[J].酿酒,2012,39(4):28-33.
WANG X L,WANG Y J,WANG D L,et al.Ccreening of high ethyl acetate producing yeasts for Fen-flavor Chinese spirits fermentation[J].Liquor Making,2012,39(4):28-33.
[10] 马金鸣.酵母乙酸异戊酯水解酶和V型ATP酶F亚基的结构生物学研究[D].合肥:中国科学技术大学,2010.
MA J M.The structural biology research of IAH1 and VMA7 from Saccharomyces cerevisiae[D].Hefei:University of Science and Technology of China,2010.
[11] 曾伟, 朱力红,付毅华.白酒溶液各主要溶质功能作用及调味启示[J].酿酒,2005(5):28-29.
ZENG W,ZHU L H,FU Y H.The function and seasoning enlightenment of main solutes in Baijiu[J].Liquor Making,2005(5):28-29.
[12] PENEDA J,BAPTISTA A,LOPES J M.Interaction of the constituents of alcoholic beverages in the promotion of liver damage[J].Acta Medica Portuguesa,1994,7:S51-S55.
[13] 范光森, 王允中,刘朋肖,等.醇酰基转移酶催化合成白酒中的乙酸乙酯研究进展[J].中国食品学报,2020,20(11):294-304.
FAN G S,WANG Y Z,LIU P X,et al.Research progress in catalytic synthesis of ethyl acetate in Baijiu by alcohol acyltransferase[J].Journal of Chinese Institute of Food Science and Technology,2020,20(11):294-304.
[14] VERSTREPEN K J,VAN LAERE S D M,VANDERHAEGEN B M P,et al.Expression levels of the yeast alcohol acetyltransferase genes ATF1,Lg-ATF1,and ATF2 control the formation of a broad range of volatile esters[J].Applied & Environmental Microbiology,2003,69(9):5 228-5 237.
[15] LILLY M,LAMBRECHTS M G,PRETORIUS I S.Effect of increased yeast alcohol acetyltransferase activity on flavor profiles of wine and distillates[J].Applied and Environmental Microbiology,2000,66(2):744-753.
[16] FUKUDA K,KUWAHATA O,KIYOKAWA Y,et al.Molecular cloning and nucleotide sequence of the isoamyl acetate-hydrolyzing esterase gene(EST2)from Saccharomyces cerevisiae[J].Journal of Fermentation and Bioengineering,1996,82(1):8-15.
[17] LILLY M,BAUER F F,STYGER G,et al.The effect of increased branched-chain amino acid transaminase activity in yeast on the production of higher alcohols and on the flavour profiles of wine and distillates[J].FEMS Yeast Research,2006,6(5):726-743.
[18] FUJII T,NAGASAWA N,IWAMATSU A,et al.Molecular cloning,sequence analysis,and expression of the yeast alcohol acetyltransferase gene[J].Applied and Environmental Microbiology,1994,60(8):2 786-2 792.
[19] CUI D Y,ZHANG Y,XU J,et al.PGK1 promoter library for the regulation of acetate ester production in Saccharomyces cerevisiae during Chinese Baijiu fermentation[J].Journal of Agricultural & Food Chemistry,2018,66(28):7 417-7 427.
[20] GIETZ R D,WOODS R A.Yeast transformation by the LiAc/SS carrier DNA/PEG method[J].Yeast Protocol,2006,313:107-120.
[21] 肖冬光, 许葵,李瑞青.酒精浓醪发酵生产工艺的优化[J].酿酒科技,2004(6):40-42.
XIAO D G,XU K,LI R Q.The optimization of production conditions of high-gravity alcohol fermentation[J].Liquor-Making Science & Technology,2004(6):40-42.
[22] 段钢, 许宏贤,钱莹,等.酸性蛋白酶在玉米酒精浓醪发酵上的应用[J].食品与发酵工业,2005,31(8):34-38.
DUAN G,XU H X,QIAN Y,et al.Application of acid protease for high dry solid alcohol fermentation[J].Food and Fermentation Industries,2005,31(8):34-38.
[23] 刘代武, 彭涛,邬善远,等.玉米酒精浓醪发酵工艺研究[J].酿酒科技,2005(2):87-89.
LIU D W,PENG T,WU S Y,et al.Study on high-concentration mash fermentation technology[J].Liquor-Making Science & Technology,2005(2):87-89.
[24] 崔丹瑶.酿酒酵母中不同强度PGK启动子文库的构建与应用[D].天津:天津科技大学,2019.
CUI D Y.Construction and application of PGK promoter library in Saccharomyces cerevisiae[D].Tianjin:Tianjin University of Science & Technology,2019.
[25] 杨林娥, 彭晓光,杨庆文,等.斐林试剂法测定还原糖方法的改进[J].中国酿造,2010,29(5):160-161.
YANG L E,PENG X G,YANG Q W,et al.Improvement of the determination of reducing sugar with Fehling’s reagent method[J].China Brewing,2010,29(5):160-161.
[26] 郑楠, 郭庆焕,何亚辉,等.乙酰辅酶A含量对酿酒酵母乙酸乙酯合成的影响[J].中国酿造,2018,37(5):150-156.
ZHENG N,GUO Q H,HE Y H,et al.Effect of acetyl-CoA content on ethyl acetate synthesis in Saccharomyces cerevisiae[J].China Brewing,2018,37(5):150-156.
[27] LU J,DONG J,WU D G,et al.Construction of recombinant industrial brewer’s yeast with lower diacetyl production and proteinase A activity[J].European Food Research and Technology,2012,235(5):951-961.
[28] 张晓晓, 任剑星,刘凯毅,等.TOR1基因缺失对酿酒酵母耐受性的影响[J].食品与发酵工业,2021,47(2):1-7.
ZHANG X X,REN J X,LIU K Y,et al.Effects of TOR1 gene deletion on the tolerance of Saccharomyces cerevisiae[J].Food and Fermentation Industries,2021,47(2):1-7.
[29] FUKUDA K,YAMAMOTO N,KIYOKAWA Y,et al.Brewing properties of sake yeast whose EST2 gene encoding isoamyl acetate-hydrolyzing esterase was disrupted[J].Journal of Fermentation & Bioengineering,1998,85(1):101-106.
[30] LI W,WANG J H,ZHANG C Y,et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J].Journal of Industrial Microbiology & Biotechnology,2017,44(6):949-960.
[31] FUKUDA K,YAMAMOTO N,KIYOKAWA Y,et al.Purification and characterization of isoamyl acetate-hydrolyzing esterase encoded by the IAH1 gene of Saccharomyces cerevisiae from a recombinant Escherichia coli[J].Applied Microbiology and Biotechnology,2000,53(5):596-600.