大曲高温放线菌(Thermoactinomyces daqus,T.daqus)CICC 10681分离自高温大曲[1],是芝麻香型白酒高温大曲堆积发酵过程中的重要微生物,其系统学发育地位属于芽孢杆菌目(Bacillales)-高温放线菌属(Thermoactinomyces)[2-3],但形态上与放线菌相似,具有发达的菌丝体,研究表明,菌株发达的菌丝体可以疏松大曲的内部结构,促进大曲水分的蒸发[4]。T.daqus CICC 10681具有良好的耐高温特性,通过解析菌株的脂肪酸组成及代谢相关基因的差异表达情况,菌株CICC 10681在高温条件下能够增加细胞膜脂肪酸异构化支链的比率[5-6],为其在高温条件下发挥生物学功能提供基础。此外,T.daqus CICC 10681能够分泌高温蛋白酶,酶的最适反应温度为65 ℃,与高温大曲发酵过程中最高品温相适应。研究报道,在高温大曲堆积发酵过程中,嗜热微生物分泌的高温蛋白酶通过降解大曲原料产生氨基酸并与还原糖发生美拉德反应[7-10],生成酮、醛、醇等杂环化合物,有利于白酒特征风味物质的形成[11-14],为酒体带来绵软醇厚、香味协调等特点。因此,对菌株CICC 10681生长性能的研究具有重要的理论意义。
高温放线菌在白酒高温大曲中具有较高的物种丰度,葛媛媛等[15]、姚粟等[16]利用非培养方法分析芝麻香型白酒高温大曲细菌群落结构多样性时发现高温放线菌、芽孢杆菌和乳酸菌是高温大曲中的优势菌属,在大曲堆积发酵过程中发挥着重要的作用。T.daqus CICC 10681作为高温大曲的重要菌株,在生长培养基上的生物量偏低,不利于菌株的生物学功能研究,后续菌株的大规模生产应用成本较高。本研究主要利用响应面方法优化T.daqus CICC 10681的生长条件,使其生物量满足微生物强化要求,节约生产成本,后续将菌株以菌粉或菌剂的形式应用于高温大曲发酵生产过程中,旨在更好的发挥菌株的生物学功能,以期改善高温大曲品质。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
T.daqus菌株CICC 10681:分离于山东扳倒井股份有限公司芝麻香型白酒高温大曲,保藏于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC)。
1.1.2 培养基
R2A琼脂培养基、营养肉汤(nutrient broth,NB)培养基,北京陆桥技术股份有限公司;R2A液体培养基,青岛高科园海博生物技术有限公司。
R2A琼脂培养基(g/L):酵母浸出粉0.5、蛋白胨0.5、酪蛋白水解物0.5、葡萄糖0.5、可溶性淀粉0.5、磷酸氢二钾0.3、无水硫酸镁0.024、丙酮酸钠0.3、琼脂15.0、pH值7.2±0.2,121 ℃灭菌15 min。
NB培养基(g/L):牛肉浸粉3、蛋白胨5,自然pH值,121 ℃灭菌15 min。
基础培养基:NB培养基。
1.1.3 化学试剂
酵母浸粉、大豆蛋白胨、酸水解酪蛋白、胰蛋白胨,北京奥博星生物技术有限责任公司;硝酸铵、硫酸镁、氯化钙、氯化钠、硫酸盐、磷酸氢二钾、蔗糖、葡萄糖、果糖、牛肉浸粉、可溶性淀粉,北京化学试剂公司。试验所用试剂均为分析纯或生化试剂。
1.2 仪器与设备
Olympus BH-2光学显微镜,奥林巴斯有限公司;Multiskan FC型酶标仪,赛默飞世尔(上海)仪器有限公司;FE20型pH计,梅特勒-托利多仪器(上海)有限公司;2000型分光光度计,尤尼柯(上海)仪器有限公司;BHG-8082型恒温培养箱、THZ-98C恒温振荡培养箱,上海一恒科学仪器有限公司。
1.3 试验方法
1.3.1 种子液制备
菌种活化:将甘油保藏的菌株CICC 10681接种于R2A液体培养基中,于55 ℃、180 r/min条件下恒温振荡培养12 h,备用。
种子液制备:将培养好的菌株稀释至OD620nm=0.5并以2%接种量接入装有50 mL R2A液体培养基中,于55 ℃、180 r/min条件下恒温振荡培养12 h,制备成种子液。
1.3.2 菌株生长曲线绘制
将活化好的菌株CICC 10681稀释至OD620nm=0.5 并以2%接种量接入50 mL NB培养基中,55 ℃,180 r/min条件下恒温振荡培养,每隔2 h测菌株CICC 10681培养液的OD620nm,以时间为横坐标,OD620nm为纵坐标,绘制大曲高温放线菌的生长曲线。
1.3.3 菌株CICC 10681培养基组分的筛选
1.3.3.1 碳源的筛选
运用单因素试验,以NB培养基为基础培养基,以果糖、蔗糖及菌株CICC 10681分离筛选培养基中含有的葡萄糖、丙酮酸钠和可溶性淀粉(添加量为3 g/L)为筛选碳源,按照上述培养和测定方法,分别考察不同碳源对菌株生长的影响。
1.3.3.2 氮源的筛选
以添加最优碳源培养基为基础培养基,分别添加5 g/L的酵母浸粉、大豆蛋白胨、胰蛋白胨、硝酸铵、酸水解酪蛋白,按照上述培养和测定方法,分别考察不同氮源对菌株生长的影响。
1.3.3.3 无机盐的筛选
无机盐离子是菌株生长必不可少的营养物质,有研究表明,适当增加无机盐的浓度可促进菌株生长[17-18]。以添加最优碳源、氮源的培养基为基础培养基,分别添加硫酸镁、氯化钠、硫酸锰、磷酸二氢钾、氯化钙(添加量为5 g/L),按照上述培养和测定方法,分别考察不同无机盐对菌株生长的影响。
1.3.4 Plackett-Burman试验设计培养条件的优化
在最优碳源、氮源、无机盐种类的基础上,选取温度、pH值、转速、装液量、接种量共8个因素进行Plackett-Burman试验,每个因素选高低2个水平,以(-1,+1)编码各值[19],各因素及取值见表1。以菌株生物量(OD620nm)为响应值,运用N=12的Plackett-Burman(PB)试验设计快速筛选对菌株CICC 10681生长影响显著的因素。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design
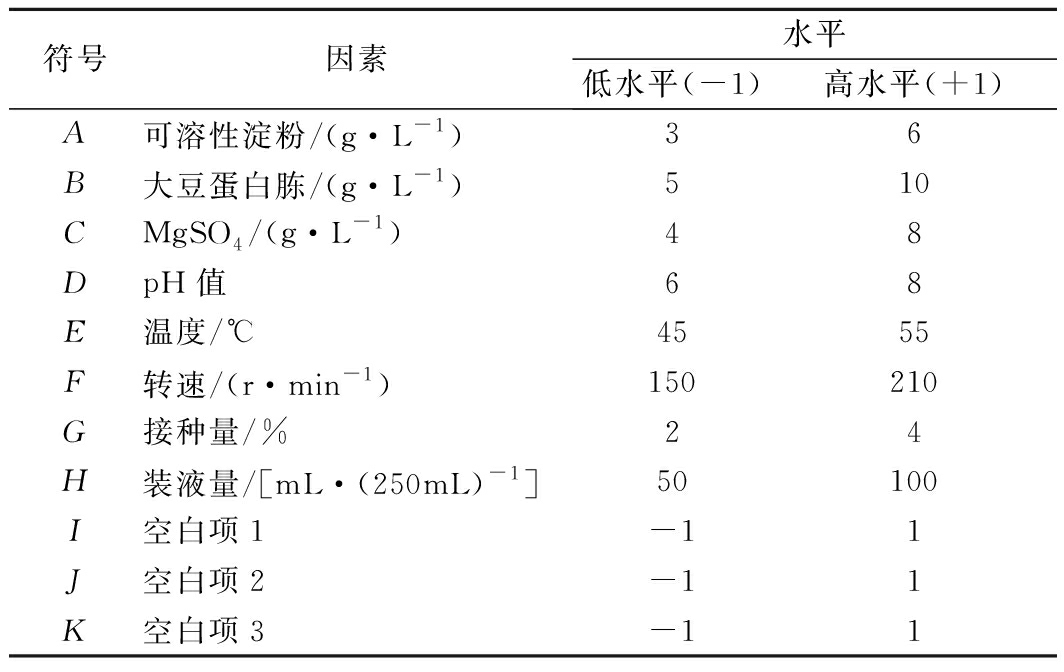
符号因素水平低水平(-1)高水平(+1)A可溶性淀粉/(g·L-1)36B大豆蛋白胨/(g·L-1)510CMgSO4/(g·L-1)48DpH值68E温度/℃4555F转速/(r·min-1)150210G接种量/%24H装液量/[mL·(250mL)-1]50100I空白项1-11J空白项2-11K空白项3-11
1.3.5 最陡爬坡试验
根据Plackett-Burman试验结果,筛选出显著影响因素,根据回归方程系数来确定爬坡方向,+号表示正相关,-号代表负相关,通过最陡爬坡试验确定响应面中心点[20-21]。
1.3.6 Box-Behnken试验设计
根据Plackett-Burman试验筛选出显著影响因素可溶性淀粉(A)、大豆蛋白胨(B)、温度(E)、装液量(H),以最陡爬坡试验结果中最大响应值所对应的各因素水平为基准,确定响应面的中心点。采用Box-Behnken试验进一步优化菌株CICC 10681生长条件[22],并利用Design-Expert 10.0.7对试验结果进行回归分析。Box-Behnken 试验设计的因子与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design

因素水平-101可溶性淀粉/(g·L-1)3.54.55.5大豆蛋白胨/(g·L-1)6810温度/℃485358装液量/mL356085
1.3.7 数据分析
所有试验重复3次,结果取平均值±标准偏差,单因素方差分析采用SPSS Statistics 20.0软件(P<0.05),运用软件Origin 9.0[23]进行数据作图处理。
2 结果与分析
2.1 单因素试验
2.1.1 不同碳源对菌株CICC 10681生长的影响
碳源的筛选结果见图1。大曲高温放线菌CICC 10681生长在高温场所,能够产生与放线菌相似的发达菌丝体,但菌株CICC 10681在生长培养基上的生物量较低。菌株CICC 10681在NB液体培养基上生物量(OD620nm)仅为0.27±0.01,与细菌域中其他的高温功能菌相比,其生物含量偏低。添加可溶性淀粉对菌株CICC 10681的生长影响最显著,生物量OD620nm达0.73±0.04(P<0.05);果糖、葡萄糖和蔗糖次之。因此试验选取可溶性淀粉为最佳碳源。
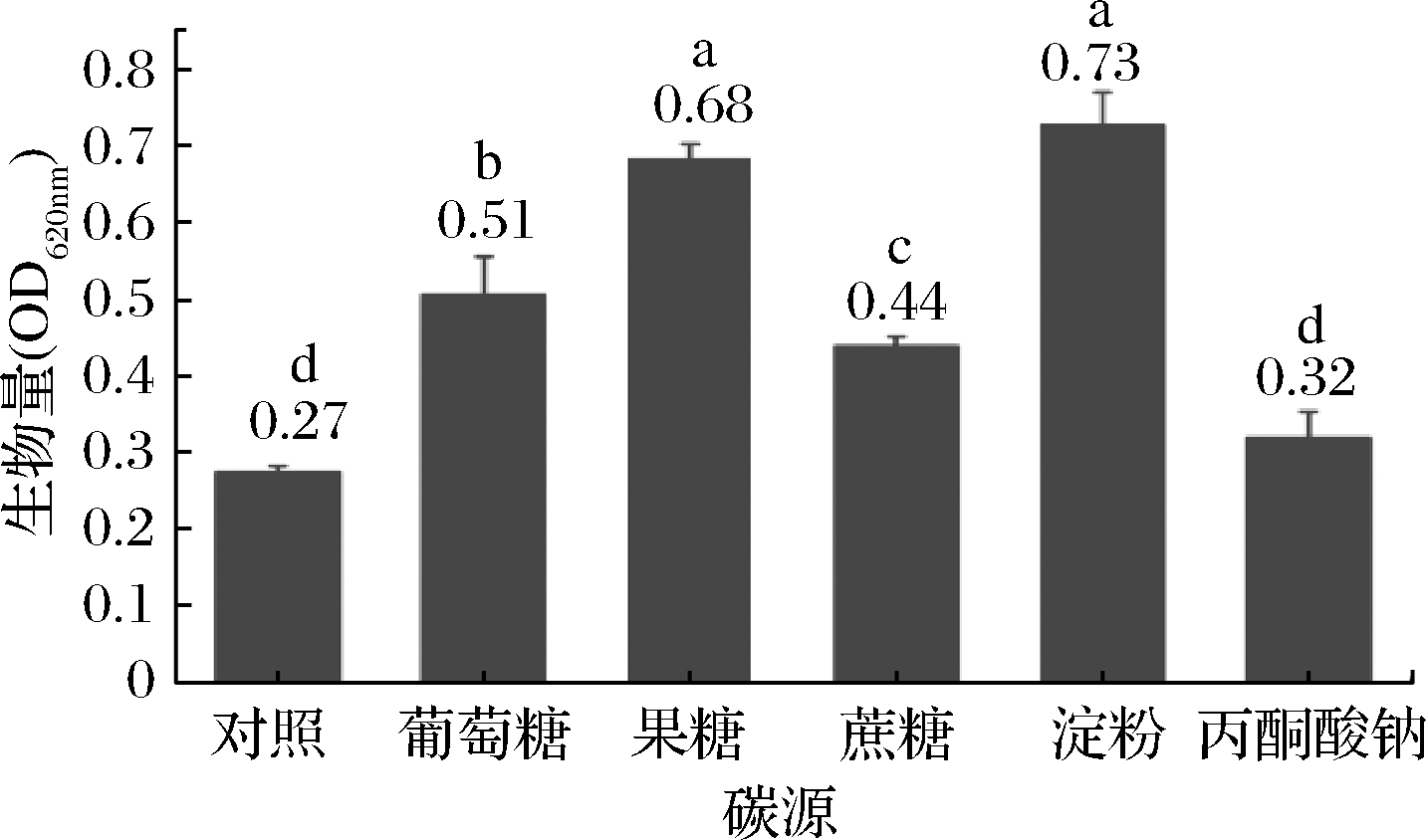
图1 不同碳源对大曲高温放线菌生长的影响
Fig.1 Effect of different carbon sources on bacteria
growth of T. daqus
注:不同字母代表差异显著(P<0.05)(下同)
2.1.2 不同氮源对菌株CICC 10681生长的影响
氮源的筛选结果见图2,添加大豆蛋白胨对菌株CICC 10681的生长影响最显著, OD620nm达1.35(P<0.05),酸水解酪蛋白、酵母浸粉和硝酸铵次之,胰蛋白胨对菌株CICC 10681的生长无显著性影响(P>0.05)。由此可见,添加大豆蛋白胨对大曲高温放线菌的生长影响最大,因此试验选取大豆蛋白胨作为最佳氮源。
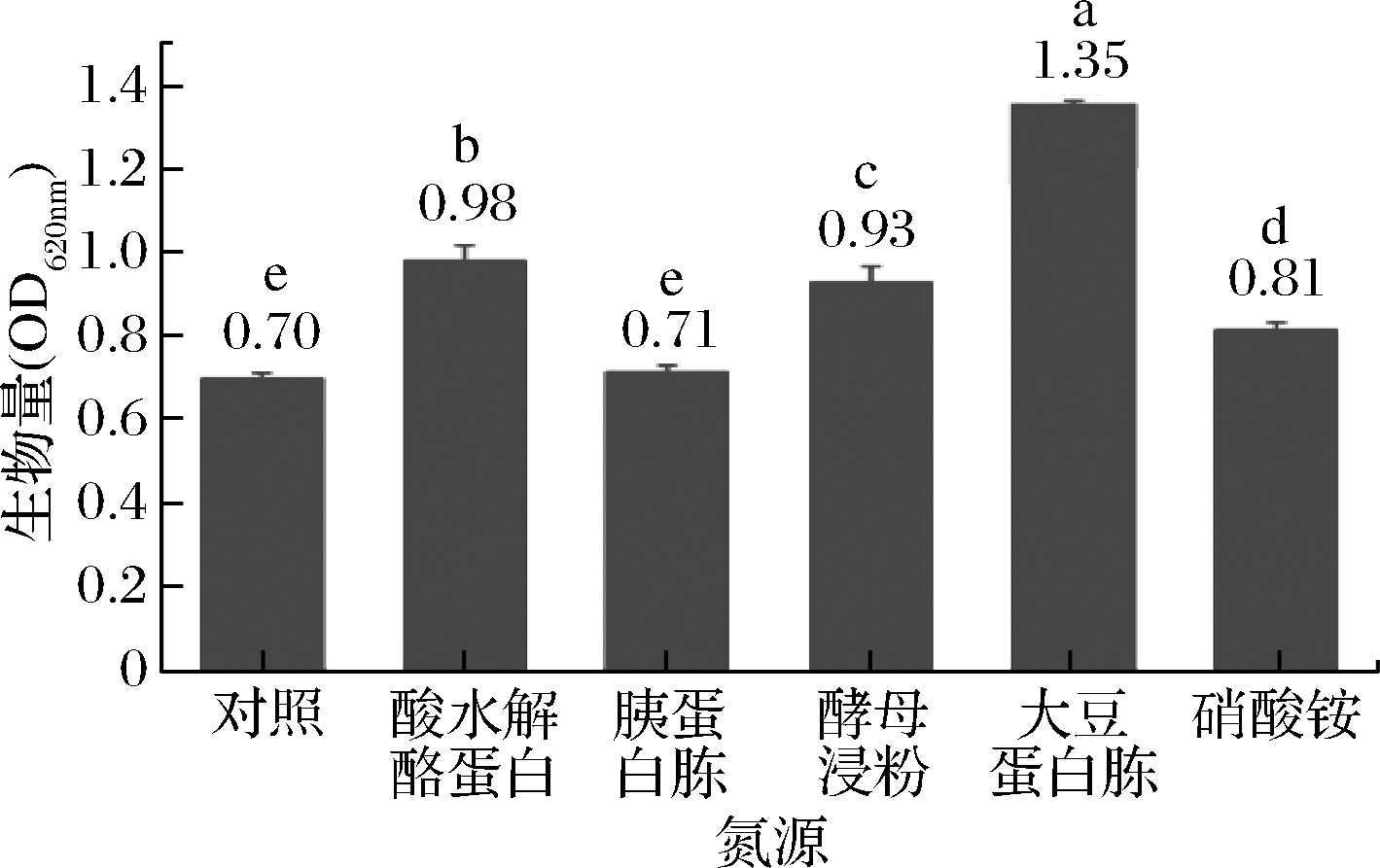
图2 不同氮源对大曲高温放线菌生长的影响
Fig.2 Effect of different nitrogen sources on bacteria growth of T.daqus
2.1.3 不同无机盐对菌株CICC 10681生长的影响
无机盐的筛选结果见图3,磷酸氢二钾、硫酸镁、氯化钙对菌株CICC 10681的生长具有明显的促进作用,其中,添加硫酸镁对菌株CICC 10681的生长影响最显著,OD620nm达1.71(P<0.05),添加氯化钠和硫酸锰对菌株CICC 10681的生长具有明显的抑制作用,因此选取硫酸镁作为最佳无机盐。
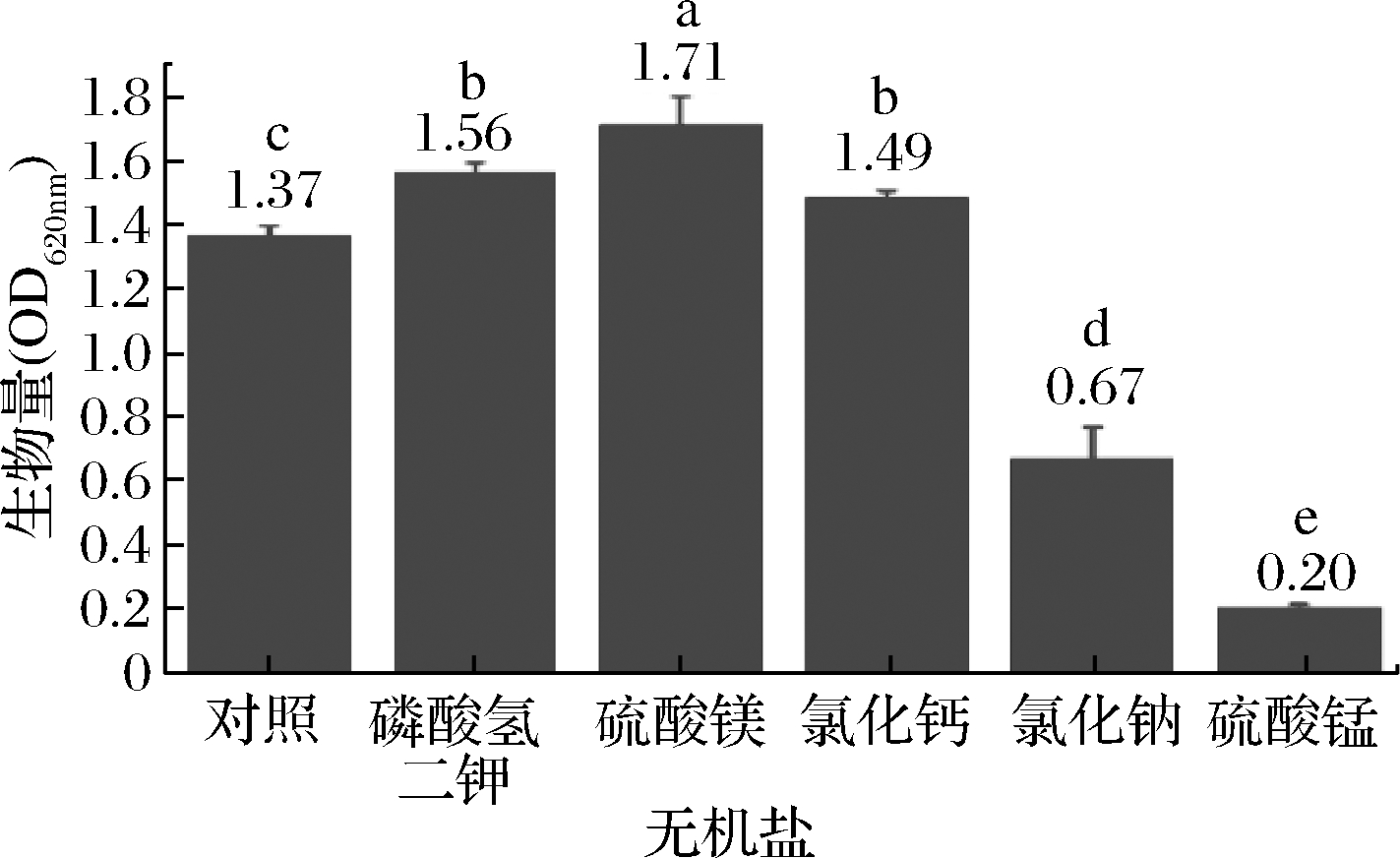
图3 不同无机盐对大曲高温放线菌生长的影响
Fig.3 Effect of different inorganic salt on bacteria growth of T.daqus
2.2 Plackett-Burman试验筛选重要影响因素
根据单因素试验结果,按1.3.4中的方法进行N=12的Plackett-Burman试验,试验结果见表3。
运用Design-Expert10.0.7软件对表3结果进行方差分析。从分析结果表4中可以看出影响因素大小顺序为温度(E)>大豆蛋白胨(B)>装液量(H)>可溶性淀粉(A)>转速(F)>pH(D)>硫酸镁(C)>接种量(G)。模型P=0.032 214<0.05,模型显著,温度P=0.009 342<0.01,影响极显著,大豆蛋白胨、装液量、可溶性淀粉的P<0.05,影响显著,一次回归方程为Y=1.022 50+0.172 50A+0.205 83B+0.107 50C-0.114 17D+0.309 17E+0.159 17F+0.027 50G-0.202 50H。
表3 Plackett-Burman设计与结果
Table 3 Design and results of Plackett-Burman
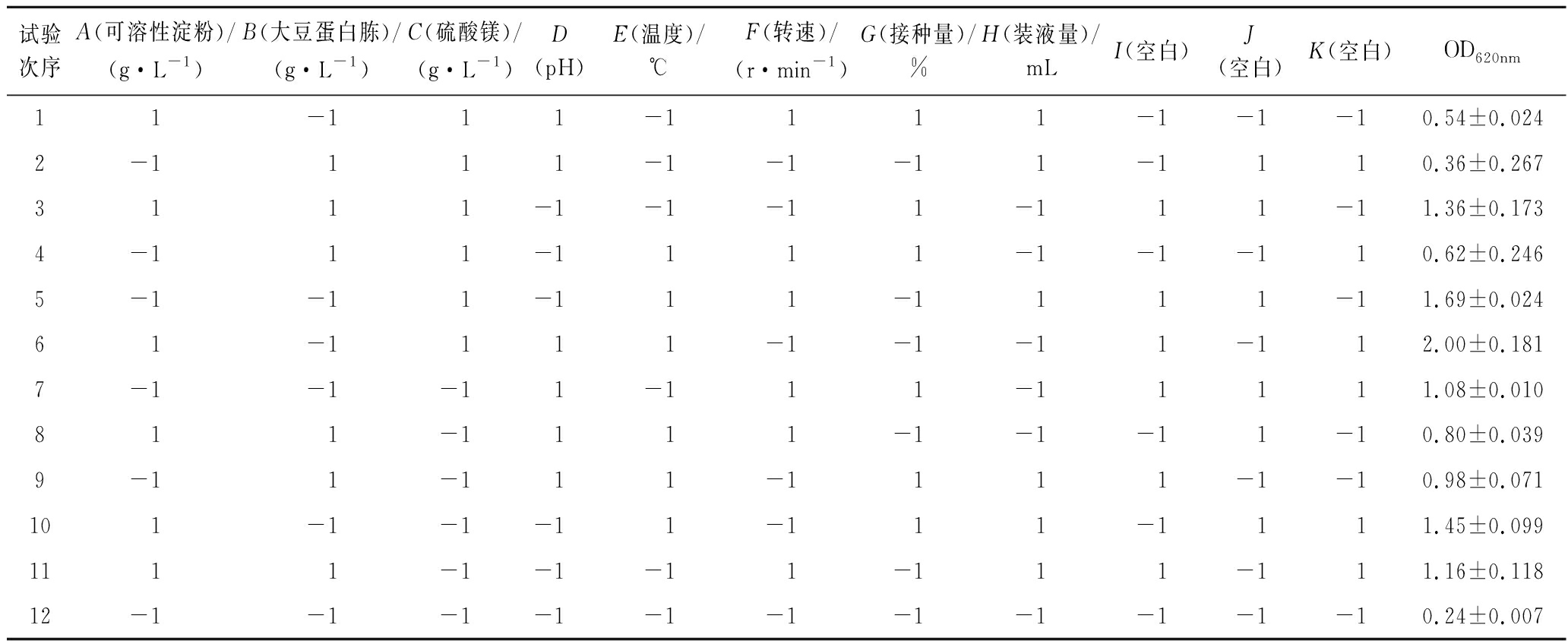
试验次序A(可溶性淀粉)/(g·L-1)B(大豆蛋白胨)/(g·L-1)C(硫酸镁)/(g·L-1)D(pH)E(温度)/℃F(转速)/(r·min-1)G(接种量)/%H(装液量)/mLI(空白)J(空白)K(空白)OD620nm11-111-1111-1-1-10.54±0.0242-1111-1-1-11-1110.36±0.2673111-1-1-11-111-11.36±0.1734-111-1111-1-1-110.62±0.2465-1-11-111-1111-11.69±0.02461-1111-1-1-11-112.00±0.1817-1-1-11-111-11111.08±0.010811-1111-1-1-11-10.80±0.0399-11-111-1111-1-10.98±0.071101-1-1-11-111-1111.45±0.0991111-1-1-11-111-111.16±0.11812-1-1-1-1-1-1-1-1-1-1-10.24±0.007
表4 Plackett-Burman试验结果方差分析
Table 4 Variance analysis of Plackett-Burman experiments results

因素平方和自由度均方F值P值显著性模型3.112 73380.389 09212.147 520.032 214*A-可溶性淀粉0.357 07510.357 07511.147 950.044 425*B-大豆蛋白胨0.508 40810.508 40815.872 60.028 303*C-硫酸镁0.138 67510.138 6754.329 460.128 912D-pH0.156 40810.156 4084.883 0980.114 126E-温度1.147 00811.147 00835.809 820.009 342**F-转速0.304 00810.304 0089.491 1980.054 103G-接种量0.009 07510.009 0750.283 3230.631 431H-装液量0.492 07510.492 07515.362 670.029 535*残差0.096 09230.032 031 误差总变异3.208 82511
2.3 最陡爬坡试验
根据Plackett-Burman试验结果筛选出温度、大豆蛋白胨、装液量、可溶性淀粉4个显著影响因素,通过最陡爬坡试验确定响应面试验的中心点,最陡爬坡试验设计及结果见表5,当可溶性淀粉为4.5 g/L、大豆蛋白胨8 g/L、温度为53 ℃、装液量为60 mL时,对应试验3的OD620nm达到最大,试验结果表明适当增加营养物质及调整生长条件有利于提高菌株CICC 10681的生物量,超出某一临界值将抑制菌株CICC 10681的生长。因此选取试验3对应条件作为响应面的中心点,即可溶性淀粉为4.5 g/L、大豆蛋白胨8 g/L、温度为53 ℃、装液量为60 mL。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent experiments

试验可溶性淀粉/(g·L-1)大豆蛋白胨/(g·L-1)温度/℃装液量/mLOD620nm12.54431100.23±0.01723.5648850.82±0.05134.5853601.76±0.04845.51058351.44±0.01056.51263100.88±0.015
2.4 Box-Behnken试验设计结果及分析
响应面试验是根据最陡爬坡试验选取的中心点,利用少量的试验总结影响因素与响应值之间的关系,同时分析各因素之间的交互作用。根据响应面中心点进行响应面试验,试验结果见表6,以菌株OD620nm为响应值的二次回归方程:Y=1.945+0.069A+0.092B+0.181C+0.089D-0.092AB-0.164AC-0.052AD-0.061BC-0.084BD-0.077CD-0.158A2-0.067B2-0.601C2-0.309D2。Y表示菌株OD620nm,A表示可溶性淀粉,B表示大豆蛋白胨,C表示温度,D表示装液量。
表6 Box-Behnken 试验设计及其结果
Table 6 Design and results of Box-Behnken experiments
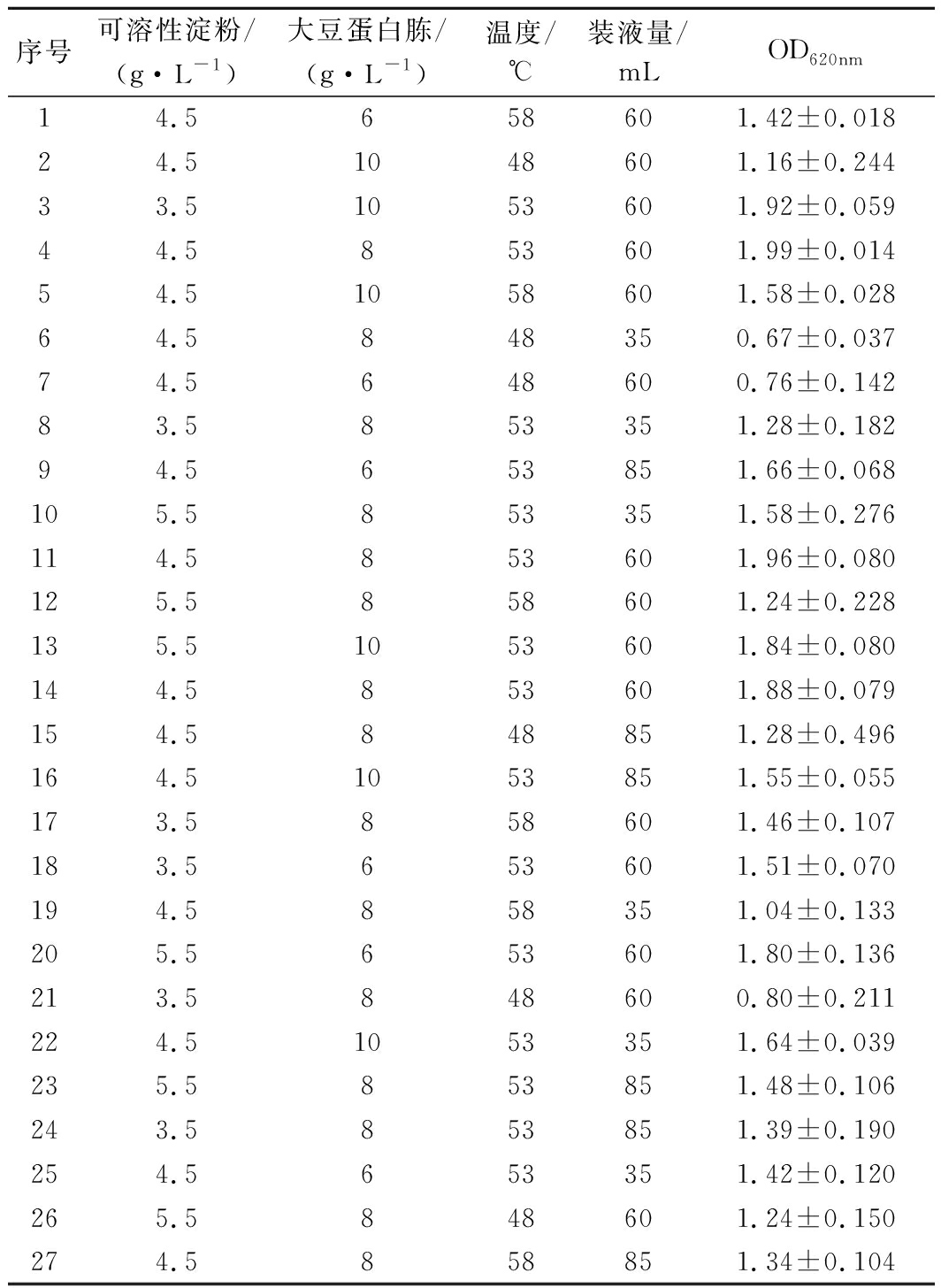
序号可溶性淀粉/(g·L-1)大豆蛋白胨/(g·L-1)温度/℃装液量/mLOD620nm14.5658601.42±0.01824.51048601.16±0.24433.51053601.92±0.05944.5853601.99±0.01454.51058601.58±0.02864.5848350.67±0.03774.5648600.76±0.14283.5853351.28±0.18294.5653851.66±0.068105.5853351.58±0.276114.5853601.96±0.080125.5858601.24±0.228135.51053601.84±0.080144.5853601.88±0.079154.5848851.28±0.496164.51053851.55±0.055173.5858601.46±0.107183.5653601.51±0.070194.5858351.04±0.133205.5653601.80±0.136213.5848600.80±0.211224.51053351.64±0.039235.5853851.48±0.106243.5853851.39±0.190254.5653351.42±0.120265.5848601.24±0.150274.5858851.34±0.104
由表7可知,方差分析结果显示模型P=0.000 1<0.05达到极显著水平,失拟项为7.028,失拟项P=0.130 9>0.05,影响不显著,说明试验所得方程与实际拟合中非正常误差所占比例较小,模型拟合程度较好;模型决定系数为0.924 6,调整决定系数为0.836 6,信噪比为9.97。回归模型分析结果显示,大豆蛋白胨、温度影响显著,可溶性淀粉与温度的交互作用显著,说明温度和大豆蛋白胨是菌株CICC 10681生长的重要影响因子。
表7 回归模型方差分析
Table 7 Variance analysis of regression model
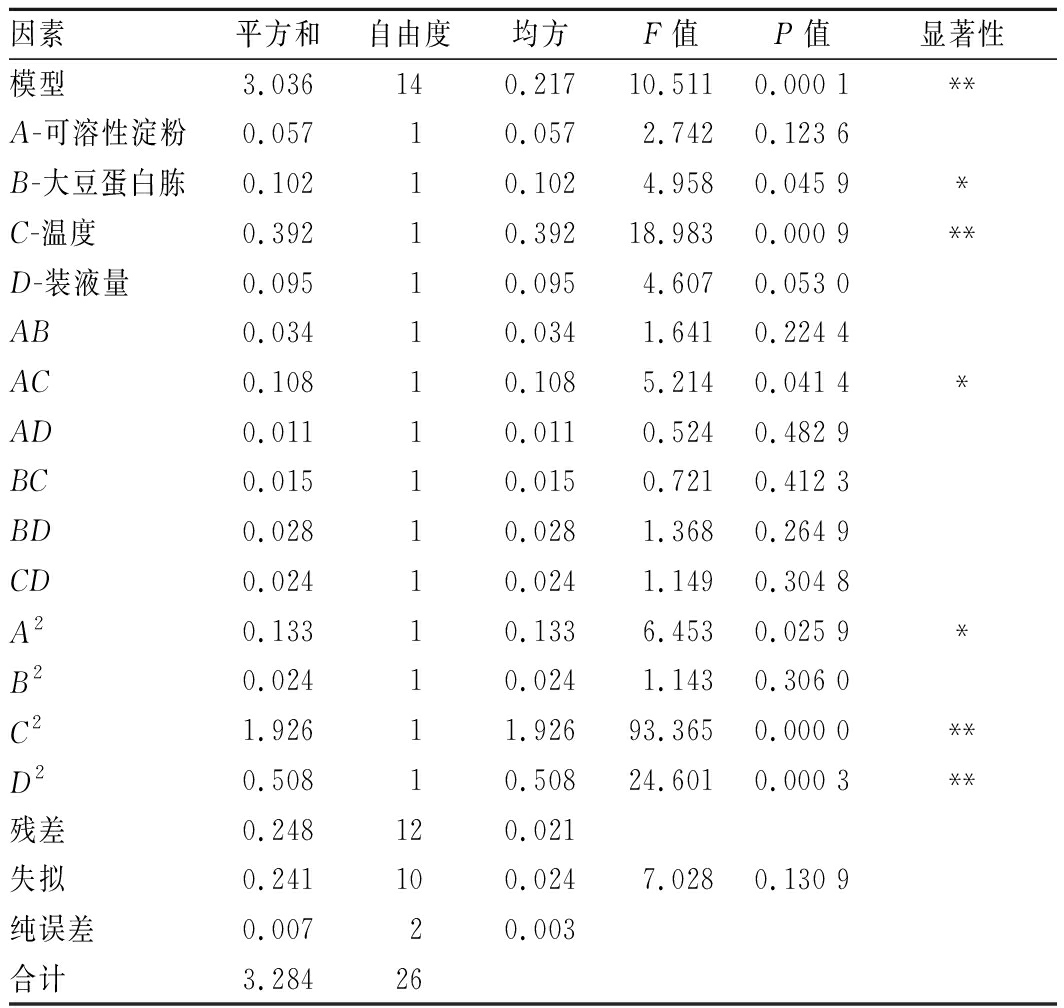
因素平方和自由度均方F值P值显著性模型3.036140.21710.5110.000 1**A-可溶性淀粉0.05710.0572.7420.123 6B-大豆蛋白胨0.10210.1024.9580.045 9*C-温度0.39210.39218.9830.000 9**D-装液量0.09510.0954.6070.053 0AB0.03410.0341.6410.224 4AC0.10810.1085.2140.041 4*AD0.01110.0110.5240.482 9BC0.01510.0150.7210.412 3BD0.02810.0281.3680.264 9CD0.02410.0241.1490.304 8A20.13310.1336.4530.025 9*B20.02410.0241.1430.306 0C21.92611.92693.3650.000 0**D20.50810.50824.6010.000 3**残差0.248120.021失拟0.241100.0247.0280.130 9纯误差0.00720.003合计3.28426
温度、可溶性淀粉、大豆蛋白胨及装液量这4个因素中两两相互作用对OD620nm的影响结果见图4。其中可溶性淀粉(A)与温度(C)交互作用显著,当可溶性淀粉添加量在较低水平时,较高生物量(OD620nm≈1.81)对应的温度在54 ℃;当可溶性淀粉添加量增加到4.6 g/L时,最大生物量(OD620nm≈1.96)对应的温度在53.6 ℃,由此可知,可溶性淀粉与温度交互作用呈负相关,在最优条件范围内,调节可溶性淀粉含量与温度的关系可提高菌株CICC 10681的生物量,此外,从等高线图可以看出图形呈椭圆型,交互作用显著[24]。

图4 温度、可溶性淀粉、大豆蛋白胨及装液量交互作用对生物量影响的响应面和等高线
Fig.4 Response surface plots and contour line of effects of interaction between temperature, soluble starch, soy peptone and ventilation content on biomass
根据上述分析及响应面软件预测,菌株CICC 10681的最佳培养条件为可溶性淀粉4.528 g/L、大豆蛋白胨8.410 g/L、硫酸镁5 g/L、温度53.28 ℃、接种量2%、装液量63.57 mL/250mL、转速180 r/min,预测最高OD620nm为1.972。为验证该模型预测的可靠性,在最优培养条件下进行3次平行试验,结合实际培养条件,调整最优条件为可溶性淀粉4.5 g/L、大豆蛋白胨8.4 g/L、硫酸镁5 g/L、温度53 ℃、接种量2%、装液量60 mL/250mL、转速180 r/min,实际试验结果显示,菌株CICC 10681的OD620nm达1.98±0.029,与响应曲面拟合所得方程的预测值相近,说明该模型较为合理。
通过单因素试验和响应面试验,大曲高温放线菌CICC 10681的生物量明显提高,OD620nm可以达到1.98±0.029,比优化之前提高了6.2倍,为后续深入研究菌株CICC 10681的功能特性及菌株的生产应用提供了良好的研究基础。
3 结论
本研究是对分离自芝麻香型白酒高温大曲的大曲高温放线菌CICC 10681的生长性能优化,以OD620nm为响应值,利用单因素试验对菌株CICC 10681培养基组成进行筛选,并结合Plackett-Burman试验、最陡爬坡试验和响应面试验对菌株CICC 10681的培养条件进行优化,旨在大曲高温放线菌的最佳培养条件,为后续对高温功能菌的生产应用提供理论基础。研究结果表明,菌株CICC 10681最佳培养条件为可溶性淀粉4.5 g/L、大豆蛋白胨8.4 g/L、硫酸镁5 g/L、53 ℃、接种量2%、装液量60 mL/250mL、转速180 r/min,在此条件下进行验证试验,菌株CICC 10681的OD620nm达1.98±0.029,较优化前提高了6.2倍。
T.daqus CICC 10681是高温大曲中的重要功能菌,发达的菌丝体可以很好的疏松大曲的内部结构,其分泌的高温蛋白酶对大曲原料的降解及大曲特征风味前体物质的形成方面具有潜在的应用价值。本研究对T.daqus CICC 10681性能的初步研究,确定了菌株的最佳培养条件,一方面为深入分析菌株功能特性提供研究基础,另一方面为挖掘菌株潜在功能及其在芝麻香型白酒高温大曲中的应用方面奠定了一定基础。
[1] YAO S, LIU Y, ZHANG M J, et al.Thermoactinomyces daqus sp.nov.a thermophilic bacterium isolated from high-temperature Daqu[J].International Journal of Systenatic and Evolutionary Microbiology, 2014, 64(1):206-210.
[2] 冯慧军, 翟磊, 程坤, 等.高温放线菌属研究进展[J].食品与发酵工业, 2017, 43(11):257-261.
FENG H J, ZHAI L, CHENG K, et al.The research advance of genus Thermoactinomyces[J].Food and Fermentation Industries, 2017, 43(11):257-261.
[3] 李文均, 张忠泽, 姜成林. 高温放线菌属分类研究进展[J]. 微生物学报, 2002, 42(6):759-763.
LI W J, ZHANG Z Z, JIANG C L. The advance on taxonomic of genus Thermoactinomyces[J]. Acta Microbiologica Sinica, 2002, 42(6):759-763.
[4] 孙思佳, 翟磊, 许玲, 等.扣囊复膜孢酵母CICC 33077在芝麻香型白酒高温大曲生产中的应用[J].酿酒科技, 2018(7):76-82.
SUN S J, ZHAI L, XU L, et al.Application of Saccharomycopsis fibuligera CICC 33077 in the production of high-temperature Zhimaxiang Daqu[J].Liquor-Making Science & Technology, 2018(7):76-82.
[5] 马挺, 刘如林.嗜热菌耐热机理的研究进展[J].微生物学通报, 2002,29(2):86-88.
MA T, LIU R L.Research progress on heat resistance mechanism of thermophilic bacteria[J].Microbiology China, 2002,29(2):86-88.
[6] 冯慧军, 翟磊, 于学健, 等.大曲高温放线菌CICC 10681在不同温度下的脂肪酸代谢变化[J].食品与发酵工业, 2018, 44(11):49-54.
FENG H J, ZHAI L, YU X J, et al.Fatty acids metabolism changes of Thermoactinomyces daqus CICC 10681 at different temperatures[J].Food and Fermentation Industries, 2018, 44(11):49-54.
[7] 苏加坤, 赵琪, 李瑞丽, 等.葡萄糖和丙氨酸的美拉德反应及其在烟草中的应用研究[J].化学试剂, 2019, 41(11):1 201-1 205.
SU J K, ZHAO Q, LI R L, et al.Maillard reaction of glucose and alanine and application in tobacco[J].Chemical Reagents, 2019, 41(11):1 201-1 205.
[8] XIAO Z J,MA C Q,XU P, et al.Acetoin catabolism and acetylbutanediol formation by Bacillus pumilus in a chemically defined medium[J].PloS One, 2009, 4(5):e5 627.
[9] 祁岩龙, 冯怀章, 于洋, 等.美拉德反应研究进展及在食品工业中的应用[J].食品工业, 2018, 39(3):248-252.
QI Y L, FENG H Z, YU Y, et al.Research progress of Maillard reaction and its application in food industry[J].The Food Industry, 2018, 39(3):248-252.
[10] 张巧玲, 吕锡斌, 秦兴, 等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造, 2019, 38(4):53-57.
ZHANG Q L, LYU X B, QIN X, et al.Comparative analysis of free amino acids in high temperature Daqu of Moutai-flavor Baijiu[J].China Brewing, 2019, 38(4):53-57.
[11] 陈双, 徐岩.全二维气相色谱-飞行时间质谱法分析芝麻香型白酒中挥发性组分特征[J].食品与发酵工业, 2017, 43(7):207-213.
CHEN S, XU Y.Characterization of volatile compounds in Chinese roasted sesame-like flavor type liquor by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Food and Fermentation Industries, 2017, 43(7):207-213.
[12] YVON M, RIJNEN L.Cheese flavour formation by amino acid catabolism[J].International Dairy Journal, 2001, 11(4-7):185-201.
[13] 赵东瑞, 张丽末, 张锋国, 等.固相微萃取、液液萃取结合气相色谱-质谱法分析芝麻香型白酒中的含硫化合物[J].食品科学, 2016, 37(22):99-106.
ZHAO D R, ZHANG L M, ZHANG F G, et al.Analysis of sulfur-containing compounds in sesame-flavor Chinese liquor by solid phase microextraction and liquid-liquid extraction coupled with GC-MS[J].Food Science, 2016, 37(22):99-106.
[14] ZHENG Y, SUN B G, ZHAO M M, et al.Characterization of the key odorants in Chinese Zhima aroma-type Baijiu by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission studies[J].Journal of Agricultural and Food Chemistry, 2016, 64(26):5 367-5 374.
[15] 葛媛媛, 姚粟, 刘洋, 等.芝麻香型白酒高温大曲嗜热细菌群落研究[J].食品与发酵工业, 2012, 38(11):16-19.
GE Y Y, YAO S, LIU Y, et al.Analysis on thermophilic bacterial communities in high temperature Daqu of sesame flavor liquor[J].Food and Fermentation Industries, 2012, 38(11):16-19.
[16] 姚粟, 葛媛媛, 李辉, 等.利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J].食品与发酵工业, 2012, 38(6):1-6.
YAO S, GE Y Y, LI H, et al.Analysis on bacterial communities in high temperature Daqu of sesame flavor liquor through culture-free approach[J].Food and Fermentation Industries, 2012, 38(6):1-6.
[17] 余炫彤, 陈双林, 何刚, 等.葡萄状枝瑚菌菌丝液体培养条件优化[J].食品工业科技, 2018, 39(24):102-108.
YU X T, CHEN S L, HE G, et al.Optimization of liquid culture conditions of mycelium of Ramaria botrytis[J].Science and Technology of Food Industry, 2018, 39(24):102-108.
[18] 汪敦飞, 朱胜男, 肖清铁, 等.基于响应面法的耐镉假单胞菌TCd-1培养条件优化[J].浙江农林大学学报, 2020, 37(5):914-921.
WANG D F, ZHU S N, XIAO Q T, et al.Optimization of culture conditions of Cd-tolerant strain Pseudomonas TCd-1 based on response surface methodology[J].Journal of Zhejiang A & F University, 2020, 37(5):914-921.
[19] VASIEE A, BEHBAHANI B A, YAZDI F T, et al.Optimization of the production conditions of the lipase produced by Bacillus cereus from rice flour through Plackett-Burman Design (PBD) and response surface methodology (RSM)[J].Microbial Pathogenesis, 2016, 101:36-43.
[20] 戴阳军, 胡舰, 周莹, 等.Plackett-Burman设计及响应面法优化无花果干复合酶解工艺[J].中国农业科技导报, 2018, 20(7):146-153.
DAI Y J, HU J, ZHOU Y, et al.Optimization of compound enzymolysis process of dried figs by Plackett-Burman design and response surface methodology[J].Journal of Agricultural Science and Technology, 2018, 20(7):146-153.
[21] 徐速, 孙立斌, 赵清霞, 等.替代抗生素枯草芽孢杆菌菌剂固态发酵工艺优化[J].中国食品学报, 2016, 16(8):132-139.
XU S, SUN L B, ZHAO Q X, et al.Optimization of solid-state fermentation process on antibiotic alternative Bacillus subtilis probiotics[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(8):132-139.
[22] FERREIRA S L C, BRUNS R E, FERREIRA H S, et al.Box-Behnken design:An alternative for the optimization of analytical methods[J].Analytica Chimica Acta, 2007, 597(2):179-186.
[23] 张建伟. Origin 9.0科技绘图与数据分析超级学习手册[M].北京:人民邮电出版社, 2014.
ZHANG J W.Origin 9.0 Super Learning Manual for Technical Drawing and Data Analysis[M].Beijing:The People′s Posts and Telecommunications Press (Posts & Telecom Press), 2014.
[24] MURALIDHAR R V, CHIRUMAMILA R R, MARCHANT R, et al. A response surface approach for the comparison of lipase production by Candida cylindracea using two different carbon sources[J]. Biochemical Engineering Journal, 2001, 9(1) :17-23.