近年来,我国果蔬干制品市场呈爆发式增长趋势,已发展成为我国休闲食品市场的重要门类之一。
目前生产中果蔬干燥加工常用方法是热风(air drying, AD)和冷冻(freeze-drying, FD)干燥。其中冷冻干燥能够较好地保持食品的色、香、味及营养成分,但其干燥时间长、能耗高、加工成本大等缺陷,受到一定程度的限制[1],王海鸥等[2]在传统冻干(conventional freeze-drying, CFD)的基础上提出了一种新的冷冻干燥方法,即“一体化冻干(integrated freeze-drying, IFD)”。果蔬在干燥加工过程中,易受到温度、水分等的影响而发生脂肪、蛋白质的分解、氧化等物理化学变化,从而影响食用口感。如谷文静等[3]发现在55~65 ℃下加热有利于提高虾肉糜鲜味的产生。吴方宁[4]发现干燥后白玉菇的可溶性糖总量均低于新鲜白玉菇,游离氨基酸总量高于新鲜白玉菇,这些变化影响了白玉菇的甜味和鲜味。
榴莲是一种著名的热带特色水果,其果肉黏性多汁,滋味以甜味为主,其甜味与糖含量尤其是蔗糖含量有很大的关系[5];除了糖以外,游离氨基酸也是被公认的呈味物质。但是对于金枕榴莲的可溶性糖和游离氨基酸的研究较少。目前,有文献报道了新鲜榴莲中游离氨基酸和可溶性糖含量[6-7],而对榴莲的游离氨基酸和可溶性糖的呈味特性分析未见报道,尤其对干燥榴莲非挥发性风味物质变化及呈味特性还未有人进行研究。呈味特性不仅与氨基酸和可溶性糖的含量有关,还与其阈值有重要联系,通常用滋味活度值(taste activity value,TAV)法进行评判,TAV法是一种基于阈值水平综合评价滋味物质对食品整体贡献的经典方法[8]。
因此,本试验以典型品种金枕榴莲为研究对象,采用高效液相色谱法分析新鲜及IFD、CFD和AD这3种干燥方法及过程中榴莲的可溶性糖、游离氨基酸含量的变化,比较不同干燥对榴莲游离氨基酸和可溶性糖的影响;通过TAV分析游离氨基酸和可溶性糖的呈味特性,揭示游离氨基酸和可溶性糖对榴莲味感的贡献程度;借助主成分分析(principal compcnent analysis,PCA)和聚类分析等方法,寻找影响榴莲滋味的关键因子,为进一步探索榴莲干燥过程中风味差异机制提供基础数据,以期为榴莲味感化学研究和风味产品的开发提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜金枕榴莲,南京苏果超市;蔗糖、果糖、葡萄糖、麦芽糖等可溶性糖标准品、16种氨基酸标准品,美国Sigma公司;邻苯二甲醛(o-phthalaldehyde, OPA)、乙腈和甲醇(色谱纯)、3-巯基丙酸、硼酸、磷酸二氢钾(分析纯),国药集团。
1.2 仪器与设备
SCIENTZ-10 ND真空冷冻干燥机,宁波新芝生物科技股份有限公司;HP1200高效液相色谱,美国安捷伦公司;LDO-101-1电热恒温鼓风干燥箱,上海龙跃仪器设备有限公司;ME204E离心机,上海安亭科学仪器厂。
1.3 样品干燥及取样方法
新鲜榴莲剥去外壳,去除种子,将果肉切成厚度为(2.0±0.1) mm薄片,将每个新鲜榴莲样品质量定量为5 g,制成标准的测试样品作为取样单元,摆盘后备用。尽管取样单元的质量随着干燥脱水的进行而逐渐减少,但均可认为是初始质量为5 g的新鲜榴莲样品,确保干燥过程中测定指标(游离氨基酸含量和可溶性糖含量)具有可比性。切好备用的榴莲测试样品分别进行IFD、CFD和AD,其取样方法如下:
(1)IFD:将样品置于干燥器仓内,开启制冷机和真空泵,榴莲水分在真空状态下快速蒸发,使物料快速降温冻结,干燥仓压强持续下降,最终维持在 20~30 Pa,真空冻结过程维持 0.5 h;将真空冻结的物料进行冷冻干燥,隔板升温程序为-10 ℃-1 h,0 ℃-1 h,10 ℃-2 h,20 ℃-2 h,30 ℃-2 h,40 ℃-2 h,50 ℃-2 h,真空压力50 Pa以下。在IFD过程中,同一批样品的取样时间点为真空冻结0.5 h、干燥后4、8、12 h,取样时先停止机器运行,解除真空后快速开仓取样,然后恢复机器运行,继续执行原干燥程序。
(2)CFD:将样品置于-40 ℃的低温冰柜中常压冻结4 h,再快速取出冻结物料置于干燥仓内,采用与IFD一致的升温程序。在CFD过程中,同一批样品的取样时间点为常压冻结4 h、干燥后4、8、12 h,冷冻干燥期间取样方法同上。
(3)AD:样品置于温度为60 ℃的干燥箱,烘干,通过前期发现,烘干9 h后物料湿基含水率在5%以下。在AD过程中,同一批样品的取样时间点为干燥后3、6、9 h。
1.4 指标测定
1.4.1 游离氨基酸含量的测定
(1)样品的制备
取新鲜榴莲及3种方法中不同干燥阶段的测试样品单元各3个分别进行制备处理。在有液氮的情况下冰浴研磨,加入10 mL氯仿-甲醇溶液[V(氯仿)∶V(甲醇)=15∶35]溶液,在冰上静置30 min,加6 mL的蒸馏水,10 000 r/min离心15 min,提取3次,合并上清液,溶液经0.45 μm滤膜过滤后待用。
(2)OPA衍等生化法
参照NANA等[9]方法稍作修改,量取标准溶液50 μL,加入250 μL 0.4 mol/L 硼酸盐缓冲液(pH 10.2),加50 μL OPA衍生剂,混匀,室温下静置2 min,经0.45 μm 滤膜过滤后,进行HPLC分析。
OPA衍生化溶液:称取15 mg OPA,加入1.5 mL 0.4 mol/L硼酸缓冲液(pH 10.2)和15 μL 3-巯基丙酸,4 ℃下冷藏。
氨基酸标准品配制:精取各氨基酸标准品,用超纯水稀释配制成不同浓度梯度的溶液,按上述方法进行衍生化,经HPLC分析后绘制标准曲线。
(3) 高效液相色谱法测定游离氨基酸含量
色谱条件:色谱柱 ZORBAX Eclipse-AAA (4.6 mm×150 mm,3.5 μm);柱温:40 ℃;流动相A[V(乙腈)∶V(甲醇)∶V(水)=45∶45∶10];流动相B(磷酸盐缓冲液,pH=7.8),梯度洗脱见表1;检测波长338 nm;流速2 mL/min;进样量20 mL。
表1 流动相梯度洗脱程序
Table 1 Elution gradient of the mobile phase
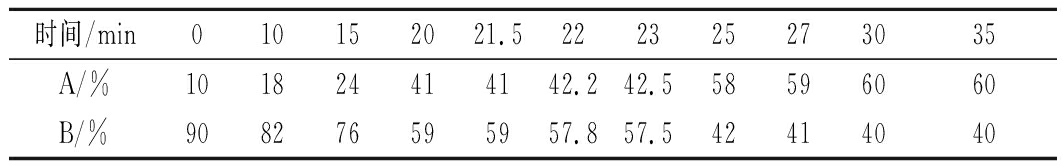
时间/min010152021.5222325273035A/%101824414142.242.558596060B/%908276595957.857.542414040
1.4.2 可溶性糖含量的测定
(1) 样品的制备
参照TAN[5]的方法稍作修改,取新鲜榴莲及3种方法中不同干燥阶段的测试样品单元各3个分别进行制备处理。加20 mL的蒸馏水研磨,70 ℃下水浴20 min,冷却后10 000 r/min离心15 min,提取3次,合并上清液,溶液经0.45 μm滤膜过滤后待用。
(2) 可溶性糖含量的测定
色谱条件:Series200 氨基柱 (250 nm× 4.6 nm,5 μm);柱温30 ℃;流动相:V(乙腈)∶V(水)=75∶25;流速1 mL/min;进样量10 μL。
(3) TAV的计算
滋味活性值反映了某一化合物对味道特征的贡献,用滋味物质样品的含量与其对应的味道阈值之比来表示[10]。
1.5 数据处理
游离氨基酸含量和可溶性糖含量均重复测定3次,取平均值,单位mg/g(新鲜榴莲)。采用SPSS 19.0对试验数据进行方差分析、PCA和聚类分析,利用Duncan′s法进行多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 三种干燥过程中榴莲游离氨基酸的组成含量及呈味分析
2.1.1 游离氨基酸的组成及含量变化
榴莲在3种干燥过程中游离氨基酸的组成含量变化如表2所示。新鲜榴莲及其不同干燥阶段包含了除色氨酸以外的苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、赖氨酸和苯丙氨酸7种必需氨基酸。以新鲜样品为对照,榴莲游离氨基酸总含量在IFD和CFD预冻结阶段(真空冻结0.5 h和常压冻结4 h)显著下降(P<0.05),在随后冷冻干燥过程中先上升后下降,IFD 8 h和CFD 8 h含量最高(P<0.05)。而随AD的进行,游离氨基酸总含量也呈先上升后下降的趋势(P<0.05),在AD 9 h时含量最低。分析认为,游离氨基酸含量在干燥过程中增加的原因可能是因为随干燥时间的延长和温度的升高,蛋白质在蛋白酶的作用下分解成氨基酸,同时氨基酸(如谷氨酸、天冬氨酸、丝氨酸等)自身也在不断释放所致[11];而在干燥后期,可能有部分游离氨基酸与还原糖发生少许美拉德反应致使游离氨基酸含量有所下降[12-13]。总体来说,新鲜与3种干燥样品(IFD 12 h、CFD 12 h、AD 9 h)的游离氨基酸总量由高到低依次是IFD>CFD和新鲜>AD,其中CFD干燥样品与新鲜样品无显著差异(P>0.05),AD干燥样品显著低于新鲜样品(P<0.05),可能是由于AD干燥后期阶段发生的Strecker降解和美拉德反应速度远大于氨基酸的生成速度。
表2 三种干燥方法过程中游离氨基酸的种类及含量变化 单位:mg/g
Table 2 Changes of free amino acid types and contents during the three drying methods
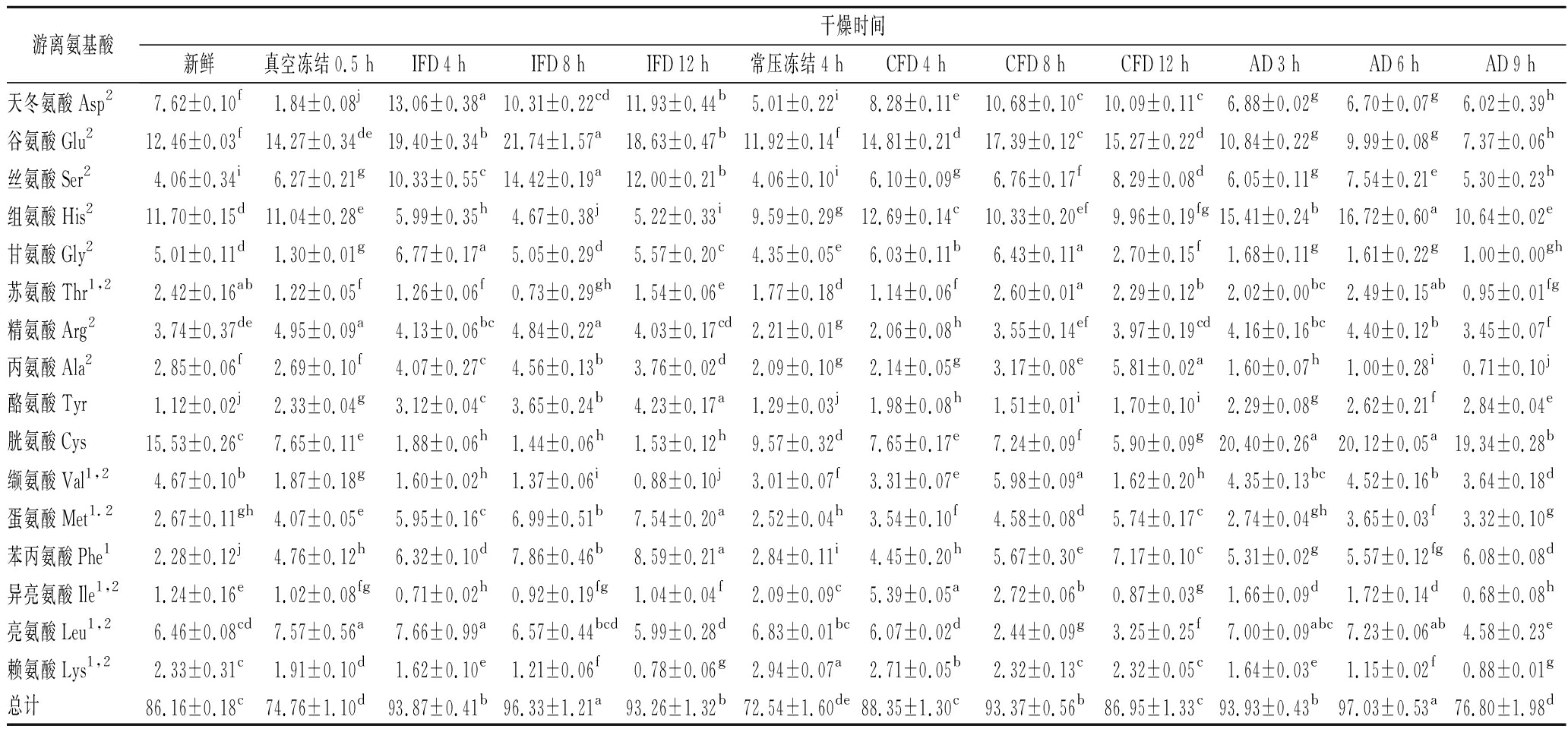
游离氨基酸干燥时间新鲜真空冻结0.5 hIFD 4 hIFD 8 hIFD 12 h常压冻结4 hCFD 4 hCFD 8 hCFD 12 hAD 3 hAD 6 hAD 9 h天冬氨酸Asp27.62±0.10f1.84±0.08j13.06±0.38a10.31±0.22cd11.93±0.44b5.01±0.22i8.28±0.11e10.68±0.10c10.09±0.11c6.88±0.02g6.70±0.07g6.02±0.39h谷氨酸Glu212.46±0.03f14.27±0.34de19.40±0.34b21.74±1.57a18.63±0.47b11.92±0.14f14.81±0.21d17.39±0.12c15.27±0.22d10.84±0.22g9.99±0.08g7.37±0.06h丝氨酸Ser24.06±0.34i6.27±0.21g10.33±0.55c14.42±0.19a12.00±0.21b4.06±0.10i6.10±0.09g6.76±0.17f8.29±0.08d6.05±0.11g7.54±0.21e5.30±0.23h组氨酸His211.70±0.15d11.04±0.28e5.99±0.35h4.67±0.38j5.22±0.33i9.59±0.29g12.69±0.14c10.33±0.20ef9.96±0.19fg15.41±0.24b16.72±0.60a10.64±0.02e甘氨酸Gly25.01±0.11d1.30±0.01g6.77±0.17a5.05±0.29d5.57±0.20c4.35±0.05e6.03±0.11b6.43±0.11a2.70±0.15f1.68±0.11g1.61±0.22g1.00±0.00gh苏氨酸Thr1,22.42±0.16ab1.22±0.05f1.26±0.06f0.73±0.29gh1.54±0.06e1.77±0.18d1.14±0.06f2.60±0.01a2.29±0.12b2.02±0.00bc2.49±0.15ab0.95±0.01fg精氨酸Arg23.74±0.37de4.95±0.09a4.13±0.06bc4.84±0.22a4.03±0.17cd2.21±0.01g2.06±0.08h3.55±0.14ef3.97±0.19cd4.16±0.16bc4.40±0.12b3.45±0.07f丙氨酸Ala22.85±0.06f2.69±0.10f4.07±0.27c4.56±0.13b3.76±0.02d2.09±0.10g2.14±0.05g3.17±0.08e5.81±0.02a1.60±0.07h1.00±0.28i0.71±0.10j酪氨酸Tyr1.12±0.02j2.33±0.04g3.12±0.04c3.65±0.24b4.23±0.17a1.29±0.03j1.98±0.08h1.51±0.01i1.70±0.10i2.29±0.08g2.62±0.21f2.84±0.04e胱氨酸Cys15.53±0.26c7.65±0.11e1.88±0.06h1.44±0.06h1.53±0.12h9.57±0.32d7.65±0.17e7.24±0.09f5.90±0.09g20.40±0.26a20.12±0.05a19.34±0.28b缬氨酸Val1,24.67±0.10b1.87±0.18g1.60±0.02h1.37±0.06i0.88±0.10j3.01±0.07f3.31±0.07e5.98±0.09a1.62±0.20h4.35±0.13bc4.52±0.16b3.64±0.18d蛋氨酸Met1.22.67±0.11gh4.07±0.05e5.95±0.16c6.99±0.51b7.54±0.20a2.52±0.04h3.54±0.10f4.58±0.08d5.74±0.17c2.74±0.04gh3.65±0.03f3.32±0.10g苯丙氨酸Phe12.28±0.12j4.76±0.12h6.32±0.10d7.86±0.46b8.59±0.21a2.84±0.11i4.45±0.20h5.67±0.30e7.17±0.10c5.31±0.02g5.57±0.12fg6.08±0.08d异亮氨酸Ile1,21.24±0.16e1.02±0.08fg0.71±0.02h0.92±0.19fg1.04±0.04f2.09±0.09c5.39±0.05a2.72±0.06b0.87±0.03g1.66±0.09d1.72±0.14d0.68±0.08h亮氨酸Leu1,26.46±0.08cd7.57±0.56a7.66±0.99a6.57±0.44bcd5.99±0.28d6.83±0.01bc6.07±0.02d2.44±0.09g3.25±0.25f7.00±0.09abc7.23±0.06ab4.58±0.23e赖氨酸Lys1,22.33±0.31c1.91±0.10d1.62±0.10e1.21±0.06f0.78±0.06g2.94±0.07a2.71±0.05b2.32±0.13c2.32±0.05c1.64±0.03e1.15±0.02f0.88±0.01g总计86.16±0.18c74.76±1.10d93.87±0.41b96.33±1.21a93.26±1.32b72.54±1.60de88.35±1.30c93.37±0.56b86.95±1.33c93.93±0.43b97.03±0.53a76.80±1.98d
注:上标1为必需氨基酸,上标2为呈味氨基酸;表中同一行不同小写字母表示有显著差异(P<0.05)
2.1.2 游离氨基酸的呈味特征和TAV分析
根据味觉强度将游离氨基酸分为三类:鲜味、甜味、苦味氨基酸[14]。其中鲜味氨基酸包括天冬氨酸、谷氨酸和赖氨酸;甜味氨基酸包括苏氨酸、丝氨酸、甘氨酸、丙氨酸和组氨酸;苦味氨基酸包括缬氨酸、异亮氨酸、亮氨酸、精氨酸和蛋氨酸。新鲜及3种干燥榴莲样品的呈味氨基酸含量如表3所示。三类味觉氨基酸含量在新鲜样品中排序为甜味>鲜味>苦味,差异显著(P<0.05);在IFD样品中排序为鲜味>甜味>苦味,差异显著(P<0.05);在CFD样品中排序为甜味>鲜味>苦味,差异显著(P<0.05);在AD样品中甜味氨基酸含量显著高于鲜味和苦味氨基酸(P<0.05)。在不同样品中,鲜味氨基酸含量由高到低依次为IFD、CFD、新鲜、AD,差异显著(P<0.05);甜味氨基酸含量IFD、CFD样品最高且未见显著差异,新鲜样品次之,AD样品最低(P<0.05);苦味氨基酸含量新鲜和IFD样品未见差异,CFD和AD样品未见差异,前两者明显较高(P<0.05)。总体来说,IFD样品的3种味觉氨基酸均为最高。
表3 新鲜及3种干燥榴莲样品的呈味游离氨基酸的含量 单位:mg/g
Table 3 Contents of flavored free amino acids in
the fresh and the three kinds of dried durian samples

类别新鲜IFDCFDAD鲜味氨基酸22.41±0.30cB31.34±0.76aA27.68±0.17bB14.27±0.34dB甜味氨基酸26.04±0.19bA28.09±0.63aB29.05±0.34aA18.60±0.23cA苦味氨基酸18.78±0.61aC19.48±0.33aC15.45±0.27bC15.67±1.98bB
注:表中同行同一指标用不同小写字母表示差异显著,同一列用不同大写字母表示差异显著(P<0.05)
氨基酸含量越高不一定对食品的味道贡献越大。通常利用TAV来表征味觉氨基酸的呈味特征,当TAV≥1时,则该呈味氨基酸对样品有显著的呈味效果,当TAV<1时,该呈味氨基酸对样品无显著效果[10]。新鲜和3种干燥榴莲样品的主要特征味觉氨基酸TAV值计算结果如表4所示。就整体而言,4种榴莲样品中谷氨酸、组氨酸、氮氨酸、精氨酸TAV值均相对较高,对样品风味贡献较大,苏氨酸TAV值很低,对样品风味贡献相对较小。
表4 新鲜榴莲及3种干燥样品呈味游离氨基酸的味道强度值TAV
Table 4 TAV values of free amino acids in the fresh and the three kinds of dried durian samples
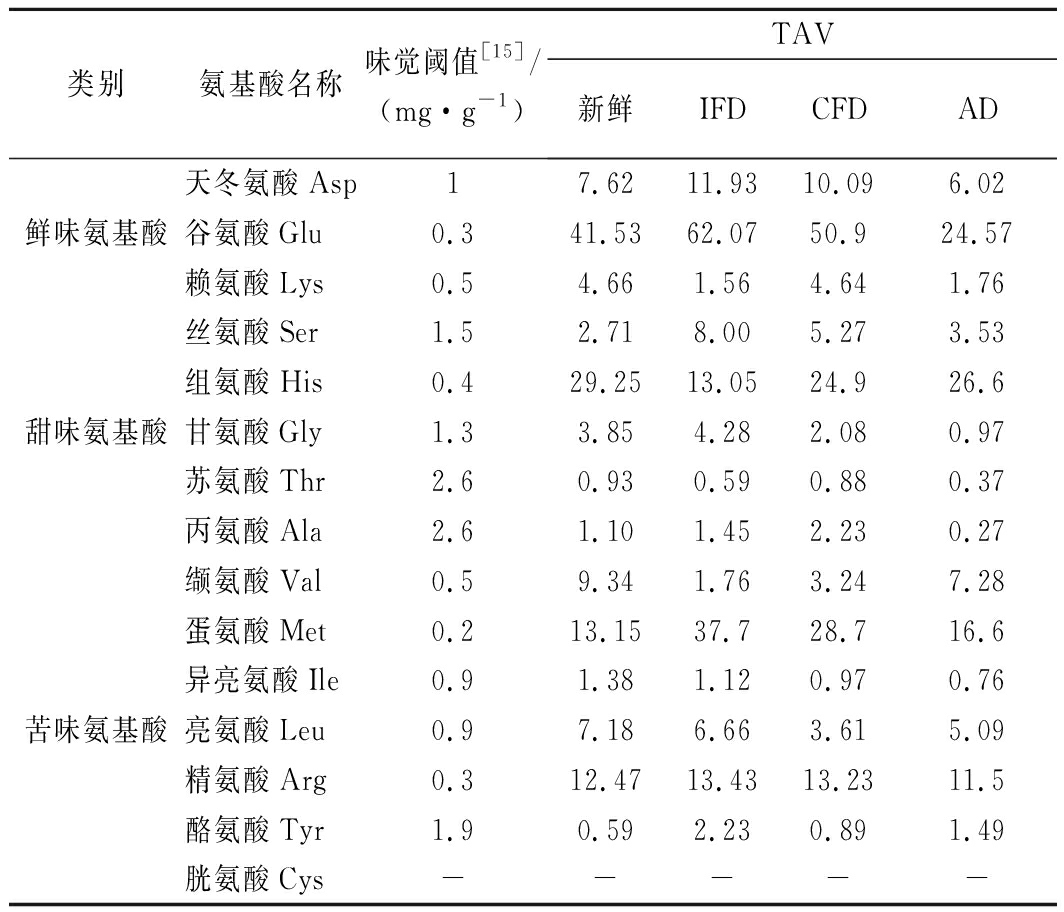
类别氨基酸名称味觉阈值[15]/(mg·g-1)TAV新鲜IFDCFDAD天冬氨酸Asp17.6211.9310.096.02鲜味氨基酸谷氨酸Glu0.341.5362.0750.924.57赖氨酸Lys0.54.661.564.641.76丝氨酸Ser1.52.718.005.273.53组氨酸His0.429.2513.0524.926.6甜味氨基酸甘氨酸Gly1.33.854.282.080.97苏氨酸Thr2.60.930.590.880.37丙氨酸Ala2.61.101.452.230.27缬氨酸Val0.59.341.763.247.28蛋氨酸Met0.213.1537.728.716.6异亮氨酸Ile0.91.381.120.970.76苦味氨基酸亮氨酸Leu0.97.186.663.615.09精氨酸Arg0.312.4713.4313.2311.5酪氨酸Tyr1.90.592.230.891.49胱氨酸Cys-----
注:表格中“-”表示未检出
在新鲜榴莲中,谷氨酸和组氨酸的TAV值明显高于其他氨基酸,说明对新鲜榴莲风味贡献最大的氨基酸是鲜味氨基酸和甜味氨基酸,而经过IFD、CFD后榴莲样品谷氨酸TAV值均明显增加,呈鲜味特征更加明显,经过AD后样品谷氨酸TAV值明显下降,鲜味特征减弱。
新鲜榴莲样品中蛋氨酸、精氨酸对苦味贡献相对较高,经过IFD、CFD后蛋氨酸TAV值均显著增加,但榴莲冻干后并没有产生令人不愉快的苦味,这可能是由于在复杂的基质中各种呈味物质之间出现的抑制和消杀作用,使其他的呈味物质掩盖了苦味物质,如天然的L型精氨酸有增加呈味复杂性和提高鲜味的作用[15]。从整体风味来说,在榴莲FD样品的特征氨基酸风味是鲜、甜味,AD样品呈鲜味的谷氨酸TAV值下降,呈甜味的组氨酸TAV值最高,AD样品整体表现为甜味。
2.2 三种干燥过程中榴莲可溶性糖含量及呈味分析
2.2.1 干燥过程中榴莲可溶性糖含量的变化
3种干燥过程中榴莲可溶性糖含量的变化如表5所示。榴莲中主要可溶性糖由高到低依次为蔗糖、葡萄糖、果糖和麦芽糖(P<0.05),这一结果与TAN等[5]对7个克隆榴莲检测的结果相似。在IFD、CFD和AD这3种干燥过程中,榴莲可溶性糖总含量均随着干燥时间逐渐降低(P<0.05),其中蔗糖含量变化最大。榴莲可溶性糖含量在IFD和CFD过程中明显下降,其原因可能是由于随着冷冻干燥的进行,细胞组织内可溶性糖浓度逐渐增加,在糖代谢相关酶活性和环境温度的共同作用下,可溶性糖可能会发生分解转化,或者参与其他物质反应,降低了榴莲中可溶性糖类物质含量[16-17]。可溶性糖含量在AD过程中不断降低,一方面可能是因为热风温度高、干燥速度速率快,导致可溶性糖在高温下发生降解,另一方面可能是由于热风干燥环境氧气充足,加快了可溶性糖与氨基化合物的美拉德反应,产生焦糖化现象,颜色变成棕褐色,致使可溶性糖物质含量下降[18]。
表5 三种干燥过程中可溶性糖的种类及含量变化 单位:mg/g
Table 5 Changes of soluble sugar types and contents during
the three drying methods
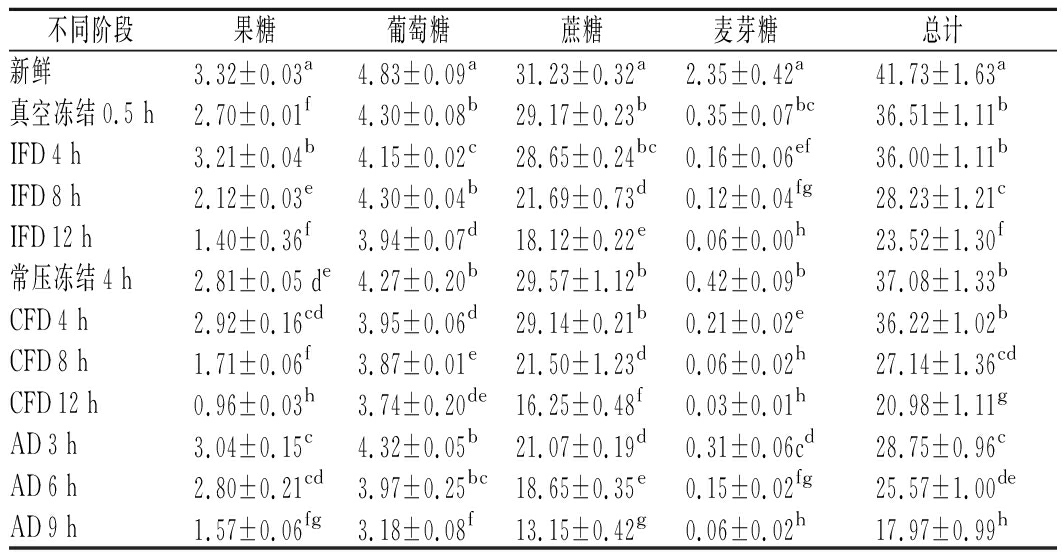
不同阶段果糖葡萄糖蔗糖麦芽糖总计新鲜3.32±0.03a4.83±0.09a31.23±0.32a2.35±0.42a41.73±1.63a真空冻结0.5 h2.70±0.01f4.30±0.08b29.17±0.23b0.35±0.07bc36.51±1.11bIFD 4 h3.21±0.04b4.15±0.02c28.65±0.24bc0.16±0.06ef36.00±1.11bIFD 8 h2.12±0.03e4.30±0.04b21.69±0.73d0.12±0.04fg28.23±1.21cIFD 12 h1.40±0.36f3.94±0.07d18.12±0.22e0.06±0.00h23.52±1.30f常压冻结4 h2.81±0.05 de4.27±0.20b29.57±1.12b0.42±0.09b37.08±1.33bCFD 4 h2.92±0.16cd3.95±0.06d29.14±0.21b0.21±0.02e36.22±1.02bCFD 8 h1.71±0.06f3.87±0.01e21.50±1.23d0.06±0.02h27.14±1.36cdCFD 12 h0.96±0.03h3.74±0.20de16.25±0.48f0.03±0.01h20.98±1.11gAD 3 h3.04±0.15c4.32±0.05b21.07±0.19d0.31±0.06cd28.75±0.96cAD 6 h2.80±0.21cd3.97±0.25bc18.65±0.35e0.15±0.02fg25.57±1.00deAD 9 h1.57±0.06fg3.18±0.08f13.15±0.42g0.06±0.02h17.97±0.99h
注:表中同一列不同小写字母表示差异显著(P<0.05)
2.2.2 榴莲干燥样品可溶性糖TAV分析
由表6可以看出,3种干燥样品的可溶性糖总量均显著低于新鲜样品,含量由高到低依次为新鲜、IFD、CFD、AD,差异均显著(P<0.05)。新鲜榴莲经过不同干燥处理后,所含的各类可溶性糖可能发生了不同程度的降解、羰氨反应、酶促反应等化学变化,物质含量下降。而IFD从冻结到干燥全过程均处于低温真空低氧的环境中,而且其冻结速度极快,物料中冰晶形成细小均匀,可溶性糖在组织中分布相对均匀,可能减缓了可溶性糖的化学反应速度,因此其含量最高[19];CFD在常压条件下冷冻4 h,其冷冻速度慢,冰晶体较大,可溶性糖组分可能会在组织中出现局部高浓度聚集,同时环境中有大量氧气存在,可能导致可溶性糖在冻结阶段参与各类化学反应的速度比IFD相对较高,因此其含量显著低于IFD[19];AD干燥样品可溶性糖含量最低,可能是由于热风干燥过程中的高温、高氧等强烈作用条件引起可溶性糖物质转变损失。PEI等[20]、吴方宁[4]研究发现冷冻干燥有利于保留双孢菇和白玉菇中的可溶糖,与本研究结果相似。通过比较已有文献中的可溶性糖味觉阈值发现[21-22],蔗糖阈值最小,其在甜度值中贡献最大,因此蔗糖是决定榴莲甜度风味的主要因子。在已知的3种可溶性糖TAV值中,4种榴莲样品由高到低依次是新鲜、IFD、CFD、AD,且蔗糖TAV值显著高于葡萄糖和果糖。
表6 新鲜榴莲及3种干燥样品可溶性糖TAV值
Table 6 The soluble sugar contents and TAVs of the fresh and the three kinds of dried durian samples
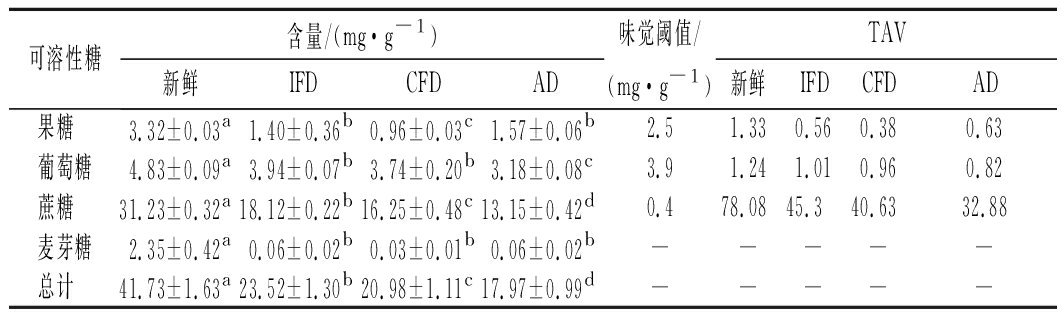
可溶性糖含量/(mg·g-1)味觉阈值/TAV新鲜IFDCFDAD(mg·g-1)新鲜IFDCFDAD果糖 3.32±0.03a1.40±0.36b0.96±0.03c1.57±0.06b2.51.330.560.380.63葡萄糖4.83±0.09a3.94±0.07b3.74±0.20b3.18±0.08c3.91.241.010.960.82蔗糖 31.23±0.32a18.12±0.22b16.25±0.48c13.15±0.42d0.478.0845.340.6332.88麦芽糖2.35±0.42a0.06±0.02b0.03±0.01b0.06±0.02b—————总计 41.73±1.63a23.52±1.30b20.98±1.11c17.97±0.99d—————
注:表中同一行用不同小写字母表示显著(P<0.05);“-”表示未检出
2.3 PCA
对3种干燥过程中榴莲游离氨基酸和可溶性糖进行PCA,结果见表7、表8。由表7可知,由于前5个主成分对应特征值均大于1,累计方差贡献率为91.378%,故可选取前5个主成分。5个主成分的方差贡献率分别为41.181%、20.588%、14.561%、9.057%和5.992%,说明5个主成分反映了游离氨基酸和可溶性糖的大部分信息,其中第1主成分对榴莲风味影响最大。由表8可知,在第1主成分中载荷绝对值大于0.7的有Glu、Ser、His、Cys、Val、Tyr、Met、Phe,包括了3种鲜甜味氨基酸和一半的苦味氨基酸;第2主成分中载荷绝对值大于0.7的有Gly、葡萄糖、蔗糖,主要呈甜味因子;第3主成分中载荷绝对值最大的前2位是Leu(苦)、Arg(苦),主要是苦味因子;第4主成分中载荷绝对值最大的前2位是Thr(甜)、Arg(苦);第5主成分中载荷绝对值最大的前2位是Asp(鲜)、Val(苦)。
表7 总方差分解结果
Table 7 Total variance decomposition results
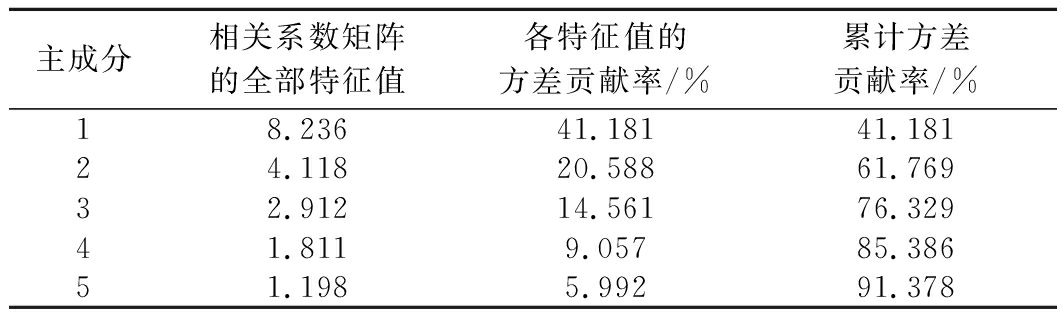
主成分相关系数矩阵的全部特征值各特征值的方差贡献率/%累计方差贡献率/%18.23641.18141.18124.11820.58861.76932.91214.56176.32941.8119.05785.38651.1985.99291.378
表8 游离氨基酸与可溶性糖的主成分载荷
Table 8 The main component loading of free amino
acids and soluble sugars
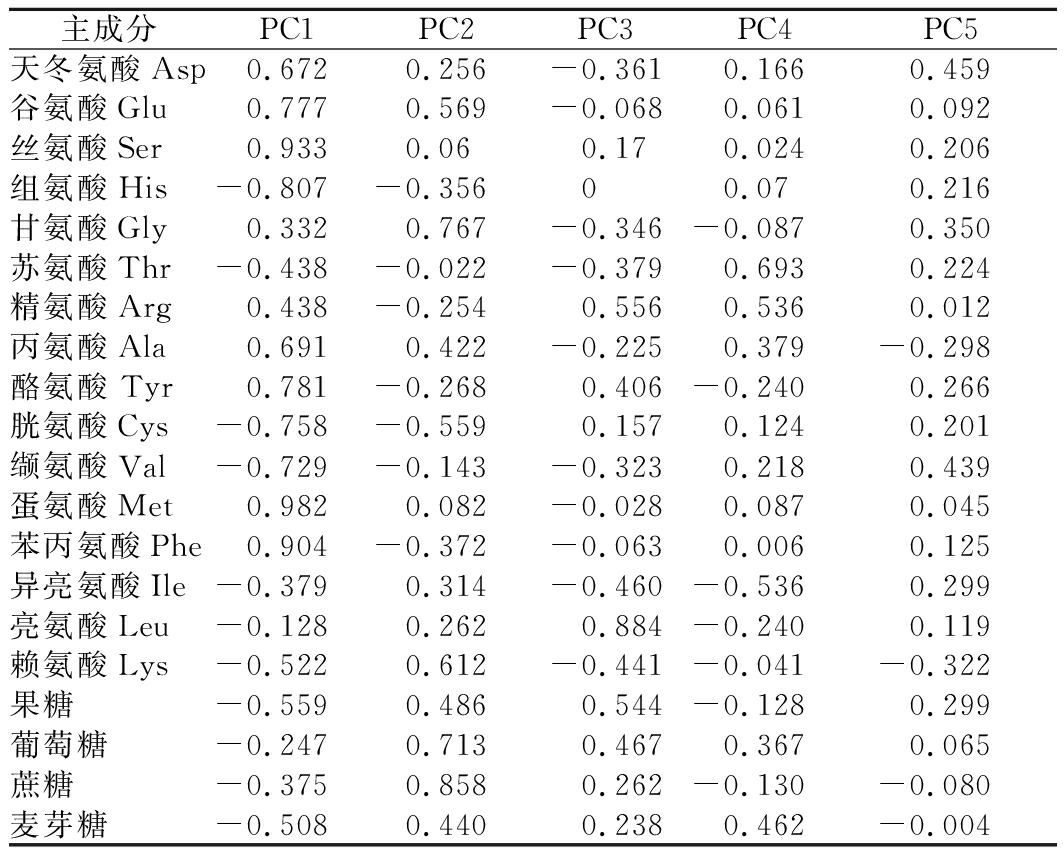
主成分PC1PC2PC3PC4PC5天冬氨酸Asp0.6720.256-0.3610.1660.459谷氨酸Glu0.7770.569-0.0680.0610.092丝氨酸Ser0.9330.060.170.0240.206组氨酸His-0.807-0.35600.070.216甘氨酸Gly0.3320.767-0.346-0.0870.350苏氨酸Thr-0.438-0.022-0.3790.6930.224精氨酸Arg0.438-0.2540.5560.5360.012丙氨酸Ala0.6910.422-0.2250.379-0.298酪氨酸 Tyr0.781-0.2680.406-0.2400.266胱氨酸Cys-0.758-0.5590.1570.1240.201缬氨酸Val-0.729-0.143-0.3230.2180.439蛋氨酸Met0.9820.082-0.0280.0870.045苯丙氨酸Phe0.904-0.372-0.0630.0060.125异亮氨酸Ile-0.3790.314-0.460-0.5360.299亮氨酸Leu-0.1280.2620.884-0.2400.119赖氨酸Lys-0.5220.612-0.441-0.041-0.322果糖-0.5590.4860.544-0.1280.299葡萄糖-0.2470.7130.4670.3670.065蔗糖-0.3750.8580.262-0.130-0.080麦芽糖-0.5080.4400.2380.462-0.004
以16个游离氨基酸和4个可溶性糖的指标为初始自变量,经主成分分析后可以得出5个主成分因子的方程表达式F1、F2、F3、F4、F5。5个主成分分别从不同方面反映不同干燥过程中榴莲游离氨基酸和可溶性糖的总体水平,以各主成分对应的相对方差贡献率作为权重,对5个主成分得分进行加权求和,以评价函数(F=0.451F1+0.225F2+0.159F3+0.099F4+0.066F5)计算各榴莲样品的综合得分,用以反映榴莲中游离氨基酸和可溶性糖的综合质量,结果见表9。IFD 8 h、IFD 12 h、IFD 4 h榴莲样品综合得分位列前3位,其中IFD 8 h榴莲样品得分最高,其游离氨基酸和可溶性糖的综合质量较高;CFD 12 h、CFD 8 h、CFD 4 h榴莲样品综合得分位列中间:而AD 9 h、AD 6 h、AD 3 h榴莲样品综合得分处于后段,其游离氨基酸和可溶性糖综合质量较低。
表9 三种干燥过程中榴莲主成分得分和综合得分
Table 9 The component scores and comprehensive scores of durian during the three drying processes
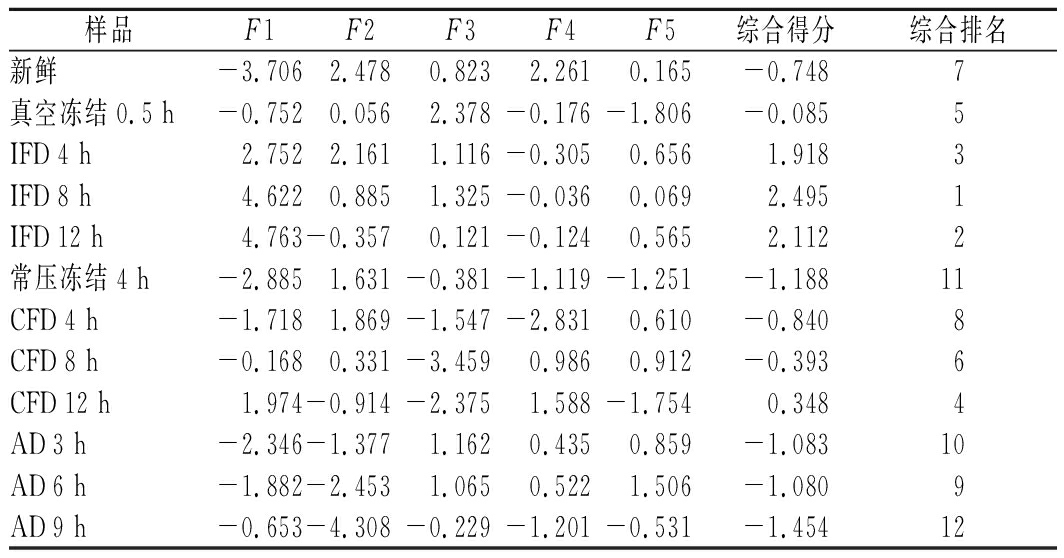
样品F1F2F3F4F5综合得分综合排名新鲜-3.7062.4780.8232.2610.165-0.7487真空冻结0.5 h-0.7520.0562.378-0.176-1.806-0.0855IFD 4 h2.7522.1611.116-0.3050.6561.9183IFD 8 h4.6220.8851.325-0.0360.0692.4951IFD 12 h4.763-0.3570.121-0.1240.5652.1122常压冻结4 h-2.8851.631-0.381-1.119-1.251-1.18811CFD 4 h-1.7181.869-1.547-2.8310.610-0.8408CFD 8 h-0.1680.331-3.4590.9860.912-0.3936CFD 12 h1.974-0.914-2.3751.588-1.7540.3484AD 3 h-2.346-1.3771.1620.4350.859-1.08310AD 6 h-1.882-2.4531.0650.5221.506-1.0809AD 9 h-0.653-4.308-0.229-1.201-0.531-1.45412
2.4 聚类分析
为了进一步分析在3种干燥过程中榴莲游离氨基酸和可溶性糖物质变化的特征,将所有样品进行聚类分析,结果如图1所示。在接近距离5处所有的样品聚为四类,每类中各样品最相似。第Ⅰ类为AD 3 h、AD 6 h、AD 9 h,均为热风干燥样品;第Ⅱ类为新鲜、常压冻结4 h、真空冻结0.5 h、CFD 4 h,为新鲜样品、冻结后样品和CFD初期样品,说明此阶段样品的游离氨基酸和可溶性糖整体风味最为相似;第Ⅲ类为CFD 8 h、CFD 12 h,为CFD后期样品;第Ⅳ类为IFD 8 h、IFD 4 h、IFD 12 h,均为IFD中后期样品。在距离9左右时,将第Ⅲ与Ⅳ类归为一类,说明这两类样品的游离氨基酸和可溶性糖整体风味具有一定的相似度;在距离16左右时,将第Ⅱ类与第Ⅲ、Ⅳ类归为一类,说明第Ⅱ类与此两类样品的游离氨基酸和可溶性糖整体风味相似度较低;而在25左右时,才将第Ⅰ类与其他三类归为一类,说明第Ⅰ类与其他类样品的游离氨基酸和可溶性糖整体风味相似度最低。从聚类分析结果可知,3种不同干燥方法对榴莲样品游离氨基酸和可溶性糖风味产生一定差异,这与主成分分析的综合分析结果基本一致。

图1 三种干燥过程中榴莲样品聚类分析的树状图
Fig.1 Dendrogram of cluster analysis of durian samples during the three drying processes
3 结论
本试验分析了IFD、CFD、AD这3种干燥方法对榴莲样品的游离氨基酸和可溶性糖含量的影响。榴莲中游离氨基酸主要为甜味氨基酸和鲜味氨基酸,可溶性糖主要为蔗糖、葡萄糖、果糖和麦芽糖。新鲜榴莲在IFD和CFD中经过冻结后其游离氨基酸总含量显著下降(P<0.05),而在3种干燥过程中游离氨基酸总含量均呈先增后降的趋势。就榴莲干燥样品而言,游离氨基酸总含量IFD最高(P<0.05),CFD与新鲜样品无显著差异(P>0.05),AD最低(P<0.05);鲜味氨基酸含量IFD、CFD均显著高于新鲜样品(P<0.05),AD最低;甜味氨基酸含量IFD、CFD与新鲜样品无显著差异(P>0.05),而AD显著低于新鲜样品。在3种干燥过程中榴莲可溶性糖总含量均呈下降趋势,新鲜榴莲经过3种干燥后可溶性糖总量由高到低分别是IFD、CFD、AD、新鲜样品,差异显著(P<0.05)。利用主成分分析提取出5种主成分,分别解释总变异量的41.181%、20.588%、14.561%、9.057%和5.992%,综合得分IFD样品相对较高、CFD样品次之、AD样品相对较低。通过聚类分析将12种榴莲样品分为四类,表明3种不同干燥方法对榴莲样品游离氨基酸和可溶性糖风味产生一定差异,与主成分分析结果基本一致。3种干燥方法中,IFD可使得榴莲干制品获得较高含量的游离氨基酸和可溶性糖,更有利于形成良好的风味品质,且其本身还具备工艺简化、设备一体化集成等优势,是生产高品质榴莲干燥制品的优选方法。本研究结论可为榴莲干制产品开发提供一定的理论依据。
[1] AN K J, ZHAO D D, WANG Z F, Et al.Comparison of different drying methods on Chinese ginger (Zingiber officinale Roscoe):Changes in volatiles, chemical profile, antioxidant properties, and microstructure[J].Food Chemistry, 2016, 197:1 292-1 300.
[2] 王海鸥, 谢焕雄, 陈守江, 等.不同干燥方法对柠檬片干燥特性及品质的影响[J].农业工程学报, 2017, 33(14):292-299.
WANG H O, XIE H X, CHEN S J, et al.Effect of different drying methods on drying characteristics and qualities of lemon slices[J].Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(14):292-299.
[3] 谷文静, 金英善, 郑睿林, 等.通电加热过程中凡纳滨对虾虾肉糜核苷酸及关联产物的变化[J].食品与发酵工业, 2020,46(11):199-209.
GU W J, JIN Y S, ZHENG R L, et al.Study on the changes of nucleotide and related com- pounds in minced Litopenaeus vannamei during ohmic heating[J].Food and Fermentation Industries, 2020, 46(11):199-209.
[4] 吴方宁.不同干燥方法对白玉蕈(White Hypsizygus marmoreus)风味物质的影响[D].南京:南京农业大学, 2014.
WU F N.The influence of drying methods on flavor components of White Hypsizygus marmoreus[D].Nanjing:Nanjing Agricultural University, 2014.
[5] TAN X Y, MISRAN A, CHEONG K W, et al.Postharvest quality indices of different durian clones at ripening stage and their volatile organic compounds[J].Scientia Horticulturae, 2020, 264:109-169.
[6] 刘冬英, 谢剑锋, 方少瑛,等.榴莲的营养成分分析[J].广东微量元素科学, 2004, 11(10):57-59.
LIU D Y, XIE J F, FANG S Y, et al.Analysis of nutritional components of durian[J].Guangdong Trace Element Science, 2004, 11(10):57-59.
[7] VOON Y Y, HAMID N S A, RUSUL G, et al.Characterisation of Malaysian durian (Durio zibethinus Murr.) cultivars:Relationship of physicochemical and flavour properties with sensory properties[J].Food Chemistry, 2007, 103(4):1 217-1 227.
[8] 黄梅桂, 余龙霞, 赵静雯,等.甜面酱中氨基酸营养价值及甜味分析[J].中国调味品, 2017, 42(7):11-15.
HUANG M J, YU L X, ZHAO J W, et al.Analysis of amino acid nutritional value and sweetness in Chinese traditional sweet fermented flour pastes(SFFPs)[J].China Condiment, 2017, 42(7):11-15.
[9] NANA L, YANG L, YUE Z.et al.Simultaneous HPLC determination of amino acids in tea infusion coupled to pre-column derivatization with 2,4-dinitrofluorobenzene[J].Food Analytical Methods, 2016, 9:1 307-1 314.
[10] ZHANG N L, WANG W L, LI B, et al.Non-volatile taste active compounds and umami evaluation in two aquacultured pufferfish (Takifugu obscurus and Takifugu rubripes)[J/OL].Food Bioscience, 2019.DOI:10.1016/j.fbio.2019.100 468.
[11] YONEDA C, OKUBO K, KASAI M, et al.Extractive components of boiled-dried scallop adductor muscle and effect on the taste of soup after mixing with chicken leg meat[J].Journal of the science of Food & Agriculture, 2005, 85(5):809-816.
[12] LI Q, ZHANG H H, CLAVER I P, et al.Effect of different cooking methods on the flavour constituents of mushroom (Agaricus bisporus(Lange) Sing) soup[J].International Journal of Food Science & Technology,2011,46(5):1 100-1 108.
[13] MES AS M, WAGNER M, GEORGE S, et al.Impact of conventional sterilization and ohmic heating on the amino acid profile in vegetable baby foods[J].Innovative Food Science & Emerging Technologies, 2016, 34:24-28.
AS M, WAGNER M, GEORGE S, et al.Impact of conventional sterilization and ohmic heating on the amino acid profile in vegetable baby foods[J].Innovative Food Science & Emerging Technologies, 2016, 34:24-28.
[14] 余昌霞, 陈明杰, 李传华, 等.不同培养基质对草菇营养成分及呈味物质的影响[J].菌物学报, 2018, 37(12):179-188.
YU C X, CHEN M J, LI C H, et al.Effects of culture substrates on nutritional and flavor components of Volvariella volvacea[J].Research Paper, 2018,37(12):179-188.
[15] 黄明泉, 王璐, 张璟琳, 等.甜面酱的鲜味成分分析[J].现代食品科技, 2015, 31(2):285-293.
HUANG M Q, WANG L, ZHANG J L, et al.Analysis of umami components in sweet bean sauce[J].Modern Food Science and Technology, 2015,31(2):285-293.
[16] 姜雪, 张敏, 赵昱瑄,等.不同初始机体温度对热水处理西葫芦果实低温贮藏品质和活性氧代谢的影响[J].食品与发酵工业, 2020, 46(5):231-239.
JIANG X, ZHANG M, ZHAO Y X, et al.Effects of different initial body temperatures on low-temperature storage quality and active oxygen metabolism of hot water treated zucchini fruit[J].Food and Fermentation Industries, 2020,46(5):231-239.
[17] 邵婷婷, 姜雪, 张敏,等.贮前强制对流热空气处理对低温胁迫下青椒果实AsA-GSH循环代谢的影响[J].食品与发酵工业, 2019, 44(18):65-72.
SHAO T T, JIANG X, ZHANG M, et al.Effect of forced convective hot air treatment on AsA-GSH cycle metabolism of green pepper fruits under low temperature stress[J].Food and Fermentation Industries, 2019,44(18):65-72.
[18] 杨调调, 何志勇, 秦昉,等.美拉德反应对产品风味品质的影响及其衍生危害物研究进展[J].食品安全质量检测学报, 2017(3):134-141.
YANG T T, HE Z Y, QIN F, et al.Research progress of the effects of Maillard reaction on flavor and quality of products as well as derivatized harmful substances[J].Journal of Food Safety and Quality, 2017(3):134-141.
[19] 侯会, 陈鑫, 方东路,等.干燥方法对食用菌风味物质影响研究进展[J].食品安全质量检测学报, 2019,10(15):4 877-4 883.
HOU H, CHEN X, FANG D L, et al.Research progress on influence of drying methods on flavor compounds of edible fungus[J].Journal of Food Safety and Quality, 2019,10(15):4 877-4 883.
[20] PEI F, SHI Y, GAO X, et al.Changes in non-volatile taste components of button mushroom (Agaricus bisporus) during different stages of freeze drying and freeze drying combined with microwave vacuum drying[J].Food Chemistry, 2014, 165:547-554.
[21] 李雪, 冯涛, 宋诗清, 等.不同处理方法对蟹味菇呈味物质释放的影响[J].食品科学, 2020, 41(10):198-205.
LI X, FENG T, SONG S Q, et al.Effect of different pretreatment methods on the release of flavor substances from Hypsizygus marmoreus[J].Food Science, 2020,41(10):198-205.
[22] HUFNAGEL J C, HOFMANN T.Quantitative reconstruction of the nonvolatile sensometabolome of a red wine[J].Journal of Agricultural and Food Chemistry, 2008, 56(19):9 190-9 199.