蕨麻(Potentilla anserina L.),蔷薇科鹅绒委陵菜植物的块根,主要分布于东北、华北和西北地区,遍布于海拔3 000 m以上、辐射强度达45 W/m2的青藏高原地区,是藏区人民重要的药食两用植物[1]。据《新华本草纲要》论证青藏高原生长的蕨麻发育极佳,药性最佳。在藏文中蕨麻又称“延寿草”、“仙人果”、“戳玛”等。其药性在许多药学典籍中均有记载,例如《四部医典》、《月王药诊》、《藏药志》、《中国藏药》等。中医认为蕨麻性甘、温,具有益补血气、益胃健脾、兼有止血、止咳之功效,常用于治疗缺血、吐血、腹泻、肝炎、脾胃虚弱等症[2]。在民间人们除了用其治病,更多的是当作养生补血的保健食品。现今随着“绿色医药”的概念深入人心,蕨麻作为一种药食两用的保健食品,市场需求量日益扩增,经济价值有增无减,但是大部分蕨麻仍以原材料形式发挥其保健功效,缺乏对其有效成分的深入开发利用。
随着近年来生物科技的进步,人们对蕨麻有效成分也进行了一定的研究,发现多糖、单宁、黄酮、三萜等有效成分均具有一定的生理活性[3]。对蕨麻多糖的药理研究发现,其可以显著提高机体的抗氧化能力并通过提高免疫细胞数目、增加胸腺和脾脏指数、抑制血清IL-10和IFN-γ水平保护环磷酰胺对小鼠免疫系统的损伤[4-6],具有良好的开发利用价值。目前,蕨麻多糖的提取方法集中于热水回流提取法、超声波提取法和复合酶提取法,未见双水相提取技术应用于蕨麻多糖的研究报道[7-8]。而双水相萃取因具条件温和、提取高效、操作简单、活性损失小、无有机溶剂残留等优点,已广泛应用于各种蛋白质纯化和抗生素提取[9-10]。本研究采用乙醇-无机盐双水相体系,以克服传统聚合物双水相体系成本高、分离时间长、易乳化、难回收等缺点,通过耦合超声波提高蕨麻多糖的提取率,并初步研究超声波辅助双水相提取方法对蕨麻多糖生物活性的影响,以期为蕨麻多糖工业化提取提供理论技术支持。
1 材料与方法
1.1 材料与试剂
蕨麻,甘肃甘南藏族自治洲,自然晾干,干燥密封保存;无水乙醇、石油醚、苯酚、浓硫酸等(均为分析纯),烟台市双双化工有限公司。
1.2 仪器与设备
N-1100旋转蒸发器,东京理化器械株式会社;KQ-250DE超声波清洗机,昆山超声波仪器有限公司;UV-2700紫外分光光度计,日本岛津仪器有限公司;5804R冷冻离心机,艾本德仪器有限公司。
1.3 实验方法
1.3.1 蕨麻预处理
将蕨麻干燥的根,超微粉碎过100目筛,经石油醚索氏提取回流脱脂。将脱脂材料浸泡于80%(体积分数)的乙醇,多次换液,除去多酚、游离单糖、氨基酸等小分子。离心收集材料,除去乙醇,干燥备用。
1.3.2 超声波辅助双水相提取蕨麻多糖的工艺研究
称取5.0 g经过预处理的蕨麻粉末于锥形瓶中,加入一定量的乙醇-硫酸铵,待形成双水相体系后,放入超声波清洗器中,在一定的超声波条件下处理一定的时间,离心,收集双水相萃取的多糖液经4 ℃放置过夜,大部分硫酸铵结晶析出,透析减压浓缩,将无水乙醇加入多糖液,使其终浓度为80%(质量分数),醇沉24 h,下层沉淀用无水乙醇、丙酮洗涤多次,冷冻干燥后得到蕨麻多糖。总糖含量用苯酚-硫酸法测定,还原糖用硝基水杨酸法测定,多糖得率按公式(1)计算:
(1)
式中:Y表示多糖得率,%;C1为总糖质量浓度,mg/mL;N1为测定时总糖的稀释倍数;C0为还原糖质量浓度,mg/mL;N0为测定时还原糖的稀释倍数;V为提取液母液体积,mL;W为蕨麻原料质量,g。
1.3.2.1 单因素试验
(1)无水乙醇质量分数对蕨麻多糖提取率的影响
准确称取5 g蕨麻粉末5份,加入的无水乙醇质量分数分别为20%、30%、40%、50%、60%,在硫酸铵质量分数20%,料液比为1∶20,超声功率200 W,提取时间30 min条件下萃取,每次试验重复3次,取平均值计算多糖提取率。
(2)硫酸铵质量分数对蕨麻多糖提取的影响
准确称取5 g蕨麻粉5份,加入的硫酸铵质量分数分别为10%、15%、20%、25%、30%,在无水乙醇质量分数20%,料液比为1∶50,超声功率200 W,提取时间60 min条件下萃取,每次试验重复3次,取平均值计算多糖提取率。
(3)料液比值对对蕨麻多糖提取的影响
准确称取1 g蕨麻粉5份,分别设置料液比为1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL),在无水乙醇质量分数20%,硫酸铵质量分数为20%,超声功率200 W,提取时间60 min条件下萃取,每次试验重复3次,取平均值计算多糖提取率。
(4)超声功率对蕨麻多糖提取的影响
准确称取5 g蕨麻粉5份,分别设置超声功率为80、120、160、200、240 W,在无水乙醇质量分数20%,硫酸铵质量分数为20%,料液比为1∶20,提取时间60 min条件下萃取,每次试验重复3次,取平均值计算多糖提取率。
1.3.2.2 响应面试验
基于单因素实验的结果,确定了无水乙醇质量分数、硫酸铵质量分数、料液比和超声功率为工艺参数,以多糖提取率为指标,利用Box-Behnken的中心组合试验设计原理进行实验设计,优化提取工艺,评价影响多糖得率因素的主效应、相互效应及因素的二次效应关素,实验因素与水平设计见表1。
表1 Box-Behnken设计因素水平
Table 1 The levels of variables for the construction of Box-Behnken design (BBD)

水平因素无水乙醇质量分数(A)/%硫酸铵质量分数(B)/%料液比(C)(g∶mL)超声功率(D)/ W-120151∶15160030201∶20200140251∶25240
试验数据利用完全二次多项式方程进行多元线性回归拟合,计算多糖提取率和各实验因素之间的函数关系,如公式(2)所示:
(2)
式中:Y为预测的响应值,即多糖提取率;A0 是常数,Ai是线性系数,Aii是二次方系数,Aij 是交互作用回归系数;X和Xi是自变量。
1.3.3 蕨麻多糖的红外光谱分析
充分干燥的KBr和多糖样品以100∶1的质量比在干燥环境中,用玛瑙研钵充分混合研磨,压片后用Thermo Nicolet iS10红外光谱仪扫描,扫描范围:400~4 000 cm-1,分辨率4 cm-1,扫描次数16 次。
1.3.4 蕨麻多糖的单糖组成分析
准确称取多糖样品20 mg加入4 mL 4 mol/L三氟乙酸(trifluoroacetic acid,TFA),120 ℃氮气保护酸解10 h,减压蒸干TFA。酸解结束后加入10 mg盐酸羟胺和0.5 mL吡啶中90 ℃反应30 min反应生成糖肟,反应结束加入0.5 mL乙酸酐90 ℃乙酰化反应30 min生成糖腈乙酸酯衍生物,减压蒸干。
氯仿溶解上述反应产物后微滤膜过滤,气相色谱质谱联用仪(Thermo Focus GC-Polaris Q MS)上样。使用气相色谱柱为TR-5 ms SQC column。升温条件为:120 ℃保持3 min,以5 ℃/min升温至250 ℃保持5 min。检测器温度:250 ℃;进样口温度:250 ℃。载气为高纯氦气,柱流量为1.0 mL/min,分流比为1∶50。
标准单糖鼠李糖(rhamnose,Rha)、来苏糖(lyxose,Lyx)、阿拉伯糖(arabinose,Ara)、木糖(xylose,Xyl)、甘露糖(mannose,Man)、葡萄糖(glucose,Glc)以及半乳糖(galactose,Gal)的衍生化方法和色谱条件同上。
1.3.5 蕨麻多糖的体外抗氧化活性
1.3.5.1 超氧阴离子自由基清除活性测定
分别将蕨麻多糖和维生素C配制质量浓度为0.1、0.5、1.0、1.5、2.0 mg/mL的待测溶液,取1 mL待测溶液依次加入1 mL的557 μmol/L还原性辅酶 Ⅰ二钠、45 μmol/L吩嗪硫酸甲酯及108 μmol/L氯化硝基四氮唑蓝,混合均匀25 ℃反应5 min,510 nm处测吸光值,每个样品重复3次,按公式(3)计算超氧阴离子自由基清除率:
(3)
式中:Y表示超氧阴离子自由基清除率,%;Ai表示多糖和维生素C溶液510 nm下测得吸光值;A0表示蒸馏水510 nm下测得吸光值。
1.3.5.2 还原力测定
分别将蕨麻多糖和维生素C配制质量浓度为0.02、0.06、0.1、0.2、0.6、1、2 mg/mL的待测溶液。取1 mL待测溶液依次加入2.5 mL磷酸缓冲液(pH 6.6)和质量分数1%铁氰化钾溶液,混合均匀50 ℃反应20 min,加入2.5 mL质量分数10%的三氯乙酸溶液混合均匀,1 000 r/min离心10 min,取上清液2.5 mL,依次加入2.5 mL蒸馏水和质量分数0.1%的氯化铁溶液混合均匀,静置10 min,700 nm处测定吸光值,每个样品重复3次。
1.4 数据统计
所有数据均表示为平均值±标准差。运用GraphPad Prism 8.0绘制实验数据相关图片。采用SPSS 18.0和 Design-Expert 8.0 数据处理系统进行统计分析。P<0.05或P<0.01表示差异具有统计学意义。
2 结果与分析
2.1 单因素试验结果
2.1.1 无水乙醇质量分数对蕨麻多糖提取率的影响
无水乙醇质量分数对蕨麻多糖提取率的影响见图1。当无水乙醇质量分数小于30%时,蕨麻多糖提取率随着无水乙醇质量分数的升高呈现上升趋势;当无水乙醇质量分数超过30%时,蕨麻多糖提取率随着无水乙醇质量分数的升高呈现下降趋势,因此,无水乙醇质量分数为30%为最佳提取参数。
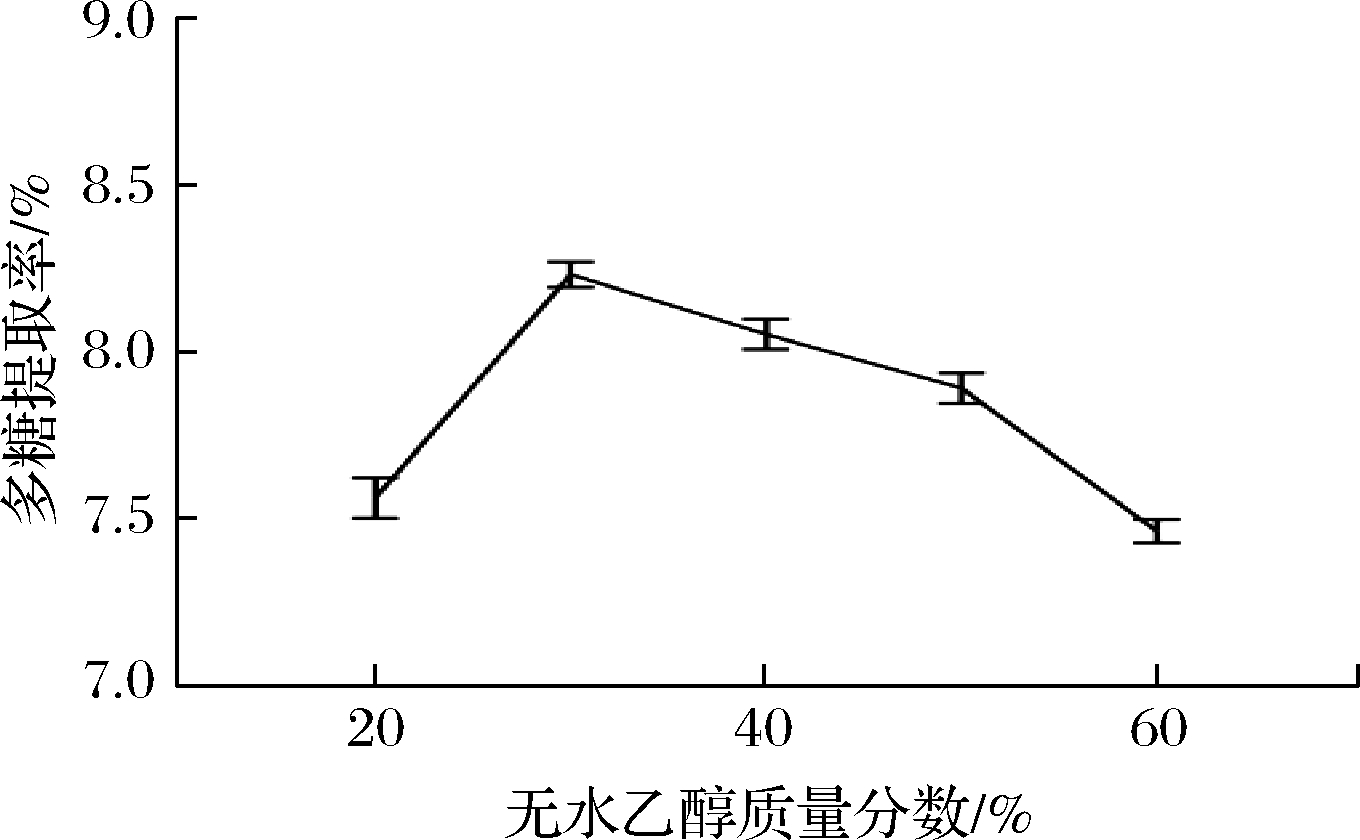
图1 无水乙醇质量分数对蕨麻多糖提取率的影响
Fig.1 Effect of ethanol concentration on extraction yield of Potentilla anserina L.polysaccharide
2.1.2 硫酸铵质量分数对蕨麻多糖提取的影响
图2表示硫酸铵质量分数对蕨麻多糖提取的影响,当硫酸铵质量分数在10%~20%时,多糖提取率随硫酸铵质量分数增大而增加,当达到20%时,多糖提取率达到最高,而后,硫酸铵质量分数再增加,多糖提取率降低。这是因为开始时随硫酸铵用量的增加会增强双水相的析出作用,提高多糖的提取率,当硫酸铵质量分数过高时,共沉淀现象增加,减少盐相中的多糖含量[11]。因此,硫酸铵质量分数为20%为最佳的提取参数。
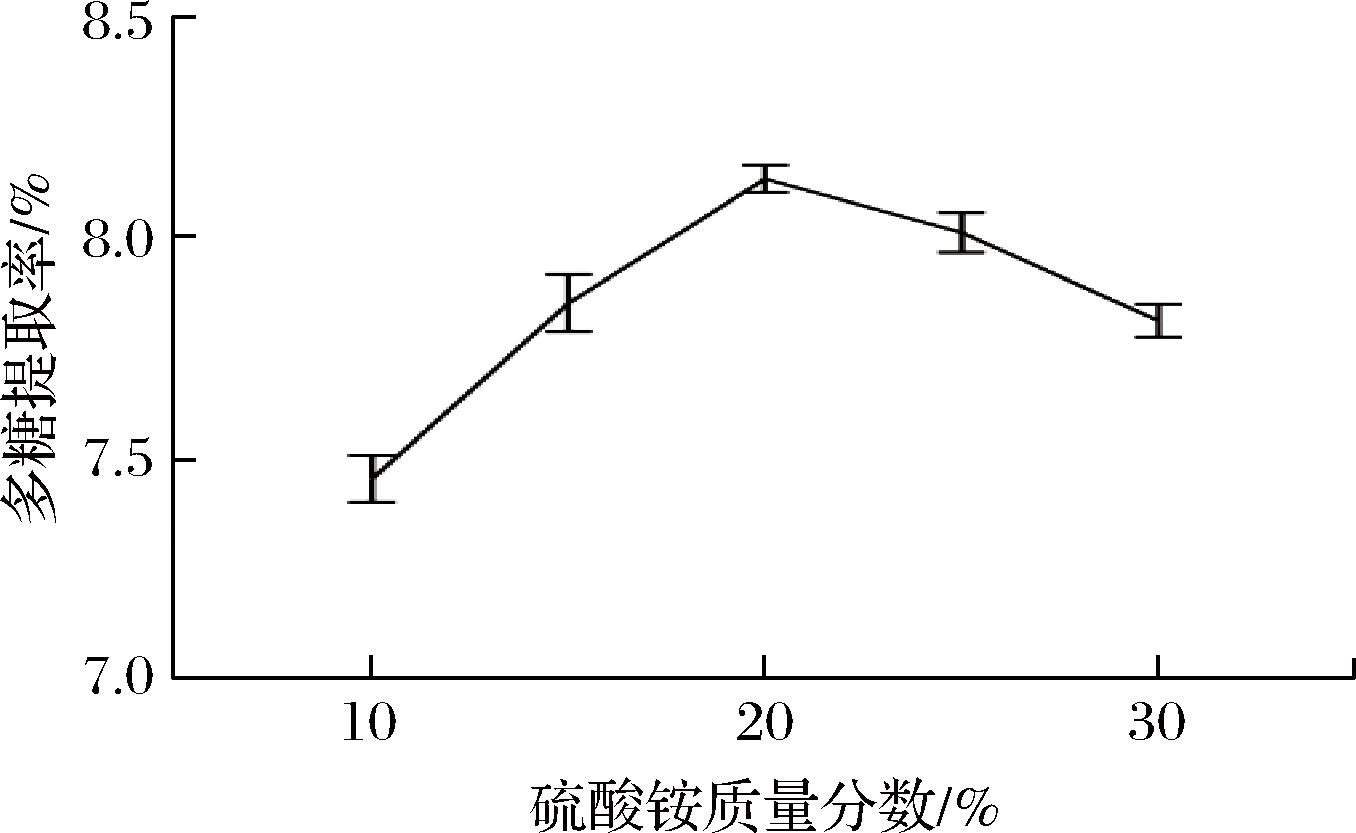
图2 硫酸铵质量分数对蕨麻多糖提取率的影响
Fig.2 Effect of ammonium sulfate concentration on extraction yield of Potentilla anserina L.polysaccharide
2.1.3 料液比对蕨麻多糖提取的影响
料液比对多糖提取率的影响如图3所示,料液比为1∶10~1∶20时,多糖提取率随料液比的升高而增加,此后继续增加料液比,多糖提取率不再增高。其主要原因是由于,在一定范围内,溶质和溶液的接触面积随着料液比的增加而扩大,更有利于多糖的溶出[12];但料液比超过1∶20之后,细胞内外的多糖已经达到了溶解平衡,已被充分浸提出来,考虑到提取成本,料液比选择1∶20作为多糖提取的最佳提取参数。

图3 料液比值对蕨麻多糖提取的影响
Fig.3 Effect of liquid to solid ratio on extraction yield of Potentilla anserina L.polysaccharide
2.1.4 超声功率对蕨麻多糖提取的影响
在无水乙醇质量分数20%,硫酸铵质量分数为20%,料液比为1∶20,提取时间60 min萃取条件下考察超声功率对蕨麻多糖提取的影响(图4)。超声功率为80~200 W时,多糖提取率随超声功率的升高而增加,此后继续增加超声功率,多糖提取率增高不明显,考虑到提取成本,超声功率为200 W作为多糖提取的最佳提取参数。
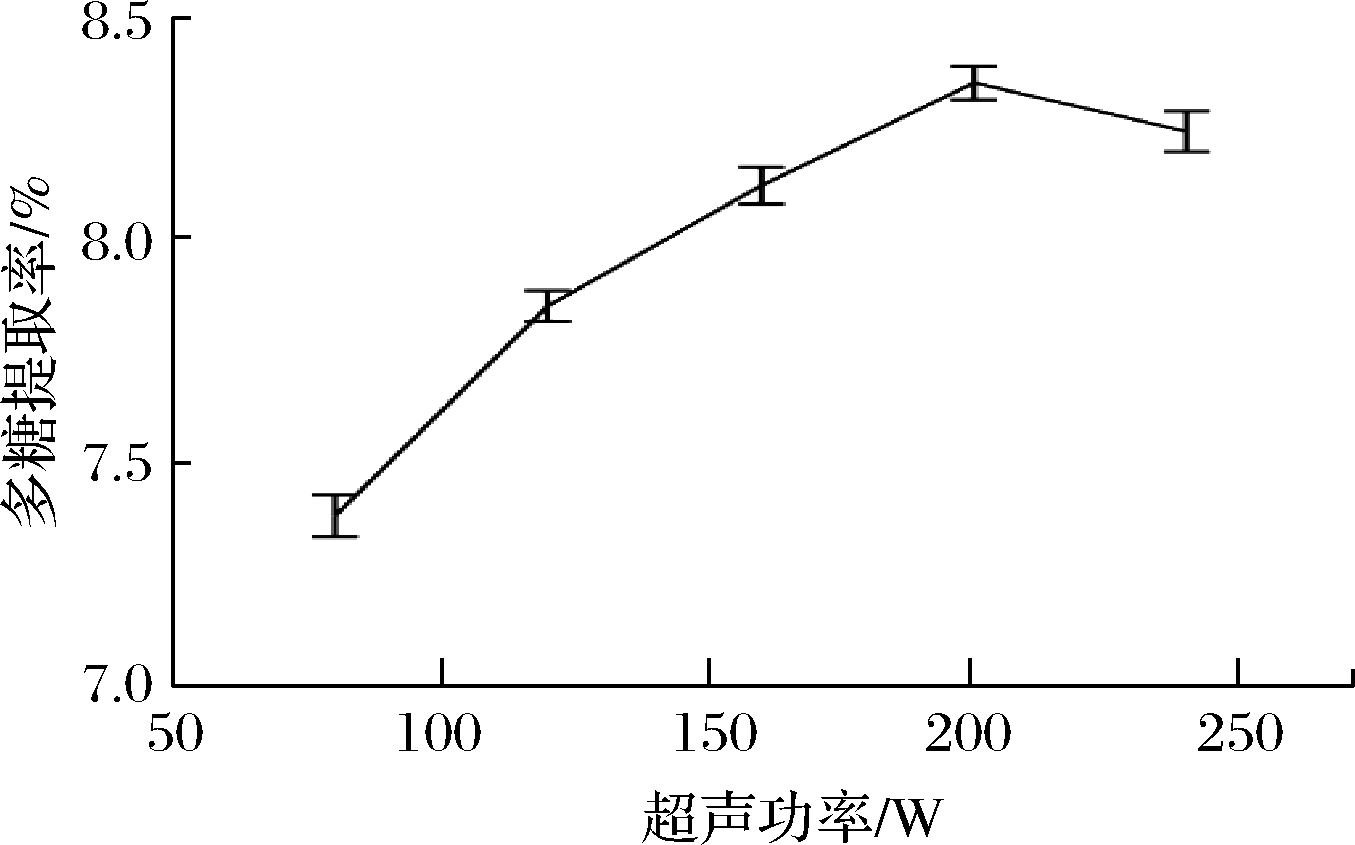
图4 超声功率对多糖提取率的影响
Fig.4 Effect of ultrasonic power on the extraction efficiency of Potentilla anserina L.polysaccharide
2.2 响应面法试验结果
2.2.1 响应面试验设计与结果分析
在单因素实验的基础上,利用BBD模型对提取参数进行了优化。表2显示了29个4因素3水平试验结果。使用SAS 数据分析软件对数据进行分析,多糖提取率和试验变量采用得出:
Y=8.90+0.25A+0.21B+0.16C+0.26D-0.31AB+0.065AC-0.25AD-0.50BC-0.27BD+0.18CD-0.52A2-0.51B2-0.69C2-0.095D2
式中:Y为多糖提取率,A为无水乙醇质量分数,B为硫酸铵质量分数,C为料液比,D为超声功率。
经Design-Expert 8.0软件ANOVA法分析响应表面二次多项式模型的显著性。实验方差结果分析如表3所示,回归模型的拟合极显著(P<0.000 1),实验复相关系数(R2)是0.971 5和校正测定系数![]() 是0.943 0,以上结果均表明模型拟合程度高可靠性强,观察值和预测值之间的相关性良好,在实验变量范围内具有很高的显著性,可用该模型来分析和预测多糖的提取条件,此外,低变异系数为1.72%表示模型的精度高。以上分析结果证实选用的试验方法准确可靠,可以用此回归方程对试验结果进行分析和预测。表3的结果显示模型的一次项A和D极显著,所选的各因素水平范围内,无水乙醇质量分数和超声功率对蕨麻多糖提取率的影响最为显著。
是0.943 0,以上结果均表明模型拟合程度高可靠性强,观察值和预测值之间的相关性良好,在实验变量范围内具有很高的显著性,可用该模型来分析和预测多糖的提取条件,此外,低变异系数为1.72%表示模型的精度高。以上分析结果证实选用的试验方法准确可靠,可以用此回归方程对试验结果进行分析和预测。表3的结果显示模型的一次项A和D极显著,所选的各因素水平范围内,无水乙醇质量分数和超声功率对蕨麻多糖提取率的影响最为显著。
表2 Box-Behnken试验设计及结果
Table 2 Box-Behnken design and results
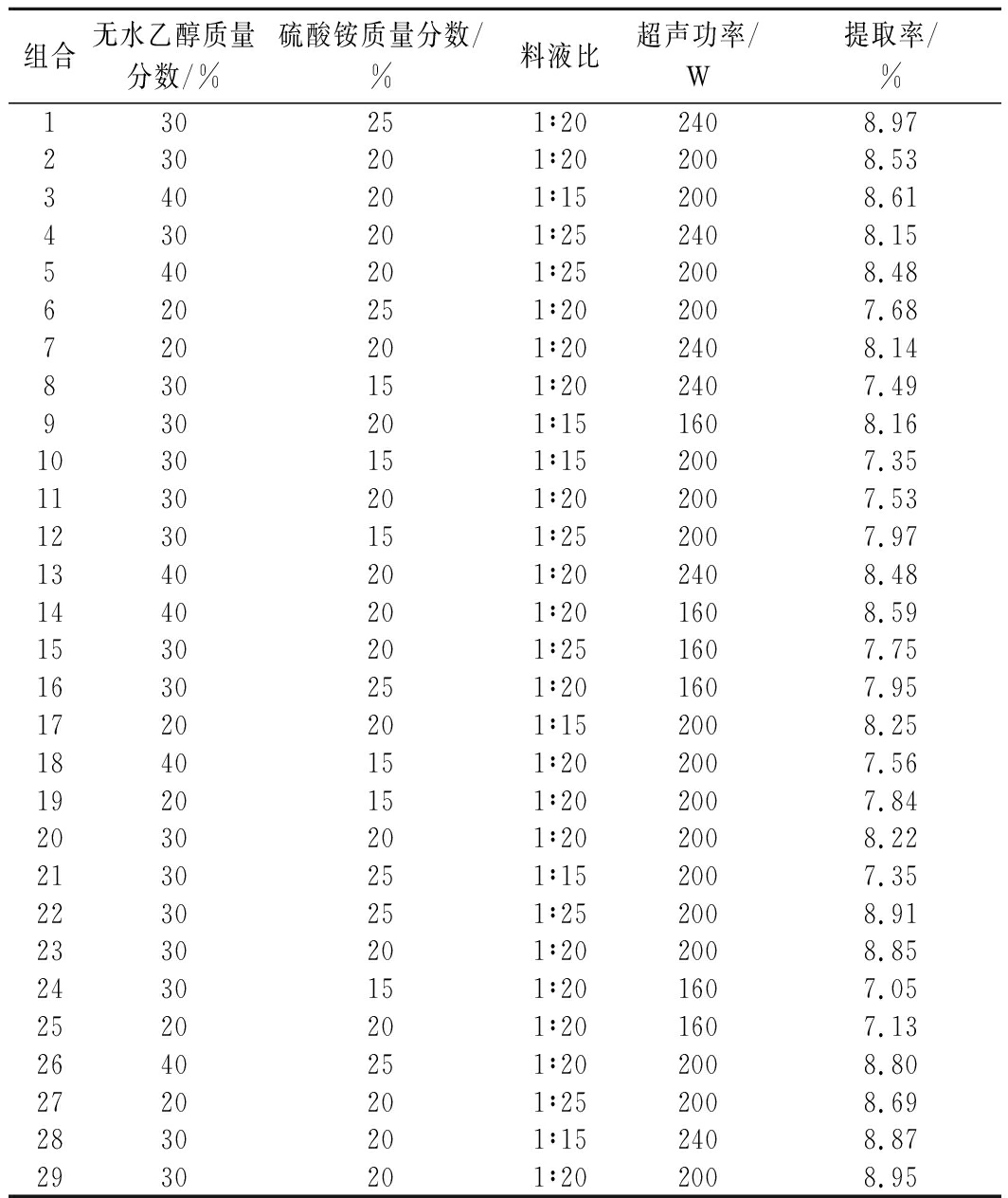
组合无水乙醇质量分数/%硫酸铵质量分数/%料液比超声功率/W提取率/%130251∶202408.97230201∶202008.53340201∶152008.61430201∶252408.15540201∶252008.48620251∶202007.68720201∶202408.14830151∶202407.49930201∶151608.161030151∶152007.351130201∶202007.531230151∶252007.971340201∶202408.481440201∶201608.591530201∶251607.751630251∶201607.951720201∶152008.251840151∶202007.561920151∶202007.842030201∶202008.222130251∶152007.352230251∶252008.912330201∶202008.852430151∶201607.052520201∶201607.132640251∶202008.802720201∶252008.692830201∶152408.872930201∶202008.95
表3 回归模型的方差分析结果
Table 3 The results of variance analysis of regression mode
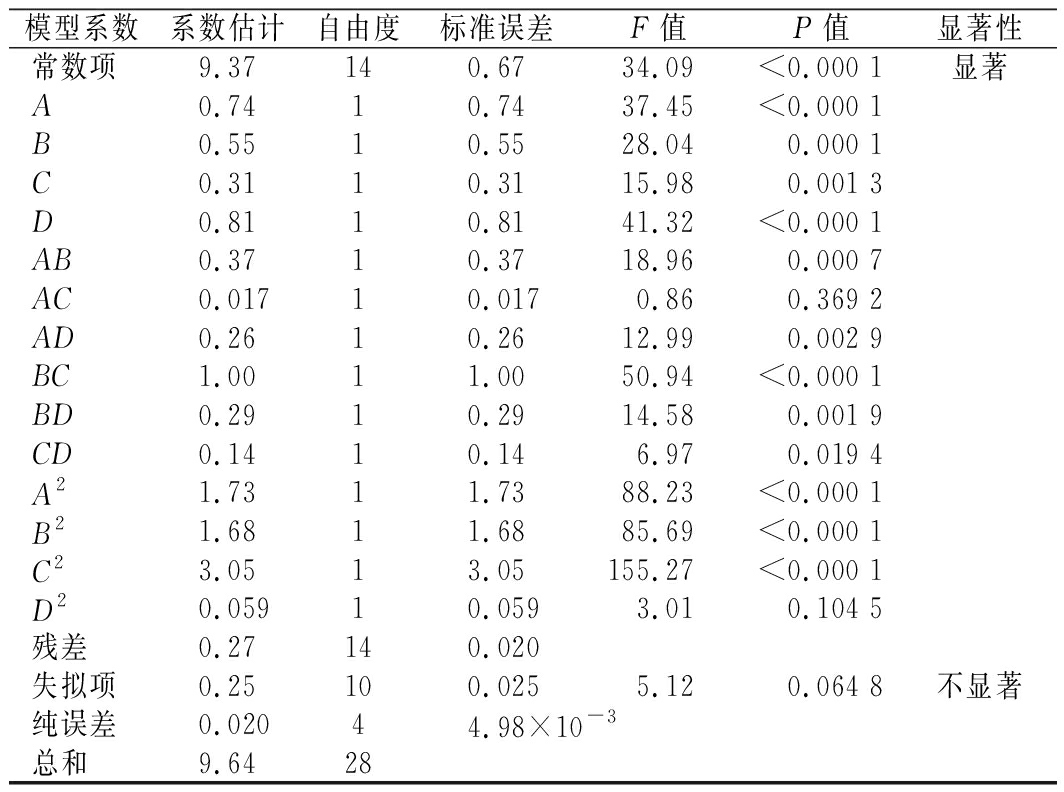
模型系数系数估计自由度标准误差F值P值显著性常数项9.37140.6734.09<0.000 1显著A0.7410.7437.45<0.000 1B0.5510.5528.040.000 1C0.3110.3115.980.001 3D0.8110.8141.32<0.000 1AB0.3710.3718.960.000 7AC0.01710.0170.860.369 2AD0.2610.2612.990.002 9BC1.0011.0050.94<0.000 1BD0.2910.2914.580.001 9CD0.1410.146.970.019 4A21.7311.7388.23<0.000 1B21.6811.6885.69<0.000 1C23.0513.05155.27<0.000 1D20.05910.0593.010.104 5残差0.27140.020失拟项0.25100.0255.120.064 8不显著纯误差0.02044.98×10-3总和9.6428
根据多元回归方程做出不同处理因素对蕨麻多糖提取率的影响相应三维响应面和二维等高线图,如图5所示。三维响应面阐释了当其他因素保持在零水平不变时,因变量之间的关系和2个测试变量之间的相互作用[13],二维等值线图的形状反映了变量之间的交互效应,圆图表示试验参数相互作用影响不显著,而椭圆轮廓图表示试验参数相互作用影响显著[14-15]。图5-c、图5-e和图5-f分别表示无水乙醇质量分数与超声功率、硫酸铵与超声功率和料液比与超声功率的交互作用,从二维等值线图曲面的变化趋势分析,超声功率显著影响多糖提取率,这一结果与方差分析结果一致。

a-无水乙醇质量分数和硫酸铵质量分数交互作用对提取率影响的等高线图;b-无水乙醇质量分数和料液比交互作用对提取率影响的等高线图;
c-无水乙醇质量分数和超声功率交互作用对提取率影响的等高线图;d-硫酸铵质量分数和料液比交互作用对提取率影响的等高线图;
e-硫酸铵质量分数和超声功率交互作用对提取率影响的等高线图;f-料液比和超声功率交互作用对提取率影响的等高线图;
g-无水乙醇质量分数和硫酸铵质量分数交互作用对提取率影响的响应面图;h-无水乙醇质量分数和料液比交互作用对提取率影响的响应面图;
i-无水乙醇质量分数和超声功率交互作用对提取率影响的响应面图;j-硫酸铵质量分数和料液比交互作用对提取率影响的响应面图;
k-硫酸铵质量分数和超声功率交互作用对提取率影响的响应面图;l-料液比和超声功率交互作用对提取率影响的响应面图
图5 不同处理因素交互作用对多糖提取率的响应面和等高线图
Fig.5 Response surface plots and contour plots showing the interactive effects on the extraction yield of polysaccharides
2.2.2 最优工艺条件及验证实验
利用Design-Expert 8.0软件分析优化蕨麻多糖提取的最佳条件:无水乙醇质量分数为30.92%,硫酸铵质量分数18.74%,料液比为1∶21.75,超声功率为240 W。最佳条件下蕨麻多糖预测最高提取率为9.127%。为检验预测结果的可靠性,兼顾实际操作的便利性,将上述最佳提取条件修正为无水乙醇质量分数为31%,硫酸铵质量分数19%,料液比为1∶22,超声功率为240 W进行重复实验。3次平行试验实际测得蕨麻多糖提取率为(9.04±0.12)%,经苯酚硫酸法检测多糖含量为(87.13±0.26)%,证实了预测值和实验值之间的良好相关性,表明该模型适用于蕨麻多糖的提取。与传统水提法提取蕨麻多糖(提取率2.54%)相比,响应面法优化超声波辅助双水相提取具有更高效的提取效率[16]。
2.3 蕨麻多糖的红外光谱分析
蕨麻多糖的红外光谱如图6所示。样品在3 600~3 000 cm-1、1 400~1 200 cm-1和1 200~700 cm-1区域显示了典型的多糖吸收峰。3 420.12 cm-1处较宽、较强的吸收峰为O—H伸缩振动吸收峰是蕨麻多糖糖链上羟基产生,由于多糖链上存在大量羟基并可以形成分子内或分子间的氢键缔合,所以该峰的波形宽大,波数向低频移动[17];在2 900 cm-1附近吸收峰为—CH3、—CH2、—CH中的C—H伸缩振动峰[18];在1 636.28 cm-1附近的吸收是1个区域,表明不对称羰基拉伸物(C![]() O)的吸收峰[19]。936~1 241 cm-1的区域一系列的吸收峰是糖苷键的C—O—C的非对称振动峰[20]。除此之外,在920 cm-1处显示有甘露糖的特征吸收峰,表明其单糖组成中可能含有甘露糖[21]。
O)的吸收峰[19]。936~1 241 cm-1的区域一系列的吸收峰是糖苷键的C—O—C的非对称振动峰[20]。除此之外,在920 cm-1处显示有甘露糖的特征吸收峰,表明其单糖组成中可能含有甘露糖[21]。
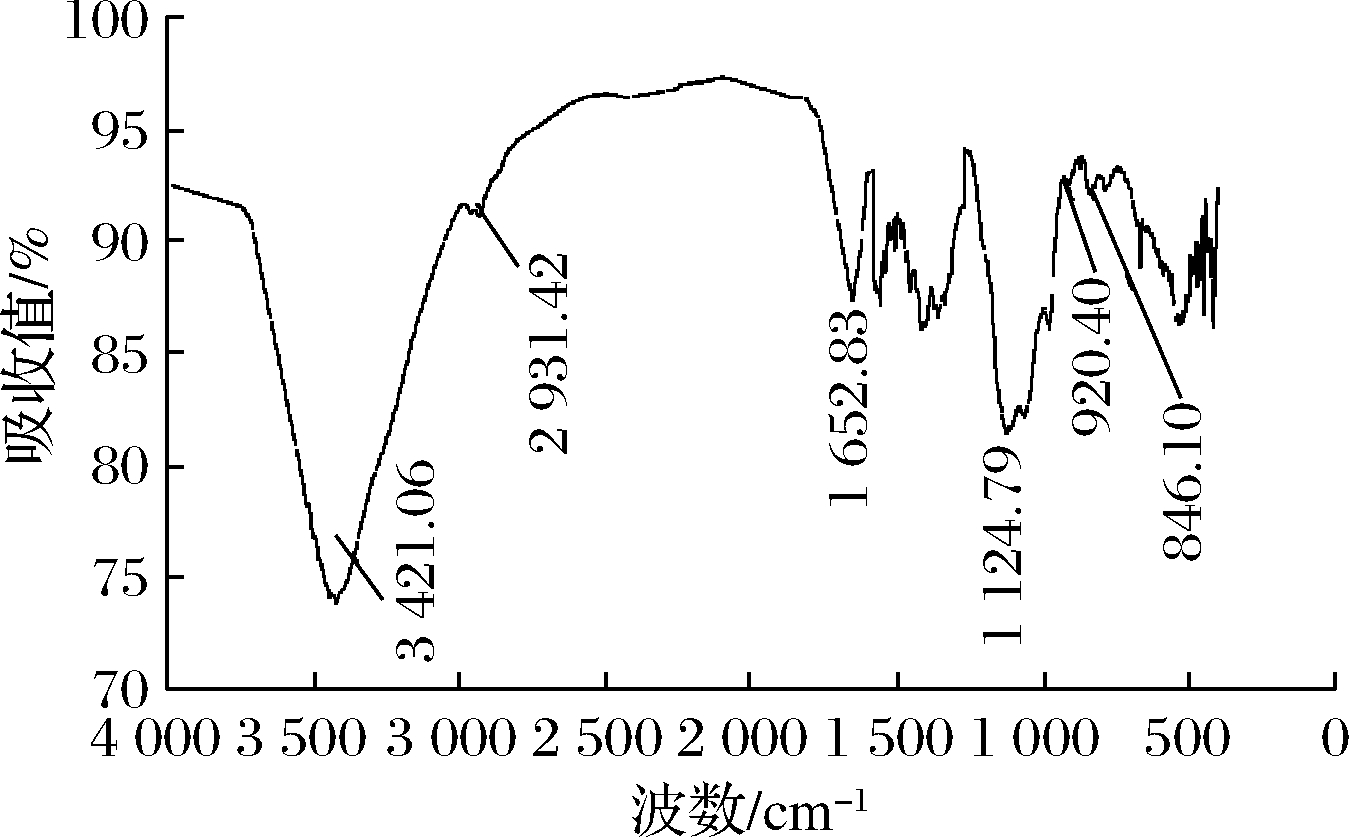
图6 蕨麻多糖的红外图谱
Fig.6 IR spectra of Potentilla anserina L.polysaccharide
2.4 蕨麻多糖单糖组成分析
多糖是由各种单糖通过不同的糖苷键连接方式连接组成的,单糖的种类和数量直接影响着多糖的结构和生理活性。图7-a是单糖标准品气相色谱质谱联用分析图谱,各色谱峰依照保留时间由小到大依次为:Rha、Lyx、Ara、Xyl、Man、Glc及Gal。蕨麻多糖经过完全酸解,制备糖腈衍生物经气相色谱质谱联用分析后的色谱图如图7-b所示。对照标准品的保留时间可知蕨麻多糖含有4种单糖,分别是Rha、Man、Glc和Gal,其摩尔比为1.00∶1.69∶10.61∶2.66。据研究发现,多糖活性的影响受到单糖种类的影响,MENG等[22]的研究发现毛孢属多糖的生物活性受单糖组成的影响,甘露糖和葡萄糖含量严重影响其抗氧化活性,甘露糖含量越高、葡萄糖含量越低,毛孢属多糖的抗氧化性越好。针对杏鲍茹多糖的研究发现,半乳糖含量较高的组分其抗氧化效果优于其他组分[23]。蕨麻多糖的单糖组成含有甘露糖和半乳糖,推测其具有一定的抗氧化性能。

a-标准单糖;b-PAP-1
图7 标准单糖和PAP-1的总离子流图
Fig.7 The total ion flow charts of standard monosaccharides and PAP-1
2.5 蕨麻多糖的体外抗氧化活性
2.5.1 超氧阴离子自由基清除活性测定
超氧阴离子自由基是体内产生的一种活性氧,正常情况下,由体内过氧化物歧化酶清除。但是过量的超氧阴离子自由基会引起一系列的反应损伤体内的生物大分子诱发多种疾病,特别是神经退行性疾病、生理性衰老和心血管疾病[24-25]。因此,使用抗氧化剂清除超氧阴离子自由基是减少机体氧化损伤的最有效手段之一,许多研究报道植物多糖具有一定的抗氧化作用[26-27]。
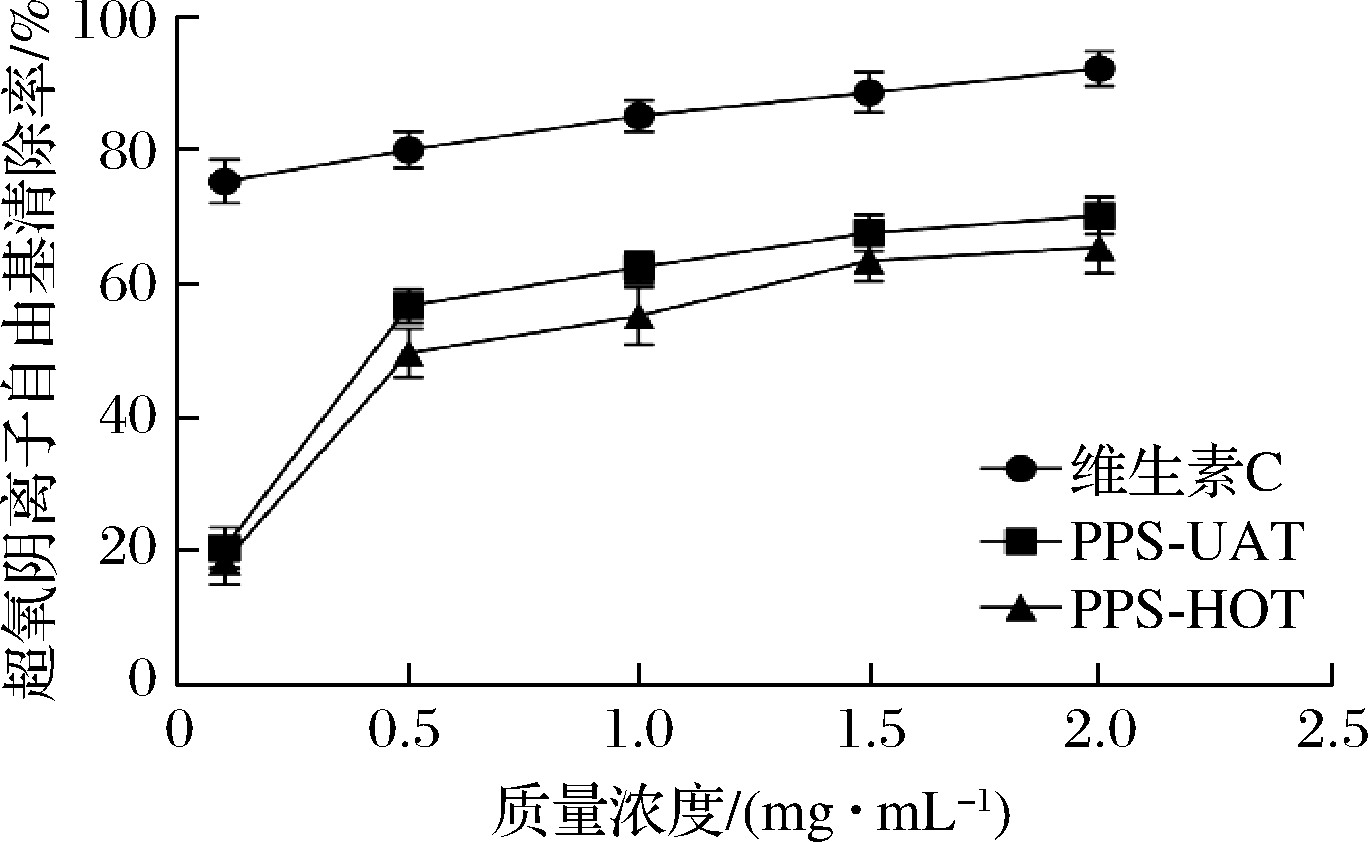
图8 蕨麻多糖的超氧阴离子自由基清除活性
Fig.8 The ability to scavenge superoxide free radical of Potentilla anserina L.polysaccharide
蕨麻多糖对超氧阴离子自由基的清除能力如图8所示,加入蕨麻多糖处理后可以显著作用于超氧阴离子自由基,且超氧阴离子自由基清除活性随蕨麻多糖的浓度升高而增强,但是对超氧阴离子自由基清除活性低于相同浓度下的维生素C处理组。针对不同方法提取的蕨麻多糖对超氧阴离子自由基的清除能力分析,相同的多糖浓度下,超声波辅助双水相提取蕨麻多糖(polysaccharides from Potentilla anserina L.by ultrasonic-assisted aqueous two-phase,PPS-UAT)超氧阴离子自由基清除能力高于传统水提法(polysaccharides from Potentilla anserina L. by hot water,PPS-HOT)。有研究指出,多糖的提取方式在一定程度上影响其生物活性,针对不同提取方法对油茶饼多糖抗氧化能力的影响发现超声波提取的多糖相较于传统水提法、碱提多糖、酶辅助提取多糖具有更强的抗氧化能力[28]。对牛蒡多糖的研究表明,在超声波辅助双水相提取、超声波提取、热水提取和酶法提取的牛蒡多糖中,超声波辅助双水相提取多糖抗氧化性能最佳[28]。造成这种差异的原因是因为不同的提取方式在一定程度上会改变多糖的结构从而影响其生物活性。许多研究表明,超声波处理可以降解多糖的糖链,降低多糖的分子质量。多糖糖分子质量越大,体积越大,黏度越高,不利于跨越细胞膜进入体内或结合生物活性位点,发挥生物学活性,生物利用率较低[29-32],在一定程度上降低多糖的分子质量有助于提高多糖物质的生物活性。
2.5.2 还原力测定
还原力是重要的抗氧化剂活性指标之一,蕨麻多糖的还原力如图9所示。在质量浓度0.02~2 mg/mL时,蕨麻多糖和维生素C的还原力均随浓度的增大而变强,且相同浓度下维生素C的还原力值高于蕨麻多糖。在相同的多糖浓度下,PPS-UAT提取蕨麻多糖还原力高于PPS-HOT传统水提法,与蕨麻多糖超氧阴离子清除活性测定结果一致。针对玛咖多糖[33]和虫草多糖[34]的研究显示,PPS-UAT是一种高效的多糖提取方法。而PPS-UAT应用于蝉花多糖的提取研究表明,PPS-UAT效果强于PPS-HOT、微波提取法和酶提取法;PPS-UAT比PPS-HOT蝉花多糖的提取率高1.83倍,且提取的多糖具有更强的抗氧化活性[35]。本次实验结果也表明,PPS-UAT是一种保证生物活性更优良的多糖提取技术。
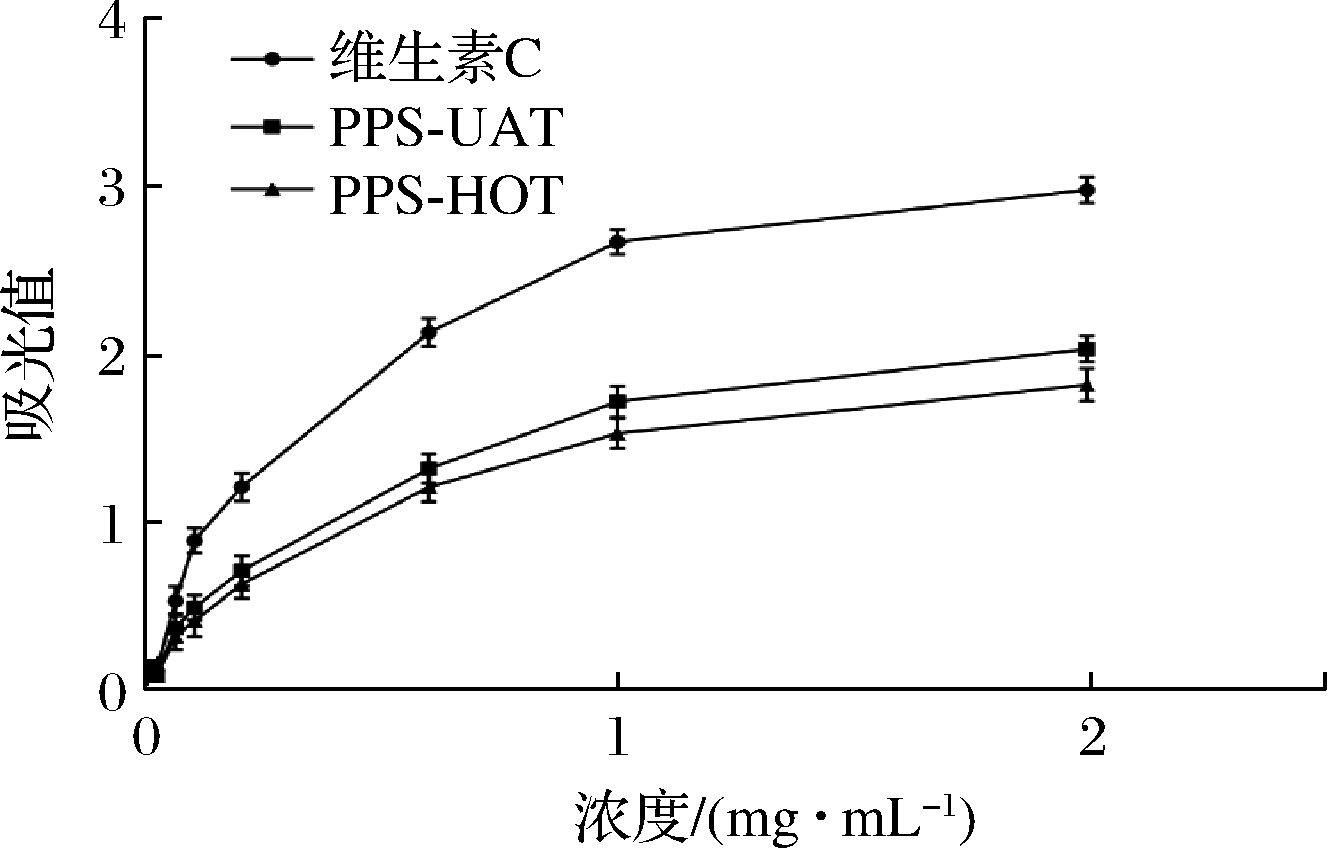
图9 蕨麻多糖的还原力
Fig.9 The reductive force of Potentilla anserina L. polysaccharide
3 结论
本研究利用响应面法优化超声波辅助双水相提取蕨麻多糖的工艺参数,在无水乙醇质量分数为31%,硫酸铵质量分数19%,料液比为1∶22,超声功率为240 W的条件下,蕨麻多糖提取率达到(9.04±0.12)%。并比较了超声波辅助双水相法与传统水提法提取的蕨麻多糖抗氧化性能差异,结果表明蕨麻多糖具备良好的抗氧化性能,并且呈现一定的量效关系,在相同浓度下,超声波辅助双水相法提取的蕨麻多糖抗氧化性能优于传统水提法。以上结论表明超声波辅助双水相法是一种可靠高效的多糖提取方法。
[1] 白世俊, 包锦渊, 李军乔.不同地区蕨麻中多糖含量的测定[J].湖北农业科学, 2012, 51(19):4 361-4 363;4 373.
BAI S J, BAO J Y, LI J Q.Determination of the polysaccharide content of Potentilla anserina in different regions[J].Hubei Agricultural Sciences, 2012, 51(19):4 361-4 363;4 373.
[2] 拉本. 藏药蕨麻的民族植物学研究[J].中央民族大学学报(自然科学版), 2013, 22(3):12-17.
LA B.Ethnobotany study on the Tibetan medicine Potentilla anserine[J].Journal of MUC (Natural Sciences Edition), 2013, 22(3):12-17.
[3] TOSHIO M, KIYOFUMI N, KATSUYA I, et al.Hepatoprotective triterpenes from traditional Tibetan medicine Potentilla anserina[J].Phytochemistry, 2014, 102:169-181.
[4] QIN X J, LI L Z, Lu Q, et al.Neuroprotection of n-Butanol extract from roots of Potentilla anserina on hypoxic injury in primary hippocampal neurons[J].Chinese Herbal Medicines, 2012, 4(3):195-200.
[5] ZHAO Y L, CAI G M, HONG X, et al.Anti-hepatitis B virus activities of triterpenoid saponin compound from Potentilla anserina L[J].Phytomedicine, 2008, 15(4):253-258.
[6] CHEN J R, YANG Z Q, HU T J, et al.Immunomodulatory activity in vitro and in vivo of polysaccharide from Potentilla anserina[J].Fitoterapia, 2010, 81(8):1 117-1 124.
[7] 高丹丹, 杨璐璐, 祁高展.响应面法优化蕨麻多糖的提取工艺[J].天然产物研究与开发, 2015, 27(6):1 099-1 104.
GAO D D, YANG L L, QI G Z.Optimization of extraction conditions of polysaccharide from Potentilla anserina by response surface methodology[J].Natural Product Research and Development, 2015, 27:1 099-1 104.
[8] 陈炼红, 张梦苑, 伍红, 等.复合酶法提取蕨麻多糖及其抗氧化活性研究[J].西南民族大学学报(自然科学版), 2015, 41(4):407-411.
CHEN L H, ZHANG M Y, WU H, et al.Extraction and antioxidant activities of polysaccharides from Potentilla anserina with combined-enzyme method[J].Journal of Southwest University for Nationalities (Natural Science Edition), 2015, 41(4):407-411.
[9] 范晓伟, 冉露, 郭箐, 等.离子液体结合超声辅助和双水相萃取提取分离柑橘果皮中黄酮类化合物[J].食品科学, 2020, 41(10):265-271.
FAN X W, RAN L, GUO Q, et al.Extraction and separation of flavonoids from citrus peel by successive ultrasound-assisted with ionic liquids and aqueous two-phase extraction[J].Food Science, 2020, 41(10):265-271.
[10] JHONATAS R B, MAUR′ICIO M S F.Polysaccharides of mushroom pleurotus spp:New extraction techniques, biological activities and development of new technologies[J].Carbohydrate Polymers, 2019,19:1 197-1 207.
[11] 张鉥孟, 陈美珍.乙醇-硫酸铵双水相体系萃取坛紫菜多糖[J].食品科学, 2014, 35(22):46-49.
ZHANG S M, CHEN M Z.Extraction of polysaccharides from Porphyra haitanensis using ethanol-ammonium sulfate aqueous two-phase system[J].Food Science, 2014, 35(22):46-49.
[12] DAYEON R, EUNMI K.Application of response surface methodology to acidified water extraction of black soybeans for improving anthocyanin content, total phenols content and antioxidant activity[J].Food Chemistry, 2018, 261:260-266.
[13] JAWHAR H, KHAOULA M H, DIDIER L C, et al.Characterization, antioxidant and antiglycation properties of polysaccharides extracted from the medicinal halophyte Carpobrotus edulis L[J].International Journal of Biological Macromolecules, 2018, 107:833-842.
[14] BALASUBRAMANIAN B, ILAVENIL S, Al-DHABI N A, et al.Isolation and characterization of Aspergillus sp.for the production of extracellular polysaccharides by response surface methodology[J].Saudi Journal of Biological Sciences, 2019, 26:449-454.
[15] XUE H Y, LI J R, LIU Y, et al.Optimization of the ultrafiltration-assisted extraction of Chinese yam polysaccharide using response surface methodology and its biological activity[J].International Journal of Biological Macromolecules, 2019, 121:1 186-1 193.
[16] 杨娜, 王鸿飞, 许凤.蕨麻多糖提取及抗氧化活性研究[J].中国食品学报, 2014, 14(2):60-66.
YANF N, WANG H F, XU F.Study on extraction of polysaccharides and antioxidant Activity of Potentilla ancerina L.polysaccharide[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(2):60-66.
[17] KACZMARSKA K, GRABOESKA B, SPYCHAJ T, et al.Effect of microwave treatment on structure of binders based on sodium carboxymethyl starch:FT-IR, FT-Raman and XRD investigations[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 199:387-393.
[18] SATHISHKUMAR R, ANANTHAN G S, SENTHIL L, et al.Structural characterization and anticancer activity of extracellular polysaccharides from ascidian symbiotic bacterium Bacillus thuringiensis[J].Carbohydrate Polymers, 2018, 190:113-120.
[19] PALANIPPAN S, MEIVELU M, SADHASIVAM S, et al.Isolation and chemical characteristics of rhamnose enriched polysaccharide from Grateloupia lithophila[J].Carbohydrate Polymers, 2018, 195:486-494.
[20] GUO J, WANG J L, SONG S, et al.Sphallerocarpus gracilis polysaccharide protects pancreatic beta-cells via regulation of the bax/bcl-2, caspase-3, pdx-1 and insulin signalling pathways[J].International Journal of Biological Macromolecules, 2016, 93:829-836.
[21] SATHISHKUMAR R S, ANANTHAN G, SENTHIL S L, et al.Structural characterization and anticancer activity of extracellular polysaccharides from ascidian symbiotic bacterium Bacillus thuringiensis[J].Carbohydrate Polymers, 2018, 190:113-120.
[22] MENG L, SUN S, LI R, et al.Antioxidant activity of polysaccharides produced by Hirsutella sp.and relation with their chemical characteristics[J].Carbohydrate Polymers, 2015, 117:452-457.
[23] JING X Y, MAO D B, GENG L J.Medium optimization, molecular characterization, and bioactivity of expolysaccharides from Pleurotus eryngii[J].Archives of Microbiology, 2013, 195:749-757.
[24] BHAT A H, DAR K B, ANEES S, et al.Oxidative stress, mitochondrial dysfunction and neurodegenerative diseases;a mechanistic insight[J].Biomedicine & Pharmacotherapy, 2015, 74:101-110.
[25] ABDOH T, ALI A K, ULLAH I A, et al.Antioxidant effects and mechanism of silymarin in oxidative stress induced cardiovascular diseases[J].Biomedicine & Pharmacotherapy, 2018, 102:689-698.
[26] OLATUNJI O J, YAN F, OLATUNJI O O, et al.Polysaccharides purified from Cordyceps cicadae protects PC12 cells against glutamate-induced oxidative damage[J].Carbohydrate Polymers, 2016, 153:187-195.
[27] YAN J K, WANG Y Y, WANG Z B, et al.Structure and antioxidative property of a polysaccharide from an ammonium oxalate extract of Phellinus linteus[J].International Journal of Biological Macromolecules, 2016, 91:92-99.
[28] SHEN S, CHENG H R, LI X, et al.Effects of extraction methods on antioxidant activities of polysaccharides from Camellia seed cake[J].European Food Research and Technology, 2014, 238(6):1 015-1 021.
[29] 巫永华, 陆文静, 刘梦虎, 等.响应面优化超声波辅助双水相提取牛蒡多糖及抗氧化分析[J].食品与发酵工业, 2020, 46(5):215-223.
WU Y H, LU W J, LIU M H, et al.Optimization of ultrasonic-assisted aqueous two-phase extraction of burdock polysaccharide by response surface design and its antioxidant activities[J].Food and Fermentation Insustries, 2020, 46(5):215-223.
[30] SHI J M, CHENG C L, ZHAO H T, et al.In vivo anti-radiation activities of the Ulva pertusa polysaccharides and polysaccharide-iron(III) complex[J].International Journal of Biological Macromolecules, 2013, 60:341-346.
[31] YAN Y S, JI Y, SU N, et al.Non-anticoagulant effects of low molecular weight heparins in inflammatory disorders:A review[J].Carbohydrate Polymers, 2017, 160:71-81.
[32] ZHANG X R, QI C H, GUO Y, et al.Toll-like receptor 4-related immunostimulatory polysaccharides:Primary structure, activity relationships, and possible interaction models[J].Carbohydrate Polymers, 2016, 149:186-206.
[33] 王全, 李红亚, 李术娜, 等.Box-Behnken设计响应面法优化超声波辅助双水相法提取玛咖多糖[J].河北大学学报(自然科学版), 2016, 36(4):387-395.
WANG Q, LI H Y, LI S N, et al.Box-Behnken design for optimized extraction of polysaccharides from maca via ultrasonic-assisted aqueous two-phase method[J].Journal of Hebei University (Natural Science Edition), 2016, 36(4):387-395.
[34] 孙诗清, 王玉洁, 朱长俊, 等.超声波辅助双水相提取虫草多糖的工艺研究[J].安徽农业科学, 2012, 40(33):16 392-16 394;16 500.
SUN S Q, WANG Y J, ZHU C J, et al.Extraction conditions of polysaccharide from cultured Cordyceps militaris by ultrasonic assisted aqueous two phase system[J].Journal of Anhui Agricultural Sciences, 2012, 40(33):16 392-16 394;16 500.
[35] 凡军民, 谢正林, 谢春芹, 等.超声波辅助双水相体系提取蝉花多糖及抗氧化研究[J].食品科技, 2020, 45(5):196-201.
FAN J M, XIE Z L, XIE C Q, et al.Optimization of ultrasonic-assisted aqueous two-phase extraction and antioxidant activity of polysaccharide from Cordyceps cicadae[J].Food Science and Technology, 2020, 45(5):196-201.