葡萄酒是一种复杂的酒精饮料,由原料葡萄经过酒精发酵、苹果酸乳酸发酵、陈酿等工序酿造而成,是有生命的酒精产品[1]。从葡萄原料的成熟度、酒精发酵过程的管理,后期陈酿装瓶,以及运输与销售的每一个环节都会对葡萄酒的质量有不同程度的影响[2]。另外,外界环境因素(温度、湿度、氧气、光线)也是影响葡萄酒整体质量的重要因素[3]。基本理化指标、颜色、花色苷、酚类物质、挥发性物质都是影响葡萄酒质量好坏的重要因素[4]。在相关的研究中,有很多关于外界环境因素对瓶储葡萄酒质量的影响[5],特别是温度和氧气,而很少有关于振动对其质量的影响。葡萄酒在运输以及酒柜贮藏的条件下都会发生不同程度的振动。研究不同振动方式对葡萄酒质量的影响,对葡萄酒在运输和贮藏过程中保持良好品质,有效延长其货架期具有重要的现实意义。
葡萄酒在运输以及酒柜贮藏的条件下都会发生不同程度的振动。本研究通过实验研究4种不同振动方式(冷冻机振动、摇床振动、漩涡振动和车载振动)对瓶储葡萄酒质量的影响,分别对葡萄酒常规理化指标、花色苷、单体酚和颜色进行分析,比较瓶装葡萄酒贮存期间的品质变化及其主要因素,以期保持葡萄酒品质,有效延长其货架期。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
西北农林科技大学葡萄酒学院自主生产赤霞珠红葡萄酒、霞多丽白葡萄酒、贵人香白葡萄酒;中粮葡萄酒有限公司生产梅鹿辄干红葡萄酒。理化指标如表1所示。
表1 实验用酒基本理化指标Table 1 Basic physical and chemical indicators of experimental wine

理化指标赤霞珠红葡萄酒梅鹿辄干红葡萄酒霞多丽白葡萄酒贵人香白葡萄酒酒精度/%vol10.12±0.0111.39±0.0112.86±0.0110.81±0.01总糖/(g·L-1)5.15±0.006.60±0.016.35±0.004.35±0.00总酸/(g·L-1)4.68±0.015.78±0.005.81±0.015.97±0.02挥发酸/(g·L-1)0.15±0.000.52±0.010.17±0.000.23±0.00干浸出物/(g·L-1)31.5±0.0128.4±0.0224.5±0.0121.1±0.02
1.1.2 仪器与设备
UV-1750型紫外可见分光光度计、LC-20AT型高效液相色谱仪,日本岛津公司;Waters UPLC I-Class型超高效液相色谱仪,配有Empower色谱工作站,ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),美国沃世特公司;XW-80A型漩涡混合仪,上海精科实业公司;Startorius BT25S型十万分之一天平,德国赛多利斯公司。
1.2 葡萄酒振动处理
采用4种不同振动方式(漩涡振动、恒温摇床振动、冷冻机振动和车载振动)分别对葡萄酒进行振动处理。其中漩涡振动对葡萄酒进行1周的振动处理,每天振动6 h;恒温摇床振动对葡萄酒进行4周振动处理,每天振动12 h,分别在振动2、4周时对所有指标进行测定;冷冻机振动对葡萄酒进行4周振动处理,每天振动12 h;车载振动对葡萄酒进行4周振动处理,将葡萄酒置于铺满冰块的绝热箱中,放于车后备箱中,每天振动4 h。振动方式和强度见表2。
表2 振动方式和强度
Table 2 Vibration modes and intensity

振动方式振动加速度/(m·s-2)处理时间漩涡振动 54.51周(6 h/d) 恒温摇床振动7.24周(12 h/d)冷冻机振动 1.64周(12 h/d)车载振动 -4周(4 h/d)
1.3 理化指标测定
根据GB/T 12456—2008《葡萄酒、果酒通用分析方法》和GB 5009.225—2016《食品安全国家标准 酒中乙醇浓度的测定》测定,包括酒精度、总糖(以葡萄糖计)、总酸(以酒石酸计)、挥发酸(以醋酸计)以及干浸出物。
1.4 颜色空间检测方法
参照李运奎等[6]的方法对葡萄酒样进行颜色空间检测。将葡萄酒样经0.2 μm滤膜过滤后,采用2 mm 光程玻璃比色皿,以去离子水作参比,用紫外分光光度计扫描酒样在可见光区400~780 nm处的吸收光谱,间隔1 nm。CIELAB参数计算选用10°观察者视场,D65标准白光源。将吸收光谱中450、520、570、630 nm处的吸光度校正到1 cm光程后,计算参数L*、a*与b*。
1.5 花色苷测定
花色苷分析参考YANG等[7]的方法采用高效液相色谱法进行,花色苷的定性分析根据实验室已建立的色谱和质谱图信息进行。色谱柱Synergi Hydro-RP C18(4.6 mm×250 mm)。流动相A:800 mL水、100 mL乙腈和25 mL甲酸;流动相B:400 mL水、500 mL乙腈和25 mL甲酸。洗脱程序:0~45 min,A相100%~65%,B相0%~35%;45~46 min,A相65%~0%,B相35%~100%;46~50 min,A相0%,B相100%;50~51 min,A相0%~100%,B相100%~0%;51~55 min,A相100%,B相0%。流速1 mL/min,柱温30 ℃,检测波长520 nm,进样量20 μL。每个样品重复3次。单体花色苷的含量以二甲花翠素-3-O-葡萄糖苷计。
1.6 单体酚检测
取2 mL酒样,加入2 mL乙酸乙酯,漩涡振荡30 s,之后4 ℃离心(3 500 r/min)4 min,胶头滴管收集上清液于50 mL离心管中,重复萃取2次,离心浓缩仪蒸干,2 mL甲醇溶解残渣,0.22 μm膜过滤,-20 ℃保存,留作色谱分析。使用waters UPLC I-Class型超高效液相色谱仪测定[8]。色谱柱:Waters BEH C18反相色谱柱(2.1 mm×50 mm,1.7 μm);二极管阵列检测器;流速:0.2 mL/min;柱温:30 ℃;检测波长:210~400 nm;流动相:A相为1%乙酸(体积比1∶99)水溶液,B相为乙腈;梯度洗脱;进样量:2 μL。梯度洗脱程序:0~3 min,B相3%~6%;3~7 min,B相为6%~15%;7~11 min,B相为15%~30%;11~13 min,B相为30%;13~15 min,B相为30%~3%。
1.7 统计分析
采用Excel 16.44进行数据整合,SPSS 26.0.0.0进行方差分析及多重比较。P≤0.05为显著相关。
2 结果与分析
2.1 振动方式对葡萄酒理化指标的影响
理化指标与葡萄酒的质量关联密切。葡萄酒的外观和口感与可溶性固形物、pH值、有机酸、单宁、总酚等息息相关[9-13]。
振动处理对葡萄酒理化指标的影响见表3。振动处理显著降低了赤霞珠、梅鹿辄和贵人香葡萄酒的酒精度、总糖、总酸和干浸出物的含量,增加了挥发酸含量。振动处理对霞多丽葡萄酒的影响与赤霞珠、梅鹿辄和贵人香葡萄酒相似,但是,冷冻机振动处理的总糖显著高于对照,而总酸和挥发酸没有显著差异。比较得出摇床振动对基本理化指标的影响最大,这与其振动强度最大相一致。
表3 振动方式对葡萄酒理化指标的影响
Table 3 Effect of vibration modes on physical and chemical indicators of wines

样品处理酒精度/%vol总糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1)干浸出物/(g·L-1)对照10.12±0.035.15±0.154.68±0.060.15±0.0331.5±0.01漩涡振动2周10.08±0.034.45±0.114.5±0.040.18±0.0327.6±0.05赤霞珠红葡萄酒摇床振动2周10.05±0.024.30±0.164.57±0.050.22±0.0326.7±0.02摇床振动4周10.00±0.024.05±0.084.46±0.050.30±0.0223.8±0.02冷冻机振动4周10.09±0.034.35±0.154.65±0.030.16±0.0429.8±0.03车载振动4周10.08±0.044.80±0.164.61±0.030.29±0.0227.6±0.04对照11.39±0.076.60±0.145.78±0.020.52±0.0528.4±0.03漩涡振动2周11.01±0.075.43±0.125.47±0.060.56±0.0328.6±0.01梅鹿辄干红葡萄酒摇床振动2周10.95±0.055.35±0.065.65±0.040.57±0.0423.6±0.03摇床振动4周10.74±0.044.78±0.115.57±0.070.60±0.0320.4±0.05冷冻机振动4周10.94±0.034.97±0.135.76±0.040.54±0.0126.9±0.04车载振动4周10.97±0.054.51±0.155.69±0.090.61±0.0123.5±0.01对照12.86±0.036.35±0.145.81±0.030.17±0.0224.5±0.03漩涡振动2周12.39±0.075.45±0.175.69±0.060.16±0.0320.3±0.01霞多丽白葡萄酒摇床振动2周12.20±0.025.05±0.215.73±0.040.19±0.0419.2±0.05摇床振动4周11.09±0.044.29±0.135.64±0.050.21±0.0518.4±0.06冷冻机振动4周12.21±0.096.80±0.145.80±0.050.18±0.0423.4±0.05车载振动4周12.34±0.115.40±0.125.72±0.030.23±0.0321.1±0.06对照10.81±0.074.35±0.135.97±0.020.23±0.0321.1±0.09漩涡振动2周10.36±0.093.24±0.135.88±0.030.23±0.0319.4±0.03贵人香白葡萄酒摇床振动2周10.26±0.123.35±0.095.80±0.010.25±0.0116.5±0.03摇床振动4周9.87±0.083.07±0.155.78±0.020.28±0.0216.1±0.05冷冻机振动4周10.49±0.053.87±0.135.96±0.060.24±0.0219.7±0.06车载振动4周10.02±0.023.43±0.125.91±0.050.29±0.0317.8±0.02
2.2 振动方式对葡萄酒酚类物质的影响
2.2.1 振动方式对红葡萄酒花色苷的影响
利用高效液相色谱仪测定了不同振动方式处理后瓶储葡萄酒花色苷种类及含量。所检测的20种花色苷分别为花翠素-3-葡萄糖苷(Dp-3-O-glu)(1号峰)、花青素-3-葡萄糖苷(Cy-3-O-glu)(2号峰)、甲基花翠素-3-葡萄糖苷(Pt-3-O-glu)(3号峰)、甲基花青素-3-葡萄糖苷(Pn-3-O-glu)(4号峰)、二甲花翠素-3-葡萄糖苷(Mv-3-O-glu)(5号峰)、锦葵色素衍生花色苷Vitisin A(6号峰)、锦葵色素衍生花色苷Vitisin B(7号峰)、二甲花翠素-3-葡萄糖苷丙酮酸[Mv-3-O-(6-O-acetyl)-glu-pyruvic acid](8号峰)、二甲花翠素-3-葡萄糖苷-乙基焦儿茶酸(1)[Mv-3-O-glu-ethyl-catechin (1)](9号峰)、4-乙醛-3′,5′-二甲花翠素-3-O-葡萄糖苷(Mv-3-O-(6-O-acetyl)-glu-acetaldehyde)(10号峰)、二甲花翠素-3-葡萄糖苷-乙基焦儿茶酸(2)[Mv-3-O-glu-ethyl-catechin (2)](11号峰)、二甲花翠素-3-葡萄糖苷-乙基-焦儿茶酸(3)[Mv-3-O-glu-ethyl-catechin (3)](12号峰)、甲基花青素-3-乙酰化-葡萄糖苷(Pn-3-O-acetylglu)(13号峰)、甲基花翠素-3-乙酰化葡萄糖苷(Pt-3-O-acetylglu)(14号峰)、二甲花翠素-3-葡萄糖苷-丙酮酸[Mv-3-O-(6-O-coumaryl)-glu-pyruvic acid](15号峰)、3′,5′-二甲花翠素咖啡酰化-3-O-葡萄糖苷[Mv-3-O-(6-O-caffeoyl)-glu](16号峰)、二甲花翠素-3-乙酰化葡萄糖苷[Mv-3-O-(6-O-coumaryl)-glu-acetaldehyde](17号峰)、顺式3′,5′-二甲花翠素-3-O-葡萄糖苷[Cis-Mv-3-O-(6-O-p-coumaryl)-glu](18号峰)、甲基花青素-3-咖啡酰化-葡萄糖苷(Pn-3-O-caffeoylglu)(19号峰)和二甲花翠素-3-咖啡酰化-葡萄糖苷(Mv-3-O-caffeoylglu)(20号峰)。其在520 nm下的色谱图见图1。
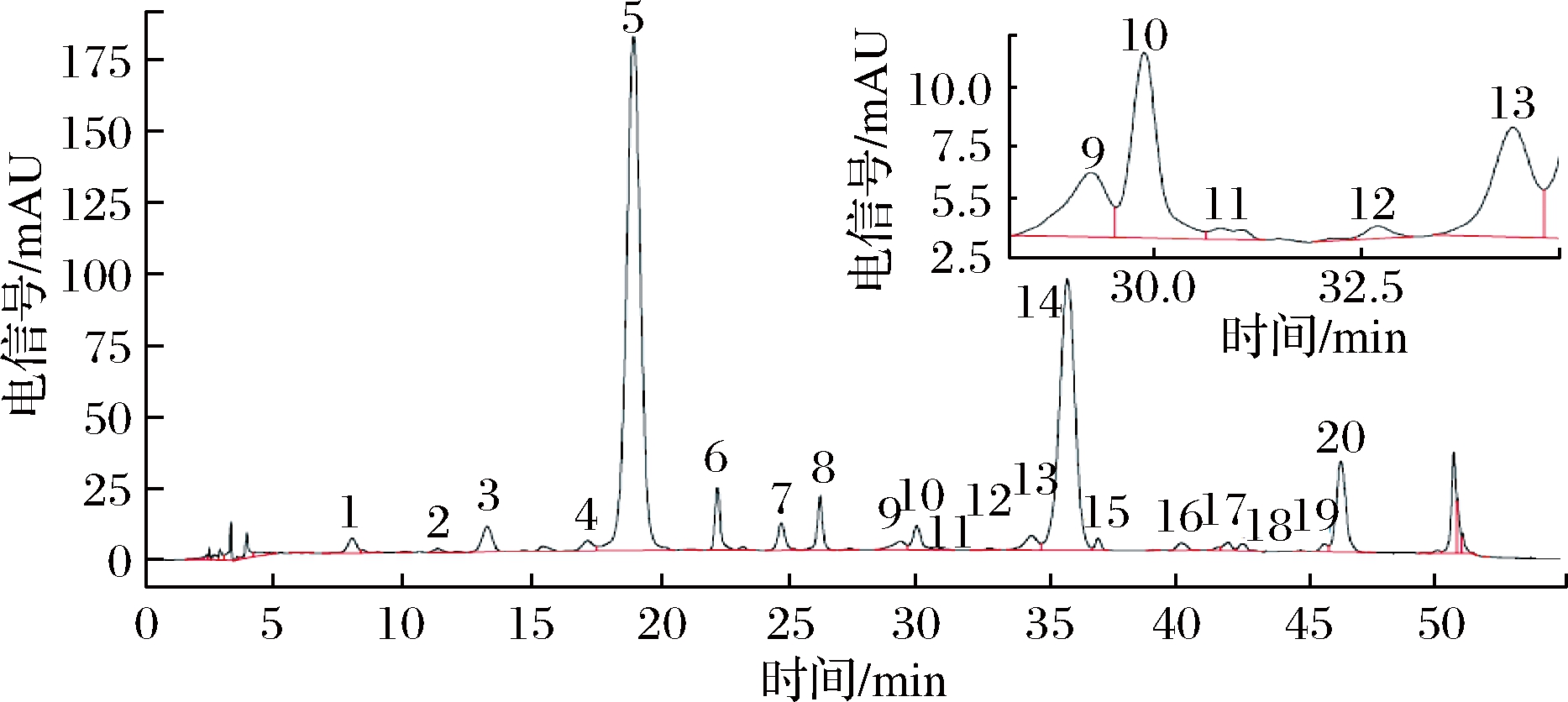
图1 赤霞珠葡萄酒的花色苷色谱图
Fig.1 Anthocyanin chromatogram of Cabernet Sauvignon wine
由表4可以看出,4种瓶装葡萄酒经过漩涡振荡、摇床振动和冷冻机振动之后,花色苷总量整体呈现明显的下降趋势。摇床振动由于振动强度较高,对花色苷含量影响最为明显。在所检测的20种花色苷中,大部分花色苷经过振动处理后,含量都有所下降,其中以二甲花翠素-3-葡萄糖苷(降低34%~79%)和甲基花翠素-3-乙酰化葡萄糖苷(降低37%~83%)含量的降低最为明显。在试验所用的2种红葡萄酒中,经过不同振动方式处理后都出现了处理前未出现的甲基花青素-3-乙酰化-葡萄糖苷。葡萄酒在贮存过程中,各类花色苷单体间在持续发生衍生转化,振动处理期间,推测由于振动强度,显著促进了衍生转化速度,导致振动处理后部分花色苷含量发生变化。
表4 不同振动方式处理后红葡萄酒花色苷含量 单位:mg/L
Table 4 The anthocyanin content of red wine after different vibration treatments
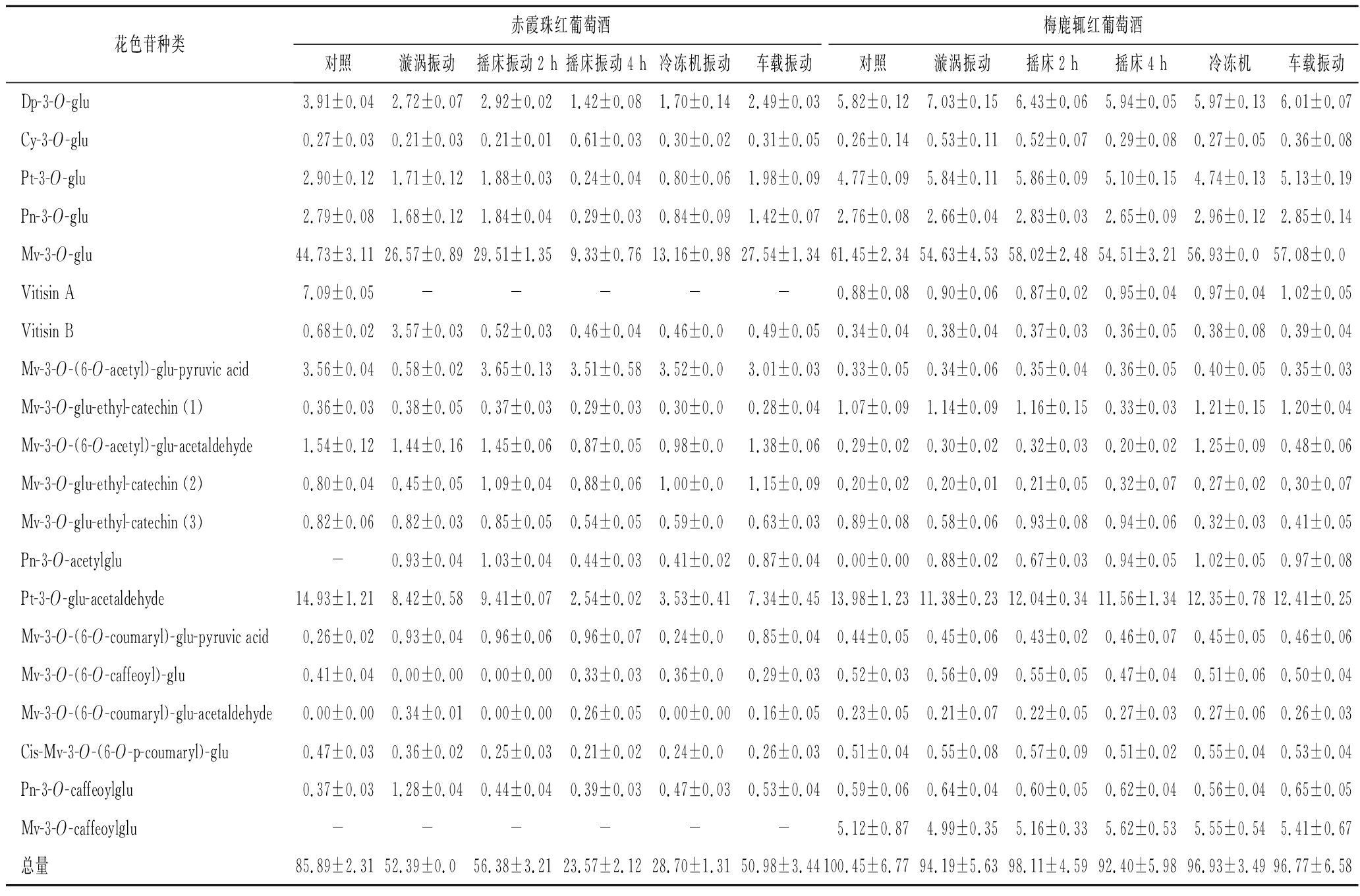
花色苷种类赤霞珠红葡萄酒梅鹿辄红葡萄酒对照漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动对照漩涡振动摇床2 h摇床4 h冷冻机车载振动Dp-3-O-glu3.91±0.042.72±0.072.92±0.021.42±0.081.70±0.142.49±0.035.82±0.127.03±0.156.43±0.065.94±0.055.97±0.136.01±0.07Cy-3-O-glu0.27±0.030.21±0.030.21±0.010.61±0.030.30±0.020.31±0.050.26±0.140.53±0.110.52±0.070.29±0.080.27±0.050.36±0.08Pt-3-O-glu2.90±0.121.71±0.121.88±0.030.24±0.040.80±0.061.98±0.094.77±0.095.84±0.115.86±0.095.10±0.154.74±0.135.13±0.19Pn-3-O-glu2.79±0.081.68±0.121.84±0.040.29±0.030.84±0.091.42±0.072.76±0.082.66±0.042.83±0.032.65±0.092.96±0.122.85±0.14Mv-3-O-glu44.73±3.1126.57±0.8929.51±1.359.33±0.7613.16±0.9827.54±1.3461.45±2.3454.63±4.5358.02±2.4854.51±3.2156.93±0.057.08±0.0Vitisin A7.09±0.05-----0.88±0.080.90±0.060.87±0.020.95±0.040.97±0.041.02±0.05Vitisin B0.68±0.023.57±0.030.52±0.030.46±0.040.46±0.00.49±0.050.34±0.040.38±0.040.37±0.030.36±0.050.38±0.080.39±0.04Mv-3-O-(6-O-acetyl)-glu-pyruvic acid3.56±0.040.58±0.023.65±0.133.51±0.583.52±0.03.01±0.030.33±0.050.34±0.060.35±0.040.36±0.050.40±0.050.35±0.03Mv-3-O-glu-ethyl-catechin (1)0.36±0.030.38±0.050.37±0.030.29±0.030.30±0.00.28±0.041.07±0.091.14±0.091.16±0.150.33±0.031.21±0.151.20±0.04Mv-3-O-(6-O-acetyl)-glu-acetaldehyde1.54±0.121.44±0.161.45±0.060.87±0.050.98±0.01.38±0.060.29±0.020.30±0.020.32±0.030.20±0.021.25±0.090.48±0.06Mv-3-O-glu-ethyl-catechin (2)0.80±0.040.45±0.051.09±0.040.88±0.061.00±0.01.15±0.090.20±0.020.20±0.010.21±0.050.32±0.070.27±0.020.30±0.07Mv-3-O-glu-ethyl-catechin (3)0.82±0.060.82±0.030.85±0.050.54±0.050.59±0.00.63±0.030.89±0.080.58±0.060.93±0.080.94±0.060.32±0.030.41±0.05Pn-3-O-acetylglu-0.93±0.041.03±0.040.44±0.030.41±0.020.87±0.040.00±0.000.88±0.020.67±0.030.94±0.051.02±0.050.97±0.08Pt-3-O-glu-acetaldehyde14.93±1.218.42±0.589.41±0.072.54±0.023.53±0.417.34±0.4513.98±1.2311.38±0.2312.04±0.3411.56±1.3412.35±0.7812.41±0.25Mv-3-O-(6-O-coumaryl)-glu-pyruvic acid0.26±0.020.93±0.040.96±0.060.96±0.070.24±0.00.85±0.040.44±0.050.45±0.060.43±0.020.46±0.070.45±0.050.46±0.06Mv-3-O-(6-O-caffeoyl)-glu0.41±0.040.00±0.000.00±0.000.33±0.030.36±0.00.29±0.030.52±0.030.56±0.090.55±0.050.47±0.040.51±0.060.50±0.04Mv-3-O-(6-O-coumaryl)-glu-acetaldehyde0.00±0.000.34±0.010.00±0.000.26±0.050.00±0.000.16±0.050.23±0.050.21±0.070.22±0.050.27±0.030.27±0.060.26±0.03Cis-Mv-3-O-(6-O-p-coumaryl)-glu0.47±0.030.36±0.020.25±0.030.21±0.020.24±0.00.26±0.030.51±0.040.55±0.080.57±0.090.51±0.020.55±0.040.53±0.04Pn-3-O-caffeoylglu0.37±0.031.28±0.040.44±0.040.39±0.030.47±0.030.53±0.040.59±0.060.64±0.040.60±0.050.62±0.040.56±0.040.65±0.05Mv-3-O-caffeoylglu------5.12±0.874.99±0.355.16±0.335.62±0.535.55±0.545.41±0.67总量85.89±2.3152.39±0.056.38±3.2123.57±2.1228.70±1.3150.98±3.44100.45±6.7794.19±5.6398.11±4.5992.40±5.9896.93±3.4996.77±6.58
注:-代表未检出
2.2.2 振动方式对葡萄酒单体酚的影响
2.2.2.1 红葡萄酒单体酚变化分析
酚类化合物是葡萄酒的重要组成部分。葡萄酒中的酚类物质包括单宁、花色苷、酚酸类化合物等,作为葡萄酒的骨架成分赋予其颜色、口感、气味,是决定葡萄酒品质的关键因素[14-17]。采用UPLC分析在赤霞珠和梅鹿辄葡萄酒中都检测了20种单体酚(图2),分别是:没食子酸(1号峰)、安息香酸(2号峰)、儿茶素(3号峰)、绿原酸(4号峰)、香草酸(5号峰)、咖啡酸(6号峰)、丁香酸(7号峰)、表儿茶素(8号峰)、对香豆酸(9号峰)、阿魏酸(10号峰)、芦丁(11号峰)、水杨酸(12号峰)、香豆素(13号峰)、杨梅素(14号峰)、白藜芦醇(15号峰)、桑色素(16号峰)、槲皮素(17号峰)、山奈酚(18号峰)、桔皮素(19号峰)和异鼠李素(20号峰)。
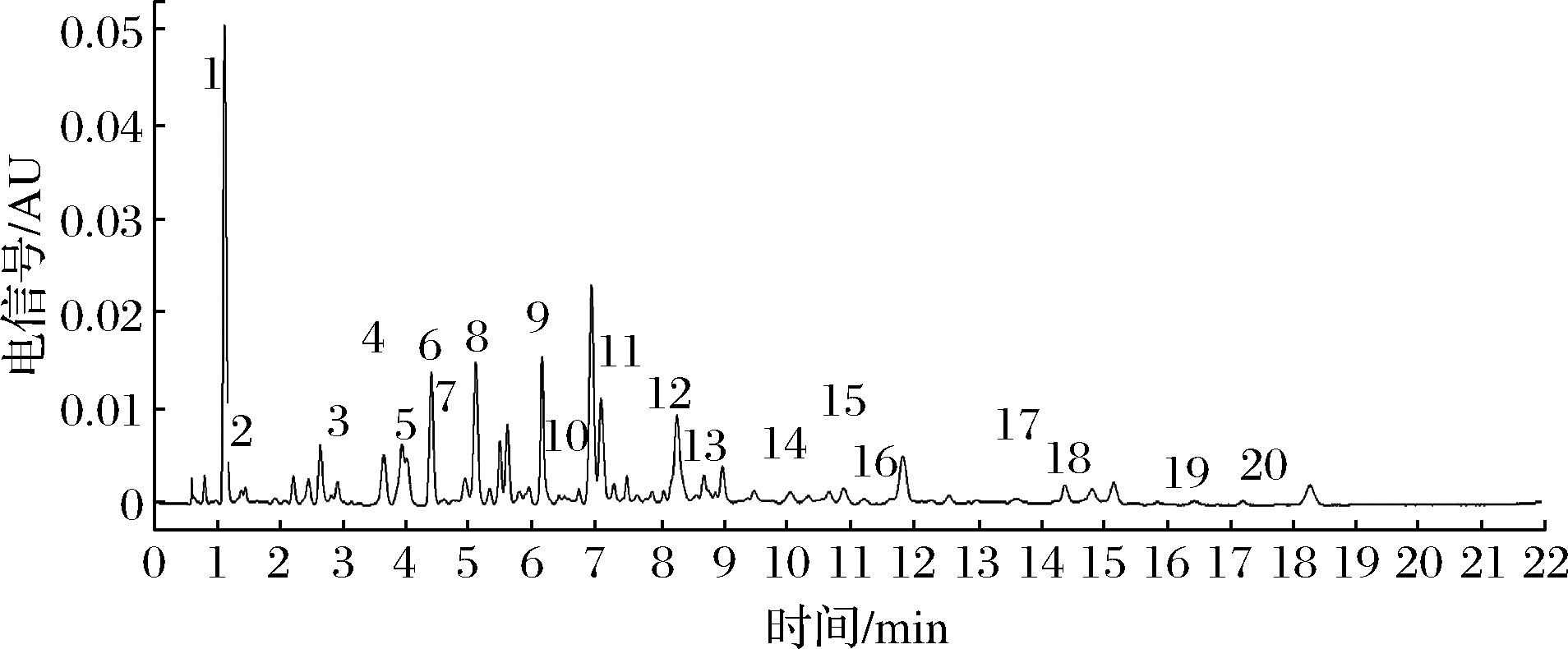
图2 未经振动处理时梅鹿辄葡萄酒的单体酚色谱图
Fig.2 Chromatogram of phenols in Merlot wines without vibration treatment
由表5可知,振荡会使红葡萄酒中酚类物质总量呈明显下降趋势,且振动强度越大,酚类物质减少越多。儿茶素、绿原酸、表儿茶素、芦丁、杨梅素和桑色素的含量经过不同振动方式处理后,含量出现大幅变化;2种葡萄酒中的槲皮素和异鼠李素经过振动处理后消失;赤霞珠红葡萄酒中未检测出桔皮素,而梅鹿辄红葡萄酒中微量的桔皮素经过振动处理后降至0;除了阿魏酸、芦丁、水杨酸和香豆素4种单体酚的含量经过振动处理后有不同程度的增加,其他14种单体酚的含量都随振动处理减少。
表5 振动方式对红葡萄酒单体酚含量影响 单位:mg/L
Table 5 Effect of vibration modes on the phenolic content of red wines

种类赤霞珠红葡萄酒梅鹿辄红葡萄酒对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动没食子酸29.94±1.1219.12±0.2319.77±0.4519.10±0.7821.01±1.2321.98±1.4539.03±2.3425.45±0.2537.91±0.2321.93±0.8925.36±1.3428.26±1.11安息香酸13.08±0.895.33±0.4313.52±0.784.81±0.315.56±0.335.98±0.337.78±0.232.99±0.157.08±0.452.45±0.122.55±0.314.01±0.23儿茶素29.28±0.998.83±0.5611.62±0.786.55±0.758.16±0.1615.33±0.6842.61±2.3115.63±0.8842.12±0.2314.82±0.8417.27±0.4541.12±0.45绿原酸40.56±1.4315.27±0.5723.86±1.3212.80±0.9414.63±0.6716.80±0.9239.59±1.8935.64±0.6936.01±0.3512.43±0.142.64±0.1418.55±0.14香草酸8.96±0.563.92±0.128.48±0.443.58±0.333.86±0.456.42±0.126.56±0.513.19±0.136.03±0.654.01±0.214.68±0.234.07±0.31咖啡酸6.79±0.231.25±0.046.41±0.326.62±0.451.08±0.071.50±0.098.08±0.453.44±0.216.78±0.426.18±0.146.36±0.317.51±0.41丁香酸5.59±0.342.05±0.126.23±0.141.67±0.151.84±0.122.76±0.315.21±0.331.79±0.095.24±0.136.89±0.131.37±0.333.81±0.19表儿茶素17.12±0.783.14±0.1314.18±0.234.40±0.258.44±0.3417.04±0.2141.77±2.1220.03±0.8740.55±0.4118.25±0.5618.75±0.3129.69±1.21对香豆酸9.11±0.349.63±0.349.14±0.439.18±0.569.94±0.568.04±0.0917.08±0.8917.17±0.4516.68±0.5417.28±0.8816.95±0.2213.16±0.41阿魏酸0.98±0.231.32±0.212.20±0.121.24±0.111.27±0.091.02±0.090.51±0.110.87±0.760.66±0.130.73±0.050.88±0.110.41±0.05芦丁1.04±0.0913.99±1.0113.36±0.322.58±0.243.18±0.111.45±0.1317.81±0.5810.10±0.4415.06±0.5611.90±0.4115.64±0.8914.42±0.32水杨酸2.09±0.145.80±0.059.57±0.139.20±0.6614.50±0.139.16±0.138.38±0.6715.94±1.3211.57±0.7114.68±0.2319.16±0.5920.87±0.98香豆素0.65±0.060.80±0.041.97±0.221.91±0.111.90±0.121.56±0.140.75±0.092.46±0.111.73±0.212.36±0.142.16±0.121.67±0.12杨梅素2.82±0.121.60±0.132.00±0.071.47±0.091.50±0.112.24±0.1111.14±0.671.19±0.152.05±0.3112.81±0.540.36±0.131.81±0.21白藜芦醇3.30±0.230.06±0.014.24±0.234.89±0.235.32±0.436.08±0.548.81±0.564.20±0.343.73±0.224.01±0.344.09±0.294.40±0.12桑色素16.15±0.231.44±0.135.09±0.161.36±0.091.43±0.235.06±0.3413.94±0.981.38±0.315.03±0.151.37±0.121.22±0.095.14±0.22槲皮素10.13±0.490000010.87±0.7700000山奈酚0.44±0.020.03±0.010.12±0.030.03±0.010.03±0.10.12±0.045.46±0.330.03±0.010.14±0.020.03±0.010.05±0.010.11±0.09桔皮素0000003.54±0.2300000异鼠李素0.18±0.03000006.94±0.3300000总量165.56±3.21118.87±4.31151.76±3.2491.39±2.98103.65±3.43122.54±4.32290.69±4.54165.45±5.31240.03±3.43152.13±3.78139.49±2.39199.01±3.41
2.2.2.2 白葡萄酒单体酚变化分析
白葡萄酒中酚类物质含量相对较少。由表6可知,2种白葡萄酒单体酚种类差异较大,霞多丽葡萄酒中含有大量的儿茶素、绿原酸和桑色素,而贵人香白葡萄酒则含有大量的安息香酸、儿茶素、咖啡酸、表儿茶素、对香豆酸和桑色素。与红葡萄酒类似,各种振动方式均使葡萄酒中酚类物质总量呈下降趋势,且振动强度越大,酚类物质减少的越多。实验所用2种白葡萄酒中的儿茶素和绿原酸经过振动处理后都出现大幅度下降;咖啡酸和白藜芦醇经过振动处理后大幅度增加;其他15种单体酚在振动后出现微量的减少。
表6 不同振动方式处理后白葡萄酒单体酚含量 单位:mg/L
Table 6 The phenolic content of white wine after different vibration treatments

种类霞多丽白葡萄酒贵人香白葡萄酒对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动没食子酸1.21±0.090.27±0.031.03±0.141.08±0.111.14±0.091.03±0.061.25±0.120.15±0.031.05±0.070.92±0.091.10±0.031.12±0.09安息香酸0.80±0.021.23±0.141.04±0.071.72±0.212.02±0.121.81±0.111.65±0.110.97±0.111.24±0.111.19±0.111.56±0.061.35±0.11儿茶素9.50±0.323.13±0.236.51±0.135.83±0.128.42±0.138.32±0.3429.08±0.6722.38±0.9428.26±1.5421.30±1.8923.52±1.5626.97±0.98绿原酸8.46±0.127.82±0.417.04±0.346.08±0.338.07±0.173.71±0.133.44±0.310.38±0.033.81±0.130.31±0.090.64±0.042.60±0.21香草酸1.15±0.090.85±0.131.13±0.071.08±0.060.07±0.021.12±0.071.16±0.060.38±0.020.63±0.090.40±0.050.56±0.050.99±0.06咖啡酸0.07±0.013.04±0.232.14±0.213.58±0.213.57±0.052.25±0.083.30±0.2314.44±1.0911.46±0.7413.55±0.126.24±0.3410.84±0.64丁香酸0.58±0.040.86±0.040.68±0.091.30±0.090.85±0.110.63±0.120.16±0.050.11±0.020.15±0.120.17±0.050.15±0.020.19±0.11表儿茶素0.34±0.020.29±0.030.31±0.080.30±0.030.32±0.090.29±0.068.14±0.390.47±0.071.12±0.091.04±0.071.23±0.091.71±0.12对香豆酸0.22±0.010.44±0.060.29±0.090.35±0.020.44±0.090.48±0.052.10±0.142.47±0.152.03±0.122.27±0.212.12±0.121.94±0.09阿魏酸0.07±0.010.38±0.110.05±0.020.43±0.060.42±0.110.05±0.010.74±0.110.15±0.030.14±0.040.07±0.010.14±0.030.51±0.06芦丁000000000000水杨酸1.58±0.212.36±0.121.80±0.120.35±0.031.17±0.113.40±0.121.54±0.130.94±0.060.73±0.050.25±0.020.36±0.051.05±0.13香豆素0.40±0.030.33±0.060.13±0.060.35±0.070.31±0.030.12±0.052.85±0.150.06±0.031.42±0.091.09±0.072.05±0.041.76±0.11杨梅素0.78±0.040.37±0.090.94±0.070.31±0.050.40±0.020.47±0.070.75±0.061.25±0.120.81±0.070.33±0.060.32±0.031.05±0.09白藜芦醇0.14±0.020.41±0.130.42±0.090.42±0.070.44±0.020.39±0.060.63±0.053.14±0.131.66±0.122.92±0.132.32±0.123.06±0.21桑色素5.01±0.120.75±0.154.23±0.321.24±0.121.28±0.124.91±0.154.89±0.121.24±0.094.86±0.451.23±0.082.13±0.213.65±0.32槲皮素0000002.33±0.1600000山奈酚0.19±0.020.03±0.010.12±0.010.03±0.010.03±0.010.15±0.020.40±0.030.03±0.010.14±0.030.04±0.010.03±0.010.11±0.02桔皮素000000000000异鼠李素0000000.0100000总量30.50±1.3122.56±1.4527.86±2.2224.45±1.9828.65±1.5629.13±2.4564.42±3.4848.56±4.3259.51±3.4247.08±2.4844.47±3.4158.90±4.32
红葡萄酒和白葡萄酒经振动处理之后,单体酚总量均出现下降的趋势,且与振动大小正相关。但是所检测的20种单体酚的变化略有不同。红葡萄酒中阿魏酸、芦丁、水杨酸和香豆素4种单体酚的含量经过振动处理后有不同程度的增加,而白葡萄酒中咖啡酸的含量大幅度增加。
2.3 振动方式对葡萄酒颜色的影响
CIE1976Lab(或Lab)系统中,参数a*表示红绿色程度;b*表示黄蓝色程度;L*表示颜色的明暗和层次;![]() 表征颜色集中于色调的程度即色彩饱和度;hab表示色调角;
表征颜色集中于色调的程度即色彩饱和度;hab表示色调角;![]() 表示总色差,可反映L*、a*、b*的综合色差值。
表示总色差,可反映L*、a*、b*的综合色差值。
如表7、表8所示,4款酒样经过不同振动方式处理后的L*值均较高。分别以未经振动处理的实验所用4款酒样作为参照酒样,ΔL*均为正值,说明漩涡振动、摇床振动、压缩机振动和车载振动颜色均亮于原始酒样,振动处理对明亮度无负面影响。Δa*和Δb*均为负值,说明振动处理后的酒样红色色调、黄色色调均有减少。总体上,不同振动方式处理的同一款酒在颜色外观上差别不明显。
表7 不同振动方式处理后红葡萄酒样品CIELab参数值
Table 7 CIELab parameter values of red wine samples after different vibration treatments
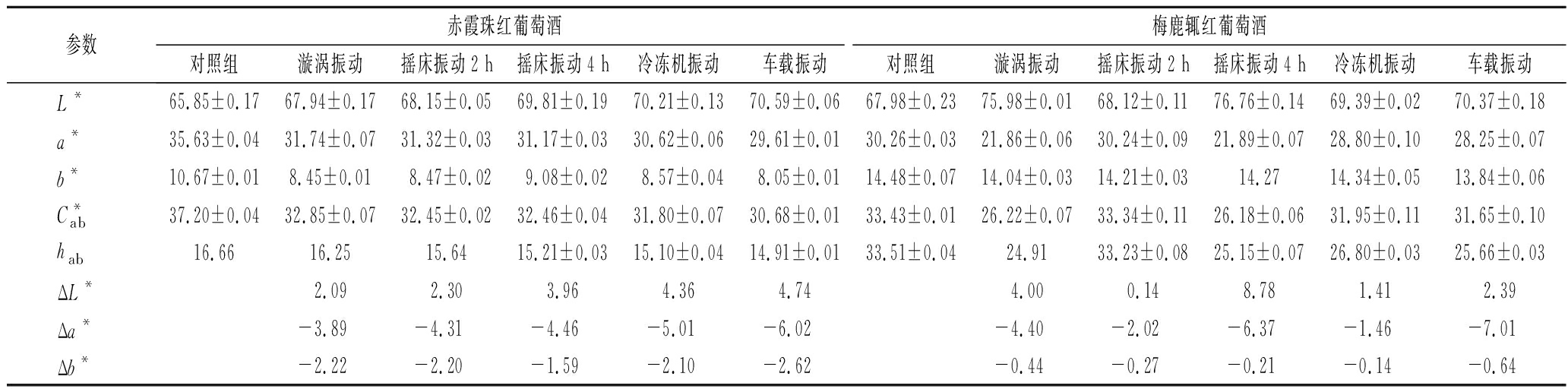
参数赤霞珠红葡萄酒梅鹿辄红葡萄酒对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动L*65.85±0.1767.94±0.1768.15±0.0569.81±0.1970.21±0.1370.59±0.0667.98±0.2375.98±0.0168.12±0.1176.76±0.1469.39±0.0270.37±0.18a*35.63±0.0431.74±0.0731.32±0.0331.17±0.0330.62±0.0629.61±0.0130.26±0.0321.86±0.0630.24±0.0921.89±0.0728.80±0.1028.25±0.07b*10.67±0.018.45±0.01 8.47±0.02 9.08±0.02 8.57±0.04 8.05±0.0114.48±0.0714.04±0.0314.21±0.0314.2714.34±0.0513.84±0.06C*ab37.20±0.0432.85±0.0732.45±0.0232.46±0.0431.80±0.0730.68±0.0133.43±0.0126.22±0.0733.34±0.1126.18±0.0631.95±0.1131.65±0.10hab16.6616.2515.6415.21±0.0315.10±0.0414.91±0.0133.51±0.0424.9133.23±0.0825.15±0.0726.80±0.0325.66±0.03ΔL*2.092.303.964.364.744.000.148.781.412.39Δa*-3.89-4.31-4.46-5.01-6.02-4.40-2.02-6.37-1.46-7.01Δb*-2.22-2.20-1.59-2.10-2.62-0.44-0.27-0.21-0.14-0.64
表8 不同振动方式处理后白葡萄酒样品CIELab参数值
Table 8 CIELab parameter values of white wine samples after different vibration treatments
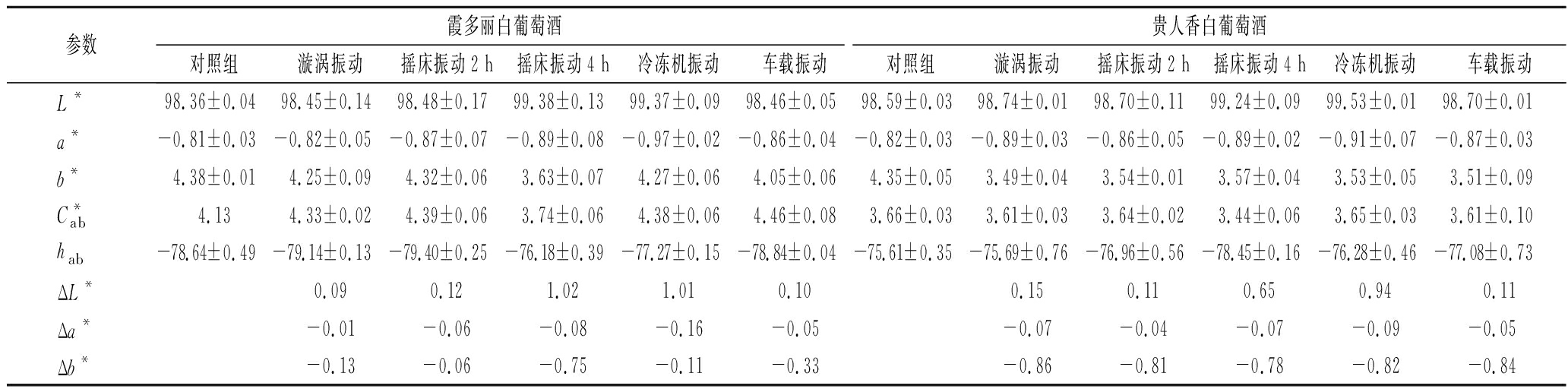
参数霞多丽白葡萄酒贵人香白葡萄酒对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动对照组漩涡振动摇床振动2 h摇床振动4 h冷冻机振动车载振动L*98.36±0.0498.45±0.1498.48±0.1799.38±0.1399.37±0.0998.46±0.0598.59±0.0398.74±0.0198.70±0.1199.24±0.0999.53±0.0198.70±0.01a*-0.81±0.03-0.82±0.05-0.87±0.07-0.89±0.08-0.97±0.02-0.86±0.04-0.82±0.03-0.89±0.03-0.86±0.05-0.89±0.02-0.91±0.07-0.87±0.03b*4.38±0.014.25±0.094.32±0.063.63±0.074.27±0.064.05±0.064.35±0.053.49±0.043.54±0.013.57±0.043.53±0.053.51±0.09C*ab4.134.33±0.024.39±0.063.74±0.064.38±0.064.46±0.083.66±0.033.61±0.033.64±0.023.44±0.063.65±0.033.61±0.10hab-78.64±0.49-79.14±0.13-79.40±0.25-76.18±0.39-77.27±0.15-78.84±0.04-75.61±0.35-75.69±0.76-76.96±0.56-78.45±0.16-76.28±0.46-77.08±0.73ΔL*0.090.121.021.010.100.150.110.650.940.11Δa*-0.01-0.06-0.08-0.16-0.05-0.07-0.04-0.07-0.09-0.05Δb*-0.13-0.06-0.75-0.11-0.33-0.86-0.81-0.78-0.82-0.84
3 讨论与结论
振动处理葡萄酒后,酒度、总糖、总酸和干浸出物均有下降的趋势。挥发酸含量有所上升,但没有超过国标规定标准。其中总糖含量下降幅度偏大。可能是葡萄酒仍处于未发酵完全的状态,经4周振动处理后,葡萄酒仍缓慢发酵,总糖含量的大幅度变化一部分可归因于发酵。
振动使葡萄酒L*(明亮度)增加,a*(红绿色程度)和b*(黄蓝色程度)减少。未经振动处理的葡萄酒除了明亮度L*值是最低之外,其余参数均最大。与CHUNG等[18]的实验结果相似,花色苷种类和含量都直接影响葡萄酒色度、色调和稳定性[19-20]。振动显著降低葡萄酒花色苷和单体酚含量,随着振动强度和振动时间的增加,花色苷和单体酚总量降低幅度更大。摇床振动4周之后,总花色苷含量下降40.3%,其次是车载振动,其余3种振动方式花色苷下降幅度基本相同,表明振动强度是影响花色苷含量的重要因素。二甲花翠素-3-葡萄糖苷和二甲花翠素-3-乙酰化-葡萄糖苷降低百分率最高,而甲基花青素-3-乙酰化-葡萄糖苷含量增加;振动显著降低儿茶素、绿原酸、桑色素和槲皮素含量;水杨酸和咖啡酸含量增加。振动可能是通过加速葡萄酒的流动,进而有助于花色苷、非花色苷单体酚与其他化合物如还原糖,有机酸和蛋白质等反应形成复合物或者直接造成化合物降解。因此,葡萄酒在贮藏和运输过程中应尽可能减少振动。
[1] SUN X Y, CHENG X H, ZHANG J Z, et al.Letting wine polyphenols functional:Estimation of wine polyphenols bioaccessibility under different drinking amount and drinking patterns[J].Food Research International, 2020, 127:108 704.
[2] GAO Y, TIAN Y, LIU D, et al.Evolution of phenolic compounds and sensory in bottled red wines and their co-development[J].Food Chemistry, 2015, 172:565-574.
[3] GUO A Q, KONTOUDAKIS N, SCOLLARY G R, et al.Production and isomeric distribution of xanthylium cation pigments and their precursors in wine-like conditions:Impact of Cu(II), Fe(II), Fe(III), Mn(II), Zn(II), and Al(III)[J].Journal of Agricultural and Food Chemistry, 2017, 65(11):2 414-2 425.
[4] SUN X Y, MA T T, HAN L Y, et al.Effects of copper pollution on the phenolic compound content, color and antioxidant activity of wine[J].Molecules, 2017, 22(5):726.
[5] RISTIC R, HULST L V D, CAPONE D L, et al.Impact of bottle aging on smoke-tainted wines from different grape cultivars[J].Journal of Agricultural and Food Chemistry, 2017, 65(20):4 146-4 152.
[6] 李运奎, 韩富亮, 张予林, 等.基于CIELAB色空间的红葡萄酒颜色直观表征[J].农业机械学报, 2017, 48(6):296-301.
LI Y K, HAN F L, ZHANG Y L, et al.Visualization for representation of red wine color based on CIELAB color space[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(6):296-301.
[7] YANG P, YUAN C L, WANG H, et al.Stability of anthocyanins and their degradation products from Cabernet Sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules, 2018, 23(2):354.
[8] 张星星, 郭安鹊, 韩富亮,等.UPLC快速测定葡萄酒中酚类物质的方法[J].食品科学, 2016, 37(10):128-133.
ZHANG X X, GUO A Q, HAN F L.Fast determination of phenolics and polyphenolics in wine by ultra performance liquid chromatography[J].Food Science, 2016, 37(10):128-133.
[9] CHENG X H, WANG X F, ZHANG A, et al.Foliar phenylalanine application promoted antioxidant activities in Cabernet Sauvignon by regulating phenolic biosynthesis[J].Journal of Agricultural and Food Chemistry, 2020, 68(52):15 390-15 402.
[10] SUN X Y, LI L, MA T T, et al.High hydrostatic pressure treatment:An artificial accelerating aging method which did not change the region and variety non-colored phenolic characteristic of red wine[J].Innovative Food Science & Emerging Technologies, 2016, 33:123-134.
[11] MA T T, WANG J Q, WANG L K, et al.Ultrasound-combined sterilization technology:An effective sterilization technique ensuring the microbial safety of grape juice and significantly improving its quality[J].Foods, 2020, 9(10):1 512.
[12] 李婉平, 刘敏, 王皆行, 等.炎热气候条件下抗蒸腾剂对酿酒葡萄光合特性与葡萄酒品质的影响[J].中国农业科学, 2019, 52(17):3 008-3 019.
LI W P, LIU M, WANG J X, et al.Influence of anti-transpirant on photosynthesis characteristic and qualities of wines in hot climate[J].Scientia Agricultura Sinica, 2019, 52(17):3 008-3 019.
[13] 孙翔宇, 杜国荣, 马婷婷, 等.陕西市售国产葡萄酒中多酚类物质的特征与抗氧化能力分析[J].现代食品科技, 2014, 30(8):242-250;218.
SUN X Y, DU G R, MA T T, et al.Polyphenol composition and antioxidant activity of domestic wines from Shaanxi Province[J].Modern Food Science and Technology, 2014, 30(8):242-250;218.
[14] MA T T, SUN X Y, GAO G T, et al.Phenolic characterisation and antioxidant capacity of young wines made from different grape varieties grown in Helanshan Donglu wine zone (China)[J].South African Journal of Enology and Viticulture, 2014, 35(2):321-331.
[15] SUN X Y, CHEN X H, LI L, et al.Effect of ultra-high pressure treatment on the chemical properties, color and sensory quality of young red wine[J].South African Journal of Enology and Viticulture, 2015, 36(3):393-401.
[16] CANAS S, CALDEIRA I, ANJOS O, et al.Phenolic profile and colour acquired by the wine spirit in the beginning of ageing:Alternative technology using micro-oxygenation vs traditional technology[J].LWT, 2019, 111:260-269.
[17] LI S Y, DUAN C Q.Astringency, bitterness and color changes in dry red wines before and during oak barrel aging:An updated phenolic perspective review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(12):1 840-1 867.
[18] CHUNG H J, SON J H, PARK E Y,et al.Effect of vibration and storage on some physico-chemical properties of a commercial red wine[J].Journal of Food Composition and Analysis, 2008, 21(8):655-659.
[19] YANG B H, HE S, LIU Y, et al.Transcriptomics integrated with metabolomics reveals the effect of regulated deficit irrigation on anthocyanin biosynthesis in Cabernet Sauvignon grape berries[J].Food Chemistry, 2020, 314:126 170.
[20] ZHANG B, YANG X S, LI, N N, et al.Colorimetric study of malvidin-3-O-glucoside copigmented by phenolic compounds:The effect of molar ratio, temperature, pH, and ethanol content on color expression of red wine model solutions[J].Food Research International, 2017, 102:468-477.