牛肉因其具有高蛋白低脂肪、营养丰富和味道鲜美等特点,深受消费者的青睐[1]。随着社会的发展、人们生活质量的不断提高,对肉制品安全和品质的关注度也逐渐提高。冷鲜牛肉因其嫩度好、颜色新鲜和营养价值高而优于冷冻和冷藏牛肉[2]。但在贮藏、运输和销售环节中,易受到外部微生物或自身酶的影响,发生脂肪和蛋白氧化,从而导致腐败变质[1,3],同时氧化产生的系列产物会影响肉品的品质以及营养价值,导致色泽劣变、风味恶化、营养物质损失等[4-6]。目前,添加抗氧化剂是防止肉制品中脂肪和蛋白氧化的方法之一,但人工合成的抗氧化剂存在较多的安全隐患,对人体健康具有不利影响,甚至能致癌[7]。天然抗氧剂因其具有较高的安全性、抗氧化能力和一定的保鲜作用,越来越受到人们的青睐[8]。因此,天然抗氧化剂在肉及肉制品中的应用成为人们关注和研究的热点。
多酚类物质是一类具有生物活性的植物次生代谢产物[9],广泛分布于植物的根、茎、叶、皮和果中,在自然界的储量非常丰富[10]。研究表明,植物多酚因具有抗氧化、抗菌和抗炎等特性[11-12],开发前景良好。这些特性能改善肉品质,并且能够抑制肉制品中微生物的生长、延缓脂肪和蛋白氧化,从而延长其保质期[8]。甜瓜营养丰富,含有大量的可溶性糖、维生素C、氨基酸、有机酸和可溶性蛋白质等物质[13],其果肉性寒,具有利尿、除烦热等功效[14]。目前甜瓜主要以鲜品和甜瓜干形式销售,其他形式的产品较为少见,而甜瓜皮和不少残次瓜被随意丢弃或者直接喂养牲畜,这造成很大的农产品资源浪费,既浪费资源又污染环境。植物多酚提取方法主要有超声波辅助法、溶剂浸提法、微波提取法、超临界CO2提取法、生物酶解提取法以及超高压提取法等[15]。超声波辅助法是利用超声波的机械和空化作用从而产生振动使细胞壁破碎,有效成分短时间被释放,减少了多酚的氧化破坏[16]。相比传统方法,超声波辅助法耗时短、提取率高,近年来受到广泛应用[15]。然而,目前采用超声波辅助法提取甜瓜皮中多酚且甜瓜皮多酚在肉及肉制品贮藏中的影响,国内外鲜有文献报道。
本文采用超声波辅助法提取甜瓜皮多酚,响应面法优化多酚提取工艺,选用不同浓度甜瓜皮多酚保鲜牛肉,在4 ℃条件贮藏,分别在第0、1、3、5、7、9天测定牛肉的pH、色度、挥发性盐基氮(total volatile base nitrogen,TVB-N)、硫代巴比妥酸反应物(thiobarbituric acid reactant substances,TBARS)值并结合感官评价,探究甜瓜皮多酚对牛肉保鲜过程中品质的变化,旨在为甜瓜皮的深加工和利用、延缓和降低肉制品贮藏过程中的品质劣变提供参考。
1 材料与方法
1.1 材料与试剂
“玛瑙”厚皮甜瓜,甘肃省民勤县收成乡露地栽培大田,将瓜皮打浆破碎,于-18 ℃冰箱中保存,使用前置于4 ℃的冰箱中融解备用;牛肉,甘肃省武威市天祥肉类加工有限公司。
没食子酸标准品、福林酚试剂,上海源叶生物科技有限公司;无水乙醇、乙酸乙酯、无水碳酸钠、三氯乙酸、硼酸、甲基红、溴甲酚绿、乙二胺四乙酸二钠、2-硫代巴比妥酸,天津市光复科技发展有限公司。
1.2 仪器与设备
KQ-500E型超声波清洗器,昆山市超声仪器有限公司;TGL-24MC高速冷冻离心机,长沙英泰仪器有限公司;PHS-3C数显酸度计,上海宇隆仪器有限公司;RE52CS型旋转蒸发仪,上海雅荣生化仪器有限公司;CR-10型色度计,柯尼美能达有限公司;WFZ UV-2802SH型紫外可见分光光度计,上海柯仪器有限公司;K9840型自动凯氏定氮仪,济南海能仪器有限公司。
1.3 实验方法
1.3.1 甜瓜皮多酚的提取
甜瓜皮多酚的提取工艺流程如下:
甜瓜皮→破碎、打浆→超声波辅助提取→抽滤→多酚粗提液→离子沉淀纯化→乙酸乙酯萃取→旋转蒸发浓缩→多酚提取液→真空冷冻干燥→多酚粉末
1.3.2 标准曲线的绘制
用福林-酚法测定[17]。称量20 mg没食子酸于20 mL 容量瓶,加蒸馏水溶解并定容,配制质量浓度为1 mg/mL的没食子酸标准液。分别吸取1、2、3、4、5 mL上述标准液于100 mL容量瓶,定容,稀释成质量浓度为0.01、0.02、0.03、0.04、0.05 mg/mL。各取1 mL置于10 mL具塞比色管,加入0.25 mL福林酚试剂,室温下反应5 min 后加入15%(质量分数)Na2CO3溶液1 mL,定容,50 ℃水浴10 min,冷却,在760 nm处测定吸光度。
1.3.3 多酚提取率的测定
取甜瓜皮多酚粗提液1.0 mL,按没食子酸标准曲线制作的方法进行测定。平行测定3次,取平均值。通过线性回归方程计算甜瓜皮多酚浓度,多酚提取率计算如公式(1)所示:
提取率![]()
(1)
式中:C表示多酚质量浓度,mg/mL;V表示粗提液体积mL;n表示稀释倍数;m表示原料质量,g。
1.3.4 单因素试验
分别考察乙醇体积分数(40%、50%、60%、70%、80%)、液料比[5∶1、10∶1、15∶1、20∶1、25∶1(mL∶g),后同]、超声时间(30、60、90、120、150 min)、超声温度(30、40、50、60、70 ℃)对提取率的影响。
1.3.5 响应面试验优化
在单因素试验的基础上,对乙醇体积分数、液料比、超声时间和超声温度设计4因素3水平试验。
1.3.6 肉样处理
开启紫外线灯杀菌30 min,在无菌环境下去除脂肪和筋膜,将肉块分割成方形,每块大约100 g。分别用无菌水和不同浓度的多酚浓缩液浸泡约5 min,取出沥干2~5 min后用无菌保鲜袋分装于4 ℃冷藏条件保存,在第0、1、3、5、7、9天对各项指标进行测定。
1.3.7 指标测定
1.3.7.1 pH值
参照杨斌等[2]的方法,用便携式酸度计测定肉样pH值,将酸度计探头插入到肉样中,待酸度计读数稳定后记录。
1.3.7.2 L*值和a*值
参照杨斌等[2]的方法,将牛肉切面自然氧合30 min,校准色差计后,垂直于牛肉切面进行测量。
1.3.7.3 挥发性盐基氮的测定
参照GB 5009.228—2016《食品中挥发性盐基氮的测定》[18]中的半微量定氮法进行测定。
1.3.7.4 硫代巴比妥酸反应物
参照GB 5009.181—2016《食品中丙二醛的测定》[19]中的分光光度法进行测定。
1.3.7.5 感官评价
参考郝瑞等[20]的方法稍作修改进行评定,每项指标满分为10分,具体评分标准见表1。
表1 感官评价表
Table 1 Sensory evaluation table

评分/分色泽气味黏度弹性1~3分颜色鲜红有光泽具有新鲜牛肉的气味,无异味外表微干,不发黏指压后凹陷立即恢复4~6分颜色较鲜红,有光泽具有牛肉气味,但不强烈,无异味略有出水,表面不发黏指压凹陷恢复较慢7~8分色泽有些许发暗,稍有光泽稍有异味,但不明显出水比较多,表面发黏指压后小部分凹陷难以恢复9~10分色泽暗红发褐,无光泽鲜牛肉特有的气味消失,且有臭味出水比较多,表面发黏严重指压后大部分凹陷不能恢复,并留有痕迹
1.4 数据统计与分析
试验均平行3次,数据取平均值±标准偏差表示,试验数据采用Origin 9.0软件绘图和SPSS 19.0对数据进行统计分析,采用单因素方差分析(ANOVA)和多重比较(Duncan法),差异显著水平为0.05,Design Expert 8软件进行响应面优化处理。
2 结果与分析
2.1 单因素结果分析
图1-a为乙醇体积分数对多酚提取率的影响,多酚提取率随乙醇体积分数的上升逐渐增大,当乙醇体积分数为60%时,多酚提取率最高,且显著,高于乙醇体积分数为50%的多酚提取率(P<0.05),其原因可能是乙醇体积分数在一定的条件下,能有效促进多酚类物质的溶解[17]。继续增大乙醇体积分数,多酚提取率变化差异不显著,可能是因为乙醇体积分数增大,一些弱极性成分、醇溶性色素等杂质溶解,抑制了有效多酚物质的充分溶出[15]。因此,选择乙醇体积分数为60%。

a-乙醇体积分数;b-液料比;c-超声时间;d-超声温度
图1 乙醇体积分数、液料比、超声时间、超声温度对甜瓜皮多酚提取率的影响
Fig.1 Effect of ethanol volume fraction, liquid-material ratio, ultrasonic time and ultrasonic temperature on extraction rate of
polyphenols from melon peel
注:不同小写字母表示不同处理组间差异显著(P<0.05)(下同)
液料比对多酚提取率的影响如图1-b所示,多酚提取率随液料比的增加先增加后趋于平缓,可能是因为一定体积的乙醇溶剂可以促进多酚类物质的溶出,当液料比为20∶1时,多酚提取率最高,此时多酚类物质的溶解度达到饱和状态[17]。继续增大液料比,多酚提取率变化不显著,可能是因为乙醇溶剂的增加使一些色素和醇溶性等杂质溶解[21],阻止了有效成分的溶出,因此选用液料比为20∶1。
图1-c为超声时间对多酚提取率的影响,多酚提取率随超声时间的延长呈先升高后降低的趋势。这可能是因为超声波使细胞组织破坏,促进多酚类物质溶出,但超声时间过短会导致多酚类物质提取不充分[17],超声60 min时提取率最高。继续延长超声时间,超声波产生强烈的热效应导致一些不稳定多酚被分解转化,同时超声时间过长会使多酚类物质被氧化分解,导致多酚提取率下降[21],故选择超声时间为60 min。
超声温度对多酚提取率的影响如图1-d所示,随超声温度升高,提取率先升高后下降,40 ℃时提取率最高。这可能是因为多酚分子在一定的温度下,渗透、溶解和扩散速度加快,提取率升高[21],但是继续升高超声温度,破坏了多酚的结构,使多酚的氧化和分解加剧,导致提取率降低[21]。因此,选择超声温度为40 ℃。
2.2 响应面试验分析
根据中心组合试验设计原理,对乙醇体积分数(A)、液料比(B)、超声时间(C)、超声温度(D)4个单因素,进行4因素3水平的试验设计。试验设计及结果和方差分析结果分别见表2、表3。
通过统计分析软件Design Expert 8对表2中数据进行拟合分析,得到二次多元回归线性方程:
Y=5.37+0.078A+0.14B-0.005C-0.091D-0.21AB+0.20AC-0.15AD+0.14BC-0.068BD+0.26CD-0.58A2-0.67B2-0.79C2-0.71D2
表2 响应面试验设计及结果
Table 2 Response surface experimental design and results

序号A(乙醇体积分数)B(液料比)C(超声时间)D(超声温度)Y提取率/(mg·g-1)1-10103.67200005.27300114.06400005.1250-1013.746-10-104.07700005.718010-14.29910-103.861010014.0411-100-13.911201104.29130-10-13.891410104.251500005.191601-104.011701013.871800-1-14.21191-1004.242000005.58210-1-103.8822001-13.6623-11004.43240-1103.6225-1-1003.822600-113.582711004.0328-10014.0729100-14.49
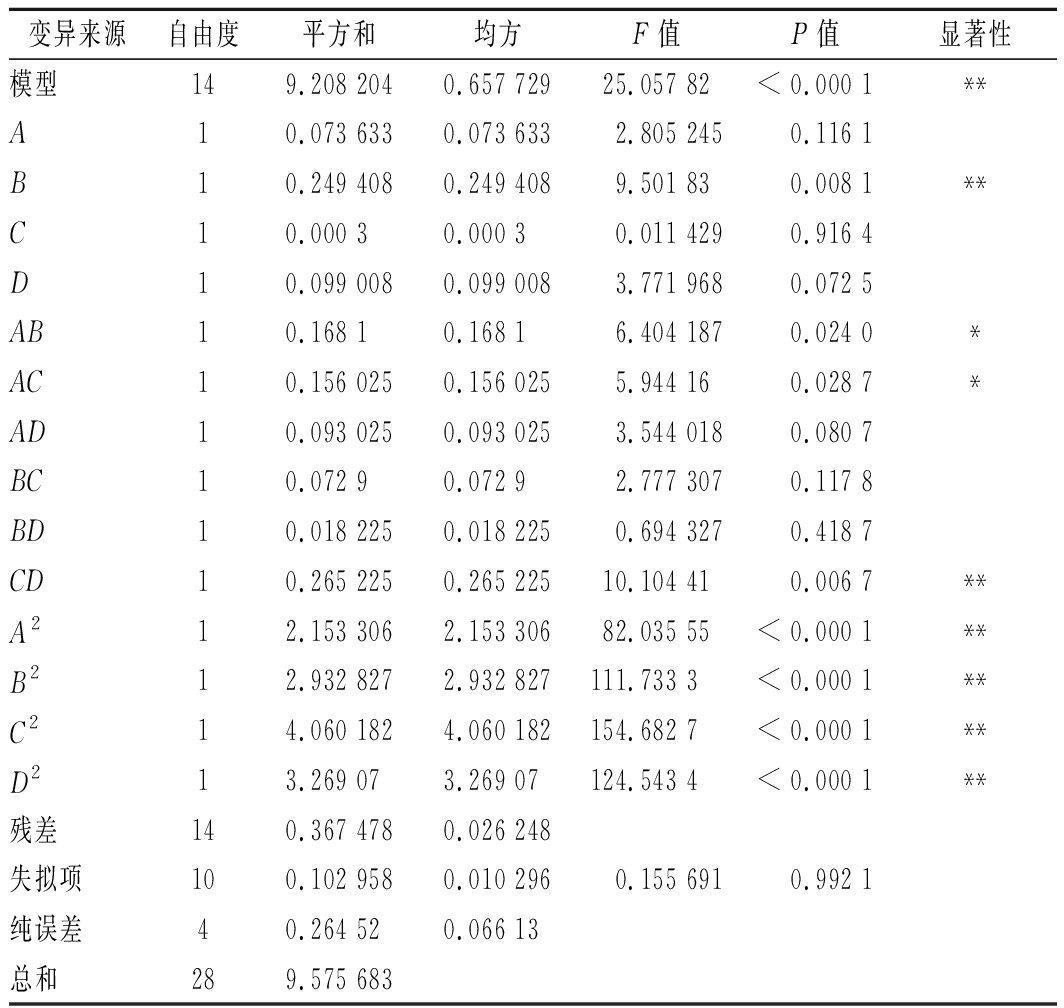
表3 回归方程方差分析
Table 3 Analysis of variance of regression equation
变异来源自由度平方和均方F值P值显著性模型149.208 2040.657 72925.057 82< 0.000 1**A10.073 6330.073 6332.805 2450.116 1B10.249 4080.249 4089.501 830.008 1**C10.000 30.000 30.011 4290.916 4D10.099 0080.099 0083.771 9680.072 5AB10.168 10.168 16.404 1870.024 0*AC10.156 0250.156 0255.944 160.028 7*AD10.093 0250.093 0253.544 0180.080 7BC10.072 90.072 92.777 3070.117 8BD10.018 2250.018 2250.694 3270.418 7CD10.265 2250.265 22510.104 410.006 7**A212.153 3062.153 30682.035 55< 0.000 1**B212.932 8272.932 827111.733 3< 0.000 1**C214.060 1824.060 182154.682 7< 0.000 1**D213.269 073.269 07124.543 4< 0.000 1**残差140.367 4780.026 248失拟项100.102 9580.010 2960.155 6910.992 1纯误差40.264 520.066 13总和289.575 683
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)
回归模型方差分析表明,模型的F=25.06,P<0.000 1,失拟项差异不显著,![]() 说明该模型具有良好的拟合性且能解释92.32%的响应值变化[17]。变异系数为3.82%,小于10%,表明该实验的重复性较好,可信度和准确性较高[17]。
说明该模型具有良好的拟合性且能解释92.32%的响应值变化[17]。变异系数为3.82%,小于10%,表明该实验的重复性较好,可信度和准确性较高[17]。
F值的大小反映因素对响应值的影响程度[21],由F值可知,各个因素对多酚提取率的影响从弱到强依次为液料比、超声温度、乙醇体积分数和超声时间。其中一次项B、二次项、交互项CD对多酚提取率的影响极显著(P<0.01),交互项AB、AC差异显著(P<0.05)。
各因素对甜瓜皮多酚提取率影响的响应面曲线图如图2所示。主要反映了乙醇体积分数、液料比、超声时间和超声温度之间的相互作用关系。响应面图形坡度越陡峭、越倾斜,说明两因素的交互作用越强[17]。由3D图可知超声温度与超声时间交互效应极显著,乙醇体积分数与液料比、乙醇体积分数与超声时间交互效应显著。
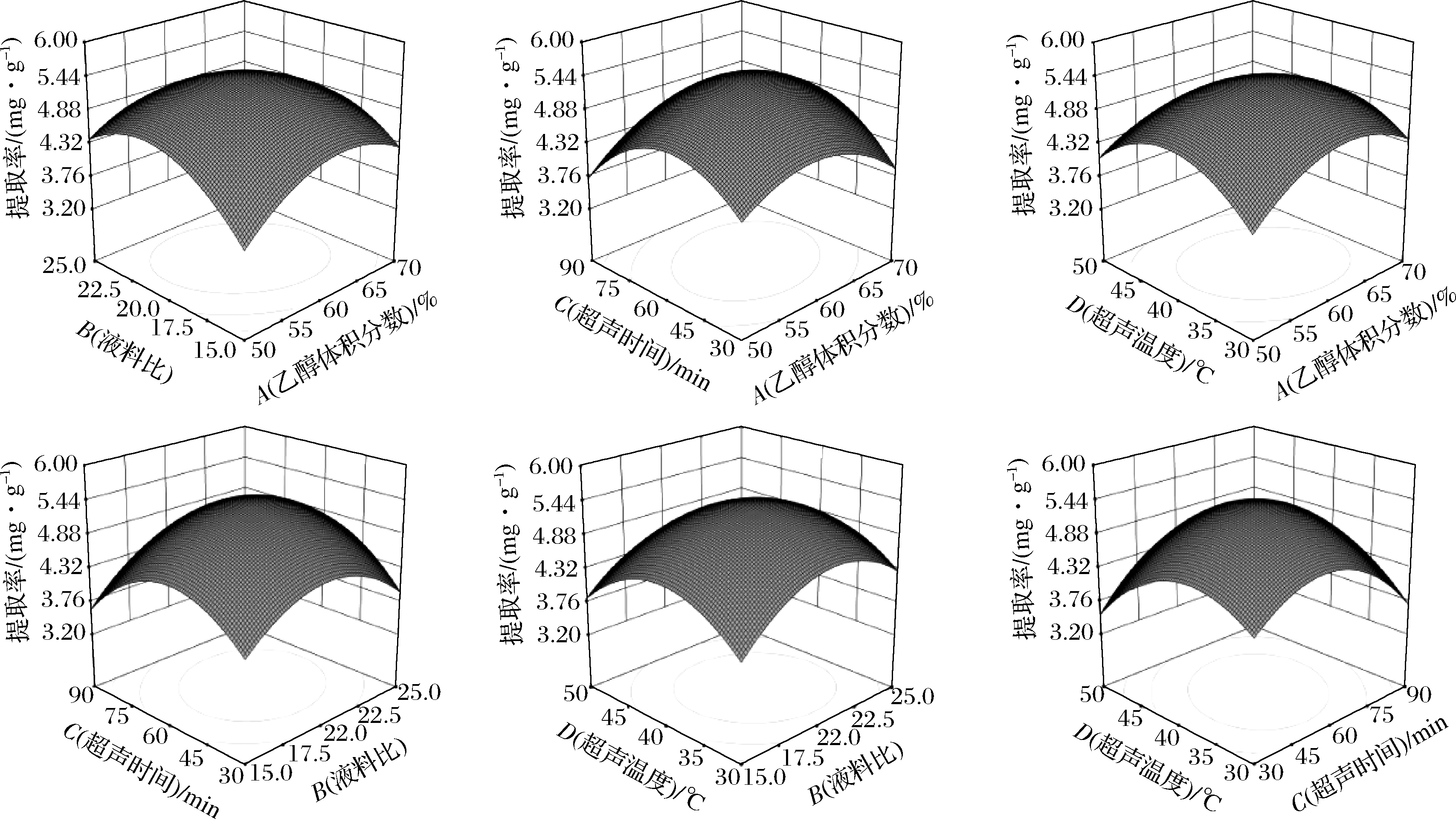
图2 各因素交互作用对多酚提取率影响的响应面曲线图
Fig.2 Response surface curve of the influence of the interaction of various factors on the extraction rate of polyphenols
2.3 最优提取工艺及验证实验
利用响应面优化分析,得到甜瓜皮多酚提取的最优工艺为:乙醇体积分数60.61%,液料比20.51∶1,超声时间60.02 min,超声温度39.25 ℃,此条件下得到的甜瓜皮多酚提取率为5.39 mg/g。但考虑实际操作范围,将提取工艺参数调整为:乙醇体积分数61%,液料比21∶1,超声时间60 min,超声温度 40 ℃。在最优工艺下平行3次验证试验,得到甜瓜皮多酚的平均提取率为5.31 mg/g。与理论预测值的误差为1.5%。因此,利用响应面优化的工艺稳定,可行。
2.4 甜瓜皮多酚对贮藏期间牛肉品质的影响
2.4.1 pH
pH是评价肉类新鲜程度的重要指标之一[2]。根据GB/T 9695.5—2008,pH 5.8~6.2为一级鲜度,pH 6.3~6.6为二级鲜度,高于6.7为变质肉。从图3可以看出,随着贮藏时间的延长,牛肉的pH值均先下降后上升,可能是因为宰后前期动物肌肉发生糖酵解,最终产物是乳酸,导致pH值下降,随贮藏时间的延长,在内源酶和微生物的作用下使蛋白分解产生碱性含氮物质,致使肉的pH上升[23]。对照组pH值均显著低于处理组,且pH值随添加量的增加升高缓慢,对照组在第9天时,pH值为6.44,多酚处理组在第9天时pH均显著低于对照组,这说明多酚对冷却肉具有很强的抑菌作用和保鲜效果,可以延长牛肉的保质期。
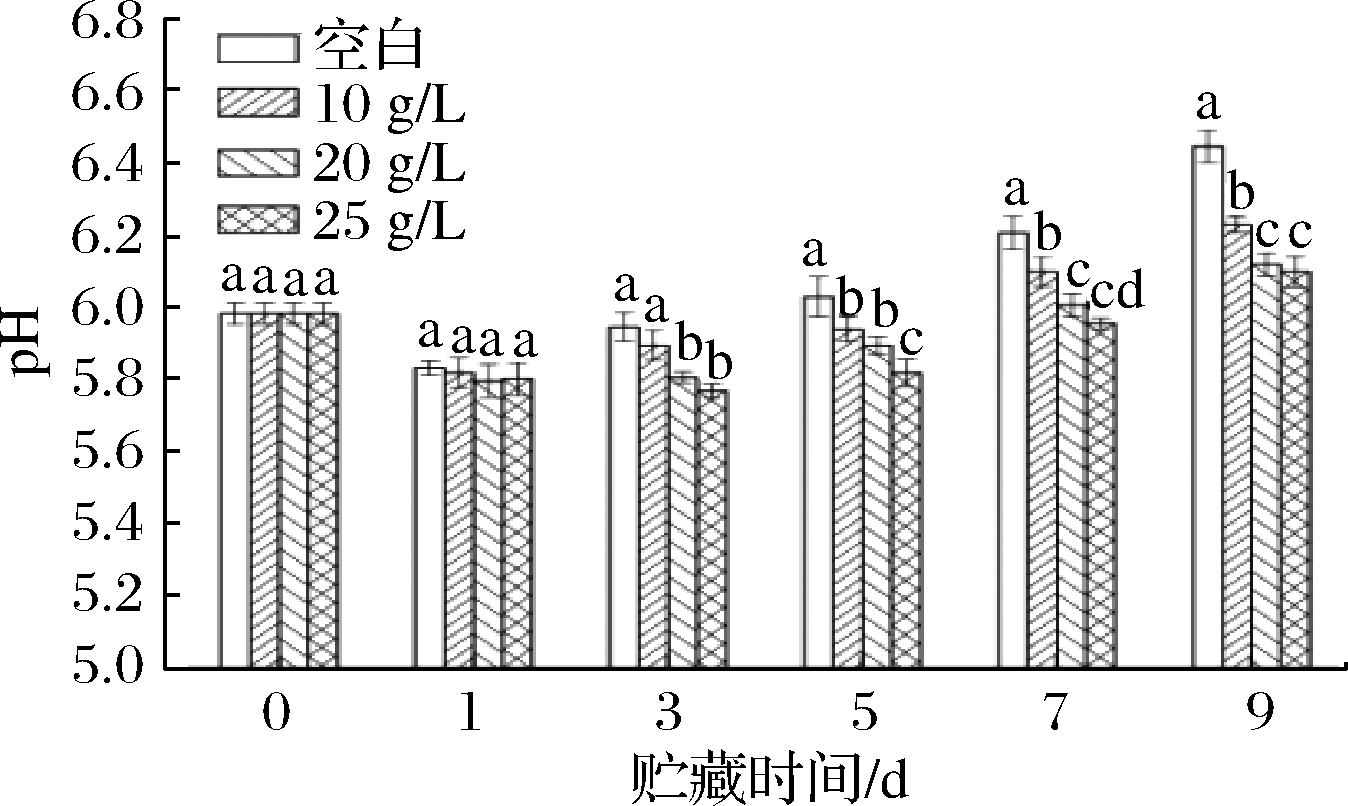
图3 贮藏期间牛肉pH值的变化
Fig.3 Changes in pH of beef during storage
2.4.2 色度
色泽在一定程度上反映肉的感官品质,直接影响消费者的喜好[2]。不同处理组牛肉在贮藏过程中色度变化如表4所示。L*随贮藏时间的延长呈现上升的趋势,可能是因为随贮藏时间的延长,蛋白质的变性程度增加,肉的保水性下降,肌肉内部的水分渗出堆积在肉的表面,提高了对光的反射能力[24],而对照组的L*值在整个贮藏期间总体显著高于中高浓度多酚处理组(P<0.05),说明多酚较好地抑制了肉中水分的流失。a*值的变化与肌红蛋白的含量和状态关系密切[25]。对照组、处理组a*值均随着保藏时间的延长,呈现先增加后降低的趋势。可能是因为贮藏前期肌红蛋白与空气中O2反应,生成氧合肌红蛋白,使a*不断上升;贮藏后期肉中氧合肌红蛋白(MbO2)逐步被氧化为高铁肌红蛋白(MetMb),导致a*值下降。中高浓度处理组的a*值均显著低于对照组,可能是因为酚类物质可与Fe2+离子络合,从而抑制肉色的褐变[26]。
表4 贮藏期间牛肉色度的变化
Table 4 Changes in color of beef during storage
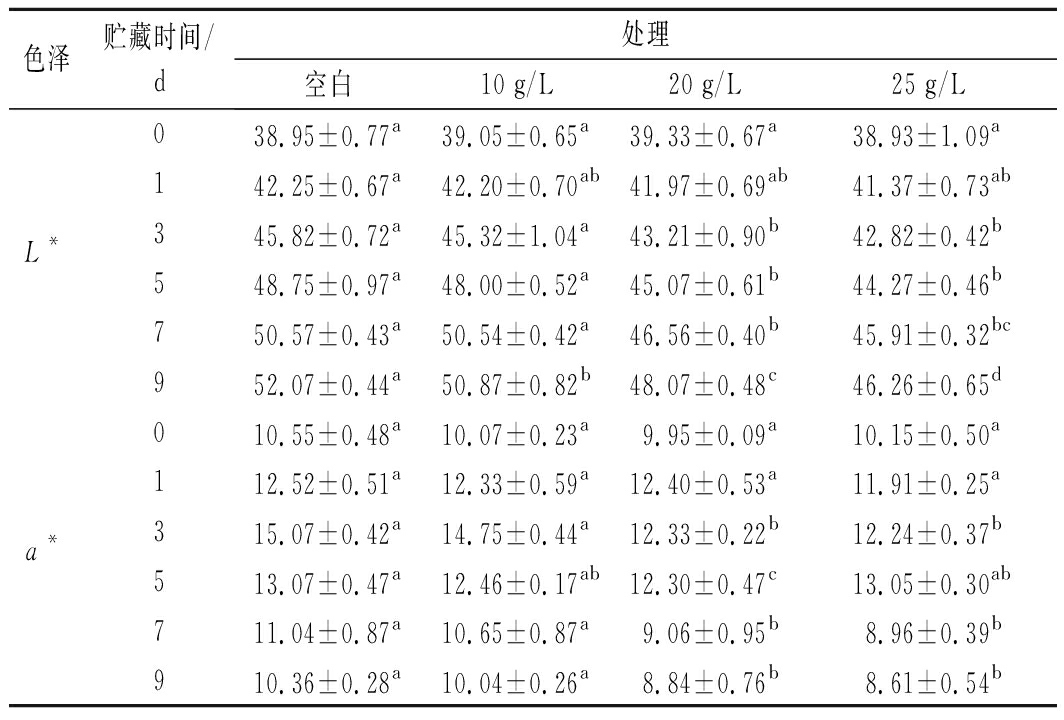
色泽贮藏时间/d处理空白10 g/L20 g/L25 g/L038.95±0.77a39.05±0.65a39.33±0.67a38.93±1.09a142.25±0.67a42.20±0.70ab41.97±0.69ab41.37±0.73abL*345.82±0.72a45.32±1.04a43.21±0.90b42.82±0.42b548.75±0.97a48.00±0.52a45.07±0.61b44.27±0.46b750.57±0.43a50.54±0.42a46.56±0.40b45.91±0.32bc952.07±0.44a50.87±0.82b48.07±0.48c46.26±0.65d010.55±0.48a10.07±0.23a9.95±0.09a10.15±0.50a112.52±0.51a12.33±0.59a12.40±0.53a11.91±0.25aa*315.07±0.42a14.75±0.44a12.33±0.22b12.24±0.37b513.07±0.47a12.46±0.17ab12.30±0.47c13.05±0.30ab711.04±0.87a10.65±0.87a9.06±0.95b8.96±0.39b910.36±0.28a10.04±0.26a8.84±0.76b8.61±0.54b
注:不同小写字母表示不同处理组间差异显著(P<0.05)(下同)
2.4.3 TVB-N
TVB-N是检验肉品新鲜度的重要指标[27]。肉在贮藏期间由于受到微生物和酶的作用将蛋白质分解为氨以及胺类等碱性含氮物质,从而使肉腐败变质[27]。由图4可知,对照组和不同浓度多酚处理的冷却肉的TVB-N含量随贮藏时间的延长而增大,且中高浓度处理组TVB-N值显著低于空白组。贮藏至第9天时,对照组达到26.37 mg/100g,已超过国标限定值。与之相比较的多酚处理的冷却肉贮藏至第9天时均未超过25 mg/100g且相比对照组降低14.30%,但20和25 g/L差异不显著。说明甜瓜皮多酚能够能延缓冷却肉TVB-N值的升高,延长其货架期。

图4 贮藏期间牛肉TVB-N值的变化
Fig.4 Changes in TVB-N of beef during storage
2.4.4 TBARS
TBARS表征反应中氧化产物丙二醛的质量分数,丙二醛是酯类物质氧化的一种次级代谢产物,肉及肉制品中脂肪氧化酸败水平可用丙二醛含量反映,丙二醛含量越高,TBARS越大,表明产生较多的小分子物质如醛、酮、酸等,脂肪氧化酸败的程度越高[28]。鲜肉TBARS为0.201~0.665 mg/kg,TBARS高于1.0 mg/kg为变质肉[29]。如图5所示,对照组和处理组TBARS均随着贮藏时间的延长呈上升趋势,但对照组上升幅度明显高于中高浓度多酚处理组(P<0.05)。对照组在贮藏至第9天时达到了1.08 mg/kg,肉品发生腐败变质,而多酚处理组TBARS均低于1.0 mg/kg,说明多酚处理能有效延缓脂肪氧化。

图5 贮藏期间牛肉TBARS的变化
Fig.5 Changes in TBARS of beef during storage
2.4.5 感官评价
感官是反映肉制品最直观的指标,肉的感官特性直接影响消费者的购买欲望[30]。图6是牛肉在贮藏期间色泽、气味、黏度和弹性综合得分。随贮藏时间的延长,牛肉的综合感官评分均呈下降的趋势且对照组下降最快。且中高浓度多酚处理组与对照组之间差异显著(P<0.05),第9天时,对照组的感官已处于不可接受水平,而经过中高浓度的多酚处理的样品在第9天感官评分显著高于对照组,这可能是因为多酚良好的抑菌性和抗氧化性,抑制微生物的生长和延缓肉制品的氧化,从而延缓牛肉感官特性的劣变[20]。

图6 贮藏期间牛肉感官评分值的变化
Fig.6 Changes in sensory score of beef during storage
3 结论
甜瓜皮多酚提取的最优工艺条件为:乙醇体积分数61%,液料比21∶1(mL∶g),超声时间60 min,超声温度40 ℃。通过对牛肉各个指标的检测,结果表明,甜瓜皮多酚对牛肉有较好的保鲜效果,可有效延缓贮藏过程中的腐败变质。当甜瓜皮多酚质量浓度为20 和25 g/L时,其保鲜效果无明显差异。因此,甜瓜皮多酚的最佳质量浓度为20 g/L,可作为天然抗氧化剂应用于食品加工及肉制品的保鲜过程中。
[1] 孙天利, 张秀梅, 张平, 等.冰温结合真空包装处理对牛肉组织结构变化的影响[J].食品科学, 2013, 34(22):327-331.
SUN T L, ZHANG X M, ZHANG P, et al.Effect of controlled freezing point storage combined with vacuum packaging on texture and histologic structure of beef[J].Food Science, 2013, 34(22):327-331.
[2] 杨斌, 曹银娟, 余群力, 等.纳米银酯化淀粉膜对牛肉保鲜的影响[J].食品科学, 2019, 40(23):199-205.
YANG B, CAO Y J, YU Q L, et al.Application of nanosilver esterified starch film in beef preservation[J].Food Science, 2019, 40(23):199-205.
[3] FALOWO A B, FAYEMI P O, MUCHENJE V.Natural antioxidants against lipid-protein oxidative deterioration in meat and meat products:A review[J].Food Research International, 2014, 64:171-181.
[4] 张典, 陈金玉, 张坤生, 等.香蕉皮多酚的提取及其对肉丸贮藏品质的影响[J].食品研究与开发, 2019, 40(3):23-30;111.
ZHANG D, CHEN J Y, ZHANG K S, et al.Extraction of polyphenol from banana (Musa nana Lour.) peels and its effect on storage quality of meat balls[J].Food Research and Development, 2019, 40(3):23-30;111.
[5] AHMED M, PICKOVA J, AHMAD T, et al.Oxidation of lipids in foods[J].Sarhad Journal of Agriculture, 2016, 32(3):230-238.
[6] LUND M N, HEINONEN M, BARON C P, et al.Protein oxidationin muscle foods:A review[J].Molecular Nutrition & Food Research, 2011, 55(1):83-95.
[7] SHAH M A, BOSCO S J D, Mir S A.Plant extracts as natural antioxidants in meat and meat products[J].Meat Science, 2014, 98(1):21-33.
[8] 郑红梅, 王少英, 史新娥.植物多酚的抗氧化作用及其改善肉质的机制[J].动物营养学报, 2020, 32(5):2 037-2 045.
ZHENG H M, WANG S Y, SHI X E.Antioxidant effect of plant polyphenols and its mechanism of improving meat quality[J].Journal of Animal Nutrition,2020, 32(5):2 037-2 045.
[9] 何强, 董静雯.果蔬中的多酚及其功能特性[J].西华大学学报(自然科学版), 2019, 38(4):37-44.
HE Q, DONG J W.Polyphenols in fruits and vegetables and its function[J].Journal of Xihua University (Natural Science Edition), 2019, 38(4):37-44.
[10] 孙达旺. 植物单宁化学[M].北京:中国林业出版社, 1992.
SUN D W.Plant Tannin Chemistry[M].Beijing:China Forestry Press,1992.
[11] SAMAD N B, DEBNATH T, JIN H L, et al.Antioxidant activity of benincasa hispida seeds[J].Journal of Food Biochemistry, 2013, 37(4):388-395.
[12] BREWER M S.Natural antioxidants:Sources, compounds, mechanisms of action, and potential applications[J].Comprehensive Reviews in Food Science and Food Safety, 2011, 10:221-247.
[13] 古娜斯·叶尔肯, 魏征.新疆地区栽培5种甜瓜营养成分比较分析[J].食品研究与开发, 2019, 40(6):115-119;125.
YEERKEN G, WEI Z.Comparison analysis of nutritional ingredients in five different melon varieties in Xinjiang[J].Food Research and Development, 2019, 40(6):115-119;125.
[14] 黄倩, 杭吟溪, 刘中华, 等.北京地区不同品种甜瓜营养品质分析[J].北京农学院学报, 2018, 33(3):40-43.
HUANG Q, HANG Y X, LIU Z H, et al.Analysis of nutritional quality of different varieties muskmelon[J].Journal of Beijing Agricultural College, 2018, 33(3):40-43.
[15] 张宁, 曹明浩, 冶鹏辉, 等.石榴皮多酚提取方法、活性及其应用研究进展[J].现代食品, 2020(20):41-45;55.
ZHANG N, CAO M H, YE P H, et al.Research progress on extraction method, activity and application of pomegranate peel polyphenols[J].Modern Food, 2020(20):41-45;55.
[16] BOTH S, CHEMAT F, STRUBE J.Extraction of polyphenols from black tea-conventional and ultrasound-assisted extraction[J].Ultrasonics Sonochemistry, 2014, 21(3):1 030-1 034.
[17] 孔方南, 李文砚, 韦优, 等.刺果番荔枝叶多酚提取工艺优化及其体外抗氧化活性[J].食品工业科技, 2020, 41(20):162-168.
KONG F N, LI W X, WEI Y, et al.Optimization of extraction process of polyphenols from Annona squamosal leaves and its antioxidant activity in vitro[J].Food Industry Technology, 2020, 41(20):162-168.
[18] 中华人民共和国国家卫生和计划生育委员会. GB 5009.228—2016食品安全国家标准 食品中挥发性盐基氮的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.228—2016 National standards for food safety Determination of volatile base nitrogen in food[S].Beijing:China Standard Press, 2016.
[19] 中华人民共和国家卫生和计划生育委员会. GB 5009.181—2016 食品安全国家标准 食品中丙二醛的测定[S].北京:中国标准出版社, 2016.
National Health and Family Planning Commission of the People′s Republic of China.GB 5009.181—2016 National standards for food safety Determination of malondialdehyde in food[S].Beijing:China Standard Press, 2016.
[20] 郝瑞, 余群力, 陈颢予, 等.复配天然保鲜剂结合冰温保鲜对牛肉保鲜效果的研究[J].食品与发酵工业, 2020, 46(16):177-182.
HAO R, YU Q L, CHEN H Y, et al.Effect of the combination of natural preservative and ice-temperature on the preservation of beef[J].Food and Fermentation Industries, 2020, 46(16):177-182.
[21] 张国强, 郭晓东, 薛文华, 等.西藏野生卷叶黄精多酚的提取及其抗氧化活性分析[J].食品科学, 2017, 38(6):236-241.
ZHANG G Q, GUO X D, XUE W H, et al.Extraction and antioxidant activity of polyphenols from tibetan wild polygonatum cirrhifolium[J].Food Science, 2017, 38(6):236-241.
[22] 汪洪涛, 薛珂.罗汉果花总多酚的提取工艺优化[J].粮食与油脂, 2020, 33(8):77-80.
WANG H T, XUE K.Optimization of extraction process of total polyphenols from Siraitia grosvenorii flower[J].Grains and Fats, 2020, 33(8):77-80.
[23] MANCINI R A, RAMANATHAN R.Effects of postmortem storage time on color and mitochondria in beef[J].Meat Science, 2014, 98(1):65-70.
[24] 李婕, 罗天林, 师希雄, 等.牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析[J].食品科学, 2016, 37(9):18-22.
LI J, LUO T L, SHI X X, et al.Correlation analysis between heat shock protein 27 expression and eating quality during postmortem aging of yak meat[J].Food Science, 2016, 37(9):18-22.
[25] WULF D M, WISE J W.Measuring muscle color on beef carcasses using the L* a* b* color space[J].Journal of Animal Science, 1999, 77(9):2 418-2 427.
[26] LEOPOLDINI M, MARINO T, RUSSO N, et al.Antioxidant properties of phenolic compounds:H-atom versus electron transfer mechanism[J].The Journal of Physical Chemistry A, 2004, 108(22):4 916-4 922.
[27] 肖轲, 李高阳, 尚雪波, 等.辣椒籽提取物对冷却肉的抗氧化性及保鲜效果[J].中国食品学报, 2020, 20(6):202-208.
XIAO K, LI G Y, SHANG X B, et al.The antioxidant and preservation effect of chilli seed extract on chilled meat[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(6):202-208.
[28] JOUKI M, YAZDI F T, MORTAZAVI S A, et al.Quince seed mucilage films incorporated with oregano essential oil:Physical, thermal, barrier, antioxidant and antibacterial properties[J].Food Hydrocolloids, 2014, 36(2):9-19.
[29] KEOKAMNERD T, ACTON J C, HAN I Y, et al.Effect of commercial rosemary oleoresin preparations on ground chicken thigh meat quality packaged in a high-oxygen atmosphere[J].Poultry Science, 2008, 87(1):170-179.
[30] 杨新磊. 紫外处理与两种天然保鲜剂对冷却猪肉品质的影响研究[D].杨凌:西北农林科技大学, 2013.
YANG X L.Study on quality of chilled pork meat with UV-C treatment and two kind of natural preservative[D].Yangling:Northwest A&F University, 2013.