大蒜(Allium satirum L.)俗称蒜、大蒜头,为百合科葱属多年生草本植物[1]。近几年,广大学者对大蒜的生物活性进行了深入研究,证实大蒜具有多方面的生物活性,如降血脂作用[2-3],抗心肌缺血作用[4-5],抗氧化、清除自由基作用[6-7],抗肿瘤作用[8-9],抗病原微生物的作用[10]等,大蒜的生物活性与大蒜中的含硫化合物(蒜氨酸、大蒜辣素、大蒜素)密切相关[11],而大蒜中含硫化合物的存在正是大蒜辛辣刺激性风味的主要形成原因[12]。陈海涛等[12]采用溶剂辅助风味蒸发方法结合气相色谱-质谱联用仪对新鲜大蒜和炸蒜油的挥发性风味成分进行分析,发现新鲜大蒜关键性风味成分主要为含硫杂环化合物和硫醚类化合物;炸蒜油关键性风味成分主要为杂环化合物、硫醚类化合物和醛类,并且由于炸蒜油中杂环类、醚类化合物的含量相较于新鲜大蒜中的有所下降,导致刺激性辛辣味减弱。刘春菊等[13]采用固相微萃取和GC-MS分析新鲜大蒜、醋浸后大蒜中挥发性风味成分的变化。结果表明,新鲜大蒜的风味主要由含硫化合物贡献,经过醋浸后大蒜中的含硫化合物在数量和相对含量上均有所减少,而相应的醇类、醛类、酮类和酯类化合物的数量和相对含量都相应增加,因此醋浸大蒜的辛辣刺激性气味有所降低。陆俊等[14]研究发现,微生物发酵能去除大蒜中的蒜臭味,发酵 45 d后的大蒜其蒜味已经明显降低,且有一种淡淡的香味,大蒜辣味由辣变成不辣,其原因可能与微生物转化大蒜素,大蒜素含量的下降和大蒜中蒜酶的降解有关。
综上,部分人难以接受大蒜的辛辣刺激性风味,但又希望长期食用大蒜防病保健,因此大蒜制品推陈出新,开发出了大蒜冻干粉及制剂、大蒜素、大蒜提取物(蒜氨酸、蒜氨酸酶)等产品[15-17],但是普通老百姓更喜爱食用传统大蒜食品来防病保健,例如老坛泡蒜、糖醋蒜、腊八蒜等。以上 3 种传统大蒜食品均采用腌制工艺制备,然而腌制过程中有无发酵、发酵程度以及腌制时间、腌制时使用的调味料均有可能影响大蒜的风味以及生物活性物质含量。目前,关于老坛泡蒜、糖醋蒜、腊八蒜中生物活性物质含量与其风味的关系的研究报道鲜见。因此,本研究采用四川坛泡咸大蒜、糖醋蒜、腊八蒜以及完整鲜大蒜(阳性对照)为样品,比较研究其风味特征以及生物活性物质含量,并找出活性物质含量与其风味的关系。本研究结果旨在了解传统腌制大蒜食品的风味特征以及活性成分含量,筛选出刺激性气味小且活性成分含量高的腌制大蒜制品,为更好地利用大蒜资源,开发大蒜功能保健食品提供理论依据和数据支持。
1 材料与方法
1.1 材料与试剂
食盐,中盐上海市盐业公司;白砂糖,成都市糖酒有限责任公司;酿造米醋,李锦记食品有限公司;色谱级甲醇、乙腈,德国默克公司;蒜氨酸标准品,上海Sigma公司;植物蒜氨酶酶联免疫分析试剂盒,江苏科特生物科技有限公司。
鲜大蒜(样品编号 XS):四川本地紫皮大蒜,购于四川省成都市菜市场,鲜大蒜去皮后备用。
四川坛泡咸大蒜(样品编号 PS):鲜紫皮大蒜去皮后,放入四川泡菜的老坛中腌制(5 年的老坛坛水),腌制时添加蒜头净重3%的食盐,10 ℃ 腌制 30 d,四川坛泡咸大蒜呈咸辣略酸味型。
糖醋蒜(样品编号 TS):鲜紫皮大蒜去皮后,放到8%(质量分数)的食盐水中浸泡 2 d 后,捞出沥干。蒜头和糖醋汁放入陶坛中,糖醋汁刚好淹没蒜头(白砂糖50 g、酿造米醋 400 g 调制糖醋汁),10 ℃腌制30 d 即可,糖醋蒜呈甜酸味型。
腊八蒜(样品编号 LS):鲜紫皮大蒜去皮后入陶坛,添加酿造米醋刚好淹没大蒜即可,10 ℃ 腌制20 d,蒜呈翠绿色即可,腊八蒜呈酸辣味型。
1.2 仪器与设备
FlavourSpec@风味分析仪(配 CTC PAL RSI 自动顶空进样装置),德国 G.A.S mbH公司;TG-16G 台式高速离心机,湖南凯达科学仪器有限公司;Aglient1260高效液相色谱仪,美国Aglient公司;PS40A超声清洗仪,深华泰科学仪器有限公司;梅特勒 LE204E 型万分之一天平,梅特勒-托利多集团;SpectraMax 190 全波长酶标仪,美国 MD 公司。
1.3 实验方法
1.3.1 气相离子迁移谱(gas chromatography-ion mobility spectroscopy,GC-IMS)分析
四川坛泡咸大蒜、腊八蒜、糖醋蒜以及完整鲜大蒜(阳性对照)作为研究对象,进行 GC-IMS 检测分析。取 3 g 样品,置于 20 mL 顶空瓶中,自动顶空进样及气相-离子迁移谱的工作条件见表1。
表1 GC-IMS 工作条件
Table 1 GC-IMS working conditions
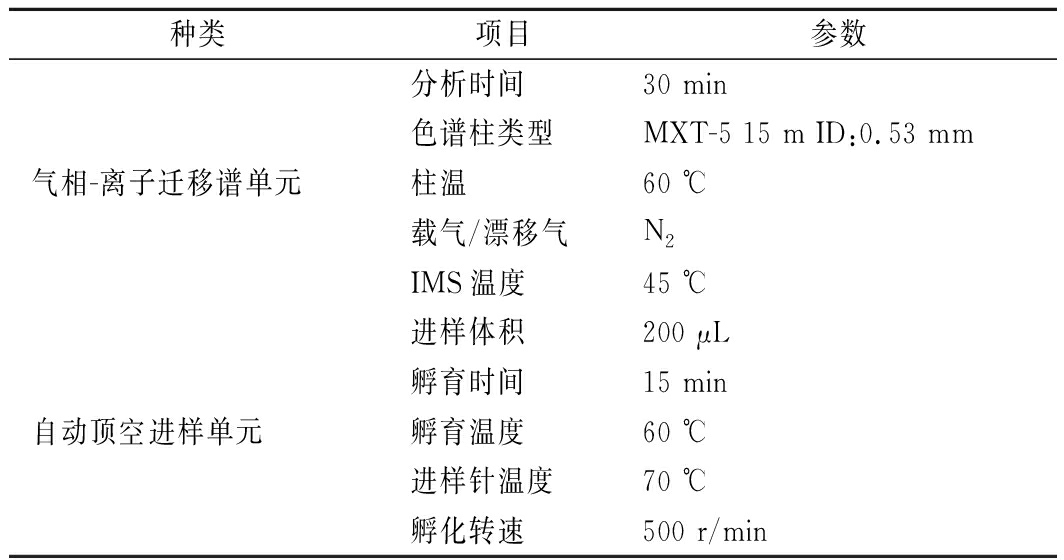
种类项目参数分析时间30 min色谱柱类型MXT-5 15 m ID:0.53 mm气相-离子迁移谱单元柱温60 ℃载气/漂移气N2IMS温度45 ℃进样体积200 μL孵育时间15 min自动顶空进样单元孵育温度60 ℃进样针温度70 ℃孵化转速500 r/min
载气/漂移气为 N2(纯度≥99.999%),漂移管温度 45 ℃,β射线,3H 为放射源,正离子化模式,载气流速程序见图1。
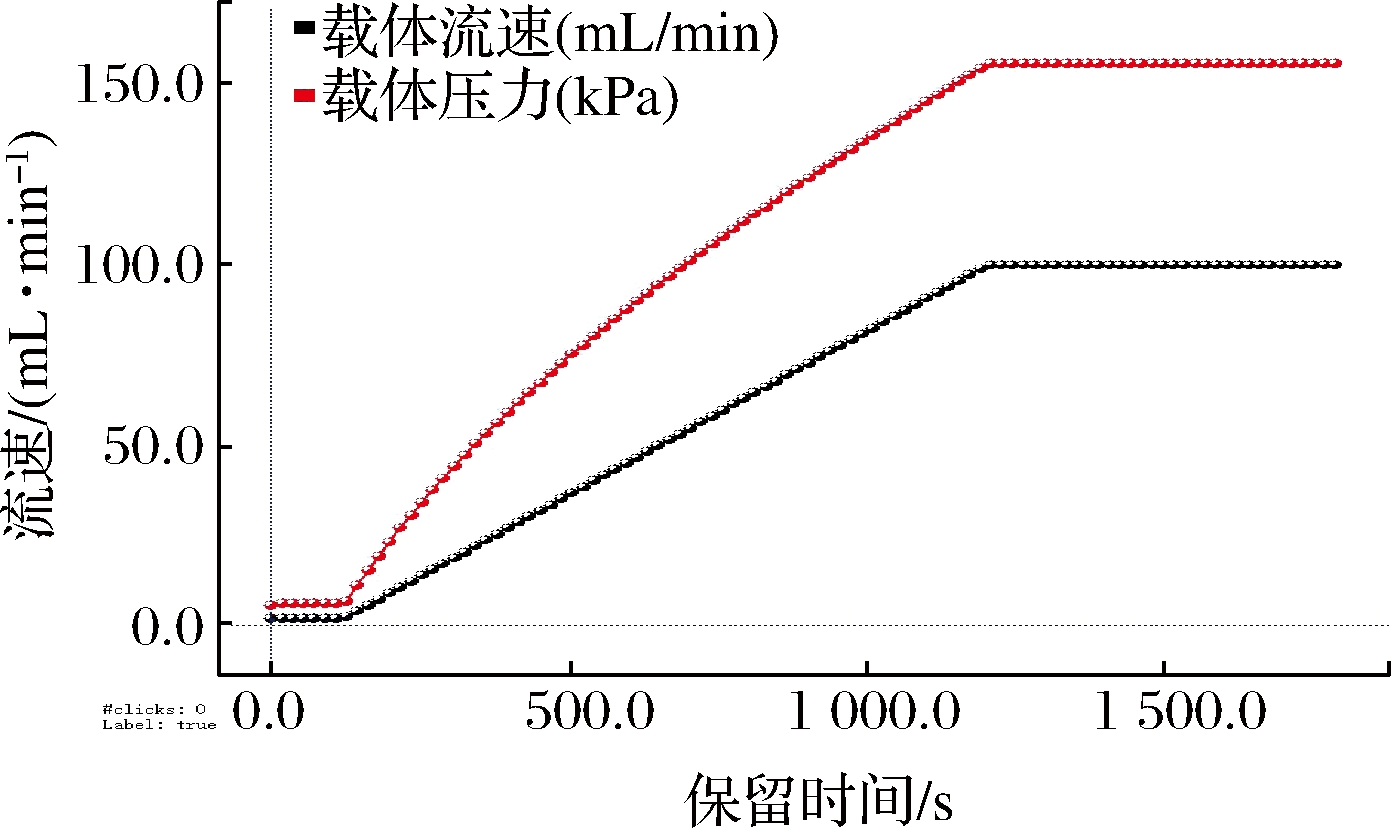
图1 载气流速程
Fig.1 Velocity range of carrier gas
1.3.2 蒜氨酸及蒜氨酸酶的测定
蒜氨酸不具有挥发性的含硫化合物,采用HPLC方法[17]。色谱柱:Agilent LC-C18(250 mm×4.6 mm);柱温:25 ℃;流动相:V(甲醇)∶V(水)=30∶70;流速:0.5 mL/min;检测波长:217 nm;进样体积:20 μL。
蒜氨酸酶的活性浓度按照植物蒜氨酶酶联免疫分析试剂盒的说明书进行操作。
1.3.3 数据处理
采用设备自带 Laboratory Analytical Viewer分析软件及 Library Search 定性软件对大蒜中的挥发性物质进行采集和分析。
2 结果与分析
2.1 腌制大蒜中活性成分的比较分析
目前,国内学者对大蒜素(All- tride,C6H10 S3,三硫二丙烯)进行研究发现其具有抗病原微生物、抗炎及抗肿瘤等作用[1],且中国药典(2010 版)将大蒜素作为大蒜药材的指标成分。然而,国外学者主要围绕大蒜中蒜氨酸、蒜氨酸酶及大蒜辣素的降血脂、保护血管内皮细胞及心肌细胞、抗氧化、抗肿瘤、抗病原微生物等生物活性作用进行研究,且美国药典、欧盟药典收载的大蒜相关产品均以蒜氨酸及(或)大蒜辣素为质控指标[15-16,18]。大蒜素并不是大蒜中的天然有效成分,而是蒜氨酸与蒜氨酸酶的反应产物——大蒜辣素在介质中进一步分解的产物[1],故本试验选择大蒜中天然成分蒜氨酸及蒜氨酸酶作为评价腌制大蒜生物活性高低的指标。由表2 可知,各腌制大蒜中蒜氨酸酶的活性浓度差异不显著(P>0.05),而蒜氨酸含量差异较大。XS 中蒜氨酸含量最高(22 875.05 μg/g),极显著高于所有腌制大蒜(P<0.01);TS 中蒜氨酸含量最低(341.34 μg/g),极显著低于LS、PS(P<0.01);LS中蒜氨酸含量极显著低于PS(P<0.01),这可能与腌制环境的 pH 值[19]、化学组分、微生物菌群[14,20]有密切关系,诱导蒜氨酸发生分解。综上,鲜大蒜的生物活性应该最强,其次分别是四川坛泡咸大蒜、腊八蒜、糖醋蒜。
表2 腌制大蒜中蒜氨酸含量及蒜氨酸酶活性浓度
Table 2 Alliin content and alliinase activity concentration in pickled garlic

样品蒜氨酸含量/(μg·g-1)蒜氨酸酶活性浓度/(U·g-1)鲜大蒜(XS)22 875.05±35.12A3.50±0.13a四川坛泡咸大蒜(PS)6 992.27±22.84B3.70±0.10a腊八蒜(LS)3 464.12±12.61BC3.80±0.10a糖醋蒜(TS)341.34±8.49BCD3.37±0.08a
注:同列不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)
2.2 腌制大蒜挥发性风味物质的比较分析
2.2.1 GC-IMS分析
图2为Reporter插件制作的不同腌制大蒜中挥发性物质的差异化谱图,以XS为参照,对比所有挥发性物质在不同样品中的差异情况,红色越深、面积越大,说明对应挥发性物质浓度高于XS样品,蓝色越深则相反。如图2所示,具有相同迁移时间和保留时间的挥发性物质(即同一挥发性化合物)在不同腌制大蒜样品中的浓度存在较大差异。LS、PS中大部分挥发性物质的浓度较XS更高;而TS中大部分挥发性物质的浓度较XS更低;其中,PS中大部分挥发性物质的浓度较LS低。
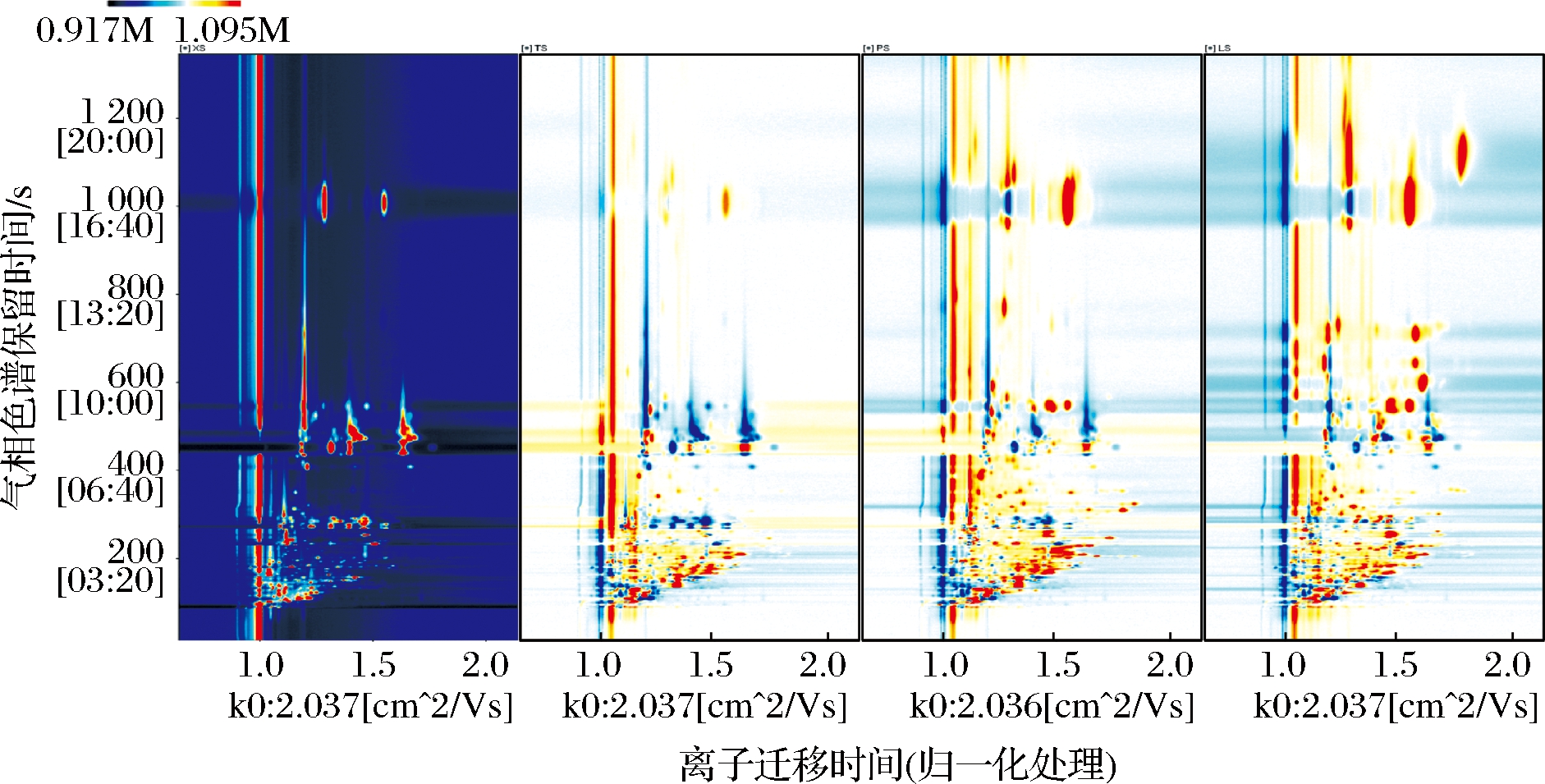
图2 腌制大蒜中挥发性物质对比差异谱图
Fig.2 Contrast spectrum of volatile compounds in pickled garlic
2.2.2 腌制大蒜中挥发性风味物质的鉴定
根据保留时间和迁移时间,从4个大蒜样品中分离出78种挥发性物质(图3)。通过 GC×IMS Library Search 软件从78种挥发性物质中定性 39 种挥发性物质,包括含硫化合物类(9种)、酯类(10种)、醛类(5种)、酮类(6种)、醇类(2种)、酚类(1种)、酸类(1种)及其他类(5种)(表3)。
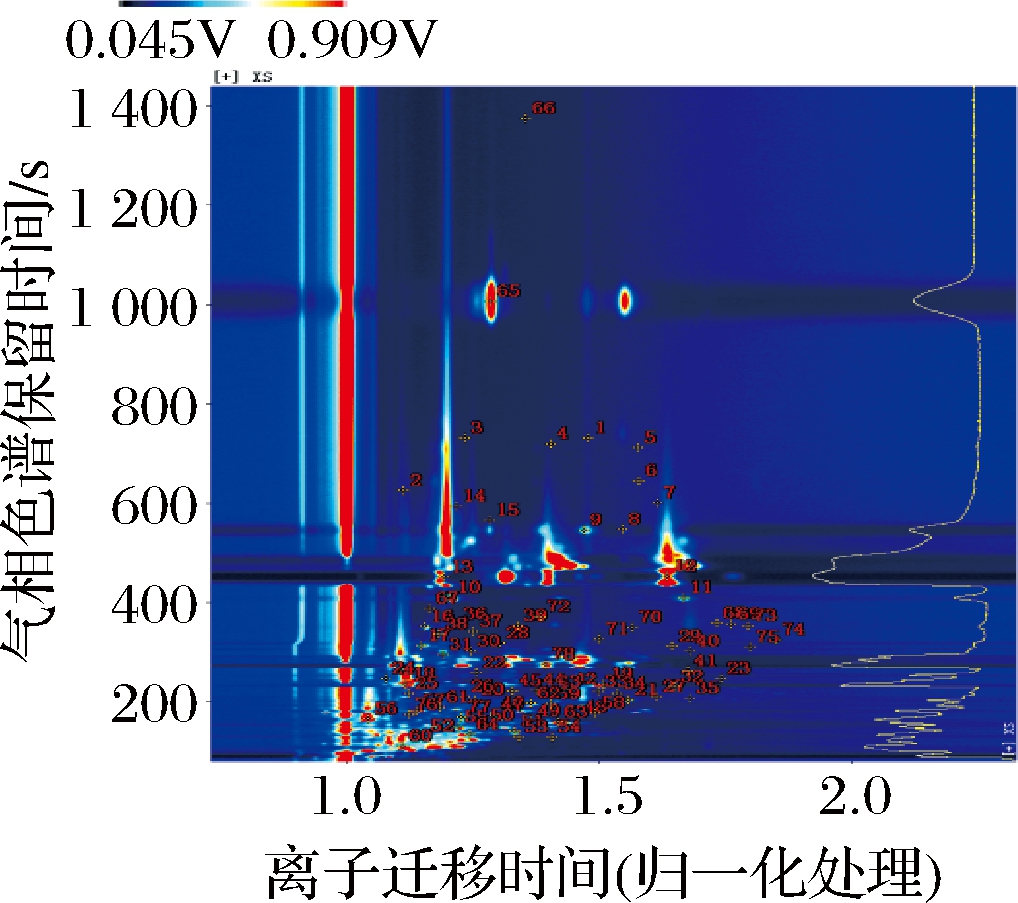
图3 腌制大蒜中挥发性物质定性分析
Fig.3 Qualitative analysis of volatile compounds in pickled garlic
表3 腌制大蒜中挥发性物质定性分析
Table 3 Qualitative analysis of volatile compounds in pickled garlic
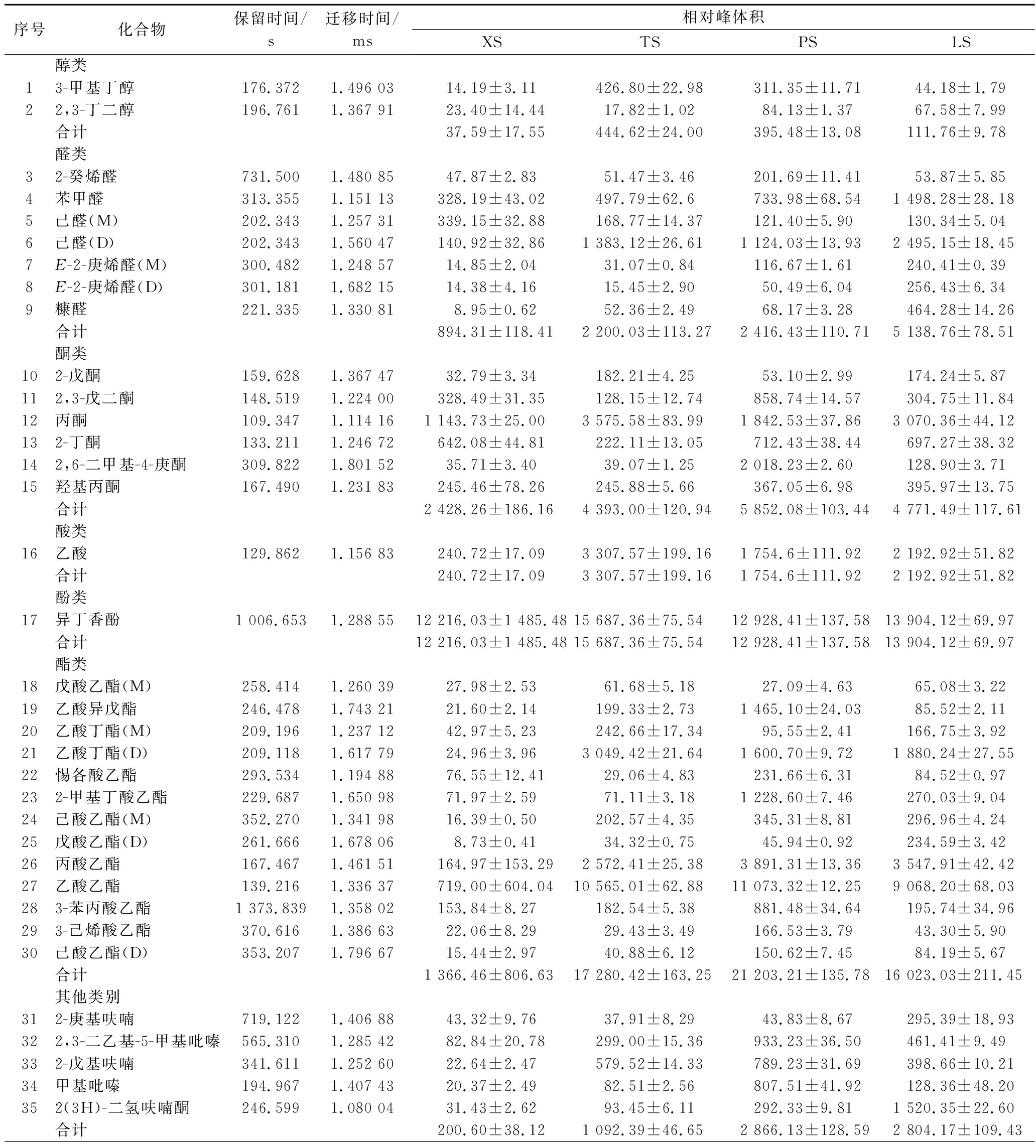
序号化合物保留时间/s迁移时间/ms相对峰体积XSTSPSLS醇类13-甲基丁醇176.3721.496 0314.19±3.11426.80±22.98311.35±11.7144.18±1.7922,3-丁二醇196.7611.367 9123.40±14.4417.82±1.0284.13±1.3767.58±7.99合计37.59±17.55444.62±24.00395.48±13.08111.76±9.78醛类32-癸烯醛731.5001.480 8547.87±2.8351.47±3.46201.69±11.4153.87±5.854苯甲醛313.3551.151 13328.19±43.02497.79±62.6733.98±68.541 498.28±28.185己醛(M)202.3431.257 31339.15±32.88168.77±14.37121.40±5.90130.34±5.046己醛(D)202.3431.560 47140.92±32.861 383.12±26.611 124.03±13.932 495.15±18.457E-2-庚烯醛(M)300.4821.248 5714.85±2.0431.07±0.84116.67±1.61240.41±0.398E-2-庚烯醛(D)301.1811.682 1514.38±4.1615.45±2.9050.49±6.04256.43±6.349糠醛221.3351.330 818.95±0.6252.36±2.4968.17±3.28464.28±14.26合计894.31±118.412 200.03±113.272 416.43±110.715 138.76±78.51酮类102-戊酮159.6281.367 4732.79±3.34182.21±4.2553.10±2.99174.24±5.87112,3-戊二酮148.5191.224 00328.49±31.35128.15±12.74858.74±14.57304.75±11.8412丙酮109.3471.114 161 143.73±25.003 575.58±83.991 842.53±37.863 070.36±44.12132-丁酮133.2111.246 72642.08±44.81222.11±13.05712.43±38.44697.27±38.32142,6-二甲基-4-庚酮309.8221.801 5235.71±3.4039.07±1.252 018.23±2.60128.90±3.7115羟基丙酮167.4901.231 83245.46±78.26245.88±5.66367.05±6.98395.97±13.75合计2 428.26±186.164 393.00±120.945 852.08±103.444 771.49±117.61酸类16乙酸129.8621.156 83240.72±17.093 307.57±199.161 754.6±111.922 192.92±51.82合计240.72±17.093 307.57±199.161 754.6±111.922 192.92±51.82酚类17异丁香酚1 006.6531.288 5512 216.03±1 485.4815 687.36±75.5412 928.41±137.5813 904.12±69.97合计12 216.03±1 485.4815 687.36±75.5412 928.41±137.5813 904.12±69.97酯类18戊酸乙酯(M)258.4141.260 3927.98±2.5361.68±5.1827.09±4.6365.08±3.2219乙酸异戊酯246.4781.743 2121.60±2.14199.33±2.731 465.10±24.0385.52±2.1120乙酸丁酯(M)209.1961.237 1242.97±5.23242.66±17.3495.55±2.41166.75±3.9221乙酸丁酯(D)209.1181.617 7924.96±3.963 049.42±21.641 600.70±9.721 880.24±27.5522惕各酸乙酯293.5341.194 8876.55±12.4129.06±4.83231.66±6.3184.52±0.97232-甲基丁酸乙酯229.6871.650 9871.97±2.5971.11±3.181 228.60±7.46270.03±9.0424己酸乙酯(M)352.2701.341 9816.39±0.50202.57±4.35345.31±8.81296.96±4.2425戊酸乙酯(D)261.6661.678 068.73±0.4134.32±0.7545.94±0.92234.59±3.4226丙酸乙酯167.4671.461 51164.97±153.292 572.41±25.383 891.31±13.363 547.91±42.4227乙酸乙酯139.2161.336 37719.00±604.0410 565.01±62.8811 073.32±12.259 068.20±68.03283-苯丙酸乙酯1 373.8391.358 02153.84±8.27182.54±5.38881.48±34.64195.74±34.96293-己烯酸乙酯370.6161.386 6322.06±8.2929.43±3.49166.53±3.7943.30±5.9030己酸乙酯(D)353.2071.796 6715.44±2.9740.88±6.12150.62±7.4584.19±5.67合计1 366.46±806.6317 280.42±163.2521 203.21±135.7816 023.03±211.45其他类别312-庚基呋喃719.1221.406 8843.32±9.7637.91±8.2943.83±8.67295.39±18.93322,3-二乙基-5-甲基吡嗪565.3101.285 4282.84±20.78299.00±15.36933.23±36.50461.41±9.49332-戊基呋喃341.6111.252 6022.64±2.47579.52±14.33789.23±31.69398.66±10.2134甲基吡嗪194.9671.407 4320.37±2.4982.51±2.56807.51±41.92128.36±48.20352(3H)-二氢呋喃酮246.5991.080 0431.43±2.6293.45±6.11292.33±9.811 520.35±22.60合计200.60±38.121 092.39±46.652 866.13±128.592 804.17±109.43
续表3
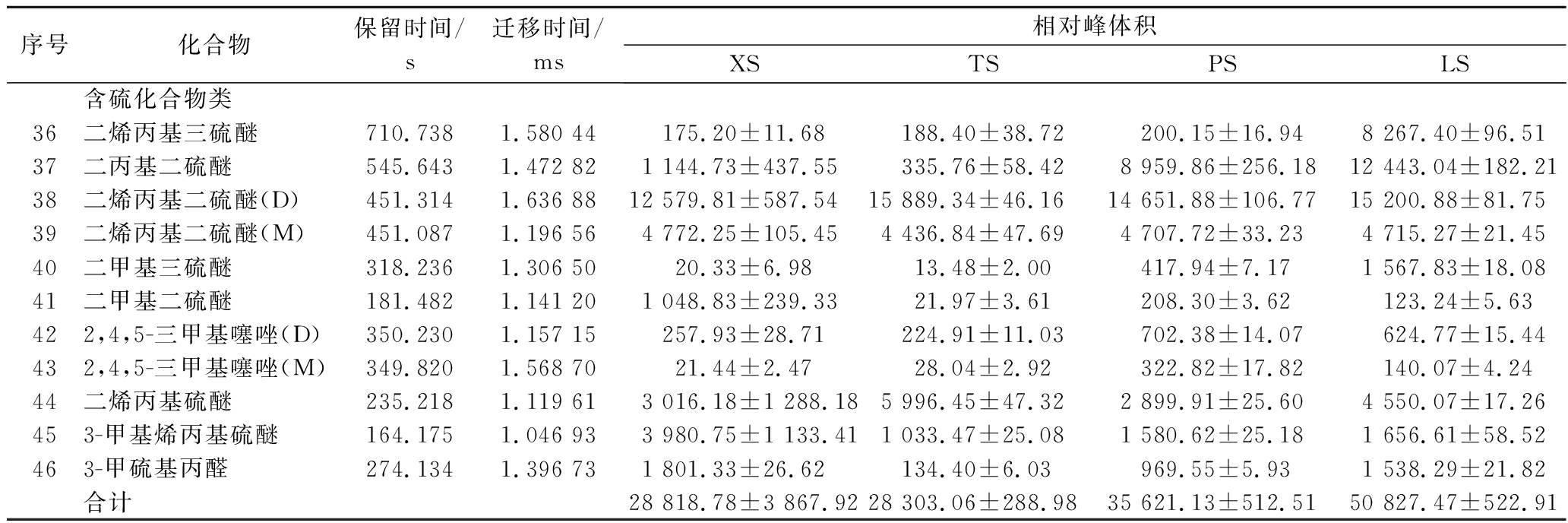
序号化合物保留时间/s迁移时间/ms相对峰体积XSTSPSLS含硫化合物类36二烯丙基三硫醚710.7381.580 44175.20±11.68188.40±38.72200.15±16.948 267.40±96.5137二丙基二硫醚545.6431.472 821 144.73±437.55335.76±58.428 959.86±256.1812 443.04±182.2138二烯丙基二硫醚(D)451.3141.636 8812 579.81±587.5415 889.34±46.1614 651.88±106.7715 200.88±81.7539二烯丙基二硫醚(M)451.0871.196 564 772.25±105.454 436.84±47.694 707.72±33.234 715.27±21.4540二甲基三硫醚318.2361.306 5020.33±6.9813.48±2.00417.94±7.171 567.83±18.0841二甲基二硫醚181.4821.141 201 048.83±239.3321.97±3.61208.30±3.62123.24±5.63422,4,5-三甲基噻唑(D)350.2301.157 15257.93±28.71224.91±11.03702.38±14.07624.77±15.44432,4,5-三甲基噻唑(M)349.8201.568 7021.44±2.4728.04±2.92322.82±17.82140.07±4.2444二烯丙基硫醚235.2181.119 613 016.18±1 288.185 996.45±47.322 899.91±25.604 550.07±17.26453-甲基烯丙基硫醚164.1751.046 933 980.75±1 133.411 033.47±25.081 580.62±25.181 656.61±58.52463-甲硫基丙醛274.1341.396 731 801.33±26.62134.40±6.03969.55±5.931 538.29±21.82合计28 818.78±3 867.9228 303.06±288.9835 621.13±512.5150 827.47±522.91
注:M表示单体;D表示二聚体;单体与二聚体属于同一种结构的化合物,故在统计化合物数量时仅计算1次(下同)
挥发性含硫有机化合物是大蒜中重要的风味物质,也是重要的生物活性物质。刘春菊等[13]采用顶空固相微萃取-气相色谱-质谱联用法(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)技术检测鲜大蒜中共有 22 种挥发性风味物质,其中 14 种含硫化合物,主要含硫化合物是二烯丙基二硫醚、1,3-二噻烷、二烯丙基硫醚、硫化丙烯、二甲基二硫醚、甲基烯丙基硫醚。如表3 所示,SX 中鉴定出 9 种含硫化合物,分别是二烯丙基三硫醚、二丙基二硫醚、二烯丙基二硫醚、二甲基三硫醚、二甲基二硫醚、2,4,5-三甲基噻唑、3-甲硫基丙醛、二烯丙基硫醚、3-甲基烯丙基硫醚,然而 SX 中无 1,3-二噻烷、硫化丙烯、2,4-二甲基噻吩、2-乙烯基噻吩、甲基烯丙基三硫醚、甲基丙烯基二硫醚、烯丙基异丙基硫醚。此外,刘春菊等[13]报道的鲜蒜中含硫化合物不包括二丙基二硫醚、2,4,5-三甲基噻唑、3-甲硫基丙醛。以上结果的差异可能与检测分析方法、不同大蒜品种、GC×IMS Library Search 检索库有关系。
刘春菊等[13]报道,大蒜经过醋浸后,醋蒜中检出 10 种含硫化合物,主要包括二烯丙基二硫醚、二烯丙基三硫醚、甲基烯丙基三硫醚、二烯丙基硫醚、1,3-二噻烷、二甲基三硫醚、甲基烯丙基硫醚,即醋浸处理导致大蒜中含硫化合物的种类减少,且二烯丙基二硫醚、二烯丙基硫醚、甲基烯丙基硫醚、甲基丙烯基二硫醚、二甲基二硫醚的相对含量减少。本试验中,腌制处理并未导致大蒜中含硫化合物种类的减少,这可能与GC×IMS Library Search 检索库中的标样数量有关系。
2.2.3 腌制大蒜 GC-IMS 指纹图谱分析
为识别不同腌制大蒜的特征峰区域,根据 GC-IMS 二维图谱中所有谱峰重构指纹图谱[21-22],详见图4,GC-IMS 指纹图谱右侧 Y 轴为大蒜样品编号(每个大蒜样品3个平行),X 轴为挥发性化合物名称,其中的数字表示化合物未鉴定出。同 2.2.1,图中色点的颜色及深浅表示浓度的高低。由图4 可知,组内的 3 个样品具有明显的相似性,3 个腌制大蒜样品及鲜大蒜样品(阳性对照)组间则呈现出明显的差异性,且各大蒜样品均有各自的特征峰区域,同时也有共同区域[23]。相对于 XS,各腌制大蒜中的二甲基二硫醚、3-甲基烯丙基硫醚、3-甲硫基丙醛等挥发性物质含量下降较多(见黄色框),这与刘春菊等[20]报道不一致;此外,MEE等[24]报道,腌制贮藏导致大蒜中二烯丙基二硫醚、甲基烯丙基硫醚含量逐渐减少,而甲基烯丙基三硫醚和二烯丙基三硫醚含量逐渐增加;JUNG[25]将大蒜浸渍于酱油和盐水中,二烯丙基三硫醚、甲基烯丙基三硫醚、二甲基三硫醚、甲基丙烯基二硫醚含量增加,二烯丙基二硫醚和甲基烯丙基二硫醚含量降低,这与本研究的结果也不完全一致。一方面,各腌制大蒜中蒜氨酸含量差异显著(见 2.1 结果),而蒜氨酸的含量可影响其裂解产物——挥发性含硫有机化合物的种类和含量;此外,大蒜中挥发性含硫有机化合物的种类及含量受挥发性物质提取、检测分析时的温度、加热时间影响[26]。刘春菊等[20]、MEE等[24]、JUNG[25]采用 SPME-GC- MS 技术测定大蒜中挥发性物质,而本试验采用 GC-IMS 技术进行检测分析,无需样品前处理,而是直接加热(60 ℃)待测样品,顶空进样后检测样品中的挥发性有机组分,也就是说 GC-IMS 检测的挥发性物质是最接近大蒜样品的实际风味。
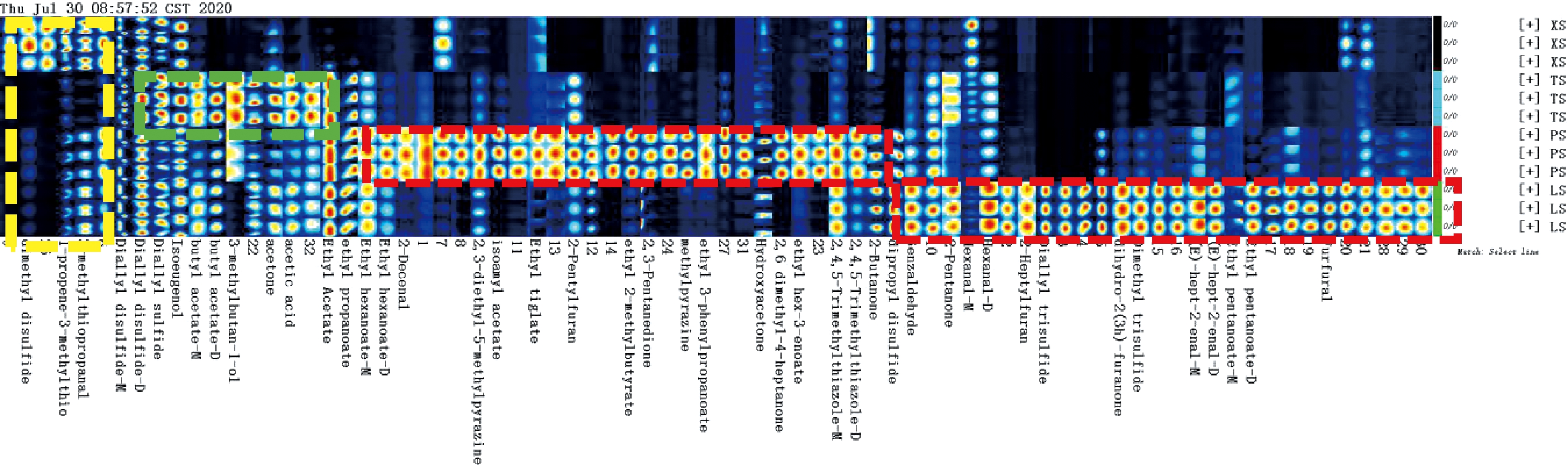
图4 不同腌制大蒜Gallery Plot指纹谱图
Fig.4 Gallery plot fingerprint of different pickled garlic
绿框为 TS 的特征峰区域,鉴定出的特色风味物质有二烯丙基硫醚、二烯丙基二硫醚、异丁香酚、乙酸丁酯(M)、乙酸丁酯(D)、3-甲基丁醇、丙酮、乙酸等,其在 3 种腌制大蒜中均具有一定含量,但是在 TS 中相对含量最高,这可能与腌制时添加的白砂糖有关。PS 的特征风味物质包括己酸乙酯(M)、己酸乙酯(D)、2-癸烯醛、2,3-二乙基-5-甲基吡嗪、乙酸异戊酯、惕各酸乙酯、2-戊基呋喃、2-甲基丁酸乙酯、2,3-戊二酮、甲基吡嗪、3-苯丙酸乙酯、羟基丙酮、2,6-二甲基-4-庚酮、3-己烯酸乙酯、2,4,5-三甲基噻唑(D)、2,4,5-三甲基噻唑(M)、2-丁酮。LS 的特征风味物质包括二丙基二硫、苯甲醛、2-戊酮、己醛(M)、己醛(D)、2-庚基呋喃、二烯丙基三硫、2(3H)-二氢呋喃酮、二甲基三硫、E-2-庚烯醛(M)、E-2-庚烯醛(D)、戊酸乙酯(D)、戊酸乙酯(M)、糠醛。综上,本试验制备的 3 种腌制蒜的特色风味物质中的链状含硫化合物较少,但含有丰富的酯类、醛类、酮类、吡嗪类等,这与腌制的酸碱环境、腌制时间、微生物组成有密切关系[17]。大蒜腌制时未受机械损伤,保持大蒜完整,大蒜中的蒜氨酸在酸碱条件下、各种微生物及其酶的作用下降解生成烯丙醇和丝氨酸,丝氨酸进一步降解生成氨、硫化氢、乙醛等小分子物质,这些小分子物质相互反应生成噻吩和噻烷等化合物[27],从而形成腌制大蒜的特色风味。
2.2.4 腌制大蒜的主成分分析
通过仪器软件自带的 Dynamic 进行主成分分析,结果如图5所示。由图5 可知,各大蒜样品在 PC1(贡献率为44%)和 PC2(贡献率为35%) 上均能得到较好地分离且组内各样品相对集中于一定范围内,通过二维空间的数据分布差异可以直观地观察到各样品间的彼此距离较远,但聚类清晰。TS与XS彼此距离相对较近,LS与 PS 彼此相距相对较近。
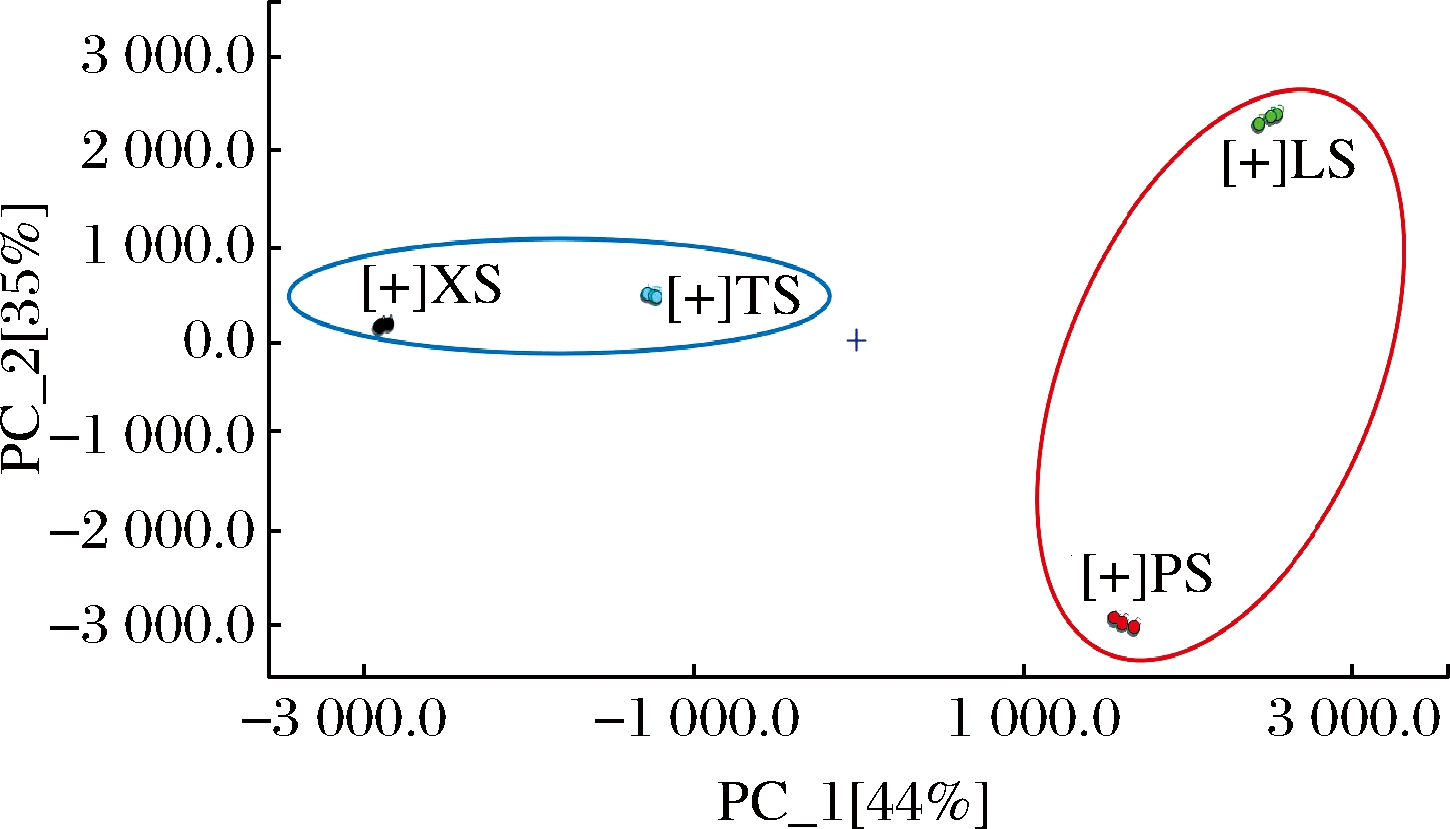
图5 腌制的主成分分析图
Fig.5 Principal component analysis of pickled garlic
3 结论
(1)根据大蒜中蒜氨酸含量及蒜氨酸酶的浓度活性,鲜大蒜的生物活性最强,其次分别是四川坛泡咸大蒜、腊八蒜、糖醋蒜。
(2)通过绘制GC-IMS指纹图谱,明确了四川坛泡咸大蒜、腊八蒜、糖醋蒜中的主要风味物质及特征风味物质。
(3)根据GC-IMS指纹图谱的主成分分析,腊八蒜与四川坛泡咸大蒜在风味上较为接近。
[1] 马丽娜, 李峰杰, 陈坚, 等.大蒜主要活性成分及药理作用研究进展[J].中国药理学通报, 2014, 30(6):760-763.
MA L N, LI F J, CHEN J, et al.Research advances in garlic′s main active ingredients and their pharmacological effects[J].Chinese Pharmacological Bulletin, 2014,30 (6):760-763.
[2] 胡斌, 匡海学, 辛运杰, 等.大蒜降血脂作用及机制研究进展[J].中国实验方剂学杂志, 2019, 25(8):181-186.
HU B, KUANG H X, XIN Y J, et al.Lipid-lowering activity and mechanism of allii sativi Bulbus[J].Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(8):181-186.
[3] 田瑞敏,宋永砚.大蒜提取物降血脂作用及其分子机制[J].中成药,2015,37(4):850-853.
TIAN R M, SONG Y Y.Lipid lowering effect of garlic extract and its molecular mechanism[J].Chinese Patent Medicine, 2015,37 (4):850-853.
[4] MUKTHAMBA P, SRINIVASAN K.Dietary fenugreek (Trigonella foenum-graecum) seeds and garlic (Allium sativum) alleviates oxidative stress in experimental myocardial infarction[J].Food Science and Human Wellness,2017,6(2):77-87.
[5] ZENG Y, LI Y, YANG J, et al. Therapeutic role of functional components in alliums for preventive chronic disease in human being[J/OL]. Evidence-Based Complementray and Alternative Medicine, 2017. DOI: 10.1155/2017/9402849.
[6] LOCATELLI D A, NAZARENO M A, FUSARI C M, et al.Cooked garlic and antioxidant activity:Correlation with organosulfur compound composition[J].Food Chemistry, 2017, 220:219-224.
[7] KE J, LI Y,CHEN F,et al.The effect of allicin on the ventricular myocytes of rabbit with heart failure[J].China Medical Abstracts(Internal Medicine),2018,27(7):729-734.
[8] TALIB W H.Consumption of garlic and lemon aqueous extracts combination reduces tumor burden by angiogenesis inhibition, apoptosis induction, and immune system modulation[J].Nutrition,2017,43-44;89-97.
[9] DAROOGHEGI MOFRAD M, MILAJERDI A, KOOHDANI F,et al.Garlic supplementation reduces circulating C-reactive protein, tumor necrosis factor, and interleukin-6 in adults:A systematic review and meta-analysis of randomized controlled trials[J].The Journal of Nutrition, 2019, 149(4):605-618.
[10] OZEN V. Comparison of the postoperative analgesic effectiveness of US-guided caudal block and US-guided pudendal nerve block in circumcision[J/OL]. International Journal of Clinical Practice, 2021. DOI:10.1111/ijcp.14366.
[11] RYU J H, KANG D.Physicochemical properties, biological activity, health benefits, and general limitations of aged black garlic:A review[J].Molecules (Basel, Switzerland), 2017, 22(6):E919.
[12] 陈海涛,李萌,孙杰,等.新鲜大蒜与炸蒜油挥发性风味物质的对比分析[J].精细化工,2018,35(8):1 355-1 362.
CHEN H T, LI M, SUN J, et al.Analysis of volatile flavor constituents of fresh garlic and fried garlic oil[J].Fine Chemicals, 2018,35 (8):1 355-1 362.
[13] 刘春菊,王海鸥,李大婧,等.醋浸和干燥对大蒜挥发性风味成分的影响[J].核农学报,2015,29(9):1 743-1 748.
LIU C J, WANG H O, LI D J, et al.Effects of vinegar pickling and drying on the volatile flavor compounds of garlic[J].Journal of Nuclear Agricultural Science, 2015,29 (9):1 743-1 748.
[14] 陆俊,刘佳佳,徐刚标,等.微生物发酵对大蒜风味及活性成分的影响[J].食品工业科技, 2008, 29(8):150-152.
LU J, LIU J J, XU G B, et al.Effects of microbial fermentation on garlic flavor and active components content of garlic[J].Food and Technology of Food Industry, 2008, 29 (8):150-152.
[15] LI F F, LI Q, WU S G, et al.Salting-out extraction of allicin from garlic (Allium sativum L.) based on ethanol/ammonium sulfate in laboratory and pilot scale[J].Food Chemistry,2017, 217:91-97.
[16] 唐铁鑫,刘慧,邓礼荷,等.大蒜辣素和阿藿烯的制备工艺研究[J].食品与药品,2018,20(4):245-248.
TANG T X, LIU H, DENG L H, et al.Study on the preparation technology of allicin and ajoene[J].Food and Drug, 2018,20(4):245-248.
[17] 陈婧,赵薪苑,吴方建,等.星点设计-效应面法优化大蒜素-羟丙基-β-环糊精包合物滴鼻液的制备工艺[J].中国医院药学杂志,2017,37(19):1 927-1 932.
CHEN J, ZHAO X Y, WU F J, et al.Optimization of preparation process of allicin-hydroxyl- β- cyclodextrin inclusion complex nasal drops by central composite design-response surface method[J].Chinese Journal of Hospital Pharmacy, 2017,37 (19):1 927-1 932.
[18] British Pharmacopoeia Commission. British Pharmacopoeia[M]. London: The Stationery Office, 2015.
[19] KIM S, PARK S L, LEE S, et al.UPLC/ESI-MS/MS analysis of compositional changes for organosulfur compounds in garlic (Allium sativum L.) during fermentation[J].Food Chemistry, 2016, 211:555-559.
[20] MOLINA-CALLE M,PRIEGO-CAPOTE F, LUQUE DE CASTRO M D.Headspace-GC-MS volatile profile of black garlic vs fresh garlic:Evolution along fermentation and behavior under heating[J].LWT,2017, 80:98-105.
[21] 姚文生,蔡莹暄,刘登勇,等.不同材料熏制鸡腿肉挥发性物质 GC-IMS 指纹图谱分析[J].食品科学技术学报,2019,37(6):37-45.
YAO W S, CAI Y X, LIU D Y, et al.Volatile compounds analysis in chicken thigh smoked with different materials by GC- IMS fingerprint[J].Journal of Food Science and Technology, 2019,37 (6):37-45.
[22] ARROYO-MANZANARES N, MART N-G
N-G MEZ A, JURADO-CAMPOS N, et al.Target vs spectral fingerprint data analysis of iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J].Food Chemistry, 2018, 246:65-73.
MEZ A, JURADO-CAMPOS N, et al.Target vs spectral fingerprint data analysis of iberian ham samples for avoiding labelling fraud using headspace-gas chromatography-ion mobility spectrometry[J].Food Chemistry, 2018, 246:65-73.
[23] 陈通, 陆道礼, 陈斌.GC-IMS 技术结合化学计量学方法在食用植物油分类中的应用[J].分析测试学报,2017,36(10):1 235-1 239.
CHEN T, LU D L, CHEN B.Application of headspace/gas chromatography-tandem ion mobility spectrometry with chemometrics in classification of edible vegetable oils[J].Journal of Instrumental Analysis, 2017,36 (10):1 235-1 239.
[24] MEE R K, EUN K M.Volatile sulfur compounds in pickled garlic[J].Korean Journal of Society Food Science, 1995,11(2):133-139.
[25] JUNG H A.Change of flavor compounds of pickled garlic with different pickling treatments[J].Journal of the East Asian Society of Dietary Life,2006,16(3):299-307.
[26] 赵功玲,娄天军,袁雪,等.不同加工方法对大蒜中大蒜素含量及清除![]() 的影响[J].食品科学, 2010, 31(11):119-122.
的影响[J].食品科学, 2010, 31(11):119-122.
ZHAO G L, LOU T J, YUAN X, et al.Effect of processing methods on garlicin content and nitrite scavenging capacity of garlic[J].Food Science, 2010, 31 (11):119-122.
[27] 韩月峰,彭光华,张声华,等.热风干燥工艺对蒜片中有机硫化物的影响[J].农业工程学报,2007, 23(10):271-274.
HAN Y F, PENG G H, ZHANG S H, et al.Effects of hot-air drying technology on the yield of organic sulfide in garlic slice[J].Transactions of the Chinese Society of Agricultural Engineering,2007, 23(10):271-274.