益生菌为一类在摄入适当数量后会对宿主机体产生益处的活体微生物,筛选具有益生功能特性的优良益生菌菌株已经成为了研究热点[1]。
2003年首次从母乳中分离出乳酸菌之前,早期研究人员认为母乳可能是无菌液体[2]。随着研究的进行,人们认识到母乳是婴儿肠道菌群的重要来源。母乳是婴儿最适宜的天然食物,不仅为婴儿生长发育提供独特而又均衡的营养物质,而且其中的人乳低聚糖是益生乳酸菌的选择培养物质,维持着婴儿肠道菌群的健康发育。婴儿肠道内的益生菌群与母乳益生菌群具有相似性,相比其他来源的益生菌,母婴来源的益生菌更加安全,且具有更好的抑菌、抗感染、促进肠道健康的活性[3-4]。
近年来,人乳源益生菌正受到越来越多的关注,研究人员开始从不同地区的母乳中分离益生菌,并研究其耐酸耐胆盐、黏附性、抗生素耐受、抑制病原菌、吸收重金属、降解霉菌毒素、缓解儿童肥胖等的潜在功能特性[5-6]。2014年,通过对德国和奥地利的66份母乳样品的研究,发现母乳中的益生菌占到母乳中所有菌类的92%,其中,乳杆菌占66%,包括唾液乳杆菌(Lactobacillus salivarius),发酵乳杆菌(Lactobacillus fermentum)等;双歧杆菌占26%,包括短双歧杆菌(Bifidobacterium breve)和长双歧杆菌(Bifidobacterium loungum)等[7]。国外对母乳来源益生菌筛选的研究越来越多,而国内相关的研究处于起步阶段。
本研究以母乳为分离源筛选乳酸菌,评价其胃肠道环境耐受能力、抗生素耐受能力和抑菌能力,以期获得自主知识产权的优质乳酸菌菌株。
1 材料与方法
1.1 样品采集
母乳样品采集自湖南地区的健康妇女。采样前志愿者先戴好一次性无菌手套,使用无菌水清洗单侧乳头及周围皮肤,丢弃第一滴母乳,收集4~5 mL左右母乳置于5 mL、体积分数为30%甘油的无菌离心管中,做好标记,放入装有干冰的泡沫箱中,立即送至实验室进行分离,随后样品及时保存于-80 ℃超低温冰箱中。
1.2 材料与试剂
莫匹罗星锂盐、半胱氨酸盐酸盐溶液、2.5 L圆底立式厌氧袋、2.5 L厌氧产气包,青岛海博生物;胃蛋白酶(1∶10 000)、细菌基因组DNA快速抽提试剂盒,生工生物工程(上海)股份有限公司;牛胆盐,北京索莱宝科技有限公司;2×Taq PCR MasterMix,宝日医生物技术有限公司;DNA分子质量标准Marker,南京维诺赞生物科技有限公司;常用药敏试纸,杭州滨和微生物试剂有限公司。
人工胃液:0.5%(质量分数)NaCl,0.3%(质量分数)胃蛋白酶(1∶10 000),用1 mol/L的HCl溶液调节pH至2.5。
LB培养基(g/L):胰蛋白胨10,NaCl 10,酵母膏5。
莫匹罗星锂盐和半胱氨酸盐酸盐溶液改良 MRS培养基:按照GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》配制。
大肠埃希氏菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、蜡样芽胞杆菌(Bacillus cereus)、伤寒沙门氏菌(Salmonella typhi)、假单胞菌(Pseudomonas brenneri),扬州大学江苏省乳品生物技术与安全控制重点实验室提供。
1.3 仪器与设备
1510型分光光度计,赛默飞世尔科技(中国)有限公司;5424R型台式冷冻离心机,艾本德中国有限公司;JF-SX-500型全自动灭菌锅,日本TOMY公司;SW-CJ-1F型超净工作台,苏州净化设备有限公司;SPX-150BSH型生化培养箱,上海新苗医疗器械制造有限公司;Nexus+x2eco型PCR仪,德国艾本德公司;3026型凝胶图像分析系统,法国VILBER公司。
1.4 试验方法
1.4.1 双歧杆菌菌株的培养
菌株液体厌氧培养:改良MRS液体培养基经高温灭菌后,立即在液体培养基上封灭菌液体石蜡,温度降至常温时添加莫匹罗星锂盐和L-半胱氨酸盐酸盐溶液,进行接种,于厌氧袋中培养。
菌株固体厌氧培养(平板计数):MRS液体培养基经高温灭菌后,立即在固体培养基中添加莫匹罗星锂盐和L-半胱氨酸盐酸盐溶液,倾注时采用双层倾注法,即菌液倾注于固体培养基,凝固后在培养基表面覆盖一层培养基以隔绝氧气,于厌氧袋中培养。
1.4.2 菌株的分离纯化
将采集到的母乳样品做梯度稀释,选取合适的稀释梯度倾注于MRS固体培养基和双层倾注于改良MRS固体培养基中,分别常规培养和厌氧培养,37 ℃培养24~48 h至长出单菌落,挑选具有乳酸菌形态的单菌落,划线接种于含溴甲酚紫的MRS固体培养基和改良MRS培养基中进行产酸复筛,培养48 h,长出单菌落经革兰氏染色后在显微镜下进行形态学观察,挑选具有乳杆菌和典型双歧杆菌形态的菌株。
1.4.3 16S rDNA鉴定
利用细菌基因组DNA提取试剂盒提取菌株的DNA,将提取的菌株基因组DNA作为PCR的模板进行扩增,乳杆菌引物为通用引物(27F:AGAGTTTGATCCTGGCTCAG;1492R:GGTTACCTTGTTACGA-CTT),双歧杆菌引物为特异性测序引物(Bif164-f:GGGTGGTAATGCCGGATG;PbiR2:GACCATGCACCACCTGTGAA)[8],电泳检测扩增产物后,送至上海生工生物工程股份有限公司进行测序。综合测序峰图将测序结果截取800 bp的区域;通过BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)与GenBank基因库进行比对得出结果。
1.4.4 菌株对人工胃液耐受能力的测定
将菌株按3%的接种量接种到MRS液体培养基中,37 ℃厌氧培养24 h后,离心收集菌体,用灭菌的PBS缓冲液将菌体洗涤2次后悬浮,取1.0 mL的菌悬液接种至9.0 mL的pH 2.5人工胃液,37 ℃培养3 h,分别在0 h和3 h利用平板计数法测定活菌数,存活率计算如公式(1)所示。每组重复3次。
存活率![]()
(1)
1.4.5 菌株对胆盐耐受能力的测定
将菌株按3%的接种量接种到MRS液体培养基中,37 ℃厌氧培养24 h后,离心收集菌体,用灭菌的PBS缓冲液将菌体洗涤2次后悬浮,取1.0 mL的菌悬液接种至9.0 mL的0.1%胆盐的MRS培养基中,37 ℃培养3 h,分别在0 h和3 h用平板计数法测定活菌数,存活率计算如公式(1)所示。每组重复3次。
1.4.6 菌株对抗生素耐药性测定
采用药敏纸片琼脂扩散法检测益生菌对抗生素的耐药性,选取12种抗生素包括利福平,氨苄西林,万古霉素,复方新诺明,环丙沙星,头孢拉定,头孢唑林,克拉霉素,青霉素P,氯霉素,链霉素,四环素。吸取0.1 mL菌悬液(1×108~1×109 CFU/mL)涂布到15.0 mL MRS琼脂培养基表面,待完全吸收后,将药敏纸片贴放表面,每个培养基贴3片,于37 ℃培养箱倒置培养48 h,然后测量并记录抑菌圈直径,所得结果由表1进行判断,每个菌株重复2次。
表1 美国CLSI抗微生物药物敏感试验执行标准
Table 1 American CLSI antimicrobial drug sensitivity test executive standard
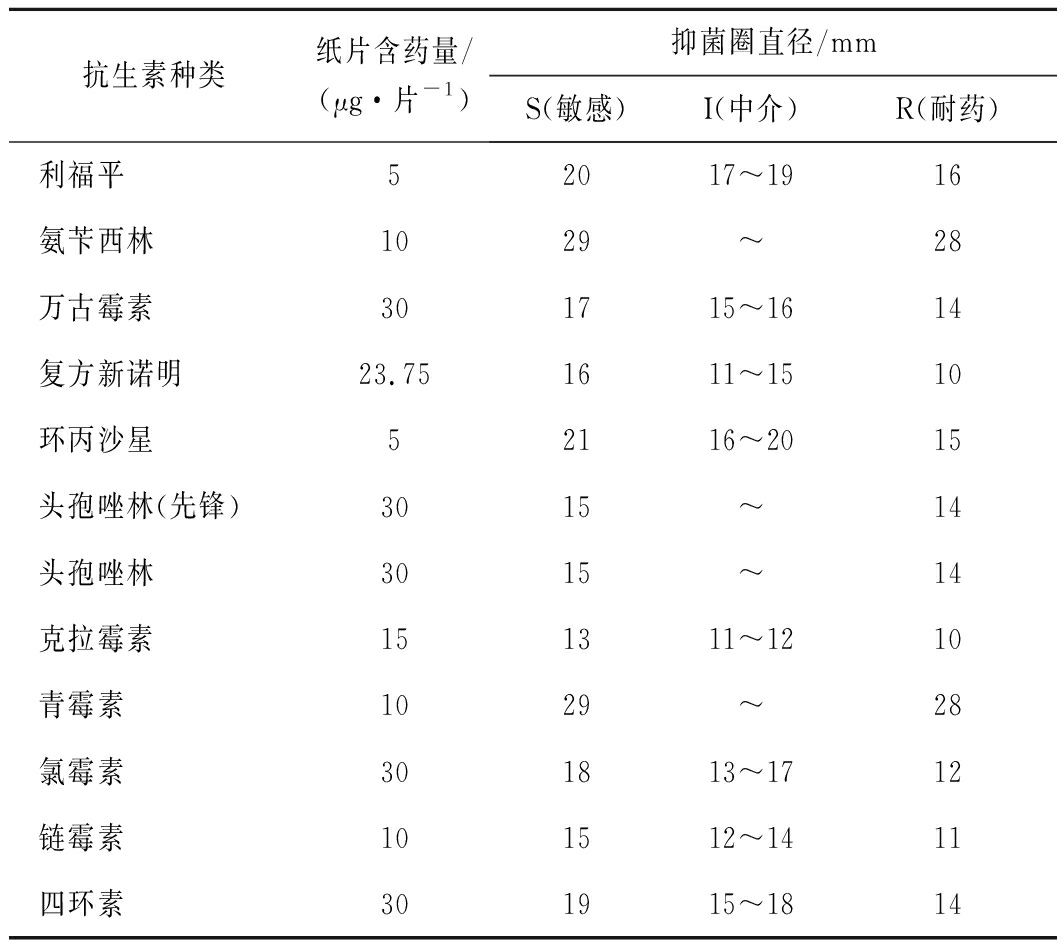
抗生素种类纸片含药量/(μg·片-1)抑菌圈直径/mmS(敏感)I(中介)R(耐药)利福平52017~1916氨苄西林1029~28万古霉素301715~1614复方新诺明23.751611~1510环丙沙星52116~2015头孢唑林(先锋)3015~14头孢唑林3015~14克拉霉素151311~1210青霉素1029~28氯霉素301813~1712链霉素101512~1411四环素301915~1814
1.4.7 菌株抑菌能力测定
选取大肠埃希氏菌,金黄色葡萄球菌等6种致病菌作为指示菌,采用牛津杯法测定菌株对致病菌的抑制作用。在平板底部倾倒薄层水琼脂;将致病菌于LB液体培养基中37 ℃培养24 h,取0.1 mL的致病菌菌液涂布于30 mL LB固体培养基表面。在水平放置的平板中均匀地放置灭菌的牛津杯,吸取0.2 mL待测菌菌悬液(1×107 CFU/mL)于牛津杯中。将平板放置4 ℃冰箱中扩散24 h,然后在37 ℃中培养24 h,测量抑菌圈大小,每个菌株重复3次。
2 结果与分析
2.1 分离菌株的形态和鉴定结果
从母乳来源样品中共分离出69个菌株,经纯化后在MRS培养基和改良MRS培养基上菌落形态呈白色且表面光滑;经革兰氏染色后,初筛得到25株革兰氏阳性菌。通过NCBI Blast比对,结合菌株镜检形态和来源,初步确定22株菌株为乳杆菌,其中包括11株鼠李糖乳杆菌(Lactobacillus rhamnosus),8株副干酪乳杆菌(Lactobacillus paracasei),1株干酪乳杆菌(Lactobacillus casei),1株发酵乳杆菌,1株植物乳杆菌(Lactobacillus plantarum)。3株菌株为双歧杆菌,其中包括1株短双歧杆菌和2株两歧双歧杆菌(Bifidobacterium bifidum)(表2)。
表2 菌株16S rDNA序列同源性
Table 2 Homology of 16S rDNA sequence

菌株编号中文名称拉丁文名称碱基序列长度/bp同源性/%M7副干酪乳杆菌Lactobacillus paracasei80099.71M15鼠李糖乳杆菌Lactobacillus rhamnosus80098.89M28鼠李糖乳杆菌Lactobacillus rhamnosus80099.11M33副干酪乳杆菌Lactobacillus paracasei80098.97M48副干酪乳杆菌Lactobacillus paracasei80099.42M49鼠李糖乳杆菌Lactobacillus rhamnosus80099.52M53鼠李糖乳杆菌Lactobacillus rhamnosus80098.84M55鼠李糖乳杆菌Lactobacillus rhamnosus80098.99M60鼠李糖乳杆菌Lactobacillus rhamnosus80099.08M64副干酪乳杆菌Lactobacillus paracasei80099.80M65鼠李糖乳杆菌Lactobacillus rhamnosus80099.52M70副干酪乳杆菌Lactobacillus paracasei80098.71M71副干酪乳杆菌Lactobacillus paracasei80099.06M79副干酪乳杆菌Lactobacillus paracasei80099.85M80鼠李糖乳杆菌Lactobacillus rhamnosus80099.06M84副干酪乳杆菌Lactobacillus paracasei80099.44M87干酪乳杆菌 Lactobacillus casei80099.11M91发酵乳杆菌 Lactobacillus fermentum80099.34M93鼠李糖乳杆菌Lactobacillus rhamnosus80099.85M101鼠李糖乳杆菌Lactobacillus rhamnosus80099.77M103鼠李糖乳杆菌Lactobacillus rhamnosus80099.56M113植物乳杆菌 Lactobacillus plantarum80099.59grx05短双歧杆菌 Bifidobacterium breve80099.61S16两歧双歧杆菌Bifidobacterium bifidum80099.55S18两歧双歧杆菌Bifidobacterium bifidum80099.71
2.2 菌株对人工胃液的耐受能力
益生菌从人的口腔进入到消化道后,胃中的胃液形成的强酸环境对益生菌的胁迫能力最强,只有少数耐酸能力强的菌株才能存活并发挥益生作用。因此,研究益生菌在胃液中受到强酸胁迫时的生长情况对提高在人体内的活菌数量和存活时间具有重要意义[9-10]。由表3可知,从母乳来源中分离出的22株乳杆菌均具有一定的耐酸能力,其中除菌株M33以外,其余杆菌表现出较好的耐酸能力;3株双歧杆菌存活率都>50%。REIS等[11]从6份母乳样品中分离出33株乳酸菌,其中71%菌株在pH 3.0的人工胃液中3 h后存活,只有2株粪肠球菌在pH 2.0和pH 2.5中存活。张欢畅[12]从母乳样品中分离出的2株植物乳杆菌在pH 3.0的人工胃液中培养3 h后,活菌数>1×107 CFU/mL。郑丽君等[13]从婴儿粪便中分离出5株乳酸菌在pH 3.0人工胃液中培养2 h后活菌数达到了1×108 CFU/mL。本研究中25株乳酸菌在pH 2.5人工胃液中培养3 h后有16株乳酸菌存活率>70%。
表3 菌株对pH 2.5人工胃液的耐受能力
Table 3 Tolerance of strain to pH 2.5 artificial gastric juice

菌株编号0 h活菌数/(CFU·mL-1)3 h活菌数/(CFU·mL-1)存活率/%M71.25×1091.02×10981.82±5.36M151.40×1091.07×10976.48±2.42M289.83×1087.87×10880.00±8.32M339.57×1085.63×1075.89±0.18M482.72×1092.77×109101.96±0.62M491.32×1091.29×10997.73±1.21M531.52×1091.06×10969.67±1.90M551.07×1091.22×109113.35±7.66M605.50×1083.36×10866.06±2.27M641.02×1091.04×109101.63±2.31M652.37×1098.77×10836.99±1.90M703.73×1087.33×10719.64±0.91M717.73×1086.67×10886.29±0.65M799.10×1089.63×108105.86±4.60M804.93×1087.60×10715.41±0.50M841.09×1096.00×10854.88±6.64M872.74×1091.56×10956.81±0.91M912.68×1092.44×10991.04±2.71M931.31×1091.38×109105.33±2.18M1016.30×1082.51×10839.89±2.43M1032.39×1092.14×10989.28±3.22M1132.89×1091.56×10954.16±2.01grx051.36×1091.28×10994.35±2.17S161.54×1091.13×10973.00±2.39S181.74×1091.32×10975.82±3.40
2.3 菌株对胆盐的耐受能力
益生菌经过胃的消化后进入小肠会受到高胆盐的胁迫,因此研究益生菌的耐胆盐能力是益生菌在肠道内发挥益生作用的标准之一[14]。由表4可知,乳杆菌M53,M60,M71,M113培养3 h后活菌数>1×106CFU/mL,其中菌株M53存活率最高,达到了45.72%;其余乳杆菌菌株存活率均<1%。杨焱炯等[15]从健康婴儿和青年粪便中分离出的乳杆菌和双歧杆菌在0.1%胆盐中培养2 h后下降2个数量级,与本研究结果基本一致。AWASTI等[16]从印度健康母乳,婴儿和成人粪便中分离出假链状双歧杆菌,短双歧杆菌和动物双歧杆菌,其中3株短双歧杆菌耐胆盐能力最强,与本研究结果基本一致,短双歧杆菌grx05存活率最高,达到了75.54%。
表4 菌株对胆盐耐受能力
Table 4 Tolerance of strain to bile salt

菌株编号0 h活菌数/(CFU·mL-1)3 h活菌数/(CFU·mL-1)存活率/%M74.57×108<106<1M151.72×109<106<1M286.34×108<106<1M336.47×108<106<1M489.83×108<106<1M491.58×109<106<1M531.71×1097.83×10845.72±5.27M552.26×109<106<1M603.13×1091.80×1085.73±0.21M641.32×109<106<1M652.29×109<106<1M701.67×109<106<1M714.07×1087.47×10718.36±0.95M799.00×108<106<1M802.11×109<106<1M841.23×109<106<1M879.13×108<106<1M912.79×109<106<1M937.53×108<106<1M1011.13×109<106<1M1032.26×109<106<1M1132.69×1098.70×1073.23±0.11grx058.30×1086.27×10875.54±3.72S165.20×1081.55×10829.74±1.46S187.37×1081.96×10826.65±0.74
2.4 菌株对抗生素的耐药性
根据上述结果,确定对菌株M53、M60、M71、M113、grx05、S16、S18进行后续试验。抗生素可以杀灭有害细菌从而达到治疗疾病的作用,因此被广泛应用到食品行业中。随着抗生素被广泛使用,甚至滥用,益生菌在抗生素的选择压力下逐渐产生耐药性,并且益生菌的耐药基因也可能转移到其他肠道菌群和致病菌中,对人类的健康造成威胁[17]。RIAZ RAJOKA等[18]研究发现从母乳中分离出的7株鼠李糖乳杆菌对链霉素,氨苄西林,庆大霉素,卡那霉素,青霉素,头孢毒素和环丙沙星耐药。D′AIMMO等[19]研究发现从商业乳制品和药品中分离出的双歧杆菌对卡那霉素,庆大霉素,链霉素,多黏菌素b,萘啶酸,巴龙霉素和新霉素具有耐药性,对青霉素P,氯霉素,洁霉素,杆菌肽和万古霉素不具有耐药性。参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)抗微生物药物敏感试验执行标准,本文对筛选到的7株菌进行耐药性测试,结果表明不同样品来源的同种菌株在耐药性方面存在差异。其中4株乳杆菌对头孢类,利福平和氯霉素敏感,菌株M71同时对氨苄西林,青霉素,克拉霉素和四环素敏感,与鼠李糖乳杆菌(Lactobacillus rhamnosus GG,LGG)有9种抗生素耐药性相同,具有良好的安全性。3株双歧杆菌对万古霉素,头孢类和氯霉素敏感,其中grx05同时对利福平,氨苄西林,环丙沙星和青霉素敏感,较D′AIMMO等[19]的研究菌株更加安全,这可能与双歧杆菌的来源有关。
表5 菌株对抗生素耐药性
Table 5 Resistance to antibiotics
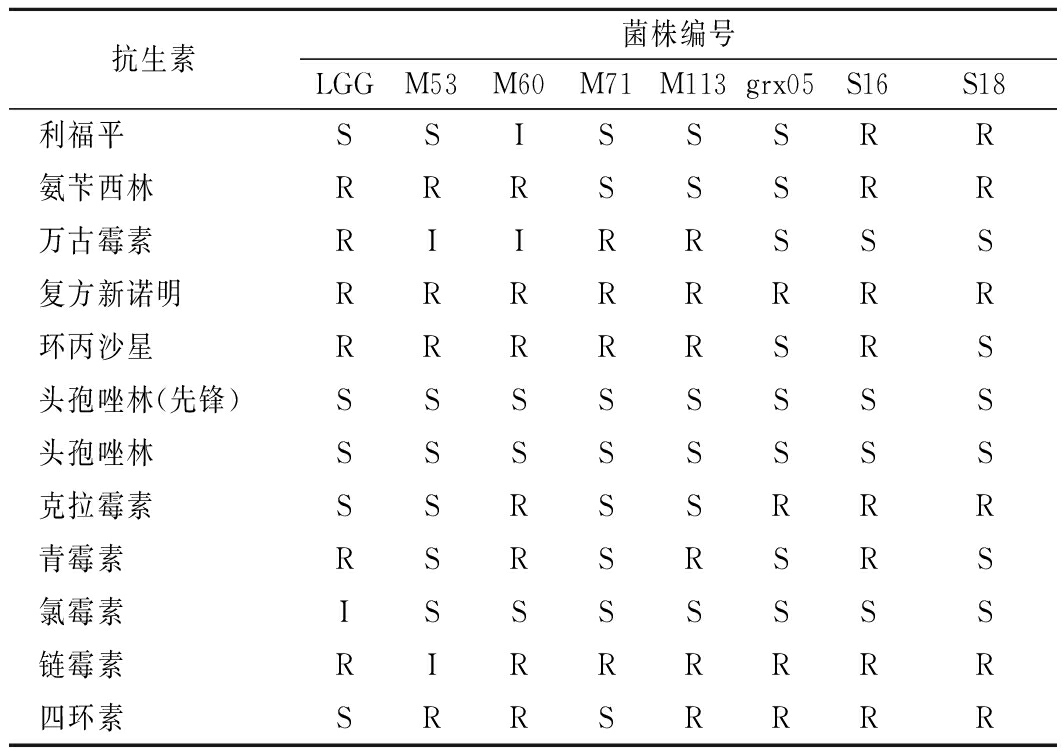
抗生素菌株编号LGGM53M60M71M113grx05S16S18利福平SSISSSRR氨苄西林RRRSSSRR万古霉素RIIRRSSS复方新诺明RRRRRRRR环丙沙星RRRRRSRS头孢唑林(先锋)SSSSSSSS头孢唑林SSSSSSSS克拉霉素SSRSSRRR青霉素RSRSRSRS氯霉素ISSSSSSS链霉素RIRRRRRR四环素SRRSRRRR
注:S:敏感;I:中介;R:耐药
2.5 菌株抑菌能力
益生菌进入人体后黏附在机体胃肠道,产生的代谢产物包括有机酸、抑菌蛋白类,脂肽类和细菌素类等物质对抑制有害菌增殖起重要的作用[20]。YANG等[21]研究发现从泡菜中分离出的乳酸乳球菌能够产生细菌素类物质,从而达到抑制金黄色葡萄球菌的目的。DELCARU等[22]研究发现从健康婴儿粪便中分离出的4株双歧杆菌对从婴儿粪便分离出的大肠埃希氏菌具有明显的抑制作用。由表6可知,本文从母乳中分离出的鼠李糖乳杆菌和双歧杆菌对3株革兰氏阳性菌均具有明显的抑制效果,抑菌圈直径均>15 mm,其中菌株M113对蜡样芽胞杆菌有一定的抑制能力,抑菌圈直径为5~10 mm,可以有效抑制肠道内病原微生物的生长,其余菌株对蜡样芽胞杆菌没有抑制效果,而LGG可以有效抑制蜡样芽胞杆菌的生长。双歧杆菌对金黄色葡萄球菌抑制效果较弱。因此组合使用不同菌株更有利于防治细菌引起的婴儿腹泻。
表6 菌株对致病菌抑制能力
Table 6 Inhibition ability of strains to pathogenic bacteria

致病菌菌株编号LGGM53M60M71M113grx05S16S18蜡样芽胞杆菌++++++++++++金黄色葡萄球菌+++++++++++++++++++++++枯草芽孢杆菌++++++++++++++++++++++++++++沙门氏菌++++++++++++++++++++++++++++++++大肠杆菌++++++++++++++++++++++++++++++++假单胞菌++++++++++++++++++++++++++++++++
注:+:抑菌圈直径<5 mm;++:抑菌圈直径为5 ~10 mm;+++:抑菌圈直径为10~15 mm;++++:抑菌圈直径>15 mm
3 结论
本研究利用选择培养基从湖南地区健康妇女的母乳中分离筛选出22株乳杆菌和3株双歧杆菌菌株。除乳杆菌M33外,其余菌株都表现出较好的耐酸能力;鼠李糖乳杆菌M53和M60,副干酪乳杆菌M71,植物乳杆菌M113和3株双歧杆菌在0.1%胆盐胁迫3 h后存活率较高,其中短双歧杆菌菌株grx05存活率最高,达到了75.54%。4株乳杆菌对头孢类,利福平和氯霉素敏感,3株双歧杆菌对万古霉素,青霉素P和氯霉素敏感,菌株M71和grx05对8种抗生素敏感,具有较高的安全性;4株乳杆菌和3株双歧杆菌对3株革兰氏阳性菌和1株革兰氏阴性菌具有明显抑制能力,而3株双歧杆菌对金黄色葡萄球菌和蜡样芽胞杆菌没有抑制效果。综合而言鼠李糖乳杆菌M53和短双歧杆菌grx05具有良好的益生特性,可作为有潜力的菌株进行下一步的研究和开发。
[1] 耿爽, 肖红利, 王斯佳.食用益生菌体外功能筛选研究进展[J].食品科技,2020, 45(5):19-23.
GENG S, XIAO H L, WANG S J.Advances in functional screening of edible probiotics[J].Food Science and Technology, 2020, 45(5):19-23.
[2] MART N R, LANGA S, REVIRIEGO C, et al.Human milk is a source of lactic acid bacteria for the infant gut[J].The Journal of Pediatrics, 2003, 143(6):754-758.
N R, LANGA S, REVIRIEGO C, et al.Human milk is a source of lactic acid bacteria for the infant gut[J].The Journal of Pediatrics, 2003, 143(6):754-758.
[3] KHALKHALI S, MOJGANI N. In vitro and in vivo safety analysis of Enterococcus faecium 2C isolated from human breast milk[J].Microbial Pathogenesis, 2018, 116:73-77.
[4] DAMACENO Q S, SOUZA J P, NICOLI J R, et al.Evaluation of potential probiotics isolated from human milk and colostrum[J].Probiotics and Antimicrobial Proteins, 2017, 9(4):371-379.
[5] ARBOLEYA S, RUAS-MADIEDO P, MARGOLLES A, et al.Characterization and in vitro properties of potentially probiotic Bifidobacterium strains isolated from breast-milk[J].International Journal of Food Microbiology, 2011, 149(1):28-36.
[6] KANG W L, PAN L N, PENG C, et al.Isolation and characterization of lactic acid bacteria from human milk[J].Journal of Dairy Science, 2020, 103(11):9 980-9 991.
[7] SOTO A, MART N V, JIMÉNEZ E, et al.Lactobacilli and bifidobacteria in human breast milk:Influence of antibiotherapy and other host and clinical factors[J].Journal of Pediatric Gastroenterology and Nutrition, 2014, 59(1):78-88.
N V, JIMÉNEZ E, et al.Lactobacilli and bifidobacteria in human breast milk:Influence of antibiotherapy and other host and clinical factors[J].Journal of Pediatric Gastroenterology and Nutrition, 2014, 59(1):78-88.
[8] 郑慧娟, 白晓晔, 高旭, 等.双歧杆菌属特异性测序引物筛选及优化[J].微生物学通报,2019, 46(7):1 736-1 747.
ZHENG H J, BAI X Y, GAO X, et al.Screening and optimization of Bifidobacterium-specific sequencing primers[J].Microbiology China, 2019, 46(7):1 736-1 747.
[9] 赵小茜, 魏旭丹, 陈戴玲, 等.乳酸菌耐酸耐胆盐机制研究进展[J].乳业科学与技术,2017, 40(3):33-36.
ZHAO X X, WEI X D, CHEN D L, et al.A review on the mechanism of acid and bile salt resistance of lactic acid bacteria[J].Journal of Dairy Science and Technology, 2017, 40(3):33-36.
[10] ALVAREZ-ORD
 EZ A, CUMMINS C, DEASY T, et al.Acid stress management by Cronobacter sakazakii.[J].International Journal of Food Microbiology, 2014, 178:21-28.
EZ A, CUMMINS C, DEASY T, et al.Acid stress management by Cronobacter sakazakii.[J].International Journal of Food Microbiology, 2014, 178:21-28.
[11] REIS N, SARAIVA M, DUARTE E, et al.Probiotic properties of lactic acid bacteria isolated from human milk[J].Journal of Applied Microbiology, 2016, 121(3):811-820.
[12] 张欢畅.母乳源植物乳杆菌的全基因组测序与潜在的益生能力探究[D].秦皇岛:河北科技师范学院,2019.
ZHANG H C.Whole genome sequencing and potential probiotics of Lactobacillus plantarum derived from human breast milk[D].Qinhuangdao:Hebei Normal University of Science and Technology, 2019.
[13] 郑丽君, 吴秀英, 李洪亮, 等.婴儿粪便中益生菌的分离筛选及培养[J].农产品加工,2019(7):8-12.
ZHENG L J, WU X Y, LI H L, et al.Isolation and cultivation of probiotics from infant faeces[J].Farm Products Processing, 2019(7):8-12.
[14] 胡爱华, 敖晓琳, 陈岑, 等.乳酸菌耐酸耐胆盐机制的研究进展[J].食品工业科技,2015, 36(8):380-383;389.
HU A H, AO X L, CHEN C, et al.Research progress on mechanism of lactic acid bacteria acid and bile salt resistance[J].Science and Technology of Food Industry, 2015, 36(8):380-383;389.
[15] 杨焱炯, 张和春, 周朝晖, 等.具有降血压功能的益生菌的筛选[J].微生物学通报,2006, 33(5):28-30.
YANG Y J, ZHANG H C, ZHOU C H, et al.Screening of antihypertensive probiotic[J].Microbiology, 2006, 33(5):28-30.
[16] AWASTI N, TOMAR S K, POPHALY S D, et al.Probiotic and functional characterization of bifidobacteria of Indian human origin[J].Journal of Applied Microbiology, 2016, 120(4):1 021-1 032.
[17] WANG N, HANG X M, ZHANG M, et al.New genetic environments of the macrolide-lincosamide-streptogramin resistance determinant erm(X) and their influence on potential horizontal transferability in bifidobacteria[J].International Journal of Antimicrobial Agents, 2017, 50(4):572-580.
[18] RIAZ RAJOKA M S, MEHWISH H M, SIDDIQ M, et al.Identification, characterization, and probiotic potential of Lactobacillus rhamnosus isolated from human milk[J].LWT, 2017, 84:271-280.
[19] D′AIMMO M R, MODESTO M, BIAVATI B.Antibiotic resistance of lactic acid bacteria and Bifidobacterium spp.isolated from dairy and pharmaceutical products[J].International Journal of Food Microbiology, 2007, 115(1):35-42.
[20] 韩乾杰, 陈俊杰, 王依依, 等.益生菌的抑菌物质研究进展[J].饲料博览,2015, 280(8):36-38.
HAN Q J, CHEN J J, WANG Y Y, et al.Research progress on antifungal substance of probiotics[J].Feed Review, 2015, 280(8):36-38.
[21] YANG J M, MOON G S.Isolation of a Lactococcus lactis strain producing anti-staphylococcal bacteriocin[J].Korean Journal for Food Science of Animal Resources, 2018, 38(6):1 315-1 321.
[22] DELCARU C, ALEXANDRU I, PODGOREANU P, et al.Antagonistic activities of some Bifidobacterium sp.strains isolated from resident infant gastrointestinal microbiota on gram-negative enteric pathogens[J].Anaerobe, 2016, 39:39-44.