ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是由多个赖氨酸残基通过α-COOH和ε-NH2连接而成的一种同型氨基酸聚合物[1],聚合度多为5~35,分子质量一般在780~4 600 Da。ε-PL产品为淡黄色粉末,吸湿性强,极易溶于水,不溶于有机溶剂,热稳定性较好,水溶液可以在100 ℃加热 30 min 或者在120 ℃条件下加热20 min不降解[2]。由于其主链上存在许多游离氨基,在酸性到弱碱性环境中表现出多阳离子特性。它对多种微生物,包括大多数革兰氏阳性菌和革兰氏阴性菌、酵母、霉菌和噬菌体均有抑制作用[3-6]。ε-PL 作为一种绿色、安全生物食品防腐剂被广泛使用[7-8]。
研究表明,ε-PL的合成是在聚赖氨酸合成酶的催化作用下,以L-赖氨酸为前体,以非核糖体多肽合成方式聚合[9]。ε-PL的抑菌性能受其聚合度影响,日本学者SHIMA等[10]考察了ε-PL的抑菌性能,发现当ε-PL聚合度<9时,抑菌活性很低,ε-PL聚合度>25时,其抑菌性能最佳。在刘庆瑞等[11]的研究中,高聚合度ε-PL对革兰氏阳性和阴性细菌的最小抑菌浓度(minimal inhibitory concentration,MIC)是发酵产生的ε-PL的1/2 ~1/4;聚合度<20的ε-PL的MIC 值是发酵产生的ε-PL 的2~4倍,ε-PL聚合度越高越有利于抑制细菌。KITO等[12]在Streptomyces albulus细胞膜上发现了ε-PL降解酶(ε-poly-L-lysine-degrading enzyme,PLD)的存在,他们研究发现其最适pH值为7.0,在发酵过程中控制低pH可以避免ε-PL降解,从而积累高聚合度的ε-PL。NISHIKAWA等[13]在ε-PL合成过程中向培养基内同时添加甘油和璜化ε-环糊精,使得ε-PL分子质量由3.5~4.5 kDa减小到2.5 kDa,他们还提出了一种通过调节培养基中多元醇浓度来控制ε-PL中赖氨酸残基数量的方法。现有的对于ε-PL聚合度控制的研究大多集中在菌株改造和发酵过程控制等环节,通过下游分离工艺来控制商品ε-PL的聚合度却尚未见报道。
膜分离技术是以选择性透过膜为介质,借助于外界能量或化学位差的推动,实现多组分混合物进行分离、分级、提纯以及浓缩富集的技术,其过程简单,无相变,无二次污染且分离系数大[14-15]。本团队前期筛选的链霉菌发酵生产的ε-PL聚合度主要分布在5~35,本研究旨在尝试通过膜分离技术,在下游分离提取环节部分分离去除低聚合度(<25)ε-PL,提高产品中高聚合度(25~35)ε-PL含量,以提高单位产品的抑菌性能。
1 材料与方法
1.1 材料
ε-PL,江苏一鸣生物科技有限公司;乙腈(纯度≥99%)、甲基橙、NaClO4·H2O等常规试剂,分析纯,国药集团化学试剂有限公司。
实验用膜片,泰州星达膜科技有限公司,主要参数如表1所示。
表1 膜片主要性能参数
Table 1 Main parameters of membrane
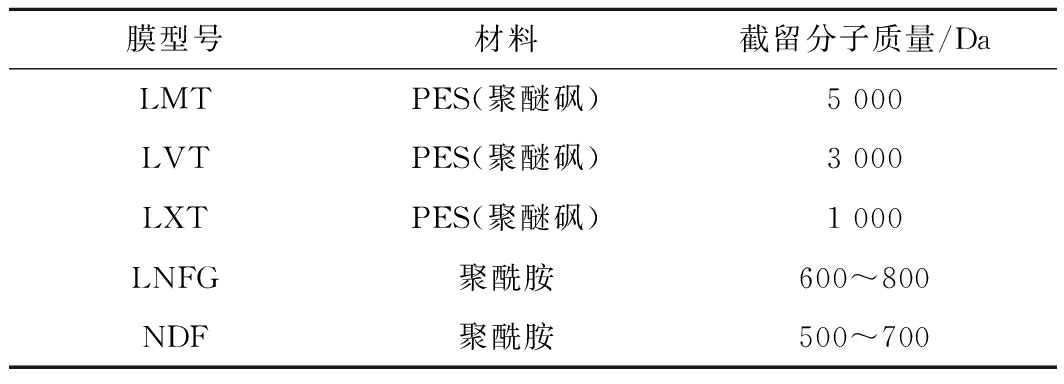
膜型号材料截留分子质量/DaLMTPES(聚醚砜)5 000LVTPES(聚醚砜)3 000LXTPES(聚醚砜)1 000LNFG聚酰胺600~800NDF聚酰胺500~700
1.2 仪器与设备
Synder小型超滤系统,泰州星达膜科技有限公司;PHS3TC pH计,上海天达仪器有限公司;UV2100分光光度计,优尼科仪器有限公司;AB204N分析天平,瑞士梅特勒公司;Agilent 1260 Infinity高效液相色谱仪,美国Agilent 公司。
1.3 ε-PL的分析
ε-PL浓度采用甲基橙比色法确定[16]。ε-PL聚合度通过离子对色谱[17-18]来测定。TSKgel ODS-80Ts色谱柱(4.6 mm×250 mm;Tosoh,Tokyo),流动相A:10 mmol/L NaH2PO4、100 mmol/L NaClO4·H2O, 10 mmol/L辛烷磺酸钠,磷酸调pH值至2.6。流动相B:20 mmol/L NaH2PO4,200 mmol/L NaClO4·H2O,20 mmol/L辛烷磺酸钠,磷酸调pH值至2.6,50%(体积分数)乙腈。流动相梯度:50 ℃,85 min内,B从55%线性变化为90%,与A混合,0.4 mL/min。检测波长:215 nm。该色谱条件下不同聚合度的ε-PL的校正因子相近,不同聚合度的ε-PL的含量由归一化法来定量。
1.4 膜的截留率与透过率
膜的截留率如计算公式(1)所示:
截留率![]()
(1)
式中:C0,原料液中的ε-PL质量浓度,g/L;C1,截留液中ε-PL质量浓度,g/L;V0、V1,料液、截留液的体积,L。
膜的透过率计算如公式(2)所示:
透过率![]()
(2)
式中:C2,透过液中ε-PL质量浓度,g/L;V2,透过液的体积,L。
1.5 膜通量的测定
通过测定一定时间得到的透过液体积,根据公式(3)计算膜通量:
膜通量![]()
(3)
式中:V,透过液的体积,L;A,膜面积,m2;t,过滤的时间,h。
1.6 透析过滤
本研究使用的小型膜分离装置结构如图1所示。操作方式参考李芳良等[19]的间歇变容渗滤。
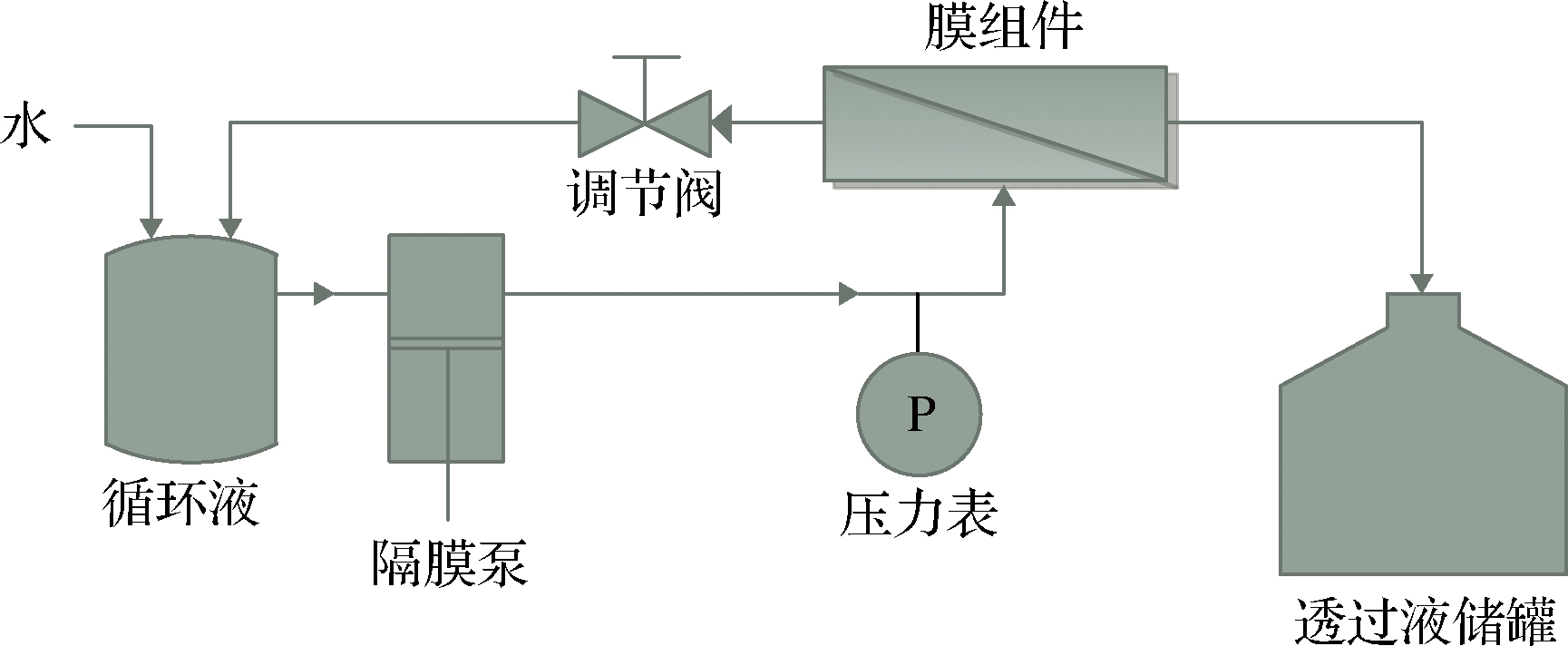
图1 膜分离装置示意图
Fig.1 Schematic diagram of membrane separation device
1.7 ε-PL的抑菌性能
测定不同ε-PL产品的MIC,比较其抑菌性能[10]。细菌采用肉汤液体培养基,酵母菌采用YPD 液体培养基,霉菌采用PDA 液体培养基来培养。向每个试管内加入 1 mL稀释后的ε-PL 溶液和1 mL培养基稀释的菌液,使细菌菌液浓度约为 5×105 CFU/mL,酵母菌、霉菌终浓度为0.5~2.5×103 CFU/mL。其中,细菌第1~11管ε-PL质量浓度分别为 1,2,4,6,8,10,12,14,16,18,20 μg/mL,酵母菌和霉菌第1~11管ε-PL质量浓度分别为 1 200、1 100、1 000、900、800、700、600、500、400、200、100 μg/mL。细菌于37 ℃培养12 h,酵母菌、霉菌于37 ℃培养48 h后,肉眼观察以完全抑制菌体生长的最低ε-PL浓度为最小抑菌浓度[11]。
2 结果与分析
2.1 膜片截留分子质量的选择
ε-PL等电点约为9,在pH=9的溶液中,ε-PL接近电中性,选择该pH条件对料液进行分离,可减少ε-PL带电性在过膜过程中的干扰。选择pH=9,质量浓度为10 g/L的ε-PL水溶液作为待分离料液,在压力为0.25 MPa的条件下进行膜片的预筛。由图2-a 可知,在同样的操作条件下,膜的截留分子质量越大,其膜通量越大。膜MT(5 000 Da)对于ε-PL截留率较低,其他4种膜对ε-PL的截留率均达到80%以上。
通过对不同型号膜的透过液进行聚合度分析(图2-b),VT膜的综合表现最好。VT膜透过液中低聚合度ε-PL含量最高,其低聚合度(<25)ε-PL含量为41.08%,聚合度在25~35的ε-PL含量为58.92%。VT膜标定的截留分子质量为3 000 Da,而聚合度为25的ε-PL的分子质量为3 348 Da,在后续的研究中,选择VT膜进行研究。
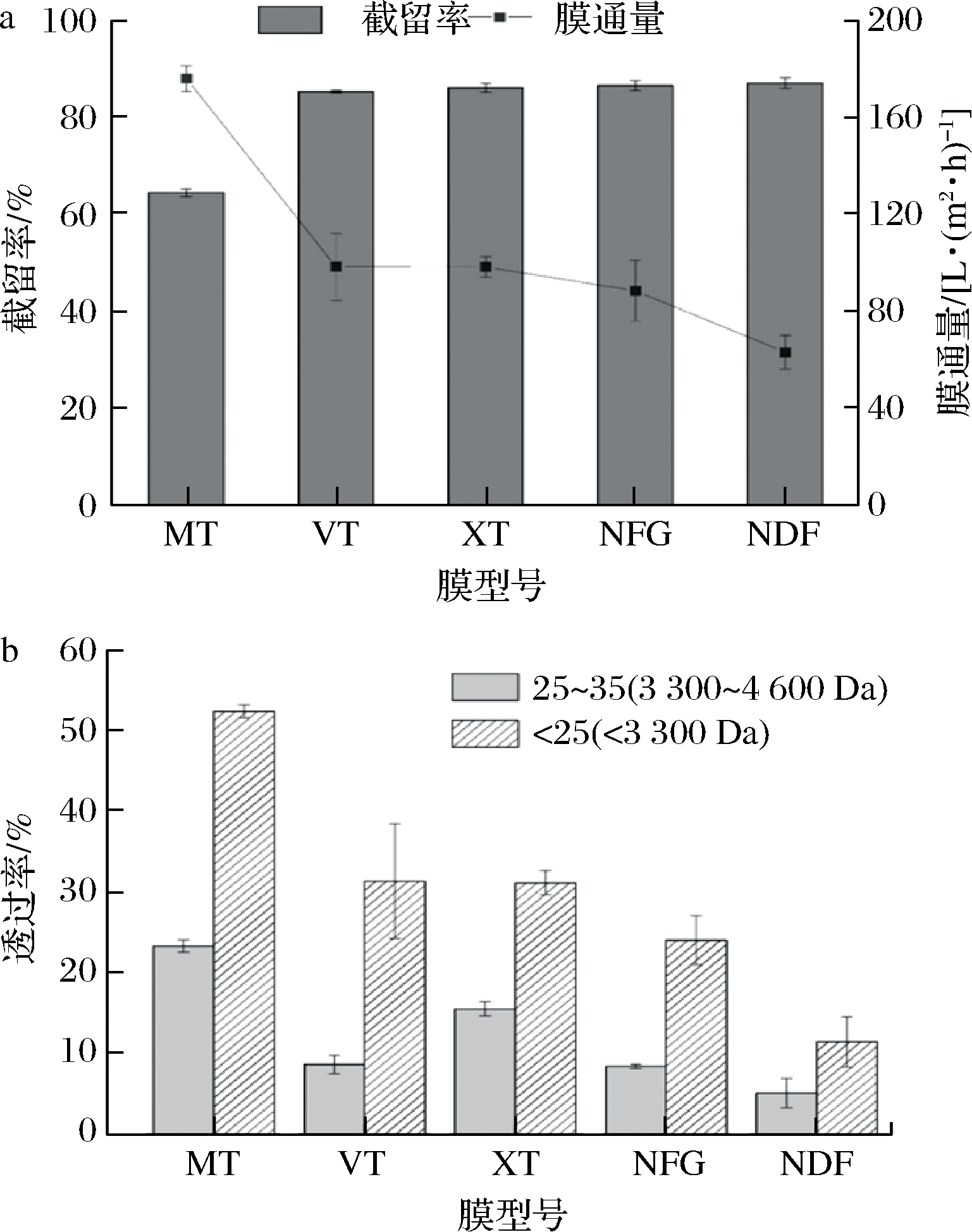
a-截留率与膜通量;b-对高低聚合度ε-PL的透过率
图2 五种不同型号的膜对ε-PL溶液的截留率与膜通量以及对高低聚合度ε-PL的透过率
Fig.2 The rejection rate and membrane flux of five membranes to ε-PL solution and the permeability to high or low degree of polymerization ε-PL
2.2 操作压力对高低聚合度ε-PL分离效果的影响
压力会影响膜分离过程的体积通量,图3-a可知体积通量随着压力的增加而增加。压力基本上不会影响VT膜对高聚合度的ε-PL的透过率(图3-b),但是压力较小时,低聚合度ε-PL透过率相对较高,可见在分离过程中,低聚合度的ε-PL相对更容易通过膜。但由于循环液中低聚合度ε-PL的含量很低(17.73%),且高低聚合度的ε-PL分子质量差异并不显著,因此分离效果并不明显。由于压力较低时膜通量很低,选择0.25 MPa(约0.25 MPa)作为后续实验的操作压力。
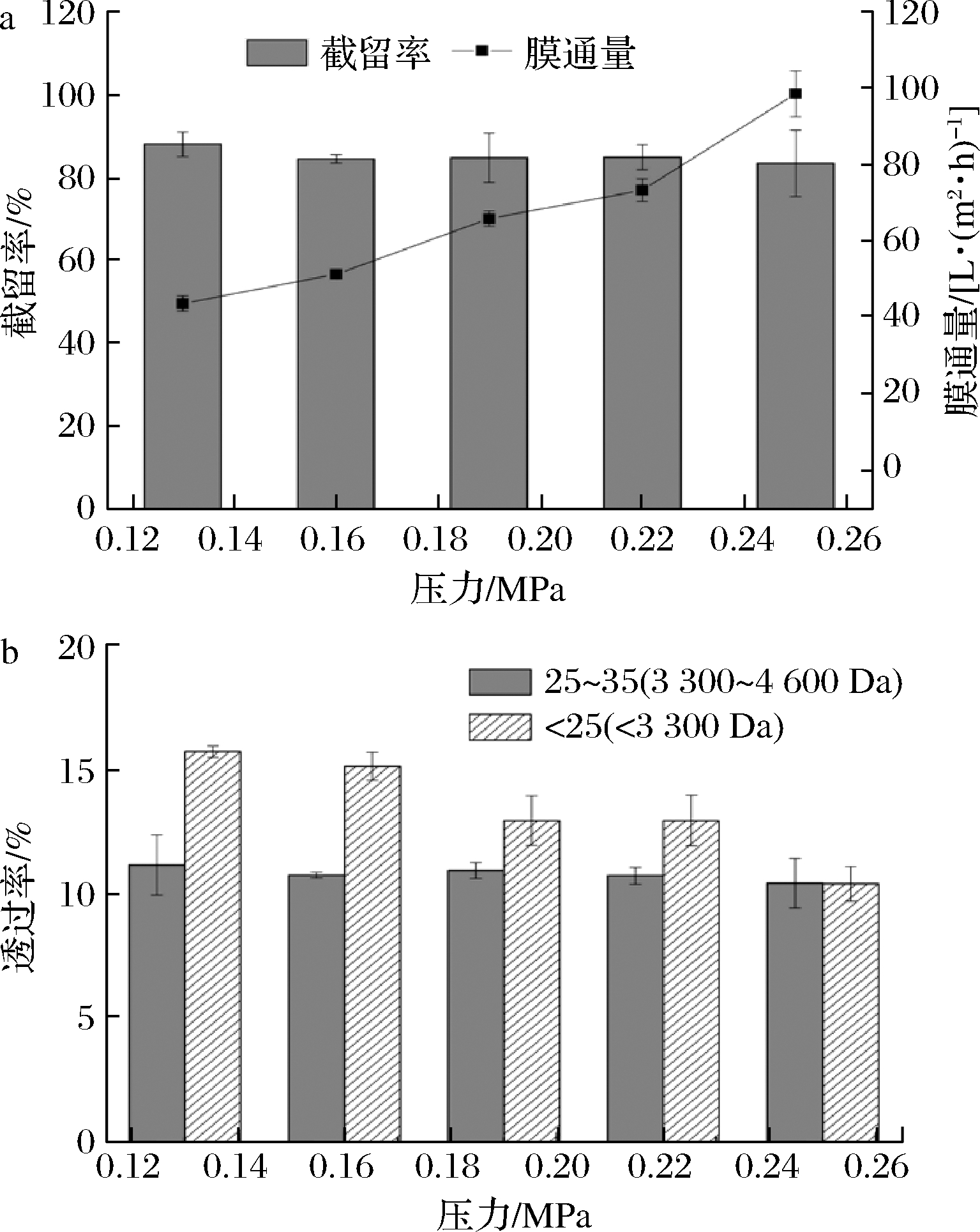
a-截留率与膜通量;b-对高低聚合度ε-PL的透过率
图3 不同操作压力下VT膜对ε-PL溶液的截留率与膜通量以及对高低聚合度ε-PL的透过率
Fig.3 The rejection rate and membrane flux of VT to ε-PL solution and the permeability to high or low degree of polymerization ε-PL with different operating pressures
2.3 pH对高低聚合度ε-PL分离效果的影响
VT对不同pH溶液中的ε-PL存在不同的筛分效果。VT对ε-PL溶液的截留率随着pH的增加减少,如图4-a所示,而体积通量基本上稳定。由图4-b可知,随着pH增加,透过液中的低聚合度ε-PL比例先增加后减少,在pH=6时,低聚合度ε-PL含量最高,为75.32%,在等电点附近,pH=9时,低聚合度ε-PL含量最低,为22.08%。
由图4-c可知,ε-PL的透过率随着pH的增加而增加。在pH=3时,VT对低聚合度ε-PL透过率为2.89%。当料液pH=10时,对低聚合度ε-PL透过率为37.51%,高聚合度ε-PL透过率为21.67%。而在pH=6时,透过液中低聚合度ε-PL比例较高,在该pH下,低聚合度ε-PL透过速率与高聚合度ε-PL相比差值更大,更有利于高低聚合度ε-PL的分离。
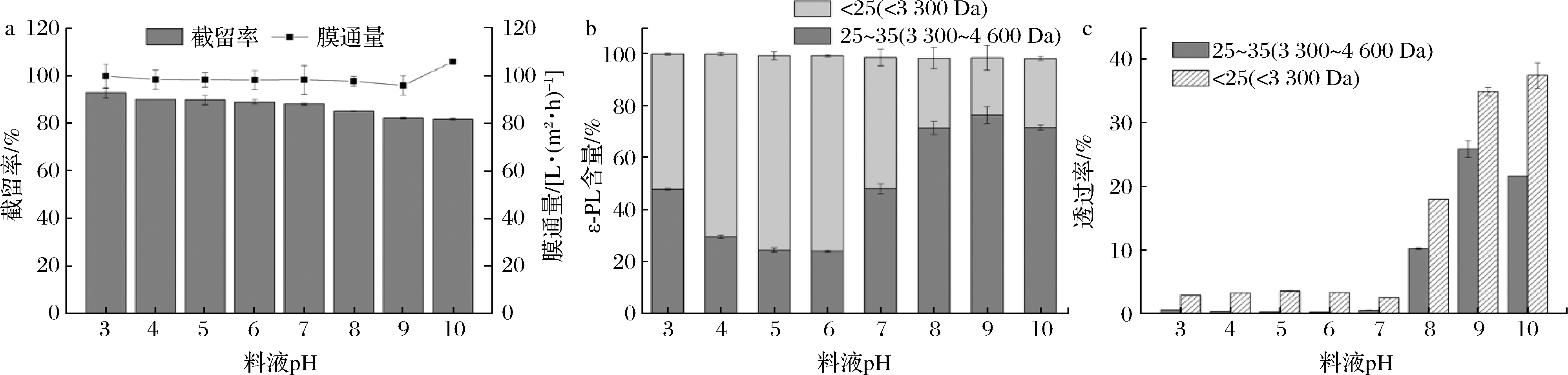
a-截留率与膜通量;b-分子质量分布;c-对高低聚合度ε-PL的透过率
图4 不同pH下VT膜对ε-PL溶液的截留率与膜通量以及对高低聚合度ε-PL的透过率
Fig.4 The rejection rate and membrane flux of VT to ε-PL solution and the permeability to high or low degree of polymerization ε-PL in different pH
2.4 初始进料浓度对高低聚合度ε-PL分离效果的影响
VT膜对ε-PL的筛分效果受料液浓度影响。体积通量会随着料液浓度的增加而降低,越稀的溶液在VT上的透过速率越快,膜对ε-PL的截留率也随料液浓度的增加而减小(图5-a)。进料液质量浓度为5 g/L的VT透过液中,低聚合度ε-PL的含量仅17.74%,VT膜基本上对溶液中高低聚合度的ε-PL没有选择性。而当进料液质量浓度为20 g/L时,低聚合度ε-PL的含量为48.04%,之后随着浓度的增加,透过液中低聚合度的ε-PL比例反而减少。由图5-b可知,低聚合度ε-PL的透过率随着浓度的增加而增大,当初始进料质量浓度为30 g/L时,低聚合度ε-PL的透过率为25.25%。进料浓度会影响ε-PL的透过,随着浓度增加,低聚合度ε-PL透过率得到提高,同时高聚合度ε-PL的透过率也会随之增加,浓度增加到一定值时,膜对高低聚合度的ε-PL的选择性降低。在本研究中,料液质量浓度为20 g/L,透过液中低聚合度ε-PL的比例最高,综合分离效果更好,选择20 g/L作为后续研究中的初始料液浓度。

a-截留率与膜通量;b-对高低聚合度ε-PL的透过率
图5 不同进料浓度下VT膜对ε-PL溶液的截留率与膜通量以及对高低聚合度ε-PL的透过率
Fig.5 The rejection rate and membrane flux of VT to ε-PL solution and the permeability to high or low degree of polymerization ε-PL with different feed concentration
2.5 透析前后产品聚合度变化
ε-PL溶液经VT透析后循环液和透过液色谱图如图6所示。循环液和透过液收集经浓缩控制质量浓度在10 g/L左右。经过不断加水循环透析,循环液中聚合度<25的ε-PL几乎被去除,经过归一化处理,此时循环液中聚合度为25~35的ε-PL含量为91.22%。相对于原产品,25~35的ε-PL比例提高了8.38%。
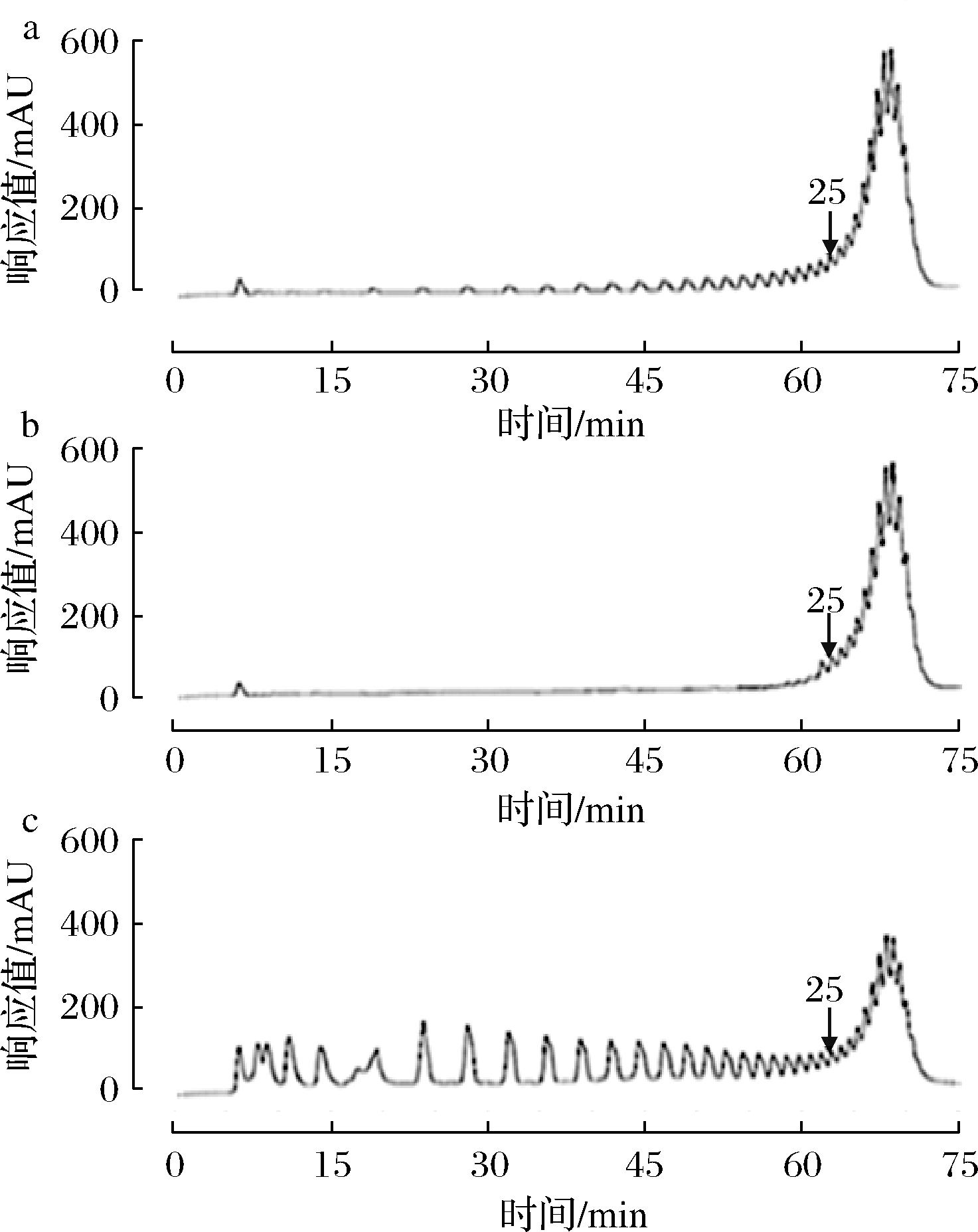
a-原产品;b-循环液;c-透过液
图6 分离前后ε-PL溶液聚合度
Fig.6 ε-PL solution polymerization degree before and after separation
2.6 不同聚合度分布的ε-PL产品的抑菌活力
通过VT透析后,我们比较了原产品与分离后产品的抑菌活力。由表2、表3可知,经过透析之后,循环液中25~35聚合度的ε-PL比例增加,无论是对于大肠杆菌还是金黄色葡萄球菌,其MIC值均低于原产品。而对于酵母和霉菌,透析后的产品与原来产品的抑菌活性无明显差异。可见,高聚合度的ε-PL更有利于抑制细菌。
表2 VT透析前后聚合度比例
Table 2 The ratio of polymerization degree before and after VT dialysis

样品低聚合度(<25)/%高聚合度(25~35)/%原产品17.1982.84分离后产品8.7891.22
表3 不同ε-聚赖氨酸产品的最小抑菌浓度
Table 3 The MIC of different ε-PL products
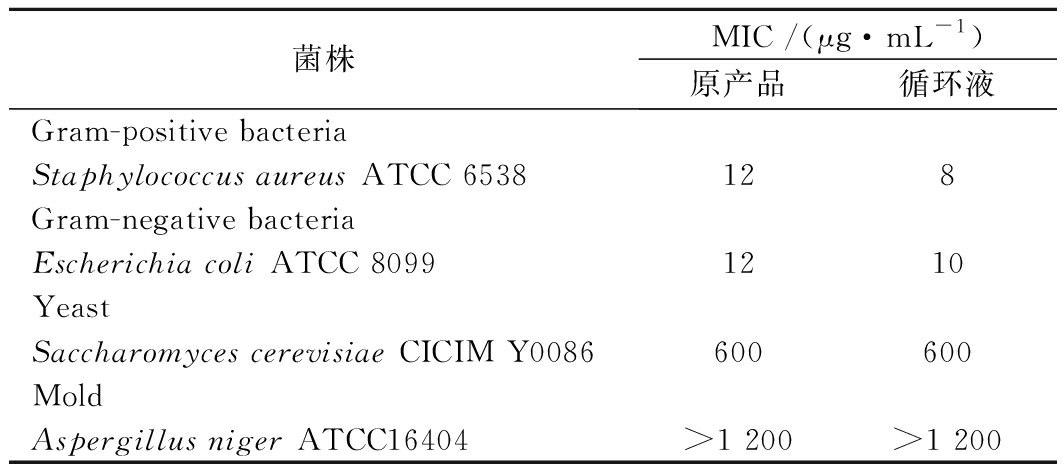
菌株MIC /(μg·mL-1)原产品循环液Gram-positive bacteriaStaphylococcus aureus ATCC 6538128Gram-negative bacteriaEscherichia coli ATCC 80991210YeastSaccharomyces cerevisiae CICIM Y0086600600MoldAspergillus niger ATCC16404>1 200>1 200
2.7 高低聚合度 ε-PL透过VT膜的模型分析
为了研究ε-PL透过膜VT的方式,我们分析了ε-PL的二级结构,结果如表4所示。ε-PL主链是长的脂肪族烃链,几乎不形成螺旋结构,主要为ε-折叠构象[20]。ε-PL侧链氨基的电离常数为8.0~9.0,当pH值低于电离常数时,氨基带有强正电荷,这导致主链中的残基相互排斥,无法形成氢键并自由膨胀,在pH<8~9的循环液和透过液中,ε-PL主要为β-折叠和无规卷曲构型。
表4 不同pH水溶液中ε-PL二级结构
Table 4 Structure of ε-PL in different pH aqueous solutions
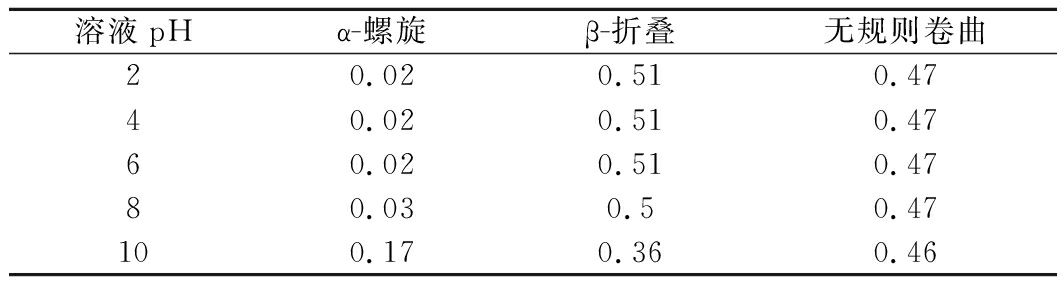
溶液pHα-螺旋β-折叠无规则卷曲20.020.510.4740.020.510.4760.020.510.4780.030.50.47100.170.360.46
由图7可知,与循环液相比,透过液中不同聚合度的ε-PL均有透过,而低聚合度ε-PL透过较多。VT由PES制成的表面活性层与支撑层2层组成,该膜的分离作用主要取决于表面活性层,活性层内含有相互交联的孔道。在pH<8~9的循环液和透过液中,不同分子质量的ε-PL呈折叠线型分子结构。当线型分子与膜面垂直时均能进入膜通道并透过,分子质量>3 000 Da的ε-PL仍然可能通过膜内的通道,分子质量<3 000 Da的ε-PL也可能会因为在膜的表面“架桥”而被截留下来,如图8所示。分子质量越大,在膜表面“架桥”的几率越大。在透析的过程中,分子质量<3 000 Da的ε-PL更容易透过膜,导致了高低聚合度ε-PL透过速度的差异,通过不停地向循环液加水循环,循环液中低聚合度ε-PL含量降低。但由于高低聚合度ε-PL分子质量差异不大,且均能透过膜片,单纯靠分子质量的差异,并不能实现高低聚合度ε-PL的绝对分离。
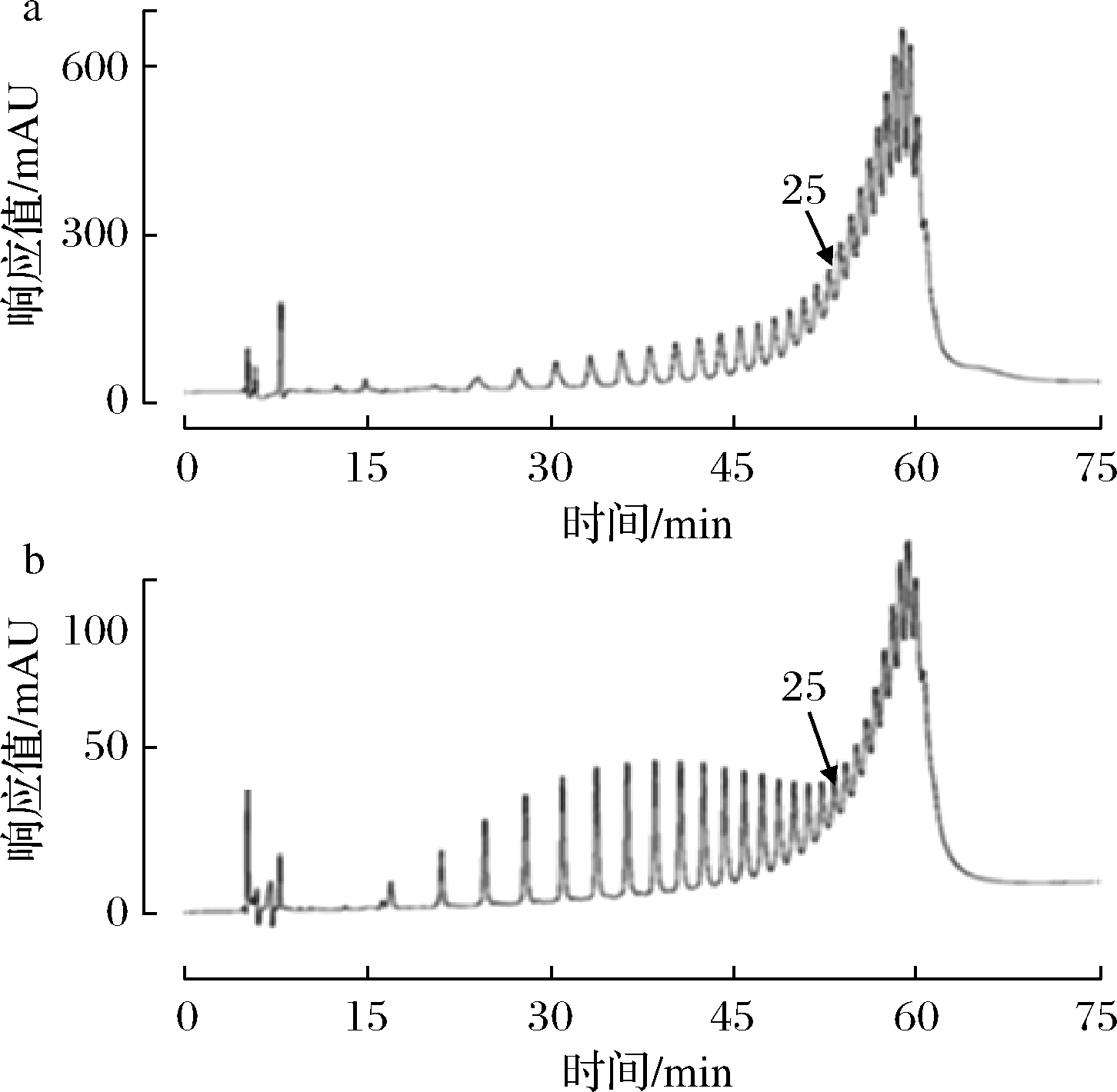
a-截留液;b-透过液
图7 VT膜的初始截留液与透过液色谱图
Fig.7 Chromatograms of the initial circulated and permeated fluid of the VT membrane

图8 透过模型示意图
Fig.8 Diagram of dialysis
3 结论
本研究尝试在下游分离提取环节提高产品中高聚合度(25~35)ε-PL含量,筛选了截留分子质量为3 000 Da的PES膜VT,确定了该膜片用来高低聚合度ε-PL的操作压力、料液pH和初始料液浓度。在操作压力0.25 MPa下,对pH=6,初始质量浓度为20 g/L的料液进行了透析,透析之后的产品中聚合度在25~35的ε-PL含量达91.22%,较原产品提高了8.38%;比较透析前后产品的抑菌性能,透析之后产品更有利于细菌的抑制。最后,对于膜工艺分离ε-PL的分离过程进行了分析。膜分离工艺不能实现不同聚合度ε-PL的绝对分离,但可以提高产品中高聚合度ε-PL的比例,提高产品对细菌的抑菌性能,对于提高ε-PL应用价值具有重要意义。
[1] SHIMA S, SAKAI H.Poly-L-lysine produced by Streptomyces.part III.chemical studies[J].Agricultural & Biological Chemistry, 1981, 45(11):2 503-2 508.
[2] SHUKLA S C, SINGH A, PANDEY A K, et al.Review on production and medical applications of ε-poly-lysine[J].Biochemical Engineering Journal, 2012, 65:70-81.
[3] SHIMA S, FUKUHARA Y, SAKAI H.Inactivation of bacteriophages by ε-poly-L-lysine produced by Streptomyces[J].Agricultural and Biological Chemistry, 1982, 46(7):1 917-1 919.
[4] HYLDGAARD M, MYGIND T, VAD B S, et al.The antimicrobial mechanism of action of epsilon-poly-L-lysine[J].Applied and Environmental Microbiology, 2014, 80(24):7 758-7 770.
[5] VAARA M.Agents that increase the permeability of the outer membrane[J].Microbiological Reviews, 1992, 56(3):395-411.
[6] 张东荣, 张超, 段作营, 等.ε-聚赖氨酸抑菌性能的初步研究[J].河南工业大学学报:自然科学版, 2006, 27(3):75-76;80.
ZHANG D R, ZHANG C, DUAN Z Y, et al.A preliminary study on the antibacterial properties of ε-poly-lysine[J].Journal of Henan University of Technology:Natural Science Edition, 2006, 27(3):75-76;80.
[7] PANDEY A K, KUMAR A.Improved microbial biosynthesis strategies and multifarious applications of the natural biopolymer epsilon-poly-L-lysine[J].Process Biochemistry, 2014, 49(3):496-505.
[8] SHUKLA S C, MISHRA A.ε-PolyLysine production from sugar cane molasses by a new isolates of Bacillus sp.and optimization of the fermentation condition[J].Annals of Microbiology, 2013, 63(4):1 513-1 523.
[9] 陈旭升, 李树, 唐蕾, 等.ε-聚赖氨酸生物制造及其在食品防腐领域的应用[J].工业微生物, 2011, 41(4):83-89.
CHEN X S, LI S, TANG L, et al.Bio-manufacturing of ε-poly-lysine and its application in the field of food preservation[J].Industrial Microbiology, 2011, 41(4):83-89.
[10] SHIMA S,MATSUOKA H,IWAMOTO T,et al.Antimicrobial action of ε-poly-L-lysine[J].The Journal of Antibiotics, 1984, 37(11):1 449-1 455.
[11] 刘庆瑞, 陈旭升, 曾昕, 等.链霉菌M-Z18膜蛋白ε-聚赖氨酸降解酶的分离纯化、酶学性质及应用[J].微生物学报, 2014, 54(9):1 022-1 032.
LIU Q R, CHEN X S, ZENG X, et al.Separation, purification, enzymatic properties and application of Streptomyces M-Z18 membrane protein ε-poly-lysine degrading enzyme[J].Acta Microbiologica Sinica, 2014, 54(9):1 022-1 032.
[12] KITO M, TAKIMOTO R, YOSHIDA T,et al.Purification and characterization of an ε-poly-L-lysine-degrading enzyme from an ε-poly-L-lysine-producing strain of Streptomyces albulus[J].Archives of Microbiology, 2002, 178(5):325-330.
[13] NISHIKAWA M, OGAWA K.Inhibition of epsilon-poly-L-lysine biosynthesis in Streptomycetaceae bacteria by short-chain polyols[J].Applied and Environmental Microbiology, 2006, 72(4):2 306-2 312.
[14] 王华, 刘艳飞, 彭东明,等.膜分离技术的研究进展及应用展望[J].应用化工,2013,42(3):532-534.
WANG H, LIU Y F, PENG D M, et al.The development of membrane separation technology and its application prospect[J].Applied Chemical Industry, 2013, 42(3):532-534.
[15] 朱鋆珊, 马平, 郭丽.膜分离技术及其应用[J].当代化工,2017,46(6):1 193-1 195;1 199.
ZHU Y S, MA P, GUO L.Membrane separation technology and its application[J].Contemporary Chemical Industry, 2017, 46(6):1 193-1 195;1 199
[16] ITZHAKI R F.Colorimetric method for estimating poly-lysine and poly-arginine[J].Analytical Biochemistry, 1972, 50(2):569-574.
[17] HIROHARA H, SAIMURA M, TAKEHARA M, et al.Substantially monodispersed poly(-L-lysine)s frequently occurred in newly isolated strains of Streptomyces sp.[J].Applied Microbiology & Biotechnology, 2007, 76(5):1 009-1 016.
[18] XU D L, WANG R, XU Z X, et al.Discovery of a short-chain ε-poly-L-lysine and its highly efficient production via synthetase swap strategy[J].Journal of Agricultural and Food Chemistry, 2019, 67(5):1 453-1 462.
[19] 李芳良, 何洪刚, 马玉, 等.纳滤脱盐在ε-聚赖氨酸分离提取中的应用[J].食品与生物技术学报, 2019, 38(11):122-129.
LI F L, HE H G, MA Y, et al.Application of nanofihration desalination in the separation and extraction of ε-poly-lysine[J].Journal of Food Science and Biotechnology, 2019, 38(11):122-129.
[20] LIU J N, CHANG S L, XU P W, et al.Structural changes and antibacterial activity of epsilon-poly-L-lysine in response to pH and phase transition and their mechanisms[J].Journal of Agricultural and Food Chemistry, 2020, 68(4):1 101-1 109.