大黄鱼肉质鲜美,脂肪含量低,蛋白含量高,营养丰富,深受消费者的喜爱。肌原纤维蛋白是大黄鱼鱼肉的重要组成部分,占鱼肉蛋白的55%~60%[1]。在鱼肉制品加工中,影响鱼肉口感和品质的主要是肌肉蛋白质,肌原纤维蛋白又是肌肉蛋白质的主要组分,因此肌原纤维蛋白结构变化对鱼肉制品品质有重要影响[2-3]。风味是十分重要的感官性质,是影响消费者选购肉制品的重要因素之一[4]。水产品的风味主要包括挥发性化合物气味和非挥发性化合物,其中挥发性成分复杂,种类繁多,对鱼肉整体风味起着重要的作用[5]。陈丽丽等[6]对6种不同水产品种鱼露的风味化合物进行测定,其中醇类、酯类和酸类化合物所占的比例最大。常海军等[7]研究发现腊肉的特征性挥发风味成分主要来自于酚类、醇类、醛类等。在肉类食品中醇、醛、酮、酯四类化合物是典型的风味物质,其与蛋白质基质紧密结合,对产品风味的改变具有决定作用。目前,肉品风味研究主要集中于对特征风味化合物的分离鉴定及加工中特征风味物质的积累,而对挥发性风味化合物在食品中的被吸附作用研究较少[8-10]。
NaCl是肉制品中重要的添加物之一,它不仅能增强食品的滋味,延长保质期,提供钠源,而且对风味物质在蛋白中的吸附作用有重要影响[11-13]。FLORES等[14]在研究干腌肉制品中不同腌制剂对风味物质释放的影响中发现NaCl是对其影响最大的物质。NAWAR等[15]认为盐溶液中离子与水分子发生水合作用,使风味成分与水分子的结合减少,促进风味释放;温欣荣等[16]研究发现,随着NaCl添加量的升高,哈尔滨风干肠中醛类化合物的含量升高,而醇类、酮类、酯类化合物的含量降低。有研究发现在水溶液中添加盐类物质会提高风味化合物在蒸汽相中的浓度,如随着NaCl浓度的增大,β-乳球蛋白对安息香醛的吸附作用降低[17]。汪娟[18]研究发现己醛和壬醛通过疏水相互作用和氢键与大豆分离蛋白结合。
已有少量报道显示肌原纤维蛋白对风味化合物的吸附作用[11],但仍缺少系统的研究。目前,NaCl浓度对海产品中肌原纤维蛋白风味吸附能力的影响并未被清晰阐明,蛋白结构的变化是否对吸附能力起作用仍不清楚[10]。对蛋白质结构及其风味物质的吸附能力进行探究,对于改善食物的风味或减少异味都有着突出作用。
本实验以养殖大黄鱼为研究对象,选择了12种典型的风味化合物(醇类、醛类、酮类、酯类),通过研究不同浓度NaCl处理后肌原纤维蛋白结构、表面疏水性、巯基含量的变化,分析肌原纤维蛋白与风味化合物相互作用机制,以便为后期养殖大黄鱼的深加工提供理论依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料与试剂
养殖大黄鱼,宁波路林市场;溴酚蓝、磷酸二氢钠、磷酸氢二钠、盐酸(分析纯),国药集团化学试剂有限公司;Tris(分析纯),德国biotech公式;1-辛烯-3-醇、1-己醇、2-庚酮、己酸乙酯、丁酸乙酯、乙酸辛脂、丁酮、2-壬酮、2-甲基丁醛、辛醛、戊醛、1-辛醇、1-戊醇、1,2-丙二醇,优级纯,国药集团化学试剂有限公司。
1.1.2 仪器与设备
Forma-725超低温冰箱,艾本德中国有限公司;J-26XP高速冷冻离心机,美国贝克曼库尔特;7230G 可见光光度计,上海舜宇恒平科学仪器有限公司;FC 型酶标仪,上海维城仪器有限公司;FSH-2A 可调高速匀浆机,上海维诚仪器有限公司;In Via-Reflex 拉曼光谱仪,法国Renishaw公司;固相微萃取装置,美国Sigma公司;气相色谱-串联质谱联用仪,美国安捷伦科技公司。
1.2 实验方法
1.2.1 样品前处理
新鲜养殖大黄鱼,将其清水冲洗,去头,去尾,去骨,取肉。将鱼肉置于绞肉机绞碎,于-20 ℃保藏,待用。
1.2.2 肌原纤维蛋白的提取
参照CHIN等[19]和JIANG等[20]的方法并适当修改,具体为:取鱼糜,加4倍体积冰提取液(20 mmol/L,pH 7.5磷酸钠缓冲液),高速匀浆机均浆60 s(7 500 r/min),将所得的匀浆液冷冻离心10 min(7 000 r/min,4 ℃),除去上清液。重复3次。得到粗肌原纤维蛋白加入4倍体积冰洗液(0.1 mol/L NaCl溶液),均浆60 s(7 500 r/min),离心10 min,取沉淀。重复1次上述实验,最后一次匀浆液用3层纱布过滤,以7 000 r/min冷冻离心10 min,沉淀置于塑料培养皿中,包保鲜膜,-40 ℃冷冻保藏。
1.2.3 肌原纤维蛋白浓度测定
取96孔板,将标准品按0、1、2、4、8、12、16、20 μL 加到孔中,再补充稀释液到20 μL。加10 μL样品于96孔板中,补充10 μl稀释液到20 μL。再各孔加入200 μL BCA工作液,37 ℃恒温摇床放置15~30 min,593 nm处测定其吸光度,标准曲线如图1所示。
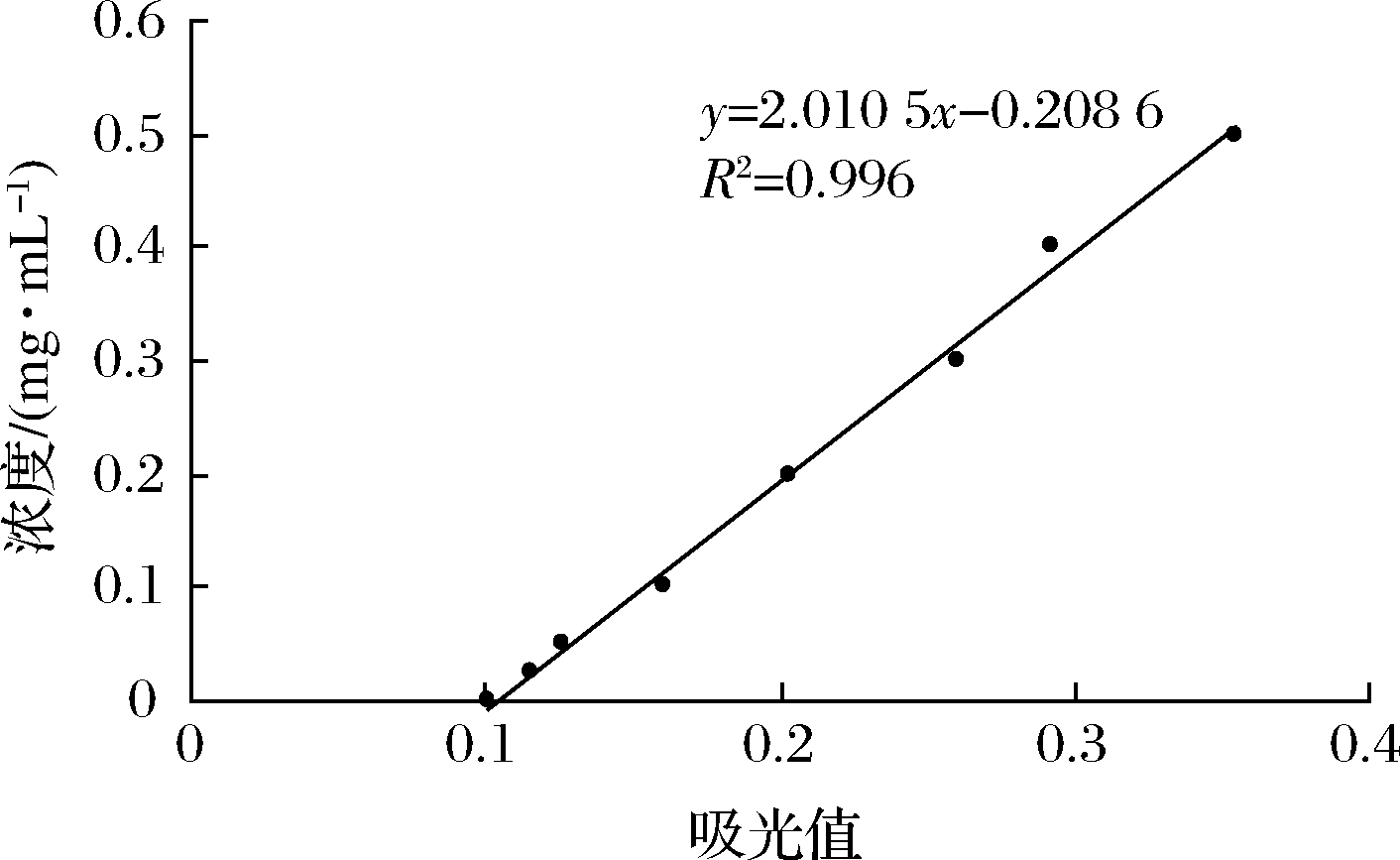
图1 蛋白浓度标准曲线
Fig.1 Standard curve of protein concentration
1.2.4 肌原纤维蛋白表面疏水性测定
依据CHELH等[21]的方法测定。用含不同浓度NaCl溶液(0、0.2、0.4、0.6、0.8、1.0 mol/L)的20 mmol/L Tris-HCl缓冲液(pH=7.0)制得蛋白质量浓度为4 mg/mL的肌原纤维蛋白溶液。取200 μL 质量浓度为1 mg/mL的溴酚蓝溶液到1 mL的肌原纤维蛋白溶液中,充分混匀,用磁力搅拌器搅拌10 min,然后常温下以7 500 r/min的转速离心15 min,取上清液(稀释10倍后),在波长为595 nm下测定吸收值A1。空白组以 Tris-HCl缓冲液在相同的条件下测得的吸光值A0,如公式(1)所示:
溴酚蓝![]()
(1)
1.2.5 肌原纤维蛋白巯基含量测定
将蛋白溶解于含有不同NaCl浓度(0、0.2、0.4、0.6、0.8、1.0 mol/L)的20 mmol/L Tris-HCl缓冲液(pH=7.0)中,加入尿素,使其终质量浓度为6 mg/mL;再向混合液中添加20 μL(1.5 mg/mL)的二硝基苯甲酸,25 ℃下静置5 min,412 nm测定吸光值,摩尔消光系数为13 600 mol/(L·cm)。巯基含量计算如公式(2)所示[22]:
(2)
式中:A为减去试剂空白后412 nm处蛋白吸光值;D为样品蛋白稀释倍数;C为蛋白质质量浓度,mg/mL。
1.2.6 拉曼光谱
用含不同NaCl浓度(0、0.2、0.4、0.6、0.8、1.0 mol/L)的肌原纤维蛋白样品采用拉曼光谱分析,参考曹锦轩等[23]的方法。将肌原纤维蛋白样品均匀涂抹于载玻片上,选择20倍长聚焦镜头对肌原纤维蛋白样品进行聚焦。具体的条件:所用功率为12 mW,532 nm氩离子激光器,分辨率为1 cm-1,获取的拉曼光谱范围在150~2 100 cm-1,每个样品测3次。
1.2.7 风味化合物制备
用适量1,2-丙二醇溶解风味化合物,用双蒸水定容,使溶液中各物质终质量浓度为800 mg/kg,密封后置于-4 ℃冰箱备用。
1.2.8 NaCl浓度对肌原纤维蛋白吸附能力的影响
参照PÉREZ等[11]与FLORES等[24]的方法并略作修改。用含不同浓度NaCl溶液(0、0.2、0.4、0.6、0.8、1.0 mol/L)的20 mmol/L Tris-HCl缓冲液(pH=7.0)配制蛋白溶液为4 mg/mL。取5 mL上述蛋白溶液于顶空瓶内,分别加入100 μL质量浓度为800 mg/kg醛类、酮类、酯类溶液,密封,匀速摇匀,4 ℃下冷藏吸附24 h。将冷藏吸附后的样品置于25 ℃下平衡2 h后,采用75 μm CAR/PDMS萃取头顶空吸附30 min。
气相色谱-质谱条件[25]:萃取头在 220 ℃下解析5 min,不分流进样,以氦气为载气,用毛细管柱对风味成分进行分离。GC升温程序:柱温在35 ℃保持3 min,以3 ℃/min程序升温至40 ℃,再以8 ℃/min升至240 ℃,保持10 min。质谱离子源温度为200 ℃,检测电压为0.9 kV,扫描质量范围为45~600 mAU。采用外标法根据色谱图的出峰时间和峰面积对12种风味物质进行定量定性。
肌原纤维蛋白吸附能力参照刘士健[26]的方法并略作修改,按公式(3)进行计算:
吸附能力![]()
(3)
式中:Ac,空白溶液中某一种挥发性化合物的峰面积;As,样品溶液某一种挥发性化合物的峰面积。
1.3 数据处理
每组试验重复3次平行,采用Office、Origin软件分析数据,SPSS软件进行显著性分析。
2 结果与分析
2.1 NaCl浓度对养殖大黄鱼肌原纤维蛋白表面疏水性的影响
蛋白质表面疏水性可以反映其表面疏水性氨基酸的相对含量,同时在一定程度上也可以反映出蛋白质结构的变化[27-28]。由图2可知,随着NaCl浓度的升高,肌原纤维蛋白表面疏水性先上升后下降。未处理组的溴酚蓝结合量为33.59 μg。当NaCl浓度为0.4 mol/L时,溴酚蓝结合量最高,为67.18 μg。当NaCl浓度为0.8、1 mol/L时,溴酚蓝结合量分别为23.42 和13.43 μg,均比未处理组低。0~0.4 mol/L浓度范围内表面疏水性的增大,可能是由于NaCl的存在使蛋白结构展开,内部的疏水性基团暴露出来。赵亚南等[29]研究发现鸭肉肌原纤维蛋白前期表面疏水性的增大可能是由于NaCl的存在破坏了蛋白分子外部亲水作用与内部疏水作用间的平衡。在NaCl浓度在0.6~1 mol/L范围内,肌原纤维蛋白表面疏水性降低,可能肌原纤维蛋白的疏水基团被包埋进蛋白内部。孔保华等[30]研究发现随着NaCl浓度的增大,鲤鱼肌原纤维蛋白的表面疏水性下降显著,继续增大浓度,表面疏水性变化不明显,可能是由于一定的离子强度可以增强肌原纤维蛋白的溶解性。
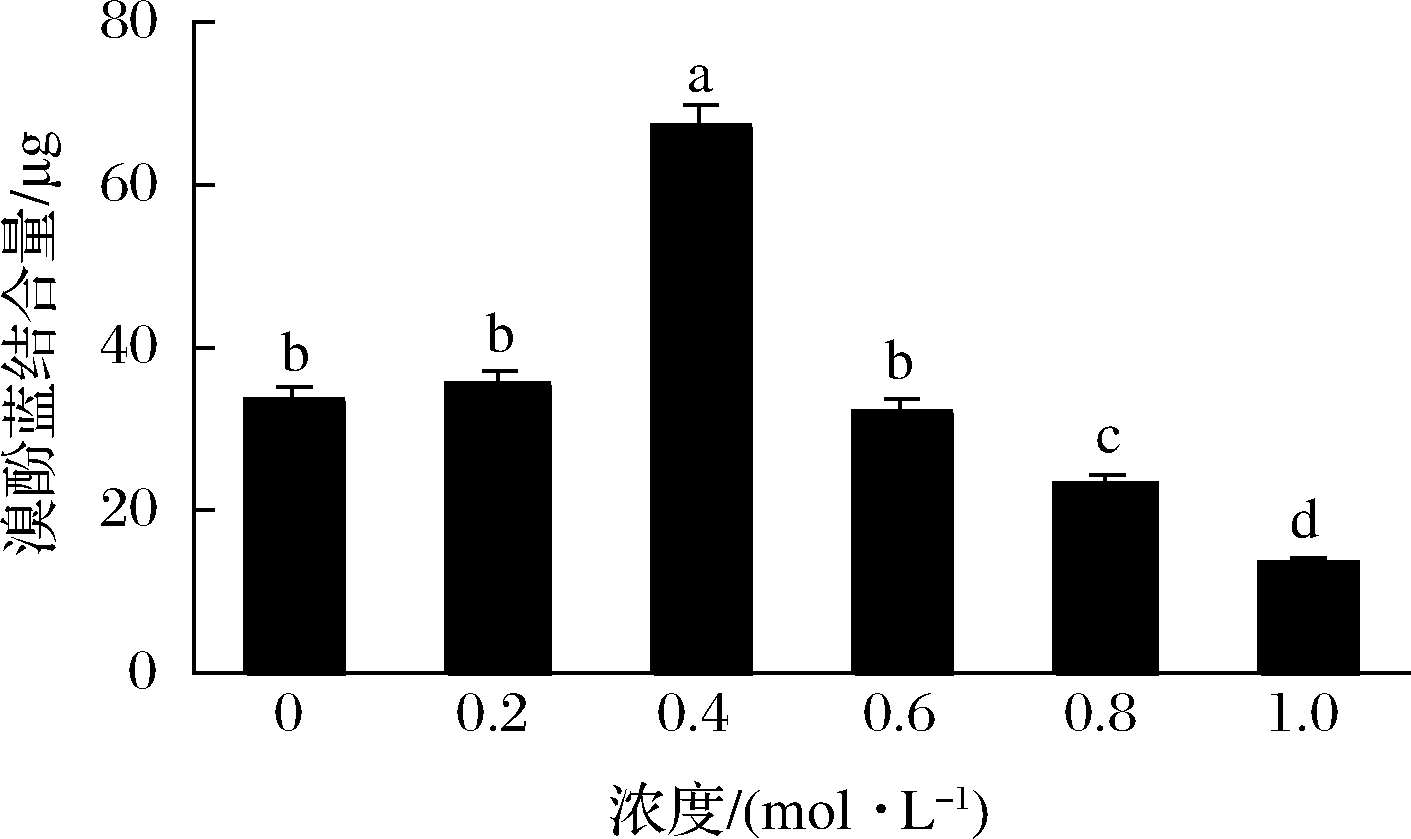
图2 NaCl浓度对肌原纤维蛋白表面疏水性的影响
Fig.2 Effect of sodium chloride concentration on the hydrophobicity of myofibrillar protein surface
注:不同小写字母表示差异显著(P<0.05)(下同)
2.2 NaCl浓度对养殖大黄鱼肌原纤维蛋白巯基含量的影响
巯基含量是蛋白结构变化的一个重要指标。由图3可以看出,随着NaCl浓度的升高,肌原纤维蛋白的巯基含量呈上升趋势。未处理组,大黄鱼肌原纤维蛋白巯基含量最低,为0.935 μmol/g,随着NaCl浓度的升高,其巯基含量逐渐上升,1 mol/L时最高,达到1.703 μmol/g。曾淑薇等[31]研究发现随着磷酸盐含量的增加,草鱼肌原纤维蛋白的巯基含量呈上升趋势,磷酸盐的加入使蛋白分子展开,二硫键断裂形成巯基。李德阳等[32]研究NaCl对大菱鲆肌原纤维蛋白巯基含量的影响发现,随着氯化钠浓度的升高,巯基含量增多,可能是由于NaCl浓度逐渐增大使蛋白分子展开,二硫键断裂形成巯基暴露在分子表面,促使蛋白巯基含量升高;且NaCl会增多肌原纤维蛋白的溶解度,使分子内部的巯基暴露在蛋白表面,巯基含量升高。
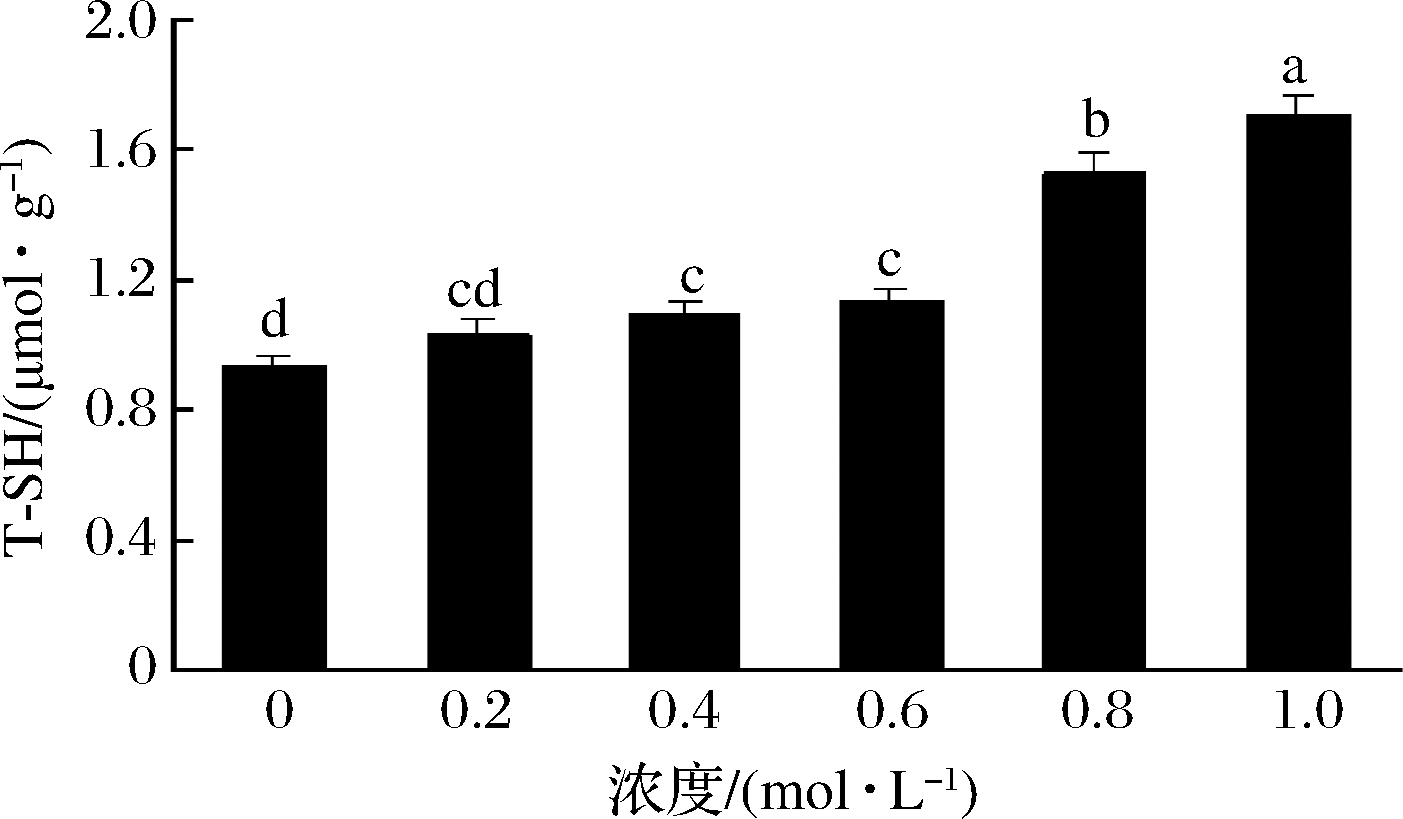
图3 NaCl浓度对肌原纤维蛋白巯基含量的影响
Fig.3 The effect of sodium chloride concentration on the sulfhydryl content of myofibrillar protein
2.3 NaCl浓度对养殖大黄鱼肌原纤维蛋白结构的影响
拉曼光谱是一种散射光谱,可以通过光谱分析分子结构,对于研究蛋白质的构象具有重要作用。蛋白的拉曼光谱图可以显示出苯丙氨酸、酪氨酸和色氨酸等氨基酸中的某些基团的特征谱带,可以通过酰胺键及C—C骨架伸缩振动谱带来获得主链骨架与侧链构象的信息,从而推测出蛋白质二级结构的变化[33]。如表1所示,在1 650~1 660 cm-1处表征的是α-螺旋结构,在1 665~1 680 cm-1处表征的是β-折叠结构,在1 660~1 665 cm-1处表征的是无规则卷曲[34]。不同浓度NaCl下肌原纤维蛋白的二级结构变化如图4所示,本实验中酰胺Ⅰ带的范围在1 650 cm-1左右,说明α-螺旋是蛋白的主要二级结构。随着NaCl浓度的升高,其最大峰值显著上移,说明α-螺旋含量不断减少,而β-折叠、β-转角结构及无规则卷曲相应增多,蛋白结构发生改变[35]。李德阳等[32]研究发现,NaCl浓度对肌原纤维蛋白的α-螺旋、β-折叠影响较大,随着NaCl浓度的升高,大菱鲆肌原纤维蛋白的α-螺旋不断下降,β-折叠的含量相对增大,而β-转角结构及无规则卷曲无明显变化,这与本实验结果一致。
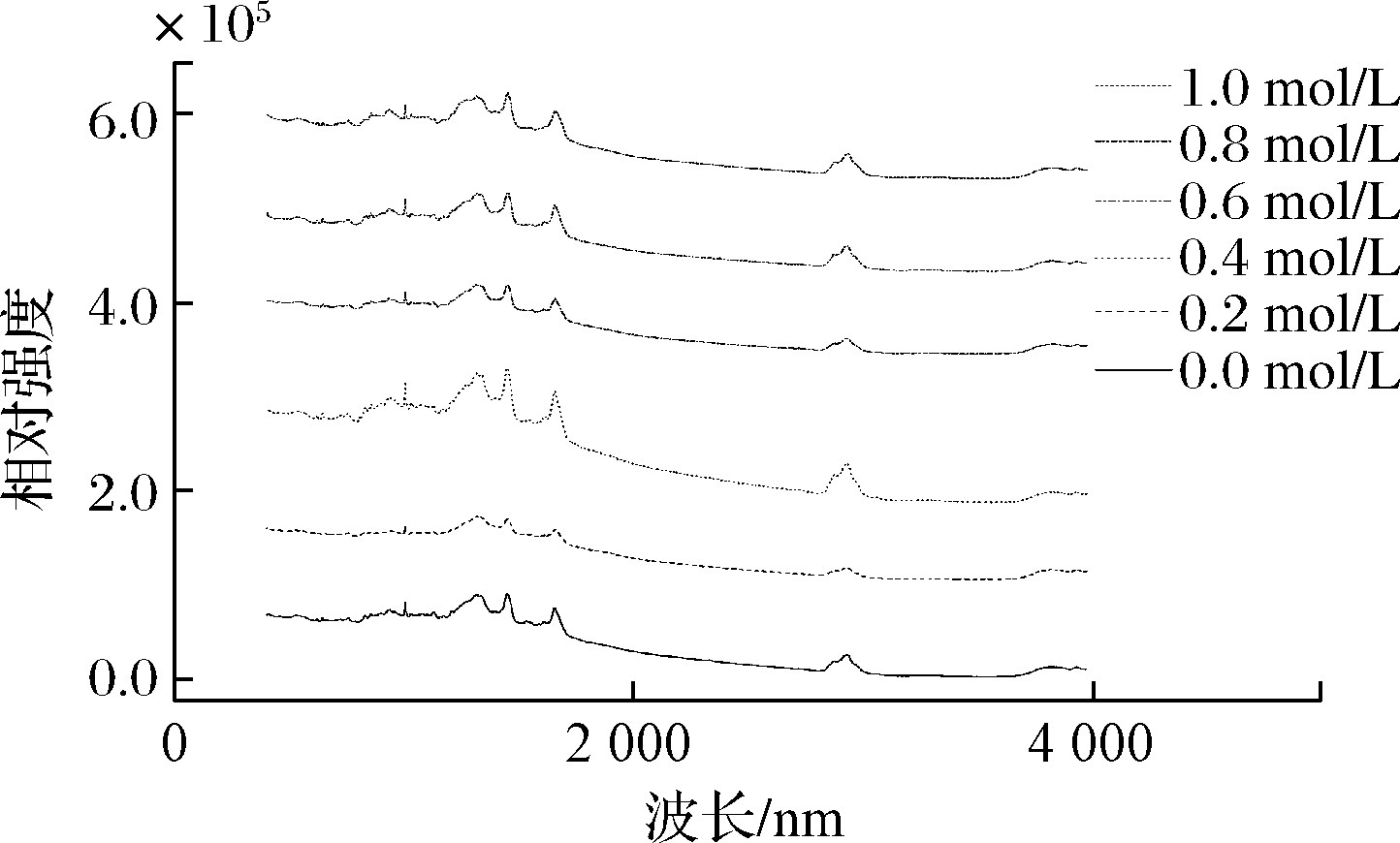
图4 NaCl浓度对肌原纤维蛋白拉曼光谱的影响
Fig.4 Effect of NaCl concentration on Raman spectra of myofibrillary protein
表1 激光拉曼光谱条带指认表
Tab 1 Raman bands identified in table

起源波数/cm-1结构酪氨酸 830/850氨基酸环境1 655±5α-螺旋酰胺I带1 665±5无规卷曲1 670±5反平行β-折叠~1 680β-转角
2.4 NaCl浓度对养殖大黄鱼肌原纤维蛋白吸附能力的影响
由图5可知,随着NaCl浓度的增加,养殖大黄鱼肌原纤维蛋白对酮类的吸附作用在降低。肌原纤维蛋白对丁酮的吸附能力随着NaCl浓度的升高而降低。在0~0.4 mol/L范围内,肌原纤维蛋白对2-庚酮的吸附能力降低,0.6 mol/L时,略有升高,之后下降。肌原纤维蛋白对2-壬酮的吸附能力在0~0.2 mol/L范围内呈下降趋势,在0.4 mol/L时,吸附能力最高。以上变化说明不同NaCl浓度影响肌原纤维蛋白对不同种酮类的吸附能力。本实验中肌原纤维蛋白巯基含量随NaCl浓度升高不断增大,蛋白结构发生变化,稳定性降低,其可能导致蛋白对酮类化合物的吸附能力下降。
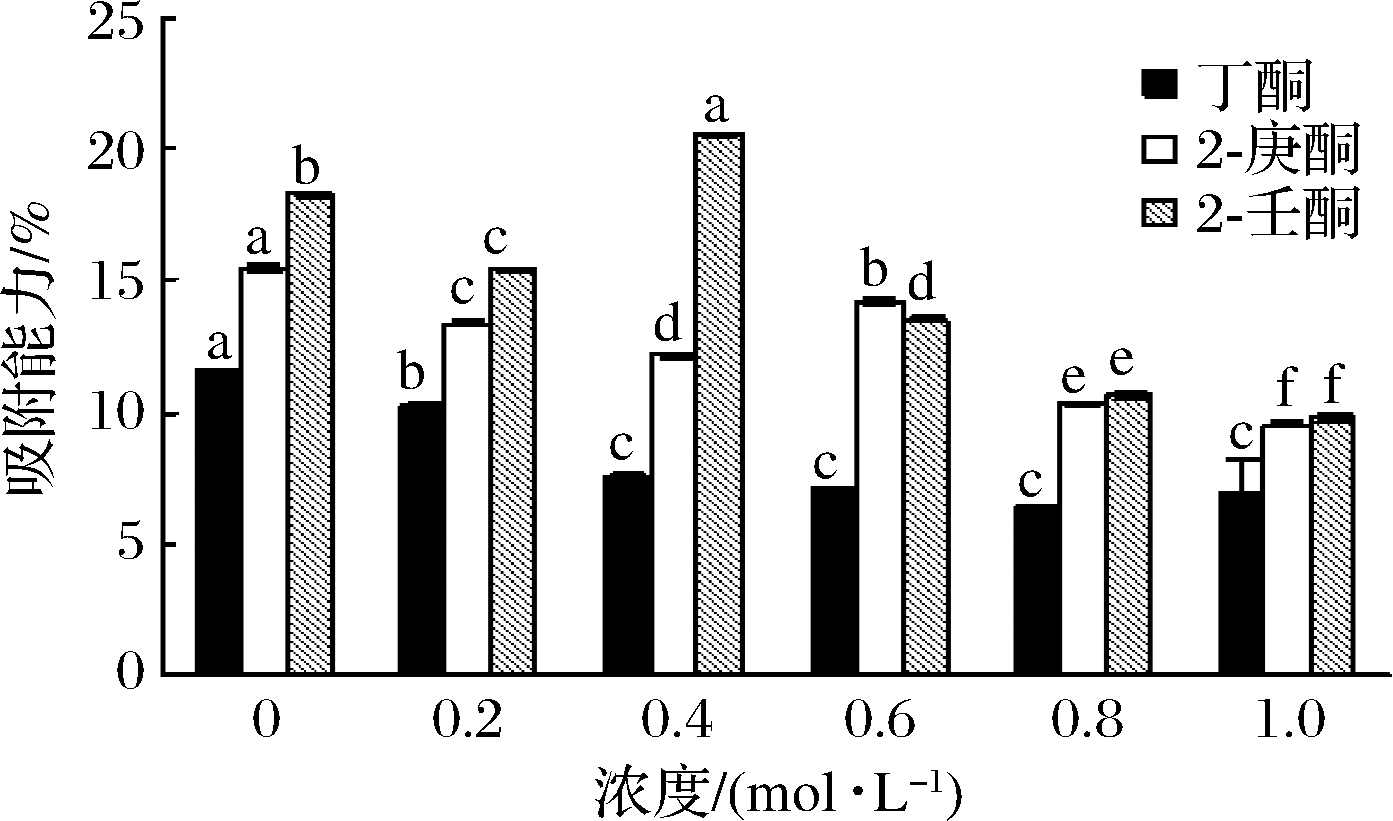
图5 NaCl浓度对肌原纤维蛋白吸附酮类化合物能力的影响
Fig.5 Effect of NaCl concentration on the capability of mycofibrin to adsorption of ketones
由图6可知,NaCl降低了肌原纤维蛋白对醛类化合物的吸附能力,醛类化合物自由比例显著上升(P<0.05)。未处理组中,肌原纤维蛋白对2-甲基丁醛、戊醛、辛醛的吸附能力分别为27.04%、57.58%、50.97%。随着NaCl浓度的升高,肌原纤维蛋白对醛类的吸附能力不断下降,在1.0 mol/L时,吸附能力分别达到12.24%、24.25%、24.85%。TAN等[36]研究发现,随着醛类化合物碳链的增长,其沸点升高,氢原子数增多且形成更多的氢键,本实验除了对照组中的戊醛的被吸附能力比辛醛大,其他浓度下的吸附作用都随碳链的增长而增大。柳敏[37]研究发现NaCl浓度会改变肌原纤维蛋白对庚醛、壬醛的吸附能力。NaCl会改变肌原纤维蛋白的空间构型,使其对风味化合物的吸附作用减弱[38]。
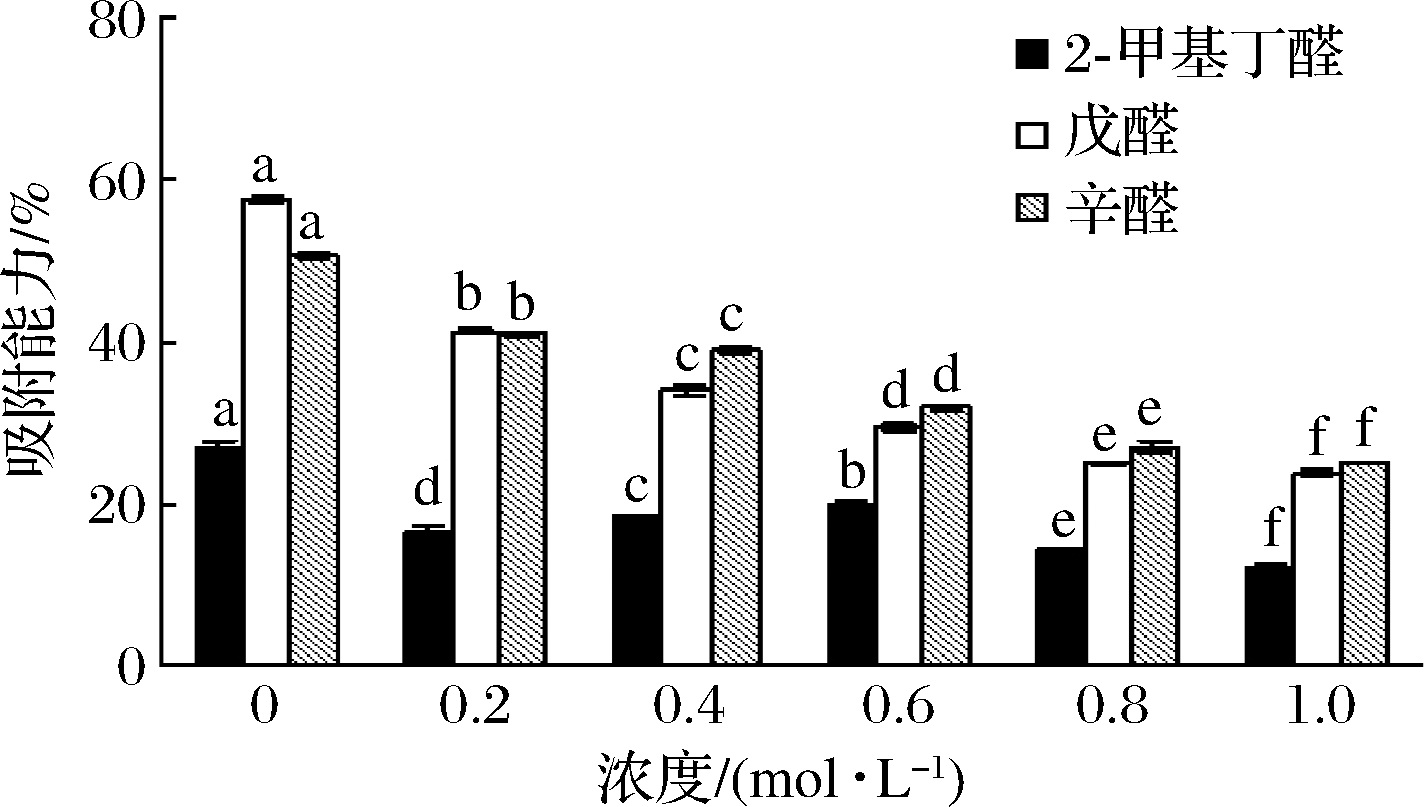
图6 NaCl浓度对肌原纤维蛋白吸附醛类化合物能力的影响
Fig.6 Effect of NaCl concentration on the capability of myofibrin to adsorption of aldodes
由图7可知,随着NaCl浓度的增大,肌原纤维蛋白对醇类的吸附能力不断发生变化,当NaCl浓度达到 0.8~1.0 mol/L时,其对醇类的吸附能力几乎接近于零。在NaCl浓度为0~0.2 mol/L时,肌原纤维蛋白对己醇与1-辛烯-3-醇的吸附能力呈下降趋势(P<0.05),当浓度达到0.4 mol/L时,又略有上升(P<0.05),分别为13.91%和27.61%。POLL等[39]发现在苹果汁中添加NaCl后乙醇、乙醛、酯类的挥发程度增大,分别为空白组的4倍、1.75~3.50倍和1.75 倍。PÉREZ等[11]发现添加了食盐的猪肉肌原纤维蛋白和肌动蛋白对风味化合物的吸附能力减弱,挥发性化合物的自有比例上升。
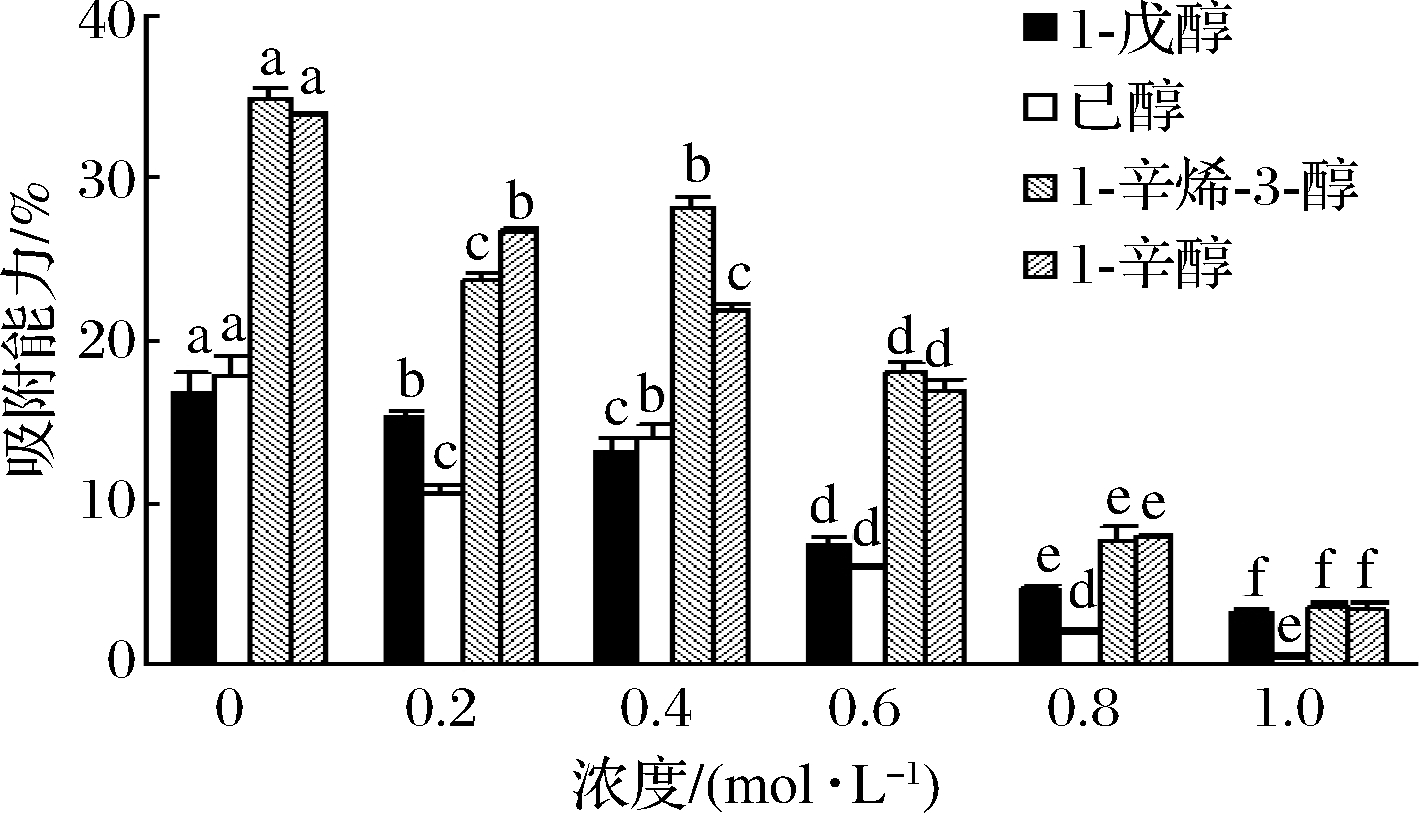
图7 NaCl浓度对肌原纤维蛋白吸附醇类化合物能力的影响
Fig.7 Effect of NaCl concentration on the capability of myofibrin to adsorption of alcohol compounds
由图8可知,NaCl浓度对肌原纤维蛋白酯类吸附能力总体呈下降趋势。与未处理组相比,肌原纤维蛋白对乙酸乙酯和乙酸辛酯吸附能力显著降低(P<0.05)。未处理组的吸附能力分别为23.3%、37.33%,在0.2~1.0 mol/L范围内,当浓度为0.6 mol/L时,肌原纤维蛋白对乙酸乙酯的吸附能力最高,为18.73%。当浓度为0.4 mol/L时,肌原纤维蛋白对乙酸辛酯的吸附能力最大,为33.93%。当盐浓度较高时,肌原纤维蛋白对酯类风味物质的吸附能力变化不明显。

图8 NaCl浓度对肌原纤维蛋白吸附酯类化合物能力的影响
Fig.8 Effect of NaCl concentration on the ability of myofibrin to adsorb ester compounds
3 讨论
有研究发现,介质条件、蛋白构象和浓度、风味化合物性质等是影响肌原纤维蛋白对挥发性风味化合物吸附作用的重要因素[6]。NaCl是食品调味的重要添加剂之一,其离子强度对于肌纤维蛋白的吸附能力具有影响,不同种类的的盐以及不同的浓度对于蛋白质的吸附能力作用程度不一样[14,36]。本实验结果表明,肌原纤维蛋白的表面疏水性随NaCl浓度的升高先上升后下降,在0.4 mol/L时最大。巯基含量随着NaCl浓度的增大不断升高,通过拉曼光谱分析发现,随着NaCl浓度的升高,肌原纤维蛋白的二级结构发生不同程度的变化。在本实验中添加了NaCl组普遍降低了肌原纤维蛋白对酮类、醛类、醇类、酯类的吸附能力。这与刘士健[26]研究NaCl对盐溶蛋白对风味化合物吸附能力的影响结果一致。KÜHN等[40]认为添加了NaCl后蛋白与风味化合出现的解吸附现象是由于蛋白溶液中存在的大量氢键,使风味化合物与水之间的氢键减少,促使风味化合物释放出来。且对于不同的风味化合物,NaCl浓度变化对其吸附能力的影响程度具有差异,比如对于醇类化合物,NaCl浓度的变化对己醇、1-辛烯-3-醇、1-辛醇的影响程度高于1-戊醇的影响。在相同NaCl浓度下,肌原纤维蛋白对1-辛烯-3-醇的吸附能力要大于1-戊醇、己醇和1-辛醇,可能是有于碳碳双键的存在可以更加显著地使风味化合物与蛋白结合。研究发现,某些特定的官能团可以影响蛋白质与风味化合物的结合能力[8]。相对于醇类化合物,肌原纤维蛋白对醛类化合物的吸附能力要显著增大,这是由于醛类化合物可以与氨基酸的α-氨基反应,生成转氨基反应中间产物席夫碱,故肌原纤维蛋白对醛类化合物的吸附能力有所增强[41]。随着NaCl浓度的增大,肌原纤维蛋白对醛类、酮类化合物的吸附能力总体呈下降趋势,在相同NaCl浓度下,肌原纤维蛋白对戊醛和辛醛的吸附作用大于2-甲基丁醛。肌原纤维蛋白对醛类物质的吸附能力与风味化合物碳链长度有关,这可能是因为风味化合物碳链越长,含有的氢键越多,其与蛋白质的结合能力越强[42-43]。韩裕睿[44]研究发现肌原纤维蛋白对2-戊醛的吸附作用大于2-甲基丁醛,这是由于2-甲基丁醛的侧链具有较大的空间位阻,阻碍其与蛋白质的结合。酮类化合物中2-壬酮受到的影响最为明显。李阳[45]研究发现,在相同NaCl含量处理后的肌球蛋白对己醇、1-辛烯-3醇、庚醛、己醛的吸附能力依次上升。本实验中,当NaCl的浓度为0~0.4 mol/L时,肌原纤维蛋白对乙酸乙酯的吸附能力呈下降趋势,浓度为0.8 mol/L时,其吸附作用增大,随后又下降。而乙酸辛酯的被吸附作用在NaCl浓度为0~0.2 mol/L时呈下降趋势,0.4 mol/L时上升,略小于对照组,在0.6~1.0 mol/L时,肌原纤维蛋白对乙酸辛酯的吸附能力大幅下降。刘士健[26]研究发现,在相同结构的酯类化合物中,其分子质量越大,蛋白质与酯类化合物的结合能力越强。此外,蛋白对酯类化合物的吸附能力还与静电相互作用有关。在0.4及0.6 mol/L时吸附能力升高可能是由于静电相互作用增强以及蛋白结构发生变化引起的。NaCl的添加可以导致鱼肉结构不稳定,部分蛋白发生溶解、聚集,蛋白聚集体的微观结构不同,影响到蛋白质之间的相互作用,改变肌原纤维蛋白的结构与构象。因此,随着NaCl浓度的提高,肌原纤维蛋白的结构不稳定,减弱蛋白对风味化合物的吸附能力[37]。
4 结论
NaCl对肌原纤维蛋白表面疏水性、巯基含量具有显著性影响,随着NaCl浓度的增大,肌原纤维蛋白的表面疏水性先上升后下降,巯基含量持续增多,且肌原纤维蛋白的二级结构发生改变,α-螺旋减少,β-折叠增多。由于肌原纤维蛋白发生变性,改变了蛋白之间的相互作用,从而导致了肌原纤维蛋白对风味化合物吸附能力的改变。但肌原纤维蛋白与风味化合物的吸附作用机制尚未明确,后续研究中可深入探讨蛋白质与风味化合物的结合位点、相互作用力等。本文研究肌原纤维蛋白对风味化合物的吸附能力对改善我国传统鱼肉制品风味品质,生产具有良好风味结合与释放特性的产品有指导意义。
[1] 杨明.马铃薯淀粉及转谷氨酰胺酶对鲤鱼肌原纤维蛋白功能特性的研究[D].哈尔滨:东北农业大学,2014.
YANG M.Effects of potato starches and transglutaminase on the functional properties of common carp myofibrillar protein[D].Harbin:Northeast Agricultural University, 2014.
[2] 姜国庆,刘英丽,张慧娟,等.肌原纤维蛋白热诱导凝胶特性研究进展[J].肉类研究,2013,27(12):19-22.
JIANG G Q, LIU Y L,ZHANG H J, et al.Progress in heat-induced gelation properties of myofibrillar proteins[J].Meat Research,2013,27(12):19-22.
[3] 杨玉玲,游远,彭晓蓓,等.加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响[J].中国农业科学,2014,47(10):2 013-2 020.
YANG Y L, YOU Y, PENG X P, et al.Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle[J].Scientia Agriculture Sinice,2014,47(10):2 013-2 020.
[4] 张建友,赵瑜亮,丁玉庭,等.脂质和蛋白质氧化与肉制品风味特征相关性研究进展[J].核农学报,2018,32(7):1 417-1 424.
ZHANG J Y, ZHAO Y L, DING Y T, et al.Research progress on the correlation between lipid and protein oxidation and meat product flavor characteristics[J].Journal of Nuclear Agricultural Sciences,2018,32(7):1 417-1 424.
[5] 杨欣怡,刘源,许长华,等.水产品中挥发性风味物质提取和分析研究进展[J].食品科学,2015,36(5):289-295.
YANG X Y, LIU Y, XU C H, et al.Extraction and analysis of volatile flavor compounds in aquatic products:A review[J].Food Science, 2015,36(5):289-295.
[6] 陈丽丽,江勇,白春清,等.不同种类鱼露中挥发性风味化合物的比较研究[J].中国调味品,2020,45(9):11-17;28.
CHEN L L, JIANG Y, BAI C Q, et al.Comparative study on volatile flavor compounds in different kinds of fish sauce[J].Chinese Condiments,2020,45(9):11-17;28.
[7] 常海军,彭荣,唐春红.重庆城口腊肉挥发性风味化合物分析[J].食品科学,2016,37(4):120-126.
CHANG H J, PENG R, TANG C H.Volatile flavor compounds of Chongqing Chengkou bacon[J].Food Science,2016,37(4):120-126.
[8] 蒋娅婷,曹锦轩,张玉林,等.蛋白质与挥发性风味成分相互作用研究进展[J].核农学报, 2014,28(2):285-291.
JIANG Y T, CAO J X, ZHANG Y L, et al.Research progress on the interaction between protein and volatile flavor components[J].Journal of Nuclear Agricultural Sciences,2014,28(2):285-291.
[9] CAO J X, LYU T, WANG Y, et al.The role of fat-related enzymes in the process of flavor formation in dry-cured meat products[J].Modern Food Science & Technology, 2015, 31(1):254-258;225.
[10] 楼宵玮,蒋娅婷,潘道东,等.氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J].食品科学,2017,38(5):74-79.
LOU X W, JIANG Y T, PAN D D, et al.Effect of NaCl on the interaction of flavor compounds with myofibrillar proteins[J].Food Science,2017,38(5):74-79.
[11] PÉREZ-JUAN M, FLORES M, TOLDR F.Binding of aroma compounds by isolated myofibrillar proteins:Effect of protein concentration and conformation[J].Food Chemistry, 2007, 105(3):932-939.
F.Binding of aroma compounds by isolated myofibrillar proteins:Effect of protein concentration and conformation[J].Food Chemistry, 2007, 105(3):932-939.
[12] TOLDR F, FLORES M.The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J].Critical Reviews in Food Scienceand Nutrition, 1998,38:331-352.
F, FLORES M.The role of muscle proteases and lipases in flavor development during the processing of dry-cured ham[J].Critical Reviews in Food Scienceand Nutrition, 1998,38:331-352.
[13] GEIALDINE S, CELINE L, JEAN-LOUIS D, et al.Distribution of aroma in a starch-polysaccharide composite gel[J].Food Research International.2007, 40(6):709-716.
[14] FLORES M, GILANELLII M, PÉREZ-JUAN F, et all.Headspace concentration of selected drycured aroma compounds in model systems as affected by curing agents[J].Food Chemistry, 2007, 102(2):488-493.
[15] NAWAR W W.Variables affecting composition of headspace aroma[J].Journal of Agricultural and Food Chemistry, 1971, 19 (6):1 057-1 059.
[16] 温荣欣,扈莹莹,殷小钰,等.食盐添加量对哈尔滨风干肠脂质和蛋白氧化及挥发性化合物形成的影响[J].食品科学,2020,41(2):29-36.
WEN R X, HU Y Y, YIN X Y, et al.Effect of salt addition on lipid and protein oxidation and volatile compound formation in Harbin dry sausages[J].Food Science,2020,41(2):29-36.
[17] 谭斌,丁霄霖.食品组份对风味释放与风味感觉的影响[J].广州食品工业科技,2004,20(4):135-140.
TAN B, DING X L.Influence of food ingredients on flavor release and flavor perception[J].Guangzhou Food Science and Technology,2004,20(4):135-140.
[18] 汪娟. 大豆分离蛋白与特定风味化合物相互作用机制的研究[D].广州:华南理工大学,2018.
WANG J.Interaction of selected volatile flavor compounds and soy protein isolate[D].Guangzhou:South China University of Technology,2018.
[19] CHIN K B, GO M Y, XIONG Y L.Konjac flour improved textural and water retention properties of transglutaminase-mediated, heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J].Meat Science, 2009, 81(3):565-572.
[20] JIANG X, ZHANG Z, CAI H, et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry, 2006, 94(4):498-503.
[21] CHELH I,GATELLIER P, SANT-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[22] HAMADA M, ISHIZAKI S, NAGAI T.Variation of SH content and kamaboko-gel forming ability of shark muscle protein by electrolysis[J].Journal of the Shimonoseki University of Fisheries, 1994, 42:131-135.
[23] 曹锦轩,张玉林,韩敏义,等.腊肉加工过程中肌原纤维蛋白结构的变化[J].中国农业科学,2013,46(18):3 871-3 877.
CAO J X, ZHANG Y L, HAN M Y, et al.Changes of the construction of myofibrillar proteins in chinese traditional bacon during processing[J].Scientia Agricultura Sinica,2013,46(18):3 871-3 877.
[24] FLORES M, OLIVARES A.Release of aroma compounds from dryfermented sausages as affected by antioxidant and saliva addition[J].European Food Research and Technology, 2008, 228(2):283-290.
[25] 吕彤,林俊杰,周昌瑜,等.热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J].农业工程学报,2016,32(8):285-291.
LYU T, LIN J J, ZHOU C Y, et al.Effect of heat treatment intensity on structure and binding capacity of volatile compounds of myosin[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(8):285-291.
[26] 刘士健.壳聚糖与盐溶蛋白对风味化合物吸附能力及其凝胶特性研究[D].重庆:西南大学,2008.
LIU S J.Effects of chitosan and salt-soluble meat protein on binding ability of volatile compounds and gel property[D].Chongqing:Southwest University,2008.
[27] PAREDI M E, CRUPKIN M.Biochemical and physicochemical properties of actomyosin from pre-and post-spawned flounder(Paralichtys patagonicus) stored on ice[J].LWT-Food Scienceand Technology, 2007, 40(10):1 716-1 722.
[28] 王发祥,张付兰,刘永乐,等.草鱼冷藏过程中肌原纤维蛋白的变化[J].食品工业科技,2015,36(18):82-86.
WANG F X, ZHANG F L, LIU Y L, et al.Changes in myofibrillar proteins of grass carp during chilling storage[J].Science and Technology of Food Industry,2015,36(18):82-86.
[29] 赵亚南,张牧焓,王道营,等.氯化钠对鸡肉冷藏过程中肌原纤维蛋白氧化的影响[J].肉类研究,2020,34(8):1-7.
ZHAO Y N, ZHANG M H, WANG D Y, et al.Effects of sodium chloride on myofibrillar protein oxidation during cold storage of chicken meat[J].Meat Research,2020,34(8):1-7.
[30] 孔保华,李明清,夏秀芳.不同盐对鲤鱼肌原纤维蛋白结构和凝胶特性的影响[J].食品与发酵工业,2011,37(3):50-55.
KONG B H, LI M Q, XIA X F.Effects of different salts on the structure and gel properties of carp myofibril protein[J].Food and Fermentation Industries,2011,37(3):50-55.
[31] 曾淑薇,李吉,熊善柏,等.磷酸盐对草鱼肌原纤维蛋白结构的影响[J].食品科学,2014,35(23):48-51.
ZENG S W,LI J,XIONG S B, et al.Effects of phosphates on the structure of myofibrillar proteins from grass carp muscle[J].Food Science,2014,35(23):48-51.
[32] 李德阳,侯雅文,黄颖,等.NaCl对大菱鲆肌原纤维蛋白特性的影响[J].食品科学,2018,39(16):61-67.
LI D Y, HOU Y W, HUANG Y, et al.Effect of NaCl on properties of myofibrillar protein from turbot (Scophthalmus maximus)[J].Food Science,2018,39(16):61-67.
[33] 邱春江.超高压对鲢鱼中关键酶与结构蛋白质构影响的研究[D].无锡:江南大学,2014.
QIU C J.Effect of ultra-high pressure technology on key enzymes and structural proteins in silver carp processing[D].Wuxi:Jiangnan University, 2014.
[34] HERRERO A M.Raman spectroscopy for monitoring protein structure in muscle food systems[J].Critical reviews in food science and nutrition, 2008, 48 (6):512-523.
[35] S NCHEZ-GONZ
NCHEZ-GONZ LEZ I, CARMONA P, MORENO P, et al.Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and raman spectroscopy[J].Food Chemistry, 2008, 106 (1):56-64.
LEZ I, CARMONA P, MORENO P, et al.Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and raman spectroscopy[J].Food Chemistry, 2008, 106 (1):56-64.
[36] TAN Y, SIEBERT K.Modeling bovine serum albumin binding of flavor compounds(alcohols,aldehydes, esters, and ketones) as a function of molecular properties[J].Journal of Food Science, 2008, 73(1):S56-S63.
[37] 柳敏. 白鲢鱼肉挥发性风味物质分析及其与蛋白质结合研究[D].杭州:浙江工业大学,2015.
LIU M.Study on the volatile compounds and their combination to proteins of silver carp[D].Hangzhou:Zhejiang University of Technology,2015.
[38] BOURTOOM T, CHINNAN M S,SANGUANDEEKUL J P,et al.Recovery and characterization of proteins precipitated from surimi wash-water[J].Food Science and Technology, 2009, 42(2):599-605.
[39] POLL L, FLINK J M.Aroma analysis of apple juice-influence of salt addition on headspace volatile composition as measured by gaschrorriatography arid corresponding sensory evaluations[J].Food Chemistry, 1984, 13:193-207.
[40] KÜHN J,CONSIDINE T,SINGH H.Interactions of milk proteins andvolatile flavor compounds:Implications in the development of protein foods[J].Journal of Food Science,2006,71(5):R72-R82.
[41] SUPPAVORASATIT I,CADWALLADER K R.Effect of enzymatic deamidation of soy pprotein by protein-glutaminase on the flavor-binding properties of the protein under aqueous conditions[J].Journal of Agricultural and Food Chemistry,2012,60(32):7 817-7 823.
[42] ZHOU F, ZHAO M, SU G, et al.Binding of aroma compounds with myofibrillar proteins modified by a hydroxyl-radical-induced oxidative system[J].Journal of Agricultural and Food Chemistry, 2014, 62(39):9 544-9 552.
[43] LIU X M, POWERS J R, SWANSON B G, et al.High hydrostatic pressure affects flavor- binding properties of whey protein concentrate[J].Journal of Food Science, 2005,70(9):C581-C585.
[44] 韩裕睿. 氧化环境中代钠盐处理对肌原纤维蛋白凝胶特性和风味吸附作用的影响[D].广州:华南理工大学,2018.
HAN Y R.Gelation and flavors binding capability of porcine myofibrillar protein prepared with calcium, magnesium and potassium chloride as partial substitutes for sodium chloride under oxidation conditions[D].Guangzhou:South China University of Technology,2018.
[45] 李阳.白鲢鱼肉挥发性物质与鱼肉肌球蛋白结合能力的初步研究[D].武汉:湖北工业大学,2015.
LI Y.Preliminary research of binding ability between fishy volatile compounds and myosin from silver carp fresh[D].Wuhan:Hubei University of Technology,2015.