中国传统食醋主要是指以谷物为主要原料,经过酵母菌和醋酸菌的代谢分解发酵而成的酸性调味品,在中国已经有3 000多年的历史[1-2]。从醋酸发酵工艺看,食醋分为固态发酵醋和液态发酵醋[3]。固态醋酸发酵是中国传统的食醋酿造工艺,由于原料、工艺等方面的差异,酿制出来的醋各具特色,以四川保宁醋、山西老陈醋、镇江香醋为代表,而液态发酵醋在西方较为盛行,以意大利香醋为代表[4-6]。食醋醋酸发酵阶段,由多种微生物共同作用,其中醋酸菌是一类重要的微生物,能将乙醇氧化成乙酸,形成醋的主体风味从而影响醋的品质[7-9]。目前,工业上常用的醋酸菌是醋酸杆菌(Acetobacter)[10],但是各地区食醋酿造过程中的主体醋酸菌及耐受性各不相同,因此,筛选产酸量高且耐受性强的醋酸菌尤为重要。
赤水晒醋是贵州省赤水市的特色产品,独特的酿造方式使其具有不可复制性[11]。赤水晒醋的酿造工艺精湛复杂,具有典型的地方特色,采用民间传统技艺,利用中草药、大米、糯米、麸皮等发酵成醋醅,醋醅经过长期曝晒过后淋出醋汁[12]。传统晒醋的酿造过程涉及36道工艺,周期长达4年,但是出醋率少、酸度不高,造成了原料的浪费。秦兴[13]对赤水晒醋醋醅的理化指标研究发现,晒醋醋醅总酸含量多在28 g/L左右,低的醋醅酸度是导致出醋率不高的主要原因。在晒醋生产过程的醋醅中筛选发酵性能优良的醋酸菌,并以此强化生产过程,可提高出醋率并稳定产品质量。华青松等[14]从镇江香醋醋醅种筛选出1株在37 ℃高温下产酸量达50.9 g/L的巴氏醋酸杆菌。谢锦明等[15]从陕西民间醋醅中筛选出1株产酸量达42.0 g/L的热带醋酸杆菌,且能耐体积分数为9%的乙醇和3%的乙酸。
为了不破坏赤水晒醋产酸环境的微生物平衡体系和便于在工业中强化,本研究以赤水晒醋醋醅为样品,通过传统的分离纯化方法和16S rRNA分子生物学鉴定的方法,筛选出优势醋酸菌,再通过发酵性能比较试验,旨在获得1株高耐受性的醋酸菌,为晒醋生产中醋酸菌的应用提供参考。
1 材料与方法
1.1 材料与仪器
醋醅样品,取自贵州赤水黔某晒醋企业。
酵母膏,北京奥博生物技术有限责任公司;碳酸钙、氢氧化钠,重庆茂业化学试剂有限公司;Agar Powder(琼脂),Beijing Solarbio Science & Technology;无水乙醇,天津市富宇精细化工有限公司;乙酸,天津市天大化工实验厂;葡萄糖、磷酸二氢钾、氯化钠、酚酞,成都金山化学试剂有限公司。
FA2004 N电子分析天平,上海菁海仪器有限公司;LS-B50L立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;SW-CJ-1F洁净工作台,上海雷韵试验仪器制造有限公司;SPX-250B智能型生化培养箱,上海琅轩实验设备有限责任公司;LD-3电动离心机,上海上登实验设备有限公司;DMS-653一体化数码液晶生物显微镜,深圳市博宇仪器有限公司;722s可见分光光度计,上海欣茂仪器有限公司;HH-b数显恒温水浴锅,常州奥华仪器有限公司;CJJ-781磁力搅拌器,城西晓阳电子仪器厂;MaxQ 4000恒温摇床,Thermo Scientific。
1.2 培养基
碳酸钙分离培养基(g/L):葡萄糖1,琼脂2,碳酸钙2,酵母膏1,水0.1,121 ℃灭菌20 min,降温至70 ℃加体积分数为3.5%的无水乙醇。
发酵培养基(g/L):葡萄糖1,酵母膏1,硫酸镁0.05,磷酸二氢钾0.05,水0.1,121 ℃灭菌20 min,降温至70 ℃加体积分数为3.5%的无水乙醇。
斜面保藏培养基(g/L):葡萄糖1,琼脂2,酵母膏1,水0.1,121 ℃灭菌20 min,降温至70 ℃加体积分数为3.5%的无水乙醇。
1.3 实验方法
1.3.1 醋酸菌的分离纯化
样品处理:称取醋醅样品25 g,置于盛有225 mL生理盐水的无菌三角瓶内,振荡30 min,制成10-1稀释液。
分离纯化:用无菌生理盐水将上述醋醅样品液进行稀释,样品稀释至10-4、10-5、10-6不同浓度,将3个稀释液分别涂布在碳酸钙分离培养基上,每个稀释度做2个平行,倒置于30 ℃恒温培养箱内培养72 h后观察,挑选产生透明圈大的单个菌落进行划线分离纯化,对单个菌落进行编号,然后保藏。
1.3.2 醋酸菌的筛选
革兰氏染色实验:将斜面保藏的菌株进行革兰氏染色镜检,挑选出革兰氏阴性菌。
产酸定性实验[16]:挑取1环活化菌接种于100 mL发酵培养基中,30 ℃恒温培养72 h,吸取5 mL培养液以5 000 r/min 离心10 min,除去菌体,用0.1 mol/L NaOH 溶液中和至pH 7.0,加入4~5滴的5% FeCl3溶液,在水浴锅内加热至沸,形成红褐色沉淀为醋酸菌。
1.3.3 醋酸菌生理生化试验
将筛选出来时的菌株进行生理生化实验,具体操作参照《伯杰氏细菌鉴定手册》(第八版)[17]。
1.3.4 醋酸菌分子生物学鉴定
将筛选出的菌株委托生工生物工程(上海)股份有限公司进行测序,测序引物选用细菌16S rRNA的通用引物27 F和1492 R。测序结果在NCBI数据库中进行同源序列检索,检索到与目标菌株具有较大同源性的菌种做分析比较,采用MEGA 4.0软件做邻位相连法构建系统发育树,分析结果。
1.3.5 醋酸菌发酵性能分析
1.3.5.1 产酸量测定
将筛选出来的菌株活化,分别量取10 mL活化菌液接种到100 mL发酵培养基中,置于30 ℃,150 r/min摇床中培养5 d,产酸量测定按照GB/T 12456—2008《食品中总酸的测定》[18]。
1.3.5.2 耐乙醇能力分析
将100 mL发酵培养基分装于250 mL锥形瓶中,按10%接种量接入筛选得到的菌株,乙醇体积分数分别设置为3%、5%、7%、9%、11%、13%,30 ℃、150 r/min 摇床培养5 d,测量菌液OD600值和产酸量,每个梯度3个平行,取平均值。
1.3.5.3 耐氯化钠能力分析
将100 mL发酵培养基分装于250 mL锥形瓶中,按10%接种量接入筛选得到的菌株,氯化钠质量浓度分别设置为2、4、6、8、10和12 g/L,30 ℃、150 r/min摇床培养5 d,测量菌液OD600值和产酸量,每个梯度3个平行,取平均值。
1.3.5.4 耐乙酸能力分析
将100 mL发酵培养基分装于250 mL锥形瓶中,按10%接种量接入筛选得到的菌株,乙酸质量浓度分别设置为10、20、30、40、50和60 g/L,30 ℃、150 r/min 摇床培养5 d,测量菌液OD600值和产酸量,每个梯度3个平行,取平均值。
2 结果与分析
2.1 醋酸菌的分离纯化
将贵州赤水某晒醋企业提供的醋醅进行梯度稀释,利用平板涂布分离法将稀释液涂布在碳酸钙分离培养基中,有11个单菌落周围产生了直径较大的透明圈,见图1。从平板中挑选这11株单菌落进行纯化并斜面保藏,编号分别为C1~C11。
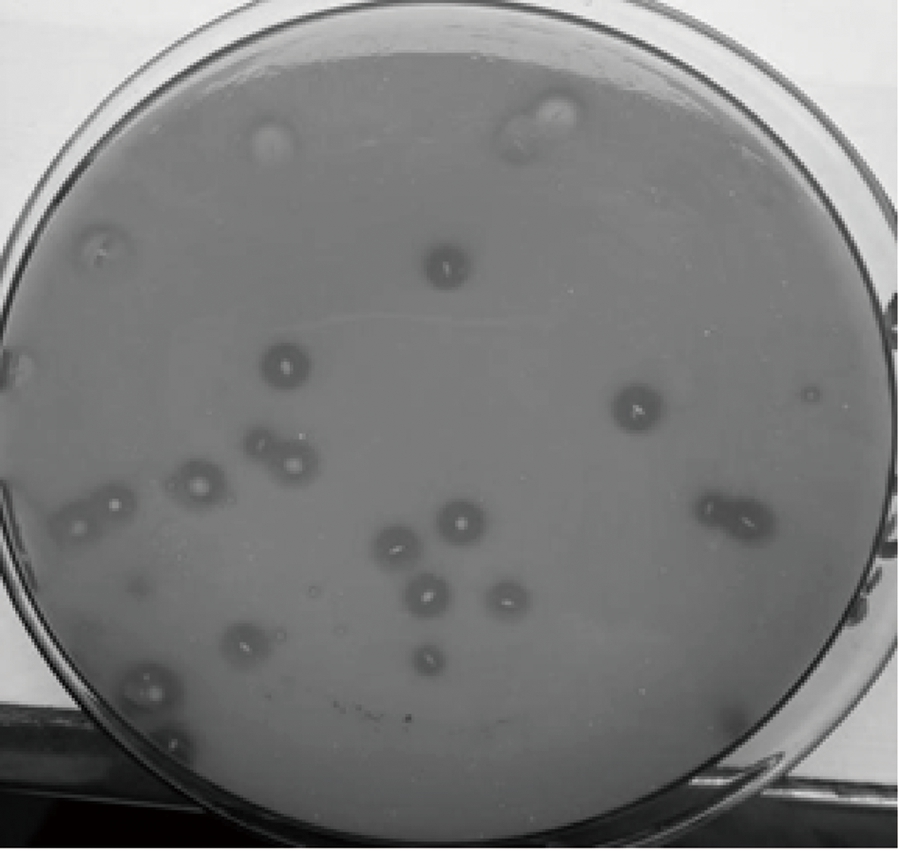
图1 醋酸菌分离平板
Fig.1 Acetic acid bacteria separation plate
2.2 醋酸菌的筛选
将保藏的单菌落进行革兰氏染色实验和产酸定性试验,结果见表1和表2。由表1、表2可知,菌株是革兰氏阴性菌且能产生红褐色沉淀的有C1、C2、C5、C6、C8和C9,这6株菌株均为产醋酸细菌。
表1 革兰氏染色和产酸定性试验结果
Table 1 Gram stain and acid production qualitative test results

菌株革兰氏染色试验产酸定性试验C1+红褐色沉淀C2+红褐色沉淀C3-浑浊无沉淀C4-红褐色沉淀C5+红褐色沉淀C6+红褐色沉淀C7-红褐色沉淀C8+红褐色沉淀C9+红褐色沉淀 C10-浑浊无沉淀 C11-红褐色沉淀
注:“+”为阳性,“-”为阴性(下同)
2.3 生理生化试验
对筛选出来的6株菌株进行生理生化试验,见表2。根据表2和《伯杰氏细菌鉴定手册》(第八版)[17]的描述对比分析,C1、C5和C6可初步鉴定为醋杆菌属。
表2 生理生化试验
Table 2 Physiological and biochemical test
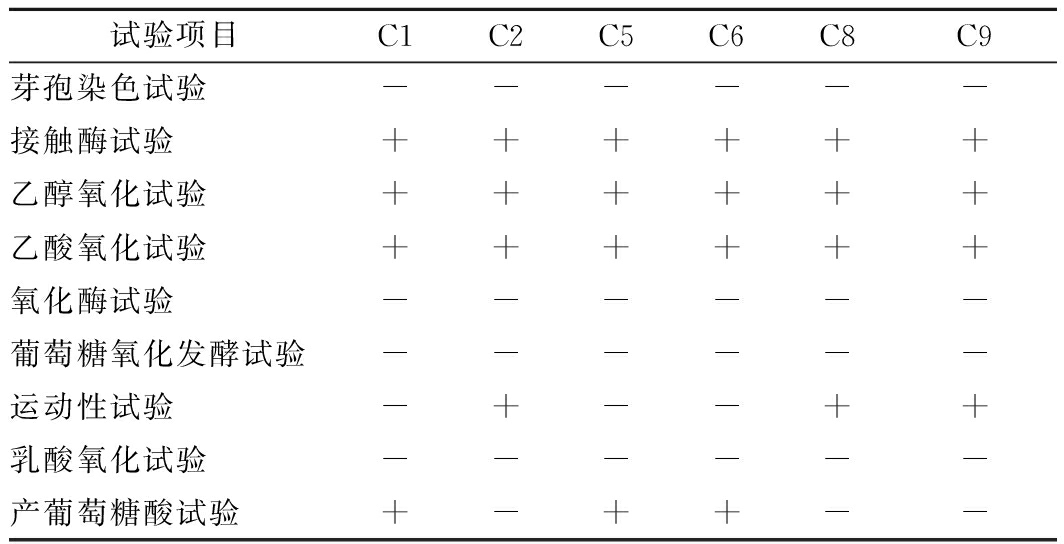
试验项目C1C2C5C6C8C9芽孢染色试验------接触酶试验++++++乙醇氧化试验++++++乙酸氧化试验++++++氧化酶试验------葡萄糖氧化发酵试验------运动性试验-+--++乳酸氧化试验------产葡萄糖酸试验+-++--
2.4 醋酸菌的分离纯化
为了进一步确定醋杆菌属C1、C5和C6,将3个菌株委托上海生工进行16S rRNA测序,测序结果在NCBI数据库中寻找同源性菌株并构建发育树,如图2所示,菌种C1、C5及C6和巴氏醋酸杆菌(A.pasteurianus)的序列同源性相比较,亲缘性最近,其序列相似性都达到99%以上,因此可以判断筛选的3株菌属于A.pasteurianus。
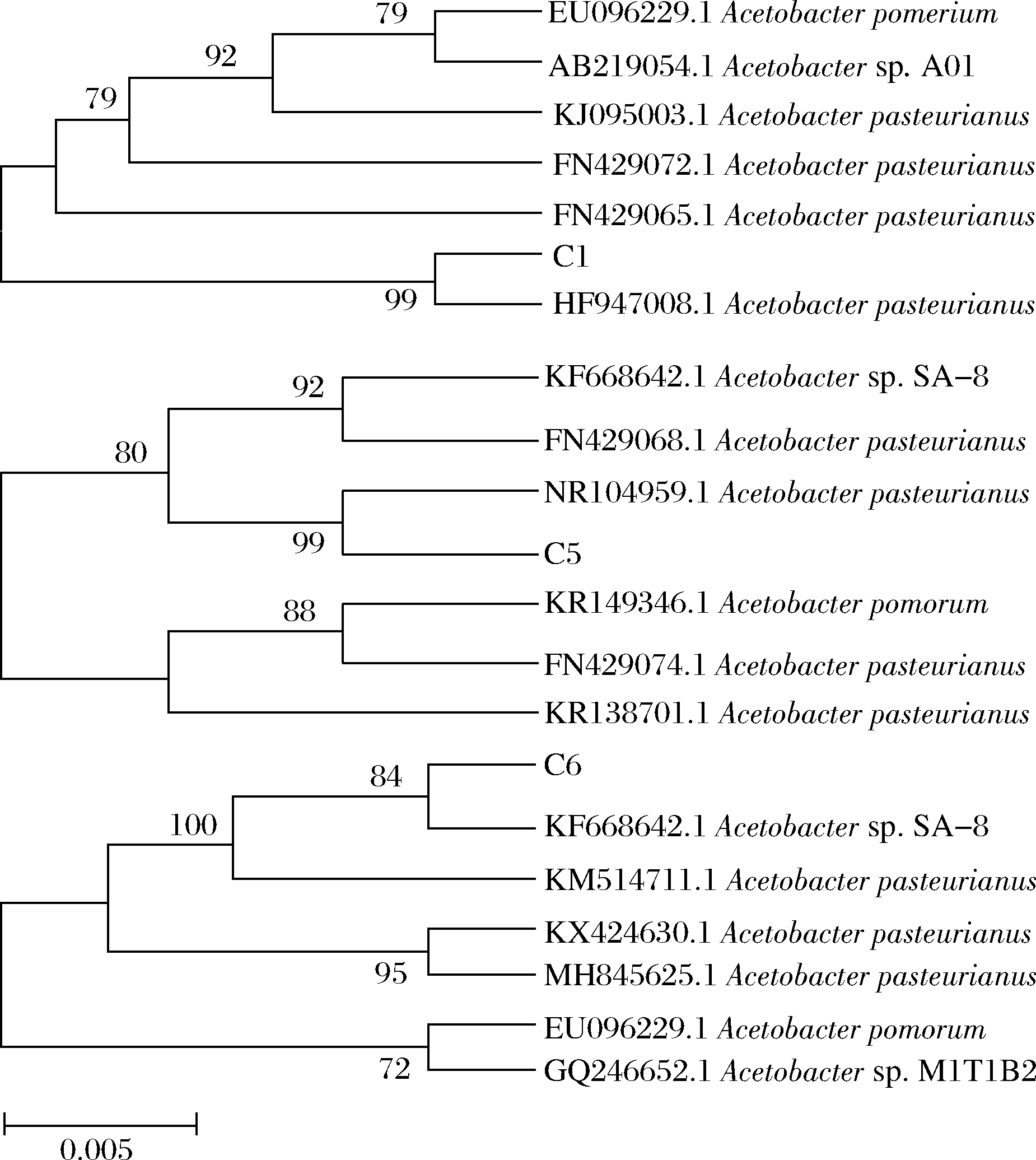
图2 醋酸菌的系统发育树
Fig.2 Phylogenetic tree of acetic acid bacteria
2.5 醋酸菌的发酵特性研究
2.5.1 产酸能力测定
从之前的研究中[13],赤水晒醋酒精发酵阶段酒醪的酒精度在1.7%左右,酒精度比较低,为了使筛选出来的醋酸菌更能够接近工业生产,所以本实验将筛选出来的醋酸菌菌株分别接种至含有3.5%(体积分数)乙醇的发酵培养基中,培养至5 d的产酸量如图3所示。C1、C5、C6菌株的产酸量分别为39.225、28.245、41.895 g/L,其中C6菌株的产酸量较高。
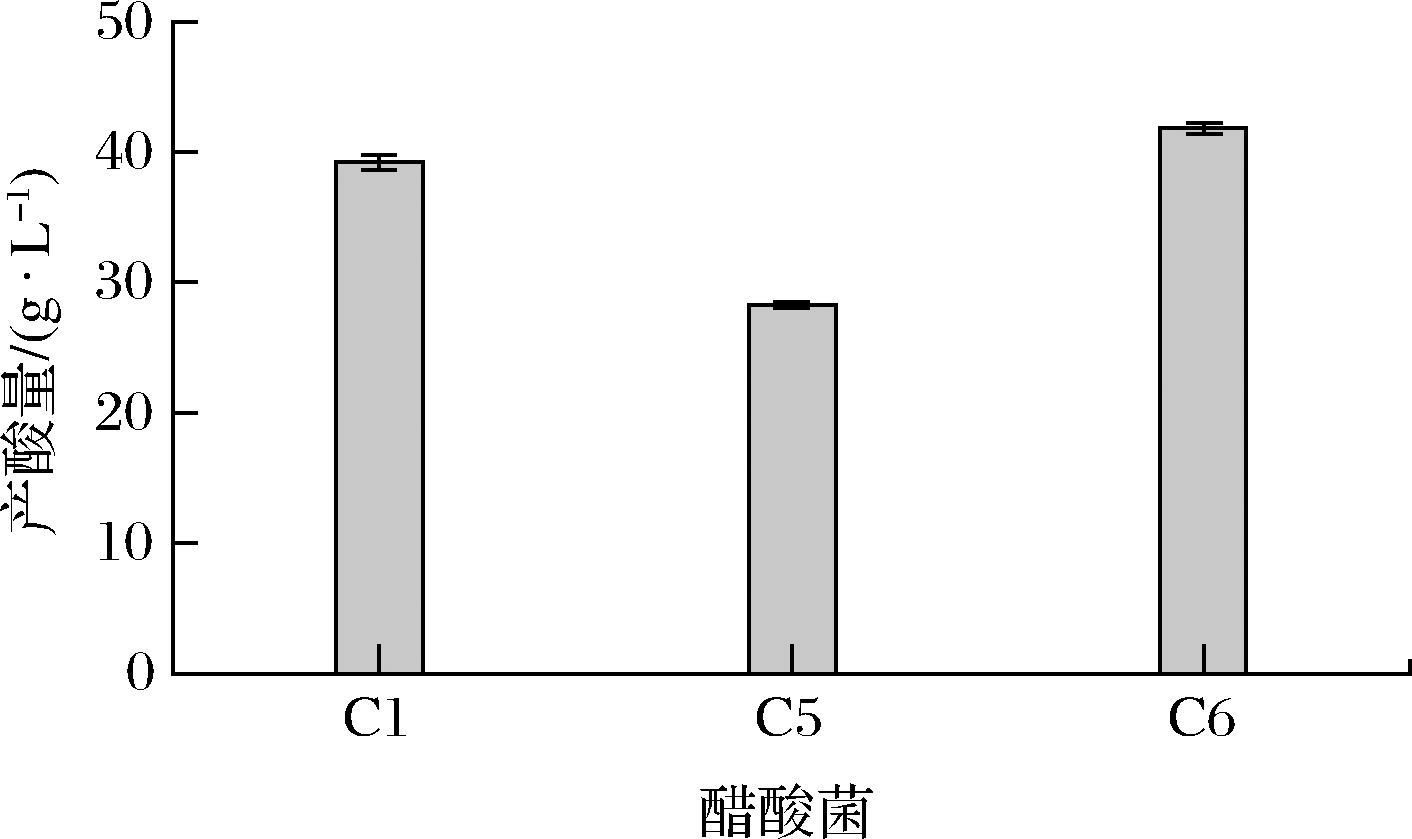
图3 菌株发酵5 d的产酸量
Fig.3 Strain fermentation for 5 d acid production
2.5.2 耐乙醇能力测定
乙醇是醋酸菌发酵能量的来源,也是形成醋酸的原料,但是过高的乙醇浓度会抑制醋酸菌的生长[19]。不同体积分数的乙醇对菌株生物量和产酸量的影响结果如图4所示,随着乙醇体积分数的上升,3株醋酸菌的生物量和产酸量都呈先上升后下降的趋势,表明乙醇能抑制醋酸菌的生长,而一定体积分数的乙醇能够促进醋酸菌的生长。乙醇体积分数在7%以下,随着乙醇体积分数的增加,产酸量逐渐增加,且C6的产酸量高于C1和C5,可达50.79 g/L。在乙醇体积分数增加至7%以上,各醋酸菌的生物量和产酸量受到抑制,生物量和产酸量均下降,当乙醇体积分数为9%时,C1和C6的产酸量较高,当乙醇体积分数为11%时,C1、C5和C6几乎不产酸。谢锦明等[15]从陕西民间醋醅筛选出的高产酸醋酸菌JM2产酸量达49.8 g/L,耐9%(体积分数)的乙醇,与本实验结果相一致,且本实验筛选出来的菌株C6的产酸量高于JM2。综合比较可知,C1和C6的耐乙醇能力优于C5,但晒醋工艺在前期液体发酵乙醇浓度不高,所以在耐乙醇试验中为了筛选出来的菌更能适应工业生产,C6菌株最佳。

a-菌体生物量;b-产酸量
图4 乙醇体积分数对菌体生物量和产酸量的影响
Fig.4 The influence of ethanol volume fraction on bacterial biomass and acid production
2.5.3 耐氯化钠能力测定
在赤水晒醋的生产过程中,醋醅主发酵结束前将加入食盐以防止酸度的降低,明确氯化钠浓度对醋酸菌的影响,对晒醋主发酵后期的加盐及醋醅曝晒操作都有参考作用。在研究菌株的耐氯化钠实验中,3株醋酸菌的耐氯化钠能力都比较强,其中C6的耐氯化钠能力最强。由图5可知,添加的氯化钠为0~12 g/L时,随着氯化钠质量浓度的增加,各醋酸菌的产酸能力受到抑制,且在氯化钠质量浓度为10 g/L时,各菌株几乎停止产酸,菌体也停止生长。在整个耐氯化钠实验中,各菌株的产酸量一直在下降,但C6的产酸量一直高于C1和C5。综合分析可知,C6对氯化钠有较强的耐受性,能耐受质量浓度为8 g/L的氯化钠。
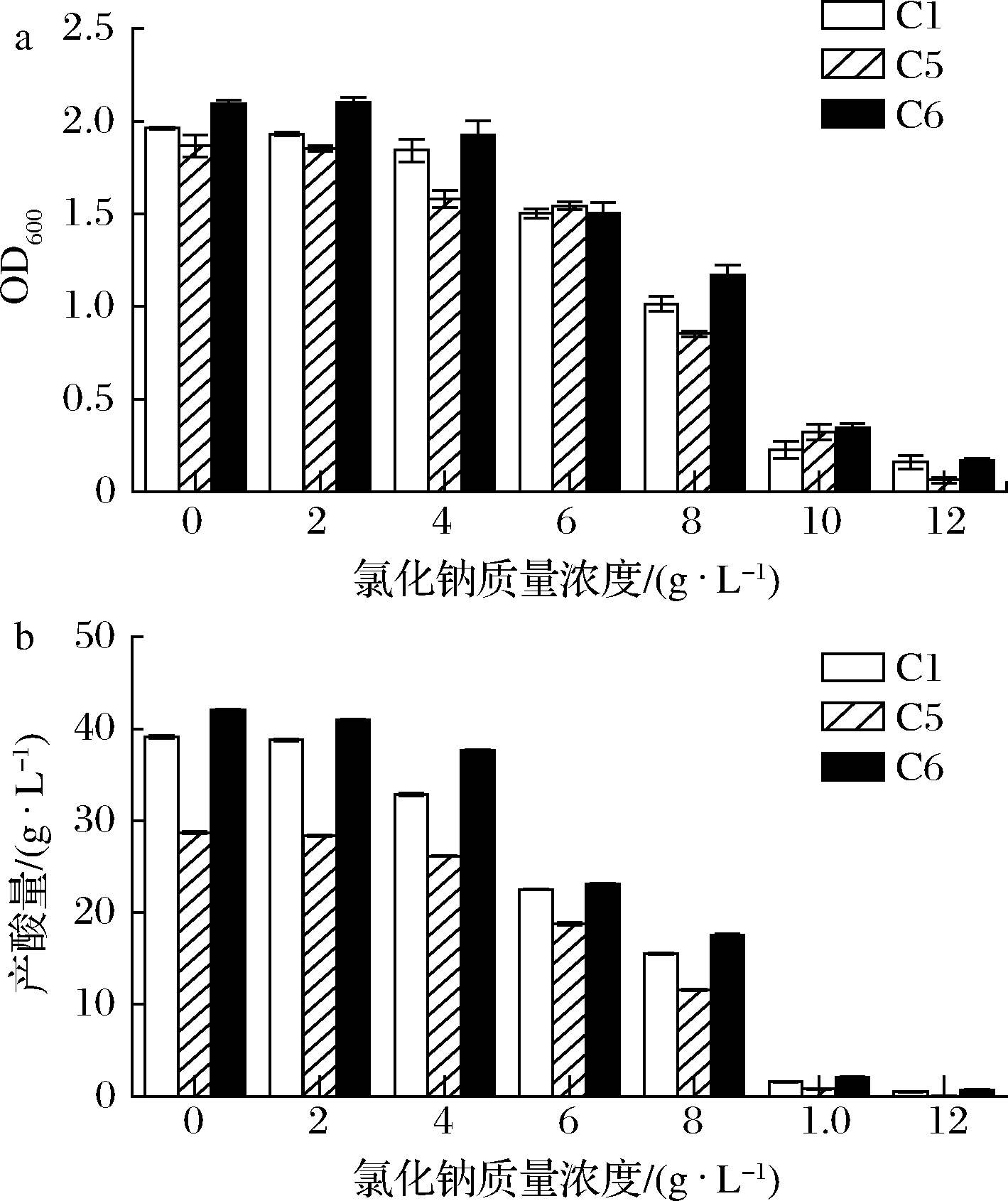
a-菌体生物量;b-产酸量
图5 氯化钠质量浓度对菌体生物量和产酸量的影响
Fig.5 The influence of sodium chloride mass concentration on bacterial biomass and acid production
2.5.4 耐乙酸能力测定
在食醋的生产过程中,乙酸是影响醋酸菌产酸的因素之一[20]。菌株的耐酸实验结果如图6所示,3株醋酸菌的产酸量均受乙酸的抑制,随着乙酸浓度的上升,产酸量呈下降趋势,而一定浓度的乙酸能够促进醋酸菌的产酸量。在乙酸质量浓度为10 g/L时,对3株菌株的产酸量有促进作用,使3株菌株的产酸量达到最大值,且C6的产酸量最高,可达43.41 g/L。乙酸质量浓度在10 g/L以上,对菌株的生物量和产酸量均产生负面影响,在乙酸质量浓度为50 g/L时,各菌株受到明显的抑制,而C6在整个耐乙酸实验中表现出较好的耐受性,产酸量高于C1和C5。张志燕等[21]从镇江香醋醋醅中筛选出来的醋酸菌D-3-4号产酸量达41.2 g/L,能耐40 g/L的乙酸,本实验研究的C6菌株的产酸量和耐乙酸能力均高于D-3-4号。综合分析得出,C6的耐乙酸性能最高,能耐40 g/L的乙酸。
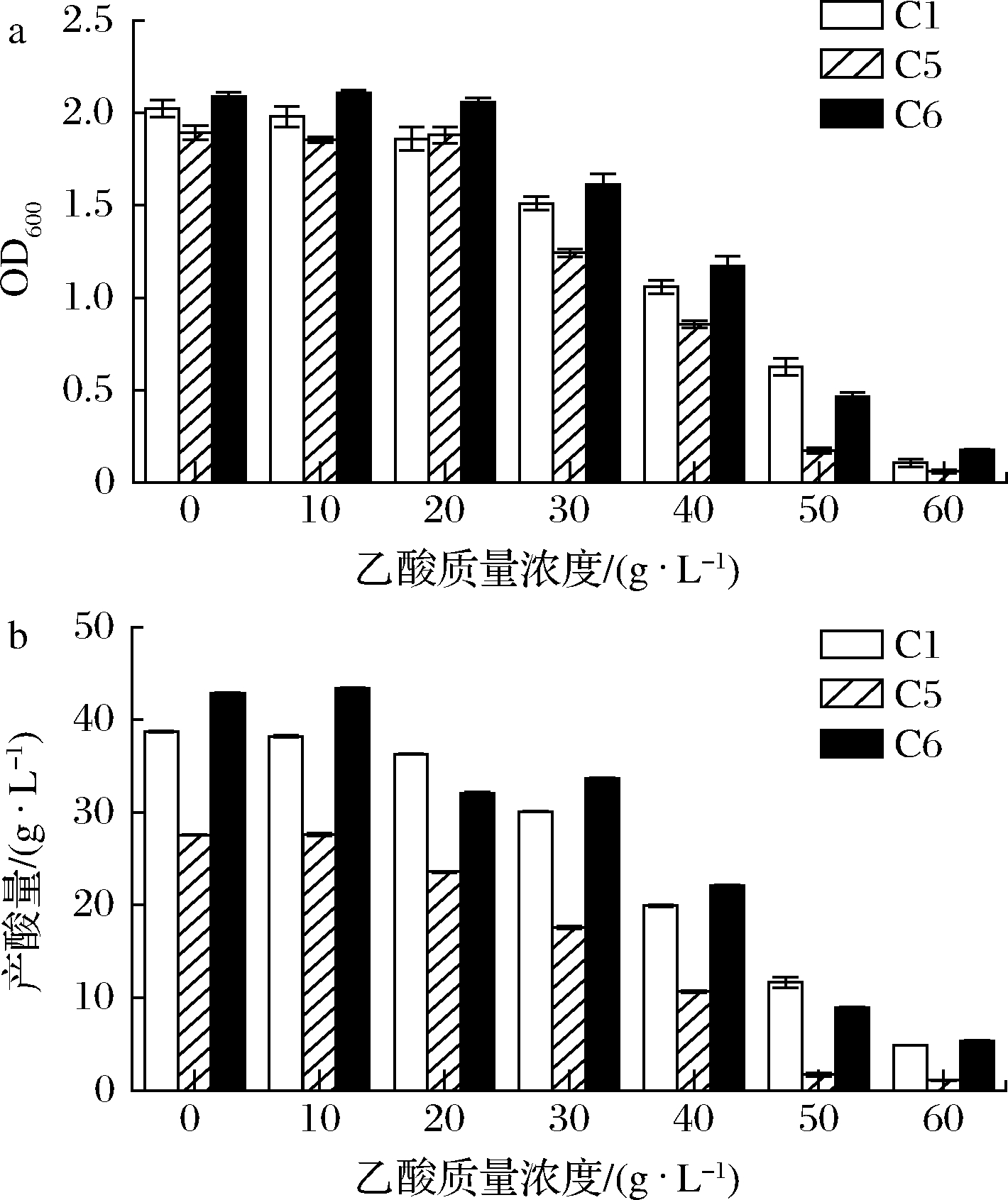
a-菌体生物量;b-产酸量
图6 乙酸质量浓度对菌体生物量和产酸量的影响
Fig.6 The effect of acetic acid concentration on the biomass and acid production
3 结论
本研究通过传统分离纯化、生理、生化和16S rRNA分子生物学鉴定的方法,从赤水晒醋中筛选出3株醋酸菌C1、C5和C6,经鉴定,3株菌株均为A.pasteurianus。在菌株发酵性能和耐受性实验研究中,C6的发酵性能和耐受性最优,能耐9%(体积分数)的乙醇、8 g/L的氯化钠和40 g/L的乙酸。
在本实验中,由于晒醋的周期过长,筛选出来的醋酸菌没有应用到工业生产中,后期的试验可以以此为基础,将筛选出来的醋酸菌应用到工业生产中,研究晒醋在醋酸发酵阶段中总酸以及微生物群落变化。
[1] 郑宇, 程程, 刘静, 等.中国传统固态发酵食醋主要特征风味物质组成分析[J].中国食品学报, 2020, 20(8):237-247.
ZHENG Y, CHENG C, LIU J, et al.Analysis of main characteristic flavor components in Chinese traditional solid-state fermented vinegars[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(8):237-247.
[2] WANG Z M, LU Z M, SHI J S, et al.Exploring flavour producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J].Scientific Reports, 2016,6:26 818.
[3] 陈程鹏, 邱晓曼, 洪厚胜.食醋液态发酵工艺的研究现状[J].中国调味品, 2020, 45(1):189-192.
CHEN C P, QIU X M, HONG H S.Research status of liquid fermentation technology of vinegar[J].China Condiment, 2020, 45(1):189-192.
[4] 李婷, 王争争, 李慧,等.四大名醋呈味物质比较分析[J].中国调味品, 2020, 45(10):144-147.
LI T, WANG Z Z, LI H, et al.Comparative analysis of flavor substances in the four famous Chinese vinegar[J].China Condiment, 2020, 45(10):144-147.
[5] GUERREIRO T M,DE OLIVEIRA D N,FERREIRA M S, et al.High-throughput analysis by SP-LDI-MS for fast identification of adulterations in commercial balsamic vinegars[J].Analytica Chimica Acta, 2014, 838:86-92.
[6] 舒杰.镇江香醋固态发酵自动化监测与翻醅控制系统研制[D].镇江:江苏大学, 2018.
SHU J.Development of an automated monitoring system for solid-state fermentation of Zhenjiang aromatic vinegar[D].Zhenjiang:Jiangsu University, 2018.
[7] 张强, 赵翠梅, 李晓伟, 等.温度和翻醅对食醋固态发酵产酸的影响[J].中国酿造, 2020, 39(4):159-164.
ZHANG Q, ZHAO C M, LI X W, et al.Effect of temperature and Cupei-turning on acids production of vinegar by solid-state fermentation[J].China Brewing, 2020, 39(4):159-164.
[8] NIE Z Q, ZHENG Y, XIE S K, et al.Unraveling the correlation between microbiota succession and metabolite changes in traditional Shanxi aged vinegar[J].Scientific Reports, 2017, 7:9 240.
[9] 杨立霞, 李锦.醋酸菌在生物转化中的应用[J].河北化工,2012, 35(4):35-38.
YANG L X, LI J.Biotransformation applications of acetic acid bacteria[J].Hebei Chemical Industry, 2012, 35(4):35-38.
[10] 张月阳, 李海峰, 曹健, 等.高耐受性醋酸菌的研究和应用进展[J].中国酿造, 2017, 36(11):11-14.
ZHANG Y Y, LI H F, CAO J, et al.Research and application process of acetic acid bacteria with high tolerance[J].China Brewing, 2017, 36(11):11-14.
[11] 杨新, 陈莉, 卢红梅, 等.赤水晒醋中增黏微生物的分离鉴定及特性研究[J].中国酿造, 2018, 37(5):54-59.
YANG X, CHEN L, LU H M, et al.Isolation, identification and characteristics of microorganism with viscosity increment from Chishui sun vinegar[J].China Brewing, 2018, 37(5):54-59.
[12] 李荣源, 卢红梅, 秦兴, 等.高通量测序分析赤水晒醋各生产阶段微生物群落结构变化[J].食品科学,2020,41(24):78-86.
LI R Y, LU H M, QIN X, et al.High-throughput sequencing study on changes in microbial community structure in different production stages of Chishui Sun-dried vinegar[J].Food Science, 2020, 41(24):78-86.
[13] 秦兴. 赤水晒醋产品品质及工艺体系研究[D].贵阳:贵州大学, 2018.
QIN X.Research on the quality and process system of Chishui sun-tanning vinegar[D].Guiyang:Guizhou University, 2018.
[14] 华青松, 宗朕, 余越, 等.镇江香醋耐高温优势醋酸菌的筛选及其发酵特性的比较研究[J].中国调味品, 2019, 44(12):39-43.
HUA Q S, ZONG Z, YU Y, et al.Screening of dominant acetic acid bacteria with high-temperature tolerance in Zhenjiang aromatic vinegar and comparison of their fermentation characteristics[J].China Condiment, 2019, 44(12):39-43.
[15] 谢锦明, 赵秀芳, 袁江兰, 等.陕西民间醋醅中高产酸醋酸菌的筛选和发酵特性[J].食品与发酵工业,2020, 46(10):173-178.
XIE J M, ZHAO X F, YUAN J L, et al.Screening of high yield acetic acid bacteria in Shaanxi Folk Vinegar Pei and its fermentation characteristics[J].Food and Fermentation Industries, 2020, 46(10):173-178.
[16] 彭倩. 醋醅中细菌多样性及木醋杆菌纤维素特性研究[D].天津:天津大学, 2016.
PENG Q.Bacterial diversities in vinegar Pei and properties of Gluconacetobacter xylinus cellulose[D].Tianjin:Tianjin University, 2016.
[17] 布坎南. 伯杰细菌鉴定手册[M].北京:科学出版设, 1984:729-830.
BU K N.Berger Bacterial Identification Manual[M].Beijing:Scientific Publishing, 1984:729-830.
[18] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 12456—2008 食品中总酸的测定[S].北京:中国标准出版社, 2008.
State Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China, China National Standardization Administration Committee.GB/T 12456—2008 Determination of total acid in food[S].Beijing:China Standards Press, 2008.
[19] 李宜丰, 温丽琴.醋酸发酵的生态学初探[J].中国调味品, 1987(11):7-8.
LI Y F, WEN L Q.Preliminary study on the ecology of acetic acid fermentation[J].Chinese Condiment, 1987(11):7-8.
[20] 史伟. 巴氏醋酸杆菌乙酸胁迫下生理和适应性进化初步研究[D].无锡:江南大学, 2019.
SHI W.Preliminary study on the physiological and adaptive evolution of Acetobacter pasterianus under acetic acid stress[D].Wuxi:Jiangnan University, 2019.
[21] 张志燕, 钱静亚, 马真, 等.镇江香醋醋醅中优势高产酸醋酸菌菌株的筛选[J].食品工业科技, 2016, 37(11):174-178;194.
ZHANG Z Y, QIAN J Y, MA Z, et al.Screening of acetic acid bacteria with high yield of acid from vinegar Pei of Zhenjiang aromatic vinegar[J]. Science and Technology of Food Industry, 2016, 37(11):174-178:194.