维生素K2是枯草芽胞杆菌及纳豆芽胞杆菌能量代谢电子传递系统的重要组成元素,在电子传递、氧化磷酸化、主动运输、内生孢子形成以及体内ATP的生成和维持生命活动等方面,都起着举足轻重的作用[1-3]。枯草芽胞杆菌及纳豆芽胞杆菌合成食品级维生素K2,近几年主要有CUI等[4-5]、MAHDINIA等[6]和BERENJIAN等[7]在研究,研究的内容大多集中于发酵过程的代谢调控。其中BERENJIAN等[8]通过多年的研究发现,纳豆芽胞杆菌摇瓶规模下静态发酵产生了大量生物膜,而这些生物膜的形成明显促进了维生素K2的合成。随后,美国宾夕法尼亚州立大学MAHDINIA等[9]为促使纳豆芽胞杆菌维生素K2的大规模合成,专门研制了可以增强生物膜形成的生物反应器,通过优化发酵过程参数发现,形成生物膜后纳豆芽胞杆菌维生素K2的合成量比游离状态时的合成量增加了58%[10]。然而,当在野生型芽胞杆菌培养基中添加维生素K2抑制剂二苯胺时,培养基中没有生物膜形成。外源添加维生素K2后,生物膜结构又重新出现[11]。并且,在其他革兰氏阳性菌中,同样发现维生素K2是形成复杂菌落形态和生物膜的重要元素[12]。因此,枯草芽胞杆菌生物膜的形成,对于促进维生素K2的合成代谢,具有十分重要的意义;并且,维生素K2对于枯草芽胞杆菌生物膜的形成,同样举足轻重。
研究表明sinR参与BS168生物膜的形成,但具体哪些因素影响sinR基因对生物膜的调控机制尚未见完整报道,并且该基因表达量的不同对维生素K2的合成是否有影响尚未可知。因此,本论文以微生物生长外部调节因素为介质,通过研究pH值、温度、金属离子对BS168、BS168-ΔsinR菌株生物膜形成和维生素K2合成能力的影响,为分析SinR蛋白在调控生物膜过程受哪些外界因素干扰,并为进一步研究革兰氏阳性菌生物膜的调控机制奠定理论基础。
1 材料与方法
1.1 材料与仪器
实验菌株:枯草芽胞杆菌BS168、大肠杆菌JM109、P7C6、PDG-CRE质粒均为本实验室保存。
培养基:大豆蛋白胨、KH2PO4、K2HPO4、甘油、胰蛋白胨、琼脂条、NaCl、酵母提取物、葡萄糖,国药集团化学有限公司。
其他相关试剂:PRIME STAR、胶回收纯化试剂盒,Takara;50×TAE缓冲液、氨苄霉素、氯霉素,上海生工生物;细菌基因组试剂盒,天根生物;苯酚、H2SO4、结晶紫、无水乙醇、MnCl2、FeSO4、CaCl2,国药集团化学有限公司。
仪器:PCR仪,美国伯乐;SK-1快速混匀器,上海医用激光仪器厂;双层振荡培养箱、恒温培养箱,知楚仪器;酶标仪,赛默飞世尔仪器有限公司;水浴锅、pH计,梅特勒;核酸定量仪、HPLC,岛津。
1.2 实验方法
1.2.1 培养基的配制
Sipizizen感受态培养基:SPI溶液、SPII溶液、50 mmol/L CaCl2、250 mmol/L MgCl2。
平板活化培养基(g/L):胰蛋白胨10、NaCl 10、酵母提取物5、琼脂条20,调pH 7.0,121 ℃灭菌20 min。
种子培养基(g/L):胰蛋白胨10、NaCl 10、酵母提取物5,调节pH 7.0,121 ℃灭菌20 min。
生物膜与发酵SYG培养基(g/L):大豆蛋白胨50、酵母提取物20、甘油50、K2HPO4 3.86、KH2PO4 1.62、微量元素2 mL(过滤除菌后加入灭菌后的培养基中)。将配制好的培养基分装并调节pH为5、6、7、8、9,121 ℃灭菌20 min。
1.2.2 构建BS168-ΔsinR菌株
根据枯草芽胞杆菌基因组图谱用Snapgene设计3对引物,分别是左同源臂上下游引物、中间部分(目的基因)上下游引、右同源臂上下游引物(约1 000 bp)。引物合成委托金唯智生物技术有限公司来完成(见表1)。利用三重融合PCR将3个片段进行连接。将纯化后的PCR产物用于转化感受态细胞,再通过使用cre/lox系统去除宿主细胞的抗性标记,最终得到阳性克隆菌株。将菌株用甘油管保存于-80 ℃冰箱备用。
1.2.3 枯草芽胞杆菌的活化及培养
从-80 ℃冰箱取出菌种在LB固体培养基上进行划线培养,得到单菌落。将单菌落挑入到100 mL LB液体培养基中,放入摇床37 ℃、220 r/min,培养12~16 h,按5%的接种比例将种子培养液加入每孔含2 mL的SYG培养基的24孔板中,放入恒温培养箱进行培养,测定72 h形成的生物膜,每组样品做3组平行。
表1 用于基因敲除和过表达的扩增引物
Table 1 Primers used for gene knockout and overexpression
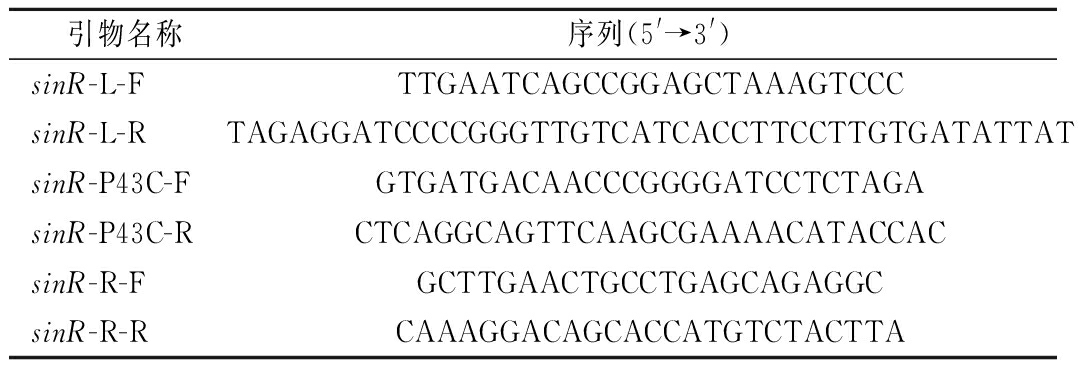
引物名称序列(5'→3')sinR-L-FTTGAATCAGCCGGAGCTAAAGTCCCsinR-L-RTAGAGGATCCCCGGGTTGTCATCACCTTCCTTGTGATATTATsinR-P43C-FGTGATGACAACCCGGGGATCCTCTAGAsinR-P43C-RCTCAGGCAGTTCAAGCGAAAACATACCACsinR-R-FGCTTGAACTGCCTGAGCAGAGGCsinR-R-RCAAAGGACAGCACCATGTCTACTTA
1.2.4 生物膜的形成与测定
参照文献方法[13],以24孔板为载体,每孔中加入5%的菌液,然后加入2 mL的SYG培养基,3个重复孔,并且以空SYG培养基作为对照,37 ℃培养72 h定量测定生物膜。首先缓慢移除每孔中的培养物,然后用无菌的PBS缓冲液清洗2~3次,洗去未黏附的菌体,室温干燥后加入2 mL的0.1%结晶紫染液进行染色20 min,再用PBS进行缓慢冲洗,直至流出无色为止,室温静置干燥,除去多余水分,随后加入2 mL 的95%乙醇进行脱色15 min, 然后混匀。最后用酶标仪测定OD570nm的值衡量生物膜的多少。
1.2.5 培养条件对BS168与BS168-ΔsinR生物膜的影响
培养温度对BS168与BS168-ΔsinR生物膜的影响:菌株按1.2.3培养并置于20、25、30、37、40、45 ℃培养箱中静置培养。按1.2.4,检测不同温度所形成的生物膜的OD570nm值。
不同pH值对BS168与BS168-ΔsinR生物膜的影响:按1.2.4生物膜形成测定方法,用HCl和NaOH调节生物膜培养基的pH值。测定pH分别为5.0、6.0、7.0、8.0、9.0时形成生物膜的OD570nm值。
Mn2+、Fe2+和Ca2+对生物膜形成的影响:生物膜培养基中分别加入不同浓度的Mn2+、Fe2+和Ca2+,使其中Mn2+浓度分别为0、0.01、0.1、1、10和100 mmol/L;Fe2+浓度分别为0、1、10、50和100 μmol/L;Ca2+浓度分别为0、0.01、0.1、1、10 mmol/L。分别置于37 ℃培养箱中静置培养72 h,每个样品做3次平行,按1.2.4,检测不同浓度金属离子所形成生物膜的OD570nm值。
1.2.6 胞外蛋白的检测
菌株按1.2.3培养,分别测定BS168与BS168-ΔsinR在上述实验中不同温度、pH以及不同浓度的金属离子(Mn2+、Fe2+、Ca2+)静置培养72 h生物膜的胞外蛋白的含量。利用核酸定量仪进行蛋白测量。
1.2.7 葡萄糖标准曲线的绘制方法
配置葡萄糖标准溶液(200 mg/L),分别吸取标准液0、100、200、300、400、600、800、1 000 μL,置具塞试管中,每管分别加6%的苯酚溶液500 μL混匀,然后加入3 mL的硫酸溶液,再混匀,置沸水浴20 min,用冰水浴冷却后于490 nm处测定各溶液的吸光度,得到标准方程为Y=1.503 8x-0.027 4,相关性系数R2=0.993,表明葡萄糖浓度与吸光度线性关系良好。
1.2.8 胞外多糖的检测
菌株按1.2.3培养,将孔板中的菌液转移至2 mL离心管中离心去上清液称重,加入约3倍质量的无水乙醇混匀,放入4 ℃冰箱过夜,离心弃上清液,再加入原质量的纯化水混匀,按上述方法测OD490nm的值,代入标准曲线中,计算糖的质量浓度[14]。
1.2.9 维生素K2标准曲线的测定
称取恒重的维生素K2的标准品,用10 mL的流动相[V(甲醇)∶V(二氯甲烷)=1∶9]将标品定溶于10 mL棕色容量瓶中,制成母液。再用流动相将母液稀释成不同浓度梯度的维生素K2溶液,用高效液相色谱仪检测峰面积。以248 nm处做维生素K2标准曲线绘制和产量测定。得到标准方程为Y = 14 368x+1 272.3,相关系数R2 = 0.999 6,表明维生素K2浓度与峰面积线性关系良好。
1.2.10 发酵液中维生素K2产量的测定
由于维生素K2是枯草芽胞杆菌发酵的后期产物,在这里我们对2株菌进行了7 d的发酵。按照参考文献[15],将不同温度、pH和金属离子浓度的菌液置于相应的培养条件中,用100 mL三角瓶静置培养7 d后,将其混匀取2 mL发酵液到离心管中,加入其4倍体积的异丙醇与正己烷混合液(1∶2,体积比),用漩涡混匀振荡器混匀。避光静置30 min后,离心取上层萃取液于5 mL离心管中,用0.22 μm有机滤膜进行过滤,得到样品,用HPLC进行测量。将测量值代入标准曲线中计算维生素K2的含量。
1.3 数据处理
所有实验均重复3次,结果取平均值。采用SPSS、Origin软件对相关数据进行分析及绘图。
2 结果与分析
2.1 BS168-ΔsinR菌株的构建
按照1.1.2中设计的引物和实验步骤,扩增sinR基因的3个片段,再通过融合PCR的方法得到目的基因,琼脂糖凝胶电泳验证目的基因扩增成功(图1)。采用spizizen转化法将融合PCR得到的目的基因转化到枯草芽胞杆菌中(图2)。再将得到的阳性克隆用抗性平板验证,验证成功后去除抗性。将得到的菌株经过测序,用软件snapgene比对,显示sinR基因敲除成功。
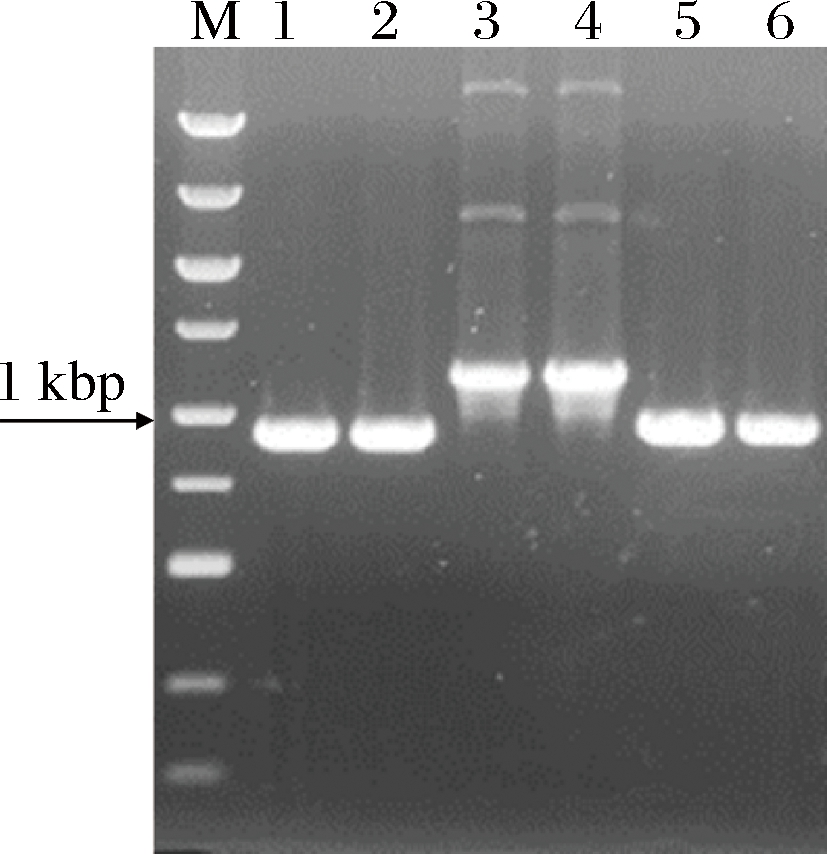
M-5 000碱基DNA对照;泳道 1、2-sinR上游;
泳道3、4-中间片段;泳道5、6:sinR下游
图1 目的基因的PCR扩增
Fig.1 Agarose gel electrophoresis for testing PCR
amplification of the target gene
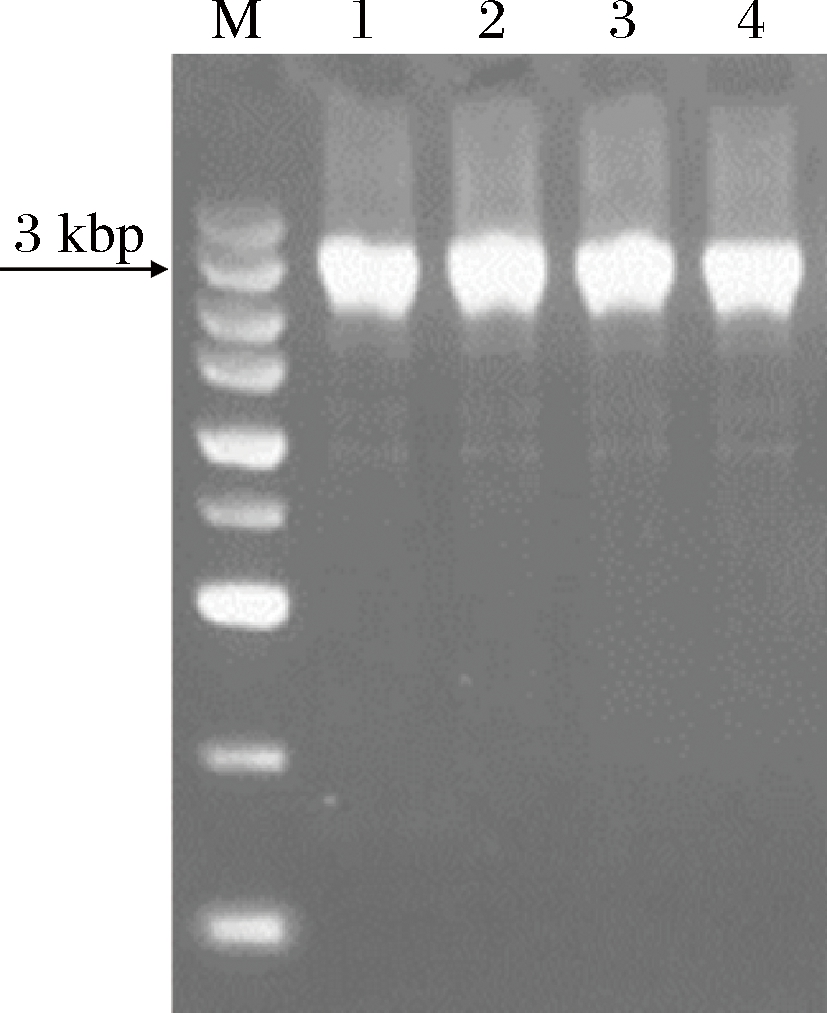
M-5 000碱基DNA对照;泳道 1、2、3、4-敲除sinR
图2 菌落PCR的琼脂糖凝胶电泳图谱验证
Fig.2 Agarose gel electrophoresis of colony PCR
2.2 不同温度、pH及Mn2+、Fe2+、Ca2+浓度对BS168与BS168-ΔsinR生物膜的外部形态及形成量的影响
由图3可知,重组菌BS168-ΔsinR在不同的培养条件下,生物膜的生长状态均优于原始菌BS168。
由图4-a可知,BS168-ΔsinR与BS168生物膜的形成量在37 ℃时无显著性差异,在其他温度条件下,BS168-ΔsinR生物膜形成量均要高于BS168(P<0.05)。在37和40 ℃ BS168成膜能力强,表现出OD570nm值大,在20和45 ℃ BS168几乎不产生物膜。而BS168-ΔsinR仅在20 ℃时成膜能力弱,在其他温度条件下均能形成生物膜,在40 ℃时菌株成膜能力最强,表现出OD570nm值最高。这与文献报道相一致,低温会抑制生物膜的形成[16-17],主要由于菌在低温条件下生长和代谢速率的降低有关。相比原始菌BS168,重组菌BS168-ΔsinR的成膜能力更强,尤其在高温条件下形成生物膜的能力更突出。

图3 培养72 h不同生长条件下的生物膜
Fig.3 The morphologies of biofilm under different cultivated conditions of 72 h
图4-b显示,当pH=8时,BS168与BS168-ΔsinR菌株形成生物膜的OD570nm值最大,且重组菌生物膜的形成量显著高于出原始菌(P<0.05)。当pH=5、9时BS168几乎不产生物膜。而BS168-ΔsinR仅在pH值为5时,生物膜成膜能力弱,在其他pH条件下均能较好的形成生物膜。相比与BS168重组菌BS168-ΔsinR在弱酸和弱碱条件下形成生物膜的能力更强。
图4-c显示,重组菌BS168-ΔsinR与原始菌BS168生物膜的形成量在Mn2+为100 mmol/L时无显著性差异,在其他浓度条件下,重组菌生物膜形成量均高于原始菌(P<0.05),低浓度的Mn2+均能促进BS168与BS168-ΔsinR生物膜的形成。在Mn2+为0.01 mmol/L时BS168形成生物膜的OD570nm最高,在其他浓度条件下,BS168几乎不能形成生物膜。而BS168-ΔsinR仅在Mn2+为100 mmol/L时,生物膜的形成受到影响,在其他浓度下均能较好的形成生物膜。对于Mn2+对生物膜的作用机制尚不清楚,但已知它参与了细胞外主要聚合物质的产生[18],从而通过支持微生物细胞聚集在一起,来帮助生物膜的形成。
图4-d显示,重组菌BS168和原始菌BS168-ΔsinR添加不同浓度的Fe2+均能形成生物膜,重组菌生物膜的形成量要显著高于原始菌(P<0.05)。在Fe2+为1 μmol/L 时,2株菌成膜能力强,表现出OD570nm值大。但不同浓度的Fe2+对BS168-ΔsinR生物膜的形态有比较明显的影响,在Fe2+为1、10 μmol/L时,生物膜较光滑,Fe2+为50、100 μmol/L时生物膜形成的褶皱较多。铁是许多需氧微生物的必需元素,在电子转移和许多其他酶反应中是主要成分。其在生物膜的形成中发挥着重要的作用[19],细胞内的铁是生物膜发育的信号分子[20],适当浓度的铁会促进生物膜的形成。
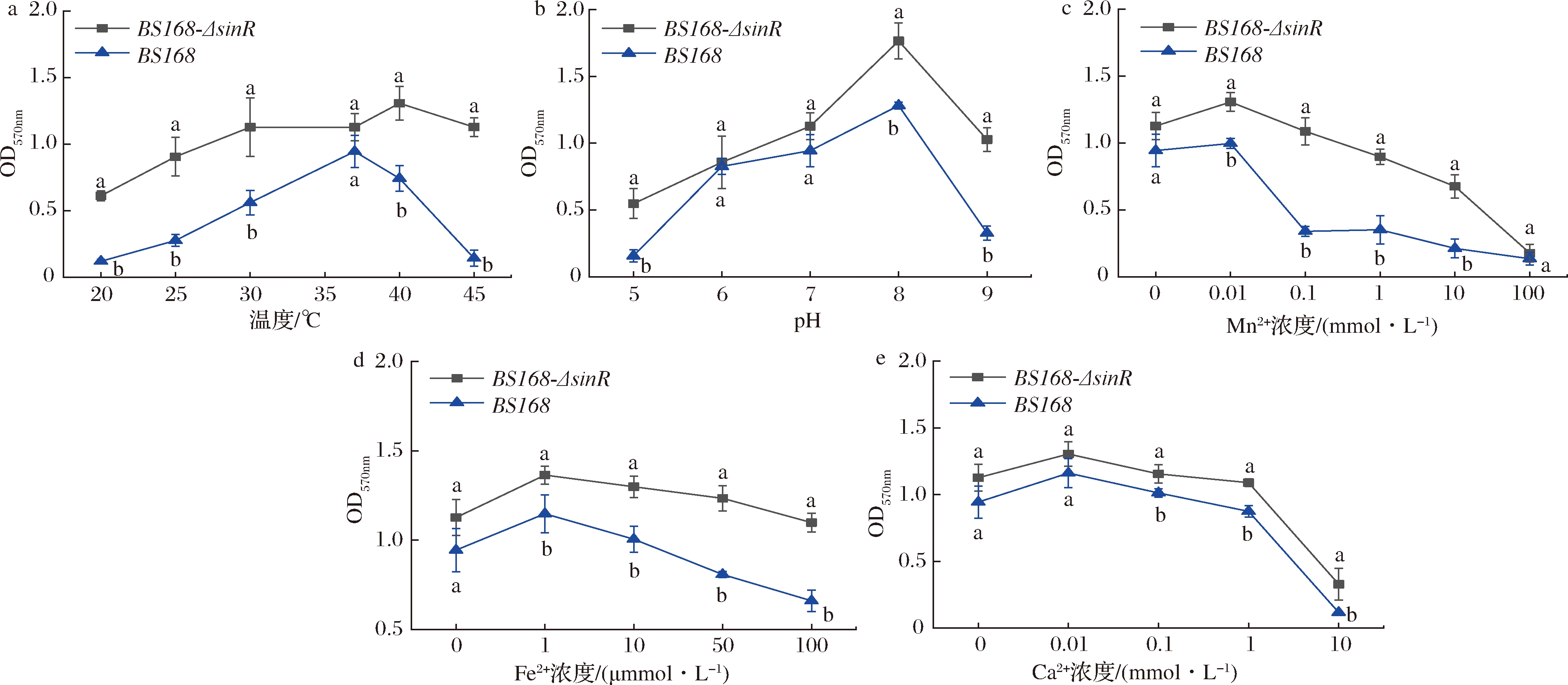
图4 不同生长条件对生物膜形成的影响
Fig.4 Effects of different cultivated conditions on biofilm formation
注:图中字母相同表示无显著性差异(P<0.05),字母不同表示存在显著性差异(P<0.05)(下同)
图4-e显示,低浓度的Ca2+可以促进生物膜的形成,高浓度则会抑制生物膜的形成,不同浓度的Ca2+对BS168与BS168-ΔsinR形成生物膜的能力相接近。当Ca2+为0.01 mmol/L时,2株菌形成生物膜的OD570nm值最高。当Ca2+浓度为10 mmol/L时,2株菌几乎不形成生物膜。钙对生物膜影响是可以通过生理依耐性吸附过程和生物膜形成的信号分子来产生[21]。
2.3 不同温度、pH及Mn2+、Fe2+、Ca2+ 浓度下BS168与BS168-ΔsinR生物膜胞外多糖、胞外蛋白的含量
由图5、图6可知,不同培养条件下BS168-ΔsinR胞外多糖与胞外蛋白的相对含量均要高于BS168。2株菌在不同培养条件下胞外多糖与胞外蛋白的含量趋势相一致,并且在一定的培养条件下重组菌胞外多糖与胞外蛋白含量显著高于原始菌(P<0.05)。在Mn2+为0.01 mmol/L,Fe2+为1 μmol/L,Ca2+为0.01 mmol/L时 BS168、BS168-ΔsinR分别在温度为37 ℃、pH值为7和温度为40 ℃、pH值为8的条件下糖和蛋白含量处于最高值,表现出OD490nm和OD280nm值最高。这与生物膜的形成量几乎吻合。生物膜的主要成分是由胞外蛋白与胞外多糖等组成,因此生物膜的含量会影响胞外多糖与胞外蛋白的含量。
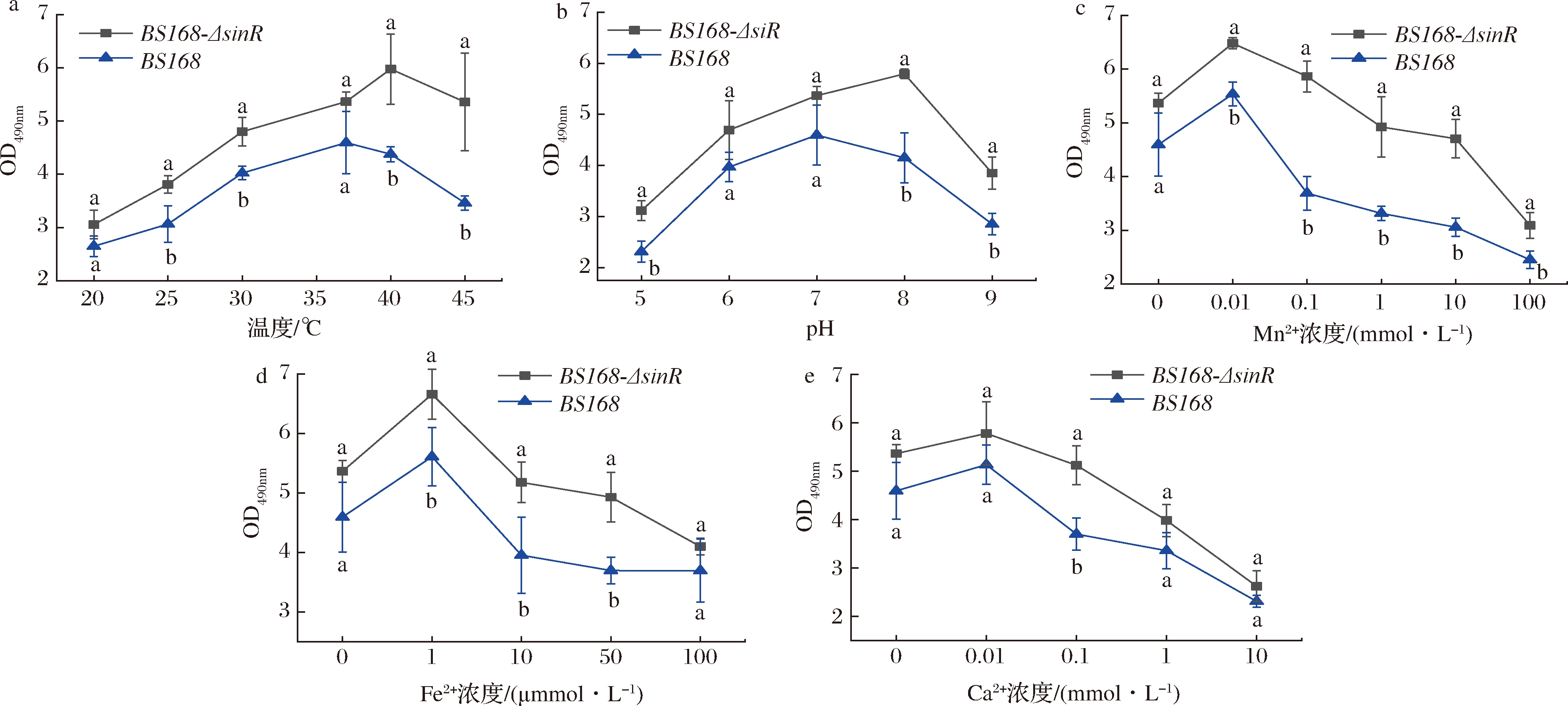
图5 不同生长条件下生物膜胞外多糖含量
Fig.5 Effects of different cultivated conditions on the concentration of exopolysaccharides
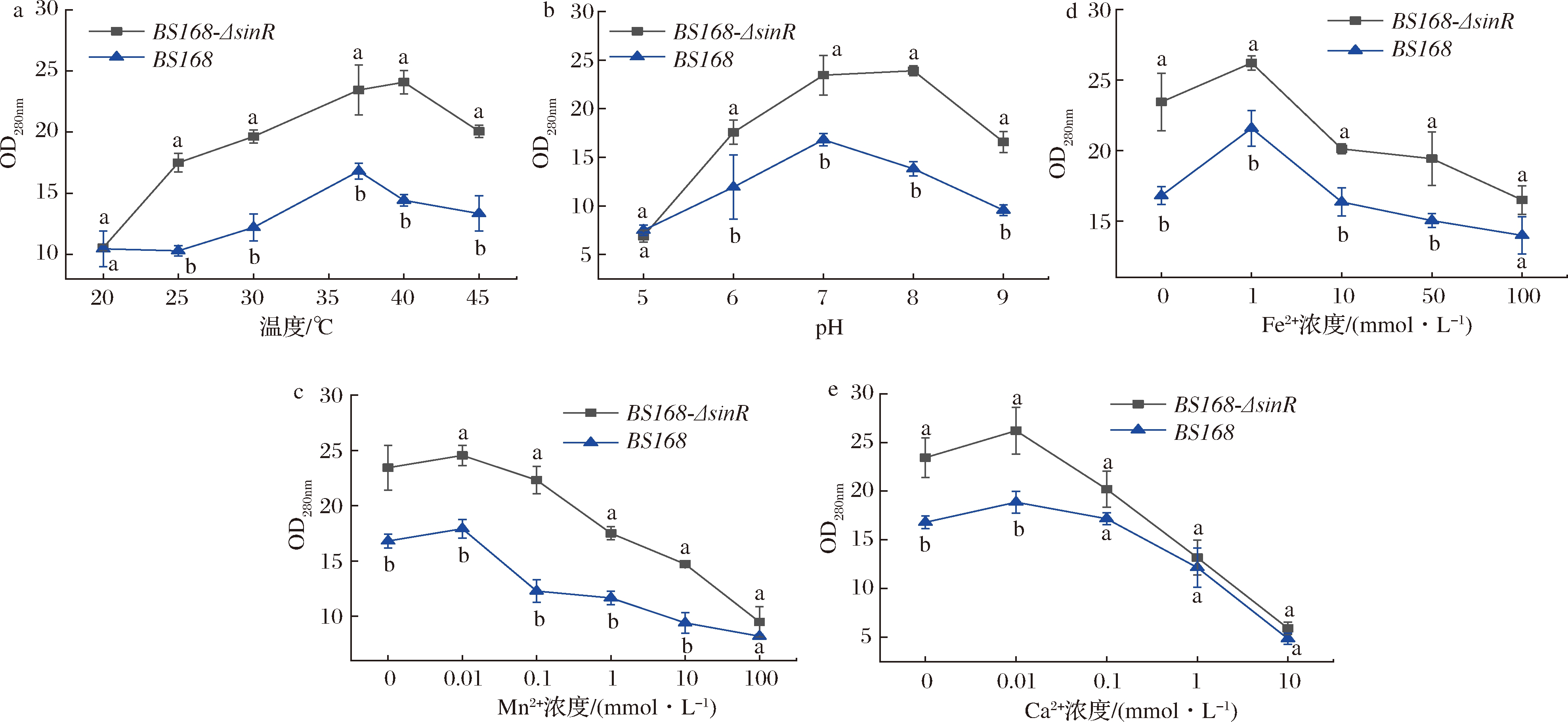
图6 不同生长条件对生物膜胞外蛋白的影响
Fig.6 Effects of different cultivated conditions on concentration of extracellular proteins
2.4 不同温度、pH及Mn2+、Fe2+、Ca2+ 浓度下BS168与BS168-ΔsinR生物膜形成量与维生素K2生物合成量的比较
由图7可知重组菌在相应的温度、pH、及Mn2+、Fe2+、Ca2+浓度下合成维生素K2的能力显著高于出发菌株(P<0.05)。2株菌的维生素K2合成能力均与其生物膜的成膜能力密切相关。在生物膜成膜能力较强时,维生素K2的合成量也相对较高。
由图7-a、图7-b可知随着温度、pH的升高,2株菌生物膜的形成能力和维生素K2的合成能力均是先升后降,在温度为37 ℃和40 ℃时菌株成膜能力佳,温度为40 ℃时维生素K2的合成量达到最高,BS168维生素K2的合成量为56.5 mg/L,BS168-ΔsinR 维生素K2的合成量为88.6 mg/L;在pH值为8.0,生物膜形成量与维生素K2合成量均处于较高值,其中BS168维生素K2的合成量为53.2 mg/L,BS168-ΔsinR 维生素K2的合成量为97.3 mg/L。因此温度为40 ℃、pH值为8.0是发酵过程中较为适合生物膜形成和维生素K2合成的条件。有趣的是BS168-ΔsinR在45 ℃ 时形成生物膜的OD570nm较高,但其维生素K2的合成量却相对较低。我们发现在发酵后期45 ℃培养条件下生物膜的溶解要早于其他的培养温度,维生素K2是发酵后期的产物,所以生物膜的过早溶解可能会降低维生素K2的合成量。

图7 不同生长条件下维生素K2的测定
Fig.7 Effects of different cultivated conditions on the concentration of formation of vitamin K2
由图7-c可知,Mn2+为0.01 mmol/L时2株菌生物膜形成量最佳,在Mn2+为0.1 mmol/L时,维生素K2的合成量达到最高,BS168 维生素K2的合成量为96.4 mg/L,BS168-ΔsinR 维生素K2的合成量为110.8 mg/L;由图7-d可知,Fe2+为1 μmol/L时,2株菌成膜能力最强;在Fe2+为50 μmol/L时,维生素K2的合成能力最强,其中BS168维生素K2的合成量为94.4 mg/L,BS168-ΔsinR 维生素K2的合成量为106.7 mg/L。由图7-e可知,Ca2+为0.01 mmol/L时2株菌形成生物膜的OD570nm最高,在Ca2+为1 mmol/L 时,维生素K2的合成量最大,BS168维生素K2的合成量为85.3 mg/L,BS168-ΔsinR 维生素K2的合成量为96.8 mg/L。在这3种金属离子中添加Mn2+对于提高维生素K2产量最为明显。其中BS168维生素K2的产量提高了73%。BS168-ΔsinR 维生素K2的产量提高了44%。相比于BS168-ΔsinR,金属离子的添加对BS168合成维生素K2的能力尤为明显。相关文献报道维生素K2的产量与生物膜的形成量有关,添加适当的金属离子可以促进生物膜的形成,但本实验中形成生物膜最佳的金属离子浓度并不是合成维生素K2最高的金属离子浓度。合成维生素K2最高的金属离子浓度均要高于形成生物膜最佳时的金属离子浓度。我们猜测金属离子的添加可能会参与发酵后期相关代谢物的反应,影响维生素K2合成的同时也影响了生物膜的形成。
3 结论
sinR是枯草芽胞杆菌生物膜形成的转录抑制因子,它编码的SinR蛋白与DNA的结合导致epsA-O和tapA-sipW-tasA操纵子的抑制[22-24],这2个操纵子都参与生物膜基质多糖和蛋白质的产生。枯草芽胞杆菌BS168通过敲除生物膜形成的关键调控基因sinR,不仅增强了BS168-sinR菌株生物膜的形成能力,而且增强菌株在高温和弱酸弱碱性环境的生长能力和在发酵过程中代谢产物维生素K2的合成能力。
近年来,有关枯草芽胞杆菌生物膜的研究主要通过分析培养条件(温度、pH、金属离子、接触面材料性质等)和生物膜形成的相关基因对生物膜形成的影响进行研究。对于提高维生素K2的产量,研究多集中在通过菌种诱变、培养基优化以及代谢关键基因改造提高其产量[24-28],对有关通过提高菌株生物膜的形成量来提高维生素K2的产量还未曾报道。因此本文通过培养条件和生物膜的关键调控基因与枯草芽胞杆菌BS168生物膜的形成作用进行了分析,再进一步比较其与维生素K2的生物合成量的关系。本研究结果为深入探究sinR基因参与枯草芽胞杆菌生物膜形成的机制提供科学依据及提高维生素K2合成产量提供参考依据。
[1] COLLINS M D, JONES D.Distribution of isoprenoid quinone structural types in bacteria and their taxonomic implication[J].Microbiological Reviews, 1981, 45(2):316-354.
[2] KISHI S, SAITO K, KATO Y, et al.Redox potentials of ubiquinone, menaquinone, phylloquinone, and plastoquinone in aqueous solution[J].Photosynthesis Research, 2017, 134(2):193-200.
[3] WANG H, LIU H, WANG L, et al.Improvement of menaquinone-7 production by Bacillus subtilis natto in a novel residue-free medium by increasing the redox potential[J].Applied Microbiology and Biotechnology, 2019,103(18):7 519-7 535.
[4] CUI S X, LYU X Q, WU Y K, et al.Engineering a bifunctional Phr60-Rap60-Spo0A quorum-sensing molecular switch for dynamic fine-tuning of menaquinone-7 synthesis in Bacillus subtilis[J].ACS Synthetic Biology, 2019, 8(8):1 826-1 837.
[5] CUI S X, XIA H Z, CHEN T C, et al.Cell membrane and electron transfer engineering for improved synthesis of menaquinone-7 in Bacillus subtilis[J].iScience, 2020, 23(3):100 918.
[6] MAHDINIA E, DEMIRCI A, BERENJIAN A.Effects of medium components in a glycerol-based medium on vitamin K (menaquinone-7) production by Bacillus subtilis natto in biofilm reactors[J].Bioprocess and Biosystems Engineering, 2018, 42(2):223-232.
[7] BERENJIAN A, MAHANAMA R, TALBOT A, et al.Designing of an intensification process for biosynthesis and recovery of menaquinone-7[J].Applied Biochemistry & Biotechnology, 2014, 172(3):1 347-1 357.
[8] BERENJIAN A, CHAN N L C, MAHANAMA R, et al.Effect of biofilm formation by Bacillus subtilis natto on menaquinone-7 biosynthesis[J].Molecular Biotechnology, 2013, 54(2):371-378.
[9] MAHDINIA E, DEMIRCI A, BERENJIAN A, et al.Optimization of Bacillus subtilis natto growth parameters in glycerol-based medium for vitamin K (Menaquinone-7) production in biofilm reactors[J].Bioprocess & Biosystems Engineering, 2018, 41(2):195-204.
[10] MAHDINIA E, DEMIRCI A, BERENJIAN A.Strain and plastic composite support (PCS) selection for vitamin K (Menaquinone-7) production in biofilm reactors[J].Bioprocess and Biosystems Engineering, 2017, 40(10):1 507-1 517.
[11] GIDI P, SHIRA O B, URI G.Menaquinone and iron are essential for complex colony development in Bacillus subtilis[J].PLoS One, 2017, 8(11):86-99.
[12] KIRBY D T, SAVAGE J M, PLOTKIN B J.Menaquinone (vitamin K2) enhancement of Staphylococcus aureus biofilm formation[J].Journal of Biosciences & Medicines, 2014, 2(1):26-32.
[13] CHOPRA L, SINGH G, KUMAR JENA K,et al.Sonorensin:A new bacteriocin with potential of an anti-biofilm agent and a food biopreservative[J].Scientific Reports, 2015, 5(1):134-146.
[14] 周万龙, 焦学, 孙亚杰, 等.1株海洋来源鞘氨醇单胞菌胞外多糖的含量测定[J].中国海洋药物, 2017, 36(2):27-34.
ZHOU W L, JIAO X, SUN Y J, et al.Determination of extracellular polysaccharides produced by marine derived Sphingomonas sp.WG[J].Chinese Journal of Marine Drugs, 2017, 36(2):27-34.
[15] 严为留, 张伟国, 钱和.响应面法优化维生素K2(MK-7)发酵条件[J].工业微生物, 2015, 45(3):14-23.
YAN W L, ZHANG W G, QIAN H.Optimization of fermentation conditions for vitamin K2(MK-7) by response surface methodology[J].Industrial Microbiology, 2015, 45(3):14-23.
[16] MORIMATSU K, HAMANAKA D, TANAKA F, et al.Effect of temperature fluctuation on biofilm formation with bacterial interaction between Salmonella enterica and Pseudomonas putida[J].九州大学大学院农学研究院纪要, 2012, 58(1):125-129.
[17] 冯静静, 杨自名, 吴静, 等.培养条件及表面活性剂的添加对纳豆芽孢杆菌生物膜形成的影响[J].食品与发酵工业, 2020, 46(3):90-96.
FENG J J, YANG Z M, WU J, et al.The effects of culture conditions and surfactants on the biofilm formation of Bacillus subtilis natto[J].Food and Fermentation Industries, 2020, 46(3):90-96.
[18] MHATRE E, TROSZOK A, GALLEGOS-MONTERROSA R, et al.The impact of manganese on biofilm development of Bacillus subtilis[J].Microbiology, 2016, 162(8):1 468-1 478.
[19] HAYRAPETYAN H, MULLER L, TEMPALAARS M, et al.Comparative analysis of biofilm formation by Bacillus cereus reference strains and undomesticated food isolates and the effect of free iron[J].International Journal of Food Microbiology, 2015, 200(4):72-79.
[20] BANIN E, VASIL M L, GREENBERG E P.From the cover:Iron and Pseudomonas aeruginosa biofilm formation[J].Proceeding of National Academy of Sciences, 2005, 102(31):11 076-11 081.
[21] TSCHLER A H, LIE L, THOMPSON C M, et al.Discovery of calcium as a biofilm-promoting signal for Vibrio fischeri reveals new phenotypes and underlying regulatory complexity[J].Journal of Bacteriology,2018, 200(15):16-18.
[22] CHU F, KEARNS D B, BRANDA S S, et al.Targets of the master regulator of biofilm formation in Bacillus subtilis[J].Molecular Microbiology, 2010, 59(4):1 216-1 228.
[23] KEARNS D B, CHU F, BRANDA S S, et al.A master regulator for biofilm formation by Bacillus subtilis[J].Molecular Microbiology, 2005, 55(3):739-749.
[24] MILTON M E, DRAUGHN G L, BOBAY B G, et al.The solution structures and interaction of sinR and sinI:Elucidating the mechanism of action of the master regulator switch for biofilm formation in Bacillus subtilis[J].Journal of Molecular Biology, 2019, 432(2):343-345.
[25] MA Y, MCCLURE D D, SOMERVILLE M V, et al.Metabolic engineering of the MEP Pathway in Bacillus subtilis for increased biosynthesis of menaquinone-7[J].ACS Synthetic Biology, 2019, 8(7):1 620-1 630.
[26] MAHDINIA E, ALI D, BERENJIAN A.Implementation of fed-batch strategies for vitamin K (menaquinone-7) production by Bacillus subtilis natto in biofilm reactors[J].Applied microbiology and biotechnology, 2018, 14(9):9 147-9 157.
[27] MAHDINIA E, DEMIRCI A, BERENJIAN A.Enhanced vitamin K (Menaquinone-7) production by Bacillus subtilis natto in biofilm reactors by optimization of glucose-based medium[J].Current Pharmaceutical Biotechnology, 2018, 19(11):917-924.
[28] LIU Y, DING X M, XUE Z L, et al.Site-directed mutagenesis of UbiA to promote menaquinone biosynthesis in Elizabethkingia meningoseptica[J].Process Biochemistry, 2017, 58(2):186-192.