大西洋鲑(Salmo salar)隶属于鲑科(Salmonoidea),鲑属(Salmon),为冷水性溯河产卵洄游鱼类,是世界著名经济鱼种之一[1]。主要原产地为挪威,作为世界名贵鱼类之一,其在加拿大、智利、澳大利亚、日本、美国等国家均有养殖[2],我国自2010年起开始工业化养殖,受养殖区域和技术的限制,在我国的养殖产量很少。生食大西洋鲑肉质细嫩、口感爽滑、颜色鲜艳,广受消费者喜爱。其产品类型以烟熏、冰冻、冰鲜形式为主,其中烟熏产品在我国消费相对较少。
虹鳟(Oncorhynchus mykiss)隶属于鲑科(Salmonoidea),大马哈鱼属(Oncorhychus),其鱼身有小黑斑分布,有一红色带位于体侧,如同彩虹,因此得名“虹鳟”,是全球性高经济价值的冷水性优良养殖品种之一[3]。虹鳟最早在美国开始淡水养殖,我国从1959年开始养殖,目前在20多个省市区都有养殖,是国内养殖范围较广的冷水鱼类[4]。2017年我国虹鳟产量为41 460 t,比2016年产量增加17.79%[5],已成为我国重要的养殖鱼类之一。尤其三倍体虹鳟的养殖周期短、个体大、肉质细腻,深受广大消费者的喜爱。
大西洋鲑和虹鳟个体均较大,随着鱼类加工处理机械的进步,切片、分割处理更有利于加工和流通。因此,了解二者不同可食部位间营养成分差异是有必要的。目前,对于大西洋鲑和和虹鳟的研究主要集中于二者鉴别方法的开发[6]、基本营养成分分析[7]及养殖和野生大西洋鲑和虹鳟中脂肪酸组成的对比分析[8],而关于这2种鱼中虾青素和脂肪酸的比较研究较少。大西洋鲑和虹鳟肌肉的营养价值高,富含虾青素和n-3不饱和脂肪酸等活性物质,有研究表明,低浓度的虾青素与二十碳五烯酸(eicosapentaenoic acid,EPA)或二十二碳六烯酸(docosahexaenoic acid,DHA)组合可协同作为抗氧化剂,预防癌症和其他炎症性疾病[9],且虾青素和鱼油(主要成分为EPA和DHA)组合作为补充剂,不但能降血脂[10]还可以通过控制氧化应激改变牙髓组织的酶促抗氧化系统[11]。近年来,消费者对虾青素和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)对人体的健康益处越来越感兴趣,因此充分了解这2种鱼中的虾青素和脂肪酸组成是有必要的。另外,肌肉的红色程度是鲑鳟鱼类质量评估中最重要的标准之一,肌肉颜色与肌肉中类胡萝卜素(主要为虾青素)的含量有关。因此测定大西洋鲑和虹鳟中的虾青素含量可作为评价其肌肉品质的重要指标。脂肪酸的种类及含量与食品的风味、质地等也存在较大关联性,对2种鱼中虾青素含量和脂肪酸组成进行不同部位间综合比较有助于人们进一步了解二者不同部位间营养价值和品质差异,且为其分部位加工和深加工提供基础资料和理论支持。
虾青素具有强的抗氧化功效、抵御紫外线、抗炎、抗糖尿病、抗肿瘤、预防心脑血管疾病、代VA活性、增强人体免疫功能、改善视力等生物功效[12-13],由于鲑鳟鱼类无法自身合成虾青素,都需要摄食含有类胡萝卜素(主要为虾青素)的饵料而使鱼肉呈现鲜红色或橘红色[14],饲料加工中用于添加的虾青素来源有多种,包括天然虾青素和化学合成虾青素,有研究证明,鱼肉中虾青素的立体异构体组成与饲料中添加的虾青素来源相关[15],但是当前市场上关于鲑鳟鱼类中虾青素的来源还不清楚。因此,本研究通过测定鱼肉中虾青素的立体异构体组成来判断饲料中添加的虾青素来源。
1 材料与方法
1.1 材料、试剂与仪器
8组虹鳟鱼样品由国内不同养殖公司提供,每组样品取3尾,体重为(5 694.00±188.44) g;8组大西洋鲑从青岛市场环节采集,每组样品取3尾,体重为(6 446.17±205.61) g。养殖公司提供样品至运抵实验室时都处于冰鲜状态,立即分部位匀浆,并将其保存在-80 ℃超低温冰柜中备用。市场采购样品为冰鲜状态,采集后加冰袋,1 h内运至实验室,进行样品处理后保存于-80 ℃超低温冰柜中备用。
丙酮、甲醇、乙腈、二氯甲烷和叔丁基甲基醚均为色谱纯,美国Merk公司;虾青素标准品(纯度>95%),德国Dr.Ehrenstorfer公司;N-丙基乙二胺(primary secondary amine,PSA)填料(40~60 μm),艾杰尔公司;磷酸、无水MgSO4、无水NaSO4,国药集团。
1100高效液相色谱仪(配紫外检测器),美国Agilent公司;KQ-300E超声波清洗机,昆山市超声仪器有限公司;CR22G 高速冷冻离心机,日本HITACHI公司。
1.2 实验方法
1.2.1 样品前处理
将虹鳟和大西洋鲑放在冰盘上解剖,用解剖刀将鱼皮与肌肉分离,按肌肉纹理分别取同一侧的背部、腹部和尾部肌肉,其中背肌取侧线上方0.5 cm处的肌肉,腹肌取侧线下方的肌肉,尾肌取尾柄部的肌肉。将按不同部位(背肌、腹肌、尾肌)分割切块后的肌肉,用组织匀浆机搅匀,备用。鱼皮用剪刀剪成小块,备用。
1.2.2 虾青素含量的测定
参考SC/T 3053—2019[16]。
1.2.3 虾青素立体异构体的测定
参考丛心缘等[17]方法将预先处理好的样品、无水硫酸镁和丙酮以1∶2∶5(g∶g∶mL)的比例混合,在40 kHz超声中提取15 min,提取液在高速冷冻离心机中8 000 r/min离心5 min。重复上述提取步骤,合并2次分离的上清液。为保证虾青素不被破坏,所有提取过程温度控制在4 ℃左右。将上清液混合均匀后放在棕色玻璃瓶中密封保存。将南极磷虾虾青素提取物和丙酮按1∶10的体积比稀释,过0.22 μm滤膜后进行分析。
参照杨澍等[18]液相色谱条件稍作改进。色谱柱:ChiralPak IC 柱(250 mm×4.6 mm,5 μm);流动相:甲基叔丁基醚-乙腈(体积比为50∶50);采用等度洗脱,洗脱流速为1 mL/min;柱温:25 ℃;进样量:20 μL。
1.2.4 脂肪酸含量的测定
称取适量样品经真空冷冻干燥机冻干,计算水分含量,并研磨成粉末状。参照国标GB 5009.168—2016[19]。
气相色谱条件:色谱柱:J&W CD-2560气相毛细管色谱柱(100 m×250 μm,0.2 μm);进样器温度250 ℃;检测器温度260 ℃;升温程序:初始温度130 ℃,以4 ℃/min升温至130~180 ℃,保持10 min,再以1 ℃/min 升温至180~240 ℃;载气流速1 mL/min,进样量1.0 μL;分流比为20∶1。
1.2.5 脂肪酸营养价值评价
参考相关文献[20]进行脂肪酸评价,通常采用多烯指数(polyene index,PI)、动脉粥样硬化指数(index of atherogenicity,IA)和血栓形成指数(index of thrombogenicity,IT),见公式(1)~公式(3):
(1)
式中:C20∶5表示二十碳五烯酸含量,g/100g;C22∶6表示二十二碳六烯酸含量,g/100g;C16∶0表示棕榈酸含量,g/100g。
(2)
式中:C12∶0表示月桂酸含量,g/100g;C14∶0表示肉豆蔻酸含量,g/100g;C16∶0表示棕榈酸含量,g/100g;∑MUFA表示总单不饱和脂肪酸(monounsaturated fatty acid,MUFA)含量,g/100g;∑PUFA表示总多不饱和脂肪酸含量,g/100g。

(3)
式中:C14∶0表示肉豆蔻酸含量,g/100g;C16∶0表示棕榈酸含量,g/100g;C18∶0表示硬脂酸含量,g/100g;∑MUFA表示总单不饱和脂肪酸含量,g/100g;∑n-6 PUFA表示总n-6型多不饱和脂肪酸含量,g/100g;∑ n-3 PUFA表示总n-3型多不饱和脂肪酸含量,g/100g。
1.2.6 数据分析
采用SPSS 17.0软件对数据进行处理,每个样品设3个平行,结果以![]() 表示,以P值小于0.05为显著,P>0.05为不显著。
表示,以P值小于0.05为显著,P>0.05为不显著。
2 结果与分析
2.1 大西洋鲑和虹鳟中虾青素含量的测定
2.1.1 方法的准确度与精密度考察
以大西洋鲑和虹鳟可食部位为测试基质,分别添加1、5和20 mg/kg浓度的反式虾青素标准溶液,按SC/T 3053—2019[16]进行测定,每个浓度做6个平行样品。同时做基质空白实验,均扣除本底值后计算加标回收率和相对标准偏差,结果见表1。
表1 大西洋鲑和虹鳟中虾青素的加标回收率及精密度测定
Table 1 Recoveries and relative standard deviations of astaxanthin in Salmo salars and Oncorhynchus mykiss
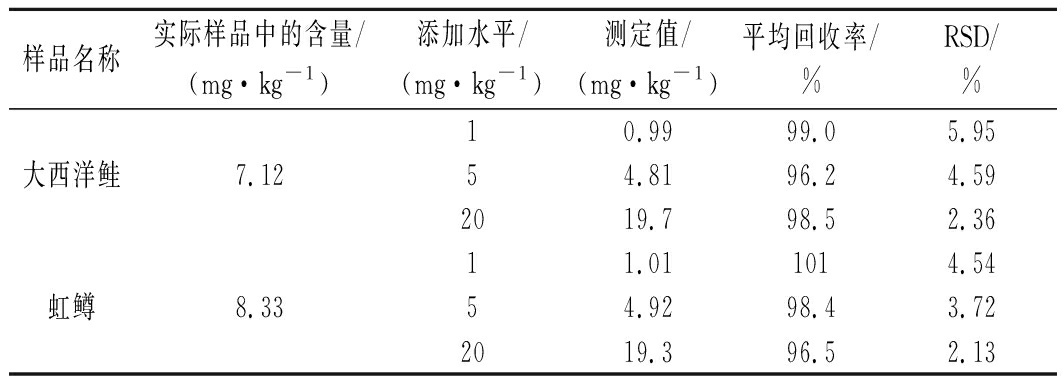
样品名称实际样品中的含量/(mg·kg-1)添加水平/(mg·kg-1)测定值/(mg·kg-1)平均回收率/%RSD/%10.9999.05.95大西洋鲑7.1254.8196.24.592019.798.52.3611.011014.54虹鳟8.3354.9298.43.722019.396.52.13
虾青素在大西洋鲑中的加标回收率在96.2%~99.0%, 相对标准偏差为2.36%~5.95%,虾青素在虹鳟中的加标回收率在96.5%~101%, 相对标准偏差为2.13%~4.54%。该方法的准确度和精密度适用于大西洋鲑和虹鳟中虾青素含量的测定。
2.1.2 大西洋鲑和虹鳟中的虾青素含量
大西洋鲑和虹鳟不同部位虾青素含量如表2所示。虹鳟肌肉中的虾青素含量高于大西洋鲑但差异不显著(P>0.05),而鱼皮中的虾青素含量显著高于大西洋鲑(P<0.05)。虾青素定评价其品质的重要指标,由于虾青素的积累,虹鳟和大西洋鲑肌肉呈现红色。虾青素在鱼体内不能合成,需要在饲料中添加,占到饲料成本的10%~20%[21]。虾青素的沉积,使得肌肉中的虾青素含量不断增加[22]。MARCH等[23]的研究证明,与虹鳟相比,大西洋鲑对饲料中虾青素的着色反应慢、虾青素沉积率要低。而且BJERKENG[24]指出,除虾青素来源外,饲料中虾青素的添加量、饲喂时间和饲料组成也会对大西洋鲑和虹鳟中虾青素的着色有显著影响,从而影响鱼体内的虾青素含量。
表2 大西洋鲑和虹鳟不同部位虾青素含量 单位:mg/kg
Table 2 Astaxanthin content of different parts of
Oncorhynchus mykiss and Salmo salar
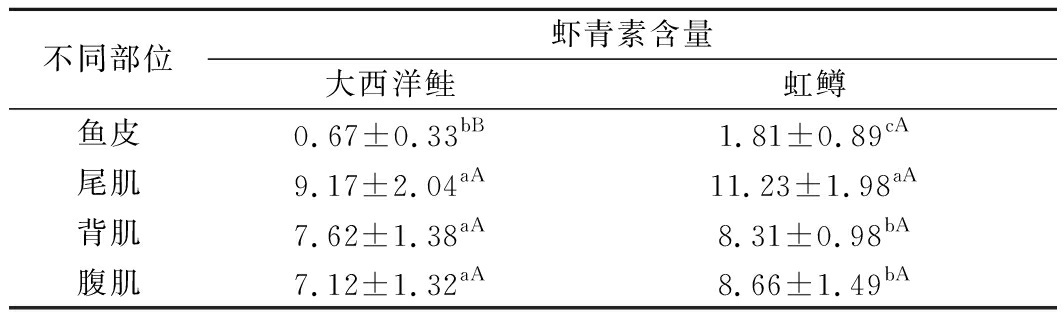
不同部位虾青素含量大西洋鲑虹鳟鱼皮0.67±0.33bB1.81±0.89cA尾肌9.17±2.04aA11.23±1.98aA背肌7.62±1.38aA8.31±0.98bA腹肌7.12±1.32aA8.66±1.49bA
注:同列数据肩标不同小写字母表示差异显著(P<0.05);同行不同肩标大写字母表示差异显著(P<0.05)(下同)
大西洋鲑肌肉中的虾青素含量显著高于鱼皮(P<0.05),各肌肉部位间无显著差异(P>0.05);虹鳟尾肌的虾青素含量显著高于背肌、腹肌和鱼皮(P<0.05),背肌与腹肌中的差异不显著(P>0.05),鱼皮中虾青素含量最低。2种鱼不同部位间虾青素含量表现出显著差异,推测原因可能是因为鱼体的生理、生化指标以及不同环境的适应能力导致虾青素在鱼体内选择性分布[25]。
2.2 大西洋鲑和虹鳟中虾青素的结构分析
可分别从图1-B~图1-D和图1-b~图1-d中看出虹鳟肌肉和大西洋鲑中的虾青素均以游离态全反式结构存在,不存在13-顺式虾青素和9-顺式虾青素。而鱼皮(图1-a和图1-A)中包含游离态虾青素和酯化态虾青素。
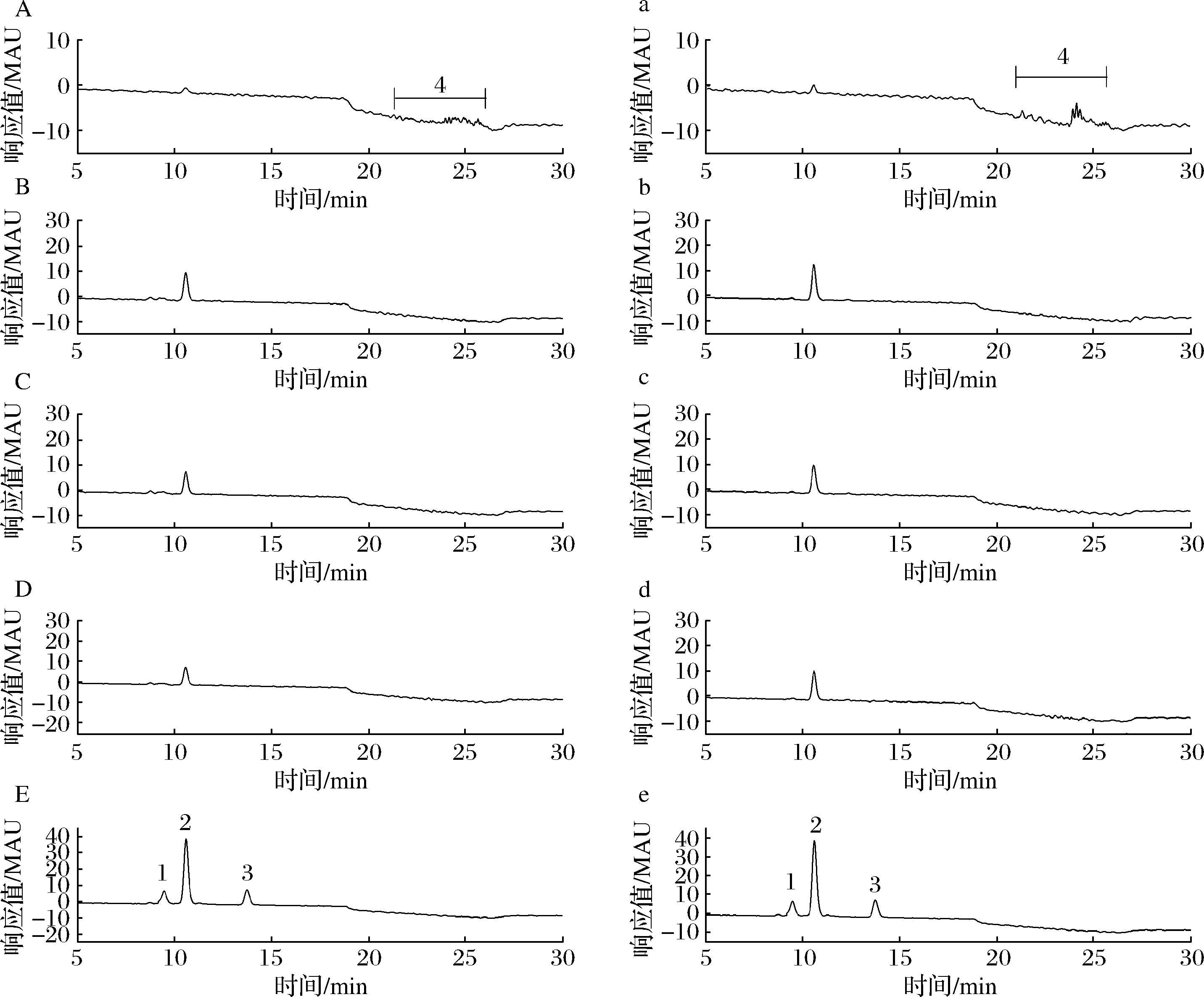
A-虹鳟鱼皮;B-虹鳟尾肌;C-虹鳟背肌;D-虹鳟腹肌;E-3种几何异构体标准品;a-大西洋鲑鱼皮;b-大西洋鲑尾肌;
c-大西洋鲑背肌;d-大西洋鲑腹肌;e-3种几何异构体标准品
图1 虹鳟和大西洋鲑不同部位中虾青素色谱图
Fig.1 Astaxanthin chromatograms in different parts of Oncorhynchus mykiss and Salmo salar
注:峰1:13-顺式虾青素;峰2:全反式虾青素;峰3:9-顺式虾青素;峰4:虾青素酯
虹鳟(图2-A~图2-D)和大西洋鲑(图2-E~图2-H)鱼皮、尾肌、背肌和腹肌中的虾青素立体异构体组成如图2所示。
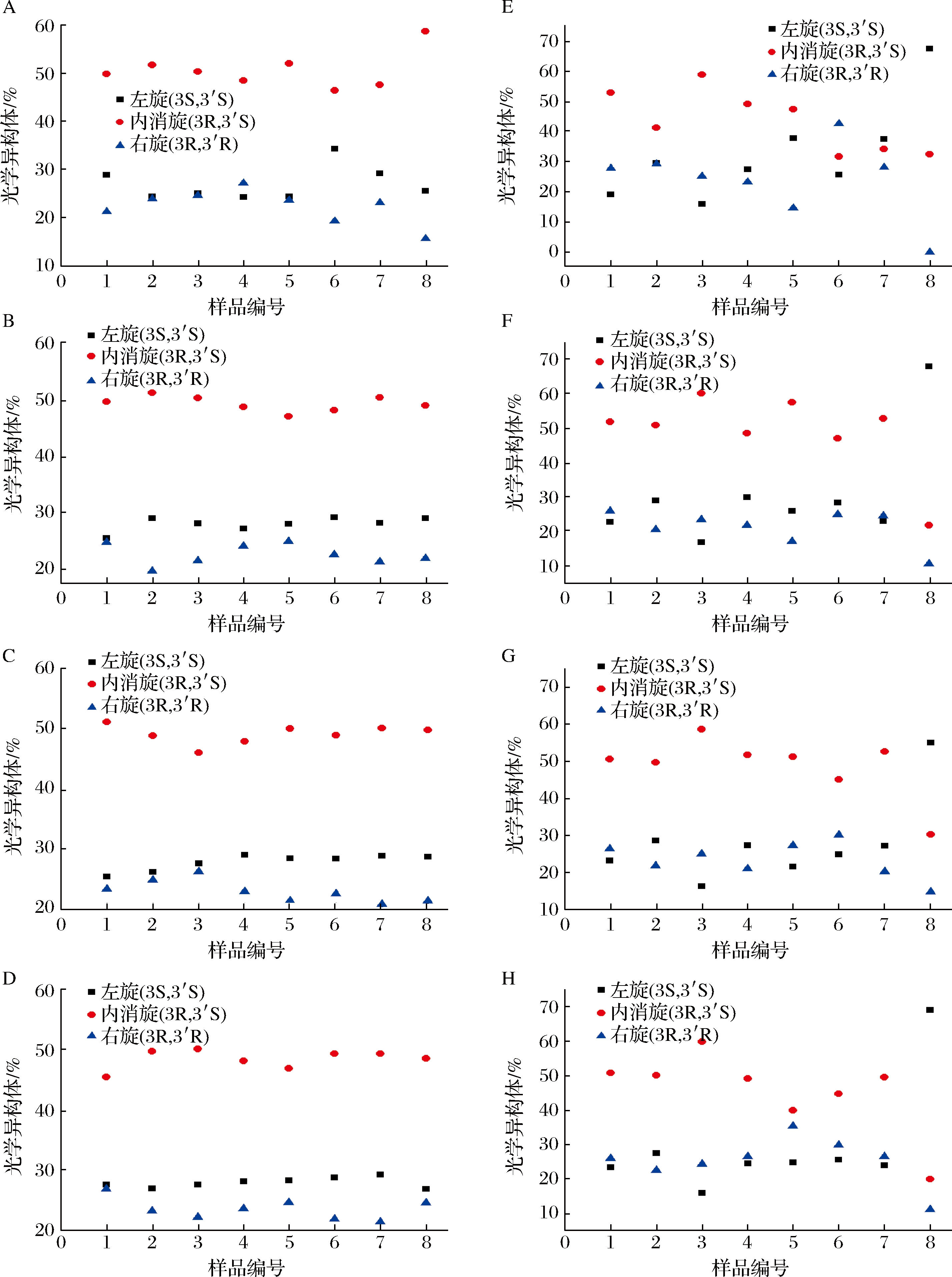
A-虹鳟鱼皮;B-虹鳟尾肌;C-虹鳟背肌;D-虹鳟腹肌;E-大西洋鲑鱼皮;F-大西洋鲑尾肌;G-大西洋鲑背肌;H-大西洋鲑腹肌
图2 虹鳟和大西洋鲑不同部位虾青素的立体异构体组成
Fig.2 Stereoisomer composition of astaxanthin in different parts of Oncorhynchus mykiss and Atlantic salmon′s fish
对于大西洋鲑,只有1个标称产地为加拿大的样品(样品编号为8)可食部位中的虾青素立体异构体3S,3′S占比为55%~69%,其余样品肌肉中虾青素的异构体组成3S,3′S∶3R,3′S∶3R,3′R约为1∶2∶1,各肌肉部位类似,但少数大西洋鲑鱼皮中的虾青素的异构体组成与其肌肉不同,存在个体差异;对于虹鳟,所有样品可食部位中虾青素异构体组成均为1∶2∶1(3S,3′S∶3R,3′S∶3R,3′R)。
虾青素的来源不同,其立体异构体组成存在差异,其中化学合成虾青素、法夫红酵母和雨生红球藻在水产饲料中应用广泛,合成虾青素的立体构型的典型比例为n(3S,3′S)∶n(3R,3′S)∶n(3R,3′R)≈1∶2∶1[26],法夫红酵母中虾青素的立体构型以3R,3′R结构为主[27],雨生红球藻主要以3S,3′S结构为主[28-29]。OSTERLIE等[30]用立体异构体3S,3′S∶3R,3′S∶3R,3′R接近1∶2∶1的膳食喂养虹鳟鱼69 d后,发现在虹鳟鱼粪便、血液、肝脏和鱼片中的虾青素结构与饲料中的异构体比例相似,证明养殖虹鳟鱼中虾青素的异构体组成与饲料中添加的虾青素来源相关。
本研究中大多数大西洋鲑和虹鳟样品中虾青素立体异构体组成相似,3S,3′S∶3R,3′S∶3R,3′R约为1∶2∶1,与化学合成虾青素一致,仅有1个大西洋鲑样品中虾青素以3S,3′S为主,这与雨生红球藻来源的虾青素立体异构体组成接近。可推断虹鳟和大西洋鲑的养殖饲料中,主要添加化学合成来源的虾青素,可以通过这种方式来推测饲料中虾青素的来源。
2.3 大西洋鲑和虹鳟中的脂肪酸组成和营养价值评价
2.3.1 脂肪酸组成和含量
大西洋鲑和虹鳟脂肪酸组成和含量见表3。2种鱼均属于典型的冷水性鱼类,富含PUFA,其能调节人体的脂质代谢,治疗和预防心脑血管疾病,促进生长发育,并在抗癌、免疫调节、延缓衰老、减肥、美容等方面均具有重要的生理作用[31],其中EPA和DHA对于大脑发育和增强记忆力具有更为明显的作用[32]。从虹鳟背肌、腹肌和尾肌中鉴定出18种脂肪酸,鱼皮中14种;大西洋鲑腹肌中也含有18种脂肪酸,高于背肌(16)、尾肌(15)和鱼皮(14),2种鱼鱼皮和大西洋鲑背肌、尾肌中有脂肪酸种类未检出,这可能与不同部位间脂肪酸组成分布不一致、鱼类养殖环境、实验仪器方法误差有关。此外,它们的脂肪酸含量差异较大,虹鳟中总饱和脂肪酸含量(ΣSFA)、总单不饱和脂肪酸含量(ΣMUFA)和总多不饱和脂肪酸(ΣPUFA)含量较高于大西洋鲑,且仅在背肌和腹肌中表现出显著差异(P<0.05)。鱼体脂肪酸含量及组成受饲料脂肪水平、类型和脂肪酸比例[33-34]、及特有养殖模式下的水生态环境[35]等多种因素的影响。2种鱼的SFA中C16∶0和C18∶0的含量较高,MUFA中C18∶1n-9含量远高于其他种类,主要PUFA含量由高到低依次为C18∶2n-6(LA)>C22∶6n-3(DHA)>C18∶3n-3(ALA)>C20∶5n-3(EPA)。本研究中的养殖虹鳟和大西洋鲑均含有较高含量的LA和C18∶1n-9,这与饲料中植物油的脂肪酸组成有关[36]。而LA是最具有代表性的n-6多不饱和脂肪酸[37],且必须从食物中获得,因此,多食用虹鳟和大西洋鲑对人体健康有益。
表3 虹鳟和大西洋鲑不同部位肌肉的脂肪酸组成和含量(湿重) 单位:g/100g
Table 3 Fatty acid composition and content of different parts of Oncorhynchus mykiss and Salmo salar

脂肪酸虹鳟大西洋鲑鱼皮背肌腹肌尾肌鱼皮背肌腹肌尾肌C14∶00.18±0.01b0.23±0.07a0.30±0.07a0.16±0.05b0.20±0.04a0.27±0.08a0.29±0.14a0.20±0.07aC16∶00.83±0.48b1.41±0.48a1.77±0.32a0.98±0.02b0.72±0.09b1.03±0.19b1.05±0.22b0.81±0.13bC18∶00.52±0.03a0.67±0.22a0.86±0.19a0.47±0.14a0.33±0.09b0.49±0.15a0.49±0.09a0.34±0.10bC20∶0―0.06±0.01a0.08±0.002a0.04±0.01a――0.05±0.002a―ΣSFA1.63±0.33b2.36±0.80a2.98±0.62a1.63±0.50b1.25±0.14b1.80±0.34b1.85±0.39b1.36±0.25bC16∶1 n-70.42±0.07a0.51±0.22a0.66±0.25a0.34±0.16a0.23±0.02a0.33±0.04a0.37±0.15a0.25±0.07aC18∶1 n-96.15±1.25a6.69±1.89a8.99±1.98a4.30±1.57b2.86±0.43b4.06±0.70b4.44±1.86b3.18±1.22bC18∶1n-70.44±0.07b0.49±0.13a0.65±0.14a0.33±0.12b0.25±0.04b0.40±0.06b0.44±0.16b0.31±0.08bC20∶10.38±0.09a0.43±0.17a0.58±0.18a0.27±0.18a0.34±0.25a0.49±0.41a0.49±0.05a0.29±0.18aC22∶1―0.14±0.02a0.13±0.01b0.06±0.001c― 0.16±0.02a0.16±0.02a0.08±0.002cC24∶1 n-9―0.17±0.01a0.18±0.01a0.12±0.01b――0.19±0.01a―ΣMUFA7.38±1.30b8.46±2.40a11.24±2.59a5.42±2.01b3.68±0.67b5.29±1.09b5.80±2.66b4.10±1.54bC18∶2 n-6(LA)1.89±0.31b2.28±0.60a2.96±0.48a1.56±0.42b1.24±0.61b1.89±1.14b1.72±0.31b1.30±0.44bC18∶3 n-3(ALA)0.44±0.09b0.49±0.13a0.67±0.19a0.33±0.13b0.27±0.06b0.43±0.04b0.45±0.18b0.32±0.11bC20∶2 n-60.11±0.01b0.13±0.04a0.17±0.03a0.10±0.007b0.11±0.03b0.17±0.08a0.16±0.01a0.12±0.02bC20∶3 n-60.11±0.02b0.12±0.05b0.15±0.02b0.12±0.01b0.16±0.01b0.22±0.01a0.12±0.01b0.09±0.03bC20∶4 n-6―0.07±0.02a0.07±0.02a0.06±0.01a―0.06±0.01a0.04±0.01b―C20∶5 n-3(EPA)0.17±0.02b0.22±0.06a0.28±0.08a0.17±0.05b0.24±0.04a0.31±0.06a0.32±0.13a0.27±0.08aC22∶5 n-30.10±0.01b0.14±0.03a0.15±0.05a0.11±0.01b0.13±0.02a0.19±0.04a0.20±0.07a0.16±0.03aC22∶6 n-3(DHA)0.63±0.08b0.94±0.19a1.12±0.24a0.77±0.17b0.54±0.11b0.79±0.26b0.77±0.29b0.71±0.15bΣPUFA3.47±0.44b4.35±1.10a5.58±0.96a3.05±0.88b2.57±0.63b3.87±1.39b3.72±0.23b2.98±0.26bn-3ΣPUFA1.33±0.19b1.76±0.40a2.23±0.47a1.33±0.39b1.17±0.23b1.71±0.02a1.74 ±0.57a1.46 ±0.26b
注:“—”表示未检出
大西洋鲑和虹鳟不同部位间脂肪酸含量为虹鳟鱼皮和尾肌中ΣSFA、ΣMUFA和ΣPUFA含量显著低于腹肌、背肌(P<0.05),背肌和腹肌差异不显著(P>0.05);大西洋鲑ΣSFA、ΣMUFA和ΣPUFA含量在不同部位间分布无显著差异(P>0.05)。这可能与不同部位鱼肉组织组成有关,NANTON等[38]从组织学角度分析不同部位间脂肪酸含量差异,发现富含脂肪细胞的脂质存储组织含有更高比例的MUFA和n-3PUFA。此外,n-3PUFA在虹鳟和大西洋鲑中含量丰富,虹鳟背肌和腹肌中ALA[(0.49±0.13)~(0.67±0.19) g/100g]和DHA[(0.94±0.19)~(1.12±0.24)g/100g]显著高于大西洋鲑[ALA(0.43±0.04)~(0.45±0.18) g/100g,DHA(0.77±0.29)~(0.79±0.26) g/100g]。且2种鱼中的n-3ΣPUFA在背肌与腹肌间无显著差异(P>0.05),均显著高于尾肌和鱼皮(P<0.05)。本研究中养殖虹鳟和大西洋鲑中含有较高比例的n-3 PUFA,且以ALA和DHA为主,除了跟饲料组成密切相关,还有研究表明,鲑科鱼类可以将植物油中的ALA转化为EPA和DHA[39]。鲑鱼中的EPA和DHA含量比带鱼、小黄鱼和鲅鱼等海水鱼要高很多[40],由于中国的膳食结构和补充来源限制,目前中国人均DHA和EPA摄入量与国际推荐值差距较大,因此应增加每日膳食中DHA和EPA的摄入量,大西洋鲑和虹鳟可作为理想来源。
2.3.2 脂肪酸营养价值评价
由于脂肪酸对血清胆固醇和低密度脂蛋白胆固醇浓度有一定的影响,其能够促进或抑制动脉粥样硬化和冠状动脉血栓的形成[41]。因此,本研究计算了PI、IA和IT指数,PI指数表示多烯不饱和脂肪酸的氧化程度;IA是衡量动脉粥样硬化程度的重要指标;IT指数能够反映某物质致血栓风险的程度。由表4可以看出大西洋鲑和虹鳟的PI、IA和IT值无显著差异(P>0.05),且2种鱼不同部位间也无显著差异(P>0.05)。虹鳟[IA(0.15±0.04)~(0.19±0.03), IT(0.15±0.05)~(0.19±0.03)]和大西洋鲑[IA(0.23±0.01)~(0.27±0.08),IT(0.16±0.03)~(0.18±0.03)]小于其他肉类及水产品,如养殖大黄鱼[IA(0.60±0.09),IT(0.54±0.04)][20]、乳羊(IA 1.3~1.7、IT 1.7~2.0)[41]和禽蛋(IA 0.27~0.41、IT 0.83~1.08)[42],说明食用大西洋鲑和虹鳟致动脉粥硬化和致血栓风险程度较小,为健康饮食推荐来源之一。
表4 大西洋鲑和虹鳟脂肪酸组成评价
Table 4 Evaluation of fatty acid composition of Oncorhynchus mykiss and Salmo salar
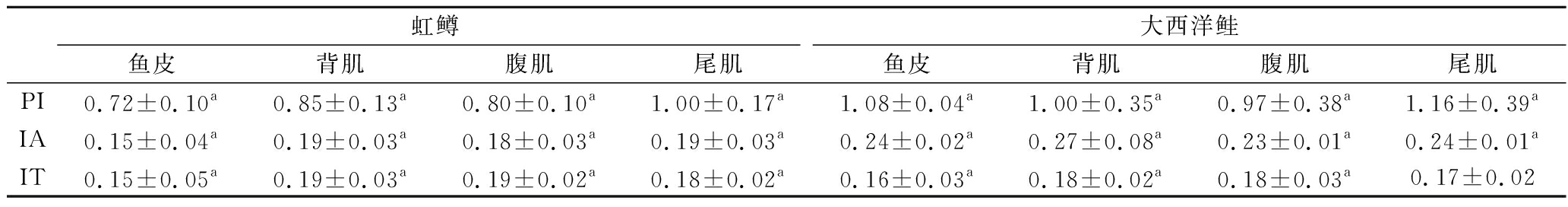
虹鳟大西洋鲑鱼皮背肌腹肌尾肌鱼皮背肌腹肌尾肌PI0.72±0.10a0.85±0.13a0.80±0.10a1.00±0.17a1.08±0.04a1.00±0.35a0.97±0.38a1.16±0.39aIA0.15±0.04a0.19±0.03a0.18±0.03a0.19±0.03a0.24±0.02a0.27±0.08a0.23±0.01a0.24±0.01aIT0.15±0.05a0.19±0.03a0.19±0.02a0.18±0.02a0.16±0.03a0.18±0.02a0.18±0.03a0.17±0.02
注:同行数据肩标不同小写字母表示差异显著(P<0.05)
3 结论
综上所述,虹鳟和大西洋鲑肌肉中的虾青素以游离态全反式结构存在,鱼皮存在游离态和酯态虾青素。大多数大西洋鲑和虹鳟肌肉中的虾青素立体异构体组成与化学合成来源的虾青素一致,由此可推断养殖饲料中主要以添加化学合成来源的虾青素为主。经验证,SC/T 3053—2019适用于大西洋鲑和虹鳟中虾青素含量的测定,虾青素在尾肌中含量最高,背肌和腹肌次之,鱼皮中含量最低。与大西洋鲑相比,虹鳟肌肉中的虾青素含量相对较高。
虹鳟腹肌和背肌中ΣSFA、ΣMUFA和ΣPUFA含量均显著高于大西洋鲑。大西洋鲑不同部位间ΣSFA、ΣMUFA和ΣPUFA无显著差异,而虹鳟背肌和腹肌显著高于尾肌和鱼皮。它们均富含n-3PUFA,包括ALA、EPA和DHA,且均为背肌和腹肌显著高于尾肌和鱼皮。2种鱼PI、IA和IT值无显著差异,且不同部位间也无显著差异。
虾青素和n-3PUFA组合作为补充剂,对人体健康非常有益。且虾青素、脂肪酸组成和含量可作为评价鲑鳟鱼品质的关键指标。本研究结果既有助于消费者充分了解大西洋鲑和虹鳟不同部位间营养品质的差异,又为它们分部位加工和副产品开发提供了基础资料和数据支撑。
[1] 潘卓, 林洪.冰温保鲜和冷藏保鲜对生食大西洋鲑品质影响的比较研究[J].食品安全质量检测学报, 2019, 10(8):2 232-2 239.
PAN Z, LIN H.Comparative research on the effect of controlled freezing-point storage preservation and cold storage preservation on the quality of raw Salmo salar[J].Journal of Food Safety and Quality Inspection, 2019, 10(8):2 232-2 239.
[2] 柳阳, 李勇, 高婷婷, 等.脂肪和蛋白质营养对封闭循环水养殖大西洋鲑生长和肌肉品质的效应[J].海洋科学, 2013, 37(6):47-59.
LIU Y, LI Y, GAO T T, et al.The effects of dietary protein and fat on growth and flesh quality of Atlantic salmon (Salmon salar L.) in the recirculating aquaculture system[J].Marine Science, 2013, 37(6):47-59.
[3] 王炳谦. 中国鲑鳟鱼养殖[M].北京:中国农业出版社, 2015.
WANG B Q.Chinese Salmon and Trout Farming[M].Beijing:China Agricultural Press, 2015.
[4] 孙大江, 王炳谦.鲑科鱼类及其养殖状况[J].水产学杂志, 2010, 23(2):56-63.
SUN D J, WANG B Q.Aquaculture of Salmonids in China[J].Journal of Fisheries Science, 2010, 23(2):56-63.
[5] 农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会编制.中国渔业统计年鉴2018[M].北京:中国农业出版社, 2018:17-25.
Fisheries and Fisheries Administration of the Ministry of Agriculture and Rural Affairs, National Fisheries Technology Extension Station, China Fisheries Society.China Fishery Statistics Yearbook 2018[M].Beijing:China Agriculture Press, 2018:17-25.
[6] 周露, 丁清龙, 杨晨, 等.双重实时荧光PCR法鉴别大西洋鲑鱼和虹鳟鱼[J].食品安全质量检测学报, 2019(13):4 145-4 151.
ZHOU L, DING Q L, YANG C, et al.Simultaneous identification of Salmo salar and Oncorhynchus mykiss by dual real-time PCR[J].Journal of Food Safety and Quality Inspection, 2019(13):4 145-4 151.
[7] 张殿福, 吴雷, 张学振,等.大西洋鲑、三倍体虹鳟、金鳟的肌肉营养成分与品质特性分析[J].中国水产科学, 2020, 27(2):186-194.
ZHANG D F, WU L, ZHANG X Z, et al.Analysis of nutrient components and texture profiles in the flesh of Atlantic salmon, triploid rainbow trout, and golden trout[J].Journal of Fishery Sciences of China, 2020, 27(2):186-194.
[8] BLANCHET C, LUCAS M, JULIEN P, et al.Fatty acid composition of wild and farmed Atlantic salmon (Salmo salar) and rainbow trout (Oncorhynchus mykiss)[J].Lipids, 2005, 40(5):529-531.
[9] SAW C L L, YANGA Y, GUO Y, et al.Astaxanthin and omega-3 fatty acids individually and in combination protect against oxidative stress via the Nrf2-ARE pathway[J].Food & Chemical Toxicology, 2013, 62:869-875.
[10] MARELO P B, DOUGLAS P M, ANAYSA P B, et al.Combined astaxanthin and fish oil supplementation improves glutathione-based redox balance in rat plasma and neutrophils[J].Chemico-Biological Interactions.2012, 197(1):58-67.
[11] LEITE M F, LIMA A M, OTTON R.Combination of astaxanthin and fish oil supplementation alters antioxidant enzyme profile of dental pulp tissue[J].International Endodontic Journal, 2012, 45(12):1 109-1 115.
[12] FASSETT R G, COOMBES J S.Astaxanthin, oxidative stress, inflammation and cardiovascular disease[J].Future Cardiology, 2009, 5(4):333-342.
[13] 姜燕蓉, 刘锴锴, 齐筱莹, 等.虾青素的生物功效及其运载体系的研究现状[J].食品与发酵工业, 2019, 45(13):250-256.
JIANG Y R, LIU K K, QI X Y, et al.Biological activities and delivery systems of astaxanthin[J].Food and Fermentation Industry, 2019, 45(13):250-256.
[14] CHITCHUMROONCHOKCHAI C, FAILLA M L.Bioaccessibility and intestinal cell uptake of astaxanthin from salmon and commercial supplements[J].Food Research International, 2016, 99(2):936-943.
[15] OSTERLIE M, BJERKENG B, LIAAEN-JENSEN S.Accumulation of astaxanthin all-E, 9Z and 13Z geometrical isomers and 3 and 3′RS optical isomers in rainbow trout (Oncorhynchus mykiss) is selective[J].Journal of Nutrition, 1999, 129(2):391-398.
[16] 中华人民共和国农业农村部. SC/T 3053—2019 水产品及其制品中虾青素的测定 高效液相色谱法[S].北京:中国标准出版社, 2019.
Ministry of Agriculture and Rural Affairs of the People′s Republic of China.SC/T 3053—2019 Determination of astaxanthin in aquatic products and their products high performance liquid chromatography[S].Beijing:China Agricultural Press, 2019.
[17] 丛心缘, 孙伟红, 张辉珍,等.南极磷虾中不同形态虾青素的分离制备、结构鉴定及含量分析[J].食品与发酵工业, 2019, 45(2):178-182.
CONG X Y, SUN W H, ZHANG H Z, et al.Separation, structure identification and content analysis of different forms of astaxanthin in Antarctic krill[J].Food and Fermentation Industries, 2019, 45(2):178-182.
[18] 杨澍, 张婷, 徐杰, 等.高效液相色谱手性拆分法分析生物体内虾青素立体异构体[J].食品科学, 2015, 36(8):139-144.
YANG S, ZHANG T,XU J, et al.Chiral separation and analysis of astaxanthin stereoisomers in biological organisms by high-performance liquid chromatography[J].Food Science, 2015, 36 (8):139-144.
[19] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局.GB 5009.168—2016 食品中脂肪酸的测定[S].北京:中国标准出版社, 2017.
National Health and Family Planning Commission of the People′s Republic of China, State Food and Drug Administration.GB 5009.168—2016 Determination of fatty acids in food[S].Beijing:China Agricultural Press, 2017.
[20] 李松, 郭全友, 李保国,等.养殖模式和饵料对养殖大黄鱼体色、质构和营养成分评价的影响[J].食品与发酵工业, 2019, 45(21):118-125.
LI S, GUO Q Y, LI B G, et al.Evaluation of culture mode and feed on body color, texture and nutritional composition of cultured Pseudosciaena crocea[J].Food and Fermentation Industries, 2019, 45(21):118-125.
[21] 张娟娟, 李小勤, 冷向军, 等.虾青素在虹鳟体内的沉积与降解研究[J].水产学报, 2012, 36(12):1 872-1 879.
ZHANG J J, LI X Q, LENG X J, et al.The study of deposition and degradation of astaxanthin on rainbow trout (Oncorhynchus mykiss)[J].Journal of Fisheries of China, 2012, 36(12):1 872-1 879.
[22] BAKER R T M, PFEIFFER A M, SCHONER F J, et al.Pigmenting efficacy of astaxanthin and canthaxanthin in fresh-water reared Atlantic salmon, Salmo salar[J].Animal Feed Science and Technology, 2002, 99(1):99-106.
[23] MARCH B E, MACMILLAN C.Muscle pigmentation and plasma concentrations of astaxanthin in rainbow trout, Chinook salmon, and Atlantic salmon in response to different dietary levels of astaxanthin[J].The Progressive Fish-Culturist, 1996, 58(3):178-186.
[24] BJERKENG B. Carotenoid pigmentation of salmonid fishes-recent progress[C]. Proceedings of the 5th International Conference on aquatic nutrition. Yucatán: 2000.
[25] 刘合露, 郑怀平, 张涛,等.海产动物体内虾青素的代谢及转运沉积[J].海洋科学, 2010(4):104-108.
LIU H L, ZHENG H P, ZHANG T, et al.Metabolism, transportation and deposition of astaxanthin in marine animals[J].Marine Sciences, 2010(4):104-108.
[26] MORETTI V M, MENTASTI T, BELLAGAMBA F, et al.Determination of astaxanthin stereoisomers and colour attributes in flesh of rainbow trout (Oncorhynchuss mykiss) as a tool to distinguish dietary pigmentation source[J].Food Additives & Contaminants, 2006, 23(11):1 056-1 063.
[27] TANGERAS A, SLINDE E.Coloring of Salmonids in Aquaculture:The Yeast Phaffiarhodozyma as A Source of Astaxanthin[M].Fisheries Processing, 1994:391-431
[28] 张瑞莲. 左旋、右旋及外消旋虾青素抗脂质过氧化活性差异的研究[D].广州:华南农业大学, 2016.
ZHANG R L.Differences in anti-lipid peroxidation activity of L-, D- and racemic astaxanthin[D].Guangzhou:South China Agricultural University, 2016.
[29] LORENZ R T, CYSEWSKI G R.Commercial potential for Haematococcus microalgae as a natural source of astaxanthin[J].Trends in biotechnology, 2000, 18(4):160-167
[30] OSTERLIE M, BJERKENG B, LIAAEN-JENSEN S.Accumulation of astaxanthin all-E, 9Z and 13Z geometrical isomers and 3 and 3′RS optical isomers in rainbow trout (Oncorhynchus mykiss) is selective[J].Journal of Nutrition, 1999, 129(2):391-398.
[31] 王萍, 张银波, 江木兰.多不饱和脂肪酸的研究进展[J].中国油脂, 2008, 33(12):42-46.
WANG P, ZHANG Y B, JIANG M L.Research advance in polyunsaturated fatty acid[J].China Oils and Fats, 2008, 33(12):42-46.
[32] 肖玫, 欧志强.深海鱼油中两种脂肪酸(EPA和DHA)的生理功效及机理的研究进展[J].食品科学, 2005, 26(8):522-526.
XIAO M, OU Z Q.Research progress of the physiological function and mechanism of two kinds of fatty acid (EPA and DHA) in the fish oil of deep sea[J].Food Science, 2005, 26(8):522-526.
[33] TORSTENSEN B E, FRØYLAND L, LIE Ø.Replacing dietary fish oil with increasing levels of rapeseed oil and olive oil - effects on Atlantic salmon (Salmo salar L.) tissue and lipoprotein lipid composition and lipogenic enzyme activities[J].Aquaculture Nutrition, 2004, 10(3):175-192.
[34] TORSTENSEN B E, FRØYLAND L, ØRNSRUD R, et al.Tailoring of a cardioprotective muscle fatty acid composition of Atlantic salmon (Salmo salar) fed vegetable oils[J].Food Chemistry, 2004, 87(4):567-580.
[35] KOSKELA J, PIRHONEN N J, JOBLING M.Feed intake, growth rate and body composition of juvenile Baltic salmon exposed to different constant temperatures[J].Aquaculture International, 1997, 5(4):351-360.
[36] TURCHINI G M, TORSTENSEN B E.Fish oil replacement in finfish nutrition[J].Reviews in Aquaculture, 2009, 1(1):10-57.
[37] MURILLOE, RAOKS, DURANTAA.The lipid content and fatty acid composition of four eastern central Pacific native fish species[J] Journal of Food Composition and Analysis, 2014, 33(1):1-5.
[38] NANTON D A, VEGUSDAL A, RR A M B, et al.Muscle lipid storage pattern, composition, and adipocyte distribution in different parts of Atlantic salmon(Salmo salar) fed fish oil and vegetable oil[J].Aquaculture-Amsterdam, 2007, 265(1-4):230-243.
[39] TURCHINI G M, FRANCIS D S, KEAST R S J, et al.Transforming salmonid aquaculture from a consumer to a producer of long chain omega-3 fatty acids[J].Food Chemistry, 2011, 124(2):609-614.
[40] 祖丽亚, 罗俊雄, 樊铁.海水鱼与淡水鱼脂肪中EPA、DHA含量的比较[J].中国油脂, 2003, 28(11):48-50.
ZU L Y, LUO J X, FAN T.Comparison of EPA and DHA content in several sea fishes and fresh water fishes[J].China Oils and Fats, 2003, 28(11):48-50.
[41] VACCA G M, CARCANGIU V, DETTORI M L, et al.Productive performance and meat quality of Mouflon×Sarda and Sarda×Sarda suckling lambs[J].Meat Science, 2008, 80(2):326-334.
[42] 王庆玲, 王宁, 詹萍, 等.禽蛋脂质脂肪酸组成评价及指纹图谱的构建[J].中国食品学报, 2017, 17(12):271-277.
WANG Q L, WANG N, ZHAN P, et al.Construction and evaluation of fingerprint on fatty acids composition of poultry eggs lipids[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(12):271-277.