丙酸(propionic acid)及其盐类[1-2]具有抑制微生物增殖和杀灭微生物的作用,常以丙酸钙或丙酸钠的形式用于食品防腐和防霉。糕点是富含蛋白质、淀粉、脂肪与糖类的食品[3],丙酸钙在糕点制作过程中易与原料均匀混合,使用尤其普遍[4]。然而丙酸摄入过量,易患肥胖症和糖尿病,食品安全国家标准GB 2760—2014规定糕点中丙酸及其盐类使用限量不超过2.5 g/kg(以丙酸计)[5]。食安通食品抽检与信息分析数据显示,近5年糕点中丙酸及其盐类超标导致不合格的事件时有发生。
食品中丙酸及其盐类测定的样品前处理主要采用直接浸提[6]、蒸馏提取[7]、液液萃取(溶剂提取)[8]、固相萃取[9]、沉淀法[10]等方法。糕点中蛋白质、脂肪、淀粉、糖类的含量较高,单一的液液萃取或者固相萃取无法完全去除蛋白质与脂肪。沉淀法去蛋白难以排除脂肪和其他添加剂(色素、甜味剂)的干扰,酸化、水蒸气蒸馏法对蒸馏仪器要求高,且水溶液直接进样容易造成气相色谱衬管过载或色谱柱损坏。目前,针对丙酸的测定方法主要有离子色谱法[11]、高效液相色谱法[12-13]、气相色谱法[14-16]、气相色谱串联质谱法(GC-MS)[17-18]。离子色谱法前处理过程复杂,测定中易损失目标物。高效液相色谱法需利用214 nm末端吸收检测,容易受基质干扰,灵敏度不高。气相色谱法具有较高灵敏度,但是定性分析与抗干扰能力较弱。因此,开发一种针对糕点中丙酸及其盐类的简便、准确的检测方法具有重要意义。酶解法[19-20]在应对蛋白类或淀粉类样品中有广泛应用,液液萃取是传统的前处理手段,通过调节pH值控制易电离化合物的化学形态,可以有效控制目标物的相间转移,同时去除基质干扰(添加剂、糖类等极性杂质)。GC-MS具有全扫描与选择离子监测工作模式,具有较好的定性与定量分析能力[21-22]。本研究采用淀粉酶-蛋白酶双酶解样品,乙醚去除脂肪等非极性杂质,调节pH值控制丙酸形态转换并结合液液萃取、净化,建立抗干扰强、高灵敏度的GC-MS检测方法,满足当前糕点中丙酸及其盐类的检测需求,为食品中添加剂残留监管提供技术支撑。
1 材料与方法
1.1 材料与试剂
丙酸(纯度99.5%),德国Dr.Ehrenstorfer公司;木瓜蛋白酶(酶活力≥2 400 U/g),北京百灵威技术有限公司;乙酸乙酯、乙醚、石油醚、正己烷(色谱纯),美国Fisher;磷酸、硫酸、盐酸、甲酸、乙酸(分析纯)、α-淀粉酶(酶活力≥3 700 U/g),国药集团化学试剂有限公司;磷酸氢二钠、氯化钠、氢氧化钠(分析纯),广州化学试剂厂;实验用水(一级水),美国Milli-Q超纯水系统制备(18.2 MΩ/cm);实验用糕点,市售。
1.2 仪器与设备
7890A-5975C气相色谱-质谱联用仪,美国Agilent公司;UW6200H分析天平,日本Shimadzu公司;CP225D分析天平,德国Sartorius公司;S470-B多功能pH 测试仪,瑞士METTLER TOLEDO公司;SW22恒温水浴装置,德国Julabo公司;MS3 digital旋涡混合器,德国IKA公司;Multi Reax涡旋振荡器,德国Heidolph公司;Allegra X-30R离心机,美国BECKMAN公司;Milli-Q超纯水系统,美国Millipore 公司。
1.3 实验方法
1.3.1 标样配制
准确称取10 mg丙酸标准品,采用乙酸乙酯溶解并定容至10 mL容量瓶中,制成丙酸标准储备液,于4 ℃ 冷藏保存,准确移取1 mL丙酸标准储备液(1 mg/mL)于10 mL容量瓶中,乙酸乙酯定容,制成丙酸标准使用液(100 μg/mL),于4 ℃冷藏保存,备用。
分别移取0.01、0.05、0.5、1和2 mL的丙酸标准使用液(100 μg/mL)于5个10 mL容量瓶中,乙酸乙酯定容、摇匀,得0.10、0.50、5.0、10和20 μg/mL的标准曲线溶液。
1.3.2 样品制备
取代表性样品约500 g,装入洁净容器并密封,于4 ℃冷藏保存。
1.3.3 酶解
称取2.50 g样品于50 mL离心管,加入15 mL磷酸氢二钠-磷酸缓冲溶液[50 mmol/L,pH值为(6.0±0.2)]溶解样品,加入1.0 mL混合酶溶液(终浓度为质量分数5%的α-淀粉酶和木瓜蛋白酶),旋涡混合5 min,37 ℃恒温水浴振摇40 min,得到样品酶解液。
1.3.4 样品的提取与净化
样品酶解液中加入0.6 mL 0.4 mol/L NaOH溶液,振摇30 min,加入1.0 g NaCl及20.0 mL乙醚,迅速旋涡混合5 min,摇匀后静置分层,8 000 r/min离心2 min,去上层乙醚,保留下层溶液。
下层溶液中加入0.4 mL磷酸(使溶液pH<4),振摇2 min,得酸化溶液。
上述酸化溶液中加入10 mL乙酸乙酯,振摇2 min,8 000 r/min离心2 min,收集有机相至容量瓶中,残渣加入10 mL乙酸乙酯,重复提取1次,合并2次萃取液至25 mL容量瓶中,加入乙酸乙酯定容,经0.22 μm滤膜过滤,气相色谱质谱系统测定。
1.3.5 气相色谱串联质谱条件
(1)色谱条件:DB-WAX毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气及流速:氦气(纯度99.999%),流速1.0 mL/min;进样口温度220 ℃;程序升温:初始温度80 ℃,保持2 min,以10 ℃/min 升至200 ℃后,保持1 min,再以20 ℃/min 升至220 ℃,保持0 min,共16 min;分流进样(40∶1),进样量1 μL。
(2)质谱条件:离子源类型:电子轰击源(EI);扫描方式:选择离子模式(SIM);电离方式:EI;电离能量:70 eV;离子源温度(TEM):230 ℃;MS四级杆温度150 ℃;溶剂延迟 5 min。
(3)离子选择参数:质谱定性分析离子为m/z 45、55、57、73,定量分析离子为m/z 74。
1.3.6 数据处理
将GC-MS中得到的化合物的质谱图与美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)数据库进行对比,将匹配度>80%的化合物作为暂定结果,然后采用NIST MS Search 2.0 标准谱库相匹配检索定性,当正反匹配度均>800(最大值为1 000)时,确定化合物的类型,通过外标法计算丙酸含量。
采用Excel 2016进行数据整理、分析,并绘制图表。
2 结果与分析
2.1 样品前处理方法的优化与建立
2.1.1 酶解时间的优化
样品中的淀粉含有大量的羟基、蛋白表面电荷会对丙酸产生静电吸附,导致丙酸第一步碱化萃取时萃取效果下降,直接影响最终浓度。因此,本实验中酶解效果以丙酸测定浓度进行判断(所有样品经检测均为阳性)。结果表明,在0~120 min内不同类型糕点中检测到丙酸的浓度随着酶解时间的延长有不同程度的增加;当酶解时间为40 min时,丙酸的检测浓度趋于稳定(图1),推断淀粉、蛋白质已酶解完全。本实验优化后的萃取时间为40 min。
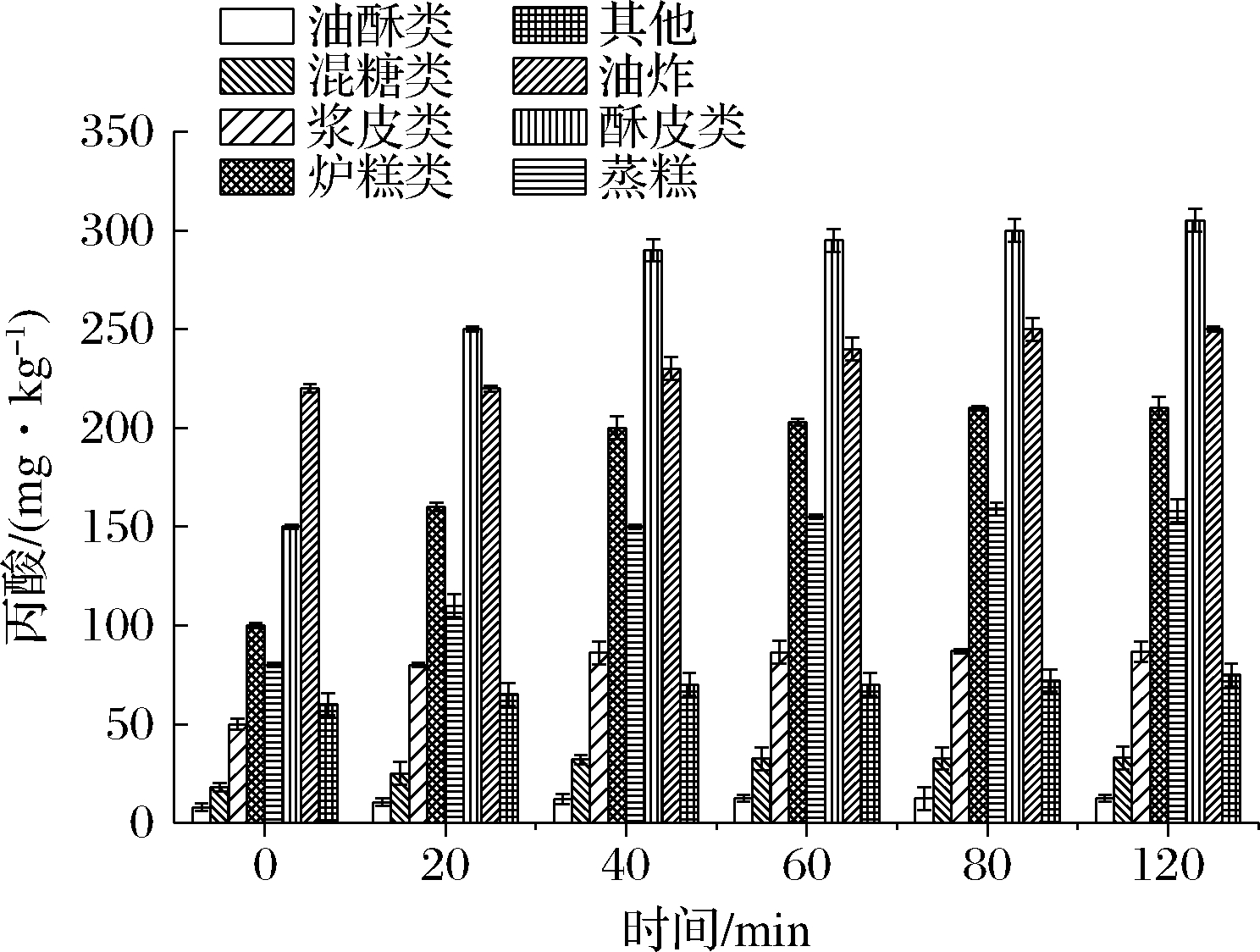
图1 酶解时间的优化(n=3)
Fig.1 Optimization of enzymolysis time (n=3)
2.1.2 pH值的优化
由于丙酸为弱酸性,丙酸在水溶液中的解离平衡常数(pKa)为5.001 9[23],强碱时极不稳定,油/水分配系数随pH的增大而降低。本文通过提高水溶液 pH 值,使丙酸成盐而降低溶解性,达到去除脂肪的目的,再降低水溶液 pH 值,增加丙酸在乙酸乙酯的溶解性,并减少水溶性杂质引入,达到提取丙酸的目的。当pH>pKa+2=7时,形成丙酸解离状态,随着pH的降低,当pKa-2
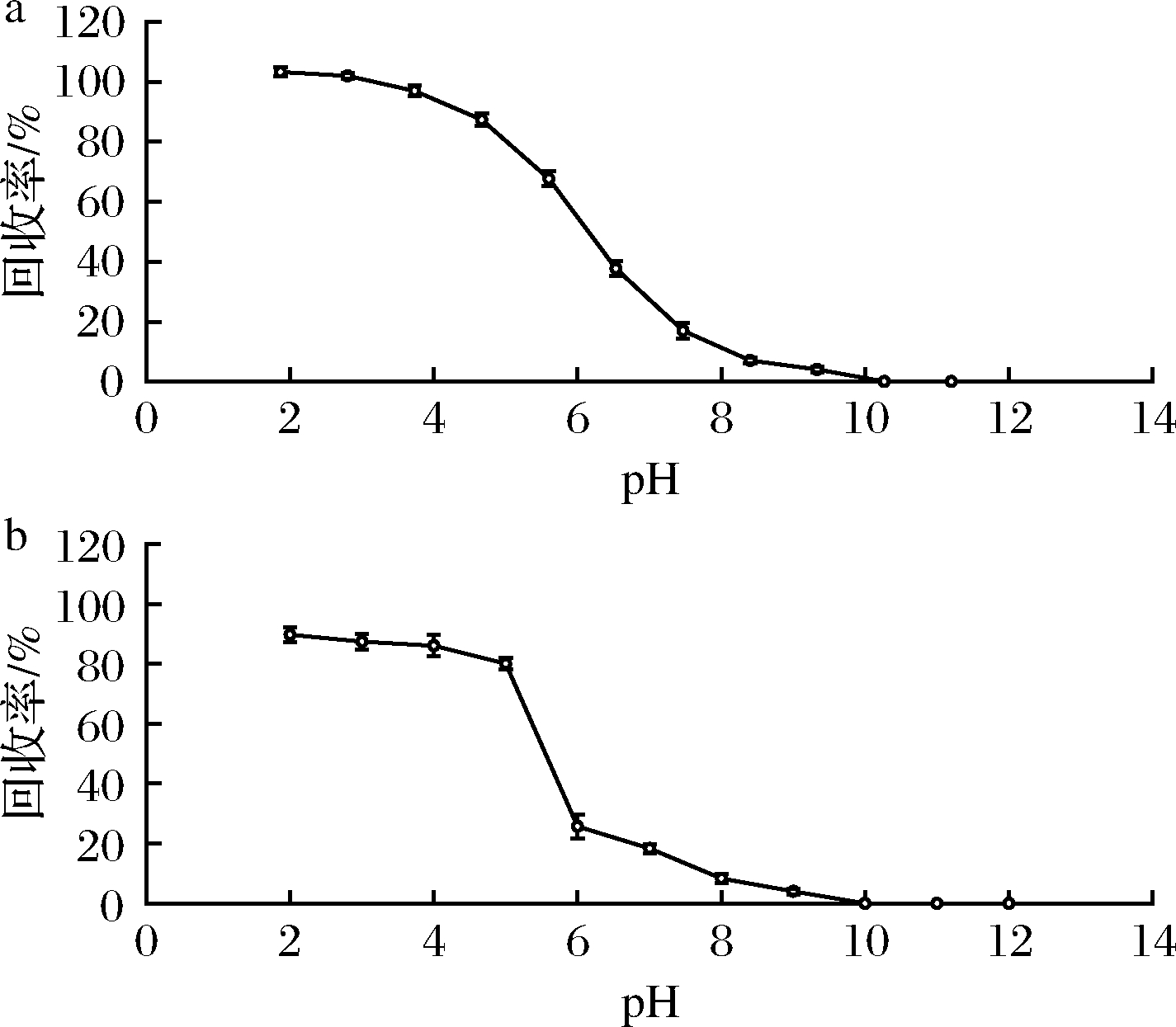
a-乙醚;b-乙酸乙酯
图2 pH值对乙醚和乙酸乙酯提取效率的影响(n=3)
Fig.2 Effect of pH value on extraction efficiency of ether
and ethyl acetate (n=3)
2.1.3 脱脂溶剂种类和用量的选择
本文采取的是溶剂脱脂法,考察选取一种与脂肪性质相似溶剂浸入酶解的水溶液中以除去脂肪。试验结果表明,当糕点脂肪提取百分率<15%,所选3种脱脂溶剂的脱脂效果基本相同。但是,当糕点脂肪提取百分率>15%,乙醚提取的脂肪含量较高,整体有机溶剂脱脂效果为乙醚>石油醚=正己烷。尤其是含磷脂高或胶原蛋白高的样品(如蛋挞),乙醚提取脂肪的效果优于石油醚或正己烷。主要原因可能是石油醚与正己烷的极性指数相同(P=0.1),乙醚的极性指数较大(P=2.8),只有极性较大的乙醚能够渗透入含有胶原蛋白较多的乳化水溶液中提取脂肪,也只有乙醚能较好溶解极性磷脂等物质(图3)。
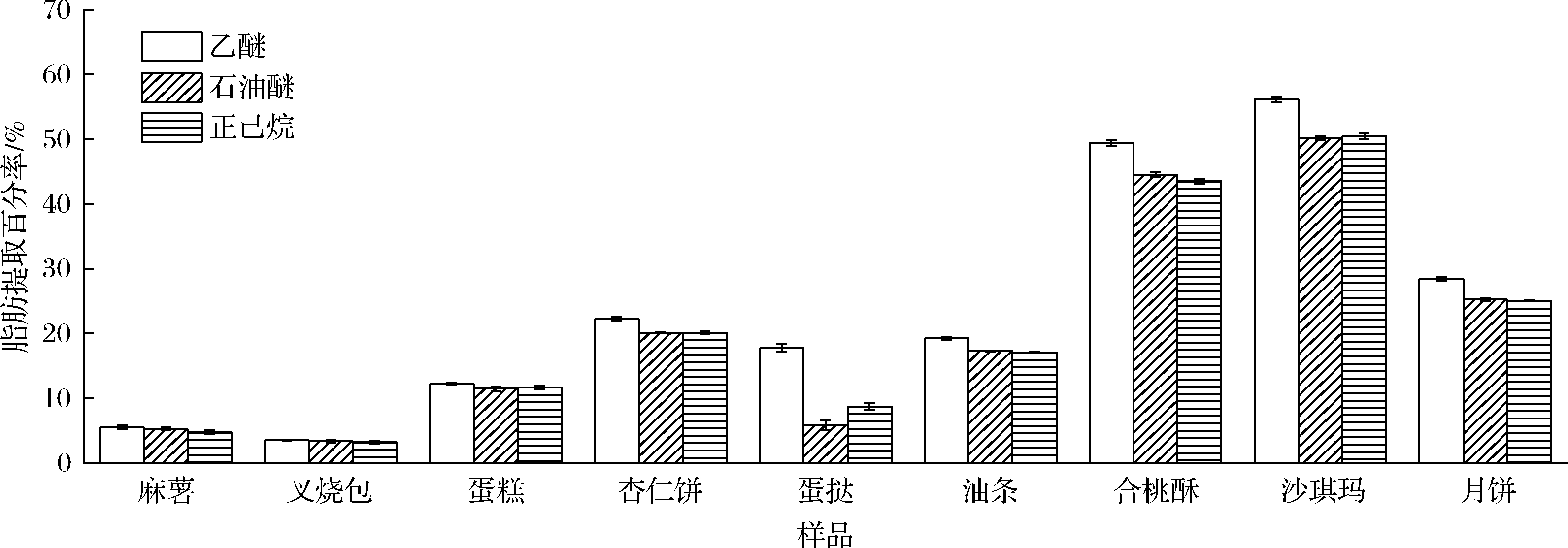
图3 脱脂溶剂的选择(n=3)
Fig.3 Selection of degreasing solvent (n = 3)
在对不同脂肪含量糕点的脂肪提取试验中,脂肪提取百分率随着乙醚量增加而升高,当乙醚的用量≥20 mL时,不同脂肪含量糕点的脂肪提取百分率基本趋于一致,接近糕点中脂肪的含量,说明试验使用20 mL 乙醚可以对不同脂肪含量的糕点达到脱脂效果(图4)。
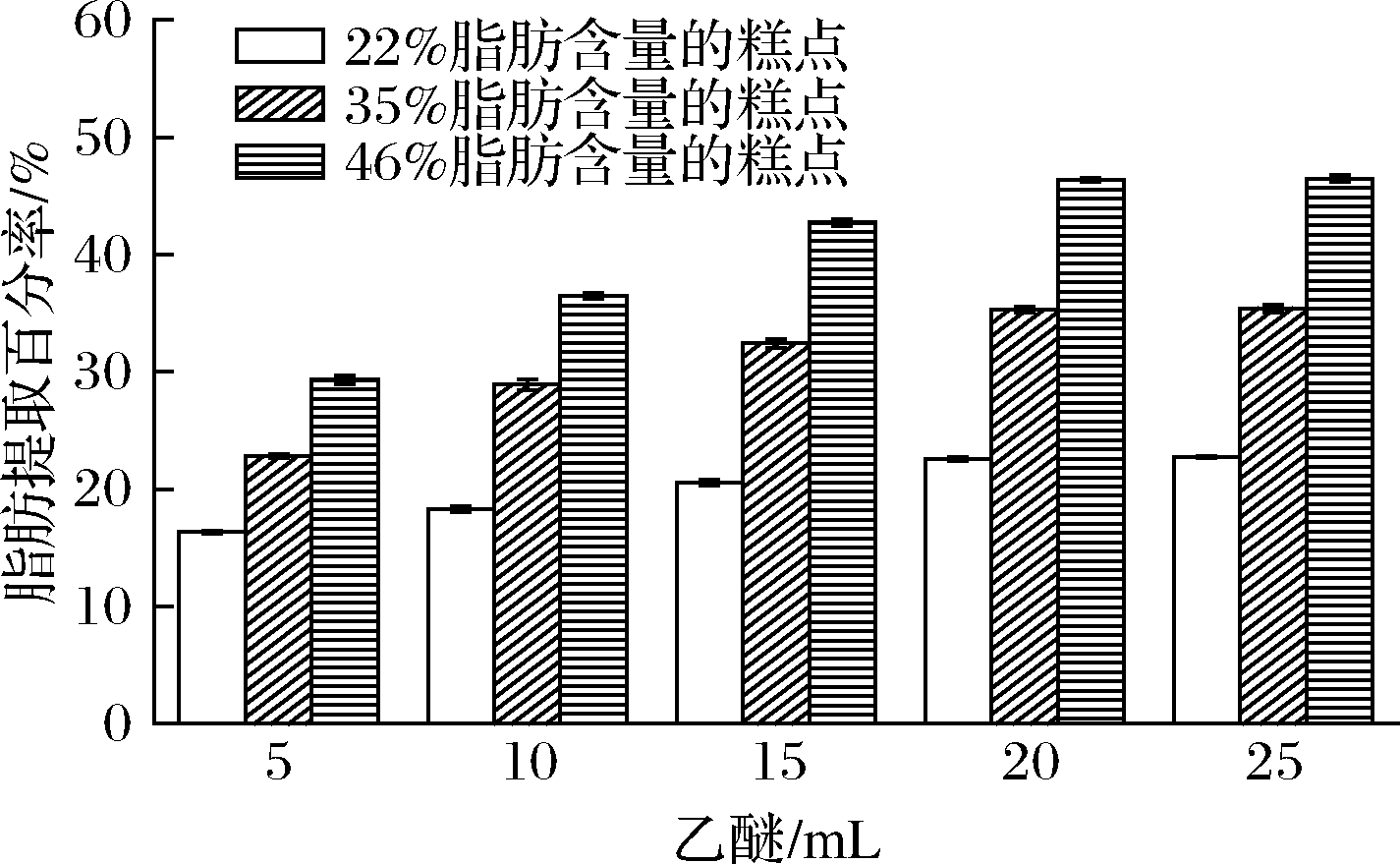
图4 不同脂肪含量糕点中乙醚用量的优化(n=3)
Fig.4 Optimization of the amount of ether in cakes with different fat content(n=3)
2.1.4 酸化试剂的选择
调节溶液的pH值<4.0,使丙酸处于非电离状态,在有机相液液萃取时能完全进入到有机相中。甲酸和乙酸的pKa分别为3.74、4.74,调节溶液pH时用量约为2.0 mL,磷酸的pKa为1.52、盐酸、硝酸、硫酸的pKa均<1,用量均为0.4 mL。结果如图5所示,甲酸、乙酸等有机酸会干扰丙酸的测定,推断其原因可能是:甲酸、乙酸与丙酸结构相似,存在加减整数倍CH2质量分数(14),且在选择离子模式状态下,分子离子容易断裂产生相似的碎片离子从而干扰丙酸的定量;甲酸和乙酸的加入量较大,有一部分会以分子形态进入到有机相中,且属于易挥发酸,会干扰到目标物的检测。磷酸、盐酸、硝酸、硫酸等无机酸干扰较小,4种无机酸的酸化效果相差不大。考虑到磷酸的无强氧化性、无强腐蚀性、安全性和弱干扰性,试验选择磷酸为酸化试剂。
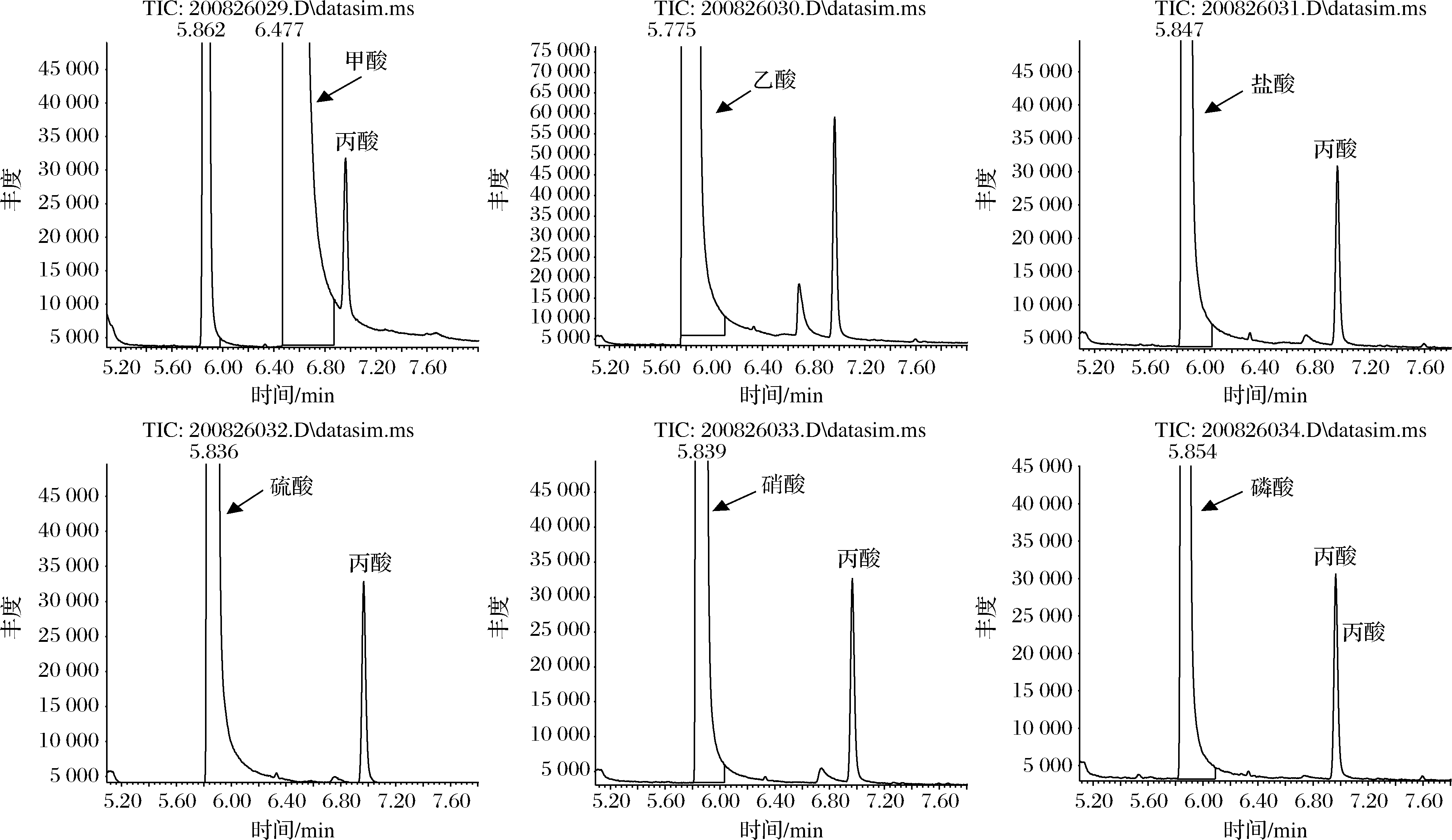
图5 不同酸化试剂的优化
Fig.5 Optimization of different acidifying reagents
2.2 色谱柱的选择和色谱质谱条件优化
丙酸属于极性物质,试验考察了HP-INNOWAX、DB-WAX、DS-FFAP色谱柱,结果表明DB-WAX色谱柱分离效果最好,丙酸峰型好,保留时间为7.00 min(图6)。采用全扫描模式对适宜浓度的标准溶液进行扫描,得到丙酸相对应的母离子保留时间,对其母离子进行碎片离子扫描,选择丰度较高的离子作为定量离子,另外4组作为定性离子[26],通过对色谱、质谱条件优化,选择丙酸质谱定性分析离子为m/z 45、55、57、73,定量离子为m/z 74(图7)。
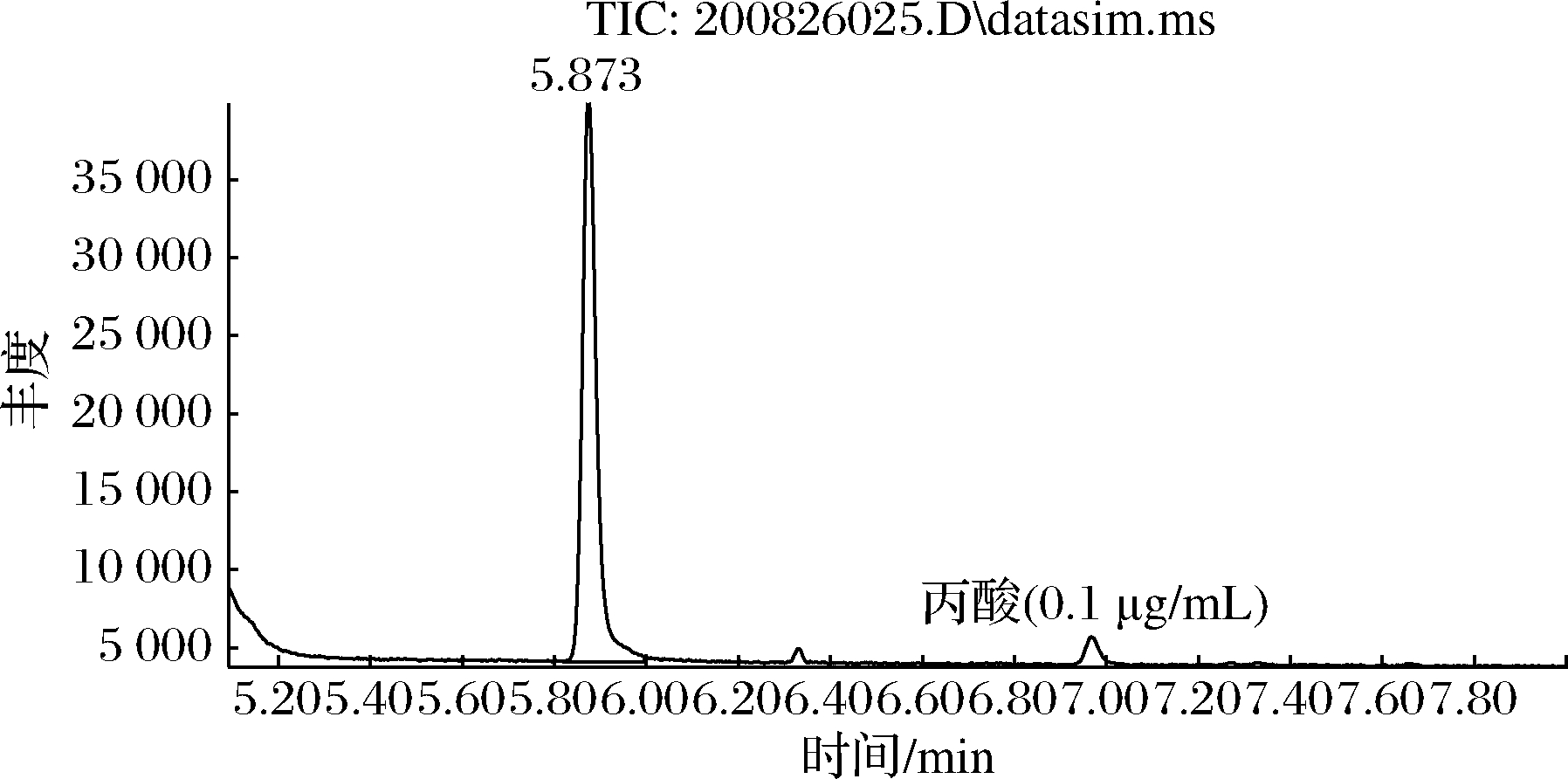
图6 标准物质谱图
Fig.6 The spectrum of standard
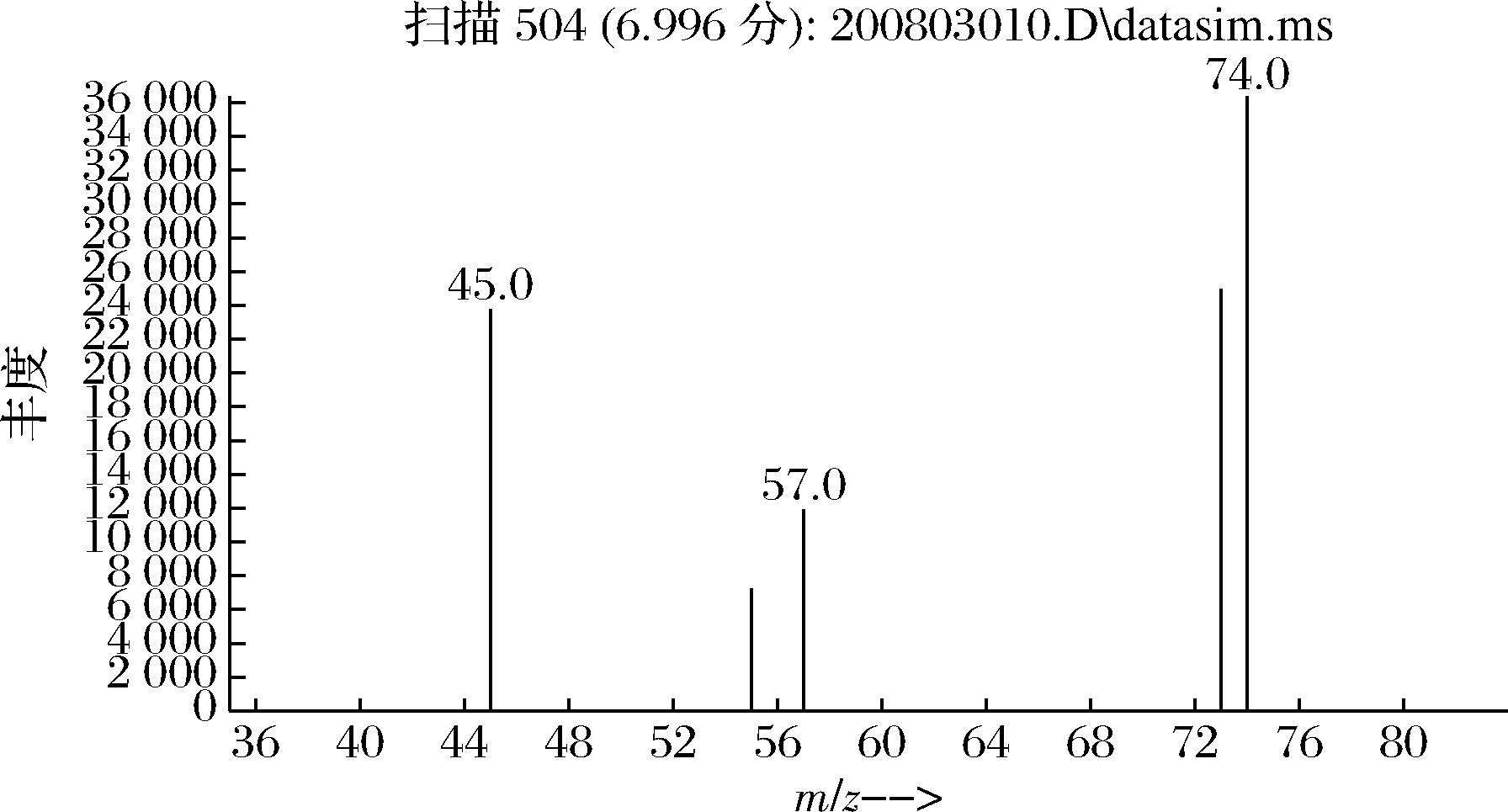
图7 丙酸的SIM 质谱图
Fig.7 The SIM mass spectrum of propionic acid
2.3 线性范围、检出限和定量限
按照1.3.5方法进行进样,按照1.3.1方法配制0.10、0.50、5.0、10和20 μg/mL标准曲线。选择已经确证的阴性样品加入丙酸标准品,计算3倍信噪比(S/N)所对应的样品质量浓度确定方法检出限。结果显示在0.100~20.0 μg/mL内浓度(y)与峰面积(x)的线性关系良好,对应线性方程为y =2 460x+302,相关系数r2 =1.000,检出限0.450 mg/kg。
2.4 回收率和精密度
选取8种类别的糕点样品(扣除本底值),在低(1.25 mg/kg)、中(12.5 mg/kg)、高(125 mg/kg)3个水平进行加标回收试验(n=6),并考察6次测定结果的相对标准偏差。结果如表1所示,平均回收率在83%~109%,相对标准偏差在1.76%~6.24%,表明方法准确可靠。
表1 加标回收率及精密度测试结果(n=6)
Table 1 Recovery and precision test results (n=6)
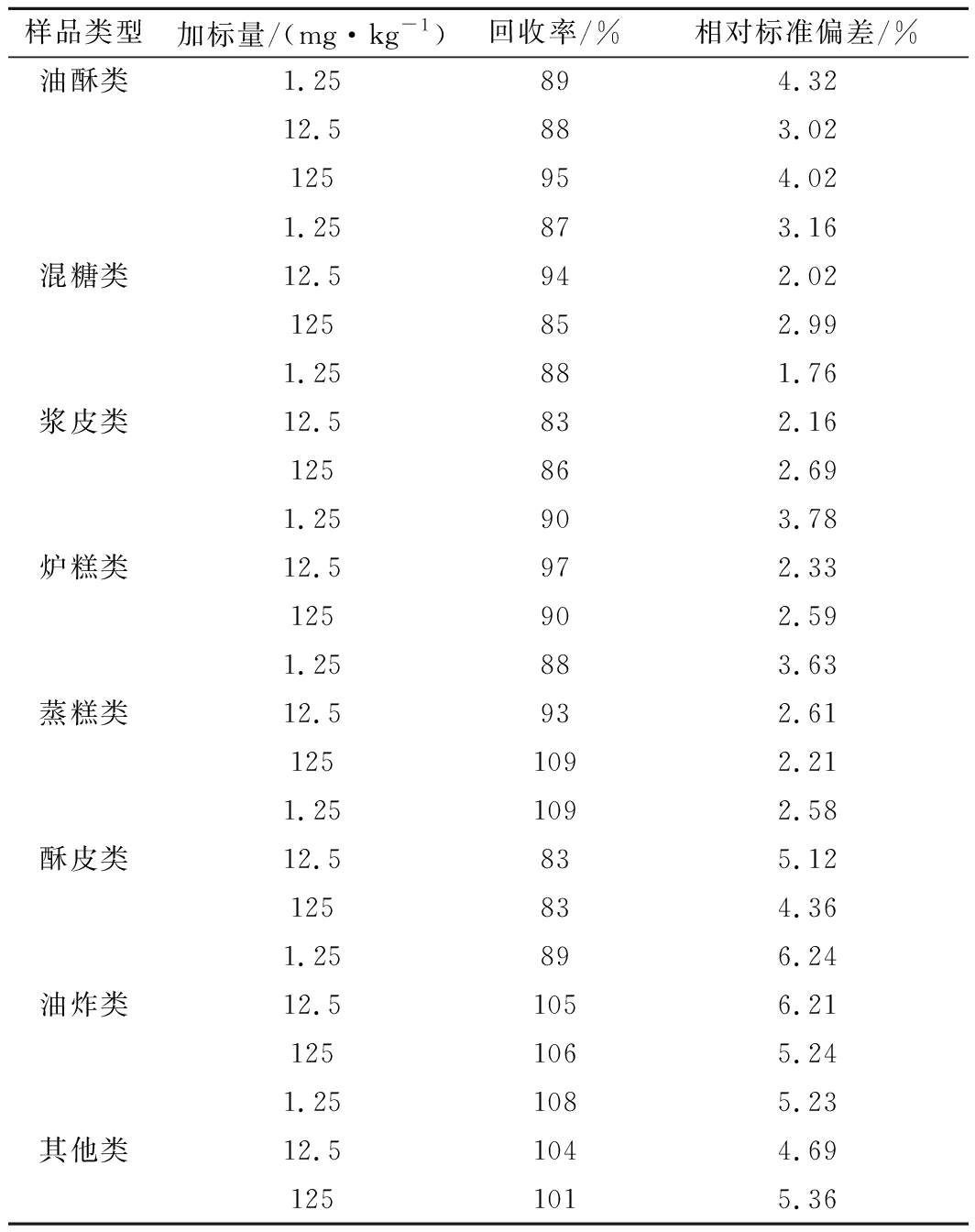
样品类型加标量/(mg·kg-1)回收率/%相对标准偏差/%油酥类1.25894.3212.5883.02125954.021.25873.16混糖类12.5942.02125852.991.25881.76浆皮类12.5832.16125862.691.25903.78炉糕类12.5972.33125902.591.25883.63蒸糕类12.5932.611251092.211.251092.58酥皮类12.5835.12125834.361.25896.24油炸类12.51056.211251065.241.251085.23其他类12.51044.691251015.36
2.5 实际样品的测定
抽取广州市不同区域市售糕点样品,采用本文所建立的方法进行测定。结果表明所测市售糕点样品的丙酸的含量在12.3~1 700 mg/kg(表2),均符合国家标准限量要求。
表2 实际样品测试结果(n=3)
Table 2 The detection results of real sample (n=3)

样品名称 含量/(mg·kg-1)相对标准偏差/%样品名称 含量/(mg·kg-1)相对标准偏差/%燕麦酥饼12.32.10抹茶吐司41.83.25燕麦光酥饼13.23.02汉堡44.72.51红枣蛋糕23.13.58面包47.24.26巴戟蛋糕32.14.52月饼51.65.38椰丝蛋糕47.15.16桃酥4815.14肉松小贝86.23.2豆腐饼5415.02罗松蛋糕13.22.58牛奶蛋糕98.21.25 果香味鸡腿汉堡13.45.26 黑糖丹麦吐司1 4122.08小龙虾汉堡33.52.11丹麦蛋糕1 5102.69 胚汉堡1 7002.54糖丹麦蛋糕5973.51
3 结论
目前,关于糕点中丙酸的质谱检测研究鲜有报道,针对糕点中丙酸检测的前处理方法研究也较少。本试验在前期研究基础上成功建立了测定糕点中丙酸含量的双酶解-液液萃取-气相色谱质谱分析方法。与现行方法相比,本研究所建立的前处理方法能有效去除蛋白质、脂肪等基质对检测信号的干扰,且操作简便、时间短、效率高,分析方法灵敏度高、选择性好、结果准确,能够满足糕点这种富含蛋白、脂肪样品中的丙酸残留检测需求,为糕点中丙酸的测定和质量监控提供新的技术补充。
[1] 闫克玉, 王岁楼.新型食品添加剂丙酸锌的制备及应用性能研究[J].食品与发酵工业,2002,28(6):1-4.
YAN K Y,WANG S L,et al.Preparation and application of zinc propionate as a new food additive[J].Food and Fermentation Industries,2002,28(6):1-4.
[2] 徐虹, 欧阳平凯,王莎莎.发酵法生产丙酸[J].食品与发酵工业,1997,23(6):62-65.
XU H,OUYANG P K,WANG S S,et al.Production of propionic acid by fermentation[J].Food and Fermentation Industries,1997,23(6):62-65.
[3] 中华人民共和国国家质量监督检验检疫局, 中国国家标准化管理委员会.GB/T 20997—2007 糕点通则[S].北京:中国标准出版社,2007.
State Administration of Quality Supervision,Inspection and Quarantine of the People′s Republic of China,China National Standardization Administration Committee.GB/T 20997—2007 General technical requirement for the pastry[S].Beijing:Standards Press of China,2007.
[4] 王瑞, 何涛.食品中的丙酸本底含量及产生机理研究进展[J].中国调味品,2015,40(9):104-106.
WANG R,HE T.Research progress of the intrinsic content of propionic acid in food and its generation mechanism[J].China Condiment,2015,40(9):104-106.
[5] 中华人民共和国国家卫生和计划生育委员会.GB 2760—2014 食品安全国家标准 食品添加剂使用标准[S].北京:中国标准出版社,2014.
State Health and Family Planning Commission of the People′s Republic of China.GB 2760—2014 National food safety standard for uses of food additives[S].Beijing:Standards Press of China,2014.
[6] 瞿春芳.直接浸提-气相色谱法测定食品中的丙酸钙[J].化学分析计量,2011,20(5):58-59.
QU C F.Determination of calcium propionate in food by direct extraction-gas chromatography[J].Chemical Analysis and Meterage,2011,20(5):58-59.
[7] 李歆, 林桢,杨芳,等.水蒸馏提取-离子色谱法检测酱油中丙酸钙[J].食品科技,2013,38(5):339-341.
LI X,LIN Z,YANG F,et al.Steam distillation extraction-ion chromatography with conductivity detection for the determination of calcium propionate in soy sauce[J].Food Science and Technology,2013,38(5):339-341.
[8] 李霞, 刘旭,李玲,等.气相色谱测定食品中丙酸及其盐类[J].色谱,2019,37(2):227-232.
LI X,LIU X,LI L,et al.Determination of propionic acid and its salts in food by gas chromatography[J].Chinese Journal of Chromatography,2019,37(2):227-232.
[9] 闫肃. 强阴离子交换柱法测定蛋糕中丙酸钙(钠)[J].广州化工,2015,43(15):102-104.
YAN S.Calcium (sodium) propionate in cakes measured by strong anion-exchange column[J].Guangzhou Chemical Industry,2015,43(15):102-104.
[10] 邹沫君. RP-HPLC法测面包中丙酸[J].食品工业,2020,41(1):288-290.
ZOU M J.Determination of the propanoic acid in bread by RP-HPLC[J].The Food Industry,2020,41(1):288-290.
[11] 熊建军, 邹大维,杨坤,等.离子色谱法检测月饼中丙酸及其盐类分析研究[J].现代食品,2018,12:98-101.
XIONG J J,ZOU D W,YANG K,et al.Determination of propionic acid and its salts in moon cakes by ion chromatography[J].Modern Food,2018,12:98-101.
[12] 卢兰香, 孙珊珊,薛霞,等.高效液相法测定食品中丙酸及盐类[J].食品工业科技,2019,40(11):234-240.
LU L X,SUN S S,XUE X,et al.Determination of propionic acid and its salts in food by high performance liquid chromatography[J].Science and Technology of Food Industry,2019,40(11):234-240.
[13] 王峰. 糕点中丙酸盐的气液相色谱分析方法比较[J].食品与发酵科技,2014,50(4):61-63.
WANG F.The comparison of gas chromatography and liquid chromatography analysis methods for propionate in pastry[J].Food and Fermentation Technology,2014,50(4):61-63.
[14] 高海军, 范自营,张红云,等.气相色谱法同时快速测定食品中丙酸、山梨酸、苯甲酸及脱氢乙酸[J].粮油食品科技,2017,5(25):47-51.
GAO H J,FAN Z Y,ZHANG H Y,et al.Simultaneous and rapid determination of propionic acid,sorbic acid,benzoic acid and dehydroacetic acid in food by gas chromatography[J].Science and Technology of Cereals,Oils and Foods,2017,5(25):47-51.
[15] 国家卫生和计划生育委员会.GB 5009.120—2016 食品中丙酸钠、丙酸钙的测定[S].北京:中国标准出版社,2016.
National Health and Family Planning Commission.GB 5009.120—2016 Determination of sodium propionate and calcium propionate in food[S].Beijing:Standards Press of China,2016.
[16] AZZAM K M A,SAAD B,HASHIM N H,et al.Determination of propionates and propionic acid in bakery products using gas chromatography[J].International Food Research Journal,2010,17(4):1 107-1 112.
[17] 焦阳,郑鹏宇,于兵,等.气相色谱-质谱法测定酱菜中的丙酸残留[J].检验检疫学刊,2012,22(1):13-16.
JIAO Y,ZHENG P Y,YU B,et al.Determination of propionic acid residue in soy sauce pickles using GC-MS[J].Journal of Inspection and Quarantine,2012,22(1):13-16.
[18] 郝鹏飞,刘东风,牟志春,等.气相色谱-质谱法测定腌渍蔬菜中的丙酸及其应用[J].食品研究与开发,2013,34(23):98-100.
HAO P F,LIU D F,MU Z C,et al.Determination and application of propionic acid in pickled vegetables by GC-MS[J].Food Research and Development,2013,34(23):98-100.
[19] 刘雪莲, 申培立,牛丹丹,等.地衣芽胞杆菌α-淀粉酶耐热耐酸突变体的酶学性质[J].食品与发酵工业,2020,46(2):7-10.
LIU X L,SHEN P L,NIU D D,et al.Biochemical sharacterization of heat and acid-resistant mutant of Bacillus licheniform is α-amylase[J].Food and Fermentation Industries,2020,46(2):7-10.
[20] 马银凤, 申培立,王彩喆,等.中温α-淀粉酶的分子进化及酶学性质[J].食品与发酵工业,2021,47(11):14-18.
MA Y F,SHEN P L,WANG C Z,et al.Molecular evolution and biochemical characterization of bacillus amyloliquefaciens α-amylase[J/OL].Food and Fermentation Industries,2021,47(11):14-18.
[21] 韩晔华, 张艳芬,刘虎威.色谱质谱技术在食品安全分析检测中的应用[J].食品安全质量检测学报,2016,7(4):1 578-1 586.
HAN Y H,ZHANG Y F,LIU H W.Application of chromatography and mass spectrometry in food safety analysis[J].Journal of Food Safety and Quality,2016,7(4):1 578-1 586.
[22] 贺燕,徐文泱,孙桂芳,等.气相色谱-质谱法检测肉制品中的杀鼠酮[J].食品与机械,2017,33(5):99-102;124.
HE Y,XU W Y,SUN G F,et al.Determination of pindone in meat product by GC-MS[J].Food & Machinery,2017,33(5):99-102;124.
[23] 姜云鹏.用pH玻璃电极研究丙酸在甲酸-水介质中的热力学性质[J].丹东纺专学报,2003,2(1):5-6.
JIANG Y P.Studying the thermodynamics nature of propionic acid in the mixture of methanol and water solution with pH glass electrode[J].Journal of Dandong Textile College,2003,2(1):5-6.
[24] 赵爱华.乙醚试剂对丙戊酸钠含量测定的影响[J].首都医药,1998,5(3):15.
ZHAO A H.The influence of ether reagent on the determination of sodium valporate[J].Capital Medicine,1998,5(3):15.
[25] 袁焜,刘艳芝,王鹏.非羧酸类有机化合物及其酸性[J].化学教育(中英文),2019,40(2):31-35.
YUAN K,LIU Y Z,WANG P.Non-carboxylic acid organic compounds and their acidity[J].Chinese Journal of Chemical Education,2019,40(2):31-35.
[26] COMMISSION D.Implementing council directive 96/23/EC concerning the performance of analytical methods and the interpretation of results[Z].Official Journal of European Communities,2002/657/EC,L 221/8-27.