近几年,关于苯并[a]芘及其代谢产物与DNA加合物的相关研究文献数量变化如图1所示,由图1可知关于苯并[a]芘及其代谢产物与DNA加合物的研究一直处于备受关注的状态。随着科技水平的提高,苯并[a]芘及其代谢产物与DNA加合物的检测技术有待进一步突破,从而加深对苯并[a]芘及其代谢产物与DNA加合物毒性作用的研究,为保障人体健康作出贡献。

图1 苯并[a]芘及其代谢产物与DNA加合物相关研究的文献数量变化
Fig.1 Changes in the number of literature on the correlation of benzo[a]pyrene and its metabolites and DNA adducts
1 苯并[a]芘概述
苯并芘(benzopyrene)是由芘和苯稠合而成的一类多环芳香烃类化合物[1],主要有1,2-苯并芘、3,4-苯并芘、4,5-苯并芘等[2]。苯并[a]芘(benzo[a]pyrene,B[a]P)又称3,4-苯并芘,分子式为C20H12,相对分子质量为252.31,在常温条件下,为晶状固体,呈浅黄色,沸点为312 ℃,熔点为179 ℃[3],其化学结构式如图2所示。B[a]P是苯并芘中毒性(致癌性、致畸性和致突变性)最强且难降解的一种化合物[4],同时也是多环芳烃的指标化合物。
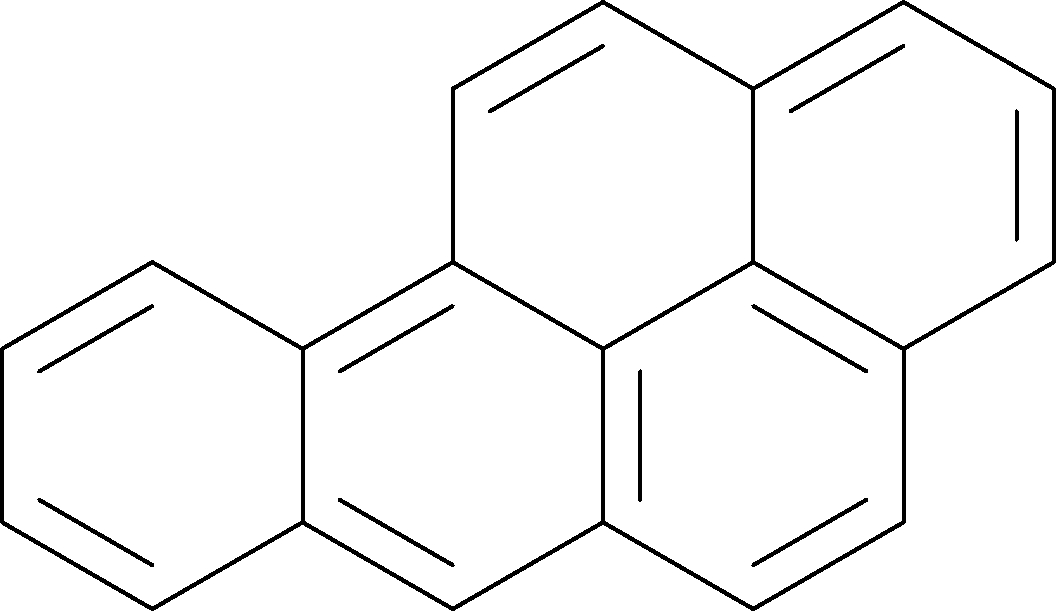
图2 B[a]P的化学结构式
Fig.2 Chemical structure formula of B[a]P
2 B[a]P检测时样品前处理方法
为了提高检测方法的灵敏度、精确度,减少非待测组分的干扰,通常要对食品或环境中的B[a]P进行前处理。可根据待测样品的特性选择最佳的前处理方法,有助于待测物的检测。检测B[a]P的前处理方法主要有固相萃取法、固相微萃取法、液液萃取法、浊点萃取法、凝胶渗透色谱法、分子印迹固相萃取等,如表1所示。
表1 苯并[a]芘检测时样品前处理方法
Table 1 Methods of sample pretreatment for detection of B[a]P

前处理方法特点参考文献固相萃取法效果好、耗用试剂少,操作简单,一般采用中性氧化铝对样品进行净化处理。[5-8]固相微萃取法在固相萃取基础上,发展起来的一种新型的前处理技术,还不够成熟,有待进一步发展。[6-8]液液萃取法处理量大、分离效果好、回收率高、可连续操作或自动控制,通常用到的提取溶剂有石油醚、二氯甲烷、环己烷、N,N-二甲基甲酰胺等。而索氏提取、皂化法在传统液液萃取法中最为常见,操作时间比较长,操作步骤比较复杂繁琐,一般不推荐使用。[6-8]浊点萃取法有机试剂使用少、节约成本且绿色、环保。但处理后的样品中残留少量试剂,对仪器分析的灵敏度方面有所干扰,所以该方法不常使用。[8-9]凝胶渗透色谱法对目标物质损失较少且回收率高,但仪器比较昂贵且试剂消耗量大,检测成本高。[10-11]分子印迹固相萃取分子印迹和固相萃取技术联用,能够有效地消除样品基质的干扰,净化效果良好,已经逐渐被广泛使用。[12-13]
3 B[a]P的检测方法
由于B[a]P对人体健康危害较大,快速检测出食品或环境中的B[a]P尤为重要。为了进一步提高检测的灵敏度、精确度,时常将2种或多种方法进行联用。目前检测B[a]P的方法有高效液相色谱-荧光法、气相色谱-质谱联用法、液相色谱-质谱联用法、气相色谱-串联质谱法、液相色谱-串联质谱法、表面增强拉曼光谱检测法等[14-26];此外,还可通过免疫分析法来检测B[a]P,如ELISA试剂盒法、电化学免疫传感器、金标免疫层析技术[6],如表2所示。
表2 B[a]P的检测方法
Table 2 Detection methods of B[a]P

检测方法检出限特点参考文献高效液相色谱-荧光法0.1~0.15 μg/kg精确度和灵敏度较高、重复性良好、分辨率相对较高。[14-16]气相色谱-质谱联用法0.3 μg/kg能够快速简便地对较复杂的化合物进行分离,可进行痕量和微量检测分析。[16-17]液相色谱-质谱联用法0.091~0.210 μg/kg高灵敏度、高分辨率,能够对复杂样品快速、高效分离,适用于样品的精确检测,但由于溶剂难挥发,基质效应高,耗时较长。[14-15]气相色谱-串联质谱法0.03 μg/kg分析速度快、检出限低、检测结果准确。[18-19]液相色谱-串联质谱法0.1 μg/kg操作简便、快速、灵敏高,分析成本低。[20]表面增强拉曼光谱检测法5.6 ng/mL操作简便、快速、信号和散射效应较强、检测灵敏度高、对样品无损伤;但对样品进行定量分析时不够准确,稳定性和重视性控制也比较困难,技术不够成熟。[14,21]酶联免疫试剂盒法3.3 ng/mL灵敏度高、快速、特异性强、操作简便。[1,15,22]电化学免疫传感器0.035 ng/mL灵敏度高、选择性较好,当待检测样品数量很大时可以采用此方法。[1,15,23]金标免疫层析技术-不需要专门的仪器设备,不费时,操作简便,与其他检测方法相比价格相对较低,对待测物质具有较高的灵敏度,但不够成熟。[1,15]
4 B[a]P代谢产物的种类
B[a]P在机体中可通过酶促反应(细胞色素P450酶、环氧还原酶和环氧水解酶等)或非酶促反应被代谢为多种产物,一般分为二醇类、酚类、环氧类和醌类[24]。环氧化物主要有B[a]P 2,3-,4,5-,7,8-和9,10-环氧异构体,这些环氧化物可被环氧水解酶转化为反式二氢二醇异构体[25]。此外,环氧化合物还可以通过非酶促反应转化为酚类化合物如1-OH B[a]P、3-OH B[a]P、6-OH B[a]P、7-OH B[a]P、9-OH B[a]P等[26],B[a]P的代谢产物结构式如图3所示。
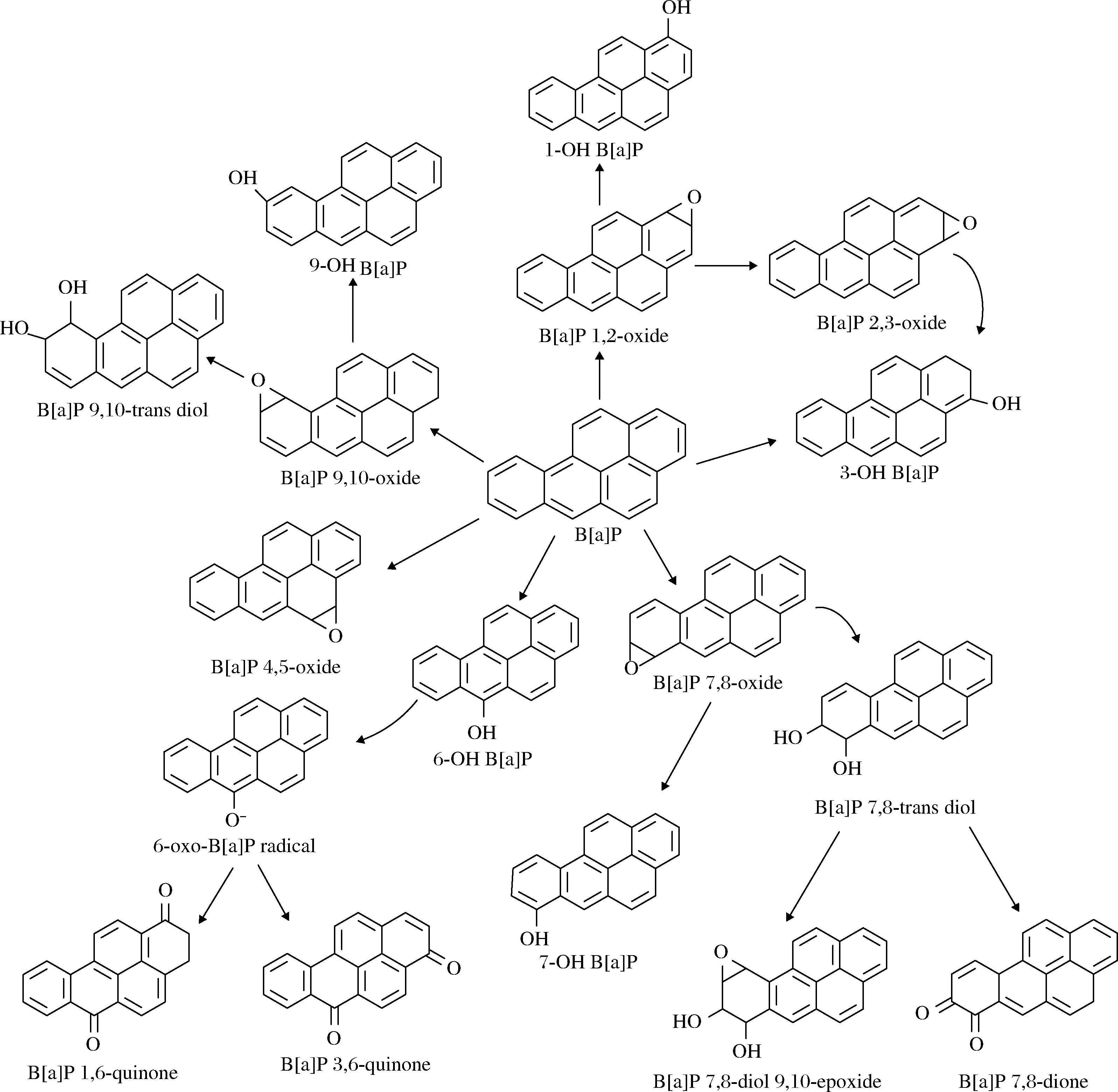
图3 B[a]P代谢产物的结构式[27]
Fig.3 Chemical structural formula for the metabolites of B[a]P[27]
5 B[a]P代谢物与DNA加合物种类及其检测方法
B[a]P不与DNA直接发生反应,当通过二醇-环氧途径、邻醌途径和自由基阳离子途径被代谢活化后才与DNA形成加合物。而DNA加合物是B[a]P危害机体的一类重要生物标志物,若其造成的DNA损伤不能被及时修复,则会导致基因突变诱发癌症,因此DNA加合物可为癌症风险评估提供重要的参考信息,对于发展相关疾病预防和治疗手段具有重要意义[33]。目前,DNA加合物常用的方法有32P后标记法、免疫分析法、色谱-质谱联用法、毛细管电泳法等,但由于生物体中DNA加合物含量极低,对其分析和鉴定仍然存在较大困难,有待进一步发展[28]。
5.1 B[a]P-7,8-氢二醇-9,10-环氧化物dG加合物
在细胞色素P450(CYP450)酶、环氧水解酶以及其他酶的作用下,B[a]P被代谢为B[a]P-7, 8-二氢二醇-9, 10-环氧化物(B[a]P-7,8-dihydrodiol-9,10-epoxide,BPDE),是B[a]P的最终致癌代谢物[29]。BPDE会与细胞DNA发生结合,在脱氧鸟苷的N2位形成BPDE-N2-dG 4种立体异构体加合物[30]如图4所示,其形成过程如图5所示,从而造成DNA损伤,但通常可以通过核苷酸切除修复和碱基切除修复2个通路进行修复,而当核苷酸切除修复和碱基切除修复2个通路中相关基因受到损伤时,细胞DNA修复能力丧失[31], 则由BPDE引起的DNA损伤不能被修复,从而诱发癌症以及其他疾病。此外,BPDE-DNA加合物与DNA甲基化呈正相关,原因可能是BPDE与DNA的结合会通过影响DNA甲基转移酶的活性而促进DNA的甲基化,或者由于BPDE-DNA加合物的位点甲基化增加所致[32],由BPDE-DNA加合物引起的DNA甲基化异常也会导致许多复杂的疾病。
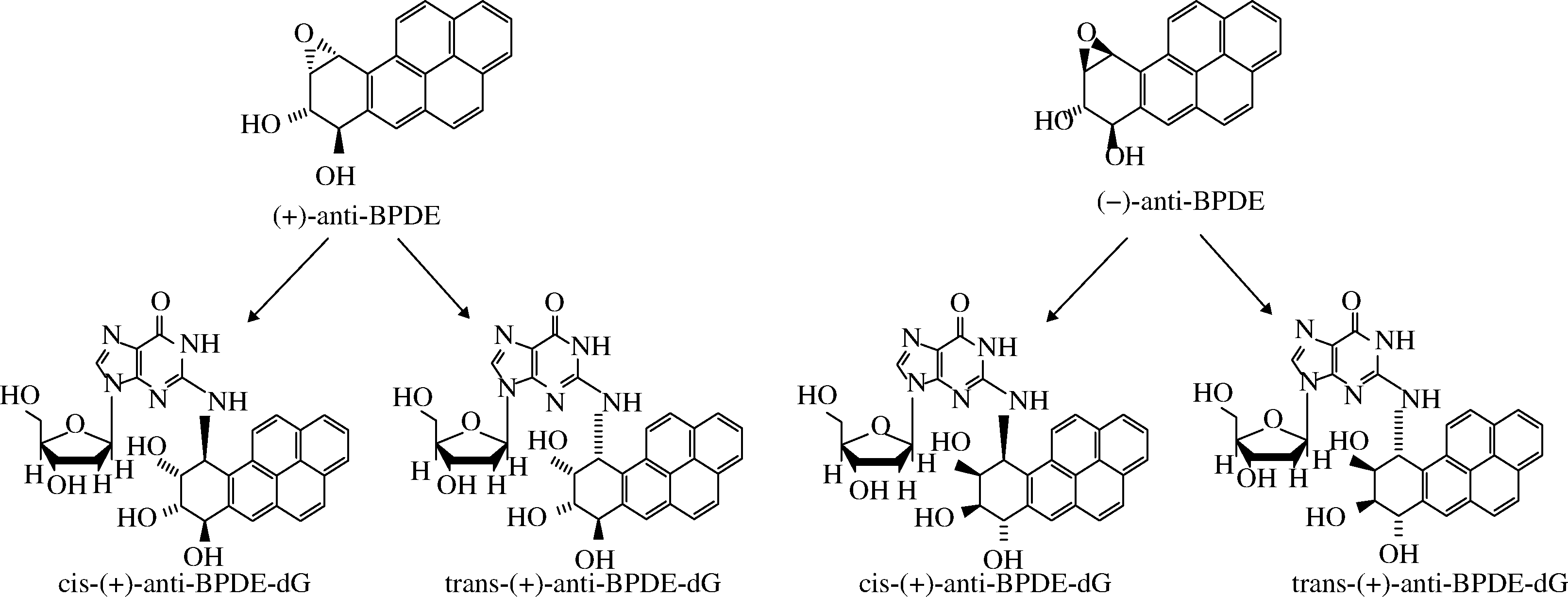
图4 BPDE-N2-dG的4种立体异构体
Fig.4 Four stereoisomers of BPDE-N2-dG
BPDE-N2-dG加合物既是接触(暴露)生物标志,又是一种效应标志物[33],对其定性或定量分析是开展相关研究的一个重要基础,可进一步揭示人类重大疾病的分子机制。目前,对于BPDE-N2-dG的检测方法越来越多,其中常用的方法包括32P后标记法、免疫分析法、液相色谱串联质谱法、毛细管电泳-激光诱导荧光法等,其检测方法及其应用如表3所示[34-41]。
表3 BPDE-N2-dG的检测方法及应用
Table 3 Detection method and application of BPDE-N2-dG

检测方法检测对象结果参考文献32P后标记法A/J雄性小鼠的肺和肝脏组织小鼠经腹腔注射B[a] P-7,8反式二醇后,肺和肝脏组织中检测出BPDE-dG加合物[33]液相色谱-串联质谱孕妇脐带血BPDE-dG加合物在正常组和出生缺陷组的脐带血样本中均有检测到,但其水平没有显著差异。[34]高效液相色谱-同步荧光分光光度法肺癌患者的肺组织研究发现吸烟程度与肺组织中BPDE-DNA加合物水平呈正相关。[36]高效液相色谱-荧光测定法人体肺组织吸烟者和戒烟者肺组织中BPDE-DNA加合物水平高于非吸烟者。[37]气相色谱-质谱联用法宫颈黏液环境中的B[a]P可转运至子宫颈,被宫颈上皮细胞代谢为BPDE-DNA加合物。[38]高效液相色谱-串联质谱法孕妇脐带血出生缺陷新生儿母亲脐带血中BPDE-dG 加合物水平高于对照组。[39]酶联免疫吸附测定法焦炉厂工人的血样BPDE-DNA加合物水平与B[a]P暴露水平显著相关。[40]毛细管电泳-激光诱导荧光检测体外合成样品反式-(+)-anti-BPDE-dG与单克隆抗体8E11 t的结合表现出最强的亲和力,顺式-(-)-anti-BPDE-dG的亲和力最低。[41]
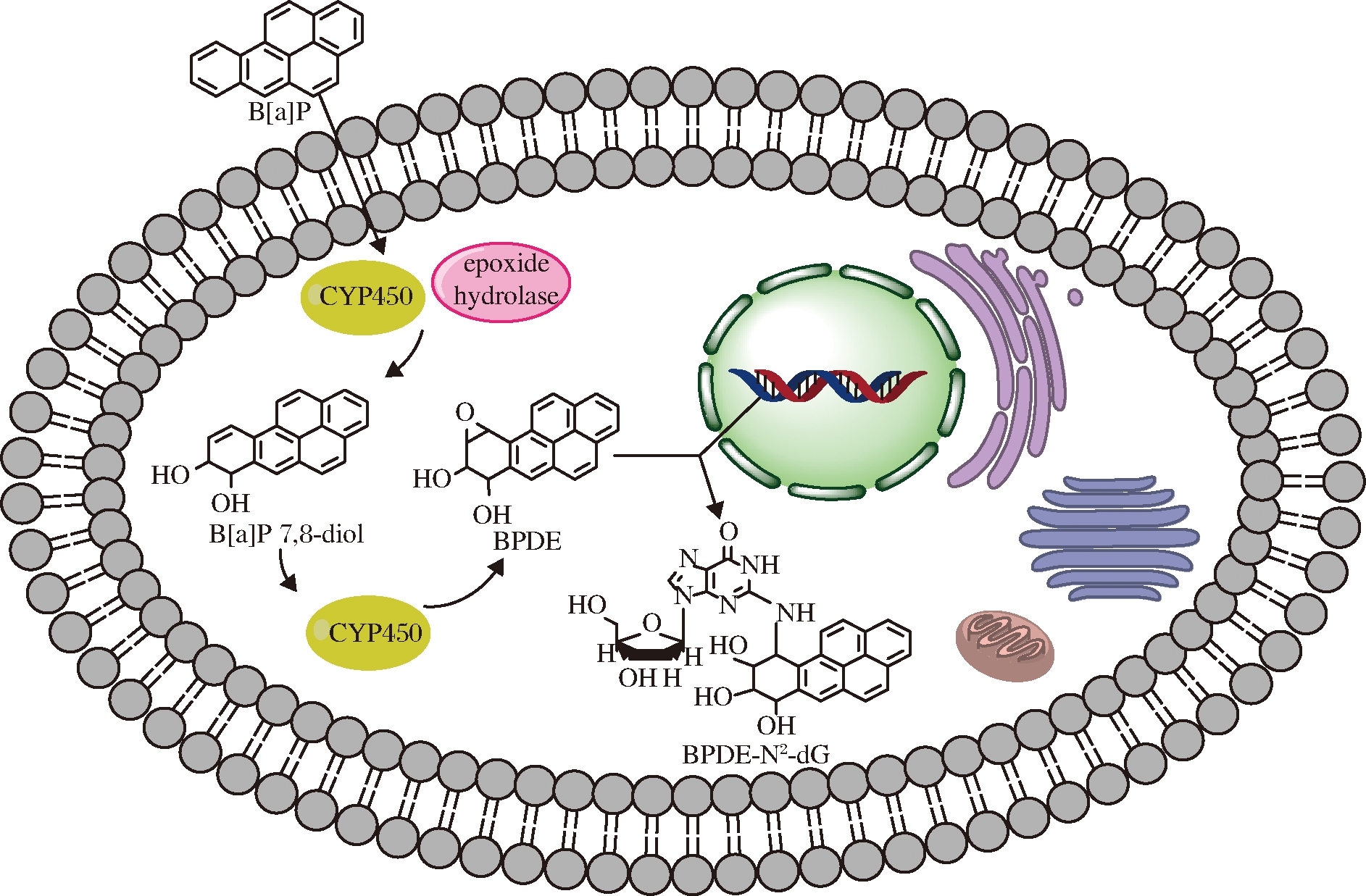
图5 BPDE-N2-dG的形成过程[29]
Fig.5 The formation of BPDE-N2-dG[29]
5.2 B[a]P-7,8-二酮-DNA加合物
B[a]P-7,8-二酮(B[a]P-7,8-dione,BPQ)是由(±)-B[a]P-7,8-反式二醇经醛酮还原酶(aldehyde ketone reductase,AKR)催化形成的[42]。它既具有亲电性,又具有氧化还原活性,亲电性使得BPQ能与DNA通过加成反应生成BPQ-DNA加合物[43]。而这些BPQ-DNA加合物在体内不稳定,不易被检测到,如NESNOW等[33] 对A/J雄性小鼠进行BPQ和B[a]P-7,8-腹腔注射后,通过32P后标记分析小鼠肺和肝脏中的DNA,未检测到BPQ-DNA加合物,但小鼠体重随时间显着下降,表明这2种药物均可引起全身毒性。
多项研究通过体外实验,对BPQ-DNA加合物进行了研究,为体内BPQ介导的遗传毒性和致癌作用奠定基础。HUANG等[44]通过液相色谱串联质谱对经过BPQ处理后的人肺腺癌A549细胞,人支气管肺泡H358细胞,永生化人支气管上皮HBEC-KT细胞中BPQ与DNA加合物进行检测,在A549细胞和HBEC-KT细胞中发现了BPQ-DNA加合物。BALU等[45]在生理PH条件下合成4个BPQ与dG、2个BPQ与dA加合物,并通过高效液相色谱/电喷雾-质谱进行了鉴定和表征。BALU等[46]还制备了dGMP(3′)、dAMP(3′)和dCMP(3′)与BPQ加合物,并通过UV、LC/MS以及一维和二维核磁共振技术对制备的加成物进行了表征。
5.3 自由基阳离子-DNA加合物
B[a]P经CYP450酶催化后会生成自由基阳离子[47],该阳离子与DNA相互作用,主要是在B[a]P的C6位置与鸟嘌呤的N7和C8位置以及腺嘌呤的N7位置形成脱嘌呤的加合物[48]。CHEN等[49]在雌性瑞士小鼠局部皮肤上用B[a]P处理4 h后处死小鼠,对处理过的皮肤进行前处理,然后通过HPLC和荧光线窄光谱法分析出5种DNA加合物分别是:B[a]P-6-C8-Gua、B[a]P-6-N7-Ade,B[a]P-C6-N7-Gua和少量BPDE-C10-N7-Ade和BPDE-C10-N7-Gua,其中自由基阳离子与DNA加合物占总DNA加合物的66%。由于自由基阳离子的寿命短,SEN等[50]通过检测自由阳离子下游产物B[a]P-1,6-二酮和B[a]P-3,6-二酮来确定经B[a]P处理后酵母菌株中自由阳离子水平,研究发现自由阳离子水平随B[a]P剂量的增加而增加,而自由基阳离子会与DNA形成加合物,但不稳定迅速被分解,会造成DNA突变,通过对P53基因进行测序,发现BPQ的诱变性比自由基阳离子强,且大多数突变都在鸟嘌呤残基处,表明加合物大多在鸟嘌呤上形成。
6 总结与展望
本文详细综述了检测B[a]P时样品前处理方法及其检测方法、代谢产物的种类以及B[a]P经过二醇-环氧途径、邻醌途径和自由基阳离子途径被代谢活化后的产物与DNA加合物的形成过程和检测方法,为分析检测B[a]P和预防其毒性提供参考。DNA加合物作为B[a]P危害机体的一类重要生物标志物,对其检测具有重要意义,但其检测方法还存在一些问题,应对DNA加合物的检测方法进行进一步探索,提高检测方法的精确度、灵敏度,为更好地探究各种有害物质的毒性机理提供参考依据,同时为发展相关疾病预防和治疗手段做出贡献。
[1] 高玮, 邓智辉.检测食品中苯并芘的方法研究[J].粮食科技与经济, 2018, 43(8):69-73.
GAO W, DENG Z H.Study on the method of detecting benzopyrene in food[J].Food Technology and Economy, 2018, 43(8):69-73.
[2] 周丽, 程远欣, 杨清山, 等.万寿菊提取加工过程中苯并芘的污染来源分析[J].食品工业, 2018, 39(4):323-326.
ZHOU L, CHENG Y X, YANG Q S, et al.Analysis of contamination source of benzo pyrene during marigold extraction and processing[J].Food Industry, 2018, 39(4):323-326.
[3] 王广峰. 苯并芘对人体的危害和食品中苯并芘的来源及防控[J].菏泽学院学报, 2014, 36(2):66-70.
WANG G F.The harm of benzopyrene to human body and the origin and prevention and control of benzopyrene in food[J].Journal of Heze University, 2014, 36(2):66-70.
[4] 冯亚净, 王瑞鑫, 李书国.食品中苯并芘的来源及减控方法的研究[J].粮食与油脂, 2017, 30(2):72-75.
FENG Y J, WANG R X, LI S G.Study on the origin and control method of benzopyrene in food[J].Cereals & Oils, 2017, 30(2):72-75.
[5] 蔡尽忠, 王集鹏, 邓盈.固相萃取-高效液相色谱法测定植物油中苯并[a]芘[J].中国油脂, 2020, 45(3):44-47;67.
CAI J Z, WANG J P, DENG Y.Determination of benzo[a] pyrene in vegetable oil by solid phase extraction (SPE) and high performance liquid chromatography (HPLC)[J].China Oils and Fats, 2020, 45(3):44-47;67.
[6] 王亚萍. 苯并[a]芘含量测定的前处理方法研究进展[J].安徽农业科学, 2016, 44(11):96-98.
WANG Y P.Research progress of pretreatment method for determination of benzo[a]pyrene[J].Anhui Agricultural Sciences, 2016, 44(11):96-98.
[7] 刘小文, 全沁果, 敖艳, 等.食用油中苯并(a)芘检测技术研究进展[J].食品与发酵工业, 2014, 40(12):125-129.
LIU X W, QUAN Q G, AO Y, et al.Progress in detection of benzo(a)pyrene in edible oil[J].Food and Fermentation Industries, 2014, 40(12):125-129.
[8] 苏慧. 食用油中苯并芘前处理方法的建立及其高效液相色谱分析[D].南京:南京农业大学, 2015.
SU H.Establishment of pretreatment method for benzopyrene in edible oil and its HPLC analysis[D].Nanjing:Nanjing Agricultural University, 2015.
[9] 杨立峰, 吴俊森, 许文, 等.浊点萃取一同步荧光法测定水中苯并[a]芘[J].山东建筑大学学报, 2011, 26(2):115-118;161.
YANG L F, WU J S, XU W, et al.Determination of benzo[a]pyrene in water by turbidity point extraction with synchronous fluorescence method[J].Journal of Shandong Jianzhu University, 2011, 26(2):115-118;161.
[10] 沈习习, 战俊良, 汤晓艳.凝胶渗透色谱净化-气相色谱-质谱法检测烤鸭鸭皮中16种多环芳烃[J].肉类研究, 2020, 34(1):77-82.
SHEN X X, ZHAN J L, TANG X Y.Detection of 16 polycyclic aromatic hydrocarbons (PAHs) in duck skin by GC-MS[J].Meat Research, 2020, 34(1):77-82.
[11] 史思, 伊雄海, 赵善贞, 等.亚临界水萃取及气相色谱-质谱法测定烟熏鱼中苯并(a)芘残留[J].上海海洋大学学报,2014, 23(6):948-953.
SHI S, YI X H, ZHAO S Z, et al.Determination of benzo(a)pyrene residue in smoked fish by subcritical water extraction and gas chromatography-mass spectrometry[J].Journal of Shanghai Ocean University, 2014, 23(6):948-953.
[12] 王丽君, 禹洁, 周佳, 等.分子印迹固相萃取柱-HPLC测定植物油中苯并芘的含量[J].食品与发酵科技, 2020, 56(2):112-116.
WANG L J, YU J, ZHOU J, et al.Determination of benzo[a]pyrene in vegetable oil by HPLC with molecularly imprinted solid phase extraction column[J].Food and Fermentation Science, 2020, 56(2):112-116.
[13] 林亚楠, 李诗言, 崔益玮, 等.分子印迹固相萃取/液-质谱联用法测定烟熏鲟鱼中苯并芘[J].中国食品学报, 2020, 20(3):251-257.
LIN Y N, LI S Y, CUI Y W, et al.Determination of benzo[a]pyrene in smoked sturgeon by molecularly imprinted solid phase extraction/liquid-mass spectrometry[J].Chinese Journal of Food Science, 2020, 20(3):251-257.
[14] 傅孝美, 李宗军, 赵志友,等.食用槟榔中苯并芘检测方法研究进展[J].食品与机械, 2019, 35(8):216-219;225.
FU X M, LI Z J, ZHAO Z Y, et al.Progress in the detection of benzopyrene in betel nut[J].Food & Machinery, 2019, 35(8):216-219;225.
[15] 孔蒙蒙, 黄忠民, 潘志利, 等.食品中致癌物质苯并芘检测方法研究进展[J].食品与营养科学, 2018, 7(4):251-256.
KONG M M, HUANG Z M, PAN Z L, et al.Progress in detection methods of benzopyrene, a carcinogen in food[J].Science of Food and Nutrition, 2018, 7(4):251-256.
[16] 程威威, 汪学德, 刘兵戈,等.HPLC-FLD和GC-MS测定芝麻油中苯并芘的方法比较[J].现代食品科技, 2015, 31(10):282-286;306.
CHENG W W, WANG X D, LIU B G, et al.Determination of benzopyrene in sesame oil by HPLC-FLD and GC-MS[J].Modern Food Science and Technology, 2015, 31(10):282-286;306.
[17] 李玮, 韩里明, 王佳琨, 等.气质联用仪法测定奶粉中多环芳烃[J].分析试验室, 2009, 28(9):109-112.
LI W, HAN L M, WANG J K, et al.Determination of PAHs in milk powder by GC/MS[J].Analytical Laboratory, 2009, 28(9):109-112.
[18] 曾楚莹, 曹小云, 吕海燕.ASE-GC-MS/MS法测定海产品中苯并(a)芘含量方法的建立[J].食品工业, 2019, 40(6):266-269.
ZENG C Y, CAO X Y, LYU H Y.Establishment of ASE-GC-MS/MS method for determination of benzo(a)pyrene in Marine products[J].Food Industry, 2019, 40(6):266-269.
[19] 陈晓水, 汤晓东, 张博, 等.气相色谱-串联质谱法同时检测卷烟主流烟气中的苯并[a]芘和NNK[J].烟草科技, 2015, 48(9):50-55.
CHEN X S, TANG X D, ZHANG B, et al.Simultaneous determination of benzo[a]pyrene and NNK in mainstream cigarette smoke by gas chromatography-tandem mass spectrometry[J].Tobacco Science and Technology, 2015, 48(9):50-55.
[20] 郭芳芳, 王明明, 王果, 等, 舒蕊华.基于固相萃取技术的液相色谱-串联质谱法快速检测食用油脂中的苯并(a)芘[J].食品科技, 2020, 45(8):271-275.
GUO F F, WANG M M, WANG G, et al.Rapid determination of benzo(a)pyrene in edible oil by liquid chromatography-tandem mass spectrometry based on solid phase extraction technology[J].Food Science and Technology, 2020, 45(8):271-275.
[21] 王炬勇. 基于表面增强拉曼光谱技术对环境水体中痕量多环芳烃的检测研究[D].厦门:厦门大学, 2019.
WANG J Y.Determination of trace pahs in environmental water based on surface-to-surface enhanced raman spectroscopy[D].Xiamen:Xiamen University, 2019.
[22] 陈超超, 邵辉峰, 王吕, 等.水体中苯并芘检测试剂盒研制及效果评价[J].中国公共卫生, 2016, 32(2):254-256.
CHEN C C, SHAO H F, WANG L, et al.Development and effect evaluation of benzo(a)pyrene detection kit in water[J].China Public Health, 2016, 32(2):254-256.
[23] 鲍乐. 基于纳米材料的持久性有机污染物快速分析方法研究[D].长沙:湖南大学, 2012.
BAO L.Rapid analysis method of persistent organic pollutants based on nanomaterials[D].Changsha:Hunan University, 2012.
[24] GELBOIN H V.Benzo[alpha]pyrene metabolism, activation and carcinogenesis:Role and regulation of mixed-function oxidases and related enzymes[J].Physiological Reviews, 1980, 60(4):1 107-1 166.
[25] HILTON D C, TRINIDAD D A, HUBBARD K, et al.Measurement of urinary benzo[a]pyrene tetrols and their relationship to other polycyclic aromatic hydrocarbon metabolites and cotinine in humans[J].Chemosphere, 2017, 189:365-372.
[26] 韩瑜, 鲁英, 杨晓燕, 等.人尿液中4种多环芳烃单羟基代谢产物的液相色谱-串联质谱联用检测法[J].环境与健康杂志, 2012, 29(10):933-936.
HAN Y, LU Y, YANG X Y, et al.Determination of four polycyclic aromatic hydrocarbon monohydroxyl metabolites in human urine by liquid chromatography-tandem mass spectrometry[J].Journal of Environment and Health, 2012, 29(10):933-936.
[27] BARBEAU D, LUTIER S, CHOISNARD L, et al.Urinary trans-anti-7,8,9,10-tetrahydroxy-7,8,9, 10-tetrahydrobenzo(a)pyrene as the most relevant biomarker for assessing carcinogenic polycyclic aromatic hydrocarbons exposure[J].Environment International,2018, 112:147-155.
[28] 冯峰, 王超, 吕美玲, 等.DNA加合物检测[J].化学进展, 2009, 21(2):503-513.
FENG F, WANG C, LYU M L, et al.DNA adduct detection[J].Advances in Chemistry, 2009, 21(2):503-513.
[29] JEE S C, KIM M, KIM KS, et al.Protective Effects of Myricetin on benzo[a]pyrene-Induced 8-hydroxy-2′-deoxyguanosine and BPDE-DNA Adduct[J].Antioxidants (Basel), 2020, 9(5):446-458.
[30] XIAO M, XIAO S, STRAATEN T V, et al.Genetic polymorphisms in 19q13.3 genes associated with alteration of repair capacity to BPDE-DNA adducts in primary cultured lymphocytes[J].Mutation Research, 2016, 812:39-47.
[31] BOYSEN G, HECHT S S.Analysis of DNA and protein adducts of benzo[a]pyrene in human tissues using structure-specific methods[J].Mutation Research, 2003, 543(1):17-30.
[32] HERBSTMAN J B, TANG D, ZHU D, et al.Prenatal exposure to polycyclic aromatic hydrocarbons, benzo[a]pyrene-DNA adducts, and genomic DNA methylation in cord blood[J].Environmental Health Perspectives, 2012, 120(5):733-738.
[33] 包晓岩. 体外诱导淋巴细胞BPDE-DNA加合物水平与19q13区域基因型与单体型的关联性研究[D].沈阳:中国医科大学, 2012.
BAO X Y.BPDE-DNA adduct level in induced lymphocytes in vitro and the correlation between 19q13 regional genotype and haplotype[D].Shenyang:China Medical University, 2012.
[34] NESNOW S, NELSON G, PADGETT W T, et al.Lack of contribution of covalent benzo[a]pyrene-7, 8-quinone-DNA adducts in benzo[a]pyrene-induced mouse lung tumorigenesis[J].Chem Biol Interact.2010, 186(2):157-165.
[35] GUO L, JIANG X, TIAN H Y, et al.Detection of BPDE-DNA adducts in human umbilical cord blood by LC-MS/MS analysis[J].Journal of Food Drug Analysis, 2019,27(2):518-525.
[36] ANDREASSEN A, KURE E H, NIELSEN P S, et al.Comparative synchronous fluorescence spectrophotometry and 32P-postlabeling analysis of PAH-DNA adducts in human lung and the relationship to TP53 mutations[J].Mutation Research, 1996, 368(3-4):275-282.
[37] LODOVICI M, AKPAN V, GIOVANNINI L, et al.Benzo[a]pyrene diol-epoxide DNA adducts and levels of polycyclic aromatic hydrocarbons in autoptic samples from human lungs[J].Chemico-Biological Interactions, 1998, 116(3):199-212.
[38] MELIKIAN A A, SUN P, PROKOPCZYK B, et al.Identification of benzo[a]pyrene metabolites in cervical mucus and DNA adducts in cervical tissues in humans by gas chromatography-mass spectrometry[J].Cancer Letters, 1999, 146(2):127-34.
[39] 郭玲. HPLC-MS/MS检测血中BPDE-dG加合物方法的建立及人群生物监测[D].郑州:郑州大学, 2016.
GUO L.Establishment of HPLC-MS/MS method for detection of BPDE-dG admixtures in blood and population biological monitoring[D].Zhengzhou:Zhengzhou University, 2016.
[40] VAN SCHOOTEN F J, VAN LEEUWEN F E, HILLEBRAND M J, et al.Determination of benzo[a]pyrene diol epoxide-DNA adducts in white blood cell DNA from coke-oven workers: The impact of smoking[J].Journal of the National Cancer Institute, 1990, 82(11):927-933.
[41] WANG C, LI T, WANG Z, et al.Quantitative study of stereospecific binding of monoclonal antibody to anti-benzo(a)pyrene diol epoxide-N(2)-dG adducts by capillary electrophoresis immunoassay[J].Journal of Chromatography A, 2010, 1217(15):2 254-2 261.
[42] PALACKAL N T, LEE S H, HARVEY R G, et al.Activation of polycyclic aromatic hydrocarbon trans-dihydrodiol proximate carcinogens by human aldo-keto reductase (AKR1C) enzymes and their functional overexpression in human lung carcinoma (A549) cells[J].The Journal of Biological Chemistry, 2002, 277(27):24 799-48 808.
[43] HUANG M, BLAIR I A, PENNING T M.Identification of stable benzo[a]pyrene-7, 8-dione-DNA adducts in human lung cells[J].Chemical in Research Toxicology, 2013, 26(5):685-692.
[44] HUANG M, LIU X, BASU S S, et al.Metabolism and distribution of benzo[a]pyrene-7,8-dione (B[a]P-7,8-dione) in human lung cells by liquid chromatography tandem mass spectrometry:Detection of an adenine B[a]P-7, 8-dione adduct[J].Chemical Research Toxicology, 2012, 25(5):993-1 003.
[45] BALU N, PADGETT W T, LAMBERT G R, et al.Identification and characterization of novel stable deoxyguanosine and deoxyadenosine adducts of benzo[a]pyrene-7, 8-quinone from reactions at physiological pH[J].Chemical Research Toxicology, 2004, 17(6):827-838.
[46] BALU N, PADGETT W T, NELSON G B, et al.Benzo[a]pyrene-7,8-quinone-3′-mononucleotide adduct standards for 32P postlabeling analyses:Detection of benzo[a]pyrene-7, 8-quinone-calf thymus DNA adducts[J].Analytical Biochemistry, 2006, 355(2):213-223.
[47] CAVALIERI E L, ROGAN E G.Central role of radical cations in metabolic activation of polycyclic aromatic hydrocarbons[J].Xenobiotica, 1995,25(7):677-688.
[48] DAI Q, XU D, LIM K, et al.Efficient syntheses of C(8)-aryl adducts of adenine and guanine formed by reaction of radical cation metabolites of carcinogenic polycyclic aromatic hydrocarbons with DNA[J].Journal of Organic Chemistry, 2007, 72(13):4 856-4 863.
[49] CHEN L, DEVANESAN P D, HIGGINBOTHAM S, et al.Expanded analysis of benzo[a]pyrene-DNA adducts formed in vitro and in mouse skin:Their significance in tumor initiation[J].Chemical Research Toxicology, 1996, 9(5):897-903.
[50] SEN S, BHOJNAGARWALA P, FRANCEY L, et al.p53 Mutagenesis by benzo[a]pyrene derived radical cations[J].Chemical Research in Toxicology, 2012, 25(10):2 117-2 126.