随着人们健康意识不断增强,“吃得营养、吃得健康”成为现代人饮食的主流观念,日常膳食消费已由温饱型转向质量型,水果摄入量不断增加。柑橘含有多种生理活性物质,具有重要的保健功能[1-2],在居民膳食结构中占据着越来越重要的地位。2018年,我国柑橘产量达到4 138.1×104 t,占水果总产量的16.1%,成为我国第一大水果[3]。然而,作为直接鲜食的初级农产品,柑橘使用农药后其消解变化动态及果实中残留的农药摄入人体后是否对人体健康产生危害,风险水平如何等质量安全问题受到广大消费者的持续关注,也成为该领域近年来的研究热点之一[4-6]。
柑橘生长周期长,病虫害多发,生产中使用的农药种类较多。张耀海等[7]对我国6省(市)主产地的198个柑橘样品中的农药残留现状进行分析评价,发现48.9%的样品中有农药残留,质量安全存在潜在风险。近来,LI等[8]进一步研究分析了我国2 922份柑橘果实样品的农药残留状况,发现有86%的样品中存在40种不同的农药残留,其中,丙溴磷、联苯菊酯和毒死蜱残留均为影响柑橘质量安全的重要危害因子。这3种农药均为广谱类杀虫剂,在我国柑橘生产中应用极为广泛。此外,已有研究表明,毒死蜱在环境和动植物体内的主要代谢产物3,5,6-三氯-2-吡啶醇(3,5,6-trichloro-2-pyridinol,TCP)比毒死蜱毒性更强,而且有可能与毒死蜱存在协同效应[9-10]。目前,丙溴磷、联苯菊酯、毒死蜱和TCP的检测方法主要有气相色谱法、气相色谱-质谱联用法、液相色谱-质谱联用法等[11-16],但尚未见关于其同时检测的方法以及在柑橘中的消解转化和健康风险评价方面的相关研究报道。为此,本试验以常见柑橘品种温州蜜柑为对象,建立4种农药化合物的超高效液相色谱-串联质谱法(UPLC-MS/MS)检测技术,同时采用田间喷药和动态取样的方式研究丙溴磷、联苯菊酯、毒死蜱及其代谢物在温州蜜柑中的消解与代谢转化规律,并对其可能存在的急性和慢性膳食暴露风险进行初步评价,以期为我国柑橘质量安全生产、监测和消费引导提供重要的技术支撑和切实参考。
1 材料与方法
1.1 试剂
丙溴磷标准品(纯度≥99%)、联苯菊酯标准品(纯度≥99.5%)、毒死蜱标准品(纯度≥99%)、TCP标准品(纯度≥98%),德国Dr.Ehrenstorfer GmbH公司;乙腈、甲醇(色谱纯),美国Sigma-Aldrich公司;乙酸铵(色谱纯),德国Honeywell-Fluka公司;乙二胺基-N-丙基(primary secondary amine,PSA),上海安谱科学仪器有限公司;石墨化炭黑(graphitized carbon black,GCB),上海安谱科学仪器有限公司;无水硫酸镁、氯化钠(分析纯),江苏强盛化工有限公司。试验用丙溴磷(50%乳油,青岛中达农业科技有限公司)、联苯菊酯(25 g/L乳油,南宁泰达丰生物科技有限公司)、毒死蜱(40%乳油,浙江新农化工股份有限公司),购于当地农资商店。
1.2 仪器与设备
LC-30AD超高效液相色谱仪,日本Shimadzu公司;QTRAPTM 6500三重四极杆线性离子阱复合质谱仪,美国AB SCIEX质谱系统公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;超纯水系统Milli-Q AdvantageA10,美国Millipore公司;CL31/CL31R多用途离心机,美国Thermo Fisher公司;CK 2000型高通量组织研磨仪,北京Thmorgan生物科技有限公司。
1.3 田间试验与样品采集
供试柑橘品种为温州蜜柑,于2019年8~10月在重庆市歇马镇柑桔研究所柑橘试验园内(海拔222.8 m,纬度29°76′63 N,经度106°39′16 E)进行。采用喷雾法对柑橘树进行农药喷施,其中,消解转化动态试验以所选农药最高推荐剂量的1.5倍液(丙溴磷375 mg a.i./kg、联苯菊酯47 mg a.i./kg、毒死蜱750 mg a.i./kg,a.i.表示有效成分)为施药剂量喷药1次,并分别于喷药后0(2 h)、1、3、7、14、21、28、35、45和60 d按随机法进行果实样品采集;最终残留量试验按良好农业规范,以所选农药的最高推荐剂量(丙溴磷250 mg a.i./kg、联苯菊酯31 mg a.i./kg、毒死蜱500 mg a.i./kg)进行喷施,丙溴磷2次、毒死蜱2次、联苯菊酯1次,并分别于各自的安全间隔期(pre-harvest interval,PHI)、安全间隔期前1周、安全间隔期后1周各采样1次。丙溴磷和毒死蜱的PHI为28 d,联苯菊酯为21 d。以4株柑橘树为1个试验小区,每个处理重复3次,以清水喷施为对照。每个处理采样不少于2 kg,样品采集标号后,置于加冰保温盒中运至实验室。用匀浆机对样品进行匀浆,于-20 ℃冷冻保存,待测。
1.4 试验方法
1.4.1 样品前处理
采用本实验室优化验证的QuEChERS方法:称取柑橘果实样品5.00 g于25 mL离心管中,加入10.00 mL乙腈,垂直振荡提取10 min,加入2.00 g无水硫酸镁和0.50 g氯化钠,垂直振荡1 min后,10 000 r/min离心5 min。移取1.50 mL上清液加入装有25 mg GCB的4 mL离心管中,涡旋1 min,以4 000 r/min离心5 min,取上清液经0.22 μm有机滤膜过滤,上机检测。
1.4.2 标准工作液的配制
分别准确称取约10.0 mg农药标准品于100 mL容量瓶中,用乙腈定容。取相应量的单标储备液于100 mL容量瓶中,用乙腈配制成10 mg/L的标准混合储备液,于-20 ℃冰箱中避光保存备用。使用时,为消除基质效应,将标准混合储备液按照1.4.1方法处理后的柑橘提取液溶液稀释至质量浓度为1、2、5、10、20、50、100和200 μg/L的系列标准溶液,于4 ℃条件下保存。
1.4.3 色谱条件
色谱柱:ACE Excel 2 C18(100 mm×2.1 mm,2 μm);柱温:40 ℃;进样量:2.0 μL;流速:0.4 mL/min;流动相A:5 mmol/L乙酸铵水溶液;流动相B:甲醇。梯度洗脱程序:0~5 min,10% B;5~8 min,90% B;8~10 min,10% B。
1.4.4 质谱条件
离子源:电喷雾离子源(electrospray ionization,ESI);扫描方式:丙溴磷、联苯菊酯和毒死蜱为正离子扫描,TCP为负离子扫描;监测模式:多反应监测(multiple reaction monitoring,MRM);离子源温度:450 ℃;电压5 500 V(ESI +)/-4 500 V(ESI-);雾化气压力:344.7 kPa;气帘气压力:241.3 kPa。MRM 质谱参数见表 1。
表1 所选农药的质谱条件参数
Table 1 UPLC-MS/MS parameters for the selected pesticides

化合物ESI模式保留时间/min母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV丙溴磷 +6.01373.0302.9*8025373.0345.28018联苯菊酯+7.40440.3181.1*4018440.3166.24056毒死蜱 +6.25350.0197.9*8249350.096.98229TCP -4.00198.035.0*-64-45198.037.0-64-45
注:标*为定量离子
1.4.5 方法学考察
取柑橘空白样品,添加3个或以上浓度水平的混合标准溶液进行加标回收率和精密度试验,每个浓度做5次平行,以满足农药残留分析回收率要求的最低添加浓度为方法定量限(limit of quantity,LOQ)。
1.5 膳食暴露风险评估
农药残留膳食暴露风险评估即对经膳食途径摄入人体内的农药残留量进行定量评价,通常使用食物消费数据和化学物浓度检测数据,结合人体体重数据,获得膳食暴露量的估计,再与国际公认的毒性参考剂量进行比较,评估目标化合物对人体健康的潜在风险。慢性膳食暴露风险按公式(1)、公式(2)进行计算[16],急性膳食暴露风险按公式(3)、公式(4)进行计算[17],暴露风险值HQ<1时,健康风险在可接受范围内;而HQ>1时,存在不可接受的健康风险。
(1)
(2)
式中:HQChronic为慢性膳食暴露风险;EDI为每日估计摄入量(mg/kg bw);ADI为每日允许摄入量(mg/kgbw),源自WHO数据库[18];DC为农药残留检出浓度(mg/kg);FC为柑橘的人均消费量(kg);BW为人群平均体重(kg bw)。不同人群体重与柑橘消费数据来源于WHO统计数据[19]。
(3)
(4)
式中:HQAcute为急性膳食暴露风险;ESTI为短期估计摄入量(mg/kg bw);ARfD为急性参考剂量(mg/kg),源自WHO数据库[18];LP为柑橘日消费大份餐(kg);HR为柑橘中检出的最高农药残留浓度(mg/kg bw);v为变异因子;BW为人群平均体重(kg bw)。柑橘日消费大份餐和变异因子数据来源于WHO统计数据[19]。
2 结果与分析
2.1 方法验证结果
用柑橘果实空白样品提取液逐级稀释标准溶液配制基质匹配标准溶液,以农药质量浓度为横坐标,对应的峰面积为纵坐标作标准曲线,以基质匹配标准曲线进行定量。做4个浓度水平的添加回收实验,添加水平为2~1 000 μg/kg,每个添加浓度重复5次,其定量限、相关系数、添加回收率等结果见表2。结果表明,在1~200 μg/L质量浓度范围内,所选农药的线性良好(r2 >0.99),LOQs在2~10 μg/kg。在4个加标水平下,所选农药的回收率为80%~108%,相对标准偏差(relative standard deviation,RSD)为0.43%~9.76%,该方法具有良好的准确度和精密度,可满足所选农药残留检测分析要求[20]。所选农药的UPLC-MS/MS色谱图见图1。
表2 试验农药的LOQ、相关系数(r2)、回收率和RSDs
Table 2 The LOQs, correlation coefficient (r2), recoveries and RSDs for the experimental pesticides
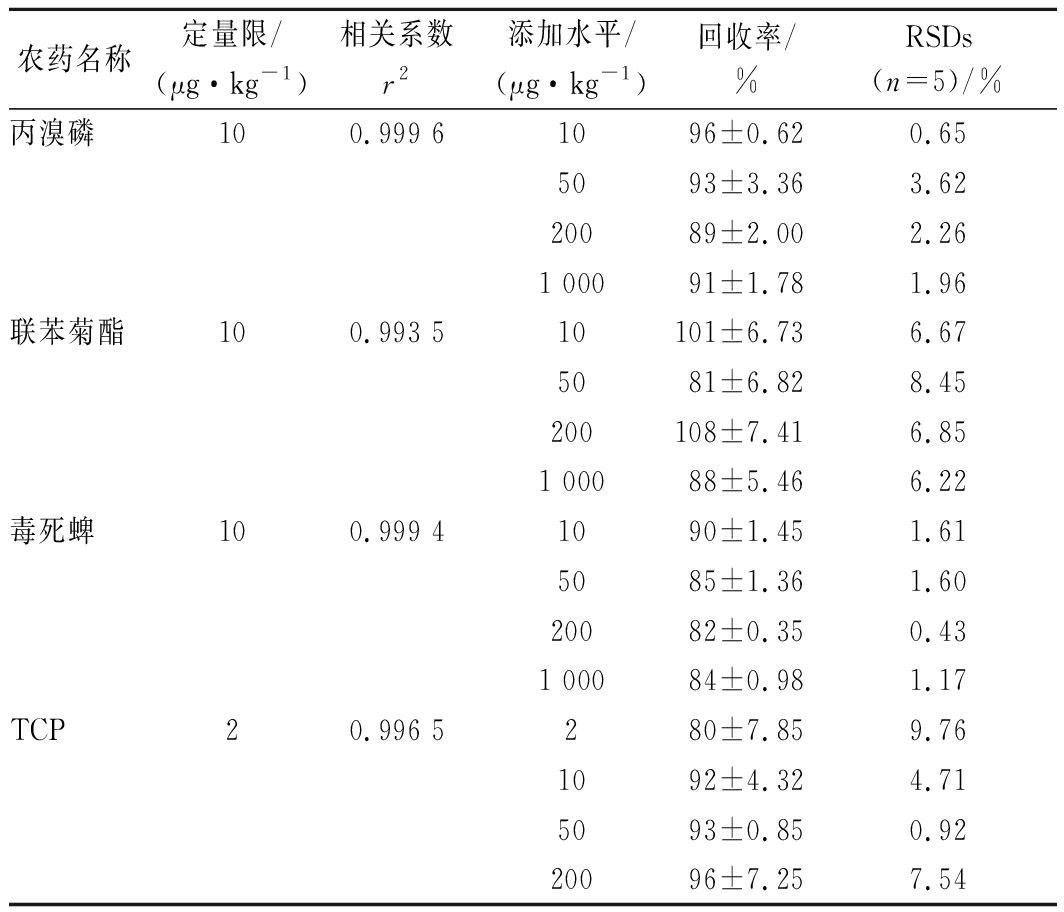
农药名称定量限/(μg·kg-1)相关系数r2添加水平/(μg·kg-1)回收率/%RSDs(n=5)/%丙溴磷100.999 61096±0.620.655093±3.363.6220089±2.002.261 00091±1.781.96联苯菊酯100.993 510101±6.736.675081±6.828.45200108±7.416.851 00088±5.466.22毒死蜱100.999 41090±1.451.615085±1.361.6020082±0.350.431 00084±0.981.17TCP20.996 5280±7.859.761092±4.324.715093±0.850.9220096±7.257.54
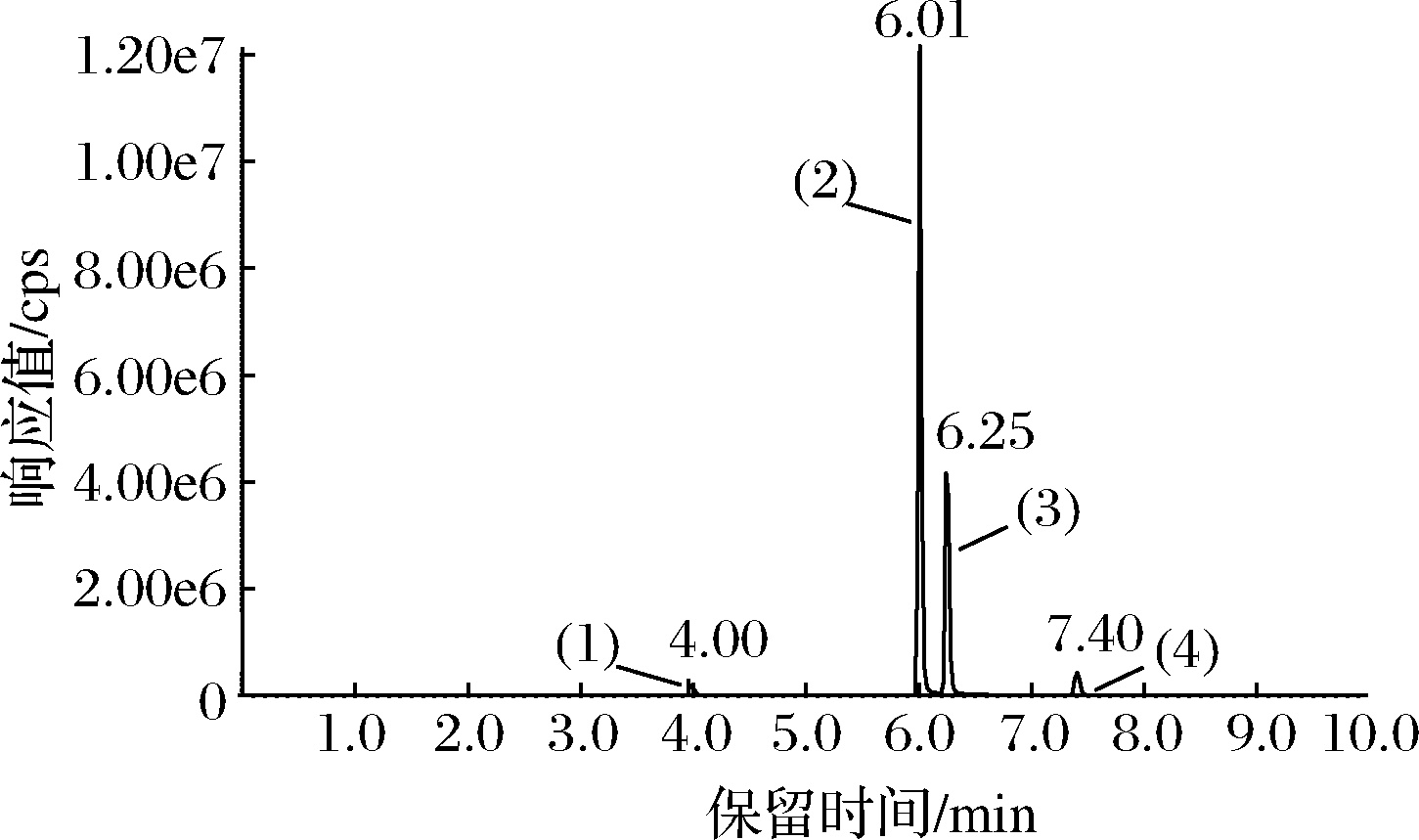
(1)-TCP;(2)-丙溴磷;(3)-毒死蜱;(4)-联苯菊酯
图1 200 μg/kg试验农药混合标准溶液的总离子流色谱图
Fig.1 The total ions chromatogram for the 200 μg/kg mixed standard solution of the experimental pesticides
2.2 柑橘生长发育过程中试验农药的残留消解变化
监测了丙溴磷、联苯菊酯、毒死蜱及其代谢物TCP在柑橘生长发育过程中的残留消解动态变化,如图2所示。施药后2 h,测得的丙溴磷、联苯菊酯、毒死蜱和TCP原始残留量分别为402.87、91.54、593.27和3.23 μg/kg。施药14 d内,丙溴磷、联苯菊酯、毒死蜱的残留量快速消解,14 d时消解率分别达到62.8%、66.0%和89.4%,均降至各自的最大残留限量(maximum residue limit,MRL)值以下[21],但与其他农药相比,3种农药在柑橘中的消解速度慢,较难降解[22-24]。之后,三者残留量呈稳定消解趋势,施药60 d时消解率为80.7%~95.5%。TCP残留量呈先升后降趋势,施药14 d时达到原始残留浓度的3.62倍,可能是毒死蜱进行代谢转化增加了TCP的残留量;14 d后TCP的残留量快速消解,表明TCP在柑橘体内积累至一定浓度后开始降解代谢[25],到60 d时残留浓度为3.69 μg/kg,与施药14 d时的最高浓度相比,消解率为68.4%。可见,TCP在柑橘中的消解速度比毒死蜱更低。
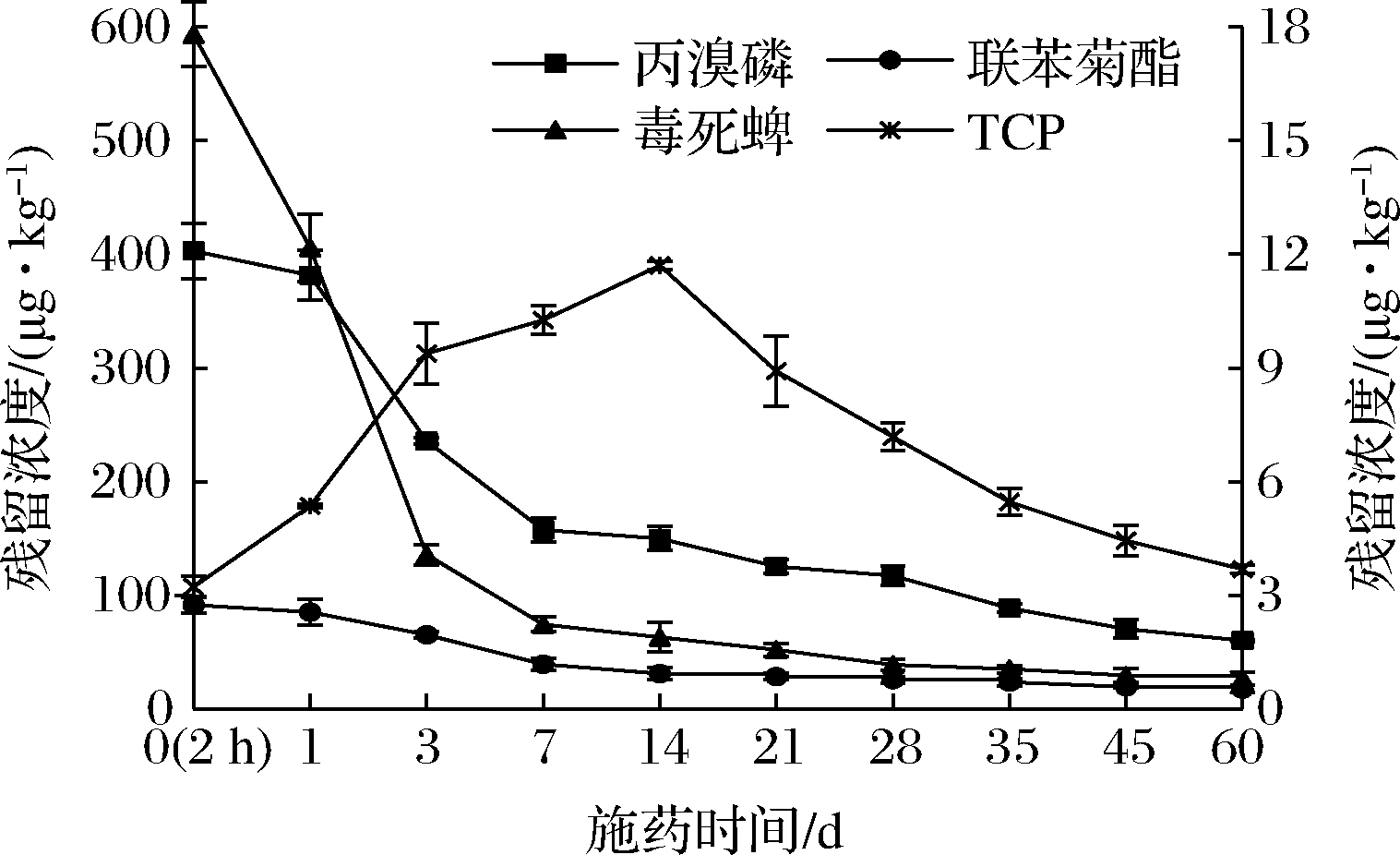
图2 试验农药在柑橘生长发育过程中的残留消解变化
Fig.2 Dissipation for the experimental pesticides during the growth and development of citrus
2.3 柑橘中试验农药残留的健康风险评价
膳食暴露风险评估是农产品质量安全评估的重
要组成部分,也是衡量产品安全性的手段之一。柑橘果实是典型的非呼吸跃变型水果,其果皮和果肉的成熟度往往不同步。温州蜜柑是宽皮柑橘的主要品种,在我国果实一般9月中下旬成熟,在完熟期之前,温州蜜柑果实在绿熟期和转色期就可能被采摘食用[26-27],使用高风险农药是否会对消费者产生健康风险需进行评价。本研究分析了3种常用杀虫剂在温州蜜柑中按照良好农业规范施用后,安全间隔期及其前后各1周采样对我国消费者的膳食风险水平。由表3和表4可知,慢性和急性暴露风险值随安全间隔期延长而降低,慢性暴露风险表现为毒死蜱>丙溴磷>联苯菊酯,分布范围在0.000 8~0.002 3,急性暴露风险表现为联苯菊酯>毒死蜱>丙溴磷,分布范围在0.000 1~0.004 5,均远低于安全界限1。因此,按照良好农业规范在温州蜜柑上施用丙溴磷、联苯菊酯和毒死蜱农药后,在安全间隔期前1周至后1周期间内,温州蜜柑中丙溴磷、联苯菊酯和毒死蜱的残留浓度对人体健康的急性或慢性膳食暴露风险均在可接受范围内,与前人研究的水果中农药残留相关风险评估结果基本一致[4,17,24,28]。
表3 试验农药对我国消费者的慢性膳食风险评估
Table 3 The chronic dietary risk assessment of the selected pesticides for Chinese consumers
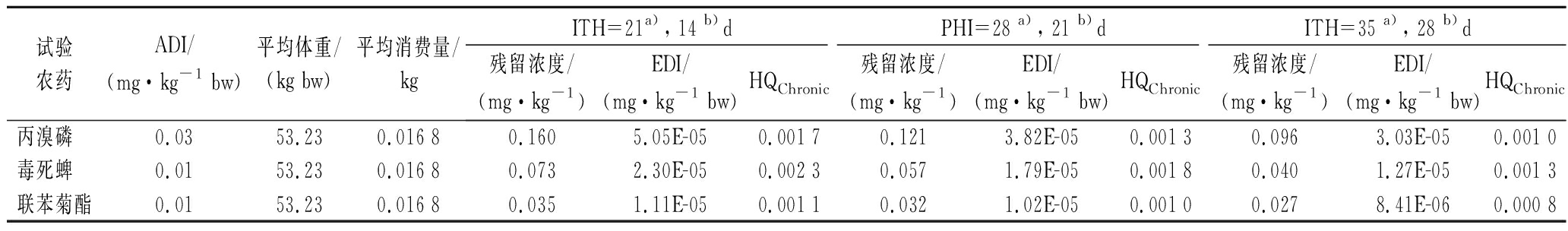
试验农药ADI/(mg·kg-1 bw)平均体重/(kg bw)平均消费量/kgITH=21a), 14 b)dPHI=28 a), 21 b)dITH=35 a), 28 b)d残留浓度/(mg·kg-1)EDI/(mg·kg-1 bw)HQChronic残留浓度/(mg·kg-1)EDI/(mg·kg-1 bw)HQChronic残留浓度/(mg·kg-1)EDI/(mg·kg-1 bw)HQChronic丙溴磷 0.0353.230.016 80.1605.05E-050.001 70.1213.82E-050.001 30.0963.03E-050.001 0毒死蜱 0.0153.230.016 80.0732.30E-050.002 30.0571.79E-050.001 80.0401.27E-050.001 3联苯菊酯0.0153.230.016 80.0351.11E-050.001 10.0321.02E-050.001 00.0278.41E-060.000 8
注:PHI(pre-harvest interval)表示安全间隔期,ITH(interval to harvest)表示采收间隔期,a)指丙溴磷和毒死蜱,b)指联苯菊酯(下同)
表4 试验农药对我国消费者的急性膳食风险评估
Table 4 The acute dietary risk assessment of the selected pesticides for Chinese consumers
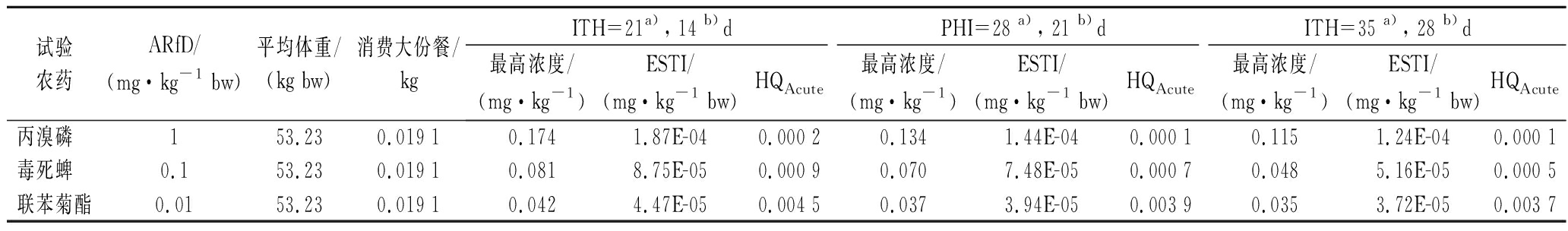
试验农药ARfD/(mg·kg-1 bw)平均体重/(kg bw)消费大份餐/kgITH=21a), 14 b)dPHI=28 a), 21 b)dITH=35 a), 28 b)d最高浓度/(mg·kg-1)ESTI/(mg·kg-1 bw)HQAcute最高浓度/(mg·kg-1)ESTI/(mg·kg-1 bw)HQAcute最高浓度/(mg·kg-1)ESTI/(mg·kg-1 bw)HQAcute丙溴磷 153.230.019 10.1741.87E-040.000 20.1341.44E-040.000 10.1151.24E-040.000 1毒死蜱 0.153.230.019 10.0818.75E-050.000 90.0707.48E-050.000 70.0485.16E-050.000 5联苯菊酯0.0153.230.019 10.0424.47E-050.004 50.0373.94E-050.003 90.0353.72E-050.003 7
3 结论
柑橘样品经QuEChERS方法处理后,采用UPLC-MS/MS技术进行检测,结果表明该方法操作简单,具有良好的准确度和精密度,可满足试验农药残留检测分析要求。在柑橘生长发育过程中,丙溴磷、联苯菊酯、毒死蜱呈先快速消解后缓慢稳定消解的趋势,而TCP残留量先升高后下降,消解速度较慢,安全间隔期及其前后1周的残留浓度均在各自的MRL值以下。按照良好农业规范在温州蜜柑上施用丙溴磷、联苯菊酯和毒死蜱后,温州蜜柑中丙溴磷、联苯菊酯和毒死蜱的残留浓度对人体健康的急性或慢性膳食暴露风险均在可接受范围内。
[1] CHHIKARA N, KOUR R, JAGLAN S, et al.Citrus medica:Nutritional, phytochemical composition and health benefits—A review[J].Food & Function, 2018, 9(4):1 978-1 992.
[2] 何雅静, 张群琳, 谷利伟, 等.柑橘中酚酸类化合物及其生物活性与机理的研究进展[J].食品与发酵工业, 2020, 46(15):301-306.
HE Y J, ZHANG Q L, GU L W, et al.Research progress on phenolic acids in citrus and their biological activities and mechanisms[J].Food and Fermentation Industries, 2020, 46(15):301-306.
[3] 国家统计局农村社会经济调查司. 2019中国农村统计年鉴[M].北京:中国统计出版社, 2019.
National Bureau of Statistics of the People′s Republic of China.China Rural Statistical Yearbook of 2019[M].Beijing:China Statistics Publishing House, 2019.
[4] DONG M F, WEN G Y, TANG H X, et al.Dissipation and safety evaluation of novaluron, pyriproxyfen, thiacloprid and tolfenpyrad residues in the citrus-field ecosystem[J].Food Chemistry, 2018, 269:136-141.
[5] BESIL N, PEREZ-PARADA A, BOLOGNA F, et al.Dissipation of selected insecticides and fungicides applied during pre-harvest on mandarin and orange trees in Uruguay[J].Scientia Horticulturae, 2019, 248:34-40.
[6] ZHAO J L, TAN Z C, WEN Y, et al.Dissipation of fluazinam in citrus groves and a risk assessment for its dietary intake[J].Journal of the Science of Food and Agriculture, 2020, 100(5):2 052-2 056.
[7] 张耀海, 焦必宁, 赵其阳, 等.我国主产地柑橘的农药残留现状研究[J].食品与发酵工业, 2011, 37(4):189-193.
ZHANG Y H, JIAO B N, ZHAO Q Y, et al.Current situation of pesticide residues in citrus from China[J].Food and Fermentation Industries, 2011, 37(4):189-193.
[8] LI Z X, ZHANG Y H, ZHAO Q Y, et al.Occurrence, temporal variation, quality and safety assessment of pesticide residues on citrus fruits in China[J/OL].Chemosphere, 2020. https://doi.org/10.1016/j.chemosphere.2020.127381.
[9] 李杨, 戴莹, 马帅, 等.QuEChERS-液相色谱-串联质谱联用法测定草莓中毒死蜱及其代谢物[J].食品安全质量检测学报, 2017, 8(9):3 531-3 535.
LI Y, DAI Y, MA S, et al.Determination of chlorpyrifos and its metabolites in strawberry using QuEChERS-liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety and Quality, 2017, 8(9):3 531-3 535.
[10] CACERES T, HE W X, NAIDU R, et al.Toxicity of chlorpyrifos and TCP alone and in combination to Daphnia carinata:The influence of microbial degradation in natural water[J].Water Research, 2007, 41(19):4 497-4 503.
[11] WANG S, WANG Z, ZHANG Y, et al.Pesticide residues in market foods in Shaanxi province of China in 2010[J].Food Chemistry, 2013, 138:2 016-2 025.
[12] 李岩, 卢雄, 宋丹丹.气相色谱-质谱法筛查测定浓缩果蔬汁中73种农药残留[J].食品与发酵工业, 2016, 42(7):217-222.
LI Y, LU X, SONG D D.Determination of 73 pesticide residues in concentrated fruit and vegetable juices using gas chromatography-mass spectrometry[J].Food and Fermentation Industries, 2016, 42(7):217-222.
[13] 舒楠, 付复华, 李高阳, 等.不同清洗方法结合磨油处理对脐橙全果降农残的影响[J].食品与发酵工业,2021.DOI:10.13995/j.cnki.11-1802/ts.026033.
SHU N, FU F H, LI G Y, et al.Effect of different cleaning methods combined with grinding oil treatment on removing pesticide residues in whole navel orange[J/OL].Food and Fermentation Industries, 2021.DOI:10.13995/j.cnki.11-1802/ts.026033.
[14] XU Z, LU L, XU Y, et al.Pesticide multi-residues in Dendrobium officinale Kimura et Migo:Method validation, residue levels and dietary exposure risk assessment[J/OL].Food Chemistry, 2021. https://doi.org/10.1016/j.foodchem.2020.128490.
[15] 谢娟, 王颜红, 王世成, 等.GC-MS法测定蔬菜中3,5,6-三氯-2羟基吡啶[J].食品科学, 2010, 31(24):277-280.
XIE J, WANG Y H, WANG S C, et al.Determination of 3,5,6-trichloro-2-pyridinol in vegetables by gas chromatography-mass spectrometry[J].Food Science, 2010, 31(24):277-280.
[16] YIN P, DAI J X, GUO G Y, et al.Residue pattern of chlorpyrifos and its metabolite in tea from cultivation to consumption[J/OL].Journal of the Science of Food and Agriculture,2021.https://doi.org/10.1002/jsfa.11049.
[17] PANG N N, DOU X Y, HU J Y.Residue behaviours, dissipation kinetics and dietary risk assessment of pyaclostrobin, cyazofamid and its metabolite in grape[J].Journal of the Science of Food and Agriculture.2019, 99:6 167-6 172.
[18] WHO.2020a.Inventory of evaluations performed by the Joint Meeting on Pesticide Residues (JMPR)[EB/OL].http://apps.who.int/pesticide-residues-jmpr-database/Home/Range/All(2021-02-20).
[19] WHO.2020b.Global Environment Monitoring System (GEMS/food)[EB/OL].http://www.who.int/foodsafety/areas_work/chemical-risks/gems-food/en/(2021-02-21).
[20] 中华人民共和国农业农村部. NY/T 788—2018农作物中农药残留试验准则[S].北京:中国农业出版社, 2018.
Ministry of Agriculture and Rural Affairs of the People′s Republic of China.NY/T 788—2018 Guideline for the testing of pesticide residue in crops[S].Beijing:China Agricultural Press, 2018.
[21] 中华人民共和国国家卫生健康委员会, 中华人民共和国农业农村部, 国家市场监督管理总局.GB 2763—2019食品安全国家标准 食品中农药最大残留限量[S].北京:中国农业出版社, 2019.
National Health Commission of the People′s Republic of China, Ministry of Agriculture and Rural Affairs of the People′s Republic of China, State Administration for Market Regulation.GB 2763—2019 National food safety standard Maximum residue limits for pesticides in food[S].Beijing:China Agricultural Press, 2019.
[22] WANG C, QIU L H, ZHAO H Y, et al.Dissipation dynamic and residue distribution of flusilazole in mandarin[J].Environmental Monitoring & Assessment, 2013, 185:9 169-9 176.
[23] SUN D L, ZHU Y M, PANG J X, et al.Residue level, persistence and safety of spirodiclofen-pyridaben mixture in citrus fruits[J].Food Chemistry, 2016, 194:805-810.
[24] ZHAO J L, TAN Z C, WEN Y, et al.Dissipation of fluazinam in citrus groves and a risk assessment for its dietary intake[J].Journal of the Science of Food and Agriculture, 2020, 100(5):2 052-2 056.
[25] 孙宝利, 陕红, 袁志华, 等.毒死蜱主要代谢物3,5,6-TCP在土壤、植物中的累积与转化[J].河北农业大学学报, 2013, 36(1):85-89.
SUN B L, SHAN H,YUAN Z H, et al.Accumulation and transformation of the chlorpyrifos metabolite 3,5,6-TCP in soil and plants[J].Journal of Agricultural University of Hebei, 2013, 36(1):85-89.
[26] 周琦, 易鑫, 欧阳祝, 等.顶空固相微萃取-气相色谱-质谱联用结合多元统计法分析不同品种温州蜜柑汁的香气成分[J].食品与发酵工业, 2020, 46(10):248-254.
ZHOU Q, YI X, OUYANG Z, et al.Analysis of aroma components in different satsuma juices by HS-SPME-GC-MS combined with multivariate statistical methods[J].Food and Fermentation Industries, 2020, 46(10):248-254.
[27] 刘淑桢, 韩静雯, 云泽, 等.国庆1号温州蜜柑果实成熟过程中极性代谢物的变化[J].中国农业科学, 2012, 45(21):4 437-4 446.
LIU S Z, HAN J W, YUN Z, et al.Changes of polar metabolites in Guoqing No.1 satsuma mandarine during fruit ripening[J].Scientia Agricultura Sinica, 2012, 45(21):4 437-4 446.
[28] MALHAT F, ABDALLAH O, AHMED F, et al.Dissipation behavior of thiophanate-methyl in strawberry under open field condition in Egypt and consumer risk assessment[J].Environmental Science and Pollution Research, 2021, 28:1 029-1 039.