马克斯克鲁维酵母(Kluyveromyces marxianus)作为一种食品安全级酵母[1-2],具有耐热性强、生长快、可利用的底物范围广等特点[3-5],被越来越多的研究人员用于构建微生物细胞工厂[6],成为潜在的工业生产应用菌[7]。相较于酿酒酵母,马克斯克鲁维酵母不仅能够利用葡萄糖,还拥有完整的木糖和阿拉伯糖代谢酶系统[8-9]。木糖进入酵母细胞后,首先在木糖还原酶和还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)的作用下生成木糖醇,而后在木糖醇脱氢酶和辅酶NAD+的作用下形成D-木酮糖,最后在木酮糖激酶的催化下合成木酮糖-5-磷酸,继而进入五碳糖磷酸途径和糖酵解途径。因此,马克斯克鲁维酵母具有利用木质纤维素类生物质生产生物燃料和生物基化学品的潜力[10]。然而木质纤维素类生物质通常是混合碳源,由于葡萄糖效应的存在,其他碳源尤其是木糖的代谢会被抑制,导致其利用效率的下降[11]。因此,进行马克斯克鲁维酵母葡萄糖效应方面的研究对于解决其葡萄糖、木糖共利用的问题具有积极意义。
目前酿酒酵母的葡萄糖效应研究基础较好[12]。mig1基因作为葡萄糖转录负调控中的关键因子,其编码的蛋白MIG1具有C2H2锌指结构,可在葡萄糖的作用下与多个基因的启动子结合,从而抑制基因的转录[13]。在无葡萄糖或葡萄糖含量很低时,MIG1蛋白不再结合到相关基因的启动子上,解除阻遏基因转录的抑制。因此,通过敲除酿酒酵母mig1基因的方式可以有效地解除其葡萄糖效应。与酿酒酵母相比,目前马克斯克鲁维酵母中葡萄糖效应相关的研究较少,其葡萄糖对木糖代谢抑制的机理研究还不明确。结合马克斯克鲁维酵母基因组中存在酿酒酵母MIG1蛋白同源基因mig1(GenBank ID:34714544),本研究拟将出发菌株LJ0的mig1基因敲除,并对野生型菌株和敲除菌株的葡萄糖、木糖以及混合糖利用能力进行检测评价,研究其对马克斯克鲁维酵母葡萄糖效应和对利用不同碳源发酵的影响,具有较大的理论意义。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基
出发菌株:K.marxianus 菌株LJ0由本校微生物基因工程研究室保藏。
YPD培养基(g/L):酵母浸粉10,蛋白胨20,葡萄糖20。
筛选培养基:潮霉素终质量浓度为100 μg/mL的YPD培养基。
发酵培养基(g/L):酵母浸粉10,蛋白胨20,一定浓度的葡萄糖(或木糖)。
1.1.2 主要试剂
逆转录试剂盒、荧光定量PCR试剂盒,康为世纪生物科技有限公司;木糖、Taq DNA聚合酶、Ezup柱式酵母基因组DNA抽提试剂盒,生工生物工程(上海)股份有限公司;葡萄糖测定试剂盒,上海荣盛生物药业有限公司。
1.2 实验方法
1.2.1 mig1基因的敲除
采用同源重组法[14-15]进行基因敲除研究,拟用编码潮霉素基因hptII的CDS(蛋白质编码区)替换基因组DNA中的mig1基因的CDS,过程见图1。根据GenBank中K.marxianus DMKU3-1042菌株的基因组DNA序列设计引物,扩增mig1基因CDS上下游各500 bp的同源臂片段mig1a、mig1b,并利用重叠延伸PCR技术[16]将两者与hptII的CDS序列构建拼接获得同源重组敲除片段mig1a-hptII-mig1b。利用电转化法[17]将敲除片段导入酵母细胞中,通过含有潮霉素的YPD平板筛选出敲除菌株,并进行hptII基因的PCR验证。
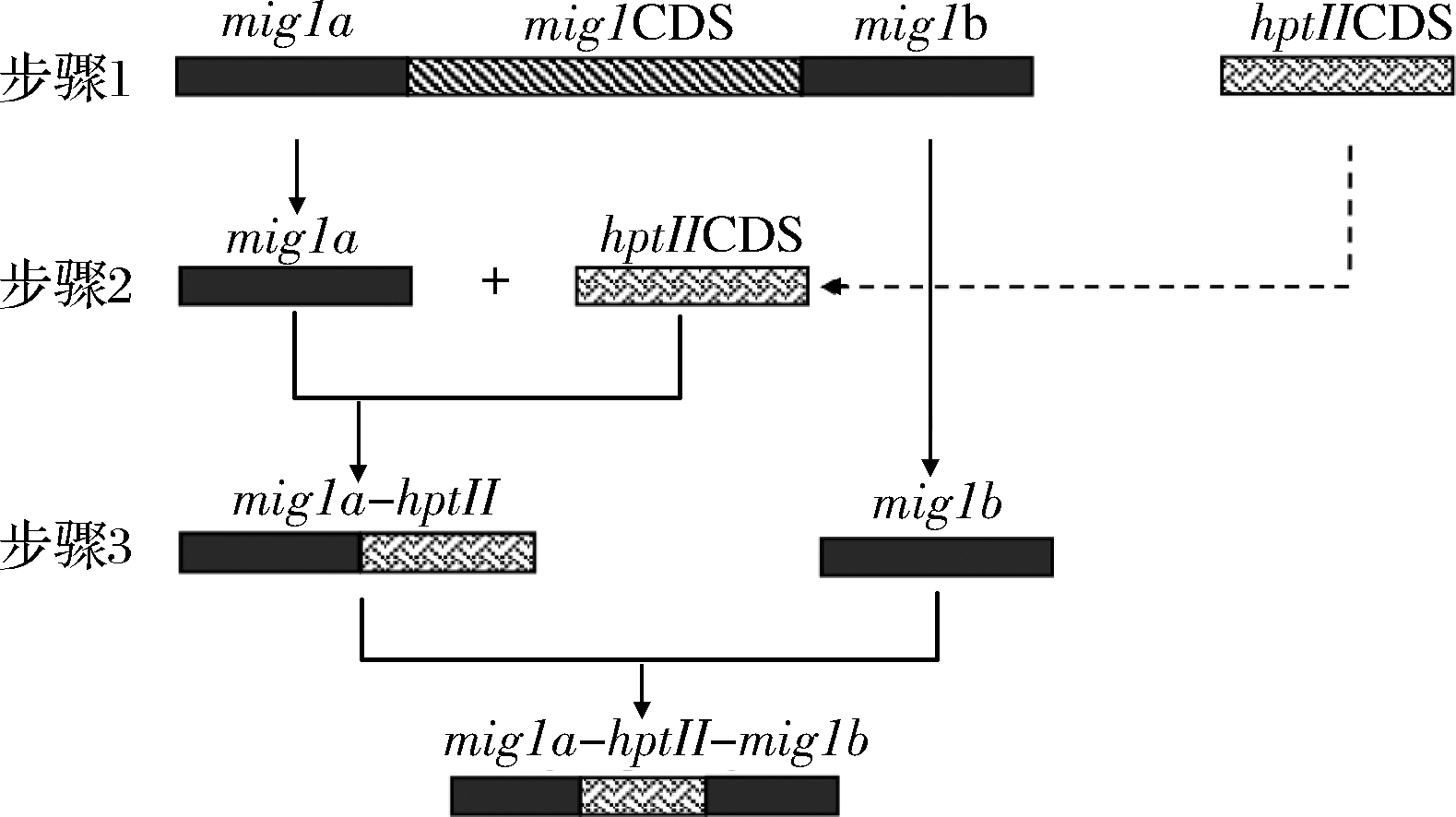
图1 mig1基因敲除同源片段的构建过程
Fig.1 Working flow for mig1 disruption cassette construction
1.2.2 敲除菌株的验证
以敲除菌株的基因组DNA为模板,扩增抗性标记基因hptII进行PCR验证,以原始菌株与敲除菌株的总RNA为模板,经逆转录后得到相应的cDNA。以得到的cDNA为模板,分别针对mig1基因进行荧光定量PCR验证,内参基因为act1基因。每个样品取3个重复根据2株菌株的循环阈值(cycle threshold,Ct),计算平均值,依照RATE=2-ΔΔCt来计算相关基因的相对表达量,验证菌株的mig1是否已经被敲除。
1.2.3 以不同碳源进行发酵
以不同浓度的葡萄糖、木糖以及不同比例的混合糖为碳源对野生型菌株和敲除菌株进行发酵,检测mig1基因的敲除是否对利用不同碳源的发酵产生影响。
1.2.4 生长曲线的测定
将种子液接种到发酵培养基当中,每隔12 h取样1次,对样品进行适当稀释,以无菌水作为参比,测定菌液在波长为600 nm时的吸光度,吸光度=稀释倍数×OD600。
1.2.5 发酵液残糖分析
利用DNS法[18]测定发酵液中还原糖的含量,利用葡萄糖测定试剂盒测定发酵液中葡萄糖的含量。
1.2.6 木糖代谢关键酶基因表达量的检测
以40 g/L的木糖为碳源对原始菌株与敲除菌株进行发酵培养,分别提取总RNA为模板,针对木糖代谢关键酶木糖还原酶基因xyl1、木糖醇脱氢酶基因xdh、木酮糖激酶基因xks1进行荧光定量PCR分析。
2 结果与分析
2.1 敲除菌株的验证
通过重叠PCR获得同源重组片段mig1a-hptII-mig1b,电泳结果如图2-a所示,片段大小与预期一致。从潮霉素筛选平板中挑取长势良好的单菌落LJ37菌株后,提取基因组DNA扩增hptII基因,电泳结果如图2-b所示,片段大小为1 026 bp,与预期一致,表明同源重组片段已成功整合到酵母基因组DNA中。提取野生型菌株和敲除菌株的基因组RNA,逆转录为cDNA后、利用荧光定量PCR检测2株菌株的mig1相对表达量。结果显示荧光扩增曲线图中无法检测出敲除菌株的mig1的信号,证明目的基因mig1并未表达,敲除菌株成功构建。
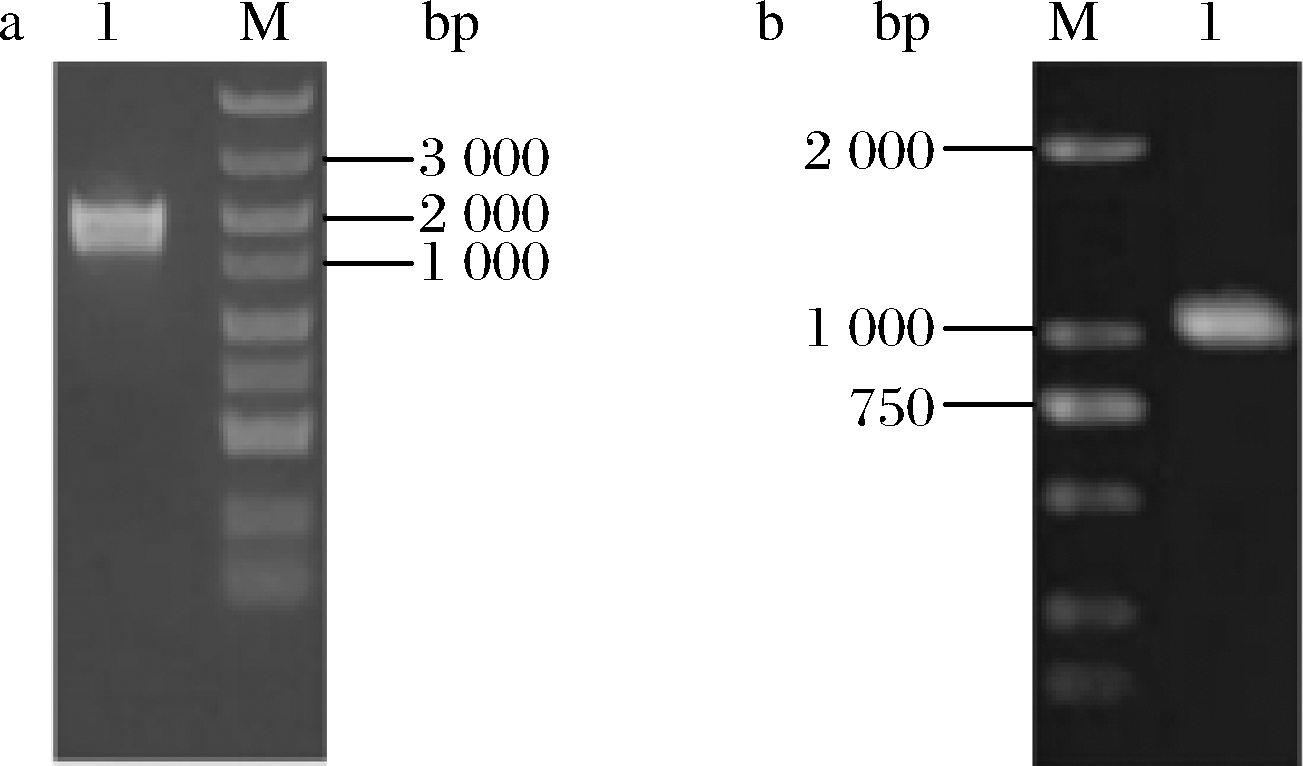
a:M-DNA marker;1-mig1a-hptII-mig1b;
b:M-DNA marker;1-hptII
图2 同源重组片段及hptII基因片段电泳结果
Fig.2 Electrophoresis results of homologous recombination fragments and hptII gene fragments
2.2 对葡萄糖利用的影响
以葡萄糖为碳源对野生型菌株LJ0和敲除菌株LJ37进行发酵。图3为2株菌株利用不同浓度葡萄糖发酵的菌株生长曲线。当葡萄糖质量浓度为40 g/L时,敲除菌株LJ37最终生长量OD600为17.43,是野生型菌株LJ0的1.24倍。当葡萄糖质量浓度提升到80、120、160 g/L时,野生型菌株生长量有所提高,但达到的最大生长量基本一致,而敲除LJ37菌株的最大生长量可随着糖浓度的增加继续增加。在糖浓度达到160 g/L时,LJ37的生长量提升为原始菌株的1.17倍,尽管提升程度较低浓度发酵有所降低,但在糖浓度较高时敲除菌株能够在12 h迅速生长到平台期,达到最大生长量。在ZHANG等[19]的相关研究中,构建的mig1敲除菌株较亲本葡萄糖抑制效应降低了49.88%,葡萄糖代谢能力得到显著提高,与本文结果一致。同时根据其他相关研究[20-21]中的内容,mig1基因的敲除也能够有效提高酿酒酵母、面包酵母菌株葡萄糖的利用速率和生物量。结果表明,敲除菌株LJ37可以适应更高浓度的葡萄糖,mig1基因的敲除有助于提高其在高浓度葡萄糖条件下的生长量,这对于马克斯克鲁维酵母高密度发酵的研究具有参考价值。
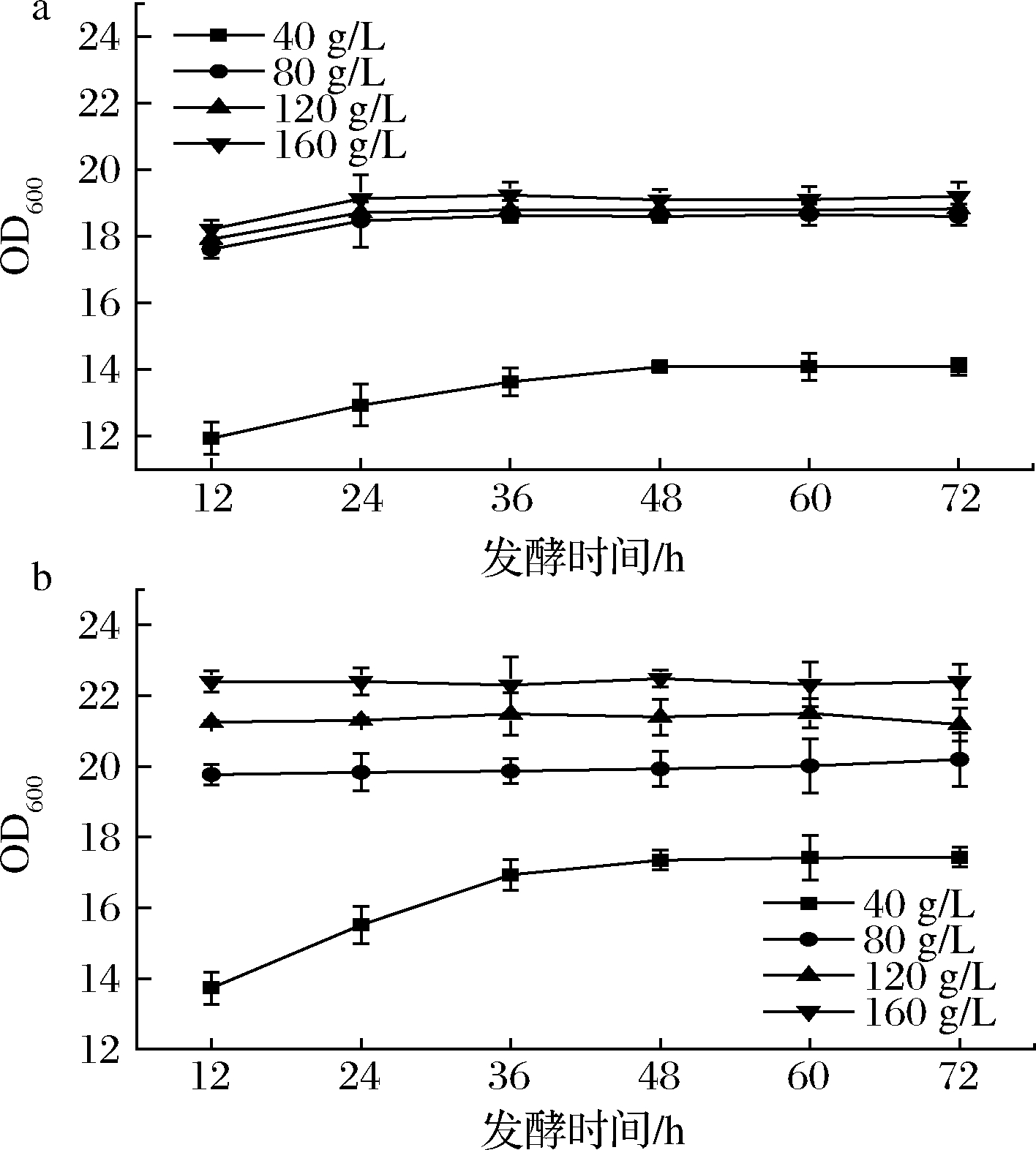
a-菌株LJ0;b-菌株LJ37
图3 葡萄糖发酵生长曲线
Fig.3 The growth curves of glucose fermentation
2.3 对木糖利用的影响
以木糖为碳源对野生型菌株LJ0和敲除菌株LJ37进行发酵,图4为2株菌株在不同浓度木糖下生长的发酵曲线及残糖变化曲线。在生长量方面,敲除菌株的整体生长量较原始菌株高。当木糖质量浓度为20 g/L时,2株菌株均达到最大生长量且此时2株菌株的生长量差距最大,较原始菌株生长量提高19.1%。当底物木糖质量浓度高于20 g/L时,2株菌株的生长量都会随着底物碳源浓度的升高而降低,但敲除菌株的整体生长量仍高于野生型菌株。在XU等[22]通过构建mig1突变体提高酿酒酵母木糖利用率的研究中发现,mig1基因的敲除对木糖代谢途径中多个关键基因相对表达量的提升有促进作用,与本文的实验结果相一致。总体而言,相较于野生型菌株,敲除菌株LJ37的生长量随着底物木糖浓度的增长变化更为明显。
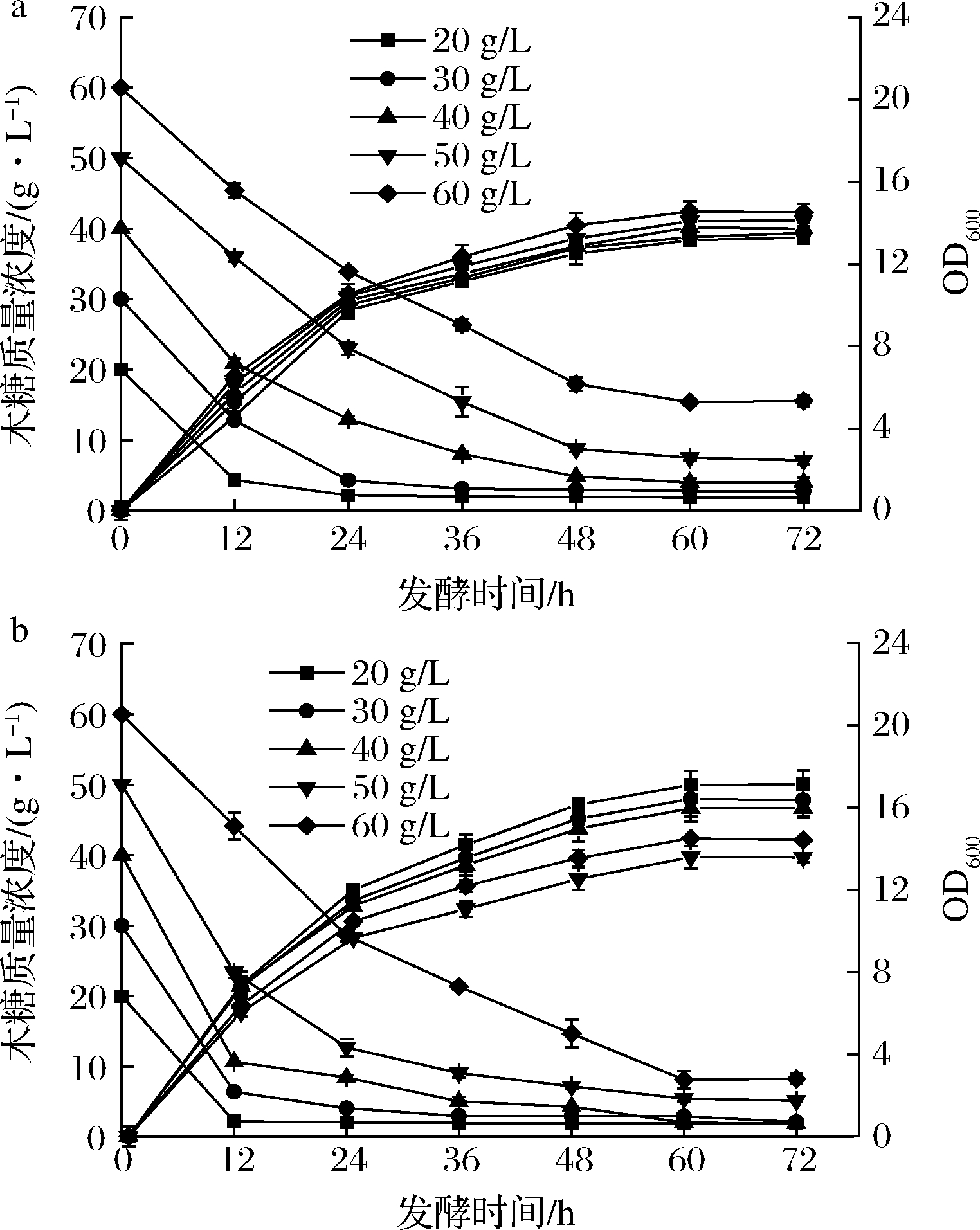
a-菌株LJ0;b-菌株LJ37
图4 木糖发酵生长曲线及残糖曲线
Fig.4 The growth curve and the residual sugar curves of xylose fermentation
通过测定野生型菌株LJ0和敲除菌株LJ37在不同木糖浓度条件下发酵培养基中的残糖浓度,进行木糖消耗量分析。当起始木糖质量浓度较低时(20~40 g/L),2株菌株均能在48 h内将底物木糖基本全部利用,随着初始底物中木糖含量的增加,敲除菌株在代谢速率上的优势愈明显。在此过程中,2株菌株均在木糖质量浓度为40 g/L、发酵12 h时达到最大糖利用速率,其中敲除菌株的最大糖利用速率达到2.44 g/(L·h),为野生型菌株的1.6倍,提升较为明显。结合2株菌株的生长情况得出,较于原始菌株,mig1基因的敲除除了提升菌株木糖的代谢能力外,对于底物木糖浓度的变化也更加敏感。当木糖质量浓度提升到60 g/L时,敲除菌株最终的木糖利用率达到86.2%,为野生型菌株的1.16倍,但此条件下2株菌株的整体木糖代谢速率差异明显减小,可能是高底物浓度对于马克斯克鲁维酵母木糖代谢有负面影响。王亮[23]在针对马克斯克鲁维酵母高密度发酵条件的优化研究中也指出,当木糖质量浓度超过65 g/L时,酵母的生长量开始降低。以上结果表明mig1基因的敲除有利于马克斯克鲁维酵母木糖代谢能力提升,可能是基因敲除解除了部分木糖代谢途径中关键酶基因的抑制作用。
2.4 对混合糖利用的影响
以不同比例葡萄糖、木糖的混合糖为碳源对野生型菌株LJ0和敲除菌株LJ37进行发酵。由于总糖浓度过高会影响渗透压使酵母菌的生长受到抑制,本文选用混合糖中木糖含量为20 g/L,葡萄糖的添加量分别为20、40、60、80 g/L。图5为2株菌株利用不同比例混合糖进行发酵的生长曲线。敲除菌株整体生长量较原始菌株高,随着混合糖浓度的增大,菌株的生长量逐渐升高。当混合糖质量浓度为20~80 g/L时,LJ37达到最大生长量,OD600达到30.27,为原始菌株的1.19倍。
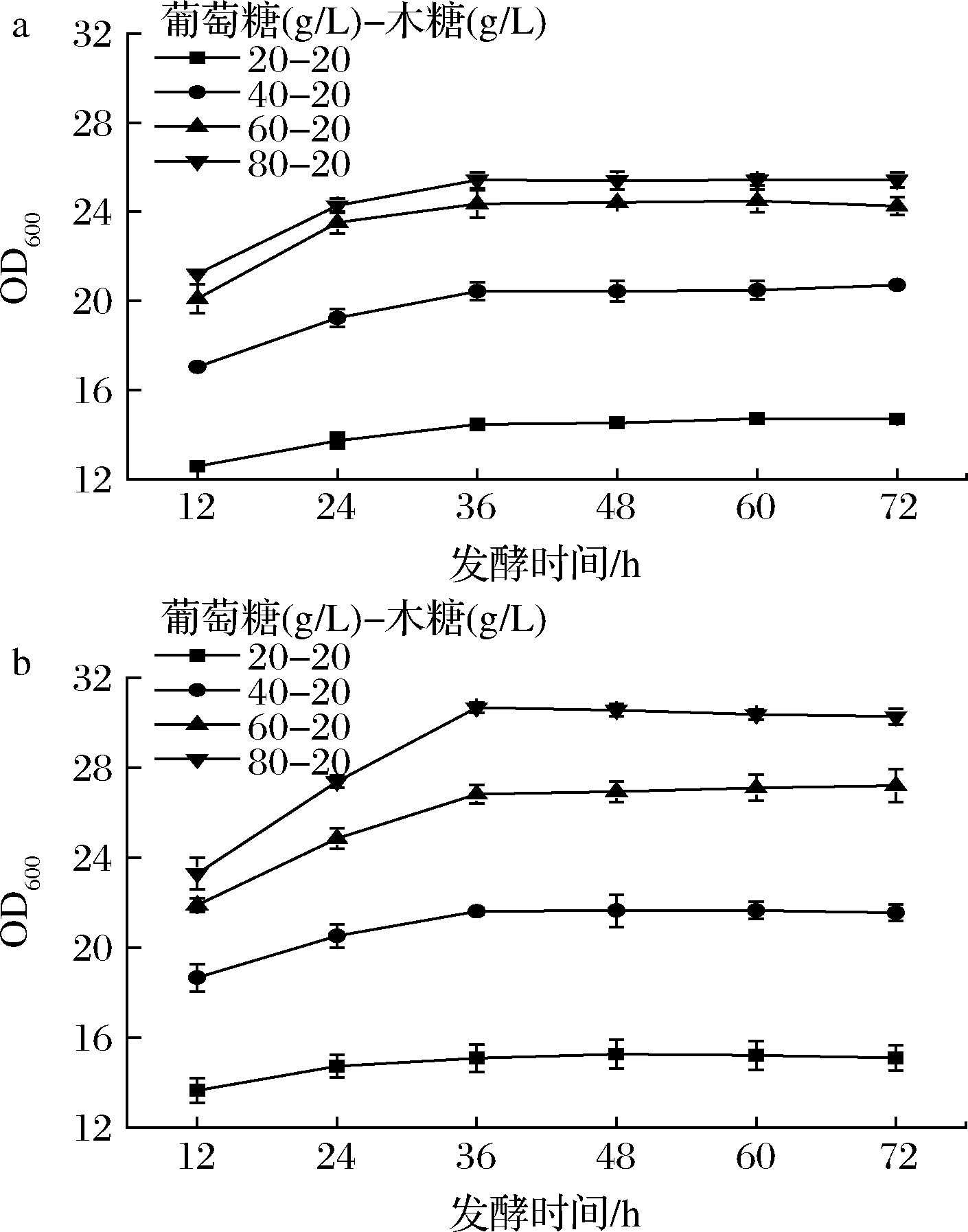
a-菌株LJ0;b-菌株LJ37
图5 混合糖发酵生长曲线
Fig.5 The growth curves of mixed xylose and glucose fermentation
通过研究2株菌株发酵过程中总残糖及葡萄糖残糖的浓度变化,可以计算出葡萄糖、木糖的消耗情况。分别测定2株菌株不同比例混合糖发酵液中的总残糖和葡萄糖残糖浓度,经对比敲除菌株的糖利用率和糖利用速率均优于原始菌株,与利用纯木糖进行发酵时的情况一致。其中混合糖质量浓度为20~80 g/L时差异最为显著,如图6-a所示。经过计算,2株菌株木糖残糖变化趋势见图6-b,可以看出2株菌株在发酵初期基本不利用木糖,发酵前18 h内仍以葡萄糖为主要碳源进行生长,当18 h后葡萄糖基本消耗完全,2株菌株开始代谢木糖进行生长,在后续消耗木糖进行生长的阶段中,敲除菌株LJ37的木糖代谢能力要强于原始菌株。另外,敲除菌株发酵底物中在12 h出现木糖逐渐减少的现象,但由于消耗的木糖量较少且并未在发酵初始就能够利用木糖,因此无法认为敲除菌株具有同时代谢2种糖的能力,即敲除菌株的木糖代谢能力虽然得到提高,但并未出现葡萄糖和木糖共代谢能力提高的现象。
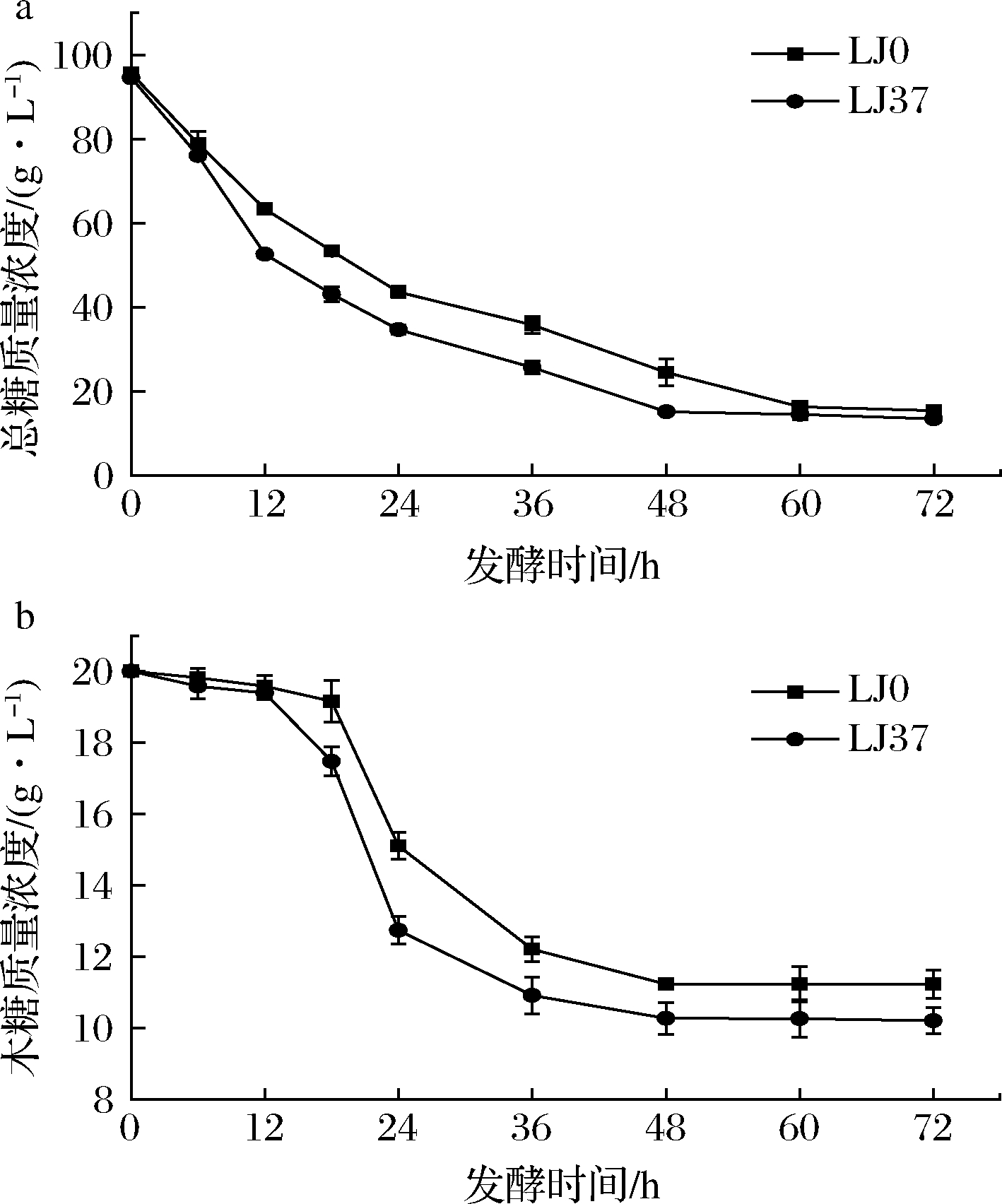
a-总糖质量浓度;b-木糖质量浓度
图6 混合糖发酵糖利用情况
Fig.6 The sugar utilization of mixed xylose and glucose fermentation
本研究中mig1基因的单敲除未能真正有效解除葡萄糖的抑制效应,推测葡萄糖阻遏效应的解除可能同时受到多个转录因子的共同调控。蔡艳青等[25]研究发现,酿酒酵母中mig1基因的敲除对于混合糖发酵中的木糖代谢并没有明显促进作用,原因可能是由于在葡萄糖效应中mig1还受到另一个关键因子snf1的负调控,需要进一步敲除snf1才可解除葡萄糖对次级碳源的阻碍作用。卢敏[11]对于马克斯克鲁维酵母混合糖共利用菌株构建的研究指出,由己糖激酶基因Hxk介导产生的葡萄糖磷酸化信号对于SNF1形成蛋白复合体以及后续MIG1蛋白的磷酸化起到调控作用,导致非葡萄糖碳源部分代谢基因的转录受到抑制,并通过敲除KmHxk基因成功解除了葡萄糖的抑制效应,但Hxk作为葡萄糖代谢通路的关键基因,敲除会导致葡萄糖代谢的严重缺陷,菌株将无法继续利用葡萄糖。由于目前针对马克斯克鲁维酵母的葡萄糖抑制效应的研究相对较少,后续实验仍需要进一步对葡萄糖效应的其他调控因子和解除葡萄糖阻遏的其他方式进行研究。
2.5 木糖代谢关键酶基因表达量的检测
以木糖为唯一碳源时,当木糖质量浓度为40 g/L,发酵12 h时木糖代谢速率达到最大值。为了在基因转录水平揭示mig1基因的敲除对于木糖代谢途径中关键酶的影响,在该发酵条件下分别检测野生型菌株和敲除菌株3个关键基因木糖还原酶基因xyl1、木糖醇脱氢酶基因xdh、木酮糖激酶基因xks1的相对表达量。图7为2株菌株关键基因相对表达量差异图。以木糖为碳源时,敲除菌株LJ37基因xyl1、xdh、xks1的相对表达量是野生型菌株的2.25、2.43、2.00倍。3种关键酶基因的相对表达量较野生型菌株均有一定程度的提升,证明mig1基因的敲除有利于提高3种关键酶基因的转录水平。在蔡艳青等[25]对酿酒酵母转录组的分析研究中指出,mig1敲除菌株中上调表达的基因中有部分与色氨酸的降解、精氨酸的吸收以及甘氨酸的代谢相关,这些基因可能直接或间接受到mig1基因的控制。这些氨基酸作为柠檬酸循环的关键中间代谢物对总反应中还原型辅酶I(nicotinamide adenine dinucleotide,NADH)的合成起到了关键作用,进而影响NADH作为辅酶在木糖代谢中催化木糖醇转化为D-木酮糖的过程,加快了木糖进入细胞后的催化过程,使得关键酶基因的表达量得到提高。
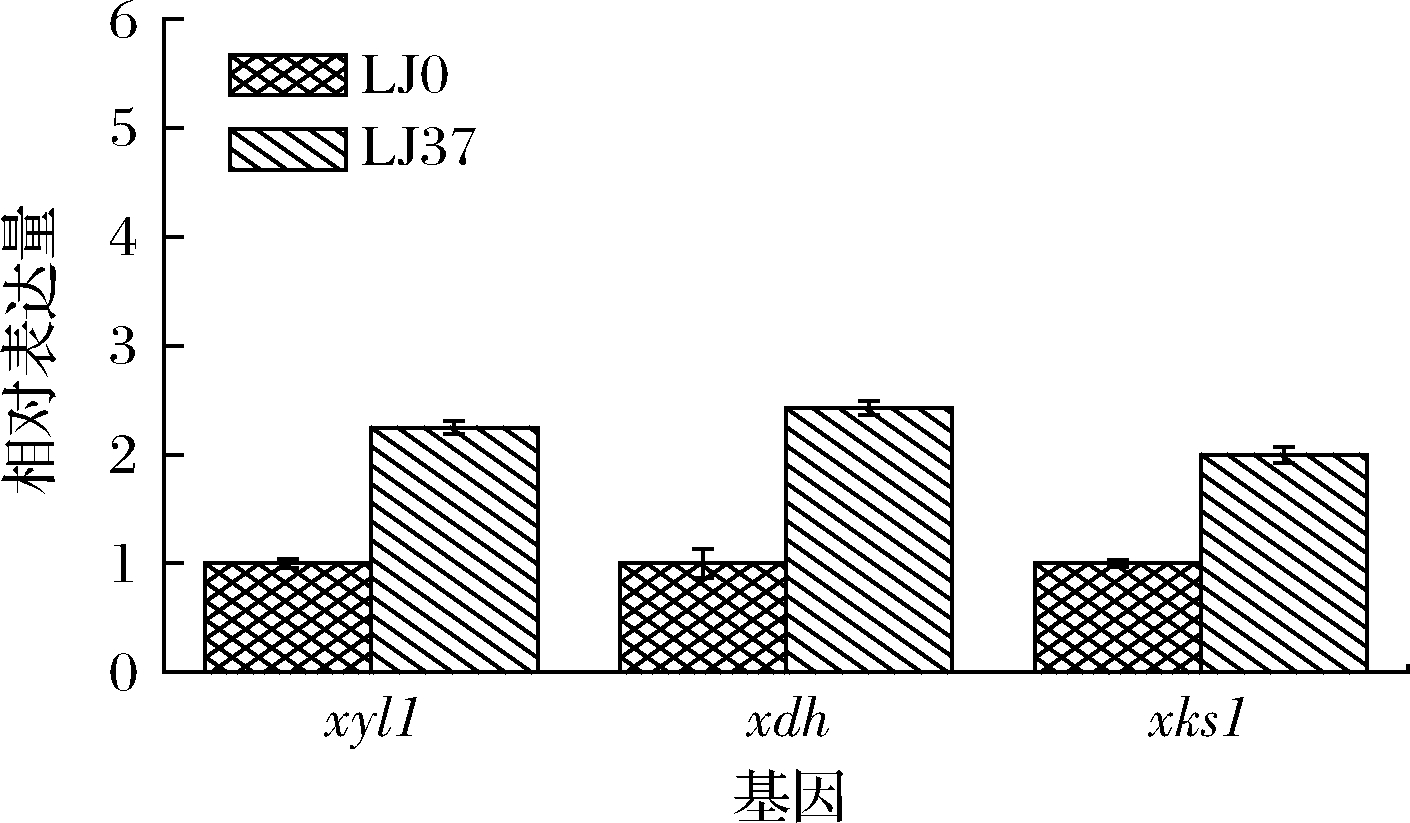
图7 木糖发酵关键基因的相对表达量
Fig.7 The relative expression levels of key genes in xylose metabolism
3 结论
本文以马克斯克鲁维酵母LJ0为出发菌株,通过同源重组法敲除mig1基因,构建了敲除菌株LJ37,通过检测2株菌株在不同碳源下的发酵性能,找出敲除mig1对于马克斯克鲁维酵母利用不同碳源的影响。实验结果表明,mig1基因的敲除对于葡萄糖和木糖条件下菌株发酵的最大生长量均有所提升。在木糖发酵过程中,敲除菌株的生长量提升为野生型菌株的1.19倍,最大生长速率提升到2.44 g/(L·h),为野生型菌株的1.6倍。在葡萄糖发酵过程中生长量提升则更为明显,敲除菌株的最大生长量提升为野生型菌株的1.24倍。但在混合糖发酵中2株菌株的代谢糖能力差异较小,发酵过程中木糖的消耗速率差别不大,说明mig1基因的敲除并未完全解除葡萄糖的抑制效应。在对木糖代谢关键酶基因的测定结果方面,发现敲除菌株在木糖发酵条件下的部分关键酶基因的表达量得到提高,进一步确认了mig1基因的敲除有利于促进马克斯克鲁维酵母对于木糖的利用。总体而言,mig1基因的敲除对于混合糖发酵的影响不明显,但是提高了菌株利用葡萄糖和木糖的能力。此外敲除菌株除了在葡萄糖发酵中代谢能力得到有效提高,还能够利用较高浓度葡萄糖进行生长,在高密度发酵方面具有一定的潜力。
[1] LANE M M, MORRISSEY J P.Kluyveromyces marxianus:A yeast emerging from its sister′s shadow[J].Fungal Biology Reviews, 2010, 24(1-2):17-26.
[2] 莫文娟, 郭超, 吕红.马克斯克鲁维酵母的遗传与生理特征[J].中国科学:生命科学, 2016, 46(4):413-419.
MO W J, GUO C, LYU H.Review of Kluyveromyces marxianus′ genetic and physiological features[J].Scientia Sinica (Vitae), 2016, 46(4):413-419.
[3] 岳寿松, 边斐, 张燕, 等.马克斯克鲁维酵母菌的分离鉴定与所产乳糖酶酶学性能研究[J].山东农业科学, 2018, 50(11):66-70;101.
YUE S S, BIAN F,ZHANG Y, et al.Isolation and identification of Kluyveromyces marxianus strain and properties of its product of β-galactosidase[J].Shandong Agricultural Sciences, 2018, 50(11):66-70;101.
[4] 刘梦. 马克斯克鲁维酵母发酵黄酒特性研究及木糖转化工程菌株的构建[D].武汉:武汉轻工大学, 2017.
LIU M.Characteristics of Chinese red wine fermented by Kluyveromyces marxianus and construction of xylose metabolic engineered strains[D].Wuhan:Wuhan Polytechnic University, 2017.
[5] 侯胜博. 马克斯克鲁维酵母的戊糖发酵[D].大连:大连理工大学, 2017.
HOU S B.Pentose fermentation of Kluyveromyces marxianus[D].Dalian:Dalian University of Technology, 2017.
[6] 王冬梅, 洪泂.在耐热的马克斯克鲁维酵母中构建微生物细胞工厂[J].生物学杂志, 2020, 37(1):1-10.
WANG D M, HONG J.Constructing microbial cell factory with thermo-tolerant yeast Kluyveromyces marxianus[J].Journal of Biology, 2020, 37(1):1-10.
[7] 陈成, 汪洪涛, 陈宝宏, 等.马克斯克鲁维酵母发酵产β-葡聚糖工艺优化[J].食品工业, 2015, 36(1):133-136.
CHEN C, WANG H T, CHEN B H, et al.Optimization of production process of β-glucans from Kluyveromyces marxianus[J].The Food Industry, 2015, 36(1):133-136.
[8] 高教琪, 韩锡铜, 孔亮, 等.马克斯克鲁维酵母在工业生物技术中的应用[J].中国生物工程杂志, 2014, 34(2):109-117.
GAO J Q, HAN X T, KONG L, et al.Application progress of Kluyveromyces marxianus in the industrial biotechnology[J].China Biotechnology, 2014, 34(2):109-117.
[9] 侯胜博, 冯华良, 高教琪, 等.马克斯克鲁维酵母的木糖和阿拉伯糖发酵[J].生物工程学报, 2017, 33(6):923-935.
HOU S B, FENG H L, GAO J Q, et al.Fermentations of xylose and arabinose by Kluyveromyces marxianus[J].Chinese Journal of Biotechnology, 2017, 33(6):923-935.
[10] 牛明福, 李亚恒, 陈金帅, 等.马克斯克鲁维酵母生物转化2-苯乙醇工艺优化及耐高温特性分析[J].食品与发酵工业, 2018, 44(2):15-20.
NIU M F, LI Y H, CHEN J S, et al.Optimization and characterization of 2-phenylethanol bioconversion by thermotolerant yeast Kluyveromyces marxianus[J].Food and Fermentation Industries, 2018, 44(2):15-20.
[11] 卢敏. 工程改造马克斯克鲁维酵母进行混合糖共利用[D].合肥:中国科学技术大学, 2015.
LU M.Genetically engineered Kluyveromyces marxianus for mix-sugar utilization[D].Hefei:University of Science and Technology of China, 2015.
[12] 池振明, 马再超.酵母菌诱导和阻遏分子机理的研究进展[J].中国海洋大学学报(自然科学版), 2013, 43(1):47-55.
CHI Z M, MA Z C.Research progress in the molecular mechanism of induction and repression of yeast[J].Periodical of Ocean University of China, 2013, 43(1):47-55.
[13] SCHMIDT G W, WELKENHUYSEN N, YE T, et al.Mig1 localization exhibits biphasic behavior which is controlled by both metabolic and regulatory roles of the sugar kinases[J].Molecular Genetics and Genomics, 2020, 295(6):1 489-1 500.
[14] 仉英, 田月如, 艾芙琪,等.同源重组敲除临床肺炎克雷伯菌质粒blaKPC-2基因[J].检验医学, 2014, 29(6):603-606.
ZHANG Y, TIAN Y R,AI F Q, et al.Homologous recombination knockout blaKPC-2 gene in clinical isolates of Klebsiella pneumonia[J].Laboratory Medicine, 2014, 29(6):603-606.
[15] 武有聪, 孟媛媛, 丁百兴, 等.以质粒为基础的同源重组技术在葡萄球菌基因敲除中的应用[J].中国人兽共患病学报, 2019, 35(7):581-586.
WU Y C, MENG Y Y, DING B X, et al.Application of plasmid-based allelic replacement in the gene deletion of Staphylococcus[J].Chinese Journal of Zoonoses, 2019, 35(7):581-586.
[16] 朱曼丽. 利用重叠延伸PCR技术在酿酒酵母中构建木糖代谢相关基因[D].天津:天津大学, 2009.
ZHU M L.Construction of genes related to xylose metabolism in Saccharomyces cerevisiae using overlap extension PCR[D].Tianjin:Tianjin University, 2009.
[17] 张佳. 通过基因工程改造马克思克鲁维酵母实现高温高产木糖醇和乙醇[D].合肥:中国科学技术大学, 2015.
ZHANG J.Xylitol and ethanol production at high temperature by engineered Kluyveromyces marxianus[D].Hefei:University of Science and Technology of China, 2015.
[18] 牛晓静, 陈天朝, 鲁静, 等.槐角中还原糖的含量测定[J].中医药信息, 2019, 36(6):18-21.
NIU X J, CHEN T C, LU J, et al.Content determination of reducing sugar in Fructus sophorae[J].Information on Traditional Chinese Medicine, 2019, 36(6):18-21.
[19] ZHANG Y, XIAO D G, ZHANG C Y, et al.Effect of mig1 gene deletion on glucose repression in baker′s yeast[J].Advanced Materials Research, 2011, 396-398:1 531-1 535.
[20] ALIPOURFARD I,DATUKISHVILI N,BAKHTIYARI S, et al.MIG1 glucose repression in metabolic processes of Saccharomyces cerevisiae:Genetics to metabolic engineering[J].Avicenna Journal of Medical Biotechnology, 2019, 11(3):215-220.
[21] ALIPOURFARD I, DATUKISHVILI N, BAKHTIYARI S, et al.Saccharomyces cerevisiae, key role of MIG1 gene in metabolic switching:Putative fermentation/oxidation[J].Journal of Biological Regulators and Homeostatic Agents, 2018, 32(3):649-654.
[22] XU J R, ZHAO X Q, LIU C G, et al.Improving xylose utilization of Saccharomyces cerevisiae by expressing the mig1 mutant from the self-flocculating yeast SPSC01[J].Protein and Peptide Letters, 2018, 25(2):202-207.
[23] 王亮, 胡曼, 王江月, 等.马克斯克鲁维酵母高密度发酵条件的优化研究[J].食品工业科技, 2017, 38(17):111-118;124.
WANG L, HU M, WANG J Y, et al.Optimization of high density fermentation conditions of Kluyveromyces marxianus[J].Science and Technology of Food Industry, 2017, 38(17):111-118;124.
[24] 魏闪. 酿酒酵母葡萄糖后继效应相关的木糖代谢效率决定性因子研究[D].济南:山东大学, 2019.
WEI S.Study on the xylose metabolic efficiency decisive factors relevant to the post-glucose-effect in Saccharomyces cerevisiae[D].Jinan:Shandong University, 2019.
[25] 蔡艳青, 齐显尼, 齐奇,等.敲除MIG1和SNF1基因对酿酒酵母共利用葡萄糖和木糖的影响[J].生物工程学报, 2018, 34(1):54-67.
CAI Y Q, QI X N, QI Q, et al.Effect of MIG1 and SNF1 deletion on simultaneous utilization of glucose and xylose by Saccharomyces cerevisiae[J].Chinese Journal of Biotechnology, 2018, 34(1):54-67.