阿尔兹海默症(Alzheimer′s disease,AD)是全世界最常见且多发于老年人群的一种神经退行性疾病,随着人口老龄化的增加,我国AD患者的数量也在急剧增加,因此,发现延缓并预防AD的潜在活性物质是目前亟待解决的问题[1]。研究表明,AD患者脑内氧化应激水平显著增加,是AD的重要发病机理之一[2]。线粒体是调控氧化应激和产生活性氧的主要细胞器之一,当机体抗氧化防御系统不足以平衡机体生成的活性氧时[3],会导致线粒体功能障碍,并造成神经细胞的氧化损伤,最终导致神经元凋亡[4],因此抑制氧化损伤是预防AD的重要途径。
壳寡糖(chitooligosaccharide,COS)是壳聚糖的生物酶解产物,由2~20个氨基葡糖通过β-1,4糖苷键连接而成的低聚合度糖类化合物。COS是自然界迄今为止发现的唯一带正电离子的多糖,且安全无毒,具有多种生物学活性,包括神经保护、免疫调节、抗炎、抗肿瘤、抗氧化等,在食品和医药领域具有广泛的发展潜力和前景[5]。本课题组前期研究发现COS在体内外均能通过降低Aβ1-42介导的活性氧(reactive oxygen species,ROS),丙二醛(malondialdehyde,MDA)和神经元凋亡而发挥神经保护作用,并通过降低Bax/Bcl-2及caspase3水平缓解Aβ1-42诱导的细胞凋亡[6-7]。此外,研究表明COS能够通过抑制氧化应激和神经炎症反应来缓解AD大鼠的认知功能障碍,也可缓解氧化应激所引发的大鼠视网膜病变[8-9]。本实验通过研究COS干预H2O2诱导的人神经母细胞瘤SK-N-SH细胞氧化损伤,探究COS对神经细胞的保护作用及其机制,为合理开发和利用COS提供理论依据。
1 材料与方法
1.1 试验材料
人神经母细胞瘤SK-N-SH细胞株,北京协和细胞资源中心;COS,脱乙酰度为91.3%,分子质量≤1 000 Da,大连Glycobio公司;DMEM(dulbecco′s modified eagle medium),美国Life Technologies公司;H2O2、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-2H-tetrazolium bromide,MTT]、JC-10线粒体膜电位试剂盒、抗体Nrf2、HO-1,美国Sigma公司;细胞凋亡检测ELISA试剂盒、乳酸脱氢酶检测试剂盒,Roche Applied Science公司;抗体Bax、Bcl-2、β-actin,Cell Signaling Technology公司;BCA蛋白定量测定试剂盒、蛋白marker、辣根过氧化物酶标记山羊抗兔免疫球蛋白G(immunoglobulin G,IgG),碧云天生物技术有限公司;电泳试剂,Bio-Rad公司。
1.2 试验方法
1.2.1 细胞培养及分组处理
将人神经母细胞瘤SK-N-SH细胞培养于含有10%胎牛血清的DMEM培养基中,置于37 ℃,5% CO2的细胞培养箱中培养,待细胞密度为80%左右时消化传代,实验全程在生物安全柜中操作。
将SK-N-SH细胞分为4组:(1)对照组:无处理的细胞培养基;(2)H2O2组:加入100 μmol/L的H2O2;(3)COS组:加入200 μg/mL的COS;(4)COS+H2O2组:200 μg/mL的COS预处理4 h后加入100 μmol/L的H2O2培养24 h。
1.2.2 MTT法检测细胞活力
通过MTT法测定细胞活力。将对数生长期的SH-N-SH细胞以1×104个细胞/孔的密度接种在96孔板中。与指定的药物孵育后,将细胞与0.5 mg/mL MTT孵育4 h后,小心除去培养基,并向每个孔中添加100 μL二甲基亚砜(dimethyl sulfoxide,DMSO)。在570 nm处并以参比波长630 nm时测量样品的吸光度。
1.2.3 乳酸脱氢酶(lactate dehydrogenase,LDH)释放水平测定
LDH从细胞释放到培养基中是膜完整性的重要指标。在该测定中,将细胞在24孔板中培养,并在不同处理后,收集培养基,并根据试剂盒说明书测定LDH活性。使用TriStar LB 941 Berthold酶标仪在490 nm处测量吸光度。
1.2.4 线粒体膜电位检测
JC-10用于测量细胞中的线粒体膜电位(mitochondrial membrane potential,MMP)。JC-10是一种阳离子亲脂性染料,浓缩后会在具有极化线粒体膜的细胞线粒体中形成可逆的红色荧光JC-10聚集体(波长590 nm)。在凋亡细胞中,MMP崩溃导致无法将JC-10保留在线粒体中,并使染料返回其单体绿色荧光形式(波长525 nm)。不同处理结束后,将细胞用PBS洗涤2次,然后与1×JC-10溶液共同温育30 min。计算红色/绿色荧光强度的比率,并将该值相对于对照组标准化。
1.2.5 细胞内ATP水平测定
使用ATP发光测定试剂盒测定细胞内ATP的水平。将细胞在裂解缓冲液中裂解,并以12 000×g离心以收集上清液。将100 μL ATP检测工作溶液添加到白色96孔培养板中,并将板在室温下振荡孵育15 min。然后,将20 μL细胞裂解物添加至孔中,并立即使用TriStar LB 941 Berthold酶标仪测量550 nm处的吸光度。
1.2.6 ELISA分析细胞凋亡水平
将细胞接种在6孔板中,并使其在37 ℃的细胞培养箱中(含5% CO2)培养24 h。将不同处理组的细胞进行裂解,并将裂解物转移到预先涂有组蛋白抗体的96孔板中。孵育90 min后,依次加入过氧化物酶结合物和显色底物,然后使用Thermo Varioskan多模式微孔板分光光度计测量405 nm处的吸光度。
1.2.7 蛋白质免疫印迹(Western Blot)
将培养好的细胞用预冷的PBS洗涤2次,加入一定量的细胞裂解液裂解后收集,4 ℃,12 000 r/min离心20 min后收集上清液,利用BCA蛋白定量测定试剂盒检测蛋白质的浓度。使用SDS-PAGE分离蛋白质样品,并将其电转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。用5%脱脂奶粉封闭膜1 h后,使用特异的一抗(体积比1∶1 000)在4 ℃下摇床过夜孵育。第2天用TBST洗涤3次,然后辣根过氧化物酶偶联的二抗(体积比1∶2 000)孵育,TBST洗涤3次后使用Millipore ECL化学发光试剂盒进行显色。利用Image J软件分析条带的强度。
1.2.8 统计学分析
数据表示为平均值±标准差,每次试验至少重复3次。使用SPSS 26.0和GraphPad Prism 6.0来分析数据,多组间进行单因素方差分析(ANOVA),然后采用Student-Newman-Keuls进行两两比较,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 COS对H2O2诱导的细胞形态的影响
如图1所示,正常对照组细胞贴壁生长,状态良好,视野内细胞数量较多,细胞间突触连接紧密;与正常对照组细胞相比,100 μmol/L的H2O2处理组细胞数量较少,细胞间突触连接减少,部分细胞胞体变圆;与H2O2处理组相比,200 μg/mL的COS预处理组细胞数量明显增加,细胞间突触连接更为紧密。

图1 COS对H2O2损伤SK-N-SH细胞后的形态学观察(标尺=200 μm)
Fig.1 Morphological observation of COS against H2O2-induced damaged in SK-N-SH cells
2.2 COS对H2O2诱导的细胞活力的影响
首先采用MTT法分析了不同浓度的H2O2和COS对SK-N-SH细胞活力的影响。如图2-a所示,不同浓度的H2O2处理SK-N-SH细胞24 h后,与对照组相比,50 μmol/L的H2O2对SK-N-SH细胞活力无显著性影响,但随着H2O2浓度的升高,SK-N-SH细胞活力表现出显著下降趋势,并以浓度依赖性方式降低细胞活力,其中100 μmol/L甚至更高的浓度会导致细胞活力显著降低。因此,我们在后续的实验中选择浓度为100 μmol/L的H2O2作用细胞24 h作为建立SK-N-SH细胞氧化损伤的诱导条件。如图2-b所示,与对照组相比,COS在50~400 μg/mL时处理细胞24 h后对SK-N-SH细胞活力没有明显抑制作用,无统计学差异(P>0.05)。并且200 μg/mL的COS处理细胞使细胞活力提高了21.8%(相对于对照,P<0.01)。所以本研究采用100、200和400 μg/mL 作为COS对H2O2诱导的细胞活力下降的干扰剂量,并进行进一步研究。

a-不同浓度H2O2处理;b-不同浓度COS处理;c-COS和H2O2
共同处理
1-空白组;2-100 μmol/L H2O2;3-100 μmol/L H2O2+100 μg/mL COS;
4-100 μmol/L H2O2+200 μg/mL COS;5-100 μmol/L H2O2+
400 μg/mL COS
图2 COS对H2O2诱导的SK-N-SH细胞活力的影响
Fig.2 Protective effect of COS against H2O2-induced
cytotoxicity in SK-N-SH cells
注:与对照组相比,**P<0.01,***P<0.001表示有显著性差异;
与H2O2处理组相比,#P<0.05,##P<0.01表示有显著性差异(下同)
为了进一步评估COS的保护作用,先用100、200和400 μg/mL的COS预处理SK-N-SH细胞4 h,然后加入100 μmol/L的H2O2培养细胞24 h后,利用MTT法测定细胞活力。如图2-c所示,与对照组相比,100 μmol/L的H2O2处理细胞后,其细胞活力降至对照的(73.2±4.15)%。而经不同浓度的COS(100、200和400 μg/mL)预处理细胞后,与H2O2处理组相比,细胞活力显著升高(P<0.05);并且200 μg/mL COS的细胞保护作用大于所使用的其他2种浓度(100和400 μg/mL),因此,本研究选用200 μg/mL的COS进行后续实验研究。
2.3 COS对H2O2诱导的LDH释放的影响
为了进一步研究COS对H2O2诱导的氧化损伤的潜在机制,进行了LDH含量测定(另一种细胞毒性指标),LDH释放量反映了氧化应激引起的细胞膜损伤。如图3所示,与对照组相比,100 μmol/L的H2O2处理导致LDH的释放显著增加,达到了(148.9±10.17)%(P<0.01);而200 μg/mL的COS单独处理的细胞未显示出LDH泄漏的显著增加(P>0.05)。但是,与H2O2处理组相比,质量浓度为200 μg/mL的COS预处理后可显著抑制LDH在细胞培养基中的释放,并且LDH的释放量降至(116.1±11.03)%(P<0.01)。
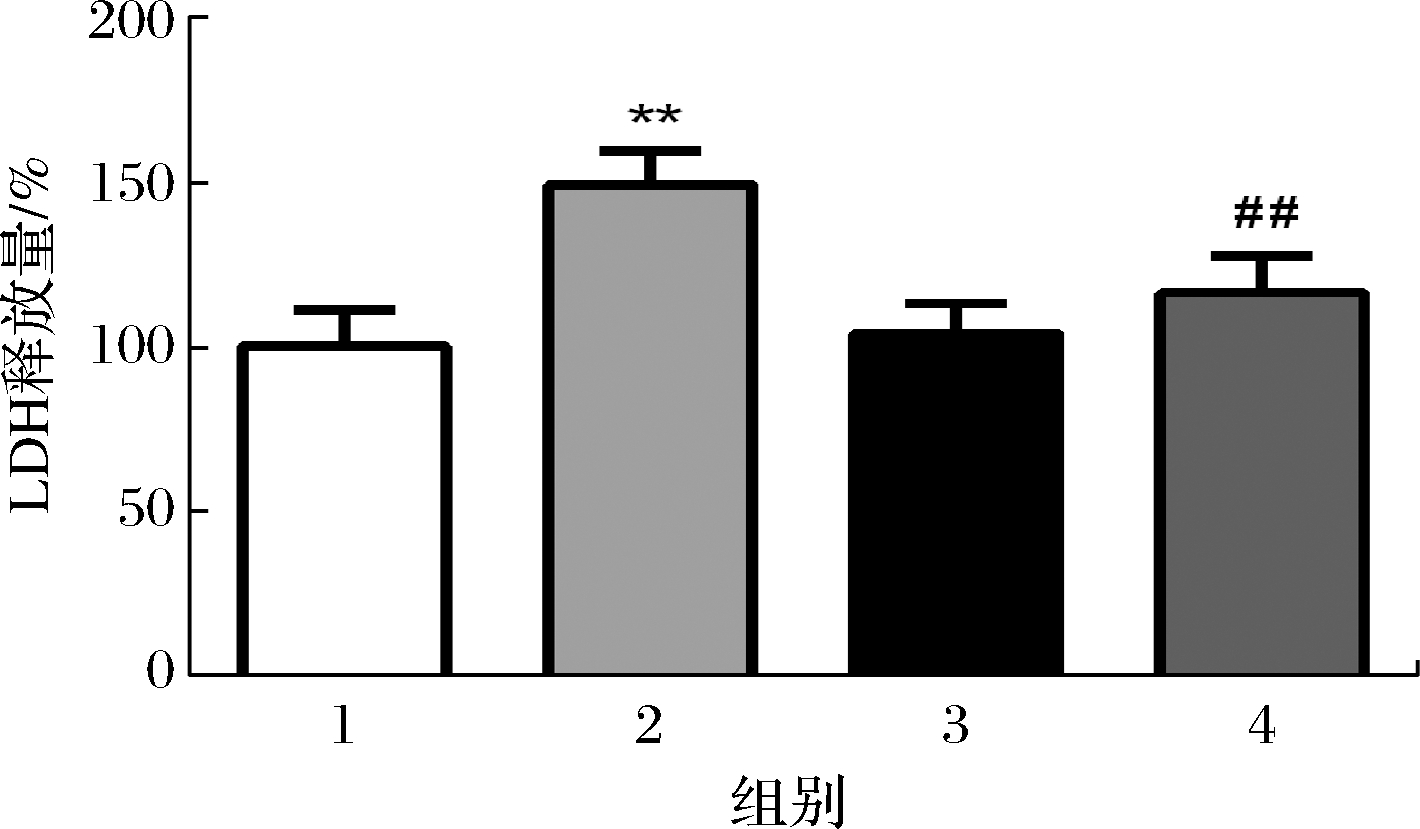
1-空白组;2-100 μmol/L H2O2;3-200 μg/mL COS;
4-100 μmol/L H2O2+200 μg/mL COS(下同)
图3 COS对H2O2诱导的LDH释放的保护作用
Fig.3 Protective effect of COS on H2O2-mediated LDH release
2.4 COS改善了H2O2诱导的线粒体损伤导致的能量耗竭
为了测定H2O2介导的氧化应激下的线粒体功能和能量代谢水平,采用了JC-10染料和ATP试剂盒。JC-10是JC-1的衍生物,JC-1是一种亲脂性阳离子染料,当线粒体膜极化时会以单体形式进入内部线粒体基质中[10]。如图4-a所示,与对照组相比,100 μmol/L的H2O2处理使MMP显著降低,并降低至(73.9±6.08)%(P<0.01),表明氧化应激导致了SK-N-SH细胞中MMP的损失;单独用200 μg/mL的COS处理对SK-N-SH细胞中的MMP无显著影响(P>0.05)。然而,与H2O2处理组相比,200 μg/mL的COS预处理显著抑制了H2O2诱导的MMP的降低(P<0.01),表明线粒体功能得以恢复。这些结果提示COS显著减弱了MMP损失。
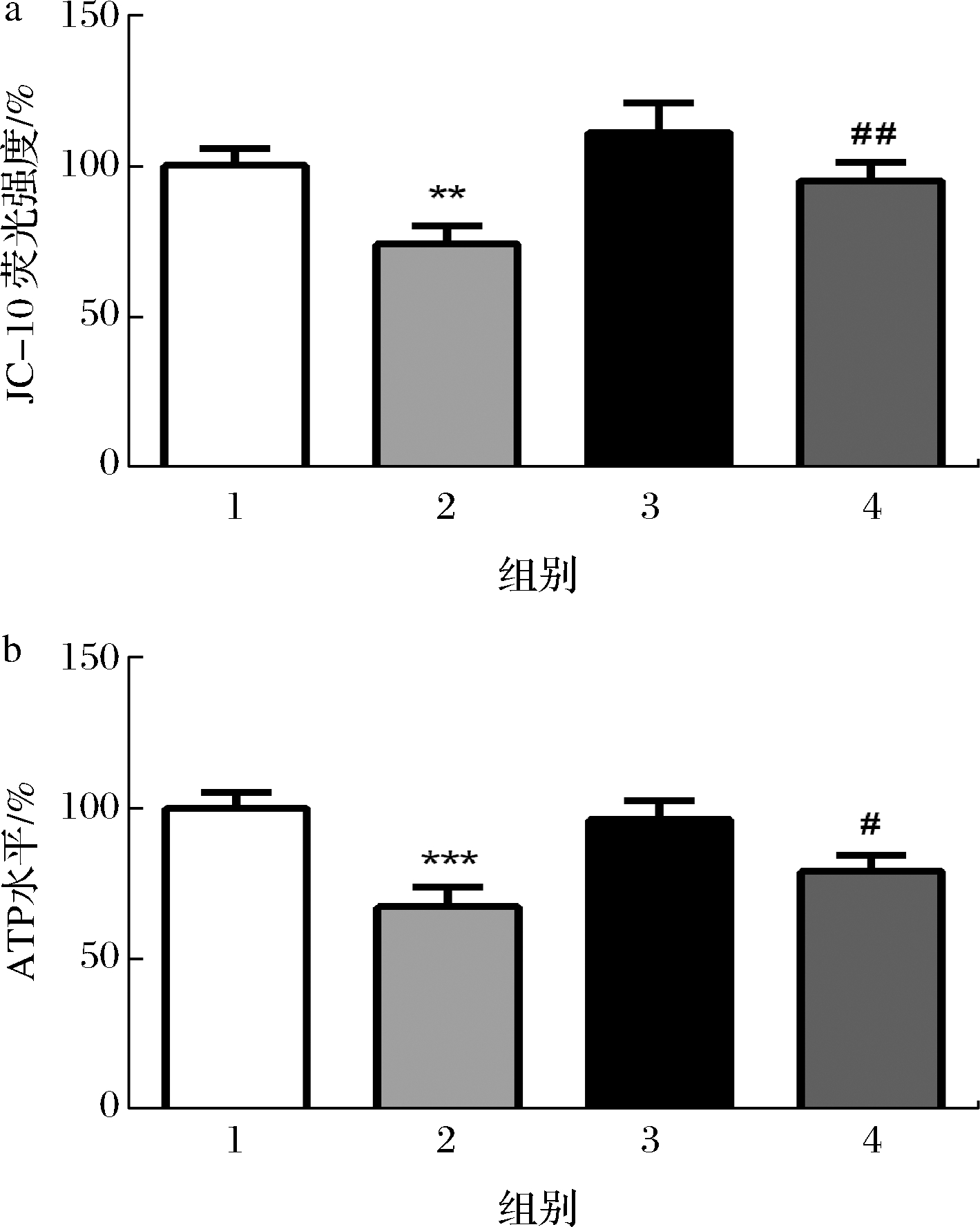
a-JC-10荧光强度;b-ATP水平
图4 COS抑制SK-N-SH细胞中H2O2介导的线粒体
损伤和能量消耗
Fig.4 COS repressed H2O2-mediated mitochondrial
impairment and energy depletion in SK-N-SH cells
由于线粒体是为细胞生存和功能所必需的各种生物活动提供ATP的主要能量产生细胞器[11-12],因此我们检测了ATP水平是否与H2O2触发的线粒体功能障碍有关。如图4-b所示,与对照组相比,100 μmol/L的H2O2处理使细胞内ATP水平显著下降(P<0.001),200 μg/mL的COS单独处理则对SK-N-SH细胞中的ATP水平无显著影响(P>0.05)。而与H2O2处理组相比,COS预处理可以显著提高因暴露于H2O2而降低的细胞内ATP水平(P<0.05)。因此,我们得出结论,COS可以通过维持线粒体功能来改善H2O2介导的能量代谢功能障碍。
2.5 COS对H2O2诱导的细胞凋亡的影响
接下来,我们使用细胞凋亡试剂盒检测不同处理对SK-N-SH细胞的细胞凋亡的影响。如图5所示,与对照组相比,100 μmol/L的H2O2处理细胞24 h后导致细胞凋亡率增加至(211±20)%(P<0.001)。而与H2O2处理组相比,200 μg/mL的COS预处理可显著抑制H2O2诱导的细胞凋亡,并降低至(82±18)%(P<0.001)。
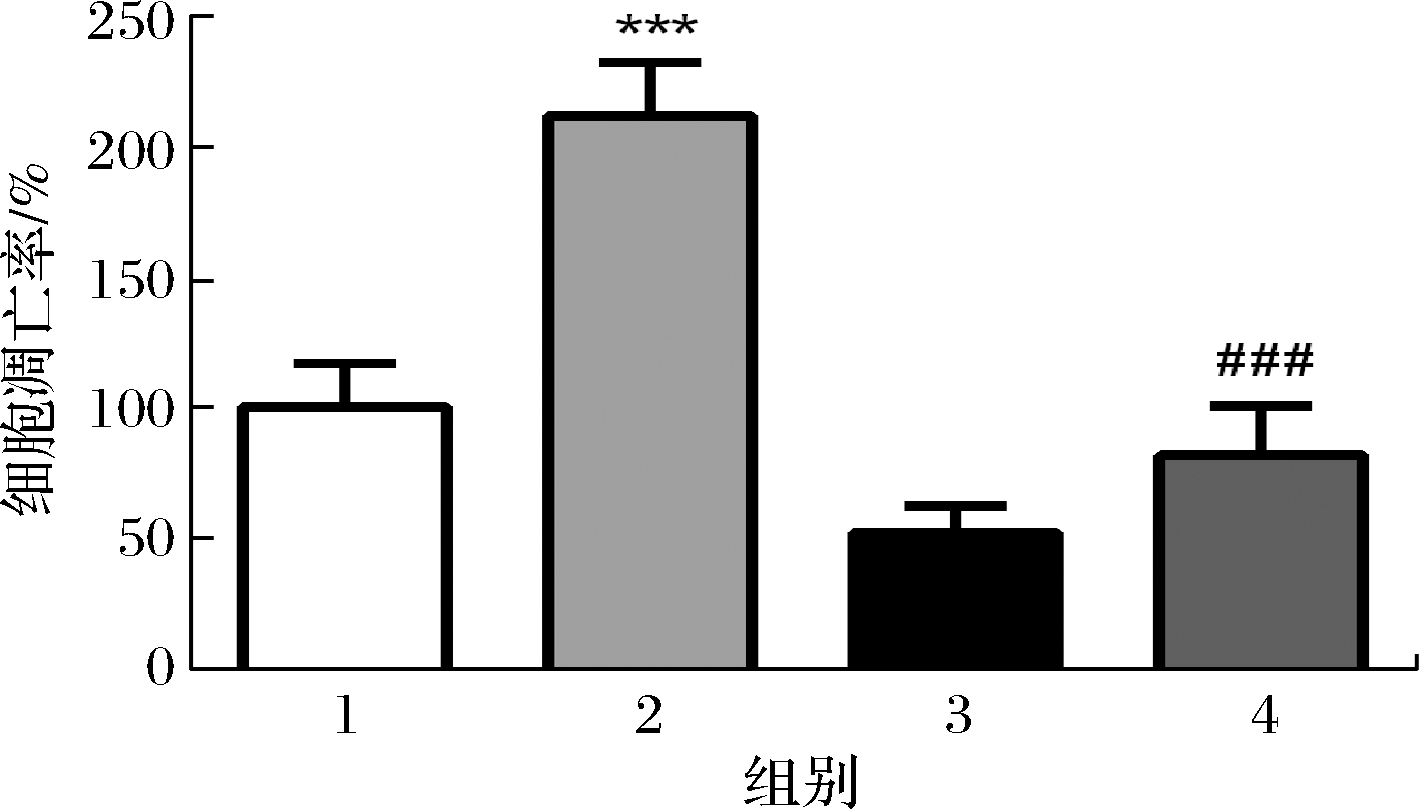
图5 COS保护SK-N-SH细胞免受H2O2诱导的细胞凋亡
Fig.5 COS protected SK-N-SH cells from H2O2-induced apoptosis
2.6 COS对H2O2诱导的SK-N-SH细胞中Bax和Bcl-2蛋白表达的影响
细胞凋亡与Bcl-2蛋白家族相关,即必需的线粒体通透性调节蛋白,包括抗凋亡蛋白Bcl-2和促凋亡蛋白Bax等。因此,本研究进一步利用Western Blot检测Bax和Bcl-2蛋白的表达情况。如图6所示,与对照组相比,100 μmol/L的H2O2处理细胞后导致Bax蛋白表达量增加,Bcl-2蛋白的表达量下降,且Bax/Bcl-2比值极显著升高(P<0.001);与H2O2组相比,200 μg/mL的COS预处理可降低Bax蛋白的表达,增加Bcl-2蛋白的表达,并且Bax/Bcl-2比值显著降低(P<0.01)。
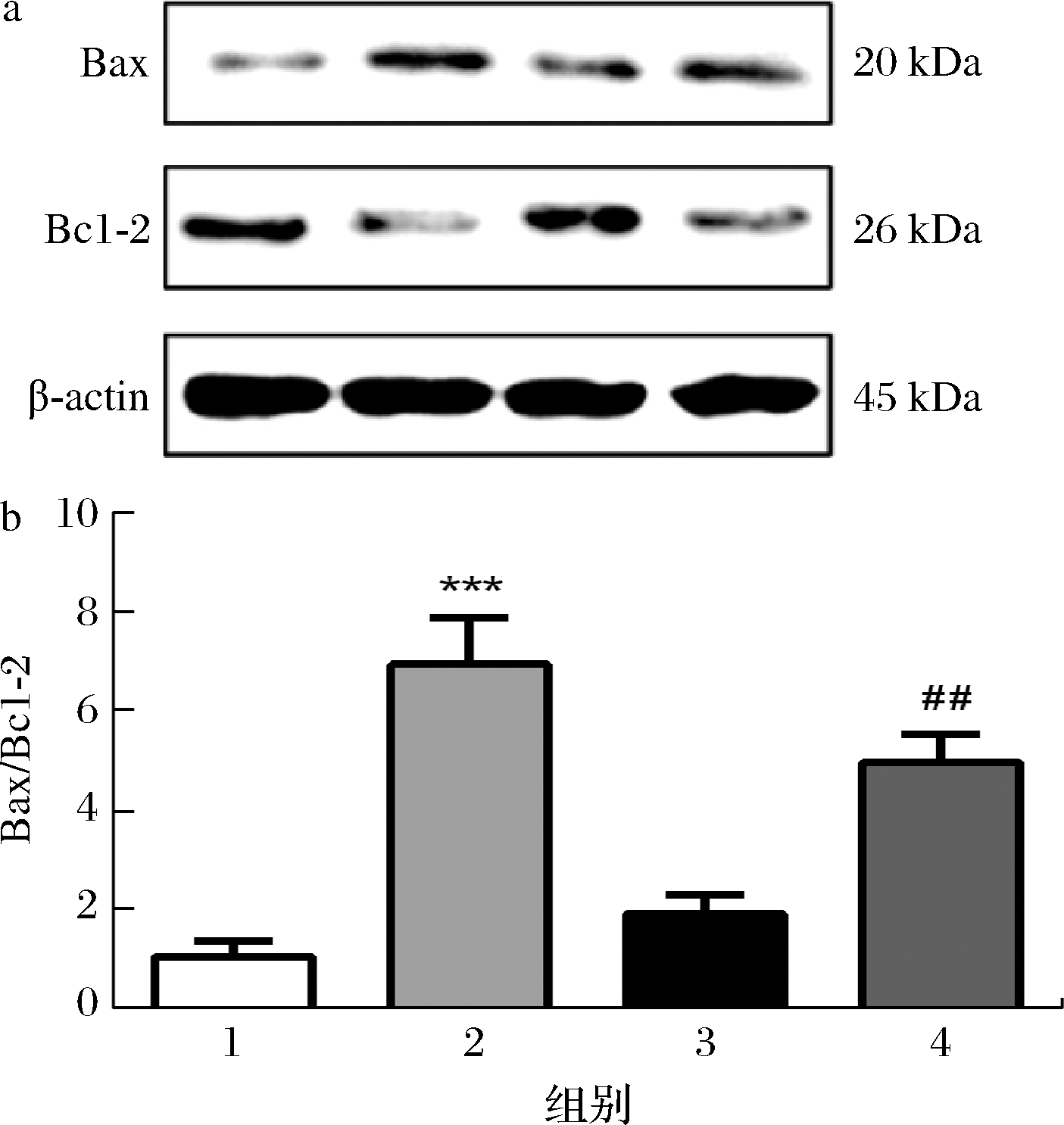
a-Bax和Bcl-2蛋白条带;b-Bax/Bcl-2比值
图6 COS对SK-N-SH细胞中Bax和Bcl-2蛋白表达的影响
Fig.6 Effect of COS on the expression of Bax and Bcl-2 in SK-N-SH cells
2.7 COS对H2O2诱导的SK-N-SH细胞中Nrf2和HO-1蛋白表达的影响
如图7所示,与对照组相比,100 μmol/L的H2O2处理细胞导致HO-1和Nrf2的表达显著降低,而200 μg/mL的COS可显著提高Nrf2的表达(P<0.01);与H2O2处理组相比,200 μg/mL的COS预处理可显著提高HO-1的表达,但对Nrf2的表达无显著影响(P>0.05)。
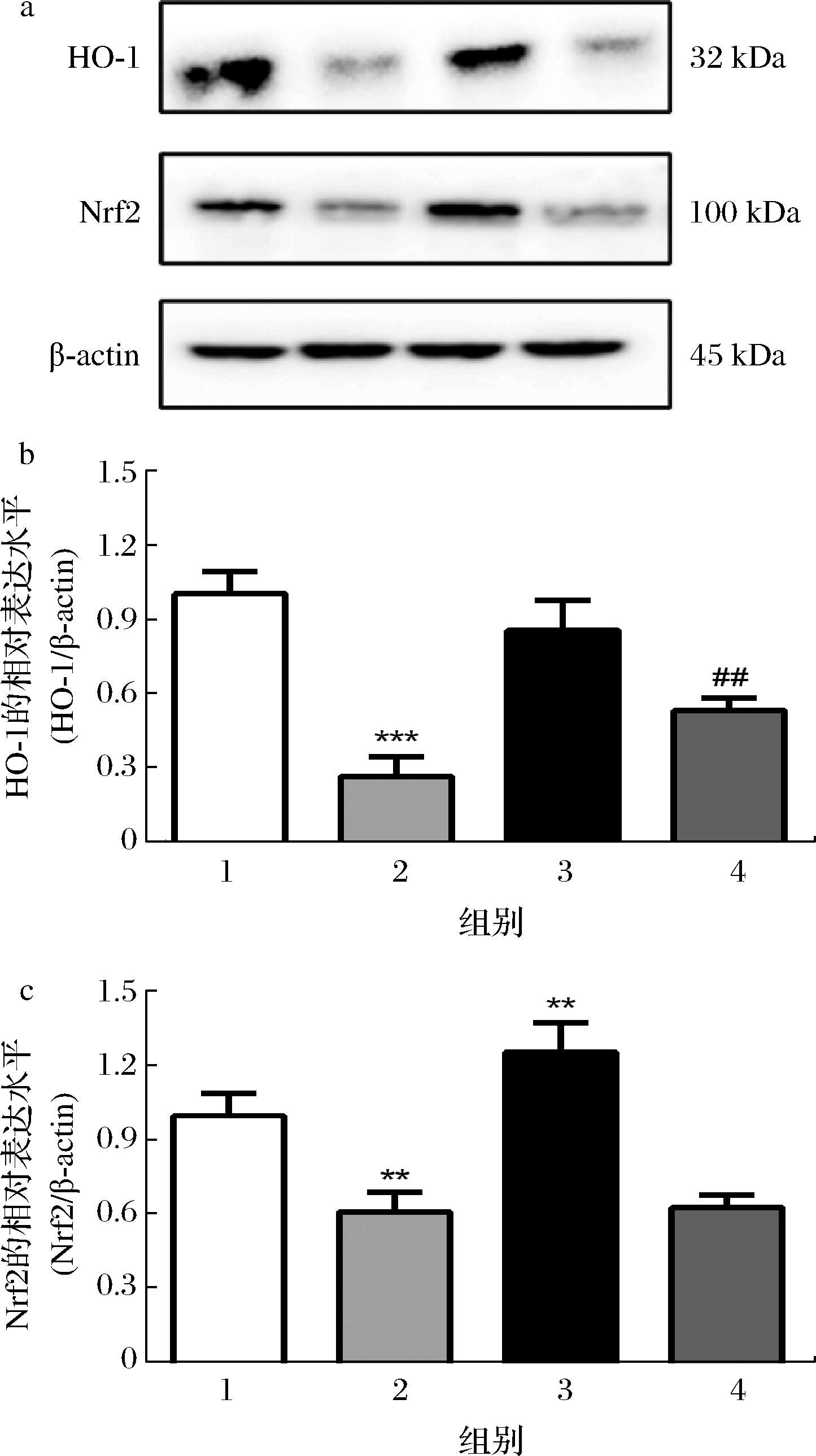
a-HO-1和Nrf2蛋白条带;b-HO-1的定量分析;c-Nrf2的定量分析
图7 COS对SK-N-SH细胞中HO-1和Nrf2蛋白表达的影响
Fig.7 Effect of COS on the expression of HO-1 and Nrf2 in SK-N-SH cells
3 讨论与结论
氧化应激是神经退行性疾病的发病机制之一,H2O2是由超氧化物歧化形成的,是主要的活性氧之一,会导致细胞中脂质过氧化、DNA损伤以及细胞凋亡,并且氧化应激能够导致线粒体膜受损、降低线粒体膜电位,并进一步减少ATP的产生。此外,氧化应激也是细胞凋亡的重要原因之一[13]。凋亡过程调节蛋白,包括促凋亡蛋白Bax和抗凋亡蛋白Bcl-2,主要位于线粒体膜中,是细胞凋亡的主要参与者,可以通过调节氧化还原的平衡调控细胞凋亡。研究发现,H2O2可以打破Bcl-2基因家族中Bcl-2和Bax之间的平衡,导致氧化应激下间充质干细胞中Bcl-2/Bax比值降低,从而激活线粒体通路促进细胞凋亡[14]。此外,LDH是存在于活细胞中的一种酶,可催化乳酸转化为丙酮酸,当细胞受到刺激或损伤时,LDH就会从受损的组织或细胞中释放出来[15-16]。本研究检测了H2O2的细胞毒性作用和COS的神经保护作用,揭示了H2O2以浓度依赖性抑制了SK-N-SH细胞的生存力,而COS以浓度依赖性抑制了H2O2诱导的细胞毒性。此外,COS可有效抑制H2O2诱导的MMP下降、提高SK-N-SH细胞内ATP水平、并降低细胞凋亡,同时还可提高抗凋亡蛋白Bcl-2的表达,降低促凋亡蛋白Bax的表达。
核因子E2相关因子2(Nrf2)介导的HO-1表达被证明对氧化应激起关键作用[17]。HO-1是一种细胞保护介质,可对抗H2O2介导的氧化应激,在调节线粒体功能时也发挥重要作用[18]。Nrf2能有效平衡线粒体呼吸作用时产生的ROS并防止线粒体产生毒素[19]。研究表明,COS可显著上调D-半乳糖诱导的肝功能受损小鼠体内Nrf2及其下游靶基因HO-1的表达,并通过激活Nrf2抗氧化信号,保护人肝细胞L02细胞免受H2O2诱导的氧化应激损伤[20]。TAO等[21]研究发现,COS可通过激活Nrf2通路上调抗氧化酶如谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide dismutase,SOD)的表达来改善肝脏的氧化应激。本研究结果表明,H2O2处理导致SK-N-SH细胞中Nrf2和HO-1的表达显著下降,而COS干预可有效提高SK-N-SH细胞中Nrf2下游分子HO-1的表达。
综上所述,COS可显著降低H2O2诱导的SK-N-SH细胞氧化损伤,能够保护SK-N-SH细胞免受H2O2诱导的细胞死亡,并且COS干预可促进线粒体膜电位的恢复和提高细胞内ATP水平来维持线粒体功能,还通过抑制凋亡相关蛋白Bax的表达以及促进Bcl-2蛋白的表达抑制细胞凋亡,提高HO-1的表达,从而起到神经保护作用。
[1] JIA J P, WEI C B, CHEN S Q, et al.The cost of Alzheimer′s disease in China and re-estimation of costs worldwide[J].Alzheimer′s & Dementia, 2018, 14(4):483-491.
[2] CHEN Z C, ZHONG C J.Oxidative stress in Alzheimer′s disease[J].Neuroscience Bulletin, 2014, 30(2):271-281.
[3] ALLAN BUTTERFIELD D, HALLIWELL B.Oxidative stress, dysfunctional glucose metabolism and Alzheimer disease[J].Nature Reviews Neuroscience, 2019, 20(3):148-160.
[4] WANG C Y, HAO J, LIU X, et al.Isoforsythiaside attenuates Alzheimer′s disease via regulating mitochondrial function through the PI3K/AKT pathway[J].International Journal of Molecular Sciences, 2020, 21(16):5 687.
[5] LIANG S, SUN Y X, DAI X L.A review of the preparation, analysis and biological functions of chitooligosaccharide[J].International Journal of Molecular Sciences, 2018, 19(8):2 197.
[6] DAI X L, HOU W Q, SUN Y X, et al.Chitosan oligosaccharides inhibit/disaggregate fibrils and attenuate amyloid β-mediated neurotoxicity[J].International Journal of Molecular Sciences, 2015, 16(5):10 526-10 536.
[7] DAI X L, CHANG P, ZHU Q Z, et al.Chitosan oligosaccharides protect rat primary hippocampal neurons from oligomeric β-amyloid 1-42-induced neurotoxicity[J].Neuroscience Letters, 2013, 554:64-69.
[8] JIA S L, LU Z, GAO Z L, et al.Chitosan oligosaccharides alleviate cognitive deficits in an amyloid-β1-42-induced rat model of Alzheimer′s disease[J].International Journal of Biological Macromolecules, 2016, 83:416-425.
[9] FANG I M, YANG C M, YANG C H.Chitosan oligosaccharides prevented retinal ischemia and reperfusion injury via reduced oxidative stress and inflammation in rats[J].Experimental Eye Research, 2015, 130:38-50.
[10] PARK S, CHUN S, KIM D.Cold exposure lowers energy expenditure at the cellular level[J].Cell Biology International, 2013, 37(6):638-642.
[11] HE W L, CUI L L, ZHANG C, et al.Sonic hedgehog promotes neurite outgrowth of cortical neurons under oxidative stress:Involving of mitochondria and energy metabolism[J].Experimental Cell Research, 2017, 350(1):83-90.
[12] ZHANG J X, CAI Q, JIANG M, et al.Mesencephalic astrocyte-derived neurotrophic factor alleviated 6-OHDA-induced cell damage via ROS-AMPK/mTOR mediated autophagic inhibition[J].Experimental Gerontology, 2017, 89:45-56.
[13] FINKEL T, HOLBROOK N J.Oxidants, oxidative stress and the biology of ageing[J].Nature, 2000, 408(6 809):239-247.
[14] WANG H R, ZHANG K Q, RUAN Z, et al.Probucol enhances the therapeutic efficiency of mesenchymal stem cells in the treatment of erectile dysfunction in diabetic rats by prolonging their survival time via Nrf2 pathway[J].Stem Cell Research & Therapy, 2020, 11(1):249-255.
[15] KIM Y, LIM H S, KIM Y, et al.Phytochemical quantification and the in vitro acetylcholinesterase inhibitory activity of Phellodendron chinense and its components[J].Molecules, 2017, 22(6):925.
[16] ZHAO Z Y, LUAN P, HUANG S X, et al.Edaravone protects HT22 neurons from H2O2-induced apoptosis by inhibiting the MAPK signaling pathway[J].CNS Neuroscience & Therapeutics, 2013, 19(3):163-169.
[17] LOBODA A, DAMULEWICZ M, PYZA E, et al.Role of Nrf2/HO-1 system in development, oxidative stress response and diseases:An evolutionarily conserved mechanism[J].Cellular and Molecular Life Sciences, 2016, 73(17):3 221-3 247.
[18] DE OLIVEIRA M R, DE BITTENCOURT BRASIL F, FÜRSTENAU C R.Inhibition of the Nrf2/HO-1 axis suppresses the mitochondria-related protection promoted by gastrodin in human neuroblastoma cells exposed to paraquat[J].Molecular Neurobiology, 2019, 56(3):2 174-2 184.
[19] ESTERAS N, DINKOVA-KOSTOVA A T, ABRAMOV A Y.Nrf2 activation in the treatment of neurodegenerative diseases:A focus on its role in mitochondrial bioenergetics and function[J].Biological Chemistry, 2016, 397(5):383-400.
[20] WANG Y M, XIONG Y L, ZHANG A P, et al.Oligosaccharide attenuates aging-related liver dysfunction by activating Nrf2 antioxidant signaling[J].Food Science & Nutrition, 2020, 8(7):3 872-3 881.
[21] TAO W J, SUN W J, LIU L J, et al.Chitosan oligosaccharide attenuates nonalcoholic fatty liver disease induced by high fat diet through reducing lipid accumulation, inflammation and oxidative stress in C57BL/6 mice[J].Marine Drugs, 2019, 17(11):645.