冬枣(Zizyphus jujuba Mill.)果皮薄而脆,果肉细嫩多汁,鲜食口感甜脆,营养成分丰富,含有人体所需的多种矿物质、维生素以及氨基酸等营养物质[1-2],特别是维生素C含量极高,可达300~600 mg/100g,被誉为“活维生素丸”[3],还富含环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和环磷酸鸟腺苷(guanosine-5′-monophosphate,GMP)等功能成分,深受人们喜爱[4]。然而冬枣在采摘以及贮藏过程中不仅极易失水皱缩造成果实软化腐烂,并且容易受到病原菌从而引起腐败,是冬枣在采后运输以及销售过程中的极大障碍[5-6]。据报道,冬枣收获后引起果实腐败的病原菌大多数为细交链格孢菌(Alternaria alternata)[7]。如何保持冬枣的采后品质,特别是减少受黑斑病侵染而造成的腐败,是当前冬枣保鲜领域亟待解决的问题。
在冬枣保鲜研究中,保鲜技术分为以下几种:物理保鲜、化学保鲜和生物防治[8]。生物防治是近几年来深受人们青睐的一种保鲜技术。它主要是利用拮抗微生物对果蔬病原菌的抑制作用从而达到保鲜效果[9-10]。我们实验室发现了1株拮抗菌GS-316属于膜醭毕赤酵母(Pichia membranifaciens),前期预实验证明其对果实黑斑病(细交链格孢菌)有明显抑制作用,并对其抗病机制进行了相关研究[11]。本试验在前期研究基础上,通过研究拮抗酵母GS-316发酵液对冬枣黑斑病的抑菌效果以及对冬枣果实贮藏期品质的影响,以期为发现拮抗菌发酵液保鲜机制,探索冬枣果实生物保鲜技术提供理论基础。
1 材料与方法
1.1 材料与试剂
材料:试验所用黄骅冬枣,天津市千品果蔬超市;拮抗菌膜醭毕赤酵母GS-316、细交链格孢菌,实验室保存。
试剂:2,6-二氯靛酚、Adamas-beta、3,5-二硝基水杨酸,天津市光复精细化工研究所;过氧化氢,天津市化学试剂二厂;邻苯二酚,上海蓝季科技发展有限公司。
1.2 仪器与设备
TGL-16M台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;TU-1810紫外分光光度计,北京普析通用仪器有限公司;DK-2000-ⅢL电热恒温水浴锅,天津泰斯特仪器有限公司。
1.3 试验方法
1.3.1 病原菌的活化及孢子悬浮液制备
将实验室保藏的病原菌菌株使用无菌接种环接种到PDA培养基上,置于28 ℃恒温恒湿培养箱中培养7 d。用无菌铲挑取培养7 d后的病原菌分生孢子于无菌蒸馏水中,制成孢子悬浮液。
1.3.2 拮抗菌的活化
无菌条件下,用无菌接种环刮取1环实验室保藏的拮抗菌GS-316菌株,采用3区划线接种于PDA培养基中,于28 ℃恒温恒湿培养箱中培养。
1.3.3 拮抗菌GS-316发酵液的制备
在无菌条件下,用无菌接种环挑取已活化好的拮抗菌膜醭毕赤酵母GS-316接入PDA液体培养基中,以120 r/min的速度在摇床上培养7 d。将培养得到的培养液用冷冻离心机以6 000 r/min冷冻离心15 min后,收集上清液。将得到的上清液经0.22 μm的微孔过滤器过滤除菌体得无菌发酵液。
1.3.4 发酵液对病原菌的影响
参照乔博鑫等[12]的方法,在培养皿平板上打孔,另一侧平行放置病原菌菌片。在小孔中加入50 μL提取的发酵液作为实验组,以小孔中加入50 μL无菌水作为对照,观察发酵液对交链孢的生长抑制率。每组处理设置3个平行。生长抑制率计算方法如公式(1)所示:
生长抑制率/%=
![]()
(1)
1.3.5 发酵液对冬枣自然发病率及病斑的影响
选取无机械损伤的枣果,用2%体积分数次氯酸钠溶液浸泡2 min,流水冲洗干净后于通风处晾干。将拮抗菌GS-316发酵液均匀喷洒于枣果表面作为实验组,以无菌水喷洒作为对照组。将处理后的枣果置于室温25 ℃闭光且湿度适宜的泡沫箱中,定时喷洒无菌水以保证其贮藏湿度,每隔2 d观察枣果的发病情况并记录数据。每组设置3个平行。发病率计算方法如公式(2)所示:
自然发病率![]()
(2)
取数个预处理后的枣果,用直径为0.5 cm的无菌打孔器在赤道部分表面打孔,在孔中注入40 μL浓度为1×105个/mL交链孢孢子悬浮液,以注入40 μL拮抗菌GS-316发酵液作为实验组,注入等量无菌水作为对照组。将处理后的枣果置于室温25 ℃闭光且湿度80%~90%的泡沫箱中,定时喷洒无菌水以保证其贮藏湿度,每天观察枣果腐烂情况并记录。每组处理设置3个平行。
1.3.6 发酵液对冬枣生理品质及抗氧化活性的影响
称重法测定失重率[13];酸碱滴定法测定可滴定酸含量[14];2,6-二氯靛酚滴定法测定维生素C含量[14];3,5-二硝基水杨酸法测定还原糖含量[14];紫外吸收法测定过氧化氢酶(catalase, CAT)活性[15];参考ADEDEJI等[16]的方法测定多聚半乳糖醛酸酶(polygalacturonase,PG)活性。
2 结果与分析
2.1 拮抗菌GS-316发酵液对病原菌细交链格孢菌的作用
从图1可以看到,病原菌在拮抗菌GS-316发酵液的存在下于PDA平板上28 ℃ 培养6 d后,相较于对照组,发酵液对病原菌的生长有明显的抑制作用,测得生长抑制率为17.03%。结果表明,拮抗菌GS-316发酵液中存在抑菌成分,并且在离体条件下抑制枣果黑斑病病原菌的生长。

a-对照组;b-发酵液组
图1 发酵液对病原菌的抑制作用
Fig.1 Inhibitory effect of fermentation broth on pathogenic bacteria
2.2 冬枣采后贮藏试验
2.2.1 拮抗菌GS-316发酵液对枣果发病率的影响
从图2可以看出,贮藏过程中,枣果的发病率随着贮藏时间的增加均呈上升的趋势,但经发酵液处理后的枣果发病率要明显优于对照组(P<0.05)。对照组枣果发病率在前期迅速上升,第14 天时发病率便达到了95.83%,而经发酵液处理后的枣果前期上升速率较对照组缓慢,第14天发病率仅为51.39%。在第20天时,对照组发病率为100.00%,实验组发病率仅为86.11%。结果说明,枣果经拮抗菌GS-316发酵液处理后,其中的抑菌成分可以有效减少病原菌对枣果的侵染,减缓冬枣被病原菌侵染的概率,有效抑制枣果发病。
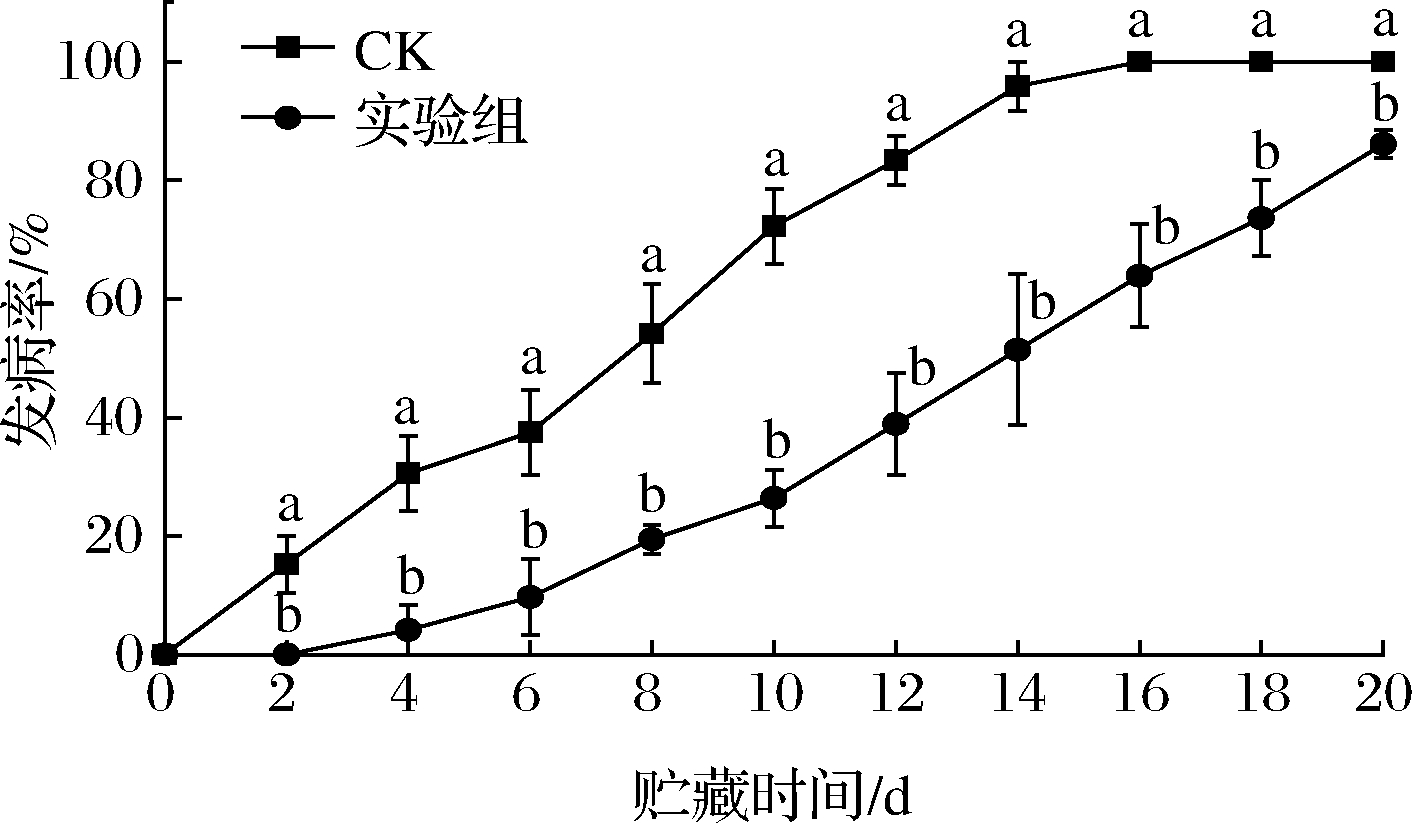
图2 发酵液对冬枣发病率的影响
Fig.2 Effect of fermentation broth on the incidence of winter jujube
2.2.2 拮抗菌GS-316发酵液对有伤接种枣果病斑的影响
从图3可以看出,实验组由于拮抗菌GS-316发酵液的存在,阻止了交链孢孢子在枣果表面定植生长,故其腐烂程度低,病斑直径小。到第7天时发酵液处理的病斑直径仅为7.00 mm,对照组达到了10.5 mm,2组差异明显(P<0.05)。结果表明,拮抗菌GS-316发酵液能有效减轻枣果黑斑病的发病程度,并在一定程度上减缓枣果的腐烂,延长冬枣的保质期。

a-冬枣病斑照片;b-病斑直径柱状图
图3 发酵液对冬枣黑斑病病斑及病斑直径的影响
Fig.3 Effect of fermentation broth on black spot and diameter of winter jujube
2.3 拮抗菌GS-316发酵液对枣果生理品质和酶活性的影响
2.3.1 果实失重率
冬枣在采后仍然会进行呼吸作用等一系列的代谢活动,会造成水分蒸发和营养物质消耗[17],是采后贮藏过程中果实失重的主要原因。从图4可以看出,2组枣果的失重率随着贮藏时间的增加呈现不断上升的趋势,而经过发酵液处理的枣果失重率一直低于对照组。至贮藏第7天时,发酵液处理后的冬枣失重率为6.04%,对照组为9.81%,两者差异显著(P<0.05)。结果表明,发酵液能够在一定程度上减少枣果中营养物质的代谢分解和水分的蒸发,保持果实的重量,提高果实的品质。
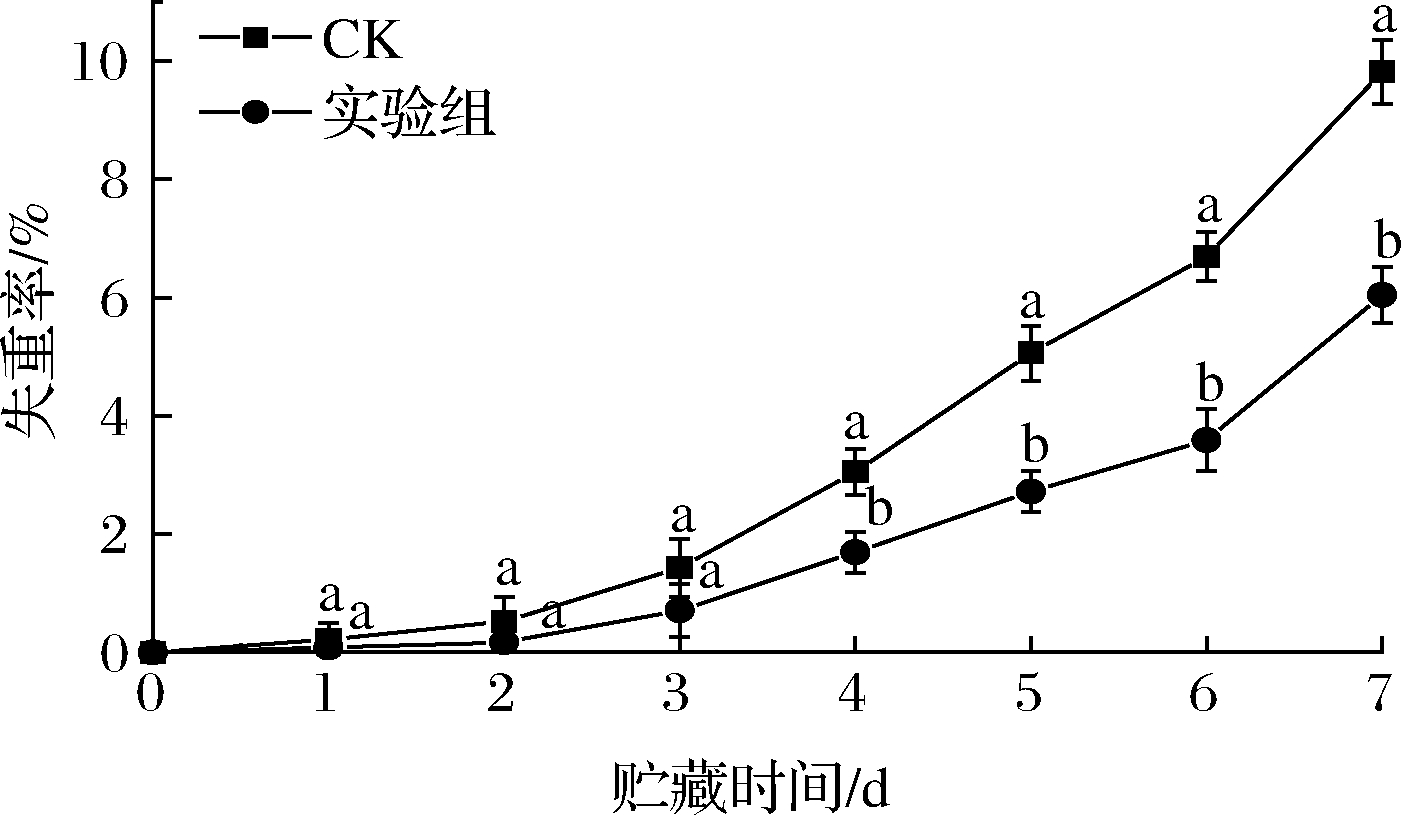
图4 发酵液对冬枣失重率的影响
Fig.4 Effect of fermentation broth on the weight loss rate of winter jujube
2.3.2 果实可滴定酸的变化
可滴定酸含量直接影响着枣果品质,是检验果实品质的重要指标之一[18]。一般在冬枣青果中含量最高,随后随着果实成熟度的增加,可滴定酸含量降低,这是因为在果实成熟过程中,可滴定酸作为呼吸作用底物被消耗[19]。从图5可以看出,对照组和实验组冬枣的可滴定酸含量随着贮藏时间的增加均呈逐渐下降的趋势,但对照组的可滴定酸含量一直低于实验组。至贮藏第7天时,经发酵液处理的枣果可滴定酸含量为0.21%,对照组为0.19%,实验组高于对照组但差异不显著(P>0.05)。结果表明,发酵液处理能够有效减缓枣果可滴定酸含量的降低,保持枣果的贮藏品质和风味口感。

图5 发酵液对冬枣可滴定酸含量的影响
Fig.5 Effect of fermentation broth on the titratable acid content of winter jujube
2.3.3 果实维生素C含量的变化
维生素C是水果的营养成分之一,对于人类来说具有重要的健康价值[20]。冬枣的维生素C含量极高,是贮藏期间重要的理化指标,且枣果维生素C含量与软化率呈负相关。由图6可知,在贮藏时间内,2组枣果维生素C含量呈现逐渐下降的趋势,经发酵液处理后的枣果维生素C含量一直高于对照组。至贮藏第7天时,对照组维生素C含量为105.42 mg/100g,而经发酵液处理枣果维生素C含量为134.17 mg/100g,差异显著(P<0.05)。结果表明,经发酵液处理有效保持枣果内维生素C含量,抑制枣果内营养成分的流失,起到了一定的保鲜作用。

图6 发酵液对冬枣维生素C含量的影响
Fig.6 Effect of fermentation broth on the vitamin Ccontent of winter jujube
2.3.4 果实还原糖含量的变化
枣果在采后贮藏期间,果实需要进行呼吸作用,还原糖是果实呼吸作用的底物,于是淀粉逐渐被淀粉酶分解为还原糖,这样便会使果实中的还原糖含量升高。如图7所示,枣果中的还原糖含量随着贮藏时间的增加呈现逐渐上升的趋势,对照组果实还原糖含量一直高于实验组(P<0.05)。结果表明,GS-316拮抗菌发酵液处理能够有效抑制枣果的呼吸作用,降低果实淀粉酶的活性,有效延长冬枣的保鲜期限。

图7 发酵液对冬枣还原糖含量的影响
Fig.7 Effect of fermentation broth on the reducing sugar content of winter jujube
2.3.5 CAT和PG
H2O2是植物体在生命代谢过程中产生的,对植物体细胞具有破坏性,而CAT可以使其分解为H2O和O2。如图8所示,枣果中的CAT活性随着贮藏时间的增加均呈现先上升后下降的趋势,在贮藏第7天时,CAT活性低于初始值,实验组显著高于对照组(P<0.05)。贮藏第1天时,对照组CAT活性高于实验组且达到高峰,实验组CAT活性在第3天才达到高峰,推测对照组枣果衰老进程较实验组快,果实中的防御系统提前启动,诱导CAT活性增加,后期冬枣腐烂,导致果实内的CAT活性降低。
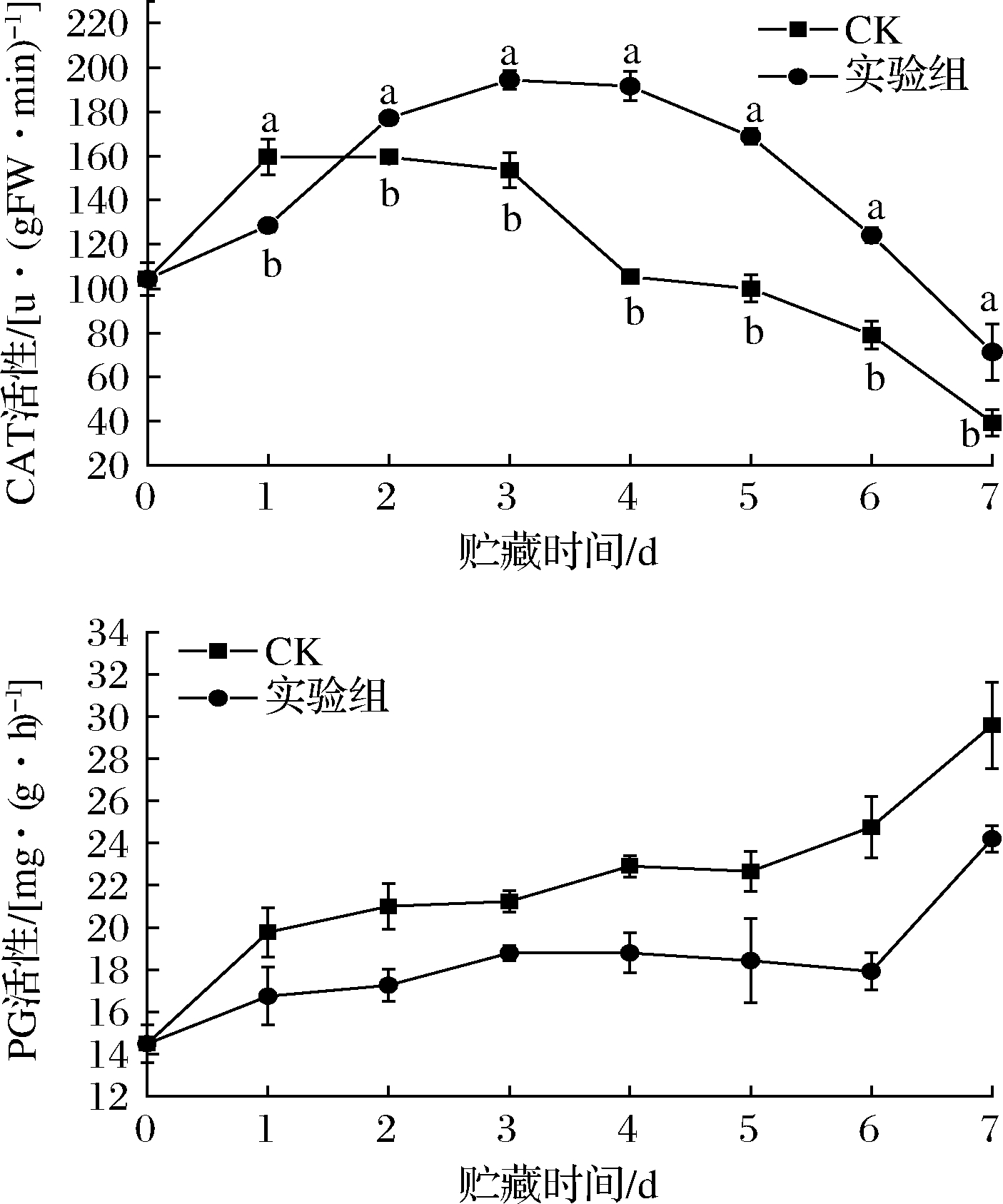
图8 发酵液对冬枣CAT和PG活性的影响
Fig.8 Effect of fermentation broth on catalase polygalacturonase activities of winter jujube
植物细胞壁中的果胶含量与果实硬度呈现正相关。PG能够特异性催化水解多聚半乳糖醛酸,使植物细胞壁中的果胶发生降解,且外界病原菌侵入会使枣果抗病酶系失效,病原菌同样会分泌果胶相关的降解酶等,也会使枣果发生软化。2组枣果的PG活性在贮藏间内呈现逐渐上升的趋势,实验组的PG活性一直低于对照组(P<0.05),且上升速率小于对照组。推测其原因可能是因为经上清液处理的枣果果实有上清液中的抑菌成分抑制了果实PG发挥其作用,并且增强了果实体内抗病酶系活性,这样就有效减少了外界病原菌入侵对果实造成的伤害。
结果表明,拮抗菌GS316发酵液处理果实能够使果实中CAT活性保持在较高位置,并且减缓枣果果实中PG活性的升高,增强冬枣果实抗病酶系的活性,提高果实的抗氧化活性,减少外界病原菌对果实细胞壁的降解,有效抑制果实软化,提升其贮藏品质及贮藏时间。
3 结论与讨论
拮抗微生物的抑菌机制研究是近几年人们研究的热点,拮抗微生物可能分泌一些抗毒素、抑菌蛋白等物质直接作用于靶标如病原菌菌丝、孢子等起到抑制效果[21-23]。已有研究报道了一种膜醭毕赤酵母可通过分泌2种抑菌蛋白PMKT和PMICT2来抑制病原真菌的生长[24]。本实验室的初步研究结果也表明,膜醭毕赤酵母菌可能产生某种物质抑制了病原菌致病水解酶,所以导致了病原菌致病力下降,抑制病原菌的入侵[12]。本文在前述成果的基础上,进一步明确了该菌的抑菌物质在发酵液中存在,抑菌物质能够对交链孢菌落起到直接抑制作用。
枣果在采后易受到病原菌的污染,主要是由于其高水分含量以及高糖分等特点,使得枣果的生理品质在采后贮藏过程中逐渐下降,直至枣果腐烂。本研究通过冬枣采后贮藏实验发现,GS-316发酵液处理后能够抑制冬枣发病,减缓果实失重率的变化并维持可滴定酸含量,抑制还原糖含量的增加,说明拮抗菌发酵液可对采后果实品质恶化有抑制作用;主要代谢酶活性分析表明,发酵液作用于果实后,能够保持较高的CAT活性,降低PG的活性,从而增强果实的抗氧化能力,降低果实软化速率,推测该拮抗酵母的发酵液中含有的抑菌类物质,能够阻止外界病原菌的侵入从而达到保持冬枣品质和抗病酶系活性的目的,并且有效的阻止果实品质的劣变。
拮抗菌GS316发酵液能够抑制冬枣果实在贮藏期的黑斑病,可作为一种生物保鲜液在冬枣保鲜中发挥作用。将拮抗微生物的发酵液应用到冬枣果实的保鲜中,为冬枣果实的贮藏保鲜提供了新技术。未来可将发酵液进行更精细的分离纯化,并可明确其起抑菌作用的物质分类及分子结构。
[1] 张婷婷. 不同涂膜处理对新疆冬枣保鲜效果的研究[D].石河子:石河子大学, 2020.
ZHANG T T.Study on fresh-keeping effect of Xinjiang winter jujube with different coatings[D].Shihezi:Shihezi University, 2020.
[2] FU M R, ZHANG X M, JIN T, et al.Inhibitory of grey mold on green pepper and winter jujube by chlorine dioxide (ClO2) fumigation and its mechanisms[J].LWT, 2019, 100:335-340.
[3] 肖黎斌. 秦宝冬枣采后生理及贮藏保鲜技术研究[D].西安:陕西师范大学, 2016.
XIAO L B.Study on postharvest physiology, storage and preservation of Zizyphus jujuba cv“Qinbao”[D].Xi′an:Shaanxi Normal University, 2016.
[4] RASHWAN A K, KARIM N, SHISHIR M R I, et al.Jujube fruit:A potential nutritious fruit for the development of functional food products[J].Journal of Functional Foods, 2020, 75:104 205.
[5] ZHANG L H, LI S F, DONG Y, et al.Tea polyphenols incorporated into alginate-based edible coating for quality maintenance of Chinese winter jujube under ambient temperature[J].LWT, 2016, 70:155-161.
[6] ZHAO Y T, ZHU X, HOU Y Y, et al.Postharvest nitric oxide treatment delays the senescence of winter jujube (Zizyphus jujuba Mill.cv.Dongzao) fruit during cold storage by regulating reactive oxygen species metabolism[J].Scientia Horticulturae, 2020, 261:109 009.
[7] ZHANG S Y, WANG Q, GUO Y J, et al.Carbon monoxide enhances the resistance of jujube fruit against postharvest Alternaria rot[J].Postharvest Biology and Technology, 2020, 168:111 268.
[8] 张惠然, 张军.冬枣采后生理及保鲜技术研究进展[J].保鲜与加工, 2017, 17(1):134-138.
ZHANG H R, ZHANG J.Research progress on postharvest physiology and storage technology of winter jujube[J].Storage and Process, 2017, 17(1):134-138.
[9] ZHANG H Y, MAHUNU G K, CASTORIA R, et al.Augmentation of biocontrol agents with physical methods against postharvest diseases of fruits and vegetables[J].Trends in Food Science & Technology, 2017, 69:36-45.
[10] DE SPADARO D, DROBY S.Development of biocontrol products for postharvest diseases of fruit:The importance of elucidating the mechanisms of action of yeast antagonists[J].Trends in Food Science & Technology, 2016, 47:39-49.
[11] GUO H L,CUI Y, ZHU E L, et al.Effect of antagonistic yeast Pichia membranaefaciens on black spot decay of postharvest broccoli[J].European Journal of Plant Pathology, 2015, 143(2):373-383.
[12] 乔博鑫, 郭红莲, 邹欣欣, 等.拮抗酵母BS-316抑菌成分分离与应用的初步研究[J].保鲜与加工, 2019, 19(1):46-50.
QIAO B X, GUO H L, ZOU X X, et al.Preliminary study on isolation and application of antimicrobial components from antagonistic yeast BS-316[J].Storage and Process, 2019, 19(1):46-50.
[13] 唐艳. 采后处理对枣贮藏品质的影响研究[D].长沙:中南林业科技大学, 2019.
TANG Y.Study on the effect of post-harvest treatment on storge quality of Ziziphus jujuba Zhongqiusucui[D].Changsha:Central South University of Forestry &Technology, 2019.
[14] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Experiment Guidance of Posttharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[15] CHENG S B, YU Y, GUO J Y, et al.Effect of 1-methylcyclopropene and chitosan treatment on the storage quality of jujube fruit and its related enzyme activities[J].Scientia Horticulturae, 2020, 265:109 281.
[16] ADEDEJI O E, EZEKIEL O O.Pretreatment of selected peels for polygalacturonase production by Aspergillus awamori CICC 2040:Purification and application in mango juice extraction[J].Bioresource Technology Reports, 2019, 7:100 306.
[17] AL OBEED R S.Jujube post-harvest fruit quality and storagability in response to agro-chemicals preharvest application[J/OL].African Journal of Agriculture Research, 2012, 7(36).DOI:10.5897/ajar12.151.
[18] ALENAZI M M, SHAFIQ M, ALSADON A A, et al.Improved functional and nutritional properties of tomato fruit during cold storage[J].Saudi Journal of Biological Sciences, 2020, 27(6):1 467-1 474.
[19] 武继芸. 不同涂膜处理对冬枣贮藏品质和抗氧化活性的影响[D].天津:天津大学, 2016.
WU J Y.Effects of coating treatments on storage quality and antioxidant capacity of Zizyphus jujuba Miller cv.Dongzao[D].Tianjing:Tianjin University, 2016.
[20] SÉRINO S, COSTAGLIOLA G, GOMEZ L.Lyophilized tomato plant material:Validation of a reliable extraction method for the analysis of vitamin C[J].Journal of Food Composition and Analysis, 2019, 81:37-45.
[21] SANTOS A, MARQUINA D.Killer toxin of Pichia membranifaciens and its possible use as a biocontrol agent against grey mould disease of grapevine[J].Microbiology, 2004, 150(8):2 527-2 534.
[22] VILLALBA M L, MAZZUCCO M B, LOPES C A, et al.Purification and characterization of Saccharomyces eubayanus killer toxin:Biocontrol effectiveness against wine spoilage yeasts[J].International Journal of Food Microbiology, 2020, 331:108 714.
[23] COELHO A R, TACH M, PAGNOCCA F C, et al.Purification of Candida guilliermondii and Pichia ohmeri killer toxin as an active agent against Penicillium expansum[J].Food Additives & Contaminants Part A, 2009, 26(1):73-81.
[24] SANTOS A, SAN MAURO M, BRAVO E, et al.PMKT2, a new killer toxin from Pichia membranifaciens, and its promising biotechnological properties for control of the spoilage yeast Brettanomyces bruxellensis[J].Microbiology (Reading, England), 2009, 155:624-634.