新疆地区地貌独特,在三山和两盆地的周围有着辽阔的天然草原,得天独厚的地理条件推动了其畜牧业的发展,是蒙古族、哈萨克族、维吾尔族等游牧民族的聚集地。由于长期的牧区生活,牧民们对加工发酵牦牛乳、曲拉、奶酪、发酵牛乳和马奶酒等自然发酵乳制品积累了丰富的经验,其中,牧民手工制作的酸牛乳是在开放环境中经过自然发酵而成,酸甜可口,营养丰富,具有调理胃肠道、改善乳糖不耐症、降低胆固醇等益生作用,深受当地牧民的喜爱,其中优良的发酵菌种经过数年代代相传而来。
近年来,诸多关于自然发酵乳制品中微生物多样性的研究表明,自然发酵酸牛乳中微生物丰富多样,其中门水平上,主要包含Firmicutes、Proteobacteria、Bacteroidetes、Actinobacteria等[1-3],种水平上,主要有Lactobacillus delbrueckii subsp.bulgaricus、Lactobacillus delbrueckii、Lactobacillus fermentum、Lactobacillus helveticus、Streptococcus thermophilus、Lactococcus lactis subsp.lactis、Lactobacillus casei等乳酸菌[4-8],并且不同种类、不同地区自然发酵乳制品中乳酸菌组成具有显著的地域差异和家庭特异性。
然而,自然发酵乳制品质量较不稳定,安全性难以保证,当前将其制作工艺统一化、标准化来实现工业化生产以提升其品质和生产规模十分重要,但如果将自然发酵乳制品脱离原始发酵环境进行工业化生产,能否保留自然发酵乳制品特有的微生物组成和品质,还需要足够的科研数据支持,相关研究还鲜有报道。
因此,本研究在实验室模拟自然发酵乳中的混合微生物连续发酵过程,通过纯培养方法结合PacBio SMRT测序技术探究新疆自然发酵酸牛乳在连续发酵过程中乳酸菌菌群结构动态变化,为自然发酵酸牛乳工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
本研究用的自然发酵酸牛乳样品由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供,采集信息如表1所示。MRS液体培养基(CM1175)、MRS固体培养基(CM1163),英格兰OXOID公司;细菌基因组 DNA 提取试剂盒,北京天根生物技术有限公司;OMEGA EZNA®Soil微生物宏基因组DNA提取试剂盒,美国OMEGA公司;KAPA HiFi HotStart ReadyMIX PCR Kit,美国KAPA生物系统公司;SMRT建库试剂盒(DNA Template Prep Kit 1.0)、测序试剂(DNA/Polymerase Bingding Kit P6 v2和DNA Sequencing Bundle 4.0),美国太平洋生物科学公司。
表1 新疆自然发酵酸牛乳样品采集信息表
Table 1 Information of traditional fermented milk samples in Xinjiang

样品编号样品类型采样地点采样时间WQ8酸牛乳喀什市乌恰县2018年9月YC8酸牛乳叶城县乌夏巴什镇2018年9月TK7酸牛乳叶城县乌夏巴什镇2018年9月
1.2 仪器与设备
SMRT RSⅡ测序平台,美国Pacific Biosciences公司;Applied Biosystems PCR仪,伯乐公司;DYY-12型电泳仪,北京六一生物科技有限公司;UVPGDS-8000型凝胶成像分析系统,UVP 公司;ND-1000型微量紫外分光光度计,Nanodrop公司。
1.3 实验方法
1.3.1 自然发酵酸牛乳的实验室连续发酵
吸取5 mL自然发酵酸牛乳样品至100 mL 110 g/L的灭菌脱脂乳中,充分混匀,置于25 ℃发酵72 h。将发酵结束的发酵乳作为下一次发酵的引子,重复上述发酵过程,连续发酵持续9个月。每次发酵结束进行pH值的测定,对第0、3、6、9月发酵乳样品进行乳酸菌计数,乳酸菌分离及16S rRNA基因序列鉴定,乳酸菌宏基因组PCR测序。
1.3.2 乳酸菌计数
采用倾注平板法[9]对所有样品中乳酸菌进行活菌计数。
1.3.3 样品中乳酸菌的分离及16S rRNA基因序列鉴定
乳酸菌的分离采用MRS培养基及平板涂布法[10],菌株纯化采用平板划线法,将革兰氏染色阳性、过氧化氢酶阴性,无芽孢菌株初步断定为疑似乳酸菌进行保藏。
用MRS培养基活化1.3.3保藏的菌株,连续培养2代后,离心收集菌体。采用TIANamp Bacteria DNA Kit试剂盒对分离株基因组DNA进行提取,并检测DNA质量是否合格[11]。将DNA基因进行PCR扩增[9,12-13],将PCR产物送至上海桑尼生物科技有限公司进行16S rRNA基因序列测定,在GenBank数据库对分离株16S rRNA基因序列进行同源性比对,鉴定其菌种[14]。
1.3.4 样品中乳酸菌宏基因组PCR测序
采用OMEGA EZNA®Soil试剂盒提取样品中宏基因组,之后使用微量紫外分光光度计检验其纯度及浓度,使用乳酸菌特异性引物对乳酸菌DNA进行PCR扩增[15]。PCR产物经AMPure beads纯化后,用Pacific Biosciences Template Prep Kit 2.0构建文库[16],加入测序引物、聚合酶后,使用SMRT RSⅡ仪器进行测序[12]。
1.3.5 生物学信息分析
使用RS_ReadsOfinsert.1对原始序列进行处理,使用QIIME[17]平台对原始序列进行过滤,保留高质量序列[18]。采用PyNAST将序列校准排齐后,使用UCLUST algorithm在> 97%的相似性条件下划分操作分类单元(operational taxonomic units,OTU)[19]。去除属于嵌合体 OTU 后,使用 RDP(ribosomal database project,Release11.5)、Sliva(v128)及Greengenes(v13.8)数据库确定各 OTU 的分类学地位,进而计算各样品乳酸菌在门、纲、目、科、属和种水平的相对含量。计算各组样本香农指数(Shannon-wiener index)、辛普森指数(Simpson index)、Chao1指数和发现的物种数量指数(Observed species),用于评估α多样性。基于Unifrac距离对样品之间进行加权(weighted)和非加权(unweighted)的主坐标分析(principal coordinate analysis,PCoA)[20]。
1.3.6 数据处理
由QIIME分析的乳酸菌α多样性结果及样品之间Unifrac距离结果使用ImageGP(www.ehbio.com/ImageGP)进行可视化处理,其余图由Origin 8.6完成,使用软件IBM SPSS Statistics 22.0进行单因素方差分析。
2 结果与分析
2.1 自然发酵酸牛乳连续发酵过程中pH值及乳酸菌活菌数的变化
3份酸牛乳样品在连续发酵过程中pH值变化如图1所示。酸牛乳样品在连续发酵期间pH值呈现下降趋势(图1-a~图1-c),由图1-d可知,在连续发酵期间,酸牛乳样品中乳酸菌活菌数变化总体呈下降趋势,这是因为部分不耐酸乳酸菌生长受到了抑制[21]。其活菌数虽有所下降,但仍保持在7.0 lgCFU/mL以上。
2.2 基于纯培养方法分析自然发酵酸牛乳连续发酵期间乳酸菌菌群结构

a-WQ8;b-TK7;c-YC8;d-乳酸菌活菌数
图1 连续发酵期间酸牛乳pH值及乳酸菌活菌数的变化
Fig.1 The variation of pH and lactic acid bacteria viable count of fermented milk during successive fermentation
如表2及图2所示,通过纯培养方法从12份酸牛乳样品中共分离到9个乳酸菌菌种,其中,L.helveticus、L.delbrueckii、L.delbrueckii subsp.bulgaricus是0月(原始)酸牛乳样品中优势菌种。然而随着连续发酵,L.delbrueckii、L.delbrueckii subsp.bulgaricus再未分离到,由此看来L.delbrueckii、L.delbrueckii subsp.bulgaricus生长受到抑制。连续发酵9个月后,样品WQ8、TK7、YC8中优势菌分别为L.helveticus、L.casei、L.fermentum,从YC8中还分离到了Enterococcus durans与Enterococcus faecium,很显然,酸牛乳样品中乳酸菌组成发生改变,其中L.helveticus、Enterococcus在对酸性条件的耐受性方面具有一定的优势[22]。
表2 连续发酵时期酸牛乳样品中乳酸菌分离鉴定结果
Table 2 Isolation and identification of lactic acid bacteria from fermented milk samples during successive fermentation stages
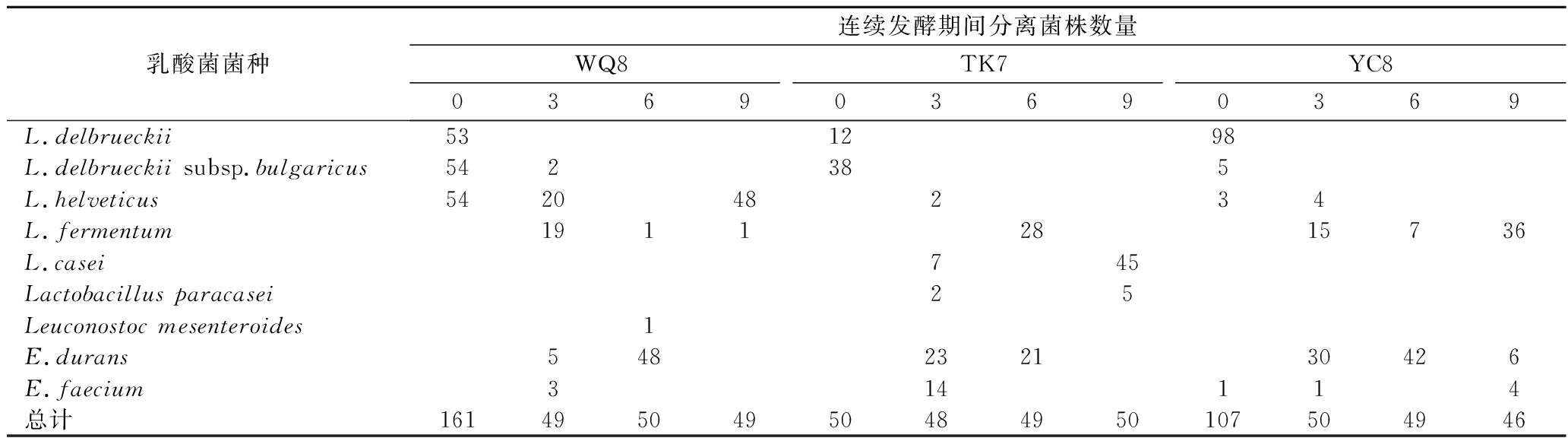
乳酸菌菌种连续发酵期间分离菌株数量WQ8TK7YC8036903690369L.delbrueckii531298L.delbrueckii subsp.bulgaricus542385L.helveticus542048234L.fermentum19112815736L.casei745Lactobacillus paracasei25Leuconostoc mesenteroides1E.durans548232130426E.faecium314114总计16149504950484950107504946
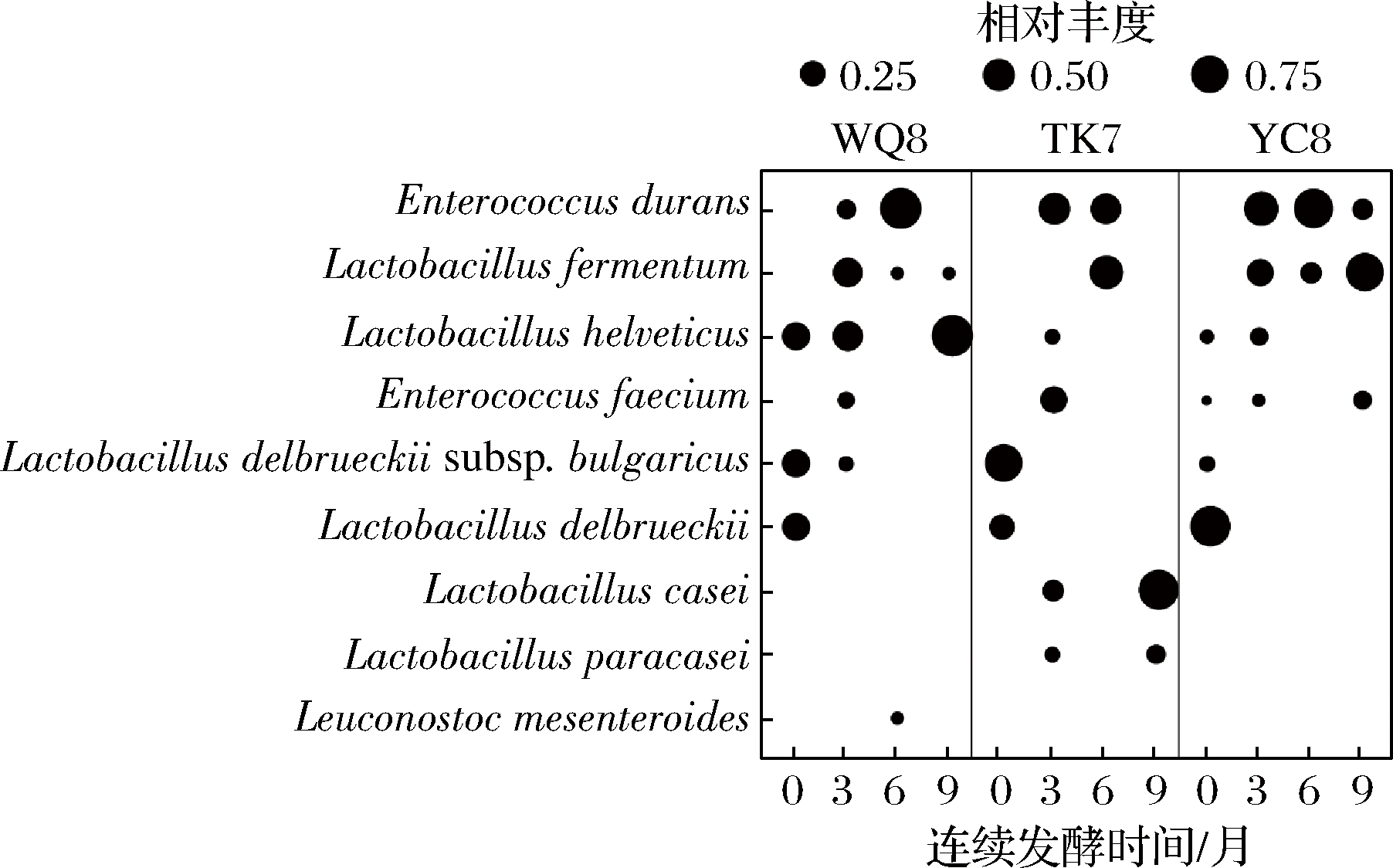
图2 酸牛乳样品连续发酵过程中乳酸菌种群结构变化
Fig.2 The variation of lactic acid bacteria population structure of fermented milk samples during successive fermentation
2.3 基于PacBio SMRT测序技术分析自然发酵酸牛乳连续发酵期间乳酸菌菌群结构
12份酸牛乳样品共产生30 209条高质量完整的16S rRNA基因序列,其中,剔除掉非乳酸菌及未能鉴定到属的序列后,最终获得30 141条乳酸菌序列,每份样品平均序列数量为(2 512±824)条。根据 97%相似度划分 OTU 后,共得到519个具有代表性的OTU,具体信息见表3。由稀疏曲线图(图3-a)可知,在当前测序量,每个样品的稀疏曲线上升趋势较弱,说明随着测序量的增加,只会发现少量新的OTU。香农指数曲线(图3-b)已经达到水平状态,这表明,随着测序量加深,微生物的多样性不再变化了,说明当前的测序量满足后续分析的需要。
表3 样品序列丰度及乳酸菌多样性信息
Table 3 Sequence abundance and lactic acid bacteria diversity of samples
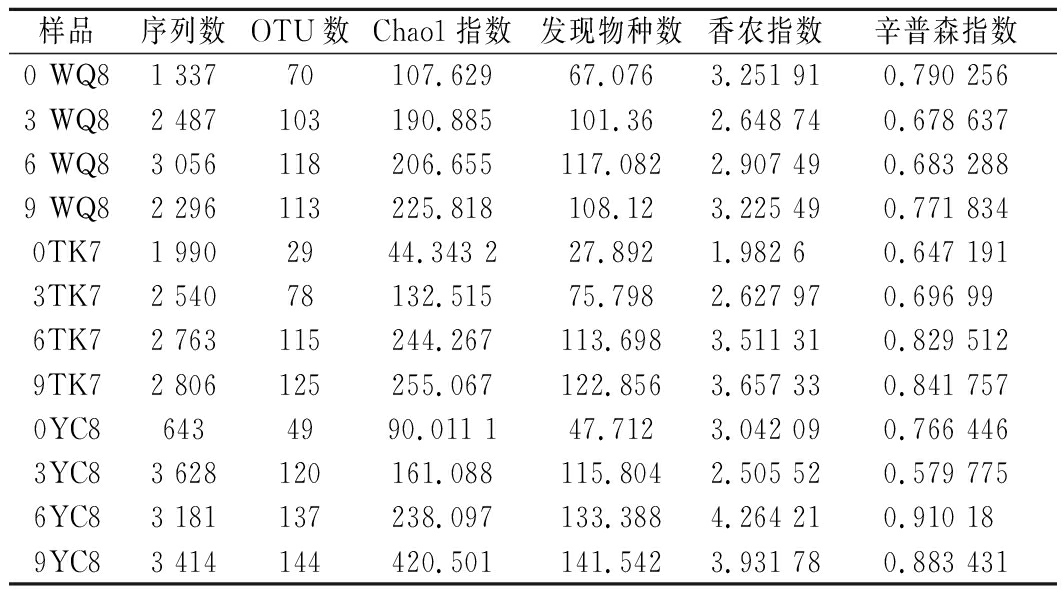
样品序列数OTU数Chao1指数发现物种数香农指数辛普森指数0 WQ81 33770107.62967.0763.251 910.790 2563 WQ82 487103190.885101.362.648 740.678 6376 WQ83 056118206.655117.0822.907 490.683 2889 WQ82 296113225.818108.123.225 490.771 8340TK71 9902944.343 227.8921.982 60.647 1913TK72 54078132.51575.7982.627 970.696 996TK72 763115244.267113.6983.511 310.829 5129TK72 806125255.067122.8563.657 330.841 7570YC86434990.011 147.7123.042 090.766 4463YC83 628120161.088115.8042.505 520.579 7756YC83 181137238.097133.3884.264 210.910 189YC83 414144420.501141.5423.931 780.883 431
注:0xxx为原始样品、3xxx为连续发酵第3月样品、6xxx为连续发酵第6月样品、9xxx为连续发酵第9月样品
本研究采用单因素方差分析分析了不同连续发酵时间的酸牛乳样品间α多样性差异性,显著性水平P为0.05。由图4可知,6月酸牛乳样品Chao1指数显著高于0月(P=0.036<0.05),而不同连续发酵
时间的酸牛乳样品发现物种数、香农指数及辛普森指数之间不存在显著差异(P>0.05),则表明不同样品乳酸菌多样性和丰富度差异不显著。

a-稀疏曲线;b-香农曲线
图3 稀疏曲线图和香农曲线图
Fig.3 Rarefaction curves and Shannon diversity index curves

a-Chao1指数;b-发现物种数;c-香农指数;d-辛普森指数
图4 不同连续发酵时期酸牛乳菌群α多样性差异性
Fig.4 The differences in α diversity of fermented milk microbiota at different continuous fermentation times
注:**表示不同连续发酵时期酸牛乳菌群α多样性差异显著(P<0.05)
在12份酸牛乳样品中只检测到了厚壁菌门。由图5可知,在属水平上,共鉴定出7个菌属,包括Lactobacillus(80%),Streptococcus(8%),Enterococcus(8%),Leuconostoc(4%),还有极少量的Staphylococcus,Streptococcus和Bacillus,酸牛乳样品中主要是Lactobacillus。
在种水平上,本研究共发现25个乳酸菌菌种,主要包括L.helveticus(49.09%)、L.delbrueckii(11.03%)、L.fermentum(10.07%)、S.thermophilus(7.46%)、Lactobacillus gallinarum(5.68%)等(图6)。由此可见,与依赖培养方法得出的结果相比,三代测序技术测得的乳酸菌菌群的多样性更高,更全面。此外,L.delbrueckii(38.25%)、S.thermophilus(29.80%)、L.helveticus(27.81%)为0月(原始)酸牛乳样品中优势菌,采用纯培养方法除了未分离到S.thermophilus以外,得到的结果与其基本一致。
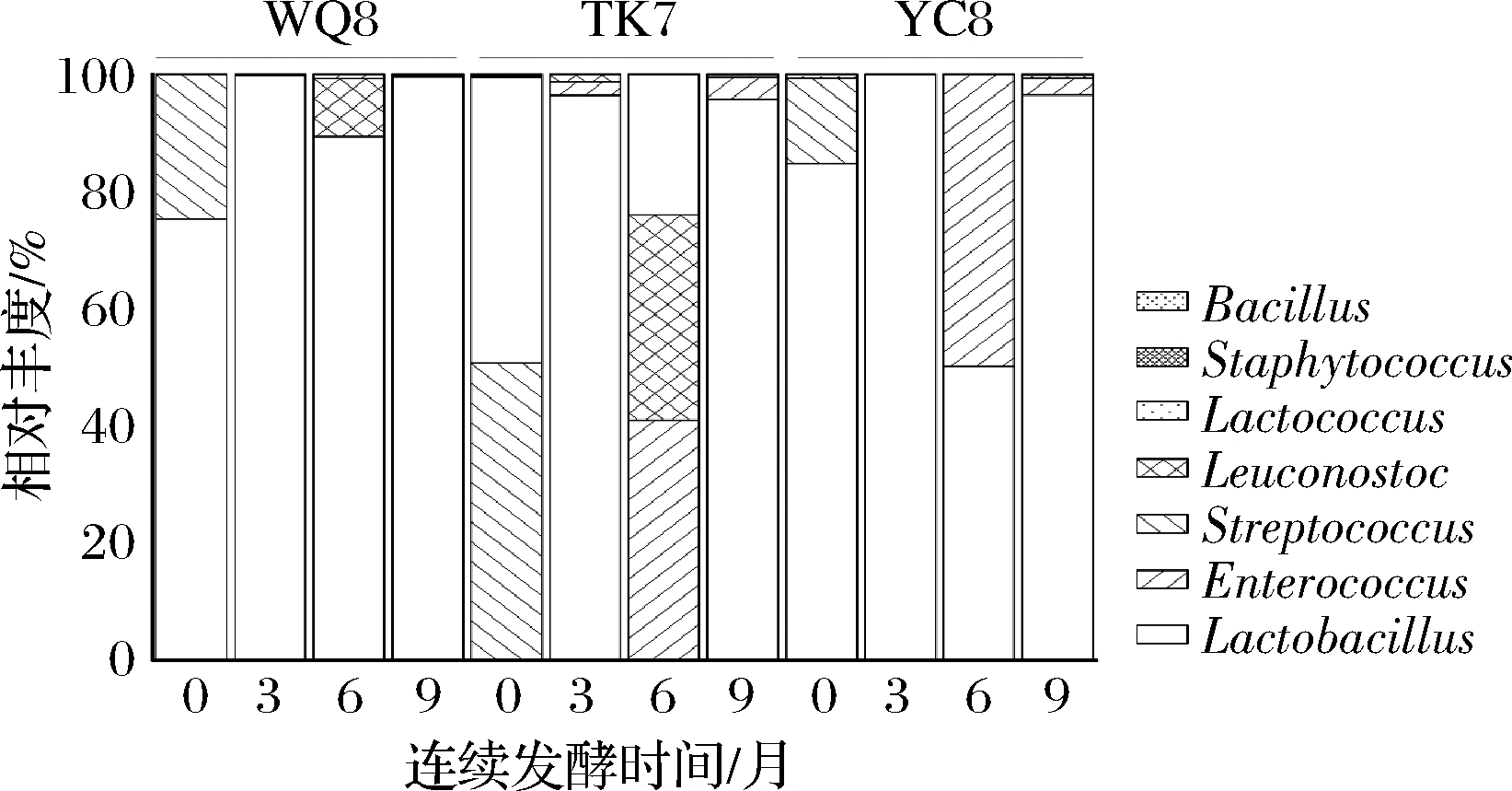
图5 酸牛乳样品中乳酸菌菌群相对含量的分析
(基于属水平)
Fig.5 Relative abundance of the lactic acid bacteria
genera in fermented milk samples (Genera level)
随着连续发酵,原有优势菌种L.delbrueckii生长受到抑制而逐渐减少,甚至消失,采用纯培养方法也得到类似结果。此外,S.thermophilus、Lactobacillus leichmannii、Lactobacillus reuteri、Lactobacillus ruminis、L.lactis等减少或消失,而L.helveticus、L.fermentum、L.gallinarum、E.durans等含量增加,表现出较强的适应性与竞争能力。
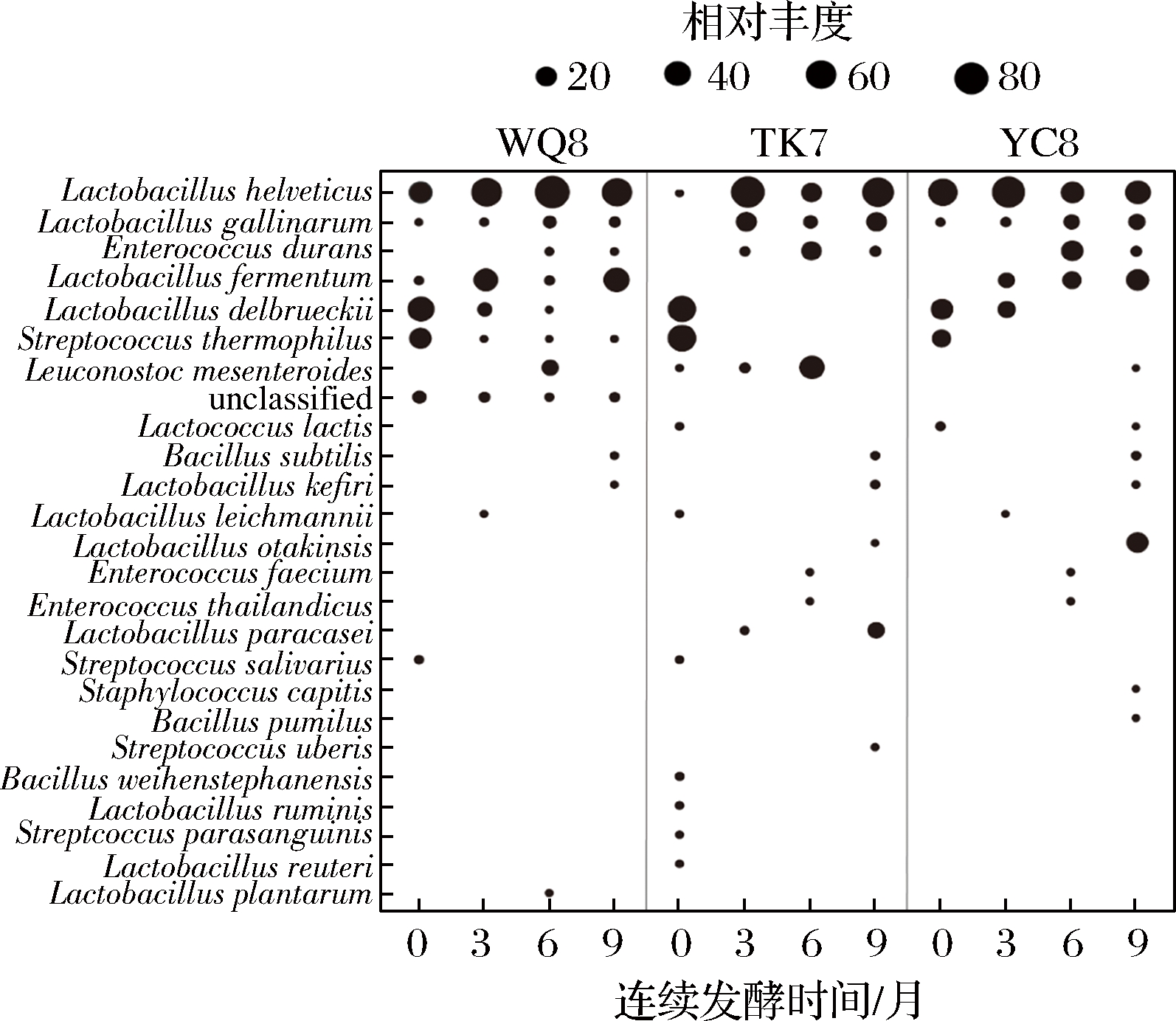
图6 酸牛乳样品连续发酵过程中乳酸菌菌群动态变化
Fig.6 Dynamic change of lactic acid bacteria in fermented milk samples during successive fermentation
本研究基于Unifrac的加权和非加权主坐标分析,对不同连续发酵时间的酸牛乳样品中乳酸菌菌群结构进行分析,结果如图7所示。PCoA加权和非加权分析均未能将不同连续发酵时间酸牛乳样品明显区分开,这可能是因为酸牛乳样品数量太少,只有3份,导致差异不明显[16]。经PCoA加权分析发现,0月(原始)样品与3、6、9月样品之间的距离较3、6、9月样品之间的距离更远,这表明连续发酵前后酸牛乳之间存在差异。
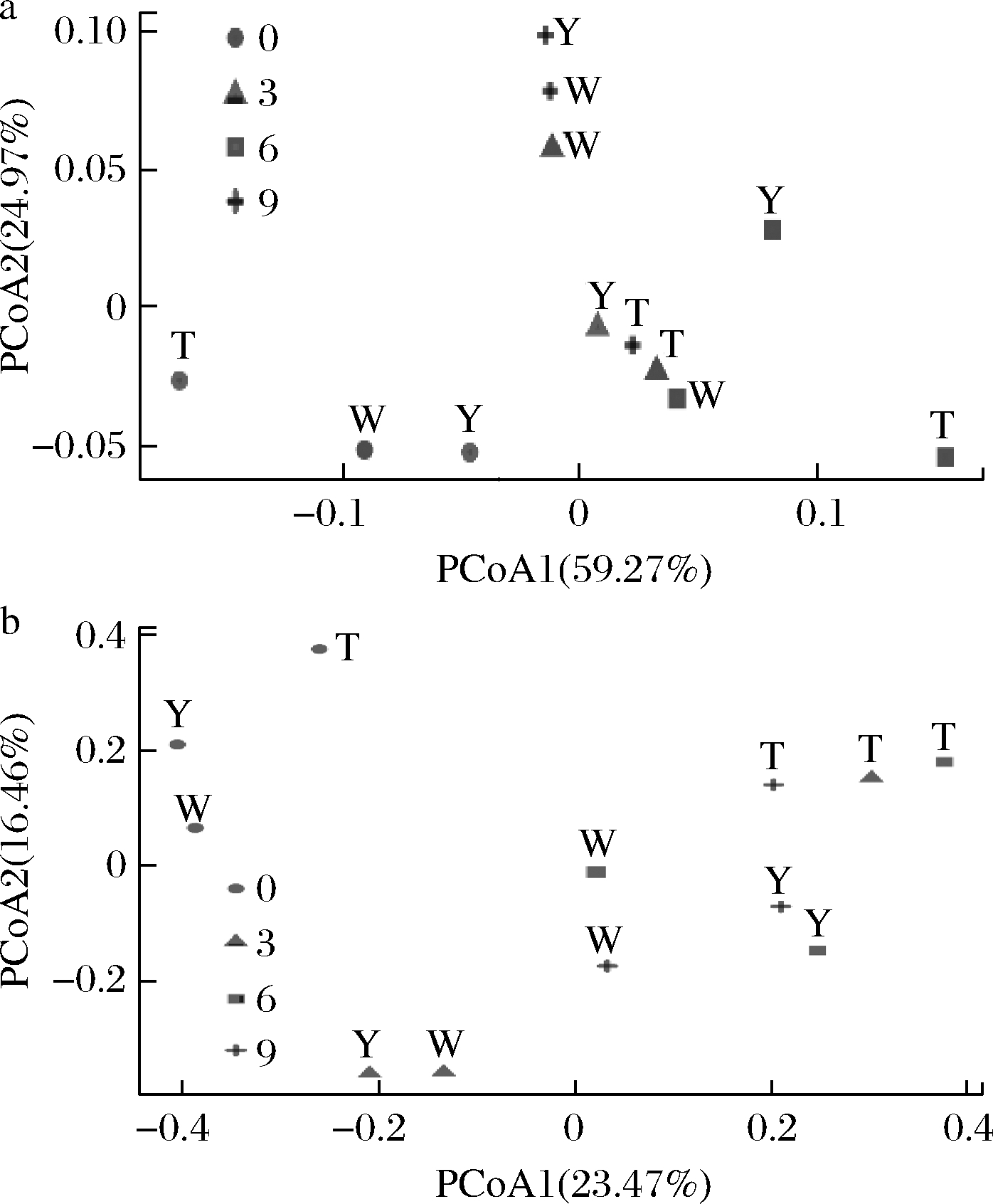
a-加权;b-非加权
图7 基于Unifrac加权和非加权的不同发酵时期酸牛乳乳酸菌群落结构主坐标分析
Fig.7 Principal coordinate analysis based on the weighted and unweighted Unifrac distances of lactic acid bacteria communities of samples from different passage periods
3 讨论
本研究尽量模拟牧民自制自然发酵酸牛乳工艺,酸牛乳的连续发酵以72 h为1个发酵周期。就整个连续发酵过程来说,酸牛乳样品几乎均以Lactobacillus为主,Lactobacillus是发酵乳制品中的核心菌属[8,11,15-16,23],并且Lactobacillus的耐酸性比Streptococcus、Lactococcus高[11],这与其他同类研究的结果一致。在连续发酵期间,随着pH不断下降,一些不适应酸性环境的乳酸菌如S.thermophilus、L.lactis、S.salivarius等,不能维持细胞内pH接近中性,便丧失活性甚至死亡[24-25],从而酸牛乳中乳酸菌活菌数降低[21],而L.delbrueckii subsp.bulgaricus依赖脱羧酶机制消耗质子,通过F1F0-ATPase质子泵排出质子来维持细胞内pH平衡,具有较强的耐酸性[26-27],但在连续发酵期间消失,可能是因为其他微生物对其存在拮抗作用。酸牛乳样品中微生物较为复杂,除了产酸较强的乳酸菌如L.helveticus、L.fermentum、E.durans等依然保留之外[28-29],还可能有一些酵母菌和其他细菌(醋酸菌)的存在,均具有产酸作用[30-31],因此,菌群产酸能力并没有因乳酸菌活菌数降低而减弱。另外,菌群产酸能力动态变化是因为每一次发酵接种的微生物数量,菌种类型及比例不同,从而导致酸牛乳中菌群产酸能力不同[32]。此外,发酵制品中微生物演替主要受发酵原料、时间、温度、地理环境等因素的影响[33],本研究的发酵环境为无菌且封闭,与自然发酵环境不同,缺乏外界自然环境中微生物对发酵体系的补充,这也是自然发酵酸牛乳中特有发酵菌种未能保留的原因之一。值得一提的是,在这样竞争激烈、条件恶劣(低pH)的环境下,L.helveticus含量增加,仍然保持优势,可见其具有不同于其他乳酸菌的特性,L.helveticus在对温度和pH值的耐受性方面具有一定的优势[22],且蛋白水解能力强大[34],对各类发酵乳制品的制作十分重要。因此,后续有望从中筛选到特性优良的菌株,从而为发酵乳制品生产提供优良乳酸菌资源。
本研究发现新疆自然发酵酸牛乳中优势菌属为Lactobacillus,其中L.delbrueckii、L.delbrueckii subsp.bulgaricus、S.thermophilus、L.helveticus为优势菌种,与其他研究结果类似[3,11]。采用纯培养方法未分离到S.thermophilus、L.lactis、L.gallinarum、L.mesenteroides等乳酸菌,不能全面分析样品中微生物组成,而PacBio SMRT测序技术正好弥补了这一不足,今后应当采取多种培养基组合使用的方式来尽可能全面地挖掘样品中微生物。
4 结论
新疆自然发酵酸牛乳在实验室连续发酵9个月期间,乳酸菌菌群结构没有稳定传递,说明自然发酵酸牛乳脱离自然发酵环境不利于其中乳酸菌菌群的保持。这也提示我们将自然发酵酸牛乳中混合菌种直接用于酸牛乳工业化生产尚需更多的研究支撑,从自然发酵乳中筛选发酵特性优良的乳酸菌菌种,确定最佳发酵菌种组合,对自然发酵酸牛乳的工业化生产具有重要意义。
[1] 李伟程, 侯强川, 于洁, 等.传统发酵乳制品中微生物多样性研究[J].食品工业科技, 2018, 39(1):131-136.
LI W C, HOU Q C, YU J, et al.Study on the diversity of microbial in traditional fermented dairy products[J].Science and Technology of Food Industry, 2018, 39(1):131-136.
[2] ZHONG Z, HOU Q, KWOK L, et al.Bacterial microbiota compositions of naturally fermented milk are shaped by both geographic origin and sample type[J].Journal of Dairy Science, 2016, 99(10):7 832-7 841.
[3] XU H Y, LIU W J, GESUDU Q, et al.Assessment of the bacterial and fungal diversity in home-made yoghurts of Xinjiang, China by pyrosequencing[J].Journal of the Science of Food and Agriculture, 2015, 95(10):2 007-2 015.
[4] MO L X, JIN H, PAN L, et al.Biodiversity of lactic acid bacteria isolated from fermented milk products in Xinjiang, China[J].Food Biotechnology, 2019, 33(2):174-192.
[5] 刘红新, 呼斯楞, 刘文俊, 等.哈萨克斯坦传统发酵乳制品中乳酸菌的多样性[J].中国乳品工业, 2017, 45(7):9-12.
LIU H X, HU S L, LIU W J, et al.Survey of diversity of lactic acid bacteria in traditional fermented milk products from Kazakhstan[J].China Dairy Industry,2017, 45(7):9-12.
[6] LIU W J, BAO Q H, JIRIMUTU, et al.Isolation and identification of lactic acid bacteria from Tarag in Eastern Inner Mongolia of China by 16S rRNA sequences and DGGE analysis[J].Microbiological Research, 2012, 167(2):110-115.
[7] SUN Z H, LIU W J, ZHANG J C, et al.Identification and characterization of the dominant lactic acid bacteria isolated from traditional fermented milk in Mongolia[J].Folia Microbiologica, 2010, 55(3):270-276.
[8] SHUANG Q, BURENTEGUSI, YU B, et al.Microflora in traditional starter cultures for fermented milk, hurunge, from Inner Mongolia, China[J].Animal Science Journal, 2006, 77(2):235-241.
[9] SUN Z H, LIU W J, GAO W, et al.Identification and characterization of the dominant lactic acid bacteria from kurut:The naturally fermented yak milk in Qinghai, China[J].The Journal of General and Applied Microbiology, 2010, 56(1):1-10.
[10] 祁茹, 温建新, 肖宇, 等.培养方式对乳酸杆菌和双歧杆菌检出率的影响[J].中国畜牧兽医文摘, 2012, 28(2):42;170.
QI R, WEN J X, XIAO Y, et al.The influence of culture method on the detection rate of Lactobacillus and Bifidobacterium[J].China Animal Husbandry and Veterinary Digest, 2012, 28(2):42;170.
[11] 莫蓝馨. 内蒙古锡林郭勒盟和蒙古国巴彦洪格尔省传统发酵乳制品中细菌多样性研究[D].呼和浩特:内蒙古农业大学,2019.
MO L X.Investigation of bacterial diversity in traditional fermented dairy products from Xilingol of Inner Mongolia and Bayankhongor of Mongolia[D].Hohhot:Inner Mongolia Agricultural University, 2019.
[12] 刘文俊, 多拉娜, 刘亚华, 等.基于纯培养方法和PacBio三代测序技术研究蒙古国传统酸马奶中乳酸菌多样性[J].中国食品学报, 2019, 19(4):27-37.
LIU W J, DUO L N, LIU Y H, et al.Lactic acid bacteria diversity in Mongolia traditional koumiss based on culture-dependent and PacBio sequencing technology[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(4):27-37.
[13] 杨彦荣, 任艳, 德亮亮, 等.传统奶酪样品中乳酸菌的分离鉴定[J].中国乳品工业, 2015, 43(9):19-22.
YANG Y R, REN Y, DE L L, et al.Isolation and identification of lactic acid bacteria from traditional cheese in the republic of Kalmykia in Russian[J].China Dairy Industry, 2015, 43(9):19-22.
[14] 刘红新, 德亮亮, 陈红霞, 等.内蒙古自然发酵绵羊奶油中乳酸菌的分离鉴定及优势菌群q-PCR定量分析[J].中国乳品工业, 2016,44 (9):16-19;27.
LIU H X, DE L L, CHEN H X, et al.Isolation and identification of lactic acid bacteria from naturally fermented sheep cream in Inner Mongolia as well as quantification of predominant species by q-PCR[J].China Dairy Industry, 2016,44 (9):16-19;27.
[15] LIU W J, ZHENG Y, KWOK L Y, et al.High-throughput sequencing for the detection of the bacterial and fungal diversity in Mongolian naturally fermented cow′s milk in Russia[J].BMC Microbiology, 2015, 15(1).DOI:10.1186/S12866-015-0385-9.
[16] 徐海燕, 刘亚华, 靳昊, 等.内蒙古地区母乳中乳酸菌和双歧杆菌的多样性[J].科学通报, 2019, 64(3):348-359.
XU H Y, LIU Y H, JIN H, et al.Diversity and composition of lactic acid bacteria and Bifidobacterium in breast milk form mothers living in Inner Mongolia[J].Chinese Science Bulletin, 2019, 64(3):348-359.
[17] CAPORASO J G, BITTINGER K, BUSHMAN F D, et al.PyNAST:A flexible tool for aligning sequences to a template alignment[J].Bioinformatics, 2010, 26(2):266-267.
[18] HOU Q C, XU H Y, ZHENG Y, et al.Evaluation of bacterial contamination in raw milk, ultra-high temperature milk and infant formula using single molecule, real-time sequencing technology[J].Journal of Dairy Science, 2015, 98(12):8 464-8 472.
[19] LOZUPONE C, KNIGHT R.Unifrac:A new phylogenetic method for comparing microbial communities[J].Applied and Environmental Microbiology, 2005, 71(12):8 228-8 235.
[20] MO L X, YU J, JIN H, et al.Investigating the bacterial microbiota of traditional fermented dairy products using propidium monoazide with single-molecule real-time sequencing[J].Journal of Dairy Science, 2019,102(5):3 912-3 923.
[21] 韩宏娇, 丛敏, 李欣蔚, 等.自然发酵酸菜化学成分含量和微生物数量的动态变化及其相关性分析[J].食品工业科技, 2019, 40(2):148-153.
HAN H J, CONG M, LI X W, et al.Dynamic changes and correlation analysis of chemical components contents and microbial quantity in naturally fermented sauerkraut[J].Science and Technology of Food Industry, 2019, 40(2):148-153.
[22] 其木格苏都. 自然发酵酸马奶细菌多样性及其基因动态变化研究[D].呼和浩特:内蒙古农业大学,2017.
QIMUGESUDU.Dynamics of bacterial diversity and functional genes during koumiss fermentation[D].Hohhot:Inner Mongolia Agricultural University, 2017.
[23] 马龙, 邢军, 李安, 等.开菲尔不同发酵时期微生物群落结构的变化[J].现代食品科技, 2019, 35(8):27-34;26.
MA L, XING J, LI A, et al.Evolution of microbial community structure in different fermentation periods in kefir[J].Modern Food Science and Technology, 2019, 35(8):27-34;26.
[24] 张兰威, 申美艳.培养温度pH值对保加利亚杆菌和嗜热链球菌混合生长的影响[J].食品与机械,1996, 12(5):26-27.
ZHANG L W, SHEN M Y.Influence of pH, temperature and contanue inoculum on mixed cultures of Streptococcus thermophilus CH9-9 and Lactobacillus bulgaricus CH9-3[J].Food & Machinery, 1996,12 (5):26-27.
[25] HUTKINS R W, NANNEN N L.pH homeostasis in lactic acid bacteria[J].Journal of Dairy Science, 1993, 76(8):2 354-2 365.
[26] 孙懿琳. 弱后酸化保加利亚乳杆菌菌株的筛选及其后酸化机理[D].哈尔滨:东北农业大学,2013.
SUN Y L.The screening and research on the mechanism of Lactobacillus bulgaricus with low-postacidification ability[D].Harbin:Northeast Agricultural University, 2013.
[27] 黄俊, 张祥, 尤玉如, 等.酸奶后酸化控制措施的研究进展[J].微生物学通报, 2016, 43(3):663-670.
HUANG J, ZHANG X, YOU Y R, et al.Advances in controlling postacidification in yogurt[J].Microbiology China, 2016, 43(3):663-670.
[28] 杨行, 王莉, 郭丽君, 等.新疆喀什地区传统酸奶中乳酸菌的分离鉴定及产酸能力评价[J].食品与发酵工业, 2020,46(2):102-107.
YANG H, WANG L, GUO L J, et al.Screening and identification of lactic acid bacteria from traditional yoghurt in Kashi region and its acid-producing characteristics[J].Food and Fermentation Industries, 2020, 46(2):102-107.
[29] 蒋艾廷, 李宝坤, 金丹, 等.新疆塔城传统酸奶中乳酸菌的多样性及发酵特性分析[J].食品工业科技, 2017, 38(15):122-128.
JIANG A T, LI B K, JIN D, et al.Analysis of the diversity and fermentation characteristics of lactic acid bacteria in traditional yogurts from Ta Cheng, Xinjiang[J].Science and Technology of Food Industry, 2017, 38(15):122-128.
[30] 张晓旭. 西部牧区酸马奶和奶渣中酵母菌分离筛选及其应用研究[D].杨凌:西北农林科技大学,2016.
ZHANG X X.Identification and application of yeasts isolated from koumiss and yak milk dreg collected in western China[D].Yangling:Northwest A&F University, 2016.
[31] 姚洪礼, 李兴江, 郑志, 等.基于16S rDNA的醋酸菌筛选及其发酵特性[J].食品科学, 2017,38 (4):6-12.
YAO H L, LI X J, ZHENG Z, et al.Screening and fermentation characteristics of an acetic acid bacterial strain based on 16S rDNA for vinegar production[J].Food Science, 2017,38 (4):6-12.
[32] 郝爽. 酸奶工艺条件的优化[D].呼和浩特:内蒙古农业大学,2012.
HAO S.The optimization for yoghurt production conditions[D].Hohhot:Inner Mongolia Agricultural University, 2012.
[33] 缪璐欢, 白凤翎, 励建荣.传统发酵食品中乳酸菌生态演替研究进展[J].食品与发酵工业, 2015, 41(1):175-180.
MIAO L H, BAI F L, LI J R.Advanced on ecological succession of lactic acid bacteria in traditional fermented food[J].Food and Fermentation Industries, 2015, 41(1):175-180.
[34] 徐煜, 刘振民, 游春苹.瑞士乳杆菌的益生功能及应用研究进展[J].食品工业科技, 2017, 38(8):374-378;383.
XU Y, LIU Z M, YOU C P.Research progress on probiotic function and application of Lactobacillus helveticus[J].Science and Technology of Food Industry, 2017, 38(8):374-378;383.